1.本公开涉及肝脏类器官,更具体地,涉及其中肝脏小叶型结构可以长时间维持的肝脏类器官及其制备方法。
背景技术:
2.新药的开发需要大量时间,努力和相当大的成本。然而,当成功时,可以创造高附加值。为了使药物有效,药物必须以足以显示其效果的浓度到达靶位点。然而,当药物在肝脏中代谢时,药物失去其活性。
3.药物诱导的肝脏毒性机制与肝脏代谢活化密切相关。药物诱导的肝脏毒性是在临床前阶段停止新药开发和在临床阶段停止临床试验的原因。此外,当甚至在药物上市后发现药物诱导的肝脏毒性时,药物从市场撤回。因此,开发用于毒性和药物代谢研究的三维肝脏模型是重要的。
4.肝脏是我们身体中最大的器官之一,其功能是产生我们身体中所需的数千种物质和酶,包括胆汁,并使各种有毒物质解毒。
5.肝脏结构非常复杂,通常肝脏具有肝脏小叶的单位结构。这些肝脏小叶由在中心位置发出中心静脉和毛细血管的三个小叶间静脉组成。来自小叶间静脉的窦状毛细管被肝细胞包围,并且在肝细胞之间形成小管导管。在窦状毛细管和肝细胞之间,存在称为disse间隙的狭窄导管,并且肝脏星状细胞位于此处。由于这种结构复杂性,非常难以制造类似于人肝脏的三维肝脏模型,特别是在二维培养过程中肝细胞的细胞功能迅速恶化。
6.最近,正在积极地进行使用类器官开发三维肝脏模型的研究。称为小器官的类器官是使用源自特定器官或组织的祖细胞或干细胞制备的结构,并且是指具有类似于实际人类器官的结构和功能的三维结构。
7.在最近的研究中,使用从人肝脏提取的成体干细胞,成功地体外制备了具有与人肝脏相似的结构和功能的肝脏类器官。然而,该方法的缺点在于,从人体中提取制备肝脏类器官所需的细胞是非常困难的,并且由于每个供体的细胞功能不同,因此制备的样品之间存在差异。此外,细胞不能以所需的形式排列,因为它们是通过细胞的自组装培养的。
8.除了类器官技术之外,还有使用如微流控装置等特定装置的三维培养技术和利用光刻技术的三维构图芯片,但是成本高,并且实验过程非常复杂。尽管球状体技术允许通过在没有生物墨水的情况下聚集细胞进行长期培养,但是由于在聚集的细胞的中心发生低氧状态,因此必须仅制备约200至300μm的大小,因此存在局限性。
9.生物打印技术与类器官一起是目前研究最多的技术。为了模拟人类肝脏的结构,使用多个头将含有各种细胞的每种生物墨水喷射并堆叠在所需位置,以制造具有数毫米大小的肝脏类似物。然而,常规的生物打印技术在打印分辨率方面具有局限性,并且在制备大结构的情况下,由于堆叠而发生氧还原。
技术实现要素:
10.技术问题
11.本公开的目的是提供一种能够通过形成肝脏小叶型结构来预防缺氧状态的肝脏类器官,从而能够长期培养并同时长时间维持肝脏小叶型结构,以及使用其的制备方法。本公开可以通过长时间维持肝脏小叶型结构来提供可用于非临床和临床试验的肝脏类器官和制备方法。
12.技术方案
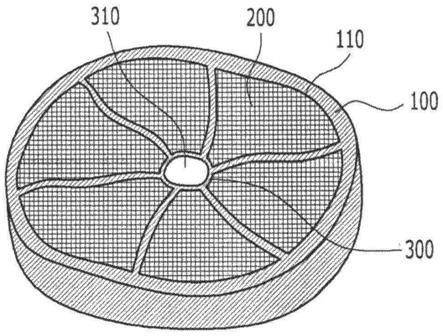
13.本公开的一个实施方式涉及肝脏类器官,所述肝脏类器官包含:管状外腔100,所述管状外腔100的内部被分成多个隔室110;填充所述多个隔室110中的每一个的细胞聚集体200;和位于外腔100中心的内腔300。
14.内腔300优选为具有空心内部的管状结构。
15.此外,外腔100可以包括血管内皮细胞和水凝胶,并且细胞聚集体200可以包括肝细胞和水凝胶。
16.水凝胶可包括选自由以下组成的组的至少一种:藻酸盐、纤维蛋白凝胶、羧甲基纤维素、硫酸乙酰肝素、透明质酸、胶原、葡聚糖、琼脂糖、明胶、层粘连蛋白、pluronic、在特定组织中脱细胞化的生物墨水、matrigel、羟基磷灰石、透明质酸和聚乙二醇,或可使用其中至少两种或三种或更多种水凝胶混合的混合水凝胶。
17.另一方面,本发明公开了一种制备肝脏类器官的方法作为本公开的另一实施方式。制备肝脏类器官的方法包括:接收部制备步骤,制备设置有分隔部件1的生物墨水接收部2,所述分隔部件1提供分隔空间以具有肝脏小叶的横截面图案;生物墨水供应步骤,向生物墨水接收部2的每个分隔空间供应不同的生物墨水;和排出步骤,通过向生物墨水接收部2施加物理力,将容纳在分隔空间中的不同生物墨水排出到单个喷嘴3。
18.分隔部件1优选地包括:在所述分隔件1的中心处形成的具有环形截面的第三中空部30;在第三中空部30外侧形成的具有扇形截面的多个第二中空部20;以及在包围第二中空部20和第三中空部30的结构中形成的第一中空部10。
19.在生物墨水供应步骤中,优选将第一生物墨水11供应到第一中空部10,将第二生物墨水21供应到第二中空部20,并且将第三生物墨水31供应到中空部30。优选地,第一生物墨水11包含血管内皮细胞和水凝胶,第二生物墨水21包括肝细胞和水凝胶,并且第三生物墨水31包括水凝胶。
20.水凝胶可包括选自由以下组成的组的任何一种或多种:藻酸盐、纤维蛋白凝胶、羧甲基纤维素、硫酸乙酰肝素、透明质酸、胶原、葡聚糖、琼脂糖、明胶、层粘连蛋白、pluronic、在特定组织中脱细胞化的生物墨水、matrigel、羟基磷灰石、透明质酸和聚乙二醇。
21.优选地,在排出步骤中施加到生物墨水接收部2的压力为0.1kpa至500kpa。
22.排出步骤与生物墨水供应步骤可以同时或顺序进行。
23.有益效果
24.根据本公开,肝脏类器官在结构上是稳定的,因为血管内皮细胞围绕外腔和内腔,并且血管内皮细胞也在外腔和内腔之间连接。即使长期培养肝脏类器官,也可以维持形状而无结构改变。
25.此外,本公开的肝脏类器官可通过包括供应氧的内腔来防止由于低氧状态引起的
细胞死亡,从而实现长期培养。
附图说明
26.图1是根据本公开的实施方式的肝脏类器官的透视图;
27.图2是显示根据本公开的另一个实施方式的肝脏类器官的制备方法的示意图;和
28.图3至图5是根据本公开培养肝脏类器官观察到的结果。
具体实施方式
29.在下文中,在通过本公开的优选实施方式详细描述之前,在本说明书和权利要求书中使用的术语或词语不应被解释为限于常规或字典含义,并且不应被解释为在本公开的技术精神内。应根据含义和概念进行解释。
30.在整个说明书中,当一部分“包括”某一组分时,其意指可以进一步包括其它组分而不是排除其它组分,除非另有说明。
31.在下文中,将更详细地描述本公开的肝脏类器官及其制备方法。
32.图1是根据本公开的实施方式的肝脏类器官的透视图。
33.参考图1,根据本公开的实施方式的肝脏类器官包括:管状外腔100,其内部被分成多个隔室110;填充所述多个隔室110中的每一个的细胞聚集体200;和内部为空的位于外腔100中心的管状内腔300。因此,肝脏类器官具有类似于实际肝脏小叶的结构。
34.通孔310形成在内腔300的中心。
35.外腔100用于维持肝脏类器官的整体结构,如图1所示,可以形成管状结构,其内部被分成多个隔室110。
36.血管内皮细胞和水凝胶包含在形成于外腔100和多个隔室110之间的通孔310的外周表面中和内腔300的中心处。
37.这些血管内皮细胞位于外腔100的外表面上,外腔100的外表面是肝脏类器官与流体直接接触并形成血管的表面,并且血管内皮细胞防止肝细胞从细胞聚集体200逸出,从而长时间维持本公开的肝脏类器官的结构。
38.另外,血管内皮细胞也在形成于多个隔室110之间的通孔310的外周表面和内腔300的中心中形成血管。
39.水凝胶可包括选自由以下组成的组的任何一种或多种:藻酸盐、纤维蛋白凝胶、羧甲基纤维素、硫酸乙酰肝素、透明质酸、胶原、葡聚糖、琼脂糖、明胶、层粘连蛋白、pluronic、在特定组织中脱细胞化的生物墨水、matrigel、羟基磷灰石、透明质酸和聚乙二醇。由于这样的水凝胶具有高水含量、优异的生物相容性和优异的机械性质,因此其非常适合应用于具有包括细胞的结构的类器官,如本公开的肝脏类器官。
40.填充外腔100的多个隔室110中的每一个的细胞聚集体200包括肝细胞和水凝胶。水凝胶通过提供细胞不能粘附的孔来诱导肝细胞之间的聚集。
41.此外,除了肝细胞和水凝胶之外,细胞聚集体200还可以包括细胞生长因子,例如细胞因子。细胞生长因子是影响细胞生长和分化的物质,是指含有细胞因子的蛋白质、多肽或其复合物。因此,细胞生长因子可包括胰岛素、胰岛素样生长因子(igf)、神经生长因子(ngf)、血管内皮生长因子(vegf)、角质形成细胞生长因子(kgf)、成纤维细胞生长因子
(fgf),包括碱性fgf(bfgf)、血小板衍生生长因子(pdgf),包括pdgf-aa和pdgf-ab、骨形态发生蛋白(bmp),包括bmp-2和bmp-7、肝细胞生长因子(hgf)、转化生长因子-α(tgf-α)、转化生长因子-β(tgf-β),包括tgfβ-1和tgfβ-3、表皮生长因子(egf),粒细胞-巨噬细胞集落刺激因子(gm-csf)、粒细胞集落刺激因子(gcsf)、白介素-6(il-6)、il-8等。
42.内腔300位于构成本公开的肝脏类器官的外腔100的中心区域中并且具有中空管状结构。内腔300具有在中心形成的通孔310,通过该通孔可以将氧提供给肝脏类器官。通过内腔300向包含在细胞聚集体200中的肝细胞供应氧,可以防止肝细胞缺氧和死亡。因此,本公开的肝脏类器官可以长期培养,并且即使在长期培养后也稳定地维持该结构。
43.为了在内腔300的中心区域中形成通孔310,内腔300的中心区域优选地由无细胞水凝胶形成,特别地,优选地由在排出之后可容易地移除的无细胞水凝胶形成。
44.例如,可以将与细胞混合的胶原(在37度的温度下胶凝)添加到分隔部件,并且可以将其中不混合细胞的藻酸盐(通过钙离子胶凝)添加到内腔的中心区域。当排出的类器官在37度凝胶化时,排出的类器官以期望的形状凝胶化(硬化),并且没有钙离子的藻酸盐维持像水一样。当用细胞培养溶液洗涤时,分隔件凝胶化并维持未洗涤,腔中心的藻酸盐被洗掉以形成对应于通孔的腔。也就是说,通过仅让内腔中心区域的水凝胶不凝胶化以形成穿透孔或内腔,可以使水凝胶被细胞培养液体洗涤并扩散和消失。
45.图2是示意性地示出了根据本公开的实施方式的用于肝脏类器官的方法的示意图。
46.参考图2,用于产生本公开的肝脏类器官的方法是使用生物墨水排出的方法。制备肝脏类器官的方法可包括:接收部制备步骤,制备设置有分隔部件1的生物墨水接收部2,分隔部件1提供分隔空间以具有肝脏小叶的横截面图案(图2(a));生物墨水供应步骤,将不同的生物墨水供应到生物墨水接收部2的每个分隔空间(图2(b));以及通过向生物墨水接收部2施加物理力,将容纳在分隔空间中的不同生物墨水排出到单个喷嘴3的排出步骤(图2(c))。
47.在接收部制备步骤中的分隔部件1优选形成为具有与上述本公开的肝脏类器官的横截面图案相对应的横截面图案。具体地,如图2(a)所示,分隔部件1的结构可以包括:第三中空部30,其形成在具有环状截面的分隔部件1的中心;在第三中空部30的外侧形成的具有扇形截面的多个第二中空部20;和形成为包围第二中空部20和第三中空部30的结构的第一中空部10。
48.该第一中空部10对应于上述肝脏类器官的外腔100,第二中空部20对应于细胞聚集体200,并且第三中空部30对应于位于内腔300中心的通孔310。
49.分隔部件1可以使用诸如丙烯腈-丁二烯-苯乙烯(abs)、聚己内酯(pcl)、丙烯腈-苯乙烯-丙烯酸酯(asa)、苯乙烯-丙烯腈共聚物(san)、聚苯乙烯(ps)、ppsf/聚苯砜(ppsu)、聚醚酰亚胺、聚乳酸(pla)、聚-d-赖氨酸(pdl)等树脂通过fdm打印方法制造,或者可以使用有色金属或有色合金通过机械加工方法制造。
50.生物墨水供应步骤是将不同的生物墨水供应到由分隔部件1分隔的生物墨水接收单元2的每个空间的步骤。具体地,如图2(b)所示,第一生物墨水11可以供应到第一中空部10,第二生物墨水21可以供应到第二中空部20,第三生物墨水31可以供应到第三中空部30。
51.第一生物墨水11用于在上述外腔100、内腔300和隔室110之间形成血管,并且优选
地包括血管内皮细胞和水凝胶。
52.第二生物墨水21用于在隔室110中形成细胞聚集体200,并且可以包括肝细胞和水凝胶。
53.作为肝细胞,可以使用例如胚胎来源的肝脏干细胞、诱导的多能肝脏干细胞、成人肝脏干细胞、原代干细胞、永生细胞系等。
54.此外,除了肝细胞和水凝胶之外,第二生物墨水21还可以包括细胞生长因子,其是影响细胞生长和分化的材料。因此,细胞生长因子可包括胰岛素、胰岛素样生长因子(igf)、神经生长因子(ngf)、血管内皮生长因子(vegf)、角质形成细胞生长因子(kgf)、成纤维细胞生长因子(fgf),包括碱性fgf(bfgf)、血小板衍生生长因子(pdgf),包括pdgf-aa和pdgf-ab、骨形态发生蛋白(bmp),包括bmp-2和bmp-7、肝细胞生长因子(hgf)、转化生长因子-α(tgf-α)、转化生长因子-β(tgf-β),包括tgfβ-1和tgfβ-3、表皮生长因子(egf),粒细胞-巨噬细胞集落刺激因子(gm-csf)、粒细胞集落刺激因子(gcsf)、白介素-6(il-6)、il-8等。
55.另外,第三生物墨水31用于形成位于上述内腔300中心的通孔310,并且第三生物墨水优选包括水凝胶。
56.水凝胶可包括选自由以下组成的组的任何一种或多种:藻酸盐、纤维蛋白凝胶、羧甲基纤维素、硫酸乙酰肝素、透明质酸、胶原、葡聚糖、琼脂糖、明胶、层粘连蛋白、pluronic、在特定组织中脱细胞化的生物墨水、matrigel、羟基磷灰石、透明质酸和聚乙二醇。
57.第一中空部和第三中空部可容纳具有不同胶凝条件的不同水凝胶。例如,将可通过钙胶凝的藻酸盐置于第一中空部中。当将在小于约30度时胶凝且在大于30度时以流体形式存在的明胶放入第三空腔中,然后排出到含有钙离子的37度细胞培养溶液中时,藻酸盐立即胶凝,而明胶不胶凝。
58.因此,明胶以流体状态扩散到细胞培养溶液中并熔掉,从而形成位于内腔中心的通孔310,并且仅保持藻酸盐,使得可以制备根据本公开的独特的肝脏类器官。
59.如图2(c)所示,排出步骤是通过向生物墨水接收部2施加压力而将容纳在分隔空间中的不同生物墨水排出到单个喷嘴3的步骤。此时,优选对不同的生物墨水中的每一个施加相同的压力。
60.施加到接收部2的压力优选在约0.1到500kpa的范围内。如果压力太强并且超过500kpa,则施加到喷嘴3的负载可能变大,并且可能发生损坏。此外,当压力小于0.1kpa时,由于生物墨水的粘性而产生的阻力使其不能从喷嘴3平稳地排出。
61.喷嘴3的直径优选为约0.1至100mm。当喷嘴3的直径小于0.1mm时,排出压力可能增加而导致细胞造成损害,而当喷嘴的直径超过100mm时,存在精度降低以及物质消耗增加太多的问题。
62.该排出步骤可以与生物墨水供应步骤同时进行,或者可以顺序进行。
63.通过在排出步骤中排出而形成的肝脏类器官可以原样使用,并且如果需要,可以切割成预定厚度并使用,或以特定图案连续层压以形成所需形状。
64.例如,肝脏类器官可以通过以纤维的形式纵向牵拉来使用,或者其可以被切割和使用,并且可以以所需的形状连续层压,优选用直径为1mm的喷嘴排出。这是因为人肝脏小叶的尺寸为约1mm,并且如果将以长纤维形式排出的结构切回1mm,则可以获得与肝脏小叶非常相似的结构。另外,当通过连续排出和层压加工而不切割将其制成大质量时,也可以制
成肝叶,其中肝叶排列成各种结构。
65.在下文中,将描述本公开的实施方式。然而,本公开的范围不限于以下优选实施方式,并且本公开所属领域的普通技术人员可以在本公开的范围内采取本文所述内容的各种修改形式。
66.[实施例1]第一生物墨水的制备
[0067]
通过将血管内皮细胞加入到中和至ph6.0-8.0并搅拌的胶原水性溶液中制备第一生物墨水。
[0068]
[实施例2]第二生物墨水的制备
[0069]
通过将成人肝脏干细胞加入到中和至ph6.0-8.0并搅拌的胶原水性溶液中制备第二生物墨水。
[0070]
[实施例3]第三生物墨水的制备
[0071]
通过将藻酸盐添加到蒸馏水中并在室温下搅拌12小时来制备第三生物墨水。
[0072]
[实施例]
[0073]
为了制备本公开的肝脏类器官,使用聚乳酸(pla)作为物质排出方法,制备如图2(a)所示的具有第一中空部、第二中空部和第三中空部的分隔部件。
[0074]
在将用上述方法制备的分隔件插入3d打印机注射器的接收部后,将用上述实施例制备的第一生物墨水供应到第一中空部,将第二生物墨水供应到第二中空部,并将第三生物墨水供应到第三中空部。此后,使用气动压力施加约10kpa的压力以从单个喷嘴(直径:1mm)排出生物墨水以制备肝脏类器官。
[0075]
[比较例]
[0076]
为了证明本公开的肝脏类器官的有效性,设置两个比较组(混合(w/o腔)vs混合(w腔)),并进行实验。首先,将肝细胞(hepg2,下文中相同)和血管内皮细胞(ea.hy926,下文中相同)以约7:3的比率混合并与生物墨水混合,然后将混合的生物墨水供应至不具有分隔部件的注射器。之后,使用气动压力施加10kpa的压力,并将生物墨水从单个喷嘴(直径:1mm)排出以制备肝脏类器官(混合w/o腔)。然后,将肝细胞和血管内皮细胞以约7:3的比例混合并与生物墨水混合,以与肝脏类器官相同的方式制备其中混合两种细胞的肝脏类器官(混合w腔)。
[0077]
结果,没有形成腔的混合模型在凝胶的中间具有低氧状态,并且当细胞仅在外侧存活时,结构严重变形。在制备腔的混合模型中,肝细胞而不是血管内皮细胞在腔中一起生长。腔血管化,并且结构无法维持。当两种细胞任意生长时,腔被充满,最终细胞存活率降低。
[0078]
[实验例1]
[0079]
将实施例和比较例的肝脏类器官培养10天后,在显微镜下观察它们并示于图3和4中(图4中的混合与图3中的混合(w腔)相同,图4中的预设与图3中的预设相同)。
[0080]
图3的混合(w/o腔)是在水凝胶中同时混合肝细胞和血管内皮细胞并通过1mm直径的喷嘴排出而没有任何图案的结果。混合(w腔)是将肝细胞和血管内皮细胞与水凝胶同时混合并以与肝脏类器官制备方法相同的方式将它们排出的结果。预设是以预定模式产生肝脏类器官的结果,允许肝细胞和血管内皮细胞之间的异质性区分。特别地,在预设的情况下,可以看出血管内皮细胞通过将外腔连接到内腔并在它们之间很好地维持它们的结构。
[0081]
[实验例2]
[0082]
为了证实实施例的肝脏类器官的结构即使在长时间培养时也得以维持,以与实施例相同的方式进行实验。
[0083]
作为第一实施方式,分别使用血管部分中的胶原、肝细胞部分中的胶原和内腔中的藻酸盐,并且在37度的温度和10kpa的压力下通过1mm直径的喷嘴将混合的生物墨水以长纤维的形式排出到细胞培养溶液中。然后,将其转移到培养箱中。
[0084]
由于胶原在37度的温度下逐渐凝胶化,当排出到37度的培养液中时,它凝胶化并以纤维形式存在于溶液中。当胶凝完成时,位于内孔中的藻酸盐扩散并溶解在介质溶液中。
[0085]
作为第二实施方式,使用血管部分中的胶原和藻酸盐,肝细胞部分中的胶原和藻酸盐以及内腔中的藻酸盐进行实验。
[0086]
这里,在胶原和藻酸盐的混合物的情况下,制备如下混合物,其中将3重量%的胶原和中和至ph7.0的3重量%的藻酸盐以9:1的体积比混合,然后将该混合物与各细胞混合并使用,仅将3重量%的藻酸盐单独用于内腔。
[0087]
与上述第一实施方式类似,在通过直径为1mm的喷嘴在10kpa的压力下以长纤维形式排出到含有钙的细胞培养基中后,使其静置约5分钟。在藻酸盐的情况下,在与钙离子接触时它尽快就凝胶化。在静置约5分钟的过程中,仅外表面的藻酸盐和胶原混合物中的藻酸盐组分胶凝,而内部的藻酸盐不胶凝。
[0088]
然后,用磷酸盐缓冲盐水(pbs)洗涤含有钙的细胞培养基,将不含钙的细胞培养基放入培养箱中培养。在胶原以这种方式顺序胶凝之后,位于内腔中的藻酸盐扩散到细胞培养基中并熔掉。
[0089]
作为第三实施方式,在血管部分中使用藻酸盐,在肝细胞部分中使用藻酸盐,在内腔中使用明胶。与上述第一和第二实施方式类似,在通过1mm直径的喷嘴在10kpa的压力下以长纤维形式排出到含有钙的细胞培养基中后,使其静置约5分钟。
[0090]
静置时间后,用磷酸缓冲盐水(pbs)洗涤含钙离子的细胞培养基,然后将不含钙离子的细胞培养基放入培养箱中培养。在37度,由于明胶以液体形式存在,明胶扩散到细胞培养基中并熔掉。
[0091]
将实施例1至3的所有样品在细胞培养装置中在37度下在24孔板中用dulbecco's改良eagle培养基(dmem)(含有10%牛血清和1%抗生素的细胞培养基)培养。每天新更换一次培养基,通过向pbs或细胞培养基中加入50mm浓度的氯化钙(cacl2)提供钙离子用于藻酸盐的凝胶化。
[0092]
为了区分和观察两种不同类型的细胞,对两种细胞中的每一种进行免疫染色。培养7天后,将样品用pbs洗涤3次并用4%甲醛固定5分钟。将固定的样品再用pbs洗涤3次,然后使用0.25%triton-x 100渗透10分钟。
[0093]
将透化的样品用pbs洗涤3次,并用1%牛血清白蛋白封闭30分钟,将封闭的样品与白蛋白一抗一起放置,并在37度的培养箱中培养约1小时。此后,将每个样品洗涤3次,将具有白蛋白固有荧光的二抗放置并在37度培养箱中培养1小时。
[0094]
通过该方法,用白蛋白将肝细胞染色。将每个样品依次洗涤3次,并将样品与cd31一抗放置,并在37度培养箱中温育1小时。此后,将样品分别洗涤3次,并将样品与含有荧光的二抗一起放置,所述二抗与白蛋白一起放置,并在37度的培养箱中温育1小时。结果,血管
内皮细胞用cd31染色,并且通过使用共聚焦显微镜在z轴方向上以10μm的厚度扫描样品来观察样品。
[0095]
以相同的方式,也将mrp2置于肝细胞上并用共聚焦激光扫描显微镜观察。
[0096]
白蛋白是由肝细胞分泌的蛋白质,其被肝细胞特异性地染色,mrp2是泵蛋白,其将胆汁色素从肝细胞排放到小管导管中并在肝细胞中被特异性地染色,cd31在血管内皮细胞中表达并用pecma-1特异性地染色(参见图5)。
[0097]
进行蛋白质印迹以证实特异性蛋白质(白蛋白,mrp2,cd31)的表达水平。首先,提取样品的混合蛋白质(混合w腔,预设)并标准化为相同的浓度。将混合蛋白在琼脂糖凝胶上电泳后,将蛋白转移到尼龙膜上,用tris-缓冲盐水(tbs)洗涤蛋白膜,用1%bsa封闭1小时后,依次与一抗和二抗反应,然后用发光装置测定蛋白表达水平(条带)。
[0098]
总之,证实了肝脏类器官(预设)的蛋白质表达和维持显著高于混合模型(混合w腔),并且结构维持也是稳定的(参见图4)。
[0099]
工业实用性
[0100]
根据本公开的肝脏类器官具有肝脏小叶型形式的结构,并且可以防止低氧状态,从而使其可以长时间培养,而同时,肝脏小叶型的结构得到长时间维持。因此,存在工业实用性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。