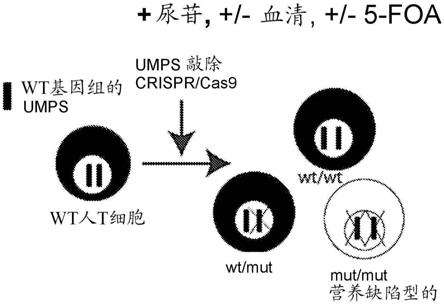
使用营养缺陷型可调控细胞的方法和组合物
相关申请的交叉引用
1.本技术要求2019年5月10日递交的美国临时专利申请第62/846,073号的优先权,其通过引用整体并入本文中。序列表
2.本技术与电子格式的序列表一起提交。序列表文件名称为1191572pct_seqlst.txt,创建于2020年4月27日,且大小为1,893字节。序列表的电子格式信息通过引用整体并入本文中。
发明领域
3.本文中的公开内容涉及具有改善的功效和安全性的基因治疗方法、组合物和试剂盒。背景
4.细胞疗法已被证明提供了有希望的治疗方法。然而,将经修饰的细胞重新引入人类宿主细胞中会带来风险,其包括免疫反应、恶性转化或转基因的过度产生或控制缺乏。
5.基因工程的几种方法可以控制人类细胞的功能,如细胞信号传导、增殖或细胞凋亡(参见bonifant,challice l.等人,molecular therapy-oncolytics 3(2016):16011;sockolosky,jonathan t.等人,science359.6379(2018):1037-1042;tey,siok-keen.clinical&translational immunology 3.6(2014):e17;其中每项均在此通过引用整体并入本文中),并使得甚至控制细胞疗法的严重副作用成为可能(bonifant等人,2016)。尽管取得了这些进展,但由于依赖于将基因编码的控制机制引入细胞中的控制系统具有多种限制的事实(tey,2014),其他应用仍无法获得广泛应用,例如将工程化的多能细胞用于再生医学(参见,ben-david和benvenisty,2011,nat.rev.cancer 11,268
–
277.;lee等人,2013,nat.med.19,998
–
1004;porteus,m.(2011)mol.ther.19,439
–
441;其中每项均在此通过引用整体并入本文中)。
6.可能出现的两个主要问题是“泄漏”,即在没有触发其的情况下该机制的低水平活动(参见ando等人,(2015)stem cell reports 5,597
–
608,其在此通过引用整体并入本文中),以及由于逃逸外部控制的几种机制,在机制激活后没有去除整个细胞群(参见garin等人,(2001)blood97,122
–
129;di stasi等人,(2011)n engl j med 365,1673
–
1683;wu等人,(2014)n engl j med 365,1673
–
1683;yagyu等人,(2015)mol.ther.23,1475
–
1485;其中每项均在此通过引用整体并入本文中)。例如,由病毒转导引入的转基因可以被细胞从表达中沉默(参见,等人,(2018)switch.int.j.mol.sci.19,197,其在此通过引用整体并入本文中),或细胞可以对效应子机制发展出抗性(参见,yagyu等人,(2015)mol.ther.23,1475
–
1485,其在此通过引用整体并入本文中)。另一个问题是具有遗传不稳定性的细胞类型中转基因的突变,例如长时间培养的细胞系或肿瘤细胞系(merkle等人,(2017)nature 545,229
–
233;d’antonio等人,(2018)cell rep.24,883
–
894;其中每项均在此通过引用整体并入本文中)。此外,原代细胞群通常在离体培养中仅在有限的时间内保留
其功能性,并且许多类型无法通过克隆分离进行纯化。
7.现有的安全开关模式也有许多风险,如(1)插入到肿瘤抑制子的转基因导致细胞系的致癌转化,以及(2)插入到表观遗传沉默区域中的转基因导致缺乏表达,并因此功效,或插入后转基因随后的表观遗传沉默。基因组不稳定性是细胞致癌转化中的常见表型。此外,外源性自杀开关的点突变或遗传损失将被快速选择和放大。基于靶向细胞信号传导通路的安全开关取决于细胞的生理机能。例如,处于“前存活”模式的细胞可能会表达半胱天冬酶抑制剂,从而防止细胞在自杀开关诱导时死亡。
8.一种尤其有吸引力的基因疗法的应用涉及由基因产物的不足引起的或者通过基因产物(例如治疗蛋白质、抗体或rna)的增加表达可治疗的病症的治疗。
9.最近的进展允许对人类细胞基因组进行精确的修饰。这种遗传工程化能够实现广泛的应用,但也需要新的方法来控制细胞行为。细胞的一种可替代控制系统是营养缺陷型,其可以通过靶向代谢中的基因进行工程化。已经针对微生物探索了该概念(参见,steidler等人,(2003)nat.biotechnol.21,785
–
789,其在此通过引用整体并入本文中),并且已被酵母遗传学家广泛用作近乎通用的研究工具。如果它是通过敲除基因而不是通过引入复杂的控制机制来产生的,并且如果营养缺陷型是针对作为细胞内源性代谢一部分的无毒化合物,那么它在哺乳动物细胞中将特别强效。这可以通过破坏代谢途径中的必需基因来实现,只有当该途径的产物被外部供应并由细胞从其环境摄取时,才允许细胞发挥功能。此外,如果相应的基因也参与了细胞毒剂的激活,那么基因敲除(ko)将使细胞对这种药物产生抗性,从而使得能够消耗非修饰的细胞和纯化细胞群中的工程化细胞。几种单基因先天性代谢缺陷可以通过提供一种代谢物来治疗,并因此可以看作是人类营养缺陷型的模型。发明概述
10.本文在一些实施方案中公开了供体模板,其包含:(a)一个或多个核苷酸序列,其与营养缺陷诱导型基因座的区域同源,或与所述营养缺陷诱导型基因座的区域的互补序列同源,以及(b)编码治疗因子的转基因,其任选地与表达控制序列连接。在一些情况下,所述供体模板是单链的。在一些情况下,所述供体模板是双链的。在一些情况下,所述供体模板是质粒或dna片段或载体。在一些情况下,所述供体模板是包含复制所必需元件的质粒,任选地包含启动子和3’utr。本文在一些实施方案中公开了载体,其包含:(a)一个或多个核苷酸序列,其与营养缺陷诱导型基因座的区域同源,或与所述营养缺陷诱导型基因座的区域的互补序列同源,以及(b)编码治疗因子的转基因。在一些情况下,所述载体是病毒载体。在一些情况下,所述载体选自:逆转录病毒、慢病毒、腺病毒、腺相关病毒和单纯疱疹病毒载体。在一些情况下,所述载体还包含病毒载体复制所必需的基因。在一些情况下,所述转基因的两侧均侧接有与所述营养缺陷诱导型基因座的区域或其互补序列同源的核苷酸序列。在一些情况下,所述营养缺陷诱导型基因座是编码参与营养缺陷型因子的合成、再循环或补救的蛋白质的基因。在一些情况下,所述营养缺陷诱导型基因座位于表1的基因中,或位于控制表1中基因表达的区域中。在一些情况下,所述营养缺陷诱导型基因座位于编码尿苷单磷酸合成酶(umps)的基因内。在一些情况下,所述营养缺陷诱导型基因座位于编码羧化全酶合成酶的基因内。在一些情况下,与所述营养缺陷诱导型基因座的区域同源的核苷酸序列与所述营养缺陷诱导型基因座的至少200个连续的核苷酸具有98%的同一性。在一些情况下,与所述营养缺陷诱导型基因座的区域同源的核苷酸序列与人尿苷单磷酸合成酶或
羧化全酶合成酶或表1中的任一基因的至少200个连续的核苷酸具有98%的同一性。在一些情况下,所述供体模板或载体还包含与所述转基因可操作地连接的表达控制序列。在一些情况下,所述表达控制序列是组织特异性表达控制序列。在一些情况下,所述表达控制序列是启动子或增强子。在一些情况下,所述表达控制序列是诱导型启动子。在一些情况下,所述表达控制序列是组成型启动子。在一些情况下,所述表达控制序列是转录后调控序列。在一些情况下,所述表达控制序列是微小rna。在一些情况下,所述供体模板或载体还包含标志物基因。在一些情况下,所述标志物基因包含至少ngfr或egfr的片段、至少cd20或cd19的片段、myc、ha、flag、gfp、抗生素抗性基因。在一些情况下,所述编码蛋白质的转基因选自:激素、细胞因子、趋化因子、干扰素、白介素、白介素结合蛋白、酶、抗体、fc融合蛋白、生长因子、转录因子、血液因子、疫苗、结构蛋白、配体蛋白、受体、细胞表面抗原、受体拮抗剂和共刺激因子、结构蛋白、细胞表面抗原、离子通道、表观遗传修饰子或rna编辑蛋白。在一些情况下,所述转基因编码t细胞抗原受体。在一些情况下,所述转基因编码rna,任选地调控性微小rna。
11.本文在一些实施方案中公开了用于将转基因靶向整合至营养缺陷诱导型基因座的核酸酶系统,其包含cas9蛋白质和特异性针对营养缺陷诱导型基因座的向导rna。本文在一些实施方案中公开了将转基因靶向整合至营养缺陷诱导型基因座的核酸酶系统,其包含特异性针对所述营养缺陷诱导型基因座的大范围核酸酶。在一些情况下,所述大范围核酸酶是zfn或talen。在一些情况下,所述核酸酶系统还包含本文所公开的供体模板或载体。
12.本文在一些实施方案中公开了离体的经修饰的宿主细胞,其包含编码整合在营养缺陷诱导型基因座处的治疗因子的转基因,其中所述经修饰的宿主细胞是营养缺陷型因子营养缺陷型的,并且能够表达治疗因子。在一些情况下,所述经修饰的宿主细胞是哺乳动物细胞。在一些情况下,所述经修饰的宿主细胞是人类细胞。在一些情况下,所述经修饰的宿主细胞是胚胎干细胞、干细胞、祖细胞、多能干细胞、诱导型多能干(ips)细胞、成体干细胞、分化的细胞、间充质干细胞、神经干细胞、造血干细胞或造血祖细胞、脂肪干细胞、角化细胞、骨骼干细胞、肌肉干细胞、成纤维细胞、nk细胞、b细胞、t细胞或外周血单个核细胞(pbmc)。在一些情况下,所述经修饰的宿主细胞来源于来自待用所述经修饰的宿主细胞治疗或待用其群体治疗的对象的细胞。
13.本文在一些实施方案中公开了产生经修饰的哺乳动物宿主细胞的方法,包括:(a)向所述哺乳动物宿主细胞中引入在营养缺陷诱导型基因座处靶向并切割dna的至少第一核酸酶系统,或编码所述第一核酸酶系统的一个或多个组件的核酸,以及(b)本文中所公开的供体模板或载体。在一些情况下,所述方法还包括在第二基因组基因座处引入靶向并切割dna的第二核酸酶系统,或编码所述第二核酸酶系统的一个或多个组件的核酸,以及任选地(b)第二供体模板或载体。
14.本文在一些实施方案中公开了将转基因靶向整合至离体哺乳动物细胞中的营养缺陷诱导型基因座的方法,其包括使所述哺乳动物细胞与本文所公开的供体模板或载体以及核酸酶接触。在一些情况下,所述核酸酶是zfn。在一些情况下,所述核酸酶是talen。
15.本文在一些实施方案中公开了产生经修饰的哺乳动物宿主细胞的方法,其包括:(a)向所述哺乳动物宿主细胞中引入(i)cas9多肽,或编码所述cas9多肽的核酸,(ii)特异性针对营养缺陷诱导型基因座的向导rna,或编码所述向导rna的核酸,和(iii)本文所公开
的供体模板或载体。事实是方法还包括:(b)向所述哺乳动物宿主细胞中引入(i)第二特异性针对营养缺陷诱导型基因座的第二向导rna,或编码所述向导rna的核酸,以及任选地(ii)第二供体模板或载体。
16.本文在一些实施方案中公开了将转基因靶向整合至离体哺乳动物细胞中的营养缺陷诱导型基因座的方法,其包括使所述哺乳动物细胞与本文所公开的供体模板或载体、cas9多肽和向导rna接触。在一些情况下,所述向导rna是嵌合rna。在一些情况下,所述向导rna包含两个杂交的rna。在一些情况下,所述方法在营养缺陷诱导型基因座中产生一个或多个单链断裂。在一些情况下,所述方法在营养缺陷诱导型基因座中产生双链断裂。在一些情况下,所述营养缺陷诱导型基因座使用所述供体模板或载体通过同源重组进行修饰。在一些情况下,产生经修饰的哺乳动物宿主细胞和/或将转基因靶向整合至离体哺乳动物细胞中的营养缺陷诱导型基因座的方法还包括将所述经修饰的哺乳动物宿主细胞或离体的哺乳动物细胞扩增成经修饰的哺乳动物宿主细胞群或离体的哺乳动物细胞群,以及任选地培养所述细胞或其群体。在一些情况下,所述方法还包括选择包含整合到所述营养缺陷诱导型基因座中的转基因的细胞或其群体。在一些情况下,所述选择包括:(i)选择需要营养缺陷型因子以存活的细胞或其群体,以及任选地(ii)选择包含整合到所述营养缺陷诱导型基因座中的转基因的细胞或其群体。在一些情况下,所述营养缺陷诱导型基因座是编码尿苷单磷酸合成酶的基因,并且通过与5-foa接触选择细胞或其群体。
17.本文在一些实施方案中公开了无菌组合物,其包含所述供体模板或载体,或所述核酸酶系统,以及无菌水或药学上可接受的赋形剂。本文在一些实施方案中公开了无菌组合物,其包含经修饰的宿主细胞和无菌水或药学上可接受的赋形剂。本文在一些实施方案中公开了试剂盒,其包含任何前述权利要求所述的供体模板或载体或核酸酶系统或经修饰的宿主细胞,或以上的组合,任选地带有容器或小瓶。
18.本文在一些实施方案中公开了在对象中表达治疗因子的方法,其包括:(a)施用经修饰的宿主细胞,(b)任选地施用条件化方案以允许经修饰的宿主细胞移植,和(c)施用营养缺陷型因子。在一些情况下,所述经修饰的宿主细胞和营养缺陷型因子同时施用。在一些情况下,所述经修饰的宿主细胞和营养缺陷型因子依序施用。在一些情况下,在足以促进所述治疗因子表达的一段时间内定期持续施用所述营养缺陷型因子。在一些情况下,所述营养缺陷型因子的施用减少,以降低治疗因子的表达。在一些情况下,所述营养缺陷型因子的施用增加,以增加治疗因子的表达。在一些情况下,所述营养缺陷型因子的施用被中止,以产生导致经修饰的宿主细胞生长抑制或死亡的条件。在一些情况下,所述营养缺陷型因子的施用被暂时中断,以产生导致经修饰的宿主细胞生长抑制的条件。在一些情况下,在足以在对象中发挥治疗效应一段时间内持续施用所述营养缺陷型因子。在一些情况下,所述经修饰的宿主细胞是再生的。在一些情况下,所述经修饰的宿主细胞的施用包括定位递送。在一些情况下,所述营养缺陷型因子的施用包括系统性递送。在一些情况下,修饰前的所述宿主细胞来源于待治疗的对象。
19.本文在一些实施方案中公开了治疗患有疾病、病症或病况的对象的方法,其包括以足以产生治疗量的治疗因子表达的量向对象施用所述经修饰的宿主细胞和所述营养缺陷型因子。在一些情况下,所述疾病、病症或病况选自:癌症、帕金森病、移植物抗宿主病(gvhd)、自身免疫性病况、过度增生性病症或病况、恶性转化、肝脏病况、遗传性病况(包括
遗传性遗传缺陷)、青少年发病型糖尿病和眼室病况。在一些情况下,所述疾病、病症或病况影响选自以下的至少一种身体系统:肌肉系统、骨骼系统、循环系统、神经系统、淋巴系统、呼吸系统、内分泌系统、消化系统、排泄系统和生殖系统。
20.本文在一些实施方案中公开了本文所公开的经修饰的宿主细胞用于治疗疾病、病症或病况的用途。本文在一些实施方案中公开了本文所公开的经修饰的宿主细胞,其用于向人类施用,或用于治疗疾病、病症或病况的。
21.本文在一些实施方案中公开了营养缺陷型因子,其用于向已接受经修饰的宿主细胞的人施用。
22.本文在一些实施方案中公开了减轻或治疗有需要的对象中疾病或病症的方法,所述方法包括向对象施用:(a)包含经修饰的宿主细胞的组合物,所述经修饰的宿主细胞包含编码整合在营养缺陷诱导型基因座处的蛋白质的转基因,其中所述经修饰的宿主细胞是营养缺陷型因子营养缺陷型的;以及(b)足以产生蛋白质的治疗性表达的量的营养缺陷型因子。在一些情况下,所述营养缺陷诱导型基因座位于编码尿苷单磷酸合成酶(umps)的基因内。在一些情况下,所述营养缺陷型因子是尿苷。在一些情况下,所述营养缺陷诱导型基因座位于编码羧化全酶合成酶(hlcs)的基因内。在一些情况下,所述营养缺陷型因子是生物素。在一些情况下,所述蛋白质是酶。在一些情况下,所述蛋白质是抗体。在一些情况下,所述经修饰的宿主细胞是胚胎干细胞、干细胞、祖细胞、多能干细胞、诱导型多能干(ips)细胞、成体干细胞、分化的细胞、间充质干细胞、神经干细胞、造血干细胞或造血祖细胞、脂肪干细胞、角化细胞、骨骼干细胞、肌肉干细胞、成纤维细胞、nk细胞、b细胞、t细胞或外周血单个核细胞(pbmc)。在一些情况下,所述经修饰的宿主细胞是哺乳动物细胞。在一些情况下,所述哺乳动物细胞是人类细胞。在一些情况下,所述经修饰的宿主细胞来源于待用所述经修饰的宿主细胞治疗的对象。在一些情况下,所述组合物和所述营养缺陷型因子依序施用。在一些情况下,所述组合物在所述营所述养缺陷型因子之前施用。在一些情况下,所述组合物和所述营养缺陷型因子同时施用。在一些情况下,在足以促进所述蛋白质治疗性表达的一段时间内定期持续施用所述营养缺陷型因子。在一些情况下,所述营养缺陷型因子的施用减少,以降低所述蛋白质的表达。在一些情况下,所述营养缺陷型因子的施用增加,以增加所述蛋白质的表达。在一些情况下,中止营养缺陷型因子的施用诱导所述经修饰的宿主细胞的生长抑制或细胞死亡。在一些情况下,在足以在对象中发挥治疗效应的一段时间内持续施用所述营养缺陷型因子。在一些情况下,所述经修饰的宿主细胞是再生的。在一些情况下,所述组合物的施用包括定位递送。在一些情况下,所述营养缺陷型因子的施用包括系统性递送。在一些情况下,所述疾病是溶酶体贮积病(lsd)。在一些情况下,lsd是高歇氏病(1/2/3型)、mps2(hunter)病、庞贝氏病、法布里病、krabbe病、低磷酸酯酶症、a/b型niemann-pick病、mps1、mps3a、mps3b、mps3c、mps3、mps4、mps6、mps7、苯丙酮尿症、mld、sandhoff病、tay-sachs病或battens病。在一些情况下,所述酶是葡糖脑苷脂酶、艾度硫酸酯酶、阿糖苷酶α、半乳糖苷酶α/β、半乳糖神经酰胺酶、阿司福酶α、酸性鞘磷脂酶、拉罗尼酶、乙酰肝素n-硫酸酯酶、α-n-乙酰葡糖胺糖苷酶、乙酰肝素-α-氨基葡糖苷n-转乙酰酶、n-乙酰氨基葡萄糖6-硫酸酯酶、elosulfaseα、glasulfate、b-葡萄糖苷酸酶、苯丙氨酸羟化酶、芳基硫酸酯酶a、氨基己糖苷酶-b、氨基己糖苷酶-a或三肽基肽酶1。在一些情况下,所述疾病是弗里德希氏共济失调、遗传性血管性水肿或脊髓性肌萎缩症。在一些情况下,所述蛋
白质是共济蛋白、c1酯酶抑制剂(其也可被称为皮下注射)或smn1。
23.本文所描述的各种实施方案提供了减小对象中肿瘤大小或降低对象中肿瘤生长速率的方法,所述方法包括:向所述对象施用如本文所述的经修饰的人宿主细胞。
24.本文还提供了离体的经修饰的宿主细胞,其包含编码治疗因子的转基因,其中所述经修饰的宿主细胞是营养缺陷型因子营养缺陷型的,并且能够表达治疗因子。
25.在一些实施方案中,所述经修饰的宿主细胞是哺乳动物,例如人类细胞。在一些实施方案中,所述经修饰的宿主细胞是t细胞。所述经修饰的宿主细胞可以来源于待用所述经修饰的宿主细胞治疗的对象。
26.在一些实施方案中,营养缺陷型经修饰的宿主细胞可以是umps基因的敲除,并且所述营养缺陷型因子可以是尿嘧啶来源或尿苷。
27.在一些实施方案中,所述转基因编码的治疗因子是嵌合抗原受体(car)。例如,car可以是cd19特异性的car(cd19-car)。
28.因此,本说明书的一些实施方案提供了经修饰的t细胞,其包含使经修饰的t细胞为尿嘧啶来源或尿苷营养缺陷型的umps敲除,以及编码car的转基因(即,营养缺陷型car t细胞)。
29.包括营养缺陷型car t细胞的所述经修饰的t细胞可用于制备用于治疗对象的疾病或病况的药物。例如,所述疾病或病况可以是癌症、帕金森病、移植物抗宿主病(gvhd)、自身免疫性病况、过度增生性病症或病况、恶性转化、肝脏病况、青少年发病型糖尿病、眼室病况,或影响对象的肌肉系统、骨骼系统、循环系统、神经系统、淋巴系统、呼吸系统、内分泌系统、消化系统、排泄系统或生殖系统的病况。
30.在一些实施方案中,所述疾病或病况是系统性红斑狼疮。
31.用于治疗对象的疾病或病况的药物还可以包括向所述对象施用营养缺陷型因子,其中所述经修饰的t细胞需要营养缺陷型因子在体外、离体和/或在体内发挥功能(例如,以生长、增殖或存活)。
32.还提供给了治疗对象的疾病或病况的方法,其包括向所述对象施用本文所述的营养缺陷型经修饰的宿主细胞。
33.治疗方法还可以包括向所述对象施用营养缺陷型因子,其中所述经修饰的宿主细胞需要施用营养缺陷型因子以在对象中发挥功能(例如,以生长、增殖或存活),并且任选地还可以包括停止所述营养缺陷型因子的施用。
34.在一些实施方案中,待治疗的疾病或病况是自身免疫性病况,并且在所述疾病或病况发生时向所述对象施用所述营养缺陷型因子。
35.还提供了产生经修饰的哺乳动物宿主细胞的方法,其包括:(a)向所述哺乳动物宿主细胞中引入靶向并切割营养缺陷诱导型基因座处的dna的一种或多种核酸酶系统,或编码所述一种或多种核酸酶系统的一个或多个组件的核酸,以及(b)向所述哺乳动物宿主细胞中引入编码治疗因子的供体模板。
36.所述治疗方法的一些实施方案还包括:(c)选择已整合供体模板并敲除所述营养缺陷诱导型基因座的细胞。选择细胞可以包括:(i)选择需要与所述营养缺陷诱导型基因座对应的营养缺陷型因子发挥功能(例如,以生长、增殖或存活)的细胞。例如,所述营养缺陷诱导型基因座可以是编码尿苷单磷酸合成酶的基因,并且可以通过需要尿嘧啶来源或尿苷
发挥功能(例如,以生长、增殖或存活)或通过使细胞与5-foa接触来选择细胞。通过引用并入
37.本说明书中所引用的所有出版物、专利和专利申请均通过引用并入本文中,其程度就像每个单独的出版物、专利或专利申请被具体地且单独地指示为以通过引用并入本文中一样。附图的简述
38.本公开所涵盖的主题特征在所附权利要求中特别阐述。通过参考以下阐述示例性实施方案的详细描述,将获得对本公开的特征和优点的更好理解,其中利用了本文公开内容所涵盖的主题的原理,以及附图,其中:
39.图1a和图1b举例说明了血清对电穿孔后最佳恢复的影响。图1a是用于确定最佳电穿孔恢复条件的测定的示例性图示。电穿孔后,细胞补充有/无血清、5-氟乳清酸(5-foa)或外源性尿嘧啶来源(尿苷)。图1b示出了在所示培养基条件下电穿孔后恢复4天后cytoflex流式细胞仪(beckman coulter)的细胞计数。该图显示了施用血清的细胞、用/不用5-foa处理的无血清模拟编辑细胞,以及用/不用5-foa处理的无血清尿苷单磷酸合成酶(umps)敲除细胞。
40.图2a-图2f举例说明了含有umps插入缺失的细胞的维持和生长需要外源性尿嘧啶来源。图2a是用于分析电穿孔和恢复后umps或模拟编辑的t细胞的生长的程序的示例性图示。图2b示出了在所示培养条件下通过umps插入缺失的分解(tide)分析追踪出插入缺失。利用寡核苷酸umps-o-1和umps-o-2对umps基因座的sanger测序进行tide分析。图2c示出了在第8天进行的通过tide分析的包含移码插入缺失的等位基因的百分比。图2d示出了在第8天的包含通过tide鉴定的等位基因的预测细胞绝对数。图2e示出了有/没有ump的细胞计数的时程。图2f示出了有/没有尿苷的细胞计数的时程。
41.图3a-图3c举例说明了5-foa在umps靶向的细胞系中的毒性较小。图3a是5-foa选择程序的示例性图示。图3b和图3c示出了在所示培养条件下5-foa选择4天后的细胞计数。在图3b和图3c中,每种培养条件的模拟结果由左侧柱表示,并且每种培养条件的umps-7的结果由右侧柱表示。
42.图4a-图4d举例说明了5-foa选择的umps靶向细胞系仅在存在外源尿嘧啶来源的情况下才表现出最佳生长。图4a为证明尿嘧啶营养缺陷型的方案的示例性图示。在5-foa中选择4天后,将细胞培养物分成测试培养基,并在细胞计数前再生长4天。图4b-4d示出了含有或缺乏外源尿嘧啶(ump或尿苷)的培养基中5-foa选择的细胞的细胞计数。
43.图5a举例说明了通过ice分析在umps基因座上进行的插入缺失定量。图5b举例说明了模拟处理、ccr5敲除或umps敲除后t细胞的增殖。图5c示出了在有或没有ump或尿苷的情况下具有umps敲除的t细胞的增殖。图5d为不同培养条件下umps敲除后第8天的插入缺失频率。图5e示出了预测会导致移码的插入缺失的频率。
44.图6a举例说明了用于靶向umps基因座的dna供体构建体。图6b示出了靶向k562细胞后表面标志物的表达。图6c举例说明了将纳米荧光素酶和绿色荧光蛋白(gfp)整合到hbb基因座中的靶向方法。图6d示出了细胞分选前k562细胞中3种整合标志物的表达。图6e示出了在不同尿苷浓度存在下培养时第8天的k562细胞生长和细胞计数。图6f示出了在用5-foa培养期间umps
ko/ko
细胞的选择。图6g示出了在5-foa存在下umps
ko/ko
细胞的增殖。
45.图7a举例说明了umps靶向t细胞后的表面标志物表达。图7b示出了umps
ko
或野生型(wt)t细胞的营养缺陷型生长。图7c示出了5-foa选择具有umps敲除的t细胞。如使用prism 7(graphpad)所示,通过统计检验对组进行比较。星号表示统计显著性水平:*=p《0.05,**=p《0.01,***=p《0.001,且****=p《0.0001。
46.图8(左图)显示了用aav转导的细胞的facs分析,该aav含有cd19-car和tngfr表达构建体,但没有trac或umps向导rna和cas9蛋白(rnp)。图8(中间图)显示了用含有cd19-car和tngfr表达构建体的aav转导的细胞的facs分析,其中trac和umps向导rna和cas9蛋白质(rnp)以标准量递送。图8(右图)显示了用含有cd19-car和tngfr表达构建体的aav转导的细胞的facs分析,其中trac和umps向导rna和cas9蛋白(rnp)以高rnp量递送。
47.图9显示了用cd19阳性nalm6靶细胞第一次挑战营养缺陷型umps敲除cd19特异性car t细胞后的细胞毒性测定结果。
48.图10显示了用cd19阳性nalm6靶细胞第二次挑战营养缺陷型umps敲除cd19特异性car t细胞后的细胞毒性测定结果。发明详述i.引言
49.最近的进展允许对人类细胞基因组进行精确的修饰。这种基因工程能够实现广泛的应用,但也需要新的方法来控制细胞行为。细胞的一种可替代控制系统是营养缺陷型,其可以通过靶向代谢基因进行工程化。本文所描述的通过破坏代谢中心基因的遗传工程化营养缺陷型的方法是一种可替代范例,可以创建人类细胞尚未探索的对细胞功能的外部控制机制。通过破坏嘧啶代谢中的关键基因,创建了一种被动遏制系统(steidler等人,2003),这是对人类细胞系统已经存在的工具箱的补充和替代,其绕过了它们之前提到的局限性。它可以通过添加或停用无毒物质尿苷来控制人类细胞的生长。先前已经在微生物中对营养缺陷型进行了工程化,例如,通过引入工程化的基因回路来针对非天然物质(参见,kato,y.(2015)an engineered bacterium auxotrophic for an unnatural amino acid:a novel biological containment system.peerj 3,e1247,其在此通过引用整体并入本文中),或通过敲除细菌基因来针对嘧啶(参见,steidler等人,(2003)nat.biotechnol.21,785
–
789,其在此通过引用整体并入本文中)。后一个概念很吸引人,因为它依赖于基因敲除而不是引入复杂的表达盒,这会阻止细胞逆转遗传修饰或抗性机制的发展,并因此解决了可替代系统的这一挑战。嘧啶核苷和核苷酸在广泛的细胞过程中发挥重要作用,其包括dna和rna合成、能量转移、信号转导和蛋白质修饰(参见,van kuilenburg,a.b.p.和meinsma,r.(2016).biochem.biophys.acta-mol.basis dis.1862,1504
–
1512,其在此通过引用整体并入本文中),使得它们的合成通路成为理论上有吸引力的靶标。
50.人类细胞对于它们必须从外部来源或共生生物体获取的某些化合物(如氨基酸)是天然营养缺陷型的(参见,murray,p.j.(2016).nat.immunol.17,132
–
139,其在此通过引用整体并入本文中)。另外,营养缺陷是调节免疫细胞功能的一种自然机制,例如,通过细胞营养缺陷的代谢物的差异供应或消耗(参见,grohmann等人,(2017)。cytokine growth factor rev.35,37
–
45,其在此通过引用整体并入本文中)。细胞营养缺陷型在防御恶性生长的机制中也起着重要作用,例如,在通过清除精氨酸抑制肿瘤生长的巨噬细胞的情况下(murray,2016)。另外,几种恶性细胞类型已显示出对某些代谢物是营养缺陷型的(参见,
fung,m.k.l.和chan,g.c.f.(2017).j.hematol.oncol.10,144,其在此通过引用整体并入本文中),这被用于通过治疗性耗尽天冬酰胺来治疗白血病患者(参见,hill等人(1967).jama 202,882)。
51.除了先前开发的微生物遏制策略外,本文中所描述的基于cas9核糖核蛋白系统(rnp)/raav6的使用基因编辑的方法允许对主要和治疗相关的人类细胞类型进行高效工程化。营养缺陷型和5-foa抗性是umps基因完全破坏的所有细胞所固有的,但为了显示概念验证,通过选择标志物的靶向整合利用双等位基因敲除促进了群体的鉴定。方法的最新发展允许对原代人类细胞进行有效的靶向修饰(参见bak等人,(2017))。
52.使用crispr/cas9和aav6的人造血干细胞和祖细胞的多重遗传工程化(bak,rasmus o.等人,elife 6(2017):e27873;bak,rasmus o.等人,elife 7(2018):e43690;bak,rasmus o.,daniel p.dever和matthew h.porteus.nature protocols 13.2(2018):358;porteus,matthew h.和david baltimore.science 300.5620(2003):763-763;sockolosky,jonathan t.等人,science 359.6379(2018):1037-1042;其中每项均在此通过引用整体并入本文中),连同代谢营养缺陷型的建立,为进一步开发不同环境中的治疗方法奠定了基础,其中使用人类细胞是必要的,例如,在使用干细胞或干细胞来源的组织或具有特定效应子功能和减少的免疫原性的其他自体成体细胞中。值得注意的是,已经使用了有助于加快临床转变的构建体和试剂,例如,靶向构建体中的选择标志物tngfr和tegfr(其避免了免疫原性),以及在使用其fda批准的前药的体内模型中供应的尿苷。
53.控制细胞功能的工程化机制具有选择表达介导控制机制的蛋白质的完全纯的细胞群的另外挑战。通过使工程化细胞对细胞毒剂具有抗性来选择这些工程化细胞的可能性特别有吸引力,因为它可以通过允许产生可以使用无毒物质进行控制的高纯度细胞群而大幅提高效率,并且对重要代谢途径功能至关重要的基因的移除阻止细胞发展出逃逸机制。因此,在遗传不稳定性和恶性转化风险发挥作用,以及即使逃逸其遏制的少量细胞也会产生灾难性影响的环境(例如,在使用成体干细胞或多能干细胞)中,该方法提供了相比现有控制机制的诸多优势。
54.这一概念已被用于微生物(steidler等人,2003),并已被酵母遗传学家广泛用作近乎通用的研究工具。如果它是通过敲除一个基因而不是通过引入复杂的控制机制来产生的,并且如果营养缺陷型是针对作为细胞内源性代谢一部分的无毒化合物,那么它在哺乳动物细胞中将特别强效。这可以通过破坏代谢途径中的必需基因来实现,只有当该途径的产物是外部供应的且由细胞从其环境摄取时,才允许细胞发挥功能。此外,如果相应的基因也参与了细胞毒剂的激活,那么基因敲除(ko)将使细胞对这种药物产生抗性,从而使得能够耗尽非经修饰的细胞和纯化细胞群中的工程化细胞。几种单基因先天性代谢缺陷可以通过提供代谢物来治疗,并因此可以看作是人营养缺陷型的模型。
55.在某些实施方案中,通过基因组编辑破坏从头嘧啶合成途径中的umps,将营养缺陷引入人类细胞中。这使得细胞的功能依赖于外源性尿苷的存在。此外,这会消除细胞将5-氟乳清酸代谢为5-fu的能力,其使得能够耗尽具有完整等位基因的剩余细胞。利用代谢物通过遗传工程化的营养缺陷型影响人类细胞功能并耗尽其他细胞的能力为这种方法的开发提供了一系列应用,其中需要纯的可控细胞群。
56.一个实例是遗传性乳清酸尿症,其中umps基因的突变导致功能障碍,该功能障碍
可以通过补充高剂量尿苷来治疗(参见,fallon等人(1964).n.engl.j.med.270,878
–
881,其在此通过引用整体并入本文中)。将这一概念转移到目标细胞类型,将基因工程用于敲除人类细胞中的umps基因,这使得细胞对尿苷营养缺陷并对5-氟乳清酸(5-foa)产生抗性。我们表明umps-/-细胞系和原代细胞仅在体外尿苷存在的情况下才能存活和增殖,并且umps工程化的细胞增殖在不补充体内尿苷的情况下受到抑制。此外,可以通过在5-foa存在下培养来从混合群体中选择细胞。ii.使用某些实施方案的组合物和方法
57.本文公开了用于基因疗法的方法和组合物的一些实施方案。在一些情况下,该方法包括以使经修饰的宿主细胞成为营养缺陷型,并且可以通过转基因表达提供改善的基因治疗功效、效能和/或安全性的方式,将编码治疗因子的转基因递送至宿主细胞。将转基因递送至特定营养缺陷诱导型基因座产生营养缺陷型细胞,例如,通过破坏或敲除基因或下调基因活性,这现在取决于连续施用的生长和繁殖营养缺陷型因子。在一些情况下,该方法包括靶向营养缺陷诱导型基因座的核酸酶系统、用于插入转基因的供体模板或载体、试剂盒和使用此类系统、模板或载体以产生为营养缺陷型且能够表达引入的转基因的经修饰的细胞的方法。
58.本文在一些实施方案中还公开了使用经修饰的宿主细胞的方法、组合物和试剂盒,其包括药物组合物、治疗方法,以及施用营养缺陷型因子以控制
–
增加、减少或停止-经修饰细胞的生长和繁殖,以及控制转基因表达和控制治疗因子水平的方法。
59.在一些情况下,可以通过诸如同源重组的方法来完成将转基因递送至所期望的基因座。如本文所使用的,“同源重组(hr)”是指在经由同源定向修复机制修复dna中的双链断裂期间插入核苷酸序列。该过程使用与断裂区域中的核苷酸序列同源的“供体”分子或“供体模板”作为修复双链断裂的模板。双链断裂的存在促进了供体序列的整合。供体序列可以被物理整合或用作经由同源重组修复断裂的模板,导致引入全部或部分核苷酸序列。许多不同的基因编辑平台都在使用这一过程来创建双链断裂,如大范围核酸酶,如锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talens)和crispr-cas9基因编辑系统。
60.在一些实施方案中,将基因递送至两个或更多个基因座,例如,用于表达多种治疗因子,或用于引入充当合成调节剂或用于将经修饰的细胞偏向于某个谱系(例如,通过表达来自第二个基因座的转录因子)。在一些实施方案中,基因被递送至两个或更多个营养缺陷诱导型的基因座。例如,不同的基因或相同基因的第二个拷贝被递送到第二个营养缺陷诱导基型因座。
61.在一些实施方案中,细胞是营养缺陷型的,因为细胞不再具有产生营养缺陷型因子的能力。如本文所使用的,“细胞”、“经修饰的细胞”或“经修饰的宿主细胞”是指起源于同一细胞的细胞群,该群的每个细胞具有相似的基因组成并保留相同的修饰。
62.在一些实施方案中,营养缺陷型因子包含一种或两种或更多种营养素、酶、改变的ph、改变的温度、非有机分子、非必需氨基酸或改变的部分浓度(与正常生理浓度相比),或以上的组合。本文对营养缺陷型因子的所有提及都考虑了施用多种因子。在本文所述的任何实施方案中,营养缺陷型因子是在对象中既无毒性也无生物可利用性的营养物或酶,其浓度足以维持经修饰的宿主细胞,并且应理解在整个本技术中对“营养缺陷型因子”的任何提及可能包括对营养素或酶的提及。
63.在一些情况下,如果经修饰的细胞没有持续地提供营养缺陷型因子,则细胞停止增殖或死亡。在一些情况下,经修饰的细胞提供了一个安全开关,其可降低与包括致癌转化在内的其他基于细胞的疗法相关的风险。
64.本文所公开的方法和组合物提供了许多优点,例如:由于整合到相同基因座而不是随机整合(如利用慢病毒)导致一致的结果和条件;转基因的恒定表达,因为避免了具有天然启动子或增强子的区域或沉默的区域;一致的整合拷贝数,1或2个拷贝,而不是泊松分布;并且致癌转变的机会有限。在一些情况下,本公开的经修饰细胞的异质性低于通过慢病毒载体或其他病毒载体工程化的产物。
65.在一些实施方案中,本文公开了产生100%营养缺陷的细胞群的反选择方法,限制回复到非营养缺陷状态的可能性。当前的安全开关依赖于插入转基因,并且经修饰的细胞可以通过转基因的突变或其表达的表观遗传沉默而逃逸(参见,例如,wu等人,mol ther methods clin dev.1:14053(2014),其在此通过引用整体并入本文中)。因此,从长远来看,将转基因插入与创建营养缺陷型机制相结合通常更安全。
66.在一些实施方案中,将营养缺陷型因子的施用降低至低水平可导致经修饰的细胞进入静止状态而不是被杀死,允许暂时中断并利用已经存在于宿主中的细胞重新开始治疗。与必须重新编辑宿主细胞和重新引入经修饰的宿主细胞相比,这将是一个优势。
67.在一些实施方案中,当需要时,例如如果检测到异常增殖或致癌转化,或者如果需要停止治疗,则停止营养缺陷型因子施用将导致经修饰细胞的死亡。
68.在一些实施方案中,增加营养缺陷型因子施用增加经修饰的细胞的生长和繁殖并导致转基因表达增加,并从而增加治疗因子的水平。在一些情况下,营养缺陷型因子的施用提供了控制基因产物剂量的手段。
69.基于营养缺陷型的安全机制规避了与当前细胞疗法相关的患者的许多风险。通过在治疗过程中为患者补充确定的营养缺陷型因子并在治疗停止或其他一些基于安全的适应症时去除该因子,细胞生长在物理上受到限制。在一些情况下,如果细胞不再能利用营养缺陷型因子,那么细胞就会停止分裂,并且不具有发展出抗性的不言而喻的机制。通过操控营养缺陷型因子的水平,体内细胞的生长速度得到控制。通过使用单独的营养缺陷型,可以在体内独立控制多个细胞系。位置特异性生长可以通过定位营养物释放来控制,如在释放营养物并防止细胞逃逸的生物相容性装置内施用的外源生长的胰腺b细胞。例如,本文所公开的方法和组合物可与嵌合抗原受体(car)-t细胞技术结合使用,以允许对体内car-t细胞的活性进行更明确的控制。在一些情况下,本文所公开的组合物用于抑制或减少肿瘤生长。例如,停用营养缺陷型因子(例如尿苷或生物素)可能导致肿瘤消退。
70.相当多的病症要么是由基因产物的不足引起的,要么可通过增加治疗因子(例如蛋白质、肽、抗体或rna)的表达来治疗。在一些实施方案中,本文公开了包含经修饰的宿主细胞的组合物,所述修饰宿主细胞包含整合在营养缺陷诱导型基因座处的编码目标治疗因子的转基因,其中所述经修饰的宿主细胞对于营养缺陷型因子是营养缺陷型的。本文在一些实施方案中还公开了使用本公开的组合物,通过提供足以产生该因子的治疗性表达的量的营养缺陷型因子来治疗有需要的个体的病况的方法。示例性治疗因子
71.以下实施方案提供了通过在营养缺陷型宿主细胞中产生治疗因子来进行治疗的
病况。
72.例如,凝血障碍是相当常见的遗传障碍,其中凝血级联中的因子不存在或由于突变而功能降低。这些包括血友病a(因子viii缺乏)、血友病b(因子ix缺乏)或血友病c(因子xi缺乏)。
73.α-1抗胰蛋白酶(a1at)缺乏症是一种常染色体隐性疾病,由α1-抗胰蛋白酶的产生缺陷引起,其导致血液和肺中a1at水平不足。它可能与慢性阻塞性肺病(copd)和肝脏病症的发展有关。
74.i型糖尿病是一种其中免疫介导的胰腺β细胞破坏导致胰岛素产生严重不足的病症。并发症包括缺血性心脏病(心绞痛和心肌梗塞)、中风和外周血管疾病、糖尿病视网膜病变、糖尿病神经病变和糖尿病肾病(这可能导致需要透析的慢性肾病)。
75.抗体是分泌的蛋白质产物,用于中和或清除引起疾病的靶蛋白以及高度选择性地杀死某些类型的细胞(例如癌细胞、自身免疫性疾病中的某些免疫细胞、感染病毒(如人类免疫缺陷病毒(hiv)、rsv、流感、埃博拉、cmv等)的细胞。抗体疗法已广泛应用于许多人类病况,qi包括肿瘤学、风湿病学、移植和眼部疾病。在一些情况下,由本文所公开的组合物编码的治疗因子是用于预防或治疗诸如癌症、传染病和自身免疫性疾病的病况的抗体。在某些实施方案中,通过降低对象中肿瘤的生长速度或减小肿瘤的大小来治疗癌症。
76.fda批准用于治疗用途的单克隆抗体包括:阿达木单抗、贝洛托舒单抗、阿维鲁单抗、度匹鲁单抗、德瓦鲁单抗、奥瑞组单抗、布罗达单抗、瑞替珠单抗、奥拉单抗、达雷妥尤单抗、埃罗妥珠单抗、耐昔妥珠单抗、英夫利西单抗、奥托萨昔单抗、阿特珠单抗、苏金单抗、美泊利单抗、纳武单抗、阿利珠单抗、艾达赛珠单抗、依洛尤单抗、地努妥昔单抗、贝伐珠单抗、派姆单抗、雷莫芦单抗、维多珠单抗、塞妥昔单抗、阿仑单抗、恩美曲妥珠单抗、帕妥珠单抗、英夫利西单抗、奥滨尤妥珠单抗、维布妥昔单抗、瑞西巴库、贝利木单抗、伊匹单抗、地诺单抗、地诺单抗、奥法木单抗、贝索单抗、托珠单抗、卡那单抗、戈利木单抗、乌司奴单抗、赛妥珠单抗、卡妥索单抗、依库珠单抗、雷珠单抗、帕尼单抗、那他珠单抗、卡妥索单抗、贝伐珠单抗、奥马珠单抗、西妥昔单抗、依法利珠单抗、替伊莫单抗、法索单抗(fanolesomab)、阿达木单抗、托西莫单抗、阿仑单抗、曲妥珠单抗、吉妥单抗、英夫利西单抗、帕利珠单抗、耐昔妥珠单抗、巴利昔单抗、利妥昔单抗、伏妥莫单抗、硫索单抗、阿西莫单抗、imiciromab、卡罗单抗、诺非妥莫单抗、阿昔单抗、沙妥莫单抗和莫罗单抗-cd3。fda批准用于治疗用途的双特异性抗体包括博纳吐单抗。在一些实施方案中,抗体被用于预防或治疗hiv或其他传染性疾病。用于治疗hiv的抗体包括人单克隆抗体(mab)vrc-hivmab060-00-ab(vrc01);mab vrc-hivmab080-00-ab(vrc01ls);mab vrc-hivmab075-00-ab(vrc07-523ls);mab f105;mab c2f5;mab c2g12;mab c4e10;抗体ub-421(靶向t淋巴细胞和单核细胞的cd4分子上的hiv-1受体(结构域1));ccr5mab004(结合ccr5的人单克隆igg4抗体);mab pgdm1400;mab pgt121(靶向hiv包膜蛋白的v1v2(pgdm1400)和v3多糖依赖性(pgt121)表位区域的重组人igg1单克隆抗体);kd-247(一种人源化的单克隆抗体);pro 140(一种单克隆ccr5抗体);mab 3bnc117;和pg9(抗hiv-1gp120单克隆抗体)。
77.治疗性rna包括反义、sirna、适体、微小rna模拟物/抗-mir和合成mrna,并且其中一些可以通过转基因表达。
78.lsd性是遗传性代谢疾病,其特征在于由于酶缺乏导致的各种有毒物质在身体细
胞中的异常积累。这些疾病总共有近50种,并且它们影响身体的不同部位,包括骨骼、大脑、皮肤、心脏和中枢神经系统。常见的实例包括鞘脂沉积症、farber病(asah1缺乏症)、krabbe病(半乳糖神经酰胺酶或galc缺乏症)、半乳糖唾液酸贮积症、神经节苷脂沉积症、α-半乳糖苷酶、法布里病(α-半乳糖苷酶缺乏症—gla,或半乳糖苷酶α/β)、schindler病(α-naga缺乏症)、gm1神经节苷脂沉积症、gm2神经节苷脂沉积症(β-氨基己糖苷酶缺乏症)、sandhoff病(氨基己糖苷酶b缺乏症),tay-sachs病(氨基己糖苷酶a缺乏症)、1/2/3型高歇氏病(葡糖脑苷脂酶缺乏症-基因名:gba)、wolman病(lal缺乏症)、a/b型niemann-pick病(鞘磷脂磷酸二酯酶1缺乏症
‑‑
smpd1或酸性鞘磷脂酶)、脑硫脂沉积病(sulfatidosis)、异染性脑白质营养不良、hurler综合征(α-l艾杜糖苷酶缺乏症
‑‑
idua)、hunter综合征或mps2(艾杜糖醛酸-2-硫酸酯酶缺乏症-艾杜硫酸酯酶或ids)、sanfilippo综合征、黏多糖病(morquio)、maroteaux-lamy综合征、sly综合征(β-葡萄糖醛酸酶缺乏症)、粘脂贮积病、i细胞病、脂沉积症、=神经元蜡样脂褐质沉积症、batten病(三肽基肽酶-1缺乏症)、pompe(阿糖苷酶α缺乏症)、低磷酸酯酶症(asfotaseα缺乏症)、mps1(拉罗尼酶缺乏症)、mps3a(肝素n-硫酸酯酶缺乏症)、mps3b(α-n-乙酰葡糖胺糖苷酶缺乏症)、mps3c(肝素-α-氨基葡糖苷n-转乙酰酶缺乏症)、mps3d(n-乙酰氨基葡萄糖6-硫酸酯酶缺乏症)、mps4(elosulfaseα缺乏症)、mps6(glasulfate缺乏症)、mps7(b-葡萄糖苷酸酶缺乏症)、苯丙酮尿症(苯丙氨酸羟化酶缺乏症)和mld(芳基硫酸酯酶a缺乏症)。总的来说,lsd在人群中的发病率约为7000名新生儿中的1人,并具有包括早逝在内的严重影响。虽然针对这些疾病中的一些的可能治疗方法的临床试验正在进行中,但目前还没有针对许多lsd的批准治疗方法。目前针对一些但并非所有lsd的治疗选择包括酶替代疗法(ert)。ert是一种医学疗法,其可替代体内缺乏或不存在的酶。在一些情况下,这是通过给患者静脉内(iv)输注含有酶的溶液来完成的。
79.本文在一些实施方案中公开了治疗有需要个体中的lsd的方法,所述方法包括使用本文所公开的组合物向个体提供酶替代疗法。在一些情况下,该方法包括离体的经修饰的宿主细胞,其包含编码整合在营养缺陷诱导型基因座处的酶的转基因,其中所述经修饰的宿主细胞是营养缺陷型因子营养缺陷型的,并且能够个体中缺乏的表达酶,从而治疗个体中的lsd。在一些情况下,营养缺陷诱导型基因座位于表1的基因内或位于控制表1中基因表达的区域内。在一些情况下,营养缺陷诱导型基因座位于编码尿苷单磷酸合成酶(umps)的基因内。在一些情况下,营养缺陷型因子是尿苷。在一些情况下,营养缺陷诱导型基因座位于编码羧化全酶合成酶(hlcs)的基因内。在一些情况下,营养缺陷型因子是生物素。在一些情况下,营养缺陷诱导型基因座位于编码天冬酰胺合成酶的基因内。在一些情况下,营养缺陷型因子是天冬酰胺。在一些情况下,营养缺陷诱导型基因座位于编码天冬氨酸转氨酶的基因内。在一些情况下,营养缺陷型因子是天冬氨酸。在一些情况下,营养缺陷诱导型基因座位于编码丙氨酸转氨酶的基因内。在一些情况下,营养缺陷型因子是丙氨酸。在一些情况下,营养缺陷诱导型基因座位于编码胱硫醚β合成酶的基因内。在一些情况下,营养缺陷型因子是半胱氨酸。在一些情况下,营养缺陷诱导型基因座位于编码胱硫醚γ-裂解酶的基因内。在一些情况下,营养缺陷型因子是半胱氨酸。在一些情况下,营养缺陷诱导型基因座位于编码谷氨酰胺合成酶的基因内。在一些情况下,营养缺陷型因子是谷氨酰胺。在一些情况下,营养缺陷诱导型基因座位于编码丝氨酸羟甲基转移酶的基因内。在一些情况下,营养缺陷型因子是丝氨酸或甘氨酸。在一些情况下,营养缺陷诱导型基因座位于编码甘氨酸合
成酶的基因内。在一些情况下,营养缺陷型因子是甘氨酸。在一些情况下,营养缺陷诱导型基因座位于编码磷酸化丝氨酸转氨酶的基因内。在一些情况下,营养缺陷型因子是丝氨酸。在一些情况下,营养缺陷诱导型基因座位于编码磷酸化丝氨酸磷酸酶的基因内。在一些情况下,营养缺陷型因子是丝氨酸。在一些情况下,营养缺陷诱导型基因座位于编码苯丙氨酸羟化酶的基因内。在一些情况下,营养缺陷型因子是酪氨酸。在一些情况下,营养缺陷诱导型基因座位于编码精氨基琥珀酸合成酶的基因内。在一些情况下,营养缺陷型因子是精氨酸。在一些情况下,营养缺陷诱导型基因座位于编码精氨基琥珀酸裂解酶的基因内。在一些情况下,营养缺陷型因子是精氨酸。在一些情况下,营养缺陷诱导型基因座位于编码二氢叶酸还原酶的基因内。在一些情况下,营养缺陷型因子是叶酸或四氢叶酸。
80.本文在一些实施方案中还公开了治疗有需要个体中疾病或病症的方法,所述方法包括使用本文所公开的组合物向个体提供蛋白质替代疗法。在一些情况下,该方法包括离体的经修饰的宿主细胞,其包含编码整合在营养缺陷诱导型基因座处的蛋白质的转基因,其中所述经修饰的宿主细胞是营养缺陷型因子营养缺陷型的,并且能够表达个体中缺乏的蛋白质,从而治疗个体中的疾病或病症。在一些情况下,营养缺陷诱导型基因座位于表1中的基因中,或位于控制表1中基因表达的区域中。在一些情况下,营养缺陷诱导型基因座位于编码尿苷单磷酸合成酶(umps)的基因中。在一些情况下,营养缺陷型因子是尿苷。在一些情况下,营养缺陷诱导型基因座位于编码羧化全酶合成酶(hlcs)的基因中。在一些情况下,营养缺陷型因子是生物素。在一些情况下,疾病是弗里德希氏共济失调,并且蛋白质是共济蛋白。在一些情况下,疾病是遗传性血管性水肿,并且蛋白质是c1酯酶抑制剂(例如,皮下注射)。在一些情况下,疾病是脊髓性肌萎缩症,并且蛋白质是smn1。iii.用于制备修饰细胞的组合物和方法a.细胞
81.本文在一些实施方案中公开了包含经修饰的宿主细胞(优选人类细胞)的组合物,所述宿主细胞被遗传工程化为营养缺陷型的(通过在营养缺陷诱导型基因座处插入编码治疗因子的转基因),并且能够表达治疗因子。考虑了离体、体外或体内经修饰的动物细胞、哺乳动物细胞,优选人类细胞。还包括其他灵长类动物的细胞;哺乳动物,其包括商业相关的哺乳动物,如牛、猪、马、绵羊、猫、狗、小鼠、大鼠;鸟类,其包括商业相关鸟类,如家禽、鸡、鸭、鹅和/或火鸡。
82.在一些实施方案中,细胞是胚胎干细胞、干细胞、祖细胞、多能干细胞、诱导型多能干(ips)细胞、成体干细胞、分化的细胞、间充质干细胞或间充质基质细胞、神经干细胞、造血干细胞或造血祖细胞、脂肪干细胞、角化细胞、骨骼干细胞、肌肉干细胞、成纤维细胞、nk细胞、b细胞、t细胞或外周血单个核细胞(pbmc)。例如,细胞可以被工程化成表达car,从而产生car-t细胞。在一些实施方案中,细胞系是被遗传工程化为营养缺陷型的t细胞。可以将工程化的营养缺陷型t细胞与营养缺陷型因子一起施用于癌症患者。在癌症被破坏后,营养缺陷型营养物质可能会被去除,其导致工程化的营养缺陷型t细胞被消除。在一些实施方案中,细胞系是多能干细胞,其被遗传工程化为营养缺陷型的。工程化的营养缺陷型多能干细胞可以与营养缺陷型因子一起施用于患者。在工程化的营养缺陷型多能干细胞转化为癌细胞后,营养缺陷型因子可以被去除,这导致癌细胞和工程化的营养缺陷型多能干细胞的消
除。
83.为了防止经修饰的细胞在被施用于对象时的免疫排斥,待修饰的细胞优选来源于对象自身的细胞。因此,优选地,哺乳动物细胞来自待用经修饰的细胞治疗的对象。在一些情况下,哺乳动物细胞被修饰为自体细胞。在一些情况下,哺乳动物细胞被进一步修饰为同种异体细胞。在一些情况下,经修饰的t细胞可以被进一步修饰为同种异体的,例如,通过灭活t细胞受体基因座。在一些情况下,经修饰的细胞可以进一步修饰为同种异体的,例如,通过删除b2m以去除细胞表面上的mhc i类,或通过删除b2m然后将hla-g-b2m融合体添加回表面,以防止nk细胞排斥在其表面上没有mhc i类的细胞。
84.细胞系可以包括使用u.s.8,945,862中所示的以下技术维持和分化的干细胞,该专利在此通过引用整体并入本文中。在一些实施方案中,干细胞不是人胚胎干细胞。此外,细胞系可以包括通过wo2003/046141或chung等人(cell stem cell,2008年2月,第2卷,第113-117页)中所公开的技术制备的干细胞;其中每一项都在此通过引用整体并入本文中。
85.例如,细胞可以是从对象分离的干细胞,用于上皮、软骨、骨、平滑肌、横纹肌、神经上皮、复层鳞状上皮和神经节中的任一种的再生医学治疗。由一种或几种细胞类型的死亡或功能障碍引起的疾病(如帕金森氏病和青少年发病型糖尿病)通常也使用干细胞进行治疗(参见,thomson等人,science,282:1145-1147,1998,其在此通过引用整体并入本文中)。
86.在一些实施方案中,根据本文所公开的方法从对象收获细胞并对其进行修饰,其可包括选择某些细胞类型,任选地扩增细胞和任选地培养细胞,并且其可另外包括选择含有整合到营养缺陷诱导型基因座中的转基因的细胞。b.用于插入转基因的供体模板或载体
87.在一些实施方案中,本文所公开的组合物包含用于将转基因插入营养缺陷诱导型基因座中的供体模板或载体。
88.在一些实施方案中,供体模板包含:(a)一种或多种核苷酸序列,其与营养缺陷诱导型基因座的片段同源,或与所述营养缺陷诱导型基因座的互补序列同源,和(b)编码治疗因子的转基因,其任选地与表达控制序列连接。例如,在将核酸酶系统用于切割dna后,在其修复dna中的断裂期间,引入供体模板可利用同源导向修复机制来插入转基因序列。在一些情况下,供体模板包含与断裂区域中核苷酸序列同源的区域,以便供体模板与邻近断裂的区域杂交,并用作修复断裂的模板。
89.在一些实施方案中,转基因的两侧均侧接有与营养缺陷诱导型基因座的片段或其互补序列同源的核苷酸序列。
90.在一些情况下,供体模板是单链的、双链的、质粒或dna片段。
91.在一些情况下,质粒包含复制所必需的元件,其包括启动子和任选地3’utr。
92.本文还公开了载体,其包含:(a)一种或多种核苷酸序列,其与营养缺陷诱导型基因座的片段同源,或与所述营养缺陷诱导型基因座的互补序列同源,和(b)编码治疗因子的转基因。
93.载体可以是病毒载体,如逆转录病毒、慢病毒(整合感受态型和整合缺陷型慢病毒载体)、腺病毒、腺相关病毒或单纯疱疹病毒载体。病毒载体还可包含病毒载体复制所必需的基因。
94.在一些实施方案中,靶向构建体包含:(1)病毒载体主链(例如aav主链)以用于生
成病毒;(2)每侧上与至少200bp但理想地400bp的靶位点同源的臂,以确保对位点的高水平可重复靶向(参见,porteus,annual review of pharmacology and toxicology,vol.56:163-190(2016);其在此通过引用整体并入本文中);(3)编码治疗因子并能够表达治疗因子的转基因;(4)与转基因可操作地连接的表达控制序列;和任选地(5)另外的标志物基因,以允许富集和/或监测经修饰的宿主细胞。
95.合适的标志物基因是本领域已知的,并且包括myc、ha、flag、gfp、截短的ngfr、截短的egfr、截短的cd20、截短的cd19,以及抗生素抗性基因。
96.可以使用本领域已知的任何aav。在一些实施方案中,主要aav血清型是aav6。
97.在任何前述实施方案中,供体模板或载体包含与营养缺陷诱导型基因座的片段同源的核苷酸序列,任选地下表1中的任一基因,其中所述核苷酸序列与营养缺陷诱导型基因座的至少200、250、300、350或400个连续的核苷酸具有至少85%、88%、90%、92%、95%、98%或99%的同一性;最多400个核苷酸通常足以确保准确重组。预期了上述参数的任意组合,例如与至少200个连续的核苷酸至少85%的同一性,或与至少200个连续的核苷酸至少88%的同一性,或与至少200个连续的核苷酸至少90%的同一性,或与至少200个连续的核苷酸至少92%的同一性,或与至少200个连续的核苷酸至少95%的同一性,或与至少200个连续的核苷酸至少98%的同一性,或与至少200个连续的核苷酸至少99%的同一性,或与至少250个连续的核苷酸至少85%的同一性,或与至少250个连续的核苷酸至少88%的同一性,或与至少250个连续的核苷酸至少90%的同一性,或与至少250个连续的核苷酸至少92%的同一性,或与至少250个连续的核苷酸至少95%的同一性,或与至少250个连续的核苷酸至少98%的同一性,或与至少250个连续的核苷酸至少99%的同一性,或与至少300个连续的核苷酸至少85%的同一性,或与至少300个连续的核苷酸至少88%的同一性,或与至少300个连续的核苷酸至少90%的同一性,或与至少300个连续的核苷酸至少92%的同一性,或与至少300个连续的核苷酸至少95%的同一性,或与至少300个连续的核苷酸至少98%的同一性,或与至少300个连续的核苷酸至少99%的同一性,或与至少350个连续的核苷酸至少85%的同一性,或与至少350个连续的核苷酸至少88%的同一性,或与至少350个连续的核苷酸至少90%的同一性,或与至少350个连续的核苷酸至少92%的同一性,或与至少350个连续的核苷酸至少95%的同一性,或与至少350个连续的核苷酸至少98%的同一性,或与至少350个连续的核苷酸至少99%的同一性,或与至少400个连续的核苷酸至少85%的同一性,或与至少400个连续的核苷酸至少88%的同一性,或与至少400个连续的核苷酸至少90%的同一性,或与至少400个连续的核苷酸至少92%的同一性,或与至少400个连续的核苷酸至少95%的同一性,或与至少400个连续的核苷酸至少98%的同一性,或与至少400个连续的核苷酸至少99%的同一性。
98.本公开还涵盖用于将转基因靶向整合至营养缺陷诱导型基因座的系统,其包含所述供体模板或载体、cas9蛋白质和向导rna。
99.本文的公开内容还涵盖用于将转基因靶向整合至营养缺陷诱导型基因座的系统,其包含所述供体模板或载体和所述特异性针对营养缺陷诱导型基因座的大范围核酸酶。例如,大范围核酸酶可以是zfn或talen。
100.在由于急性毒性可能需要快速去除细胞的情况下,插入的构建体还可以包括其他安全开关,如基因座中的标准自杀基因(例如icasp9)。本公开提供了稳健的安全开关,从而
可以通过去除营养缺陷型因子来消除移植到体内的任何工程化细胞。如果工程化细胞已经转化为癌细胞,这一点尤其重要。
101.在一些情况下,供体多核苷酸或载体任选地还包含与所述转基因可操作地连接的表达控制序列。在一些实施方案中,表达控制序列是启动子或增强子、诱导型启动子、组成型启动子、组织特异性启动子或表达控制序列、转录后调控序列或微小rna。c.核酸酶系统
102.在一些实施方案中,本文所公开的组合物包含靶向营养缺陷诱导型基因座的核酸酶系统。例如,本公开涵盖(a)靶向并切割所述营养缺陷诱导型基因座处的dna的大范围核酸酶,或(b)编码所述大范围核酸酶的多核苷酸,其包括用于表达所述大范围核酸酶的载体系统。例如,大范围核酸酶是作为融合蛋白的talen,其包含:(i)结合营养缺陷诱导型基因座的转录激活因子样效应物(tale)dna结合结构域,其中tale dna结合蛋白包含多个tale重复单元,每个tale重复单元包含结合营养缺陷诱导型基因座中的靶序列中的核苷酸的氨基酸序列,和(ii)dna切割结构域。
103.本文还公开了在营养缺陷诱导型基因座处靶向和切割dna的crispr/cas或crispr/cpfl系统。示例性的crispr/cas系统包含:(a)cas(例如cas9)或cpf1多肽或编码所述多肽的核酸,和(b)与所述营养缺陷诱导型基因座特异性杂交的向导rna,或编码所述向导rna的核酸。在自然界中,cas9系统由cas9多肽、crrna和反式激活crrna(tracrrna)组成。如本文所使用的,“cas9多肽”是指天然存在的cas9多肽或保留切割至少一条dna链的能力的经修饰的cas9多肽。经修饰的cas9多肽可以例如与天然存在的cas9多肽具有至少75%、80%、85%、90%或95%的同一性。可以使用来自不同细菌物种的cas9多肽;化脓性链球菌(s.pyogenes)通常商业出售。cas9多肽通常会产生双链断裂,但可以通过将失活突变引入hnh或ruvc结构域中,将其转化为仅切割dna单链的切口酶(即产生“单链断裂”)。类似地,天然存在的tracrrna和crrna可以被修饰,只要它们继续杂交并保留靶向所期望dna的能力,以及结合cas9的能力。向导rna可以是嵌合rna,其中两个rna融合在一起(例如利用人工环),或者向导rna可以包含两个杂交的rna。大范围核酸酶或crispr/cas或crispr/cpf1系统可在营养缺陷诱导型基因座内产生双链断裂或一个或多个单链断裂,例如,以产生包括突出部分的切割末端。
104.在一些情况下,本文所述的核酸酶系统还包含如本文所述的供体模板。
105.本领域已知多种用于编辑核酸的方法,例如以引起基因敲除或基因表达下调。例如,各种核酸酶系统,如锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)、大范围核酸酶或以上的组合在本领域中已知用于编辑核酸,并且可用于本公开中。大范围核酸酶是天然存在的限制酶的修饰形式,其通常具有延伸或融合的dna识别序列。
106.crispr/cas系统在例如wo 2013/176772、wo 2014/093635和wo 2014/089290中有详细描述;其中每项在此通过引用整体并入本文中。它在t细胞中的用途在wo 2014/191518中提出,该专利在此通过引用整体并入本文中。t细胞的crispr工程化在ep 3004349中有讨论,该专利在此通过引用整体并入本文中。
107.产生突变(敲除、敲入或基因替代)细胞系的时间限制因素是开发crispr/cas9平台之前的克隆筛选和选择。如本文所使用的,术语“crispr/cas9核酸酶系统”是指遗传工程化工具,其包括具有cas9结合位点的向导rna(grna)序列和特异性针对待修饰区域的靶向
序列。cas9与grna结合形成核糖核蛋白,该蛋白结合并切割靶区域。crispr/cas9允许轻松地对多个基因编辑进行多路复用。在一些实施方案中,grna包含seq id no:1的核酸序列。
108.除了crispr/cas 9平台(其为ii型crispr/cas系统)外,还存在可替代系统,其包括i型crispr/cas系统、iii型crispr/cas系统和v型crispr/cas系统。已经公开了各种crispr/cas9系统,举例来说其包括化脓性链球菌cas9(spcas9)、嗜热链球菌(streptococcus thermophilus)cas9(stcas9)、空肠弯曲杆菌(campylobacter jejuni)cas9(cjcas9)和灰色奈瑟球菌(neisseria cinerea)cas9(nccas9)。cas系统的替代物包括新凶手弗朗西斯菌(francisella novicida)cpf1(fncpf1)、氨基酸球菌(acidaminococcus sp.)cpf1(ascpf1)和毛螺科细菌nd2006 cpf1(lbcpf1)系统。任何上述crispr系统都可被用于产生本文公开的细胞系的方法。例如,使用的crispr系统可以是crispr/cas9系统,如化脓性链球菌crispr/cas9系统。iv.产生经修饰的宿主细胞的方法
109.在一些实施方案中,营养缺陷诱导型基因座位于选自表1中所公开的那些的靶基因中,或控制该基因表达的区域中。在一些实施方案中,靶基因选自umps(产生尿嘧啶营养缺陷型的细胞系)和羧化全酶合成酶(产生生物素营养缺陷型的细胞系)。在一些实施方案中,营养缺陷型因子选自生物素、丙氨酸、天冬氨酸、天冬酰胺、谷氨酸、丝氨酸、尿嘧啶和胆固醇。
110.本文还公开了使用所述核酸酶系统产生本文描述的经修饰的宿主细胞的方法,其包括向细胞中引入:(a)靶向并切割营养缺陷诱导型基因座处的dna的一种或多种核酸酶系统的组件,例如大范围核酸酶(如zfn或talen),或crispr/cas核酸酶(如crispr/cas9),和(b)如本文所述的供体模板或载体。每个组件都可以被直接引入细胞中,或者可以通过引入编码所述一种或多种核酸酶系统的组件的核酸而在细胞中被表达。该方法还可以包括引入第二核酸酶系统,例如靶向并切割第二基因座处的dna的第二大范围核酸酶或第二crispr/cas核酸酶,或靶向第二基因座处的dna的第二向导rna,或编码任何上述元件的核酸,和(b)第二供体模板或载体。第二供体模板或载体可包含不同的转基因,或同一转基因的第二个拷贝,其随后将根据此类方法整合在第二基因座处。
111.此类方法将编码治疗因子的转基因靶向整合到离体宿主细胞中的营养缺陷诱导型基因座。
112.此类方法还可以包括:(a)向细胞中引入供体模板或载体,任选地在扩增所述细胞之后,或任选地在扩增所述细胞之前,和(b)任选地培养细胞。
113.在一些实施方案中,本文的公开内容涵盖产生经修饰的哺乳动物宿主细胞的方法,其包括向哺乳动物细胞中引入:(a)cas9多肽,或编码所述cas9多肽的核酸,(b)特异性针对营养缺陷诱导型基因座的向导rna,或编码所述向导rna的核酸,和(c)如本文所述的供体模板或载体。该方法还可以包括引入:(a)特异性针对第二营养缺陷诱导型基因座的第二向导rna,和(b)第二供体模板或载体。在此类方法中,向导rna可以是嵌合rna或两个杂交的rna。
114.在这些方法的任一种中,核酸酶可以在营养缺陷诱导型基因座内产生一个或多个单链断裂,或在营养缺陷诱导型基因座内产生双链断裂。在这些方法中,利用所述供体模板或载体,通过同源重组对营养缺陷诱导型基因座进行修饰,以导致转基因插入到基因座中。
115.该方法还可以包括:(c)选择含有整合到营养缺陷诱导型基因座中的转基因的细胞。选择步骤可以包括:(i)选择需要营养缺陷型因子以存活的细胞,以及任选地(ii)选择包含整合到营养缺陷诱导型基因座中的转基因的细胞。
116.在一些实施方案中,营养缺陷诱导型基因座是编码尿苷单磷酸合成酶的基因,并且通过使它们与5-foa接触来选择细胞。umps基因是将5-foa代谢为5-fump所必需的,5-fump由于其掺入rna/dna中而对细胞有毒。因此,umps基因被破坏的细胞将在5-foa处理中存活下来。由此产生的细胞都将是营养缺陷型的,尽管并非所有细胞都可能含有转基因。随后对转基因的阳性选择将仅分离出营养缺陷型并且也能够表达转基因的经修饰的宿主细胞。
117.在一些实施方案中,本文的公开内容提供了产生经修饰的人类宿主细胞的方法,其包括以下步骤:(a)获得细胞库,(b)使用核酸酶将转基因引入营养缺陷诱导型基因座,例如,通过敲除或下调基因的表达,和(c)筛选营养缺陷型,和(d)筛选转基因的存在。
118.可以通过在有或没有表1中公开的营养缺陷型因子之一的情况下培养细胞来进行筛选步骤。
119.用于插入能够表达功能性因子、抗体和细胞表面受体的转基因(包括大型转基因)的技术是本领域已知的(参见,例如bak和porteus,cell rep.2017年7月18日;20(3):750
–
756(egfr的整合);kanojia等人,stem cells.2015年10月;33(10):2985-94(抗her2抗体的表达);eyquem等人,nature.2017年3月2日;543(7643):113-117(car的基因座特异性整合);o’connell等人,2010plos one 5(8):e12009(人il-7的表达);tuszynski等人,nat med.2005年5月;11(5):551-5(成纤维细胞中ngf的表达);sessa等人,lancet.2016年7月30日;388(10043):476-87(用于治疗mld的离体基因疗法中芳基硫酸酯酶a的表达);rocca等人,science translational medicine 2017年10月25日:第9卷,第413期,eaaj2347(共济蛋白的表达);bak和porteus,cell reports,第20卷,第3期,2017年7月18日,第750-756页(将大型转基因盒整合到单个基因座中),dever等人,nature 2016年11月17日:539,384-389(将tngfr加入造血干细胞(hsc)和hspc中,以选择和富集经修饰的细胞);其中每项均在此通过引用整体并入本文中。a.营养缺陷诱导型基因座和营养缺陷型因子
120.在一些实施方案中,单个基因的破坏造成所期望的营养缺陷型。在可替代的实施方案中,多个基因的破坏产生所期望的营养缺陷型。
121.在一些实施方案中,营养缺陷诱导型基因座是编码产生营养缺陷型因子的蛋白质的基因,所述蛋白质包括用于产生营养缺陷型因子的通路上游的蛋白质。
122.在本文所述的一些实施方案中,营养缺陷诱导型基因座是编码尿苷单磷酸合成酶(umps)的基因(并且相应的营养缺陷型因子是尿嘧啶),或编码羧化全酶合成酶的基因(并且相应的营养缺陷型因子是生物素)。在一些实施方案中,营养缺陷诱导型基因座选自表1中的以下基因。通过选择具有注释为“营养缺陷型”的表型的酿酒酵母(s.cerevisiae)基因整理了表1的基因,从酵母菌基因组数据库(sgd)上的酵母表型本体数据库下载了“化学”数据(参见,cherry等人,2012,nucleic acids res.40:d700-d705,其在此通过引用整体并入本文中)。使用数据库或在可替代实施方案(酵母菌基因组数据库(sgd))中,将这些基因转化为人类同源物。通过它们的ensembl基因符号和ensg标识符来鉴定这些基
因,这些标识符可以在ensembl数据库(www.ensembl.org)中找到。已删除ensg标识符的前五个零(例如,ensg00000)。表1.营养缺陷诱导型基因座
123.ccbl1也可称为kyat1。ccbl2也可称为kyat3。dhfrl1也可称为dhfr2。pycrl也可称为pycr3。hrsp12也可称为rida。
124.营养缺陷型因子可以是一种或两种或更多种营养素、酶、改变的ph、改变的温度、非有机分子、非必需氨基酸或改变的部分浓度(与正常生理浓度相比),或以上的组合。本文对营养缺陷型因子的所有提及都考虑了施用多种因子。任何因子都是合适的,只要它对对象没有毒性并且在未治疗的对象中不是生物可利用的或以足够的浓度存在,以维持经修饰的宿主细胞的生长和繁殖。
125.例如,营养缺陷型因子可以是一种营养物质,它是经修饰的宿主细胞增殖所需的物质或在经修饰的宿主细胞的代谢中起辅因子的作用。在表1中公开了各种营养缺陷型因子。在某些实施方案中,营养缺陷型因子选自生物素、丙氨酸、天冬氨酸、天冬酰胺、谷氨酸、丝氨酸、尿嘧啶、缬氨酸和胆固醇。生物素,也称为维生素b7,是细胞生长所必需的。在一些情况下,造血干细胞的增殖和维持需要缬氨酸。在一些情况下,本文是公开的组合物用于在hsc中表达酶,其减轻对缬氨酸补充的需要,并从而与未经修饰的细胞相比,在从饮食中去除缬氨酸时赋予那些细胞选择性优势。b.转基因
126.由经修饰的宿主细胞的基因组编码的治疗实体可引起治疗效应,如分子运输、诱导细胞死亡、另外细胞的募集或细胞生长。在一些实施方案中,治疗效果是治疗性蛋白质的表达。在一些实施方案中,治疗效应是诱导细胞死亡,其包括肿瘤细胞的细胞死亡。c.转基因表达的控制
127.在一些情况下,转基因任选地连接至一个或多个表达控制序列,其包括基因的内源启动子,或异源组成型或诱导型启动子、增强子、组织特异性启动子或转录后调控序列。例如,可以使用组织特异性启动子(转录靶向)来驱动转基因表达,或者可以在rna中包括调控序列(微小rna(mirna)靶位点),以避免在某些组织中表达(转录后靶向)。在一些情况下,表达控制序列的功能是按照与正常个体相同的表达模式(生理性表达)表达治疗性转基因(参见,toscano等人,gene therapy(2011)18,117
–
127(2011),针对其关于启动子和调控序列,通过引用整体并入本文中)。
128.组成型哺乳动物启动子包括但不限于以下基因的启动子:次黄嘌呤磷酸核糖转移酶(hptr)、腺苷脱氨酶、丙酮酸激酶、α-肌动蛋白启动子和其他组成型启动子。在真核细胞中发挥组成性功能的示例性病毒启动子包括,例如,来自猿猴病毒、乳头瘤病毒、腺病毒、人类免疫缺陷病毒(hiv)、劳斯肉瘤病毒、巨细胞病毒、moloney白血病病毒和其他逆转录病毒的长末端重复序列(ltr)的启动子,以及单纯疱疹病毒的胸苷激酶启动子。常用的启动子包括cmv(巨细胞病毒)启动子/增强子、ef1a(延伸因子1a)、sv40(猿猴病毒40)、鸡β-肌动蛋白和cag(cmv、鸡β-肌动蛋白、兔β-珠蛋白)、泛素c和pgk,所有这些都在大多数细胞类型中提供组成性活性、高水平的基因表达。其他组成型启动子是本领域普通技术人员已知的。
129.诱导型启动子在诱导剂存在下被激活。例如,在某些金属离子存在的情况下,金属硫蛋白启动子被激活以增加转录和翻译。其他诱导型启动子包括醇调控的、四环素调控的、类固醇调控的、金属调控的、营养调控的启动子和温度调控的启动子。
130.对于肝脏特异性靶向:天然和嵌合启动子和增强子已被并入病毒和非病毒载体中,以将因子viia、因子viii或因子ix的表达靶向肝细胞。来自肝脏特异性基因(如白蛋白和人α1抗胰蛋白酶(haat))的启动子区域是天然启动子的很好的实例。可替代地,已经开发了嵌合启动子以增加特异性和/或载体效率。很好的实例是(apoe)4/haat嵌合启动子/增强子,其包含四个拷贝的肝脏特异性apoe/haat增强子/启动子组合,以及dc172嵌合启动子,其包含一个拷贝的haat启动子和两个拷贝的α(1)-微球蛋白增强子。
131.对于肌肉特异性靶向:天然(肌酸激酶启动子-mck,结蛋白)和合成的(α-肌球蛋白重链增强子-/mck增强子-启动子(mhck7))启动子已包括在病毒和非病毒载体中,以实现高效和特异性的肌肉表达。
132.对于内皮特异性靶向,天然(vwf、flt-1和icam-2)和合成启动子都已被用于驱动内皮特异性表达。
133.对于髓系细胞靶向,据报道含有髓系转录因子caat盒增强子结合家族蛋白(c/ebp)和pu.1的结合位点的合成嵌合启动子,其在粒细胞分化过程中高度表达,以指导主要在骨系细胞中的转基因表达(参见,santilli等人,mol ther.2011年1月;19(1):122-32,其在此通过引用整体并入本文中。cd68还可被用于髓系靶向。
134.用于遗传病的基因疗法的组织特异性载体的实例在表2中示出。表2.组织特异性载体
135.用于遗传病的基因疗法的生理调控载体的实例显示在表3中。表3.生理调控的载体
136.还可以通过改变转基因的mrna稳定性和/或翻译效率(转录后靶向)来追求组织特异性和/或生理调控的表达。可替代地,将mirna靶标识别位点(mirt)掺入表达的mrna中已被用于募集内源性宿主细胞机制,以阻止特定组织或细胞类型中的转基因表达(脱靶)。mirna是非编码rna,大约有22个核苷酸,与特定mrna的3'utr区域(称为mirt)完全或部分互补。mirna与其特定mirt的结合促进了翻译衰减/失活和/或降解。通过mirna的表达调控被描述于geisler和fechner,world j exp med.2016年5月20日,6(2):37
–
54;brown和naldini,nat rev genet.2009年8月,10(8):578-85;gentner和naldini,tissue antigens.2012年11月,80(5):393-403中;其中每项均在此通过引用整体并入本文中。工程化被特定mirna细胞类型识别的mirt载体已被证明是在非期望的细胞类型中敲低治疗基因表达的有效方式(参见,toscano等人,同上,其在此通过引用整体并入本文中)。d.药物组合物
137.本文在一些实施方案中公开了使用经修饰的细胞的方法、组合物和试剂盒,其包
括药物组合物、治疗方法,以及施用营养缺陷型因子来控制
–
增加、减少或停止-经修饰的细胞的生长和繁殖并且控制转基因表达治疗因子的方法。
138.经修饰的哺乳动物宿主细胞可以与营养缺陷型因子分开或与营养缺陷型因子组合施用于对象。尽管本文所提供的药物组合物的描述主要涉及适合于向人施用的药物组合物,但本领域技术人员将理解此类组合物通常适合于向任何动物施用。
139.考虑施用药物组合物的对象,其包括但不限于:人类和/或其他灵长类动物;哺乳动物,其包括商业相关的哺乳动物,如牛、猪、马、绵羊、猫、狗、小鼠、大鼠;鸟类,其包括商业相关的鸟类,如家禽、鸡、鸭、鹅和/或火鸡。在一些实施方案中,将组合物施用于人类、人类患者或对象。
140.在一些情况下,本文所述的药物组合物被用于治疗对象的疾病、病症或病况的方法中,所述方法包括:(i)产生对营养物、酶、改变的ph、改变的温度、改变的部分浓度和/或生态位环境是营养缺陷型的细胞系,使得对象中不存在营养物、酶、改变的ph、改变的温度和生态位环境;(ii)使对象与步骤(i)所得的营养缺陷型细胞系接触;(iii)使(ii)的对象与选自改变ph和/或温度的营养物、酶、部分,以及对象中的细胞生态位环境接触,使得营养缺陷型因子激活营养缺陷型系统或元件,导致对象细胞系生长和/或表达一种或多种治疗实体。
141.本文公开的药物组合物还可被用于治疗对象的疾病、病症或病况的方法中,其包括(a)根据本文的公开内容向对象施用经修饰的宿主细胞,和(b)以足以促进经修饰的宿主细胞生长的量向对象施用营养缺陷型因子。
142.包含营养物营养缺陷型因子的组合物还可被用于向包含本文公开内容的经修饰的宿主细胞的人施用。v.制剂a.细胞工程化制剂
143.经修饰的宿主细胞被遗传工程化以将编码治疗因子的转基因插入到营养缺陷诱导型基因座中。可以通过脂质体介导的转染、电穿孔或核定位来递送靶向所期望基因座的cas9蛋白/grna核糖核蛋白复合物(cas9 rnp)。在一些实施方案中,经修饰的宿主细胞在电穿孔后与含有血清的培养基接触。在一些实施方案中,经修饰的宿主细胞在电穿孔后与含有减少血清或不含血清的培养基接触。b.治疗制剂
144.可以使用一种或多种赋形剂配制本文公开的经修饰的宿主细胞或营养缺陷型因子以:(1)增加稳定性;(2)改变生物分布(例如,将细胞系靶向特定组织或细胞类型);(3)改变编码治疗因子的释放特征;和/或(4)提高营养缺陷型因子的摄取。
145.本公开的制剂可以包括但不限于盐水、脂质体、脂质纳米颗粒、聚合物、肽、蛋白质及以上的组合。
146.本文所描述的药物组合物的制剂可以通过药理学领域中已知的或以后开发的任何方法来制备。如本文所使用的,术语“药物组合物”是指包括至少一种活性成分和任选地一种或多种药学上可接受的赋形剂的组合物。本公开的药物组合物可以是无菌的。
147.通常,此类制备方法包括将活性成分与赋形剂和/或一种或多种其他辅助成分缔合的步骤。如本文所使用的,短语“活性成分”通常指(a)经修饰的宿主细胞或供体模板,其
包括能够表达插入营养缺陷诱导型基因座中的治疗因子的转基因,或(b)相应的营养缺陷型因子,或(c)用于在营养缺陷诱导型基因座内靶向切割的核酸酶系统。
148.本文所述的经修饰的宿主细胞或营养缺陷型因子和药物组合物的制剂可以通过本领域已知的多种方法制备。
149.根据本公开的药物组合物可以作为单一单位剂量和/或多个单一单位剂量批量制备、包装和/或销售。如本文所使用的,“单位剂量”是指包括预定量的活性成分的离散量的药物组合物。
150.根据本公开的药物组合物中的活性成分(例如,经修饰的宿主细胞或营养缺陷型因子)、药学上可接受的赋形剂,和/或任何另外的成分的相对量可以根据接受治疗的对象的特性、大小和/或状况而变化,并且还取决于组合物的施用途径。例如,组合物可包括0.1%-99%(w/w)的活性成分。举例来说,组合物可包括0.1%至100%,例如0.5%至50%、1%至30%、5%至80%或至少80%(w/w)的活性成分。c.赋形剂和稀释剂
151.在一些实施方案中,药学上可接受的赋形剂可以为至少95%、至少96%、至少97%、至少98%、至少99%或100%的纯度。在一些实施方案中,赋形剂被批准用于人和兽医用途。在一些实施方案中,赋形剂可能得到美国食品及药物管理局(united states food and drug administration)批准。在一些实施方案中,赋形剂可能为药物级别。在一些实施方案中,赋形剂可能符合美国药典(the united states pharmacopoeia,usp)、欧洲药典(the european pharmacopoeia,ep)、英国药典(the british pharmacopoeia)和/或国际药典(the international pharmacopoeia)的标准。
152.如本文所使用的的赋形剂包括但不限于任何和所有溶剂、分散介质、稀释剂或其他液体媒介物、分散或悬浮助剂、表面活性剂、等渗剂、增稠剂或乳化剂、防腐剂等,适合于所期望的特定剂型。用于配制药物组合物的各种赋形剂和用于制备该组合物的技术是本领域已知的(参见remington:the science and practice of pharmacy,第21版,a.r.gennaro,lippincott,williams&wilkins,baltimore,md,2006;通过引用整体并入本文中)。常规赋形剂介质的使用可被考虑在本公开的范围内,除非任何常规赋形剂介质可能与物质或其衍生物不相容,如通过产生任何不期望的生物效应,或要不以有害方式与药物组合物的任何其他组分相互作用。
153.示例性的稀释剂包括但不限于碳酸钙、碳酸钠、磷酸钙、磷酸二钙、硫酸钙、磷酸氢钙、磷酸乳糖钠、蔗糖、纤维素、微晶纤维素、高岭土、甘露醇、山梨醇、肌醇、氯化钠、干淀粉、玉米淀粉、糖粉等,和/或以上的组合。d.非活性成分
154.在一些实施方案中,制剂可以包括至少一种非活性成分。如本文所使用的,术语“非活性成分”是指对包括在制剂中的药物组合物的活性成分的活性没有贡献的一种或多种试剂。在一些实施方案中,可用于本公开的制剂中的所有、没有或一些非活性成分可被美国食品和药物管理局(fda)批准。e.药学上可接受的盐
155.营养缺陷型因子可以以其药学上可接受的盐的形式施用。如本文所使用的,“药学上可接受的盐”是指所公开化合物的衍生物,使得母体化合物通过将现有酸或碱部分转化
为其盐形式(例如,通过使游离碱基团与合适的有机酸反应)而被修饰。药学上可接受的盐的实例包括但不限于:碱性残基(如胺)的矿物或有机酸盐;酸性残基(如羧酸)的碱金属盐或有机盐等。代表性的酸加成盐包括乙酸盐、乙酸、己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯磺酸、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、延胡索酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚糖酸盐、己酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂烷基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸酯、过硫酸盐、3-苯基丙酸酯盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐、十一烷酸盐、戊酸盐等。代表性的碱金属或碱土金属盐包括钠、锂、钾、钙、镁等,以及无毒的铵、季铵和胺阳离子,其包括但不限于铵、四甲基铵、四乙基铵、甲胺、二甲胺、三甲胺、三乙胺、乙胺等。本公开的药学上可接受的盐包括例如由无毒无机或有机酸形成的母体化合物的常规无毒盐。vi.给药和施用
156.包括在上述药物组合物中的本公开的修饰宿主细胞或营养缺陷型因子可以通过任何递送途径、系统性递送或局部递送施用,这导致治疗有效的结果。这些包括但不限于肠内(进入肠道内)、胃肠道、硬膜外(进入硬脑膜内)、口服(通过口腔的方式)、经皮、脑内(进入大脑内)、脑室内(进入脑室内)、表皮(施用到皮肤上)、皮内(进入皮肤本身内)、皮下(皮肤下)、经鼻施用(通过鼻子)、静脉内(进入静脉内)、静脉内团注、静脉滴注、动脉内(进入动脉内)、肌内(进入肌肉内)、心内(进入心脏内)、骨内输注(进入骨髓内)、鞘内(进入椎管内)、实质内(进入脑组织内)、腹膜内(输注或注射到腹膜内)、膀胱内输注、玻璃体内、(通过眼睛)、海绵窦内注射(进入病理腔内)、腔内(进入阴茎根部内)、阴道内施用、子宫内、羊膜外施用、透皮(通过完整皮肤扩散用于系统性分布)、跨粘膜(通过粘膜扩散)、经阴道、吹气(鼻吸)、舌下、唇下、灌肠、滴眼液(在结膜上)或以滴耳液、耳(在耳朵内或通过耳朵的方式)、口腔(针对脸颊)、结膜、皮肤、牙(至一颗或多颗牙齿)、电渗、颈管内、鼻窦内、气管内、体外、血液透析、浸润、间质、腹内、羊膜内、关节内、胆内、支气管内、囊内、软骨内(在软骨内)、尾部内(在马尾内)、脑池内(在小脑延髓池内)、角膜内(在角膜内)、牙冠内、冠状动脉内(在冠状动脉内)、冠状海绵体内(在阴茎海绵体的可膨胀空间内)、椎间盘内(在椎间盘内)、导管内(在腺管内)、十二指肠内(在十二指肠内)、硬膜内(在硬脑膜内或硬脑膜下方)、表皮内(至表皮)、食管内(至食道)、胃内(在胃内)、龈内(在牙龈内)、回肠内(在小肠的远端内)、病灶内(在局部病灶内或直接引入局部病灶)、管腔内(在管腔内)、淋巴内(在淋巴内)、髓内(在骨髓腔内)、脑膜内(在脑膜内)、心肌内(在心肌内)、眼内(在眼睛内)、卵巢内(在卵巢内)、心包内(在心包内)、胸膜内(在胸膜内)、前列腺内(在前列腺内)、肺内(在肺或其支气管内)、鼻内(在鼻窦或眶周窦内)、脊柱内(在脊柱内)、滑膜内(在关节的滑膜腔内)、腱内(在肌腱内)、睾丸内(在睾丸内)、鞘内(在任意水平脑脊髓轴处的脑脊液内)、胸腔内(在胸腔内)、小管内(在器官的小管内)、肿瘤内(在肿瘤内)、鼓室内(在耳中层内)、血管内(在一个或多个血管内)、心室内(在心室内)、离子电渗疗法(通过电流的方式,其中可溶性盐的离子迁移到身体组织中)、冲洗(以沐浴或冲洗开放的伤口或体腔)、喉(直接在喉部上)、鼻胃(通过鼻子并进入胃内)、封闭敷裹技术(局部途径施用,然后通过阻塞该区域的敷料将其覆
盖)、眼科(到外眼)、口咽(直接到口腔和咽部)、肠胃外、经皮、关节周围、硬膜外、神经周围、牙周、直肠、呼吸(对于局部或全身效应,通过经口或经鼻吸入在呼吸道内)、球后(脑桥后或眼球后)、软组织、蛛网膜下、结膜下、粘膜下、局部、经胎盘(通过或穿过胎盘)、经气管(通过气管壁)、经鼓膜(穿过或通过鼓腔)、输尿管(至输尿管)、尿道(至尿道)、阴道、尾端阻滞、诊断、神经阻滞、胆道灌注、心脏灌注、光分离术和脊椎。a.肠胃外和可注射施用
157.在一些实施方案中,经修饰的宿主细胞可肠胃外施用。
158.可注射制剂,例如无菌可注射水性或油性混悬液,可根据已知技术使用合适的分散剂、润湿剂和/或悬浮剂配制。无菌注射制剂可以是在无毒肠胃外可接受的稀释剂和/或溶剂中的无菌注射溶液、混悬液和/或乳剂,例如,作为在1,3-丁二醇中的溶液。可以使用的可接受的媒介物和溶剂包括水、林格氏溶液、u.s.p.和等渗氯化钠溶液。无菌的固定油通常用作溶剂或悬浮介质。为此目的,可以采用任何温和的固定油,包括合成的甘油单酯或甘油二酯。脂肪酸(如油酸)可被用于制备注射剂。
159.注射制剂可以被灭菌,例如,通过细菌截留过滤器过滤,和/或通过掺入无菌固体组合物形式的灭菌剂,该固体组合物可以在使用前溶解或分散在无菌水或其他无菌可注射介质中。
160.为了延长活性成分的作用,通常需要减缓来自皮下或肌内注射的活性成分的吸收。这可以通过使用水溶性差的结晶或无定形物质的液体混悬液来实现。活性成分的吸收速率取决于溶解速率,而溶解速率又可能取决于晶体大小和晶型。可替代地,肠胃外施用的药物形式的延迟吸收是通过将药物溶解或悬浮在油性媒介物中来实现的。可注射贮库形式是通过在生物可降解聚合物(如聚丙交酯-聚乙交酯)中形成药物的微囊基质而制成的。根据药物与聚合物的比例以及所采用的特定聚合物的性质,可以控制药物释放的速率。其他生物可降解聚合物的实例包括聚(原酸酯)和聚(酸酐)。贮库注射制剂是通过将药物包裹在与身体组织相容的脂质体或微乳液中来制备的。b.贮库施用
161.如本文所述的,在一些实施方案中,将包括本公开的经修饰的宿主细胞的药物组合物配制在用于延长释放的贮库中。通常,特定器官或组织(“靶组织”)被靶向施用。在一些实施方案中,局部释放经由利用生物相容装置而受到影响。例如,生物相容性装置可以限制细胞系在对象中的扩散。
162.在本文公开的一些方面,包括本公开的经修饰的宿主细胞的药物组合物在空间上保留在靶组织内或接近靶组织。提供了通过使靶组织(其包括一个或多个靶细胞)与包括经修饰的宿主细胞或营养缺陷型因子的药物组合物接触,来向哺乳动物对象的靶组织提供包括经修饰的宿主细胞或营养缺陷型因子的药物组合物的方法,在这样的条件下进行,其使得它们被大量保留在靶组织中,意指至少10%、20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、96%、97%、98%、99%、99.9%、99.99%或超过99.99%的组合物保留在靶组织中。例如,在施用后一段时间存在至少1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、96%、97%、98%、99%、99.9%、99.99%或超过99.99%的向对象施用的包括经修饰的宿主细胞或营养缺陷型因子的药物组合物。
163.本公开的某些方面涉及通过在使得它们被大量保留在此类靶组织中的条件下,使
靶组织与包括经修饰的宿主细胞的药物组合物接触,向哺乳动物对象的靶组织提供包括本公开的经修饰的宿主细胞或营养缺陷型因子的药物组合物的方法。包括经修饰的宿主细胞的药物组合物包括足够的活性成分,使得在至少一个靶细胞中产生目标效应。在一些实施方案中,包括经修饰的宿主细胞的药物组合物通常包括一种或多种细胞渗透剂,尽管也考虑“裸”制剂(如不含细胞渗透剂或其他试剂),其具有或不具有药学上可接受的赋形剂。c.治疗方法
164.本公开另外提供了将包括为药物组合物或制剂的一部分的任何上述经修饰的宿主细胞或营养缺陷型因子,递送至对象(包括哺乳动物对象)的方法。d.剂量和方案
165.本公开提供了根据本公开内容向有需要的对象施用经修饰的宿主细胞或营养缺陷型因子的方法。可以使用有效预防、治疗、管理或诊断疾病、病症和/或病况的任意量和任何施用途径,向对象施用包括经修饰的宿主细胞或营养缺陷型因子的药物组合物,以及本公开的组合物。所需的确切量因对象而异,取决于对象的物种、年龄和一般状况、疾病的严重程度、特定组合物、其施用方式、其活性方式等。对象可以是人、哺乳动物或动物。任何特定个体的特定治疗有效、预防有效或适当的诊断剂量水平将取决于多种因素,包括所治疗的病症和病症的严重程度;所采用的特定有效载荷的活性;采用的具体组合物;患者的年龄、体重、一般健康状况、性别和饮食;营养缺陷型因子的施用时间、施用途径和排泄率;治疗的持续时间;与所采用的特定经修饰的宿主细胞或营养缺陷型因子联合使用或同时使用的药物;以及医学领域众所周知的类似因素。
166.在某些实施方案中,可以以足以递送以下剂量的的剂量水平,一天一次或多次给予施用根据本公开的修饰的经修饰的宿主细胞或营养缺陷型因子药物组合物以获得所需的治疗、诊断或预后效果:每天约0.0001mg/kg对象体重至约100mg/kg对象体重、约0.001mg/kg对象体重至约0.05mg/kg对象体重、约0.005mg/kg对象体重至约0.05mg/kg对象体重、约0.001mg/kg对象体重至约0.005mg/kg对象体重、约0.05mg/kg对象体重至约0.5mg/kg对象体重、约0.01mg/kg对象体重至约50mg/kg对象体重、约0.1mg/kg对象体重至约40mg/kg对象体重、约0.5mg/kg对象体重至约30mg/kg对象体重、约0.01mg/kg对象体重至约10mg/kg对象体重、约0.1mg/kg对象体重至约10mg/kg对象体重或约1mg/kg对象体重至约25mg/kg对象体重。
167.在某些实施方案中,可以以约10至约600μl/部位、50至约500μl/部位、100至约400μl/部位、120至约300μl/部位、140至约200μl/部位、约160μl/部位,施用根据本公开的经修饰的宿主细胞或营养缺陷型因子药物组合物。作为非限制性实例,可以以50μl/部位和/或150μl/部位施用经修饰的宿主细胞或营养缺陷型因子。
168.本公开的经修饰的宿主细胞或营养缺陷型因子的所期望剂量可以为仅递送一次、每天三次、每天两次、每天一次、每隔一天、每三天、每周、每两周、每三周或每四周。在某些实施方案中,可以使用多次施用(例如,两次、三次、四次、五次、六次、七次、八次、九次、十次、十一次、十二次、十三次、十四次或更多次施用)递送所期望的剂量。
169.可以一次或多次施用所期望剂量的本公开的经修饰的宿主细胞。营养缺陷型因子在一段时间内以设定频率定期施用,或作为“连续流”持续施用。总日剂量,即在24小时内给予或规定的量,可以通过这些方法中的任何一种或作为这些方法的组合来施用。
170.在一些实施方案中,将本公开的经修饰的宿主细胞或营养缺陷型因子递送至对象提供以下时间的治疗效应:至少1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、20个月、21个月、22个月、23个月、2年、3年、4年、5年、6年、7年、8年、9年、10年或多于10年。
171.经修饰的宿主细胞可以与一种或多种其他治疗剂、预防剂、研究或诊断剂或医学程序顺序或同时组合使用。一般而言,每种试剂将以针对该试剂确定的剂量和/或时间表施用。在一些实施方案中,本公开涵盖药物、预防、研究或诊断组合物与可提高其生物利用度、减少和/或改变其代谢、抑制其排泄和/或改变其在体内的分布的试剂组合的递送。
172.例如,经修饰的宿主细胞或营养缺陷型因子作为生物相容性装置施用,其限制在对象中的扩散以增加靶向治疗区域中的生物利用度。经修饰的宿主细胞或营养缺陷型因子也可以通过局部递送来施用。
173.本文的公开内容涵盖在对象中表达治疗因子的方法,其包括:(a)施用所述经修饰的细胞,(b)任选地施用条件化方案以允许移植经修饰的细胞,和(c)施用所述营养缺陷型因子。vii.治疗应用
174.本文所述的营养缺陷型细胞和/或营养缺陷型因子至对象的剂量和施用可被用于治疗或减轻对象的一种或多种疾病病况。
175.一般而言,工程化的营养缺陷型t细胞可被用作car t细胞以充当活药物并与营养缺陷型因子一起施用于对象,以使对象条件化以进行造血干细胞移植。在递送供体造血干细胞之前,可能会去除营养缺陷型因子,从而消除工程化的营养缺陷型t细胞。
176.在一些实施方案中,细胞系是遗传工程化为营养缺陷型的同种异体t细胞。工程化的营养缺陷型同种异体t细胞可以与营养缺陷型因子一起施用于对象以提供治疗效果。
177.在对象发展成移植物抗宿主病(gvhd)时,可以去除营养缺陷型因子,这导致已变成同种异体反应性的工程化的营养缺陷型同种异体t细胞的消除。
178.在一些实施方案中,定期持续施用营养缺陷型因子足以表达治疗因子的一段时间,并且优选地足够治疗因子发挥治疗效应的一段时间。在一些实施方案中,施用营养缺陷型因子减少,以降低治疗因子的表达。在一些实施方案中,施用营养缺陷型因子增加,以增加治疗因子的表达。在一些实施方案中,施用营养缺陷型因子被中止,以产生导致经修饰的细胞生长抑制或死亡的条件。在一些实施方案中,施用营养缺陷型因子被暂时中断,以产生导致经修饰的细胞生长抑制的条件。
179.本文的公开内容还还涵盖治疗患疾病、病症或病况的对象的方法,其包括以足以产生治疗量的治疗因子表达的量向对象施用:(a)本公开的经修饰的哺乳动物宿主细胞,和(b)营养缺陷型因子。
180.本公开还涵盖根据本公开的经修饰的哺乳动物宿主细胞用于治疗疾病、病症或病况的用途。
181.某些实施方案提供了选自以下的疾病、病症或病况:癌症、帕金森病、移植物抗宿主病(gvhd)、自身免疫性病况、过度增生性病症或病况、恶性转化、肝脏病况、遗传性病况(包括遗传性遗传缺陷)、青少年发病型糖尿病和眼室病况。
182.在某些实施方案中,疾病、病症或病况影响选自以下的至少一种身体系统:肌肉系统、骨骼系统、循环系统、神经系统、淋巴系统、呼吸系统、内分泌系统、消化系统、排泄系统和生殖系统。可以用多于一种的经修饰的宿主细胞治疗影响对象中多于一种的细胞类型的病况,每种细胞系由不同的营养缺陷型因子激活。在一些情况下,可以向对象施用多于一种营养缺陷型因子。
183.某些实施方案提供可再生的细胞系。在本公开的一个方面,对象可以与不止一种经修饰的宿主细胞和/或一种或多种营养缺陷型因子接触。某些实施方案提供了营养缺陷型因子(例如营养物或酶)的定位释放。可替代实施方案提供了系统性递送。例如,定位释放会通过使用生物相容装置而受到影响。在本公开的一个方面,生物相容性装置可以限制细胞系在对象中的扩散。该方法的某些实施方案提供了去除营养缺陷型因子以在对象中消耗经修饰的宿主细胞的治疗效果或在经修饰的宿主细胞中诱导细胞死亡。该方法的某些实施方案提供的治疗效果包括选自以下中的至少一种:分子运输、诱导细胞死亡和募集另外的细胞。该方法的某些实施方案规定,未经修饰的宿主细胞来源于在用经修饰的宿主细胞治疗对象之前的同一对象。
184.本公开涵盖包含此类组合物或此类组合物的组分的试剂盒,任选地带有容器或小瓶。
185.下文进一步详述了本文所述的营养缺陷型细胞和/或营养缺陷型因子的具体应用。a.自身免疫性病况
186.根据本说明书的营养缺陷型细胞可被用于治疗自身免疫性病况。在一些实施方案中,根据本说明书的营养缺陷型细胞可被用于治疗涉及b细胞介导的自身免疫的自身免疫病况,器包括但不限于类风湿性关节炎、多发性硬化症、i型糖尿病、桥本氏病和系统性红斑狼疮(“狼疮”)等病况。例如,已经表明,表达嵌合抗原受体的工程化的t细胞(即car t细胞)可有效作为自身免疫性病况的治疗选择。例如,kansal等人报告说,cd19靶向的car t细胞可以持续消耗自身反应性b细胞,消除自身抗体,并改善狼疮鼠类模型中的疾病症状(kansal,rita等人,“sustained b cell depletion by cd19-targeted car t cells is a highly effective treatment for murine lupus.”science translational medicine 11.482(2019):eaav1648;还参见clark,rachael a."slamming the brakes on lupus with car t cells."science immunology 4.34(2019):eaax3916;二者均通过引用整体并入本文中)。
187.因此,营养缺陷型细胞可被工程化为表达car(例如抗cd19 car)以靶向b细胞来治疗自身免疫性病况。在一些实施方案中,修饰为本文所述的营养缺陷型因子营养缺陷型的car t细胞可被用于耗尽患自身免疫性病况对象的自身反应性b细胞。在一些实施方案中,修饰为本文所述的营养缺陷型因子营养缺陷型的car t细胞可被用于消除患自身免疫性病况对象的自身抗体。在一些实施方案中,修饰为本文所述的营养缺陷型因子营养缺陷型的car t细胞可被用于消除患自身免疫性病况对象中的疾病症状。
188.施用于患自身免疫性病况对象的营养缺陷型car t细胞可靶向对象的b细胞(例如,使用抗cd19 car的cd19阳性b细胞),并从而耗尽自身反应性b细胞,消除自身抗体,和/或消除对象的疾病症状。在一些实施方案中,仅在对象共同施用支撑营养缺陷型细胞功能
(包括生长、存活和/或增殖)的营养缺陷型因子时,营养缺陷型细胞才增殖和有效靶向对象中的b细胞。因此,可连同营养缺陷型因子一起向患自身免疫性病况(如狼疮)的对象施用营养缺陷型cd19-靶向car t细胞。营养缺陷型cd19-靶向car t细胞将耗尽对象的自身反应性b细胞,消除对象中的自身抗体,和/或消除对象中的疾病症状。当自身免疫性症状被控制、减轻或克制时,可停止营养缺陷型因子施用,提供可靠的关闭开关,其允许在治疗自身免疫性病况后恢复b细胞。因此,在一些实施方案中,在自身免疫性病况发生期间施用营养缺陷型因子,并且在发作被改善或减缓后停用营养缺陷型因子。
189.例如,可根据本说明书产生umps敲除cd19 car t细胞。可将umps敲除cd19 car t细胞施用于患自身免疫性病况的对象。在一些实施方案中,自身免疫性病况是狼疮,并且umps敲除cd19 car t细胞与尿苷一起共同施用于对象。在对象中存在尿苷的情况下,umps敲除cd19 car t细胞靶向b细胞以治疗自身免疫性病况(例如狼疮)。可经由饮食或其他合适的递送途径向对象施用营养缺陷型因子。营养缺陷型因子可被停用以挽救由cd19 car t细胞引起的b细胞发育不全。在一些实施方案中,当自身免疫性病况的症状或生理标志物指示对象中病况的自身免疫性发作时,经由饮食向对象施用营养缺陷型因子(例如,尿苷)。在一些实施方案中,一旦自身免疫性病况的症状或生理标志物指示自身免疫性发作已减轻、克制、控制或消除时,即从对象饮食中停用营养缺陷型因子(例如,尿苷)。b.条件化方案
190.术语“条件化方案(conditioning regime)”或“条件化方案(conditioning regimen)”是指对象在干细胞移植之前经历的治疗过程。例如,在造血干细胞移植之前,对象可以接受清髓疗法、非清髓疗法或降低强度条件化以防止干细胞移植的排斥反应,即使干细胞源自同一对象。条件化方案可涉及施用细胞毒性剂。条件化方案还可以包括免疫抑制、抗体和辐射。其他可能的条件化方案包括抗体介导的条件化(参见例如,czechowicz等人,318(5854)science 1296-9(2007);palchaudari等人,34(7)nature biotechnology 738-745(2016);chhabra等人,10:8(351)science translational medicine 351ra105(2016)),以及car t介导的调节(参见例如,arai等人,26(5)molecular therapy 1181-1197(2018);其中每项均在此通过引用整体并入本文中)。例如,需要使用条件化来在大脑中为源自工程化的造血干细胞(hsc)的小胶质细胞创造空间,以便迁移以递送目标蛋白质(如最近的ald和mld基因治疗试验)。条件化方案还旨在产生生态位“空间”,以允许移植的细胞在体内有一个位置进行移植和增殖。例如,在hsc移植中,条件化方案在骨髓中产生了供移植的hsc植入的生态位空间。如果没有条件化方案,移植的hsc就无法移植。在一些实施方案中,细胞系是被遗传工程化为营养缺陷型的t细胞。
191.因此,在一些实施方案中,工程化为表达car的营养缺陷型t细胞(即,营养缺陷型car t细胞)可被用于条件化方案中。例如,靶向cd34(即,表达cd34特异性的car)或靶向另一hsc相关标志物的营养缺陷型car t细胞可连同营养缺陷型因子一起施用于对象,以耗尽对象中的hsc。营养缺陷型car t细胞从而促进移植到对象中的治疗细胞的植入,并提高细胞治疗的功效。在干细胞耗尽和/或充分调节对象后,营养缺陷型因子可被停用,导致hsc正常化和/或移植的hsc在对象中的植入。viii.定义
192.与数值x相关的术语“约”意指例如x 10%。
193.术语“活性成分”通常是指组合物中参与发挥治疗作用的成分。如本文所使用的,它通常指(a)包括本文所述转基因的经修饰的宿主细胞或供体模板,(b)本文所述相应的营养缺陷型因子,或(c)用于在营养缺陷诱导型基因座内靶向切割的核酸酶系统。
194.如本文所使用的,术语“改变的浓度”是指与施用本文所述的药物组合物之前对象中营养缺陷型因子的浓度相比,营养缺陷型因子的浓度增加。
195.如本文所使用的,术语“改变的ph”是指与施用本文所述的药物组合物之前对象中的ph相比,在对象中诱导的ph变化。
196.如本文所使用的,术语“改变的温度”是指与施用本文所述的药物组合物之前对象中的温度相比,在对象中诱导的温度变化。
197.如本文所使用的,术语“营养缺陷型”或“营养缺陷的”是指需要外源施用营养缺陷型因子以维持细胞生长和繁殖的细胞状况。
198.如本文所使用的,术语“营养缺陷诱导型基因座”是指细胞中染色体的区域,当其被破坏时,会导致细胞成为营养缺陷型的。例如,可以通过破坏编码参与营养缺陷型因子合成、再循环或补救的酶的基因(通过合成用于产生营养缺陷型因子的中间体直接或上游),或通过破坏调控基因表达的表达控制序列,来使细胞变成营养缺陷型。
199.如本文所使用的,术语“生物利用度”是指施用于对象给定量的经修饰的宿主细胞或营养缺陷型因子的系统性利用度。
200.如本文所使用的,术语“cas9”是指crispr相关蛋白9,其是用于基因组编辑的核酸内切酶。
201.术语“包含(comprising)”意指“包括(including)”以及“组成(consisting)”,例如“包含(comprising)”x的组合物可仅由x组成,或可包括一些另外的组分,例如x y。
202.术语“条件化方案”是指对象在干细胞移植之前经历的治疗过程。
203.如本文所使用的,术语“连续流动”是指以单一途径/单一接触点连续施用一段时间的治疗剂量,即连续施用事件。
204.如本文所使用的,术语“crispr”是指dna的成簇的规则间隔的短回文重复序列,其部署了切割入侵细胞的rna核苷酸的酶。
205.如本文所使用的,术语“crispr/cas9核酸酶系统”是指一种基因工程工具,其包括具有cas9结合位点的向导rna(grna)序列和特异性针对靶dna中待切割位点的靶向序列。cas9与grna结合形成核糖核蛋白复合物,该复合物结合并切割靶位点。
206.当在细胞的上下文中使用时,术语“扩增”是指通过后代的产生增加细胞的数量。
207.术语“表达控制序列”是指能够调控或控制目标核苷酸序列表达的核苷酸序列。实例包括启动子、增强子、转录因子结合位点、mirna结合位点。
208.与细胞结合使用的术语“发挥功能”是指细胞进行正常代谢过程的能力。例如,营养缺陷型细胞仅在营养缺陷型因子存在的情况下才能“发挥功能”,这意味着营养缺陷型细胞需要营养缺陷型因子用于例如体内、体外和/或离体活力、生长、增殖和/或存活。
209.术语“同源重组”(hr)是指在经由同源定向修复机制修复dna断裂期间插入核苷酸序列。该过程使用与断裂区域中的核苷酸序列同源的“供体”分子或“供体模板”作为修复断裂的模板。插入的核苷酸序列可以是基因组中的单个碱基变化或dna大序列的插入。
210.术语“同源的”或“同源性”,当在两个或多个核苷酸序列的上下文中使用时,是指
足以在生理条件下将细胞中的两个核苷酸序列特异性结合在一起的碱基配对或杂交的程度。同源性也可以通过计算将与互补序列进行watson-crick碱基配对的核苷酸的百分比来描述,例如在指定数量的碱基上至少70%同一性,优选至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性。例如,对于供体模板,同源性可以超过200-400个碱基。例如,对于向导序列,同源性可以超过15-20个碱基。
211.术语“可操作地连接”是指核酸表达控制序列(如启动子、增强子、信号序列或转录因子结合位点阵列)和第二核酸序列之间的功能性连接,其中表达控制序列影响第二核酸序列的转录和/或翻译。
212.如本文所使用的,术语“药物组合物”是指包括至少一种活性成分和任选地一种或多种药学上可接受的赋形剂的组合物。
213.如本文所使用的,术语“药学上可接受的盐”是指所公开化合物的衍生物,使得母体化合物通过将现有酸或碱部分转化为其盐形式(例如,通过使游离碱基团与合适的有机酸反应)而被修饰。本文所有提及的化合物或组分都包括其药学上可接受的盐。
214.如本文所使用的,术语“再生的”是指对象的器官或系统的更新或恢复。
215.术语“治疗因子”是指由插入的转基因编码的产物,其治疗和/或减轻对象的疾病、病症或病况的症状。
216.术语“治疗量”是指足以发挥“治疗效果”的治疗因子的量,所述治疗效果意指疾病、病症或病况的症状的减轻或改善。
217.如本文所使用的,术语“单位剂量”是指离散量的药物组合物,其包括预定量的活性成分。
实施例
实施例1.通用t细胞培养方法
218.将k562细胞(从atcc获得)和nalm6细胞(由c.mackall友情提供)在补充有10%牛生长血清、2mm l-谷氨酰胺和100u/ml青霉素和100u/ml链霉素的rpmi 1640(hyclone)中培养。在将从健康供体获得的血沉棕黄层分离后新鲜使用t细胞。通过聚蔗糖密度梯度离心分离t细胞,然后使用泛t细胞分离试剂盒(miltenyi biotec)进行磁性富集。
219.细胞被冷冻保存在bambanker
tm
培养基中。解冻后,在37℃、5%co2下,于补充有或没有5%人血清(sigma-aldrich)和100人重组il-2(peprotech)和10ng/ml人重组il-7(bd biosciences)的x-vivo 15(lonza)中培养细胞。加入250μg/ml的ump或尿苷。添加100μg/ml至1mg/ml的5-foa。在培养过程中,每2天更换一次培养基。
220.使用固定化的抗cd3(克隆okt3,tonbo biosciences)和溶解的抗cd28(克隆cd28.2,tonbo biosciences)将t细胞激活3天,然后进行电穿孔。
221.将140万个激活的t细胞重悬于电穿孔溶液中,与预复合的rnp混合,并使用4d-nucleofector
tm
系统(lonza),使用程序eo-115进行电穿孔。rnp由300μg/ml的cas9蛋白质(基于化脓性链球菌的crispr/cas9系统,idt)和sgrna组成,使用2.5摩尔比的sgrna:cas9。
222.使用quickextract
tm
dna提取试剂盒(epicentre)收获基因组dna。使用台盼蓝染色在自动细胞计数器上,或在带有自动读板器cytoflex流式细胞仪(beckman coulter)上,使
用countbright
tm
珠(thermofisher)作为标准化值的参考,来对细胞进行计数。可替代地,在也测量体积的accuri
tm
c6流式细胞仪(bd biosciences)或facs aria
tm
ii sorp细胞分选仪(bd biosciences)上,用荧光染料标记的抗体(biolegend)染色后,对细胞进行分析。使用excel(microsoft)和flowjo软件(tree star)分析数据。
223.umps基因座的sanger测序使用umps-o-1和umps-o-2进行,使用phusion
tm
热启动flex 2
×
反应混合物(new england biolabs,inc.)扩增区域。通过tide分析(参见brinkman等人,2014,nucleic acids res.42(22):e168),其在此通过引用整体并入本文中)分析sanger测序痕迹,以鉴定编辑后的插入和缺失(插入缺失)。使用tide在线工具(www.deskgen.com/landing/tide.html)对序列进行插入缺失量化(参见,m.sadelain,n.engl.j.med.365,1735
–
7(2011),其在此通过引用整体并入本文中。
224.grna序列(包括前间隔区相邻基序,也称为pam):
225.umps-7
226.gcc ccg cag auc gau gua gag uuu uag agc uag aaa uag caa guu aaa aua agg cua guc cgu uau caa cuu gaa aaa gug gca ccg agu cgg ugc uuu u(seq id no:1)
227.用于umps基因座tide分析的测序寡核苷酸:
228.umps-o-1:cccggggaaacccacgggtgc(seq id no:2)
229.umps-o-2:agggtcggtctgcctgcttggct(seq id no:3)
230.在初步筛选之后,选择显示出最高频率的插入缺失的sgrna“umps-7”,用于进一步分析,实施例2.通过人t细胞中的cas9-sgrna电穿孔编辑umps
231.将t细胞解冻并培养,然后活化并随后用如上所述的cas9-umps-7sgrna rnp进行电穿孔。电穿孔后,允许细胞在含有或不含血清、5-foa或外源尿嘧啶源的培养基中恢复(图1a)。当培养基中包括血清时,电穿孔后的细胞存活率显著增加(图1b),并因此在所有后续实验中进行了在含有血清、尿苷和ump的培养基中的四天恢复期。电穿孔后的细胞计数显示在表4中。表4.细胞计数实施例3.混合的umps编辑群体的生长和umps突变的维持
232.如实施例2那样对t细胞进行电穿孔和编辑,并允许其在含有血清、尿苷和ump的培养基中恢复4天时间。在第4天,将细胞转移到ump、尿苷或尿嘧啶源培养基中。该实验特征没有选择步骤,并因此产生的细胞群是野生型(wt)、杂合突变体和纯合突变体细胞的异质混合物。观察到纯合umps突变细胞的生长依赖于外源性尿嘧啶来源
–
因为这些应该是营养缺
陷的(图2a)。当靶向umps时,观察到在约50%的细胞中产生了插入缺失(如通过tide分析测定的(参见,brinkman等人,2014,nucleic acids res.42(22):e168),其在此通过引用整体并入本文中)。
233.当去除外源尿嘧啶源时,生长三天后群体中的插入缺失频率降低(第7天=恢复四天,以及在测试培养基中三天)。这与以下模型一致,其表明任何纯合营养缺陷型umps突变细胞在群体中将被非营养缺陷型杂合突变体超过,并且编辑后仍然存在wt细胞
–
导致表观插入缺失频率降低(参见图2b)。具有插入缺失的等位基因百分比显示在表5中。表5.具有插入缺失的等位基因条件等位基因百分比(无5-foa)无代谢物57.9有ump71.1有尿苷77.0
234.观察到异质umps编辑群体的最佳生长取决于外源尿嘧啶来源的存在(图2c-图2f)。具有移码插入缺失的等位基因的百分比显示在图2c中,并且值显示在表6中。表6.具有移码插入缺失的等位基因 等位基因百分比(无5-foa)无代谢物14.3有ump46.1有尿苷52.5
235.图2d比较了在第8天包含通过tide鉴定的等位基因的细胞的预测绝对数。值显示在表7中。表7.预测的活细胞计数
236.图2e显示了有/无ump的细胞计数的时程(8天)。值显示在表8中。表8.细胞密度[细胞/ml]
处理代谢物第0天第1天第2天第4天第6天第8天模拟物无代谢物5.00e 059.67e 052.35e 063.44e 064.15e 063.71e 06ccr5敲除无代谢物5.00e 058.35e 052.29e 063.42e 063.90e 063.91e 06umps敲除无代谢物5.00e 058.08e 051.59e 062.51e 062.21e 062.55e 06模拟物有ump5.00e 059.83e 052.01e 063.80e 064.18e 063.90e 06ccr5敲除有ump5.00e 051.02e 061.80e 063.32e 063.80e 064.03e 06umps敲除有ump5.00e 058.74e 051.86e 063.47e 063.88e 063.63e 06
[0237]
图2f显示了有/无尿苷的细胞计数的时程(8天)。值显示在表9中。表9.细胞密度[细胞/ml]
处理代谢物第0天第1天第2天第4天第6天第8天
模拟物无代谢物5.00e 059.67e 052.35e 063.44e 064.15e 063.71e 06ccr5敲除无代谢物5.00e 058.35e 052.29e 063.42e 063.90e 063.91e 06umps敲除无代谢物5.00e 058.08e 051.59e 062.51e 062.21e 062.55e 06模拟物有尿苷5.00e 059.78e 051.98e 063.90e 064.91e 064.09e 06ccr5敲除有尿苷5.00e 059.67e 051.71e 063.70e 063.92e 063.96e 06umps敲除有尿苷5.00e 057.69e 051.59e 063.43e 063.79e 063.17e 06
[0238]
ump和尿苷使umps编辑培养物的生长恢复到与模拟物编辑细胞相同的水平。这种对生长的拯救依赖于umps编辑,并且在用外源尿嘧啶源处理的模拟物细胞中看不到,表明编辑后的umps使人类t细胞特别依赖于补充尿嘧啶以获得最佳细胞生长。
[0239]
值得重申的是,umps编辑的群体包含未编辑的或杂合的细胞,这些细胞预计不会是营养缺陷型的,并因此不期望umps编辑细胞在缺乏尿嘧啶的培养基中完全不生长。实施例4. 5-foa处理选择umps靶向的细胞
[0240]
5-foa选择其他生物体中的尿嘧啶营养缺陷型细胞(例如boeke等人,1984,mol.gen.genet.197(2):345-6),其在此通过引用整体并入本文中)。为了研究5-foa在人类细胞中选择尿嘧啶营养缺陷型的潜在效用,通过cas9-grna复合物电穿孔,然后恢复(如实施例2中所示),然后进行对5-foa处理的抗性测定,在人t细胞中靶向umps基因(图3a)。在进行细胞计数之前,细胞在5-foa和多种血清和尿嘧啶源的组合中生长4天。
[0241]
表10比较了在有或没有血清的情况下培养的细胞群的细胞计数。表10.细胞计数
[0242]
血清虽然对电穿孔后细胞的恢复很重要,但对细胞在5-foa中的存活率没有影响(图3b)。在不含血清的5-foa中生长的另外样品的细胞计数显示在图3c和表11中。表11.细胞计数
[0243]
与对照相比,尿苷和ump提高了5-foa中模拟处理的和umps靶向细胞的存活率。这可能是通过基于竞争的机制(尿苷可以逆转人类的5-氟尿嘧啶毒性(参见,van groeningen等人,1992,semin.oncol.19(2suppl 3):148-54,其在此通过引用整体并入本文中))(图3b和图3c)。在所有情况下,与模拟物靶向的细胞相比,umps靶向的细胞表现出增加的存活率。该数据表明5-foa可被用于选择人类细胞培养物中的尿嘧啶营养缺陷型细胞。实施例5. 5-foa选择的umps靶向的细胞表现出尿嘧啶营养缺陷型
[0244]
如实施例4中所示,为了测定通过5-foa处理选择的细胞是否为尿嘧啶营养缺陷
型,将模拟物或umps靶向的t细胞暴露于5-foa。在5-foa选择4天后,细胞群被分到含有尿嘧啶的培养基(ump、尿苷或两者)和缺乏尿嘧啶的培养基中。随后在测试培养基中孵育4天后(第8天)通过细胞计数进行生长测定(图4a)。在所有情况下,模拟物靶向的细胞培养物中的细胞生长可以忽略不计,并且与尿嘧啶源补充无关
–
表明在5-foa选择步骤期间成功杀死了非umps靶向的细胞(图4b-图4d)。在umps靶向的群体中,在所有条件下,细胞生长都通过添加尿嘧啶来刺激,并且在没有尿嘧啶时观察到细胞生长不良(图4b-图4d)。
[0245]
图4b比较了第8天培养物中不含血清的样品的细胞计数。值显示在表12中。表12.第8天的细胞计数
[0246]
图4c比较了补充有ump和没有血清的培养物中的细胞计数。值显示在表13中。表13.第8天的细胞计数
[0247]
图4d比较了补充有尿苷和不含血清的培养物中的细胞计数。值显示在表14中。表14.第8天的细胞计数
[0248]
综上所述,实施例1-5的结果表明,通过cas9在人t细胞中编辑umps基因座产生依赖于外源尿嘧啶源以获得最佳细胞生长的细胞。这些结果表明,工程化的人类营养缺陷型可以被用作控制t细胞增殖或一些其他细胞疗法的机制。此外,umps编辑细胞的5-foa选择为选择真正的营养缺陷型t细胞群提供了有用的机制。实施例6.培养干细胞
[0249]
为了评估具有潜在治疗相关性的另一种细胞类型,在人多能细胞中工程化了umps。作为本文公开内容的主题的经修饰的宿主细胞可包括使用以下如u.s.8,945,862中所示的技术维持和分化的干细胞,该专利在此通过引用整体并入本文中。
[0250]
在灭活的小鼠胚胎成纤维细胞(mef)饲养层(stem cells,2007.25(2):p.392-401,其在此通过引用整体并入本文中)上培养未分化的hesc(来自的h9系,35-45代)。简而言之,将细胞在0.1%明胶包被板上的辐照低传代mef饲养层上保持在未分化阶段。每天更换培养基。该培养基由dulbecco改良eagle培养基(dmem)/f-12、20%敲除血清替代物、0.1mm非必需氨基酸、2mm l-谷氨酰胺、0.1mmβ-巯基乙醇和4ng/ml rhfgf-2(r&d systems inc.,minneapolis)组成。将未分化的hesc在dmem/f12中用1mg/ml iv型胶原酶处理,并在传代当天机械刮除。在分化之前,将hesc接种到按如下从mef制备的条件培养基(cm)中的蛋白质混合物(corning,inc.)包被的板上(nat biotechnol,
2001.19(10):p.971-4,其在此通过引用整体并入本文中)。收获mef细胞并用50gy辐照,并用不含碱性成纤维细胞生长因子(bfgf)的hes培养基培养。每天收集cm并在饲喂hes细胞之前补充额外的4ng/ml bfgf。实施例7.人胚胎干细胞(esc)-内皮细胞(ec)的体外分化
[0251]
如先前所述的,为了诱导hesc分化,将未分化的hesc在含有iscove改良dulbecco培养基(imdm)和15%特定胎牛血清(fbs)(hyclone,logan,utah)、0.1mm非必需氨基酸、2mm l-谷氨酰胺、450μm硫代甘油(sigma,st.louis,mo.)、50u/ml青霉素和50μg/ml链霉素的分化培养基中培养,均在超低附着板中,用于形成悬浮的胚状体(eb)(参见,proc natl acad sci usa,2002.99(7):p.4391-6和stem cells,2007.25(2):p.392-401;其中每项均在此通过引用整体并入本文中)。简而言之,在37℃下,通过2mg/ml分散酶(invitrogen,carlsbad,calif.),将利用条件化培养基在蛋白混合物(corning,inc.)包被的板上培养基的hesc处理15分钟,以松弛细胞群。然后将细胞群刮掉并转移到超低附着板(corning incorporated,corning,n.y.)中以形成胚状体。实施例8.营养缺陷型经修饰的宿主细胞的选择
[0252]
如通过基因组基因座的扩增和sanger测序所评估的,通过cas9 rnp的电穿孔和选择在外显子1中具有插入缺失的克隆来破坏hesc中的umps基因座。对于基因编辑,在电穿孔前用10μm rock抑制剂(y-27632)处理hesc 24小时。用溶液(life technologies)收获70%-80%汇合的细胞。每个反应使用500,000个细胞,spcas9浓度为150μg/ml(integrated dna technologies),且cas9:sgrna摩尔比为1:3,并在p3原代细胞溶液(lonza)中,于4d nucleofector系统(lonza)中的16孔nucleocuvette
tm
条中进行电穿孔。电穿孔后立即将细胞转移到蛋白质混合物(corning,inc.)包被的24孔板的一个孔中,该24孔板含有500μl mtesr
tm
培养基(stemcell technologies)和10μm y-27632。编辑后24小时更换培养基,并在48小时后移除y-27632。
[0253]
sanger测序比较了编辑前的hesc群、rnp电穿孔后的大量群体和所选克隆的基因型。结果显示在sgrna靶区域周围有10bp的缺失。该区域中缺乏序列痕迹表明两个等位基因都已被修饰。
[0254]
用不同浓度的尿苷进行超过四天的营养缺陷型测定。在以相似的密度接种umps
ko/ko hesc并在不同尿苷浓度存在下培养后第4天拍摄孔的显微镜照片。照片显示细胞在2.5
–
250μg/ml存在下增殖,但在不添加尿苷的情况下没有增殖。在接种后第4天对活细胞进行定量以评估不同尿苷浓度的影响,如表15中所示。表15.活细胞计数尿苷重复1重复2重复3无0002.5μg/ml31040380654518925μg/ml318103963536283250μg/ml191473105033955
[0255]
生成了不同浓度补充剂相对于对照的杀伤曲线,以证明外源供应形式的敲除基因产物拯救了细胞系的营养缺陷型表型。
[0256]
为了评估对5-foa的抗性,umps-ko hesc被遗传工程化以从整合到安全港基因座
中的表达盒表达gfp,以便在与umps-wt细胞的共培养中更容易鉴定。
[0257]
选择了显示出明亮且稳定的gfp表达的克隆。将这些umps
ko/ko hesc与不表达gfp的umps
wt/wt
细胞混合,然后在不同浓度的5-foa存在下进行荧光激活细胞分选(facs)分析。表16提供了用不同5-foa浓度培养后的gfp 和gfp-细胞的计数。表16.活细胞计数表16.活细胞计数
[0258]
类似于先前的细胞类型,观察到gfp 细胞随时间的富集。在没有5-foa的组中54.8%的细胞是gfp ,并且在有5-foa的组中95.0%的细胞是gfp 。如表16中所示的,在这种细胞类型中,umps-wt细胞对所有测试的5-foa浓度敏感,并且umps-ko细胞也耐受0.25μg/ml的浓度,同时在较高浓度下显示增殖受损。
[0259]
总之,这些结果证实,可以有效地工程化代谢的关键途径以在从白血病细胞系到多能细胞系和原代免疫细胞的一系列人类细胞中产生营养缺陷型。两个umps等位基因的基因靶向可被用于产生和纯化具有纯合敲除的细胞群或使用5-foa富集那些细胞。还可以产生具有多个敲除和突变的细胞系以提供快速的多重基因组工程化和选择(例如,5个营养缺陷型突变和5种抗生素)。实施例9.体内分析
[0260]
体外验证的营养缺陷型基因敲除细胞系也可以在体内进行分析。这些细胞系受到人类营养缺陷型因子的毒性和生物利用度的限制。基因敲除细胞系由人类t细胞或任何其他淋巴细胞工程化而来。细胞系的有条件体外生长在营养缺陷型因子存在的情况下得到证实,并且在营养缺陷型因子不存在的情况下则不然。可以在小鼠模型中施用经证实对该因子是营养缺陷型的并且能够表达转基因的经修饰的哺乳动物宿主细胞。只有消耗营养缺陷型因子补充剂的小鼠才能维持人类淋巴细胞的生长。此外,当从小鼠食物源中去除营养物时,细胞生长在体内停止。实施例10.通过遗传工程化在人类细胞中产生营养缺陷型
[0261]
使用生物信息学工具(crispor.tefor.net)来鉴定spcas9的umps基因的外显子1中可能的sgrna靶位点。使用cosmid(crispr.bme.gatech.edu/)预测推定的脱靶(ot)效应(参见,majzner等人,cancer cell.31,476
–
485(2017),其在此通过引用整体并入本文中)。使用基于网络的生物信息学程序cosmid(crispr.bme.gatech.edu)鉴定了人类基因组中潜在的脱靶基因座(hg38),在19pam近端碱基中允许多达3个错配或具有1个错配的1bp缺失/插入。sgrna按高度相似的脱靶位点的数量(cosmid分数《1)排序,然后按得分较高的ot位点的数量排序。还通过cosmid程序设计了用于扩增所有位点的引物。所有位点都通过基因座特异性pcr进行扩增,经由第二轮pcr加条形码,以等摩尔量合并,并使用illumina miseq,使用250bp配对末端读取进行测序,如先前在porteus,m.mol.ther.19,439
–
441(2011)中所述的,该文献在此通过引用整体并入本文中。使用自定义脚本indelquantificationfromfastqpaired-1.0.1.pl(10)(https://github.com/piyuranjan/
nucleaseindelactivityscript/blob/master/indelquantificationfromfastqpaired-1.0.1.pl)分析所得数据。
[0262]
鉴定出具有最少ot位点数量的3个sgrna,并将其用于体外活性筛选。这些sgrna显示在表17中。表17.具有最少ot位点的sgrna
名称靶序列 pamseq id no.粘粒总ot位点mit特异性得分umps-3ccccgcagatcgatgtagat ggg4196umps-7gccccgcagatcgatgtaga tgg5694umps-6ggcggtcgctcgtgcagctt tgg6394
[0263]
从synthego corporation获得具有化学经修饰的sgrna。将sgrna与cas9蛋白(idt)以2.5:1(sgrna:蛋白质)的摩尔比复合,并使用4d-nucleofector
tm
系统(lonza)电穿孔到激活的t细胞中。4天后,收获细胞,并根据产生商的方案,使用quickextract
tm
dna提取试剂盒(epicentre)提取基因组dna。将sgrna靶位点用特异性引物(表18)扩增,并将扩增子通过sanger测序(mclab,south san francisco)进行测序。表18.引物名称序列seq id no.umps tide正向cccggggaaacccacgggtgc2umps tide反向agggtcggtctgcctgcttggct3
[0264]
使用crispr编辑(ice)和ice-d在线工具(ice.synthego.com)的干扰对序列进行插入缺失定量(图5a)。结果显示在表19中。表19.插入缺失定量 ice插入缺失(%)ice-d插入缺失(%)umps-34543umps-61211umps-73993
[0265]
sgrna“umps-7”被选择用于进一步的实验。这种sgrna导致了较大比例大(大于30bp)缺失的产生,这些缺失可以通过推断crispr编辑
–
不一致(ice-d),而非通过传统的ice或tide分析(www.deskgen.com/landing/tide.html)来检测。
[0266]
为了评估在不添加尿苷或尿苷单磷酸(ump)的情况下培养时umps敲除是否导致差异细胞增殖,通过利用台盼蓝染色的自动细胞计数随着时间的推移追踪培养物中的细胞计数。与模拟物电穿孔或使用靶向不同基因组基因座(即,ccr5)的cas9电穿孔的细胞相比,umps敲除导致来自电穿孔后第2天的细胞计数降低(图5b)。细胞计数显示在表20中。表20.插入缺失定量天模拟物,无代谢物ccr5敲除,无代谢物umps敲除,无代谢物05000005000005000001967000835000808000223500002290000159000043440000342000025100006415000039000002210000
8371000039100002550000
[0267]
相反,如果以高浓度(各250μg/ml)补充ump或尿苷,则在umps敲除后细胞增殖未受损(图5c)。每ml的活细胞数显示在表21中。表21.每ml的活细胞数天umps敲除,无代谢物umps敲除,有umpumps敲除,有尿苷050000050000050000018080008740007690002159000018600001590000425100003470000343000062210000388000037900008255000036300003170000
[0268]
为了证实基因组水平上的结果,在实验结束时收获基因组dna并定量插入缺失(图5d-图5e)。图5d比较了未暴露于5-foa的细胞在不同培养条件下的插入缺失的频率。百分比显示在表22中。表22.总体插入缺失频率的百分比培养条件百分比(%)无代谢物57.9有ump71.1有尿苷77.0
[0269]
图5e比较了未暴露于5-foa的细胞在不同培养条件下的移码插入缺失的频率。百分比显示在表23中。表23.移码插入缺失频率的百分比表23.移码插入缺失频率的百分比
[0270]
在没有尿苷或ump的情况下培养后,总体插入缺失频率略有降低,但是当定量会导致移码的插入缺失(不是 3/-3的倍数)时,没有添加代谢物的细胞群中的插入缺失减少。这证实,与umps野生型细胞或保留阅读框的在外显子1中具有插入缺失的细胞相比,由于外显子1中的移码插入缺失而具有umps敲除的细胞在存活和增殖方面具有劣势。
[0271]
接下来,产生了基因靶向构建体,其允许将2个不同的标志物整合到umps基因座中,从而破坏基因表达,并能够通过tegfr和tngfr的共表达,使用bak等人,elife 28:6(2017)中描述的方法来鉴定具有双等位基因敲除的细胞(图6a),该文献在此通过引用整体并入本文中。使用标准分子生物学方法,通过gibson组装克隆构建体,其质粒骨架侧接有aav2反向末端重复序列(itr)。
[0272]
为了靶向干细胞和原代人类细胞,将构建体包装在6型重组腺相关病毒(raav6)中,以在产生双链断裂后递送dna,从而刺激同源重组以整合转基因。通过gibson组装(hifi dna组装反应混合物,new england biolabs inc.),通过将转基因和周围的与靶向的基因组区域同源的臂克隆到与侧接有反向末端重复序列(itr)相邻的
paav-mcs质粒(agilent technologies)的主链中,来产生用于产生raav6的转移质粒。通过pcr,从健康供体基因组dna扩增同源臂。对于表面标志物的表达,我们使用了tngfr和tegfr(参见,teixeira等人,curr.opin.biotechnol.55,87
–
94(2019);chen等人,sci.transl.med.3(2011);其中每项均在此通过引用整体并入本文中)。对于转录终止,使用了来自牛生长激素(bgh)的聚腺苷酸化序列。
[0273]
通过转移质粒与pdgm6包装质粒的共转染在hek293t细胞中进行aav的产生,并通过碘克沙醇梯度离心进行纯化。利用pdgm6辅助质粒和各自的侧接有aav2 itr的同源臂之间携带转基因的转移质粒,将hek293细胞与聚乙烯亚胺共转染。48小时后,将细胞分离,与上清液分离,并裂解。将悬浮液用benzonase(sigma aldrich)处理并沉淀碎片。在碘克沙醇密度梯度上纯化粗制aav提取物,然后在1x104截留分子量(mwco)slide-a-lyzer
tm
g2透析盒(thermo fisher scientific)中,进行2个循环的pbs透析和1个循环的具有5%山梨糖醇的pbs透析。aav滴度是通过quickextract
tm
dna提取试剂盒(epicentre)提取基因组dna,并根据产生商的方案,使用先前报道的引物和探针组,通过液滴数字pcr(bio-rad),测量itr拷贝数的绝对浓度来确定的(参见,ja
é
n等人,mol.ther.methods clin.dev.6,1
–
7(2017,其在此通过引用整体并入本文中)。
[0274]
首先在髓样白血病细胞系k562(ccl-243
tm
)中测试了用这些用作质粒的供体构建体的靶向性。按照产生商的方案,在sf细胞系4d nucleofector
tm
系统(lonza)上用2μg的每种质粒对细胞进行电穿孔。当将这两种标记物靶向umps基因座中时,鉴定出显示两种标记物共表达的小而稳定的细胞群(图6b)。
[0275]
将磁珠富集用于依次富集表达表面标志物egfr和ngfr的细胞。对于磁性分离,将表达tngfr和tegfr的细胞通过连续磁珠分选,使用针对ngfr和egfr的抗体,利用pe和apc作为荧光染料(biolegend)、抗藻红蛋白(pe multisort试剂盒(miltenyi)和抗apc微珠(miltenyi),在ls或ms柱(miltenyi)上,进行富集。在facs aria
tm
ii sorp细胞分选仪(bd biosciences)上进行facs分选。
[0276]
为了使鉴定更容易,进行第二编辑步骤,其中将具有萤火虫荧光素酶和turbogfp的表达盒靶向安全港基因座(hbb)中(图6c)。将k562细胞悬浮在具有6μg cas9蛋白(idt)和3.2μg sgrna(trilink)的20ul sf细胞系溶液中,并进行电穿孔。在k562细胞培养基(具有10%bgs并补充有glutamax
tm
和青霉素/链霉素的rpmi)中重悬后,用携带表达盒的raav转导细胞。这导致细胞群表达所有3种标记物(tngfr、tegfr和gfp),这些标记物通过流式细胞术进行分选。流式细胞术的结果显示在图6d中。每组中gfp 细胞的百分比显示在图6f中。
[0277]
对分选的umps
ko/ko
/gfp
细胞群进行测定,以评估它们的营养缺陷型和它们对5-foa的抗性。将细胞分成相等数量的样品,并在不同浓度的尿苷存在或不存在的情况下进行培养。补充高浓度尿苷(250μg/ml)后,细胞迅速扩增。细胞生长在较低浓度(25μg/ml)下受到抑制,而细胞数量随着较低浓度或没有尿苷而下降(图6e)。每ml细胞数显示在表24中。表24.第1-8天每ml的细胞数
[0278]
用nalm6细胞进行相同的实验,并观察到对培养物中尿苷浓度的类似依赖性,这对于具有完整umps的细胞是不可见的。表25提供了用不同尿苷浓度培养的umps
ko/ko nalm6细胞的生长曲线数据。在接受尿苷补充剂治疗的组和未接受野生型细胞的组之间没有观察到差异。表25.umps
ko/ko nalm6细胞的细胞计数
[0279]
在补充有尿苷的组中,尤其是补充有25μg/ml和250μg/ml尿苷的组中,观察到显著更大的生长。
[0280]
为了确定umps敲除细胞对5-foa的抗性,将纯化的umps
ko/ko
/gfp
k562细胞与umps
wt/wt
/gfp阴性k562细胞以相等的比例混合。在尿苷和不同浓度的5-foa存在下培养细胞(图6f)。表26提供了不同培养条件下gfp阳性( )细胞的百分比。表26.gfp 细胞的百分比
[0281]
图6g显示了不同量的5-foa下gfp 细胞的生长曲线。值显示在表27中。表27.每μl的gfp 细胞数量 1000ug/ml 5-foa100ug/ml 5-foa10ug/ml 5-foa无5-foa第1天75925.72115272.3587013.0480080.81第2天79080.77106377.73163245.74135616.84第4天151010.55376993.53569281.05304640.45
第6天217794.10501940.62550780.31282520.65第8天339282.35693093.53719624.13203799.66
[0282]
在使用的所有浓度下,umps
ko/ko
细胞的分数均随着时间增加。具有ump敲除的细胞在10和100μg/ml的5-foa浓度下增殖良好,而最高浓度会减慢它们的细胞生长。实施例11.umps编辑在t细胞中产生营养缺陷型并允许选择5-foa
[0283]
使用聚蔗糖密度梯度和macs阴性选择(miltenyi t细胞富集试剂盒),从获自斯坦福血液中心(palo alto,ca)的血沉棕黄层分离t细胞。将t细胞在补充有5%人血清(sigma)和100iu/ml il-2的x-vivo15培养基中培养。
[0284]
在电穿孔之前,用抗cd3/cd28珠(stemcell technologies)(本领域中也称为dynabeads)和il-2(100iu/ml)将t细胞激活3天。在电穿孔前通过磁性固定去除活化珠。将k562细胞和nalm6细胞在电穿孔前保持在对数生长期。sgrna从synthego获得,在两端的三个末端核苷酸处具有2
’‑
o-甲基-3
’‑
硫代磷酸酯修饰(参见,bonifant等人,mol.ther.-oncolytics.3,16011(2016),其在此通过引用整体并入本文中)。
[0285]
在从健康供体分离cd3 t细胞并激活细胞后,将两种选择标记tegfr和tngfr靶向原代人类t细胞中的umps基因座中。
[0286]
大规模sgrna是通过高效液相色谱(hplc)纯化获得的。高保真(hifi)cas9蛋白购自idt。将sgrna与hifi spcas9蛋白(idt)以2.5:1(sgrna:蛋白)的摩尔比复合,并使用4d-nucleofector
tm
系统(lonza)在16小池条中电穿孔到细胞系或活化的t细胞中。
[0287]
为了将转基因靶向基因组的特定基因座中,如所述编辑细胞,在电穿孔后直接重悬于80μl培养基中,然后与raav6一起孵育以用于以5000vg/细胞的感染复数(moi)转导。8-12小时后,将悬浮液用培养基稀释,达到每毫升0.5-1e6个细胞的细胞浓度。为了靶向hbb基因座,使用了先前表征的具有靶序列cttgccccacagggcagtaa(seq id no:7)的sgrna(参见,teixeira等人curr.opin.biotechnol.55,87
–
94(2019),其在此通过引用整体并入本文中)。将cas9和sgrna与rnp复合,并与重悬在p3缓冲液中的t细胞混合,并使用程序eo-115在4d nucleofector
tm
系统(lonza)中进行电穿孔。如bak等人2018中所述,本领域已知人类t细胞允许低毒性的高编辑频率,以使用rnp/raav6基因靶向方法创建具有双等位基因umps敲除的细胞群。同时表达表达两种标志物的细胞。使用以下每个电穿孔的细胞计数、电穿孔溶液和程序:于sf细胞系溶液中的2e5 k562细胞,使用程序ff-120,于sf细胞系溶液中的2e5 nalm6细胞和程序cv-104,以及于p3溶液中的1e6激活的t细胞。对于在ccr5基因座处编辑的对照,sgrna的基因组靶序列是gcagcatagtgagcccagaa(seq id no:8)。电穿孔后,将细胞重新悬浮在培养基中并加入raav。
[0288]
靶向后三天,通过在高尿苷浓度存在下与抗cd3/cd28磁珠共培养来鉴定和扩增egfr /ngfr 细胞群。将egfr /ngfr 细胞群与单独接受aav的细胞区分开来,因为较亮的表达表明稳定的整合,而不是来自aav的游离表达。
[0289]
扩增后,使用流式细胞术对egfr /ngfr 群体进行分选,以获得具有双等位基因umps敲除的t细胞群。结果显示在图7a中。
[0290]
还对这些t细胞进行了营养缺陷型测定,并测试了用5-foa选择这些细胞的可能性。当在抗cd3/cd28珠和不同浓度的尿苷存在下培养细胞时,细胞仅在存在尿苷的情况下增殖,这证实了它们的营养缺陷型细胞生长。较高的尿苷浓度导致较高的增殖率。umps ko
或野生型(wt)t细胞的营养缺陷型生长显示在图7b和表28中。表28.每ml的活细胞表28.每ml的活细胞
[0291]
表29显示了第4天细胞群的相对活力。表29.每ml的活细胞
[0292]
为了评估利用5-foa选择umps
ko/ko
细胞的可能性,将分选的细胞与用不同示踪染料标记的野生型细胞混合,并在存在或不存在5-foa的情况下培养。在部分样品中,仅在第一天(第0天)添加5-foa,而在另一组中则每天补充。表30和图7c显示了在有或没有5-foa下培养时随时间推移的umps-ko t细胞(用efluor670标记)的百分比(%)。表30.混合细胞群中umps
ko/ko
细胞的百分比
[0293]
使用非配对t检验比较组的统计学显著差异。在用5-foa处理的组之间没有观察到统计学显著性,而与未处理组相比,处理组中umps-ko t细胞的百分比显著增加。
[0294]
在两个5-foa处理组中,umps敲除的细胞分数随时间增加,表明与野生型细胞相比,它们对化合物的抗性增加,并且用5-foa一次性处理足以在几天内导致经修饰的细胞的富集。表30中的数据说明了5-foa对umps敲除的t细胞的选择。
[0295]
事实上,umps敲除和野生型t细胞的混合群与5-foa一起的培养物的facs分析。将umps-ko t细胞用efluor670标记,并将野生型细胞用羧基荧光素琥珀酰亚胺酯(cfse)标记。结果显示,在仅在第一天(第0天)用5-foa处理的组中,在第0天,43.7%的细胞为umps-ko t细胞,而观察到56.0%为野生型细胞。在第0天,在未用5-foa处理的对照组中,47.7%的细胞是umps-ko t细胞,并且52.1%是野生型细胞。在每天补充5-foa的组中,在第3天,74.0%的细胞是umps-ko t细胞,而25.8%是野生型细胞。在未用5-foa处理的对照组中,第3天,43.1%的细胞是umps-ko t细胞,并且56.4%是野生型细胞。实施例12.细胞疗法
[0296]
多能干细胞经过遗传工程化,使它们依赖于外部提供的因子。这些细胞被注射到免疫缺陷nsg小鼠中作为畸胎瘤形成测定,以评估安全系统,该系统通过停用外部供应的化合物来防止畸胎瘤形成。使用的细胞系是ipscs:ilif3、isb7-m3(来源:斯坦福大学的nakauchi实验室)和hes:h9。
实施例13.腓肠肌中的畸胎瘤形成测定
[0297]
为了确定安全开关是否可以根除源自多能细胞的畸胎瘤,将基因经修饰的ipsc或es细胞(或对照细胞)移植到小鼠中。细胞表达用于体内检测的荧光素酶。将1x106个umps工程化的hesc重新悬浮在100μl蛋白质混合物(corning,inc.)和pbs混合物中,并注射到麻醉nsg小鼠右后腿的腓肠肌中。通过肿瘤大小测量和生物发光成像跟踪小鼠的肿瘤形成。在建立肿瘤后,测试了三乙酸尿苷(uta)的停用是否导致肿瘤消退。在终点(肿瘤大小超过1.7cm或小鼠活动受损,否则为24周),肿瘤被移出并固定用于组织学分析。实施例14.k562异种移植模型
[0298]
对于k562异种移植测定,在麻醉下,利用1x106个k562细胞移植6-12周龄雄性nod scidγ小鼠(nsg)小鼠,该细胞重悬于用pbs 1:1稀释的蛋白质混合物(corning,inc.)中。所有动物均按照机制指南进行饲养和处理,且实验方案得到斯坦福大学实验室动物护理管理委员会的批准。
[0299]
在移植到模型生物体中后通过向动物提供高剂量尿苷来体内分析umps
ko/ko
工程化细胞的生长。尿苷已在人类中用于治疗遗传性乳清酸尿症和氟嘧啶过量引起的毒性(参见,van groeningen等人,ann.oncol.4,317
–
320(1993);becroft等人,j.pediatr.75,885
–
91(1969);其中每项均在此通过引用整体并入本文中),但它在胃肠道中的吸收很差并在肝脏中分解(参见,gasser等人,science.213,777
–
8(1981);其中每项均在此通过引用整体并入本文中)。其生物利用度可通过作为前药尿苷三乙酸酯(uta,pn401)施用而增加,该药物已被fda批准用于上述适应症(参见,weinberg等人,plos one.6,e14709(2011);ison等人,clin.cancer res.22,4545
–
9(2016);其中每项均在此通过引用整体并入本文中)。在人类和小鼠模型中,这可以有效地将尿苷血清水平提高10倍以上(参见,garcia等人,brain res.1066,164
–
171(2005);fda,“xuriden-highlights of prescribing information.”(2015),(可在https://www.accessdata.fda.gov/drugsatfda_docs/label/2015/208169s000lbl.p df获得);其中每项均在此通过引用整体并入本文中。
[0300]
在nsg小鼠的异种移植模型中使用先前工程化的表达萤火虫荧光素酶(fluc)的umps
ko/ko k562细胞系。具有野生型umps的对照k562细胞通过将带有fluc和gfp的表达盒靶向安全港基因座中而进行工程化,以便为两种umps基因型建立可比较的异种移植模型,其中可以通过生物发光成像监测肿瘤。cas9 rnp靶向具有通过raav6转导的向导rna和dna供体模板的hbb基因座的外显子1,所述raav6携带位于sffv启动子控制下的fluc-2a-gfp-聚a盒。在靶向k562细胞四天后进行facs分析以评估gfp表达,然后再分选gfp 群体。在仅施用aav的对照组中,1.61%的细胞是gfp ,且13.4%的细胞。
[0301]
给小鼠喂食常规小鼠食物或富含8%(w/w)uta的定制食物,该量先前已显示能够增加小鼠的血清水平同时耐受良好(参见,garcia等人,2005)。uta获自accela chembio inc.,并添加到teklad小鼠食物(envigo)中以制成8%(w/w),并在使用前辐照食物。对照食物是标准小鼠食物teklad 2018(辐照的)。
[0302]
可替代地,食物补充有尿苷单磷酸酯。这些细胞可以通过静脉(iv)注射局部(后腿)或全身植入免疫功能低下的小鼠体内。
[0303]
将umps
ko/ko k562细胞或对照细胞皮下移植,并每周用生物发光成像观察。在腹膜内(ip)注射125mg/kg d-荧光素(perkinelmer)5分钟后,在ivis光谱成像系统
(perkinelmer)上对k562细胞进行发光成像。观察到已描述的k562细胞皮下异种移植后的局部生长(参见,sontakke等人,stem cells int.2016,1625015(2016),其在此通过引用整体并入本文中)。在小鼠垂死或最长肿瘤直径超过1.75cm时将其安乐死。除了一只植入失败的小鼠外,观察到在正常或uta补充食物的umps野生型细胞中肿瘤负荷增加。相比之下,仅在喂食8%uta的小鼠中观察到umps
ko/ko k562来源的肿瘤的发光增加,而在大多数接受不含uta的食物的小鼠中观察到肿瘤负荷保持稳定。
[0304]
还分析了体内umps
ko/ko
工程化的hes细胞的营养缺陷型细胞增殖。除了一只未能形成畸胎瘤的小鼠外,在将多能细胞注射到nsg小鼠的后腿中后,在所有补充了uta的小鼠中都观察到了肿块。当在细胞注射后7周对小鼠实施安乐死时,将在用uta喂养的小鼠的注射区域中形成的大畸胎瘤提取出来,而在正常食物的小鼠中,畸胎瘤是可见的,但明显更小,且重量更轻,如表31中所示。在动物死亡或处死时(注射后最近16周)分析骨髓。表31显示了畸胎瘤重量的定量结果(通过比较组间所有小鼠的未配对t检验,p《0.05,当审查没有移植的小鼠时,p《0.01)。如使用prism 7(graphpad)所示,通过统计检验对组进行比较。表31.畸胎瘤的重量
[0305]
体内结果与之前的体外结果一致,其显示在尿苷浓度为2.5μg/ml(=10nmol/ml)时,umps
ko/ko
细胞的增殖减少但未完全消除。该浓度对应于小鼠的血清尿苷水平,文献中报道其范围为8-11.8nmol/ml(参见,karle等人,anal.biochem.109,41
–
46(1980),其在此通过引用整体并入本文中)。
[0306]
总之,这些结果证明代谢营养缺陷可以被工程化以在体外和体内增加对人类细胞的细胞增殖的控制机制。实施例15.gvhd模型
[0307]
在小鼠模型中确定安全系统是否可以防止异种gvhd的副作用。将经过遗传经修饰的人类t细胞或对照t细胞移植到辐射过的免疫功能低下的小鼠体内,并为小鼠提供或不提供uta。评估小鼠的体重减轻或gvhd的其他迹象,并在疾病确立时(最近16周)处死。随后对细胞进行生物发光成像和抽血。实施例16.溶酶体贮积病(lsd)的酶替代疗法
[0308]
多能干细胞经过遗传工程化以编码整合在umps基因座处的目标酶,从而使它们依赖于外部提供的尿苷。需要特定酶的酶替代疗法来治疗lsd的个体被施用包含这些细胞和尿苷的组合物,以促进个体中缺乏的酶的表达。尿苷的施用剂量和时间根据酶的所期望的表达进行调整。
[0309]
在一些情况下,细胞经过遗传工程化以在hlc基因座处编码目标酶,从而使它们依赖于外部提供的生物素。实施例17.用于治疗自身免疫性疾病的营养缺陷型cd19-car t细胞
[0310]
使用本文所述的方法,包括实施例1中提供的那些方法,将t细胞工程化为尿苷营养缺陷型(umps敲除)。简而言之,使用靶向umps基因的外显子1的双引导sgrna方法靶向
umps基因座,并且靶向trac基因座以进行car构建体的位点定向整合。具体地,用含有cas9蛋白和第一umps sgrna(umps-1,seq id no:9)的第一cas9 rnp、含有cas9蛋白和第二sgrna(umps-7,seq id no:5)的第二cas9 rnp,以及含有cas9蛋白和靶向trac基因座的sgrna的第三cas9 rnp,对t细胞进行电穿孔,如例如macleod,daniel t.等人,"integration of a cd19car into the tcr alpha chain locus streamlines production of allogeneic gene-edited car t cells."molecular therapy 25.4(2017):949-961中所述,其通过引用整体并入本文中。经由raav6转导,将含有针对trac基因座的同源臂、编码cd19-car的核苷酸序列和编码tngfr标记的核苷酸序列的同源重组供体载体引入细胞中。因此,产生了在trac处携带cd19-car/tngfr敲入的umps敲除细胞。将细胞仅用aav或aav trac和umps sgrna转导,如以上实施例1中的标准rnp量或双倍rnp量(高rnp)。图8显示了转导后第4天tcr(非trac敲入细胞)和ngfr(cd19-car敲入细胞)的facs分析结果。用aav转导的细胞仅表现出高tcr表达而无ngfr表达(图8,左图),证明了单独用aav转导不影响内源性trac基因座的表达(表达的tcr蛋白),并且不表达cd19-car/tngfr。与标准rnp量一起转导的细胞显示出ngfr的高表达且没有tcr,证明了成功敲入trac基因座(图8,中间的图)。高rnp量(图8,右图)导致敲入效率略微增加。如本文所述,使用crispr编辑(ice)的干扰进行插入缺失定量,以评估umps编辑效率。标准rnp量导致大约85%的umps敲除,且高rnp量导致91%umps敲除效率。umps和trac基因座编辑/靶向结果组合的总体效率显示在表32中。表32.umps和trac编辑和靶向结果:具有经修饰的等位基因细胞的百分比
[0311]
使用cd19阳性nalm6细胞(靶细胞)在连续细胞毒性测定中测试表达cd19-car的umps敲除细胞(效应细胞)的功效。简而言之,将效应细胞或对照细胞(仅用aav处理的非car t细胞)与尿苷或无尿苷一起培养(第一次挑战,图9)。在不同时间点进行facs分析以确定效应细胞杀死靶细胞的功效。对效应细胞进行第二次挑战(图10),其中每孔添加固定数量的靶细胞(1
×
10^6),或每孔添加调整后的靶细胞数量(1:1效应子:靶标)。重复facs分析以确定效应细胞杀死靶细胞的功效。
[0312]
图9显示了第一次挑战的结果。在存在尿苷或不存在尿苷的情况下与car t细胞一起培养时,靶细胞(上图)被从培养物中去除,但当与非效应细胞(图9中的“非car t细胞”)一起培养时,靶细胞增殖。同时,效应细胞浓度(下图)显示效应细胞仅在存在尿苷的情况下增殖。在图9的顶部和底部图中,x轴显示靶细胞和效应细胞共培养开始后的天数。在共培养开始后的第1、2和5天进行facs分析。结果表明,在第一次挑战期间,umps敲除car t细胞在有或没有尿苷的情况下杀死靶细胞,但仅在存在尿苷的情况下增殖。
[0313]
图10显示了第二次挑战的结果。当每孔加入固定数量的靶细胞(1
×
10^6)时,靶细胞(上图)在没有尿苷的情况下增殖;在尿苷存在的情况下,效应细胞在整个实验过程中保持对靶细胞的细胞毒性作用(左上图)。当每孔加入调整数量的靶细胞(1:1效应子:靶标)
时,即使没有尿苷,靶细胞也会减少;在尿苷存在的情况下,效应细胞在整个实验过程中保持对靶细胞的细胞毒性作用(右上图)。同时,当每孔添加固定靶细胞数或调整后的靶细胞数时,效应细胞(下图)仅在存在尿苷的情况下增殖。在图10的所有图中,x轴显示第一次挑战结束后的天数;即,第二次挑战的第0天是第一次挑战的第5天,这样所测定的细胞被共培养了总共8天。结果表明,umps敲除的car t效应细胞在不加尿苷的情况下在培养中不扩增,并且在不加尿苷的情况下对靶细胞的细胞毒作用显著降低。实施例18.营养缺陷型car t细胞的体内评估
[0314]
体内评估了umps敲除car t效应细胞(例如,cd19特异性car t细胞)的安全性和功效。人造血干细胞和祖细胞(hsc)被异种移植到nsg小鼠中。允许hsc移植。向小鼠施用尿苷,例如,在饮食中使用尿苷三乙酸盐补充剂。将在尿苷存在下制备(例如,根据实施例17)的营养缺陷型car t细胞移植到预先暴露于尿苷的小鼠中。在所有小鼠都保持服用尿苷时,在移植car t细胞之前分析外周血样本以确认人类b细胞植入,并在移植car t细胞后分析外周血样本以确认car t细胞植入和人类b细胞耗尽。随后,一组小鼠继续服用尿苷,而另一组小鼠则停止使用尿苷(例如,从饮食中去除尿苷三乙酸盐补充剂)。采集外周血样本以分析不同时间点的人类t细胞和b细胞计数。进行终点分析以确定外周血、脾脏、骨髓和肝脏中的人类t/b细胞。在尿苷存在的情况下,营养缺陷型car t细胞最初会导致b细胞耗尽。停用尿苷后,小鼠中的b细胞计数恢复。仅在实验终点维持尿苷的小鼠中观察到car t细胞的扩增。等同物和范围
[0315]
本领域技术人员将认识到或能够仅使用常规实验来确定根据本公开的具体实施方案的许多等同物。本公开的范围不旨在限于以上说明书,而是如所附权利要求中所阐述的。
[0316]
在权利要求中,诸如“一个/种(a/an)”和“所述(the)”的冠词可以意指一个或多于一个,除非指出相反或否则从上下文中明显看出。如果组成员中的一个、超过一个或全部存在于、被用于或以其他方式与给定产物或过程相关,则包括组的一个或多个成员“或”位于组的一个或多个成员之间的权利要求或描述被认为是满意的,除非指出相反或从上下文或否则从上下文中明显看出。本公开包括这样的实施方案,其中该组中的一个成员恰好存在于、用于或以其他方式与给定的产生或过程相关。本公开包括这样的实施方案,其中多于一个或整个组成员存在于、被用于或以其他方式与给定产物或过程相关。
[0317]
还应注意,术语“包含(comprising)”旨在是开放性的并且允许但不要求包括额外的元件或步骤。当本文使用术语“包含(comprising)”时,术语“由
……
组成(consisting of)”因此也被涵盖和公开。
[0318]
在给出范围的情况下,包括端点。此外,应当理解,除非另外指出或否则从上下文和本领域普通技术人员的理解中明显看出,表示为范围的值可以采用本公开的不同实施方案中所述范围内的任何特定值或子范围,至范围下限的十分之一单位,除非上下文另外明确指出。
[0319]
另外,应当理解,落入现有技术内的本公开的任何特定实施方案可以明确地从任何一项或多项权利要求中排除。由于此类实施方案被认为是本领域普通技术人员已知的,因此即使在本文中没有明确阐述排除,它们也可以被排除。本公开的组合物和方法的任何特定实施方案可以出于任何原因从任何一项或多项权利要求中排除,无论是否与现有技术
的存在相关。
[0320]
应当理解,已经使用的词语是描述性词语而不是限制性词语,并且可以在所附权利要求的范围内进行改变而不脱离本公开在更广泛方面的真实范围和精神。
[0321]
虽然本公开已经关于几项描述的实施方案以一定的长度和一些特殊性进行了描述,但并不旨在将其限制于任何这样的细节或实施方案或任何特定实施方案,而是应该参考所附权利要求对其进行解释,以便根据现有技术提供对这些权利要求的最广泛可能的解释,并因此有效地涵盖本公开的预期范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。