1.本发明涉及本发明涉及生物技术领域,特别涉及一种甘氨酸的生产方法。
背景技术:
2.甘氨酸(glycine)是氨基酸系列中结构最为简单,人体非必须氨基酸。作为一种重要的精细化工中间体,广泛应用于农药、医药、食品和饲料添加剂领域。在食品中添加甘氨酸可以用作食品的防腐剂,延长其保质期;在含酒精饮料和动植物食品的加工中,则作为调味剂,增香剂。在医药方面,甘氨酸可以合成多种药物,如治疗高血压药物盐酸地拉普利、抑制胃溃疡用碳酸钙制剂、扑热息痛甘氨酸盐、单甘氨酸乙酰水杨酸钙、利血胺注射液、抗帕金森氏药物l-多巴、甲砜霉素等。工业级甘氨酸则主要用于大规模生产除草活性最强的除草剂草甘膦。
3.我国甘氨酸的产能约55万吨,主要通过有机合成法生产。主要包括氯乙酸氨水解法、施特雷克法(strecker)和海因法(hydantion)等(徐泽辉,刁春霞,黄亚茹,常慧。甘氨酸的生产现状及发展趋势。2004,石油化工技术经济。20(5):41-45.)。这些方法的原料或制备中间体对环境污染严重,不符合现代社会对工业生产的环保要求。
4.利用微生物酶体外催化氨基乙氰酸溶液水解生产甘氨酸,是生物法制备甘氨酸方法之一。20世纪90年代,日本发表了以氨基氰酸为底物,利用微生物酶催化的专利(us5238827),虽然在30h甘氨酸产量能达到148g/l,但底物氨基乙氰酸毒性大,微生物酶容易受有机物的影响失活。
5.尽管利用体外酶催化法能够实现甘氨酸的合成,其仍具有生产局限性。在细胞体内从头法合成甘氨酸能解决这一问题,但是合成途径中参与催化乙醛酸到甘氨酸反应的酶尚无,有待挖掘,也是实现这一技术的关键点。
6.综上,目前利用生物法从头合成甘氨酸还处于空白。
技术实现要素:
7.本发明的目的是提供一种甘氨酸的生产方法。
8.第一方面,本发明要求保护一种构建能够生产甘氨酸的工程菌株的方法。
9.本发明所提供的构建能够生产甘氨酸的工程菌株的方法,可包括如下步骤(a1):
10.(a1)使受体菌表达乙醛酸氨化酶,所得菌株命名为工程菌1;所述工程菌1为能够生产甘氨酸的工程菌株。
11.进一步地,所述乙醛酸氨化酶可为如下a1)-a7)所示7种来源中任一种:
12.a1)来源于耻垢分枝杆菌(mycobacterium smegmatis)的乙醛酸氨化酶;
13.a2)来源于少盐芽孢杆菌(paucisalibacillus globuius)的乙醛酸氨化酶;
14.a3)来源于结核分支杆菌(mycobacterium tuberculosis)的乙醛酸氨化酶;
15.a4)来源于海水芽孢杆菌(bacillus aquimaris)的乙醛酸氨化酶;
16.a5)来源于玻利维亚盐单胞菌(halomonas boliviensis)的乙醛酸氨化酶;
17.a6)来源于维氏气单胞菌(aeromonas veronii)的乙醛酸氨化酶;
18.a7)来源于团聚拉布伦茨氏菌(labrenzia aggregata)的乙醛酸氨化酶。
19.进一步地,所述方法还可包括如下步骤(a2):
20.(a2)以所述工程菌1为出发菌株,对其内源的甘氨酸脱羧酶(glycine decarboxylase)进行抑制表达,所得菌株命名为工程菌2;所述工程菌2为能够生产甘氨酸的工程菌株。
21.进一步地,所述方法还可包括如下步骤(a3):
22.(a3)以所述工程菌2为出发菌株,对其内源的苹果酸合成酶(malate synthase)进行抑制表达,所得菌株命名为工程菌3;所述工程菌3为能够生产甘氨酸的工程菌株。
23.进一步地,所述方法还可包括如下步骤(a4):
24.(a4)以所述工程菌3为出发菌株,对其内源的转录抑制蛋白(transcriptional repressor)进行抑制表达,所得菌株命名为工程菌4;所述工程菌4为能够生产甘氨酸的工程菌株。
25.更进一步地,所述步骤(a1)可为:向所述受体菌中导入所述乙醛酸氨化酶的编码基因,所得菌株即为所述工程菌1。所述步骤(a2)可为:以所述工程菌1为出发菌株,敲除基因组中的甘氨酸脱羧酶编码基因,所得菌株即为所述工程菌2。所述步骤(a3)可为:以所述工程菌2为出发菌株,敲除基因组中苹果酸合成酶编码基因,所得菌株即为所述工程菌3。所述步骤(a4)可为:以所述工程菌3为出发菌株,敲除基因组中转录抑制蛋白编码基因,所得菌株即为所述工程菌4。
26.进一步地,所述方法还可包括如下步骤(a5):
27.(a5)以所述工程菌4为出发菌株,提高内源异柠檬酸裂解酶(isocitrate lyase)的活性和/或表达量,所得菌株命名为工程菌5;所述工程菌5也为能够生产甘氨酸的工程菌株。
28.在本发明的具体实施方式中,具体是通过将m1-93启动子整合于基因组中异柠檬酸裂解酶编码基因起始密码子前来提高内源异柠檬酸裂解酶的表达量的。
29.在步骤(a1)中,所述受体菌可隶属埃希氏菌属(escherichia),如大肠杆菌等;也可隶属棒杆菌属(corynebacterium),如谷氨酸棒状杆菌corynebacterium glutamicum等;还可隶属单胞菌属(pseudoalteromonas),如维氏气单胞菌aeromonas veronii,或铜绿假单胞菌pseudomonas aeruginosa等;亦可隶属芽孢杆菌属(bacillus),如海水芽孢杆菌bacillus aquimaris,或蜡样芽孢杆菌bacillus cereus,或弯曲芽孢杆菌bacillus flexus,或地衣芽孢杆菌bacillus licheniformis,或贝莱斯芽孢杆菌bacillus velezensis,或枯草芽孢杆菌bacillus substilis,或嗜热脂肪芽孢杆菌geobacillus stearothermophilus,或赖氨酸芽孢杆菌lysinibacillus fusiformis,或少盐芽孢杆菌paucisalibacillus globuius,或巨大芽孢杆菌bacillus megaterium等;还可隶属克雷伯氏菌属(klebsiella),如耻垢分枝杆菌mycobacterium smegmatis,或结核分支杆菌mycobacterium tuberculosis;还可隶属酵母属(saccharomyces),如酿酒酵母saccharomyces cerevisiae,或解脂耶氏酵母菌yarrowia lipolytica,或东方伊萨酵母菌issatchenkia orientalis等。
30.在本发明的具体实施方式中,所述受体菌具体为大肠杆菌atcc 8739。
31.在本发明中,所述来源于耻垢分枝杆菌的乙醛酸氨化酶为氨基酸序列如seq id no.6所示的蛋白质,或为seq id no.6经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质,或为与seq id no.6具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质,或为在seq id no.6所示的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
32.在本发明中,所述来源于少盐芽孢杆菌的乙醛酸氨化酶为氨基酸序列如seq id no.5所示的蛋白质,或为seq id no.5经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质,或为与seq id no.5具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质,或为在seq id no.5所示的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
33.在本发明中,所述来源于结核分支杆菌的乙醛酸氨化酶为氨基酸序列如seq id no.7所示的蛋白质,或为seq id no.7经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质,或为与seq id no.7具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质,或为在seq id no.7所示的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
34.在本发明中,所述来源于海水芽孢杆菌的乙醛酸氨化酶为氨基酸序列如seq id no.2所示的蛋白质,或为seq id no.2经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质,或为与seq id no.2具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质,或为在seq id no.2所示的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
35.在本发明中,所述来源于玻利维亚盐单胞菌的乙醛酸氨化酶为氨基酸序列如seq id no.3所示的蛋白质,或为seq id no.3经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质,或为与seq id no.3具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质,或为在seq id no.3所示的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
36.在本发明中,所述来源于维氏气单胞菌的乙醛酸氨化酶为氨基酸序列如seq id no.1所示的蛋白质,或为seq id no.1经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质,或为与seq id no.1具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质,或为在seq id no.1所示的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
37.在本发明中,所述来源于团聚拉布伦茨氏菌的乙醛酸氨化酶为氨基酸序列如seq id no.4所示的蛋白质,或为seq id no.4经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质,或为与seq id no.4具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质,或为在seq id no.4所示的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
38.其中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加是指不多于十个氨基酸残基的取代和/或缺失和/或添加。
39.上述蛋白质中,所述标签是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述标签可为flag标
签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
40.上述蛋白质中,同源性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
41.上述蛋白质中,所述95%以上的同源性可为至少96%、97%、98%的同一性。所述90%以上的同源性可为至少91%、92%、93%、94%的同一性。所述85%以上的同源性可为至少86%、87%、88%、89%的同一性。所述80%以上的同源性可为至少81%、82%、83%、84%的同一性。
42.步骤(a2)中,所述甘氨酸脱羧酶为gcvp蛋白;所述gcvp蛋白的氨基酸序列为protein_id:wp_000195064.1。步骤(a3)中,所述苹果酸合成酶为aceb蛋白;所述aceb蛋白的氨基酸序列为protein_id:wp_000138905.1。步骤(a4)中,所述转录抑制蛋白为iclr蛋白;所述iclr蛋白的氨基酸序列为protein_id:wp_000226403.1。步骤(a5)中,所述异柠檬酸裂解酶编码基因为acea基因;所述acea基因编码的蛋白质(即acea蛋白)的氨基酸序列为protein_id:wp_000857856.1。
43.在本发明中,来源于所述耻垢分枝杆菌的乙醛酸氨化酶的编码基因为核苷酸序列如seq id no.13所示的dna分子,或在严格条件下与seq id no.13所示的dna分子杂交且编码seq id no.6所示的蛋白质的dna分子,或与seq id no.13所限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码seq id no.6所示的蛋白质的dna分子。
44.在本发明中,来源于所述少盐芽孢杆菌的乙醛酸氨化酶的编码基因为核苷酸序列如seq id no.12所示的dna分子,或在严格条件下与seq id no.12所示的dna分子杂交且编码seq id no.5所示的蛋白质的dna分子,或与seq id no.12所限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码seq id no.5所示的蛋白质的dna分子。
45.在本发明中,来源于所述结核分支杆菌的乙醛酸氨化酶的编码基因为核苷酸序列如seq id no.14所示的dna分子,或在严格条件下与seq id no.14所示的dna分子杂交且编码seq id no.7所示的蛋白质的dna分子,或与seq id no.14所限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码seq id no.7所示的蛋白质的dna分子。
46.在本发明中,来源于所述海水芽孢杆菌的乙醛酸氨化酶的编码基因为核苷酸序列如seq id no.9所示的dna分子,或在严格条件下与seq id no.9所示的dna分子杂交且编码seq id no.2所示的蛋白质的dna分子,或与seq id no.9所限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码seq id no.2所示的蛋白质的dna分子。
47.在本发明中,来源于所述玻利维亚盐单胞菌的乙醛酸氨化酶的编码基因为核苷酸序列如seq id no.10所示的dna分子,或在严格条件下与seq id no.10所示的dna分子杂交
且编码seq id no.3所示的蛋白质的dna分子,或与seq id no.10所限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码seq id no.3所示的蛋白质的dna分子。
48.在本发明中,来源于所述维氏气单胞菌的乙醛酸氨化酶的编码基因为核苷酸序列如seq id no.8所示的dna分子,或在严格条件下与seq id no.8所示的dna分子杂交且编码seq id no.1所示的蛋白质的dna分子,或与seq id no.8所限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码seq id no.1所示的蛋白质的dna分子。
49.在本发明中,来源于所述团聚拉布伦茨氏菌的乙醛酸氨化酶的编码基因为核苷酸序列如seq id no.11所示的dna分子,或在严格条件下与seq id no.11所示的dna分子杂交且编码seq id no.4所示的蛋白质的dna分子,或与seq id no.11所限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码seq id no.4所示的蛋白质的dna分子。
50.上述编码基因中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,2
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.5
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在65℃,0.1
×
ssc,0.1%sds中漂洗;也可为:在6
×
ssc,0.5%sds的溶液中,在65℃下杂交,然后用2
×
ssc,0.1%sds和1
×
ssc,0.1%sds各洗膜一次。
51.上述编码基因中,同源性是指核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定核苷酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对核苷酸序列的同一性进行计算,然后即可获得同一性的值(%)。
52.上述编码基因中,所述95%以上的同源性可为至少96%、97%、98%的同一性。所述90%以上的同源性可为至少91%、92%、93%、94%的同一性。所述85%以上的同源性可为至少86%、87%、88%、89%的同一性。所述80%以上的同源性可为至少81%、82%、83%、84%的同一性。
53.步骤(a2)中,所述甘氨酸脱羧酶编码基因为gcvp基因;所述gcvp基因的核苷酸序列为gene id:6064873。步骤(a3)中,所述苹果酸合成酶编码基因为aceb基因;所述aceb基因的核苷酸序列为gene id:6064573。步骤(a4)中,所述转录抑制蛋白编码基因为iclr基因;所述iclr基因的核苷酸序列为gene id:6064567。步骤(a5)中,所述异柠檬酸裂解酶编码基因为acea基因;所述acea基因的核苷酸序列为gene id:6064570。步骤(a5)中,所述m1-93启动子是按照包括如下步骤的方法制备得到的:以重组大肠杆菌m1-93的基因组dna为模板,用引物acea-p-up/acea-rbs-down(表2)扩增,得到含有所述m1-93启动子的dna片段。
54.在本发明的具体实施方式中,步骤(a1)中,所述a1)-a7)所示7种来源中任一种的
乙醛酸氨化酶的编码基因是通过重组载体的形式导入所述受体大肠杆菌中的;所述重组载体具体为将所述a1)-a7)所示7种来源中任一种的乙醛酸氨化酶的编码基因克隆到ptrc99a-m质粒的kpni和sali位置后得到的重组质粒。
55.在本发明的具体实施方式中,步骤(a2)中,所述“以所述工程菌1为出发菌株,敲除基因组中的甘氨酸脱羧酶编码基因(gcvp基因)”是通过包括如下步骤的方法实现的:(a1)在供体质粒placz的基础上添加了半乳糖转录抑制蛋白编码基因(laci基因)和针对自身质粒氯霉素cat基因的n20-grna序列,得到供体质粒pv4;(a2)在所述供体质粒pv4的基础上构建用于敲除gcvp基因的pv4-del-gcvp质粒,该质粒含有针对甘氨酸脱羧酶编码基因(gcvp基因)的gcvp-n20-grna序列和敲除甘氨酸脱羧编码基因(gcvp基因)的上下游同源臂序列;(a3)将所述pv4-del-gcvp质粒和predcas9质粒共同转化所述工程菌1,从而实现敲除所述工程菌1基因组中的编码基因(gcvp基因)。
56.更加具体的,步骤(a1)中,以placz质粒为模板,使用引物bone-f(见表2)和引物bone-r(见表2)进行pcr扩增,得到dna片段i(6.6kb左右的pcr产物);以pacyc184-m质粒为模板,使用引物laci-ptrc-up(见表2)和引物laci-ptrc-down(见表2)进行pcr扩增,得到dna片段ii(1.5kb左右的pcr产物);以placz质粒为模板,用引物cat-n20-up(见表2)和引物cat-n20-down(见表2)进行pcr扩增,得到dna片段iii(400bp左右的pcr产物);将所述dna片段i、所述dna片段ii和所述dna片段iii用golden gate技术策略进行组装,得到所述供体质粒pv4。
57.更加具体的,步骤(a2)中,以所述供体质粒pv4为模板,用引物n20-b-f1(见表2)和引物n20-b-r1(见表2)反向pcr扩增,得到dna片段i’(4.1kb左右的pcr产物);以所述供体质粒pv4为模板,用引物gcvp-n20-b-f2(见表2)和引物n20-b-r2(见表2)进行pcr扩增,得到dna片段ii’(400bp左右的pcr产物);以所述受体大肠杆菌的基因组dna为模板,用引物gcvp-f1(见表2)和引物gcvp-r1(见表2)进行pcr扩增,获得dna片段iii’(上游同源臂片段);以所述受体大肠杆菌的基因组dna为模板,用引物gcvp-f2(见表2)和引物gcvp-r2(见表2)获得dna片段iv’(下游同源臂片段);将所述dna片段i’、所述dna片段ii’、所述dna片段iii’和所述dna片段iv’用golden gate技术策略进行组装,得到所述pv4-del-gcvp质粒。
58.在本发明的具体实施方式中,步骤(a3)中,所述“以所述工程菌2为出发菌株,敲除基因组中苹果酸合成酶编码基因(aceb基因)”是通过包括如下步骤的方法实现的:(b1)同上述步骤(a1),得到所述供体质粒pv4;(b2)在所述供体质粒pv4的基础上构建用于敲除aceb基因的pv4-del-aceb质粒,该质粒含有针对苹果酶合成酶编码基因(aceb基因)的aceb-n20-grna序列和敲除苹果酸合成酶编码基因(aceb基因)的上下游同源臂序列;(b3)将所述pv4-del-aceb质粒和predcas9质粒共同转化所述出发菌株(所述工程菌2),从而实现敲除所述工程菌2基因组中的苹果酸合成酶编码基因(aceb基因)。
59.更加具体的,步骤(b2)中,以所述供体质粒pv4为模板,用引物n20-b-f1(见表2)和引物n20-b-r1(见表2)反向pcr扩增,得到dna片段i’(4.1kb左右的pcr产物);以所述供体质粒pv4为模板,用引物aceb-n20-b-f2(见表2)和引物n20-b-r2(见表2)进行pcr扩增,得到dna片段ii’(400bp左右的pcr产物);以所述受体大肠杆菌的基因组dna为模板,用引物aceb-f1(见表2)和引物aceb-r1(见表2)进行pcr扩增,获得dna片段iii’(上游同源臂片段);以所述受体大肠杆菌的基因组dna为模板,用引物aceb-f2(见表2)和引物aceb-r2(见
表2)获得dna片段iv’(下游同源臂片段);将所述dna片段i’、所述dna片段ii’、所述dna片段iii’和所述dna片段iv’用golden gate技术策略进行组装,得到所述pv4-del-aceb质粒。
60.在本发明的具体实施方式中,步骤(a4)中,所述“以所述工程菌3为出发菌株,敲除基因组中iclr基因”是通过包括如下步骤的方法实现的:(c1)同上述步骤(a1),得到所述供体质粒pv4;(c2)在所述供体质粒pv4的基础上构建用于敲除转录抑制蛋白编码基因(iclr基因)的pv4-del-iclr质粒,该质粒含有针对转录抑制蛋白编码基因(iclr基因)的iclr-n20-grna序列和敲除转录抑制蛋白编码基因(iclr基因)的上下游同源臂序列;(c3)将所述pv4-del-iclr质粒和predcas9质粒共同转化所述出发菌株(所述工程菌3),从而实现敲除所述工程菌3基因组中的iclr基因。
61.更加具体的,步骤(c2)中,以所述供体质粒pv4为模板,用引物n20-b-f1(见表2)和引物n20-b-r1(见表2)反向pcr扩增,得到dna片段i’(4.1kb左右的pcr产物);以所述供体质粒pv4为模板,用引物iclr-n20-b-f2(见表2)和引物n20-b-r2(见表2)进行pcr扩增,得到dna片段ii’(400bp左右的pcr产物);以所述受体大肠杆菌的基因组dna为模板,用引物iclr-f1(见表2)和引物iclr-r1(见表2)进行pcr扩增,获得dna片段iii’(上游同源臂片段);以所述受体大肠杆菌的基因组dna为模板,用引物iclr-f2(见表2)和引物iclr-r2(见表2)获得dna片段iv’(下游同源臂片段);将所述dna片段i’、所述dna片段ii’、所述dna片段iii’和所述dna片段iv’用golden gate技术策略进行组装,得到所述pv4-del-iclr质粒。
62.在本发明的具体实施方式中,步骤(a5)中,所述“以所述工程菌4为出发菌株,将m1-93启动子整合于基因组中异柠檬酸裂解酶编码基因(acea基因)起始密码子前”是通过包括如下步骤的方法实现的:(d1)以pxz-cs质粒为模板,使用引物acea-cat-up(见表2)和引物acea-sacb-down(见表2)进行pcr扩增,得到同源重组的cat-sacb片段i,并将其整合于所述工程菌3基因组中acea基因的atg前;(d2)以重组大肠杆菌m1-93的基因组dna为模板,用引物acea-p-up(见表2)和引物lacea-rbs-down(见表2)进行pcr扩增,得到同源重组的dna启动子片段ii,进行第二次同源重组,替换异柠檬酸裂解酶编码基因(acea基因)前的cat-sacb。
63.第二方面,本发明要求保护利用前文第一方面所述方法构建得到的大肠杆菌工程菌株。
64.第三方面,本发明要求保护如下任一应用:
65.(b1)第二方面所述大肠杆菌工程菌株在生产甘氨酸中的应用。
66.(b2)前文所述的a1)-a7)所示7种来源中任一种的乙醛酸氨化酶或其相关生物材料在构建前文所述大肠杆菌工程菌株中的应用。
67.(b3)前文所述的a1)-a7)所示7种来源中任一种的乙醛酸氨化酶或其相关生物材料在生产甘氨酸中的应用。
68.其中,所述相关生物材料可为前文所述a1)-a7)所示7种来源中任一种的乙醛酸氨化酶的编码基因,或含有所述编码基因的表达盒或重组载体或重组菌或转基因细胞系。
69.所述表达盒是指能够在宿主细胞中表达所述乙醛酸氨化酶的dna,该dna不但包括启动所述乙醛酸氨化酶的编码基因转录的启动子,还可包括终止转录的终止子。进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子,组织特异型启动子和诱导型启动子。可用于本发明的增强子可包括翻译增强子或转录增强子,
这些增强子区域可以是atg起始密码子或邻接区域起始密码子等。翻译控制信号的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。
70.为了便于对转基因细胞系或者重组菌进行鉴定及筛选,可对所用重组载体进行加工,如加入可在宿主细胞中表达的编码可产生颜色变化的酶或发光化合物的基因(萤光素酶基因等)、具有抗性的抗生素标记物(庆大霉素标记物、卡那霉素标记物等)等。
71.所述重组载体可为细菌质粒、噬菌体、酵母质粒或逆转录病毒包装质粒等。
72.所述重组菌可为原核细胞或低等真核细胞。
73.具体地,所述原核细胞可为细菌;所述低等真核细胞可为酵母细胞。
74.更加具体地,所述细菌可为大肠杆菌。
75.第四方面,本发明要求保护一种生产甘氨酸的方法。
76.本发明所要求保护的生产甘氨酸的方法,可为如下任一:
77.(c1)一种通过发酵生产甘氨酸的方法,可包括如下步骤:对前文第二方面所述的大肠杆菌工程菌株进行发酵培养,从发酵产物中获得甘氨酸。
78.进一步地,进行所述发酵培养时使用的发酵培养基为含5g/l葡萄糖和100mm(nh4)2so4的无机盐培养基nbs。
79.更进一步地,所述发酵培养基的配方如下:每1l中含有葡萄糖5g,(nh4)2so
4 13.2g、kh2po
4 3.5g、k2hpo
4 6.55g、(nh4)2hpo
4 3.5g、mgso4·
7h2o 0.12g、甜菜碱-kcl0.15g。fecl3·
6h2o 1.5μg、cocl2·
6h2o 0.1μg、cucl2·
2h2o 0.1μg、zncl
2 0.1μg、na2moo4·
2h2o 0.1μg、mncl2·
4h2o 0.2μg、h3bo
3 0.05μg;余量为水。
80.进一步地,所述发酵培养的条件可为37℃、250r/min培养3天。
81.(c2)一种体外催化生产甘氨酸的方法,可包括如下步骤:以前文所述的a1)-a7)所示7种来源中任一种的乙醛酸氨化酶体外催化乙醛酸和铵根离子反应生成甘氨酸。
82.所述乙醛酸氨化酶可以粗酶液、粗酶液冻干粉、纯酶或细胞的形式发挥催化作用。
83.其中,所述粗酶液、粗酶液冻干粉和纯酶均可按照包括如下步骤的方法制备得到:培养能够表达所述乙醛酸氨化酶的重组工程菌或天然菌,经诱导表达后,裂解菌体获得所述粗酶液、粗酶液冻干粉或纯酶。
84.在本发明中,所述重组工程菌为将含有所述乙醛酸氨化酶的编码基因的重组载体导入大肠杆菌后所得。其中,所述重组载体为将所述编码基因克隆到pet30a载体的多克隆位点处后得到的重组质粒。
85.在本发明中,所述诱导表达为终浓度为0.1mm的iptg、37℃诱导表达。
86.在以上所述乙醛酸氨化酶体外催化乙醛酸和铵根离子反应生成甘氨酸的过程中,反应体系的ph为7.0;反应体系中还含有磷酸钾缓冲液、nadph。
87.在本发明的具体实施方式中,所用的反应缓冲液组成具体如下:40mm磷酸钾缓冲液、400mm硫酸铵、0.2mm nadph、50mm乙醛酸钠;ph7.0。
88.在本发明中,所述“乙醛酸氨化酶”是指催化乙醛酸和氨还原为甘氨酸反应的酶。
89.在本发明中,所述甘氨酸脱羧酶(glycine decarboxylase)是指能催化甘氨酸使之脱羧降解为二氧化碳和氨的酶。
90.在本发明中,所述苹果酸合成酶(malate synthase)是指能催化乙醛酸和酰基辅
酶a聚合生成苹果酸的酶。
91.在本发明中,所述转录抑制蛋白(transcriptional repressor)是指参与操纵子acebak(分别编码苹果酸酶,异柠檬酸裂解酶和异柠檬酸脱氢酶磷酸/磷酸化酶)表达的转录调控蛋白iclr。
92.在本发明中,所述异柠檬酸裂解酶(isocitrate lyase)是指催化异柠檬酸裂解成乙醛酸和柠檬酸的酶。
93.实验证明,本发明利用大肠杆菌原核表达得到的多种来源的乙醛酸氨化酶不仅能够体外催化乙醛酸和铵根离子生成甘氨酸,且本发明构建的大肠杆菌基因工程菌nz-gan005在摇瓶发酵中甘氨酸产量最高可达210mg/l。本发明开辟了利用生物法合成甘氨酸的先河。
附图说明
94.图1为甘氨酸生物合成反应。
95.图2为不同来源的乙醛酸氨化酶发酵产甘氨酸分析。来源av-ald:维氏气单胞菌aeromonas veronii,ba-ald:海水芽孢杆菌bacillus aquimaris,bc-ald:蜡样芽孢杆菌bacillus cereus,bf-ald:弯曲芽孢杆菌bacillus flexus,bl-ald:地衣芽孢杆菌bacillus licheniformis,bv-ald:贝莱斯芽孢杆菌bacillus velezensis,bs-ald:枯草芽孢杆菌bacillus substilis,gs-ald:嗜热脂肪芽孢杆菌geobacillus stearothermophilus,hb-ald:玻利维亚盐单胞菌halomonas boliviensis,la-ald:团聚拉布伦茨氏菌labrenzia aggregata,lf-ald:赖氨酸芽孢杆菌lysinibacillus fusiformis,pa-ald:铜绿假单胞菌pseudomonas aeruginosa,pg-ald:少盐芽孢杆菌paucisalibacillus globuius,ms-ald:耻垢分枝杆菌mycobacterium smegmatis,mt-ald:结核分支杆菌mycobacterium tuberculosis。大肠杆菌atcc 8739为对照菌株。纵坐标表示每升发酵液中甘氨酸产量。
96.图3为重组大肠杆菌nz-gan001、nz-gan002、nz-gan003、nz-gan004、nz-gan005发酵结果。纵坐标表示每升发酵液中甘氨酸产量。
具体实施方式
97.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
98.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
99.本发明中的甘氨酸生物合成反应如图1所示。本发明所用的菌株和质粒如表1所示,所用的引物如表2所示。
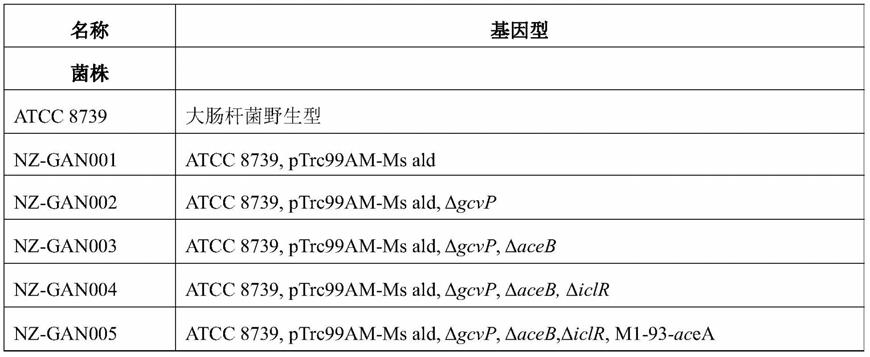
100.表1本发明中所用的菌株与质粒
101.[0102][0103]
表2本发明所用的引物
[0104]
[0105][0106]
实施例1、乙醛酸氨化酶基因全基因合成于表达质粒上
[0107]
将来源于维氏气单胞菌aeromonas veronii,海水芽孢杆菌bacillus aquimaris,蜡样芽孢杆菌bacillus cereus,弯曲芽孢杆菌bacillus flexus,地衣芽孢杆菌bacillus licheniformis,贝莱斯芽孢杆菌bacillus velezensis,枯草芽孢杆菌bacillus substilis,嗜热脂肪芽孢杆菌geobacillus stearothermophilus,玻利维亚盐单胞菌halomonas boliviensis,团聚拉布伦茨氏菌labrenzia aggregata,赖氨酸芽孢杆菌lysinibacillus fusiformis,铜绿假单胞菌pseudomonas aeruginosa,少盐芽孢杆菌
paucisalibacillus globuius,耻垢分枝杆菌mycobacterium smegmatis,结核分支杆菌mycobacterium tuberculosis的乙醛酸氨化酶基因ald(去除终止密码子)分别合成于pet30a( )(金斯瑞公司)的ndei和xhoi之间上,经测序验证正确后依次得到相应的质粒pet30a-av ald,pet30a-ba ald,pet30a-bc ald,pet30a-bf ald,pet30a-bl ald,pet30a-bv ald,pet30a-bs ald,pet30a-gs ald,pet30a-hb ald,pet30a-la ald,pet30a-lf ald,pet30a-pa ald,pet30a-pg ald,pet30a-ms ald和pet30a-mt ald(表1)。将这些质粒分别转化至表达菌bl21中,得到相应的菌株av,ba,bc,bf,bl,bv,bs,gs,hb,la,lf,pa,pg,ms和mt。
[0108]
其中,来源于维氏气单胞菌aeromonas veronii的乙醛酸氨化酶的氨基酸序列如seq id no.1所示,对应的编码基因序列如seq id no.8所示;来源于海水芽孢杆菌bacillus aquimaris的乙醛酸氨化酶的氨基酸序列如seq id no.2所示,对应的编码基因序列如seq id no.9所示;来源于蜡样芽孢杆菌bacillus cereus的乙醛酸氨化酶的氨基酸序列如genbank号qcx92624.1所示,对应的编码基因序列如genbank号cp034551.1所示;来源于弯曲芽孢杆菌bacillus flexus的乙醛酸氨化酶的氨基酸序列如genbank号qcs51333.1所示,对应的编码基因序列如genbank号cp040367.1所示;来源于地衣芽孢杆菌bacillus licheniformis的乙醛酸氨化酶的氨基酸序列如genbank号wp_061578175.1所示,对应的编码基因序列如genbank号cp042252.1所示;来源于贝莱斯芽孢杆菌bacillus velezensis的乙醛酸氨化酶的氨基酸序列如genbank号qkx13377.1所示,对应的编码基因序列如genbank号cp055160.1所示;来源于枯草芽孢杆菌bacillus substilis的乙醛酸氨化酶的氨基酸序列如genbank号qjr47777.1所示,对应的编码基因序列如genbank号cp053102.1所示;来源于嗜热脂肪芽孢杆菌geobacillus stearothermophilus的乙醛酸氨化酶的氨基酸序列如genbank号abm69270.1所示,对应的编码基因序列如genbank号ef154460所示;来源于玻利维亚盐单胞菌halomonas boliviensis的乙醛酸氨化酶的氨基酸序列如seq id no.3所示,对应的编码基因序列如seq id no.10所示;来源于团聚拉布伦茨氏菌labrenzia aggregata的乙醛酸氨化酶的氨基酸序列如seq id no.4所示,对应的编码基因序列如seq id no.11所示;来源于赖氨酸芽孢杆菌lysinibacillus fusiformis的乙醛酸氨化酶的氨基酸序列如genbank号ajk86806.1所示,对应的编码基因序列如genbank号cp010820.1所示;来源于铜绿假单胞菌pseudomonas aeruginosa的乙醛酸氨化酶的氨基酸序列如genbank号qks42302.1所示,对应的编码基因序列如genbank号cp034908.2所示;来源于少盐芽孢杆菌paucisalibacillus globuius的乙醛酸氨化酶的氨基酸序列如seq id no.5所示,对应的编码基因序列如seq id no.12所示;来源于耻垢分枝杆菌mycobacterium smegmatis的乙醛酸氨化酶的乙醛酸氨化酶的氨基酸序列如seq id no.6所示,对应的编码基因序列如seq id no.13所示;结核分支杆菌mycobacterium tuberculosis的乙醛酸氨化酶的氨基酸序列如seq id no.7所示,对应的编码基因序列如seq id no.14所示。
[0109]
实施例2、乙醛酸氨化酶酶活分析
[0110]
对实施例1获得的不同来源的乙醛酸氨化酶表达菌株av,ba,bc,bf,bv,bl,bs,gs,hb,la,lf,pa,pg,ms,mt进行乙醛酸氨化酶(ald)的酶活分析。
[0111]
接种菌株的单克隆于lb液体培养基(卡那霉素终浓度为50mg/l)中,37℃,250rpm
培养至od550=0.1,加入诱导剂iptg,终浓度为0.1mm,继续培养至对数期。取30ml培养液于50ml离心管中,在4℃下10,000rpm离心5min,弃去上清液,收集菌体,用15ml 100mm tris-hcl buffer洗涤2次后,将菌体悬浮3ml 100mm tris-hcl,冰浴超声破碎(功率:25w;开:1s;关:3s)破碎3-5min至澄清,4℃下10,000rpm离心20min,收集上清。用镍柱(ge healthcare公司,瑞典)进行乙醛酸氨化酶蛋白纯化(具体步骤按说明书进行)。用10k超滤管(amicon公司,爱尔兰)进行乙醛酸氨化酶的浓缩和清洗。最后,用bradford试剂(bio-rad公司,美国)进行乙醛酸氨化酶纯酶定量。
[0112]
乙醛酸氨化酶(ec:1.4.1.1)酶活(usha,v.,jayaraman,r.,toro,j.c.,hoffner,s.e.,das,k.s.,2002.glycine and alanine dehydrogenase activities are catalyzed by the same protein in mycobacterium smegmatis:upregulation of both activities under microaerophilic adaptation.can j microbiol.48,7-13)检测反应体系为:反应缓冲液990μl(40mm磷酸钾缓冲液、400mm硫酸铵、0.2mm nadph、50mm乙醛酸钠;ph7.0),加入10μl乙醛酸氨化酶纯酶,混匀后置于比色皿中,记录a340的变化情况。空白对照为反应缓冲液加入10μl的ddh2o。nadph在340nm处的消光系数为6.22cm
–1mm
–1。酶活力单位(u)定义为:每分钟每mg蛋白消耗1μmol的nadph所需酶量(室温,ph7.0)。
[0113]
不同来源的乙醛酸氨化酶纯酶的酶活结果见表3。
[0114]
表3乙醛酸氨化酶酶活分析及甘氨酸分析
[0115][0116][0117]
注:体外催化一栏指的是每升反应体系中生成的甘氨酸的质量,发酵一栏指的是每升发酵液中含有的甘氨酸的质量。
[0118]
实施例3、乙醛酸氨化酶(ald)体外催化产甘氨酸
[0119]
将实施例2获得的不同来源的乙醛酸氨化酶纯酶进行体外催化,测定甘氨酸合成产量。
[0120]
乙醛酸氨化酶体外催化产甘氨酸反应体系为:1.5ml离心管,加入反应缓冲液990μl(40mm磷酸钾缓冲液、400mm硫酸铵、0.2mm nadph、50mm乙醛酸钠;ph7.0),加入10μl 3u乙
醛酸氨化酶纯酶,反应10min,在氨基酸分析仪上(日立全自动氨基酸分析仪l-8900)进行氨基酸分析检测甘氨酸的产量。
[0121]
将不同来源的乙醛酸氨化酶纯酶进行体外催化,均能实现体外产甘氨酸的能力。来源于维氏气单胞菌a.veronii,海水芽孢杆菌b.aquimaris,蜡样芽孢杆菌b.cereus,弯曲芽孢杆菌b.flexus,地衣芽孢杆菌b.licheniformis,贝莱斯芽孢杆菌b.velezensis,枯草芽孢杆菌b.substilis,嗜热脂肪芽孢杆菌g.stearothermophilus,玻利维亚盐单胞菌h.boliviensis,团聚拉布伦茨氏菌l.aggregata,赖氨酸芽孢杆菌l.fusiformis,铜绿假单胞菌p.aeruginosa,少盐芽孢杆菌p.globuius,耻垢分枝杆菌m.smegmatis,结核分支杆菌m.tuberculosis的乙醛酸氨化酶体外催化产甘氨酸分别为:20,45,36,5,4,2,3,46,41,38,26,33,31,75和55mg/l(表3)。
[0122]
实施例4、直接发酵法产甘氨酸
[0123]
将来源于维氏气单胞菌a.veronii,海水芽孢杆菌b.aquimaris,蜡样芽孢杆菌b.cereus,弯曲芽孢杆菌b.flexus,地衣芽孢杆菌b.licheniformis,贝莱斯芽孢杆菌b.velezensis,枯草芽孢杆菌b.substilis,嗜热脂肪芽孢杆菌g.stearothermophilus,玻利维亚盐单胞菌h.boliviensis,团聚拉布伦茨氏菌l.aggregata,赖氨酸芽孢杆菌l.fusiformis,铜绿假单胞菌p.aeruginosa,少盐芽孢杆菌p.globuius,耻垢分枝杆菌m.smegmatis,结核分支杆菌m.tuberculosis的乙醛酸氨化酶基因(ald)从相应的pet30a-ald上克隆至ptrc99a-m(参考文献:“zhao j,li q,sun t,zhu x,xu h,tang j,zhang x,ma y(2013).engineering central metabolic modules of escherichia coli for improvingβ-carotene production.metabeng 17:42-50”)的sali和kpni位点上,得到相应质粒ptrc99am-av ald,ptrc99am-ba ald,ptrc99am-bc ald,ptrc99am-bf ald,ptrc99am-bv ald,ptrc99am-bl ald,ptrc99am-bs ald,ptrc99am-gs-ald,ptrc99am-hb ald,ptrc99am-la ald,ptrc99am-lf ald,ptrc99am-pa ald,ptrc99am-pg ald,ptrc99am-ms ald和ptrc99am-mt ald。
[0124]
将这些质粒转化至大肠杆菌atcc 8739(gunsalus ic,hand db(1941)the use of bacteria in the chemical determination of total vitamin c.j biolchem 141:853-858.)电转化感受态细胞中。涂布氨苄平板(终浓度50mg/l)。得到的单克隆进行发酵分析。发酵的培养基如下:
[0125]
种子培养基为lb:每1l中含胰蛋白胨10g,酵母粉5g,nacl 10g;余量为水。灭菌后加氨苄青霉素(终浓度为50mg/l)。
[0126]
1l nbs发酵培养基:葡萄糖5g、(nh4)2so
4 13.2g、kh2po
4 3.5g、k2hpo
4 6.55g、(nh4)2hpo
4 3.5g、mgso4·
7h2o 0.12g、和甜菜碱-kcl 0.15g。fecl3·
6h2o 1.5μg、cocl2·
6h2o 0.1μg、cucl2·
2h2o 0.1μg、zncl
2 0.1μg、na2moo4·
2h2o 0.1μg、mncl2·
4h2o 0.2μg,h3bo
3 0.05μg;余量为水。
[0127]
将抗生素平板上的单克隆转接于20ml lb液体培养基中(终浓度50ml/l的氨苄抗生素),37℃、250r/min培养10-12h,获得摇瓶发酵种子液。离心收集20od的种子液,重悬于10ml nbs培养基中,37℃、250r/min培养3天。
[0128]
取样离心,上清用氨基酸分析仪(日立全自动氨基酸分析仪l-8900)甘氨酸产量。发酵结果如图2所示,对照菌株大肠杆菌atcc 8739的产量为0,含有维氏气单胞菌
a.veronii,海水芽孢杆菌b.aquimaris,蜡样芽孢杆菌b.cereus,弯曲芽孢杆菌b.flexus,地衣芽孢杆菌b.licheniformis,贝莱斯芽孢杆菌b.velezensis,枯草芽孢杆菌b.substilis,嗜热脂肪芽孢杆菌g.stearothermophilus,玻利维亚盐单胞菌h.boliviensis,团聚拉布伦茨氏菌l.aggregata,赖氨酸芽孢杆菌l.fusiformis,铜绿假单胞菌p.aeruginosa,少盐芽孢杆菌p.globuius,耻垢分枝杆菌m.smegmatis,结核分支杆菌m.tuberculosis乙醛酸氨化酶基因(ald)的工程菌株对应的甘氨酸产量分别为:4.8,5.7,4.3,1.7,0.8,1.5,1.4,2.5,5.6,4.8,1.8,3.2,6.8,9.4,6.8mg/l(表2,图2)。甘氨酸产量在4.8mg/l以上的有7组,对应的乙醛酸氨化酶分别是:来源于耻垢分枝杆菌的氨基酸序列如seq id no.6所示的乙醛酸氨化酶(对应编码基因为seq id no.13),来源于少盐芽孢杆菌的氨基酸序列如seq id no.5所示的乙醛酸氨化酶(对应编码基因为seq id no.12),来源于结核分支杆菌的氨基酸序列如seq id no.7所示的乙醛酸氨化酶(对应编码基因为seq id no.14),来源于海水芽孢杆菌的氨基酸序列如seq id no.2所示的乙醛酸氨化酶(对应编码基因为seq id no.9),来源于玻利维亚盐单胞菌的氨基酸序列如seq id no.3所示的乙醛酸氨化酶(对应编码基因为seq id no.10),来源于维氏气单胞菌的氨基酸序列如seq id no.1所示的乙醛酸氨化酶(对应编码基因为seq id no.8),来源于团聚拉布伦茨氏菌的氨基酸序列如seq id no.4所示的乙醛酸氨化酶(对应编码基因为seq id no.11)。其中,来源于耻垢分枝杆菌m.smegmatis的ald产量最高,为9.4mg/l,将此大肠杆菌工程菌株命名为nz-gan001。
[0129]
实施例5、nz-gan002菌株的构建
[0130]
从大肠杆菌nz-gan001出发,采用crispr/cas9双质粒基因编辑系统敲除甘氨酸脱羧酶编码基因(gcvp基因,gene id:6064873),获得重组大肠杆菌nz-gan002(表1)。
[0131]
(1)供体质粒pv4的构建
[0132]
供体质粒pv4在predcas9的作用下具有自剪切功能,是在供体质粒placz(仇焕娜,赵东东,满淑丽,毕昌昊,朱欣娜,张学礼(2018)大肠杆菌染色体上严谨型启动子的构建.微生物学通报,45(8):1693-1704.)的基础上添加了laci基因和针对自身质粒cat基因的n20-grna序列,具体构建过程如下:
[0133]
第一步,获得骨架dna片段i。以placz质粒为模板,使用引物bone-f和bone-r(表2)进行pcr扩增,得到6.6kb左右的pcr产物,即为骨架dna片段i,含有cat、p15a和lacz基因。
[0134]
扩增体系为:new england biolabs phusion 5x缓冲液10μl、dntp(每种dntp各2.5mm)1μl、dna模板20ng、引物(10μm)各2μl、phusion high-fidelity dna聚合酶(2.5u/μl)0.5μl、蒸馏水33.5μl,总体积为50μl。
[0135]
扩增条件为:98℃预变性2分钟(1个循环);98℃变性10秒、56℃退火10秒、72℃延伸2.5分钟(30个循环);72℃延伸5分钟(1个循环)。
[0136]
第二步,获得laci基因及ptrc启动子片段ii。以pacyc184-m质粒(zhao j,li q,sun t,zhu x,xu h,tang j,zhang x,ma y(2013).engineering central metabolic modules of escherichia coli for improvingβ-carotene production.metabeng 17:42-50.)为模板,使用引物laci-ptrc-up和laci-ptrc-down(表2)进行pcr扩增,得到1.5kb左右的pcr产物,即为dna片段ii。扩增体系和扩增条件参考上文中的第一步。
[0137]
第三步,获得cat-n20-grna片段iii。以placz质粒为模板,用引物cat-n20-up和
cat-n20-down(表2)进行pcr扩增,得到400bp左右的pcr产物,即为dna片段iii。扩增体系和扩增条件参考上文中的第一步。
[0138]
第四步,将骨架dna片段i、laci和ptrc启动子片段ii和cat-n20-grna片段iii用golden gate技术策略(engler c,kandzia r,marillonnet s(2008)a one pot,one step,precision cloning method with high throughput capability.plos one 3,e3647.)进行组装,转化感受态细胞transt1(北京全式金生物技术公司)。得到的克隆用引物v4-laci-yz-up和cat-yz-down(表2)进行pcr验证,条带大小为1.7kb,阳性克隆提取质粒dna送样测序分析,得到正确的pv4质粒,该质粒添加了laci-ptrc-cat-n20-grna元件,因此具有自剪切功能。
[0139]
(2)甘氨酸脱羧酶编码基因(gcvp基因)敲除质粒pv4-del-gcvp的构建
[0140]
在pv4质粒基础上构建gcvp基因敲除质粒pv4-del-gcvp,该质粒含有针对gcvp基因的gcvp-n20-grna序列和敲除gcvp基因的上下游同源臂序列。具体步骤如下:
[0141]
第一步,获得pv4质粒骨架片段i。以pv4质粒为模板,用引物n20-b-f1和n20-b-r1(表2)反向pcr扩增,得到4.1kb左右的pcr产物,即为pv4质粒骨架片段i。该片段含有cat、p15a和自剪切元件laci-ptrc-cat-n20-grna。扩增体系和扩增条件参考步骤(1)中的第一步。
[0142]
第二步,获得gcvp-n20-grna序列片段ii。以pv4质粒为模板,用引物gcvp-n20-b-f2和n20-b-r2(表2)进行pcr扩增,得到400bp左右的pcr产物,即为dna片段ii。扩增体系和扩增条件参考步骤(1)中的第一步。
[0143]
第三步,获得gcvp基因的上下游同源臂片段iii和片段iv。以大肠杆菌atcc 8739(gunsalus ic,hand db(1941)the use of bacteria in the chemical determination of total vitamin c.j biolchem 141:853-858.)的基因组dna为模板,用引物gcvp-f1和glya-r1(表2)进行pcr扩增,获得上游同源臂片段iii,约500bp。同理,用引物gcvp-f2和gcvp-r2(表2)获得下游同源臂片段iv,约500bp。扩增体系和扩增条件参考步骤(1)中的第一步。
[0144]
第四步,将pv4质粒骨架片段i、gcvp-n20-grna序列片段ii和gcvp基因的上下游同源臂片段iii和片段iv用golden gate技术策略进行组装,转化化转感受态细胞transt1(北京全式金生物技术公司)。得到的克隆用引物p15a-up和gcvp-r2(表2)进行pcr验证,条带大小为1.3kb,阳性克隆提取质粒dna送样测序分析,得到正确的pv4-del-gcvp质粒。
[0145]
(3)敲除甘氨酸脱羧酶编码基因(gcvp基因)
[0146]
从大肠杆菌nz-gan001出发,制备电转化感受态细胞,将质粒predcas9(zhu,x.,zhao,d.,qiu,h.,fan,f.,man,s.,bi,c.,zhang,x.,2017.the crispr/cas9-facilitated multiplex pathway optimization(cfpo)technique and its application to improve the escherichia coli xylose utilization pathway.metab.eng.43,37-45)和pv4-del-gcvp同时转化到nz-gan001电转化感受态细胞,涂卡纳霉素和氯霉素双抗平板,置于30℃过夜培养。挑取单克隆于2ml lb(含卡纳霉素和氯霉素;2.5%l( )-阿拉伯糖),250r/min转速,30℃过夜诱导同源重组和切割未发生重组的dna。稀释涂lb平板(含卡纳霉素和氯霉素,2.5%l( )-阿拉伯糖),30℃过夜培养。挑取10个单克隆进行菌落pcr验证,引物为gcvp-del-yz-up和gcvp-del-yz-down(表2),大小约1kb。阳性克隆经最终测序验证正确后命名为
coli succinate production.biotechnology for biofuels,9.;chen j,zhu x,tan z,xu h,tang j,xiao d,zhang x(2014).activating c4-dicarboxylate transporters dcub and dcuc for improving succinateproduction.applmicrobiolbiotechnol,98(5),2197-2205.)。以pxz-cs质粒(tan,z.,zhu,x.,chen,j.,li,q.,zhang,x.,2013.activating phosphoenolpyruvate carboxylase and phosphoenolpyruvate carboxykinase in combination for improvement of succinate production.appl.environ.microbiol.79,4838-4844.)为模板,使用引物acea-cat-up/acea-sacb-down(表2)进行pcr扩增,得到同源重组的cat-sacb片段i,并将其整合于acea基因的atg前。以重组大肠杆菌m1-93(lu j,tang j,liu y,zhu x,zhang t,zhang x(2012)combinatorial modulation of galp and glk gene expression for improved alternative glucose utilization.appl microbiol biotechnol 93:2455-2426.)的基因组dna为模板,用引物acea-p-up/acea-rbs-down(表2)扩增,得到同源重组的dna启动子片段ii,进行第二次同源重组,替换异柠檬酸裂解酶编码基因(acea基因)前的cat-sacb,从而实现m1-93调控acea的表达。用引物ap1-up/acea-yz-down200(表2)进行pcr验证。验证正确的重组菌株经最终测序验证正确(将m1-93启动子插入到了大肠杆菌基因组中acea基因atg前)后命名为nz-gan005(表1)。
[0166]
实施例9、重组大肠杆菌nz-gan001、nz-gan002、nz-gan003、nz-gan004、nz-gan005发酵
[0167]
使用实施例3的方法对重组大肠杆菌nz-gan001、nz-gan002、nz-gan003、nz-gan004、nz-gan005进行产甘氨酸分析评价。
[0168]
结果分析(见图3):随着菌株的改造,敲除乙醛酸的旁支代谢途径aceb、iclr和强启动子m1-93替换增加acea的表达,大肠杆菌重组菌株的甘氨酸产量逐渐增加,相对于nz-gan001的产量为9.4mg/l,nz-gan002、nz-gan003、nz-gan004和nz-gan005的产量分别为10,58,122和210mg/l。其中,重组大肠杆菌nz-gan005的产量是出发菌株的22倍。
[0169]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。