一种(2
‑
溴乙炔基)苯类化合物的制备方法
技术领域
1.本发明属于有机合成技术领域,具体涉及一种(2
‑
溴乙炔基)苯类化合物的制备方法。
背景技术:
2.(2
‑
溴乙炔基)苯是一类重要的有机合成中间体,可以用于α
‑
溴代芳基乙酮、顺式1,2
‑
二卤代烯烃、1,4
‑
二芳基
‑
1,3
‑
丁二炔、炔基格氏试剂、炔基锌试剂等的制备。现有制备(2
‑
溴乙炔基)苯的方法主要包括苯乙炔与nbs、n,n
‑
二溴对甲苯磺酰胺等溴化试剂的反应(acs.catal.,2011,1,601
‑
606;rsc adv., 2014,4,30046
‑
30049;tetrahedron,2016,72,4151
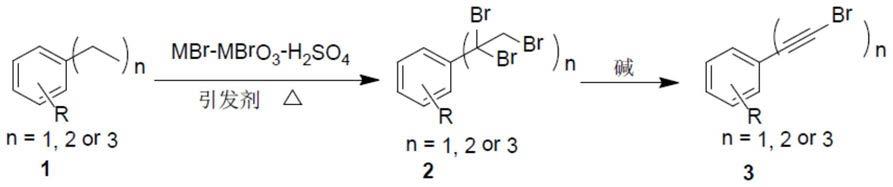
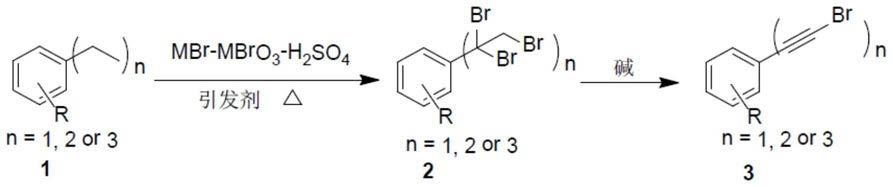
–
4158)、炔基硼化合物的脱硼溴代反应(tetrahedron,2012,68,3738
‑
3743;org.lett.,2010,41,700
‑
703; cheminform,2012,68,3738
‑
3743)、(2,2
‑
二溴乙烯基)苯的脱溴化氢反应(j.org. chem.,2014,79,3678
‑
3683)等。但是,现有方法具有原料难以获得、价格昂贵、制备操作复杂等缺陷。
技术实现要素:
3.基于现有技术中存在的上述缺点和不足,本发明的目的之一是至少解决现有技术中存在的上述问题之一或多个,换言之,本发明的目的之一是提供满足前述需求之一或多个的一种(2
‑
溴乙炔基)苯类化合物的制备方法。
4.为了达到上述发明目的,本发明采用以下技术方案:
5.一种(2
‑
溴乙炔基)苯类化合物的制备方法,包括以下步骤:
6.(1)在第一有机溶剂中,以溴酸盐、溴化盐及硫酸作为溴化试剂,并在引发剂的作用下,对乙基苯类化合物进行自由基溴代反应,得到(1,1,2
‑
三溴乙基)苯衍生物;
7.(2)在碱性溶液中,(1,1,2
‑
三溴乙基)苯衍生物进行消除反应,得到(2
‑ꢀ
溴乙炔基)苯类化合物;
8.其中,乙基苯类化合物的化学式为:其中,n为乙基的个数,取值为1、2或3;r为氢原子或取代基;
9.(1,1,2
‑
三溴乙基)苯衍生物的化学式为:
10.(2
‑
溴乙炔基)苯类化合物的化学式为:
11.作为优选方案,所述步骤(1)中,乙基苯类化合物、溴酸盐、溴化盐及硫酸的物质的量之比为1.0:(2.0~2.4)
×
n:(1.0~1.2)
×
n:(1.5~1.8)
×
n;
12.所述第一有机溶剂的体积与乙基苯类化合物的物质的量之比为1.6~4 ml/mmol;
13.所述引发剂的物质的量与乙基苯类化合物的物质的量之比为(0.04~0.12)
ꢀ×
n mol/mmol。
14.作为优选方案,所述步骤(1)中还加入水,水的体积与乙基苯类化合物的物质的量之比为1.5~5ml/mmol。
15.作为优选方案,所述第一有机溶剂为二氯甲烷、1,2
‑
二氯乙烷、四氯化碳中的一种或几种的混合。
16.作为优选方案,所述溴化物为溴化钠、溴化钾中的一种或两种的混合;所述溴酸盐为溴酸钠、溴酸钾中的一种或两种的混合。
17.作为优选方案,所述引发剂为偶氮二异庚腈、偶氮二异丁腈、过氧化二苯甲酰中的一种或几种的混合。
18.作为优选方案,所述碱性溶液为碱盐与第二有机溶剂的混合液。
19.作为优选方案,所述碱盐与(1,1,2
‑
三溴乙基)苯衍生物的物质的量之比为(2~4)
×
n:1;第二有机溶剂的体积与(1,1,2
‑
三溴乙基)苯衍生物的物质的量之比为1~8ml/mmol。
20.作为优选方案,所述碱盐为叔丁醇钾,所述第二有机溶剂为叔丁醇。
21.作为优选方案,所述取代基为硝基、卤素原子、苯甲酰基、叔丁基、cn 或co2ch3。
22.本发明与现有技术相比,有益效果是:
23.(1)本发明的(2
‑
溴乙炔基)苯类化合物的制备方法,采用两步法即可制得(2
‑
溴乙炔基)苯类化合物,工艺简单;
24.(2)反应选择性好,产品收率高;
25.(3)所有原料均为常用化学品,价廉易得,合成成本低;
26.(4)采取的操作均为常规操作,简单安全;
27.(5)消除反应所得副产物溴化钾,可以通过直接过滤的方式回收,并重新应用于(1,1,2
‑
三溴乙基)苯的制备;
28.(6)本发明的底物适用范围广。
附图说明
29.图1是本发明实施例的(2
‑
溴乙炔基)苯类化合物的制备方法的流程图。
具体实施方式
30.以下通过具体实施例对本发明的技术方案作进一步解释说明。
31.如图1所示,本发明从价廉易得的乙基苯类化合物1出发,以mbr
ꢀ‑
mbro3‑
h2so4(m=na or k)为溴化试剂,并在引发剂的作用下,通过自由基溴代反应制备得到(1,1,2
‑
三溴乙基)苯衍生物;然后在碱的作用下进行消除反应得到(2
‑
溴乙炔基)苯3。
32.其中,乙基苯类化合物的化学式为:其中,n为乙基的个数,取值为1、2或3;r为氢原子或取代基;
33.(1,1,2
‑
三溴乙基)苯衍生物的化学式为:
34.(2
‑
溴乙炔基)苯类化合物的化学式为:
35.本发明的(2
‑
溴乙炔基)苯类化合物的制备方法,具有原料价廉易得、操作简单安全、反应选择性好、产品收率高、三废排放少等优点。以下通过具体实施例进行示例说明:
36.实施例1:
37.本实施例的(2
‑
溴乙炔基)苯的制备方法,包括以下步骤:
38.(1)在25ml的三口烧瓶中分别加入乙基苯(3mmol),nabr(6.6 mmol),nabro3(3.3mmol),1,2
‑
二氯乙烷(3.5ml)和水(0.4ml),然后装上尾气吸收装置和回流冷凝管,搅拌加热至回流,滴加硫酸溶液(4.95 mmol)和偶氮二异丁腈溶液(0.12mmol aibn,1,2
‑
二氯乙烷为溶剂),滴加完成后,继续回流反应,用薄层色谱法跟踪检测,反应完全后,停止加热,并降至室温,加入饱和碳酸氢钠水溶液中和,用1,2
‑
二氯乙烷萃取水相,合并有机相,有机相用无水硫酸钠干燥、过滤,减压蒸馏回收溶剂,残余物经硅胶柱色谱纯化,得到中间体(1,1,2
‑
三溴乙基)苯,黄色油状物,产量1.01g,产率98%。
39.其中,中间体(1,1,2
‑
三溴乙基)苯的化学式为:核磁数据如下:
[0040]1h nmr(600mhz,cdcl3)δ7.76(d,j=7.8hz,2h),7.39(t,j=7.5hz, 2h),7.36(d,j=7.1hz,1h),4.66(s,2h);
13
c nmr(151mhz,cdcl3)δ141.1, 129.5,128.3,127.1,64.6,45.5.gc
‑
ms(ei):calcd for c8h7br2(m
‑
br):262.9. found:262.9。
[0041]
(2)一定温度下,将
t
buok(2.1mmol)、
t
buoh(3ml)、(1,1,2
‑
三溴乙基)苯(1.0mmol)加入到反应瓶中,35℃下搅拌反应,薄层色谱法跟踪,反应完成后,加入适量的水和乙酸乙酯,分液、并用乙酸乙酯萃取。合并有机相,用无水硫酸钠干燥,减压蒸馏除去溶剂,残留物通过柱层析法分离纯化,得到 (2
‑
溴乙炔基)苯,白色固体,产量177mg,收率98%。
[0042]
其中,(2
‑
溴乙炔基)苯的化学式为:核磁数据如下:
[0043]1h nmr(600mhz,cdcl3)δ7.47
–
7.46(m,1h),7.46(t,j=1.9hz,1h), 7.35
–
7.33(m,1h),7.33(dd,j=2.2,1.4hz,1h),7.32(dd,j=2.2,1.5hz, 1h);
13
c nmr(151mhz,
cdcl3)δ131.9,128.6,128.3,122.6,80.0,49.7。
[0044]
实施例2:
[0045]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0046]
以3mmol 1
‑
叔丁基
‑3‑
乙基苯为原料,其他步骤参照实施例1的步骤(1),得到中间体1
‑
(1,1,2
‑
三溴乙基)
‑3‑
叔丁基苯,无色油状物,产量0.92g,产率77%。
[0047]
其中,中间体1
‑
(1,1,2
‑
三溴乙基)
‑3‑
叔丁基苯的化学式为:核磁数据如下:
[0048]1h nmr(600mhz,cdcl3)δ7.80(t,j=2.0hz,1h),7.59
‑
7.58(m,1h), 7.40
‑
7.38(m,1h),7.32(t,j=7.8hz,1h),4.67(s,2h),1.37(s,9h);
13
c nmr (151mhz,cdcl3)δ151.3,140.9,128.1,126.7,124.6,124.4,65.6,45.7,35.0, 31.4。
[0049]
以1mmol 1
‑
(1,1,2
‑
三溴乙基)
‑3‑
叔丁基苯为原料,其他步骤参照实施例 1的步骤(2),得到产物1
‑
(2
‑
溴乙炔基)
‑3‑
叔丁基苯,无色油状物,产量 182mg,产率77%。
[0050]
其中,1
‑
(2
‑
溴乙炔基)
‑3‑
叔丁基苯的化学式为:核磁数据如下:
[0051]1h nmr(600mhz,cdcl3)δ7.53(s,1h),7.41(d,j=7.6hz,1h),7.29(dd, j=14.5,7.6hz,2h),1.34(s,9h).
13
c nmr(151mhz,cdcl3)δ151.2,129.0, 128.0,125.9,122.2,80.5,48.9,34.6,31.1。
[0052]
实施例3:
[0053]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0054]
以3mmol 1
‑
溴
‑4‑
乙基苯为原料,其他步骤参照实施例1的步骤(1),得到中间体1
‑
溴
‑4‑
(1,1,2
‑
三溴乙基)苯,无色油状物,产量1.09g,产率86%。
[0055]
其中,中间体1
‑
溴
‑4‑
(1,1,2
‑
三溴乙基)苯的化学式为:核磁数据如下:
[0056]
1h nmr(600mhz,cdcl3)δ7.62(d,j=8.8hz,2h),7.52(d,j=8.8hz, 2h),4.61(s,2h);13c nmr(151mhz,cdcl3)δ140.3,131.45,128.9,123.9, 63.1,45.2。
[0057]
以1mmol 1
‑
溴
‑4‑
(1,1,2
‑
三溴乙基)苯为原料,其他步骤参照实施例1的步骤(2),得到产物1
‑
溴
‑4‑
(2
‑
溴乙炔基)苯,白色固体,产量223mg,产率86%。
[0058]
其中,1
‑
溴
‑4‑
(2
‑
溴乙炔基)苯的化学式为:核磁数据如下:
[0059]
1h nmr(600mhz,cdcl3)δ7.37(d,j=8.3hz,2h),7.29(d,j=8.3hz, 2h);13c nmr
(151mhz,cdcl3)δ134.7,133.1,128.6,121.1,78.9,51.0。
[0060]
实施例4:
[0061]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0062]
以3mmol 1
‑
氯
‑4‑
乙基苯为原料,其他步骤参照实施例1的步骤(1),得到中间体1
‑
(1,1,2
‑
三溴乙基)
‑4‑
氯苯,无色油状物,产量0.98g,产率87%。
[0063]
其中,中间体1
‑
(1,1,2
‑
三溴乙基)
‑4‑
氯苯的化学式为:核磁数据如下:
[0064]1h nmr(600mhz,cdcl3)δ7.69(d,j=8.7hz,2h),7.36(d,j=8.7hz, 2h),4.61(s,2h);
13
c nmr(151mhz,cdcl3)δ139.7,135.6,128.6,128.4,63.1, 45.2。
[0065]
以1mmol 1
‑
(1,1,2
‑
三溴乙基)
‑4‑
氯苯为原料,其他步骤参照实施例1的步骤(2),得到产物1
‑
(2
‑
溴乙炔基)
‑4‑
氯苯,白色固体,产量211mg,产率98%。
[0066]
其中,2
‑
溴
‑1‑
(4
‑
氯苯基)乙酮的化学式为:核磁数据如下:
[0067]
1h nmr(600mhz,cdcl3)δ7.37(d,j=8.3hz,2h),7.29(d,j=8.3hz, 2h);13c nmr(151mhz,cdcl3)δ134.7,133.1,128.6,121.1,78.9,51.0。
[0068]
实施例5:
[0069]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0070]
以3mmol(4
‑
氯苯基)(4
‑
乙基苯基)甲酮为原料,其他步骤参照实施例 1的步骤(1),得到中间体(4
‑
氯苯基)[4
‑
(1,1,2
‑
三溴乙基)苯基]甲酮,白色固体,产量1.21g,产率84%。
[0071]
其中,中间体(4
‑
氯苯基)[4
‑
(1,1,2
‑
三溴乙基)苯基]甲酮的化学式为:核磁数据如下:
[0072]1h nmr(600mhz,cdcl3)δ7.88(d,j=8.6hz,2h),7.78(dd,j=8.5,6.9 hz,4h),7.48(d,j=8.5hz,2h),4.67(s,2h);
13
c nmr(151mhz,cdcl3)δ 194.2,145.1,139.3,137.9,135.2,131.4,129.7,128.8,127.4,62.8,44.9.hrms (esi)calcd for c
15
h
10
br3clnao(m na)
500.7859,found 500.7863。
[0073]
以1mmol(4
‑
氯苯基)[4
‑
(1,1,2
‑
三溴乙基)苯基]甲酮为原料,其他步骤参照实施例1的步骤(2),得到产物(4
‑
氯苯基)[4
‑
(2
‑
溴乙炔基)苯基]甲酮,白色固体,产量253mg,产率79%。
[0074]
其中,(4
‑
氯苯基)[4
‑
(2
‑
溴乙炔基)苯基]甲酮的化学式为:
核磁数据如下:
[0075]1h nmr(600mhz,cdcl3)δ7.74
–
7.72(m,4h),7.61
–
7.59(m,2h),7.48
ꢀ–
7.46(m,2h);
13
c nmr(151mhz,cdcl3)δ194.6,139.1,137.0,135.4,132.1, 131.3,129.7,128.7,126.5,82.6,58.7.c
15
h9brclo(m h)
318.9534,found318.9520。
[0076]
实施例6:
[0077]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0078]
以3mmol 1
‑
乙基
‑4‑
硝基苯为原料,其他步骤参照实施例1的步骤(1),得到中间体1
‑
(1,1,2
‑
三溴乙基)
‑4‑
硝基苯,黄色固体,产量0.52g,产率45%。
[0079]
其中,中间体1
‑
(1,1,2
‑
三溴乙基)
‑4‑
硝基苯的化学式为:核磁数据如下:
[0080]1h nmr(600mhz,cdcl3)δ8.26
–
8.23(m,2h),7.95
–
7.93(m,2h),4.64 (s,2h);
13
c nmr(151mhz,cdcl3)δ148.0,147.3,128.5,123.4,61.1,44.6. gc
‑
ms(ei):calcd for c8h6br2no2(m
‑
br):307.9.found:307.9。
[0081]
以1mmol 1
‑
(1,1,2
‑
三溴乙基)
‑4‑
硝基苯为原料,其他步骤参照实施例1 的步骤(2),得到产物1
‑
(2
‑
溴乙炔基)
‑4‑
硝基苯,黄色固体,产量215mg, 产率95%。
[0082]
其中,1
‑
(2
‑
溴乙炔基)
‑4‑
硝基苯的化学式为:核磁数据如下:
[0083]1h nmr(600mhz,cdcl3)δ8.18(d,j=7.7hz,2h),7.59(d,j=7.7hz, 2h);
13
c nmr(151mhz,cdcl3)δ147.3,132.8,129.4,123.5,78.4,56.3。
[0084]
实施例7:
[0085]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0086]
以3mmol 4
‑
乙基苯甲酸甲酯为原料,其他步骤参照实施例1的步骤(1),得到中间体4
‑
(1,1,2
‑
三溴乙基)苯甲酸甲酯,白色固体,产量0.96g,产率 80%。
[0087]
其中,中间体4
‑
(1,1,2
‑
三溴乙基)苯甲酸甲酯的化学式为:核磁数据如下:
[0088]1h nmr(600mhz,cdcl3)δ8.06
–
8.03(m,2h),7.84
–
7.81(m,2h),4.64 (s,2h),3.93(s,3h);
13
c nmr(151mhz,cdcl3)δ165.9,145.3,131.0,129.5, 127.3,63.0,52.3,45.1。
[0089]
以1mmol 4
‑
(1,1,2
‑
三溴乙基)苯甲酸甲酯为原料,其他步骤参照实施例 1的步骤(2),得到产物4
‑
(2
‑
溴乙炔基)苯甲酸,白色固体,产量202mg,产率90%。
[0090]
其中,4
‑
(2
‑
溴乙炔基)苯甲酸的化学式为:核磁数据如下:
[0091]1h nmr(600mhz,dmso
‑
d6)δ13.16(s,1h),7.92(d,j=8.2hz,2h),7.60 (d,j=8.2hz,2h);
13
c nmr(151mhz,dmso
‑
d6)δ167.1,132.4,131.4,129.9, 126.6,79.5,56.6。
[0092]
实施例8:
[0093]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0094]
以3mmol 4
‑
乙基苯甲腈为原料,其他步骤参照实施例1的步骤(1),得到中间体4
‑
(1,1,2
‑
三溴乙基)苯甲腈,白色固体,产量0.44g,产率40%。
[0095]
其中,中间体4
‑
(1,1,2
‑
三溴乙基)苯甲腈的化学式为:核磁数据如下:
[0096]1h nmr(600mhz,cdcl3)δ7.87(d,j=8.5hz,2h),7.69(d,j=8.5hz, 2h),4.62(s,2h);
13
c nmr(151mhz,cdcl3)δ145.5,132.1,128.1,117.7,113.3, 61.6,44.6.hrms(esi)calcd for c9h6br3nna(m na)
387.7933,found 387.7943。
[0097]
以1mmol 4
‑
(1,1,2
‑
三溴乙基)苯甲腈为原料,其他步骤参照实施例1的步骤(2),得到产物4
‑
(2
‑
溴乙炔基)苯甲酸,白色固体,产量131mg,产率58%。
[0098]
实施例9:
[0099]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0100]
以3mmol 1,4
‑
二乙基苯为原料,nabr、nabro3、h2so4和aibn用量分别为13.2mmol、6.6mmol、9.9mmol和0.24mmol,其他步骤参照实施例1 的步骤(1),得到中间体1,4
‑
二(1,1,2
‑
三溴乙基)苯,白色固体,产量1.64 g,产率90%。
[0101]
其中,中间体1,4
‑
二(1,1,2
‑
三溴乙基)苯的化学式为:核磁数据如下:
[0102]1h nmr(600mhz,cdcl3)δ7.76(s,4h),4.62(s,4h);
13
c nmr(151mhz, cdcl3)δ142.2,127.2,62.8,45.0。
[0103]
以1,4
‑
二(1,1,2
‑
三溴乙基)苯为原料,
t
buok和
t
buoh用量分别为4.1 mmol和6ml,其他步骤参照实施例1的步骤(2),得到产物1,4
‑
二(2
‑
溴乙炔基)苯,白色固体,产量247mg,产率87%。
[0104]
其中,1,4
‑
二(2
‑
溴乙炔基)苯的化学式为:核磁数据如下:
[0105]1h nmr(600mhz,cdcl3)δ7.38(s,4h);
13
c nmr(151mhz,cdcl3)δ 131.8,122.9,79.5,52.1。
[0106]
实施例10:
[0107]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0108]
以3mmol 1,3
‑
二乙基苯为原料,nabr、nabro3、h2so4和aibn用量分别为13.2mmol、6.6mmol、9.9mmol和0.24mmol,其他步骤参照实施例1 的步骤(1),得到中间体1,3
‑
二(1,1,2
‑
三溴乙基)苯,白色固体,产量1.27 g,产率70%。
[0109]
其中,中间体1,3
‑
二(1,1,2
‑
三溴乙基)苯的化学式为:核磁数据如下:
[0110]1h nmr(600mhz,cdcl3)δ8.17(t,j=2.0hz,1h),7.75(dd,j=8.0,2.1 hz,2h),7.42(t,j=8.0hz,1h),4.63(s,4h);
13
c nmr(151mhz,cdcl3)δ 141.3,128.3,126.6,63.2,45.3。
[0111]
以1,3
‑
二(1,1,2
‑
三溴乙基)苯为原料,
t
buok和
t
buoh用量分别为4.1 mmol和6ml,其他步骤参照实施例1的步骤(2),得到产物1,3
‑
二(2
‑
溴乙炔基)苯,无色液体,产量244mg,产率86%。
[0112]
其中,1,3
‑
二(2
‑
溴乙炔基)苯的化学式为:核磁数据如下:
[0113]1h nmr(600mhz,cdcl3)δ7.54(s,1h),7.42(dd,j=7.8,1.6hz,2h), 7.27(t,j=7.8hz,1h);
13
c nmr(151mhz,cdcl3)δ135.3,132.1,128.4,123.1, 78.9,50.9。
[0114]
实施例11:
[0115]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法与实施例1的不同之处在于:
[0116]
以3mmol 1,3,5
‑
三乙基苯为原料,nabr、nabro3、h2so4和aibn用量分别为19.8mmol、9.9mmol、14.85mmol和0.36mmol,其他步骤参照实施例1的步骤(1),得到中间体1,3,5
‑
三(1,1,2
‑
三溴乙基)苯,无色油状物,产量2.35g,产率90%。
[0117]
其中,中间体1,3,5
‑
三(1,1,2
‑
三溴乙基)苯的化学式为:核磁数据如下:
[0118]1h nmr(600mhz,cdcl3)δ8.15(s,3h),4.62(s,6h);
13
c nmr(151mhz, cdcl3)δ
141.6,127.5,62.1,45.1。
[0119]
以1,3,5
‑
三(1,1,2
‑
三溴乙基)苯为原料,
t
buok和
t
buoh用量分别为6.1 mmol和8ml,其他步骤参照实施例1的步骤(2),得到1,3,5
‑
三(2
‑
溴乙炔基)苯,白色固体,产量317mg,产率82%。
[0120]
其中,1,3,5
‑
三(2
‑
溴乙炔基)苯的化学式为:核磁数据如下:
[0121]1h nmr(600mhz,cdcl3)δ7.46(s,3h);
13
c nmr(151mhz,cdcl3)δ 135.2,123.5,78.1,52.1。
[0122]
实施例12:
[0123]
本实施例的(2
‑
溴乙炔基)苯类化合物的制备方法进行放大实验,具体包括以下步骤:
[0124]
(1)在250ml的三口烧瓶中分别加入1
‑
溴
‑4‑
乙基苯(0.1mol)、nabr (22.6g,0.22mol)、nabro3(16.6g,0.11mol)、1,2
‑
二氯乙烷(80ml) 和水(15ml),然后装上尾气吸收装置和冷凝回流管,搅拌加热至回流,滴加硫酸溶液(16.2g,0.165mol浓硫酸用5ml水稀释所得)和偶氮二异丁腈溶液(2g,12mmol aibn用40ml 1,2
‑
二氯乙烷溶解所得),滴加完成后,继续回流反应,用薄层色谱法跟踪,反应完全后,停止加热,降至室温。分液,水相分别用30ml 1,2
‑
二氯乙烷萃取三次,合并有机相,无水硫酸钠干燥,减压蒸馏回收溶剂1,2
‑
二氯乙烷136ml,回收率90%,得到中间体1
‑
溴
‑4‑
(1,1,2
‑ꢀ
三溴乙基)苯粗品;
[0125]
(2)在250ml三口烧瓶中分别加入叔丁醇钾(20.3g,0.18mol)、叔丁醇(120ml),搅拌均匀,分批加入步骤(1)所得的1
‑
溴
‑4‑
(1,1,2
‑
三溴乙基)苯粗品,35
‑
50℃下搅拌反应,用薄层色谱法跟踪,原料反应完全后,用10%hbr调节体系ph至7,过滤,回收得到溴化钾20.5g,回收率96.5%。滤液减压蒸馏回收溶剂叔丁醇,残留物用30ml工业酒精重结晶,得到产品 1
‑
溴
‑4‑
(2
‑
溴乙炔基)苯18.5g,两步反应总收率达到82%。
[0126]
鉴于本发明方案实施例众多,各组分的材料选择以及添加量均可在相应的范围内选取,各实施例实验数据庞大众多,不适合于此处逐一列举说明,但是各实施例所需要验证的内容和得到的最终结论均接近。故而此处不对各个实施例的验证内容进行逐一说明,仅以实施例1
‑
12作为代表说明本发明申请的优异之处。
[0127]
以上所述仅是对本发明的优选实施例及原理进行了详细说明,对本领域的普通技术人员而言,依据本发明提供的思想,在具体实施方式上会有改变之处,而这些改变也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。