作为dpp-4抑制剂的苯并六元环衍生物及其应用
技术领域
1.本发明涉及药物化学领域;具体地说,本发明涉及新型的苯并六元环衍生物,其合成方法及其作为dpp-4抑制剂在制备糖尿病相关疾病的药物中的应用。
背景技术:
2.1.糖尿病是一代谢性疾病,体内胰岛素的缺乏或是机体对胰岛素利用率下降导致血糖水平升高是这一疾病的主要特征。如果不加以治疗,糖尿病会对机体造成严重损害,例如心血管疾病、肾病、神经疾病、视网膜病变失明等。据2019年国际糖尿病联盟会(idf)报道显示,2019年全球约4.63亿成人患糖尿病,预计到2045年,糖尿病患者可能达到7亿。仅中国大陆,2019年统计就约有1.164亿糖尿病患者(20-79岁),大概占全球的1/4。糖尿病治疗周期较长,费用投入大,对家庭、国家经济及医疗体系都是沉重的负担。
3.2.糖尿病由其发病机制主要分为两类。第一类为ⅰ型糖尿病,占5%-10%,主要是因为自身免疫性反应或遗传引起。第二类为ⅱ型糖尿病,占90%左右,其病理机制主要是由胰岛素抵抗或分泌障碍导致的胰岛素缺乏,使得血糖,血脂的代谢出现异常。这也是糖尿病极易并发心脑血管、肾、眼底等微血管病变的原因。
4.3.对糖尿病的治疗临床上主要采用多种口服降糖药和胰岛素补充来延缓糖尿病进程。然而,这些方法有时无法达到预期治疗效果,且存在诱发低血糖、心血管疾病等副作用,对损伤的胰岛细胞也没有保护作用。随着对糖尿病的发病机制的深入了解,依据发病关键靶点作用机制寻找有效的降糖药物成为研究热点。
5.4.二肽基肽酶
-ⅳ
(dpp-4)是已经证明治疗ⅱ型糖尿病的有效靶点,它能迅速降解肠胰岛素血糖素样肽-1(glp-1)和葡萄糖依赖性胰岛素释放肽(gip)等多种重要的肠促胰岛素,从而导致胰岛素分泌不足。因此,dpp-4抑制剂可以提glp-1和gip水平,促进胰岛素分泌,降低血糖。
6.5.临床试验表明,dpp-4抑制剂可以降低血糖水平,增加葡萄糖耐量,且没有出现体重增加和低血糖等副作用。目前,已应用于临床的dpp-4抑制剂有西格列汀、沙格列汀、维格列汀、阿格列汀和利格列汀等。dpp-4抑制剂已经是降糖药物市场的主导。
7.6.然而,目前所有上市的dpp-4抑制剂都处于专利保护期内,还有多种新型dpp-4抑制剂处于临床前研究阶段。
8.因此,本领域急需研发新型、高效、低毒性的dpp-4抑制剂。
技术实现要素:
9.本发明的目的在于提供具备全新结构的、高效、低毒、能够作为新型dpp-4抑制剂的化合物,包括所述化合物的药物组合物、所述化合物的制备方法以及所述化合物在制备预防或治疗dpp-4相关疾病的药物中的用途。
10.在第一方面,本发明提供通式ⅰ所示化合物,或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物:
[0011][0012]
式中:
[0013]
x选自ch2、o、s、nh;
[0014]
a是带有1-5个取代基的苯环,每个取代基独立的选自卤素、氰基、羟基、c
1-6
烷基或被卤素、优选f,更优选1-5个f取代的c
1-6
烷基、c1-6烷氧基或被卤素、优选f,更优选1-5个f取代的c
1-6
烷氧基;
[0015]
a环还可选自具有1-4个取代基的含氮、硫五元或六元饱和或不饱和杂环,各取代基独立选自卤素、氰基、硼酸基;
[0016]
a杂环选自以下结构:
[0017][0018]
环b、c不同时存在,
[0019]
环b选自芳香苯环、芳杂环、饱和或不饱和的五元六元环、含氮、氧和硫的五元或六元饱和或不饱和杂环,
[0020]
其取代基r独立选自h、卤素、氰基、羟基、c
1-6
烷基或含1-5个f原子c
1-6
烷基、c
1-6
烷氧基或含1-5个f原子c
1-6
烷氧基,n=1-4,
[0021]
环c选自芳香苯环、芳杂环、饱和或不饱和的五元六元环、含氮、氧和硫的五元或六元饱和或不饱和杂环,
[0022]
其取代基r1独立选自h、卤素、氰基、羟基、c
1-6
烷氧基或含1-5个f原子c
1-6
烷氧基,n=1-4;或者
[0023]
环c不存在时,r1直接与化合物主体相连,
[0024]
此时,r1为h、羰基、卤素、任选取代的苯基、氰基、羟基、c
1-3
羧基(优选cooh)、任选取代的c
1-6
烷基、任选取代的c
1-10
烷氧基(优选c
1-6
烷氧基)、任选取代的c
2-10
含烯键、炔键的烷氧基、任选取代的苄氧基、任选取代的c
1-10
烷基甲酰氧基、任选取代的c
1-3
烷氧基甲氧基、双取代基och2ch2o和och2o、任选取代的c
1-6
烷氧甲酰基、氨基甲酰基、氨基、任选取代的c
1-5
烷基甲酰胺基、任选取代的c
3-5
烷基内酰胺基、任选取代的c
1-6
烷基磺酰胺基、任选取代的c
3-5
烷基内磺酰胺基、巯基、任选取代的c
1-5
烷基巯基、任选取代的c
1-5
烷基磺酰基、任选取代的c
3-5
环烷基磺酰基、任选取代的c
1-5
烷基亚磺酰基、任选取代的吗啡啉基、任选取代的四氢吡喃基,m=1-2。
[0025]
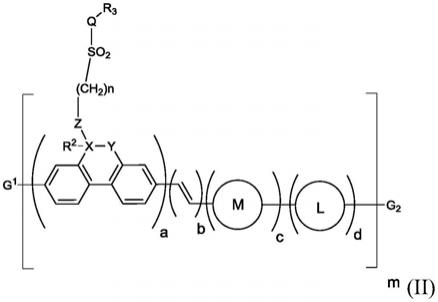
在具体的实施方式中,所述化合物是通式(ⅱ)所示化合物:
[0026][0027]
x选自ch2、o、s、nh;
[0028]
a是带有1-5个取代基的苯环,每个取代基独立的选自卤素、氰基、羟基、c
1-6
烷基或被卤素、优选f,更优选1-5个f取代的c
1-6
烷基、c1-6烷氧基或被卤素、优选f,更优选1-5个f取代的c
1-6
烷氧基;
[0029]
r4独立选自h、羟基、f、氰基;
[0030]
r5为h、羰基、卤素、氰基、羟基、c
1-3
羧基(优选cooh)、任选取代的c
1-6
烷基、任选取代的c
1-10
烷氧基(优选c
1-6
烷氧基)、任选取代的c
2-10
含烯键、炔键的烷氧基、任选取代的苄氧基、任选取代的c
1-10
烷基甲酰氧基、任选取代的c
1-3
烷氧基甲氧基、双取代基och2ch2o和och2o、任选取代的c
1-6
烷氧甲酰基、氨基甲酰基、氨基、nr2r3、任选取代的c
1-5
烷基甲酰胺基、任选取代的c
3-5
烷基内酰胺基、任选取代的c
1-6
烷基磺酰胺基、任选取代的c
3-5
烷基内磺酰胺基、巯基、任选取代的c
1-5
烷基巯基、任选取代的c
1-5
烷基磺酰基、任选取代的c
3-5
环烷基磺酰基、任选取代的c
1-5
烷基亚磺酰基、任选取代的吗啡啉基、任选取代的四氢吡喃基,任选取代的苯基,q=1-2。
[0031]
在具体的实施方式中,所述化合物是通式(ⅲ)所示化合物:
[0032][0033]
其中,
[0034]
x选自o、s、nh;
[0035]
r6为h、羰基、卤素、氰基、羟基、c
1-3
羧基(优选cooh)、任选取代的c
1-6
烷基、任选取代的c
1-10
烷氧基(优选c
1-6
烷氧基)、任选取代的c
2-10
含烯键、炔键的烷氧基、任选取代的苯基(优选甲磺酰基取代的苯基)、任选取代的苄氧基、任选取代的c
1-10
烷基甲酰氧基、任选取代的c
1-3
烷氧基甲氧基、双取代基och2ch2o和och2o、任选取代的c
1-6
烷氧甲酰基、氨基甲酰基、氨基、nr2r3、任选取代的c
1-5
烷基甲酰胺基、任选取代的c
3-5
烷基内酰胺基、任选取代的c
1-6
烷基磺酰胺基、任选取代的c
3-5
烷基内磺酰胺基、巯基、任选取代的c
1-5
烷基巯基、任选取代的c
1-5
烷基磺酰基、任选取代的c
3-5
环烷基磺酰基、任选取代的c
1-5
烷基亚磺酰基、任选取代的吗啡啉基、任选取代的四氢吡喃基;
[0036]
r7、r8、r9独立选自氢、cl、f、氰基。
[0037]
在具体的实施方式中,所述化合物是通式(ⅳ)所示化合物:
[0038][0039]
其中,
[0040]
x选自o、s、nh;
[0041]
r
10
为独立选自为氢、卤素、氰基、羟基、疏基、c
1-3
羧基(优选cooh)、c
1-3
羧酸甲酯基(优选甲酸甲酯基)、c
1-6
烷基磺酰基、c
1-6
烷基磺酰胺基或被卤素、优选f,更优选1-5个f取代的烷基磺酰胺基、c
1-6
烷氧基、四唑基,r=1-5;
[0042]
r7、r8、r9独立选自氢、cl、f、氰基。
[0043]
在具体的实施方式中,所述化合物是通式(
ⅴ
)所示化合物:
[0044][0045]
其中,
[0046]
x选自o、s、nh;
[0047]
r
10
独立选自为c
1-6
氘代甲氧基、c
1-6
烷氧基或被卤素、优选f,更优选1-5个f取代的烷氧基;r
12
独立选自为氰基。
[0048]
r7、r8、r9独立选自氢、cl、f、氰基。
[0049]
在具体的实施方式中,所述化合物是选自下组的化合物或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物:
[0050][0051][0052]
在第二方面,本发明提供一种药物组合物,所述药物组合物含有第一方面所述的化合物或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物以及药学上可接受的载体或赋形剂。
[0053]
在具体的实施方式中,所述药物组合物是适于口服的剂型,包括但不限于片剂、溶
液剂、混悬液、胶囊剂、颗粒剂、粉剂。
[0054]
在第三方面,本发明提供第一方面所述化合物或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物的用途,用于制备抑制dpp-4的药物、治疗或预防二肽基肽酶
-ⅳ
(dpp-4)相关疾病的药物,或作为利尿剂或治疗和预防炎症的药物。
[0055]
在具体的实施方式中,所述二肽基肽酶
-ⅳ
(dpp-4)相关的疾病是糖尿病、糖耐量异常、肠道病、溃疡性结肠炎、克隆氏病、肥胖或代谢综合征。
[0056]
在具体的实施方式中,所述糖尿病是非胰岛素依赖的ⅱ型糖尿病。
[0057]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
[0058]
发明人经过广泛而深入的研究,发现一批结构全新的苯并六元环衍生物,这些衍生物能够抑制dpp-4的活性,对dpp-4抑制活性的ic
50
值达到nm级别,在此基础上完成了本发明。
[0059]
本文为临床候选物提供了可靠的备选化合物7a,7a体外dpp-4活性与化合物2相当,ic
50
值达到3.03nm。2-(2,4,5-三氟苯基)-3,4-二氢-2h-苯并[h]色满-3-胺和2-(2,4,5-三氟苯基)-6-苯基-3,4-二氢-2h-色满-3-胺两个系列化合物的发现,为我们进一步的结构改造提供了有益的参考,强化了现有知识产权的保护。
[0060]
术语定义
[0061]
本文中涉及到的一些基团定义如下:
[0062]
本文中,“烷基”指碳链长度为1-10个碳原子的饱和的支链或直链或环烷基,优选的烷基包括长1-5个、1-2个、1-6个、1-4个、3-8个碳原子不等的烷基。烷基的例子包括但不限于:甲基、乙基、正丙基、异丙基、正丁基、异丁基、庚基等。烷基可以被1个或多个取代基取代,例如被卤素或卤代烷基取代。例如,烷基可以是被1-4个氟原子取代的烷基,或者烷基可以是被氟代烷基取代的烷基。
[0063]
本文中,“链烯基”通常表示具有至少一个双键的单价烃基,通常含有2-8个碳原子,优选含有2-6个碳原子,可以是直链或支链。链烯基的例子包括但不限于乙烯基、丙烯基、异丙烯基、丁烯基、异丁烯基、己烯基等等。
[0064]
本文中,“酯基”通常表示具有至少一个酯基的羧酸衍生物,通常含有3-8个碳原子,优选含有3-6个碳原子,可以是直链或支链。酯基的例子包括但不限于甲酸甲酯、甲酸乙酯、乙酸甲酯、乙酸乙酯、乙酸丙酯等等。
[0065]
本文中,“羟基”指碳链长度为1-10个碳原子的支链或直链醇,通常含有1-10个碳原子,优选含有1-6个碳原子,可以是直链或支链。酯羟基的例子包括但不限于1-羟基正丁基、1-羟基异丁基等等。
[0066]
本文中,“酰氨基”指结构式为
“-
r
’-
nh-c(o)-r”的基团,其中,r’可选自氢或烷基,r可选自烷基、链烯基、炔基、被nr
c
r
d
取代的烷基、被nr
c
r
d
取代的链烯基和nr
c
r
d
取代的炔基、被卤素取代的烷基、被氰基取代的链烯基,其中,r
c
和r
d
可选自烷基和链烯基。
[0067]
本文中,“芳基”指含有6到14个碳原子的单环、双环或三环芳族基团,包括苯基、萘
基、菲基、蒽基、茚基、茀基、四氢化萘基、二氢化茚基等。芳基可任选地被1-5个(例如,1、2、3、4或5个)选自以下的取代基取代:卤素、c
1-4
醛基、c
1-6
烷基、氰基、硝基、氨基、酰胺基、羟基、羟甲基、卤素取代的烷基(例如三氟甲基)、卤素取代的烷氧基(例如三氟甲氧基)、羧基、c
1-4
烷氧基、乙氧甲酰基、n(ch3)和c
1-4
酰基等、杂环基或杂芳基等。
[0068]
本文中,“杂环基”包括但不限于含有1-3个选自o、s或n的杂原子的5元或6元杂环基团,包括但不限于呋喃基、噻吩基、吡咯基、吡咯烷基、吡唑基、咪唑基、三唑基、噁唑基、吡喃基、吡啶基、嘧啶基、吡嗪基、哌啶基、吗啉基等。
[0069]
本文中,“芳杂环基”是指含有5-14个环原子,并且有6个、10个或14个电子在环体系上共用。而且所含环原子是碳原子和从氧、氮、硫中任选的1-3个杂原子。有用的芳杂环基包括哌嗪基、吗啉基、哌啶基、吡咯烷基、噻吩基、呋喃基、吡喃基、吡咯基、咪唑基、吡唑基、吡啶基、包括但不限制于嘧啶基等。芳杂环基可任选地被1-5个(例如,1、2、3、4或5个)选自以下的取代基取代:卤素、c
1-4
醛基、c
1-6
直链或支链烷基、氰基、硝基、氨基、羟基、羟甲基、卤素取代的烷基(例如三氟甲基)、卤素取代的烷氧基(例如三氟甲氧基)、羧基、c
1-4
烷氧基、乙氧甲酰基、n(ch3)和c
1-4
酰基。
[0070]
本文中,“烷氧基”指被烷基取代的氧基。优选的烷氧基是长1-6个碳原子的烷氧基,更优选为长1-3个碳原子的烷氧基。烷氧基的例子包括但不限于:甲氧基、乙氧基、丙氧基等。烷氧基可以被1个或多个取代基取代,例如被卤素或卤代烷基取代。例如,烷氧基可以是被1-4个氟原子取代的烷基,或者烷基可以是被氟代烷基取代的烷基。
[0071]
本文中,“卤素”指氟、氯、溴或碘。
[0072]
本文中,“任选取代的”指其所修饰的取代基可任选地被1-5个(例如,1、2、3、4或5个)选自以下的取代基取代:卤素、c
1-4
醛基、c
1-6
直链或支链烷基、氰基、硝基、氨基、羟基、羟甲基、卤素取代的烷基(例如三氟甲基)、卤素取代的烷氧基(例如三氟甲氧基)、羧基、c
1-4
烷氧基、乙氧甲酰基、n(ch3)和c
1-4
酰基。
[0073]
本发明的化合物
[0074]
本发明所述苯并六元环衍生物是通式ⅰ所示化合物,或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物:
[0075][0076]
式中各基团的定义如上所述。
[0077]
在优选的实施方式中,本发明提供通式(ⅱ)所示化合物,或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物:
[0078][0079]
式中各基团的定义如上所述。
[0080]
在优选的实施方式中,本发明提供通式(ⅲ)所示化合物,或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物:
[0081][0082]
式中各基团的定义如上所述。
[0083]
在优选的实施方式中,本发明提供通式(ⅳ)所示化合物,或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物:
[0084][0085]
式中各基团的定义如上所述。
[0086]
在优选的实施方式中,本发明提供通式(
ⅴ
)所示化合物,或其药学上可接受的盐或前药,或其光学活性异构体或溶剂化物:
[0087][0088]
式中各基团的定义如上所述。
[0089]
在具体的实施方式中,本发明提供选自下组的化合物或其药学上可接受的盐或前药:
[0090][0091]
[0092]
在本发明的化合物的基础上,本发明提供一种药物组合物,该组合物含有治疗有效量的本发明的化合物或其药学上可接受的盐,以及药学上可接受的载体或赋形剂。
[0093]
本发明化合物的药学上可接受的盐的例子包括但不限于无机和有机酸盐,例如盐酸盐、氢溴酸盐、硫酸盐、柠檬酸盐、乳酸盐、酒石酸盐、马来酸盐、富马酸盐、扁桃酸盐和草酸盐;以及与碱例如钠羟基、三(羟基甲基)胺基甲烷(tris,胺丁三醇)和n-甲基葡糖胺形成的无机和有机碱盐。
[0094]
本发明的药物组合物可被配制成适合各种给药途径的制剂形式,包括但不限于被配制成用于肠外,皮下,静脉,肌肉,腹腔内,透皮,口腔,鞘内,颅内,鼻腔或外用途径给药的形式,用于治疗肿瘤和其他疾病。给药量是有效地改善或消除一个或多个病症的药量。对于特定疾病的治疗,有效量是足以改善或以某些方式减轻与疾病有关的症状的药量。这样的药量可作为单一剂量施用,或者可依据有效的治疗方案给药。给药量也许可治愈疾病,但是给药通常是为了改善疾病的症状。一般需要反复给药来实现所需的症状改善。药的剂量将根据病人的年龄,健康与体重,并行治疗的种类,治疗的频率,以及所需治疗效益来决定。
[0095]
本发明的药物制剂可以给予任何哺乳动物,只要他们能获得本发明化合物的治疗效果。在这些哺乳动物中最为重要的是人类。
[0096]
本发明的化合物或其药物组合物可用于治疗和预防二肽基肽酶-4(dpp-4)相关的疾病。本文中,所述二肽基肽酶-4(dpp-4)相关的疾病是糖尿病,尤其是非胰岛素依赖的2-型糖尿病、糖耐量异常、肠道病、溃疡性结肠炎、克隆氏病、肥胖或代谢综合征。本文发明化合物还可以用于利尿剂和炎症的预防和治疗。
[0097]
本发明的药物制剂可用已知的方式制造。例如,由传统的混合,制粒,制锭,溶解,或冷冻干燥过程制造。制造口服制剂时,可结合固体辅料和活性化合物,选择性研磨混合物。如果需要或必要时加入适量助剂后,加工颗粒混合物,获得片剂或锭剂芯。
[0098]
合适的辅料特别是填料,例如糖类如乳糖或蔗糖,甘露醇或山梨醇;纤维素制剂或钙磷酸盐,例如磷酸三钙或磷酸氢钙;以及粘结剂,例如淀粉糊,包括玉米淀粉,小麦淀粉,大米淀粉,马铃薯淀粉,明胶,黄芪胶,甲基纤维素,羟丙基甲基纤维素,羧甲基纤维素钠,或聚乙烯吡咯烷酮。如果需要,可增加崩解剂,比如上面提到的淀粉,以及羧甲基淀粉,交联聚乙烯吡咯烷酮,琼脂,或褐藻酸或其盐,如海藻酸钠。辅助剂特别是流动调节剂和润滑剂,例如,硅石,滑石,硬脂酸盐类,如镁硬脂酸钙,硬脂酸或聚乙二醇。如果需要,可以給锭剂核芯提供可以抵抗胃液的合适包衣。为此,可以应用浓缩糖类溶液。这个溶液可以含有阿拉伯树胶,滑石,聚乙烯吡咯烷酮,聚乙二醇和/或二氧化钛,漆溶液和合适的有机溶剂或溶剂混合物。为了制备耐胃液的包衣,可使用适当的纤维素溶液,例如醋酸纤维素邻苯二甲酸或羟丙基甲基纤维素邻苯二甲酸。可向药片或锭剂核芯的包衣加入染料或色素。例如,用于识别或为了表征活性成分剂量的组合。
[0099]
基于上述化合物和药物组合物,本发明进一步提供一种治疗和预防二肽基肽酶-4(dpp-4)相关疾病的方法,所述疾病包括(但不限于)糖尿病,尤其是非胰岛素依赖的2-型糖尿病、糖耐量异常、肠道病、溃疡性结肠炎、克隆氏病、肥胖或代谢综合征。该方法包括给予需要的对象以本发明的化合物或其药学上可接受的盐,或本发明的药物组合物。
[0100]
给药方法包括但不限于本领域周知的各种给药方法,可根据患者的实际情况加以确定。这些方法包括但不限于肠外、皮下、静脉、肌肉、腹腔内、透皮、口腔、鞘内、颅内、鼻腔
或外用途径给药。
[0101]
进一步地,本发明包括本发明的化合物或其药学上可接受的盐在制备治疗或预防二肽基肽酶-4(dpp-4)相关的疾病,包括(但不限于)糖尿病,尤其是非胰岛素依赖的2-型糖尿病、糖耐量异常、肠道病、溃疡性结肠炎、克隆氏病、肥胖或代谢综合征dpp-4介导的疾病的药物中的用途:制备抑制dpp-4的药物中的用途;以及制备作为利尿剂和治疗和预防炎症的药物中的用途。
[0102]
本发明的优点:
[0103]
1.本发明提供的化合物是一种结构全新dpp-4抑制剂;
[0104]
2.本发明提供的化合物对dpp-4具有优异的抑制活性;
[0105]
3.本发明提供的化合物为开发能抑制靶向dpp-4的药物奠定了基础,具备极大的产业化和商品化前景以及市场价值,经济效益显著。
[0106]
以下结合具体实施案例对本发明的技术方案进一步描述,但以下实施案例不构成对本发明的限制,所有依据本发明的原理和技术手段采用的各种施用方法,均属于本发明范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0107]
材料与方法
[0108]
2-(2,4,5-三氟苯基)-3,4-二氢-2h-苯并[h]色满-3-胺衍生物合成路线
[0109][0110]
试剂和条件:(a)1,1-dichlorodimethyl ether,agotf,dcm,-78℃to r.t.,n2,55.3%;(b)1,1-dichlorodimethyl ether,ticl4,0℃to r.t.,22.5%-79.0%;(c)alcl3,dcm,0℃to 40℃,40.5%-66.5%;(d)l-pipecolinic,toluene,120℃,n2,10.2%-42.5%;(e)1)nabh4,thf/ch3oh,r.t.;2)dipea,etoh,r.t.;(f)zn,hcl,etoh,r.t.,10.8%-25.9%;(g)ch3so2na,l-proline,naoh,cui,dmso,130℃,n2,88.8%;(h)ch3oh,h2so4,70℃,95.0%;(i)ch3so2cl,pyridine,dcm,0℃to r.t.,45.0%;(j)tf2o,et3n,dcm,-78℃to r.t.,68.1%;(k)(1)(3,6-dihydro-2h-pyran-4-yl)-boronic acid pinacol ester,pd(pph3)4,cs2co3,dmf/h2o,90℃,n2;(2)pd/c,h2,meoh,r.t.,73.3%for two steps;(l)(3-(methylsulfonyl)phenyl)boronic acid,pd(pph3)4,cs2co3,dmf/h2o,95℃,n2,73.0%;(m)morpholine,pd2(dba)3,binap;t-buok,toluene,100℃,n2,49.0%;(n)naoh,meoh/h2o,50
℃,50.0%;(o)pocl3,dmf,0℃to r.t.,69.6%.
[0111]
2-(2,4,5-三氟苯基)-6-苯基-3,4-二氢-2h-色满-3-胺衍生物的合成路线
[0112][0113]
试剂和条件:(a)cs2co3,pdcl2(dppf)2,dmf/h2o,100℃,n2,31.0-60.0%;(b)l-pipecolinic,toluene,120℃,n2,23.0%-70.0%;(c)1)nabh4,thf/ch3oh,r.t.;2)dipea,etoh,r.t.;(d)zn,hcl,etoh,r.t.,10.0%-69.0%.
[0114]
2-(2,4,5-三氟苯基)-3,4-二氢-2h-苯并[f]色满-3-胺衍生物合成路线
[0115][0116]
试剂和条件:(a)bbr3,dcm,-78℃to r.t.,77.6%;(b)cd3i or ch3ch2i,k2co3,mecn,40℃~50℃,45.5%;(c)zn,hcl,etoh,r.t.,30.5%;(d)optical resolution.
[0117]
2-(2,5-二氟苯基)-6-甲氧基-7-氰基-3,4-二氢-2h-苯并[f]色满-3-胺的合成路线
[0118][0119]
试剂和条件:(a)1,1-dichlorodimethyl ether,ticl4,0℃to r.t.,74.5%;(b)alcl3,dcm,0℃to 40℃,70.0%;(c)l-pipecolinic,toluene,120℃,n2,25%;(d)1)nabh4,thf/ch3oh,r.t.;2)dipea,etoh,r.t.,23%;(e)zn,hcl,etoh,r.t.,13%;(f)optical resolution.
[0120]
实施例1.具体合成方法
[0121]
1-甲氧基-萘衍生物(8c、8e、8g-j)的合成
[0122]
1-甲氧基-4-甲磺酰基萘(8c)
[0123]
[0124]
将1-碘-4-甲氧基萘酚(100.00mg,0.35mmol)、甲基亚磺酸钠(50.00mg,0.42mmol),碘化亚铜(7.00mg,0.10mmol),l-脯氨酸(10.00mg,0.07mmol),氢氧化钠(2.80mg,0.07mmol),无水dmso(5ml)加入到25ml三口反应瓶中,氮气保护,升温至130℃搅拌,tlc监测反应进度。待反应结束后,冷却至室温,向反应体系中加入水10ml,然后用乙酸乙酯(10ml
×
3)萃取,有机相用卤水洗涤,再加入无水na2so4干燥,硅胶柱层析纯化分离(pe:ea=10:1),得淡黄色产品73.01mg,收率为87.9%。
[0125]1h nmr(400mhz,cdcl3)δ8.60(dd,j=40.4,26.8hz,1h),8.39(d,j=8.4hz,1h),8.28(d,j=8.3hz,1h),7.71(t,j=7.7hz,1h),7.59(t,j=7.6hz,1h),6.87(d,j=8.4hz,1h),4.07(s,3h),3.18(s,3h).lc-ms(esi)m/z 237.05[m h]
.
[0126]
4-甲氧基-1-萘甲酸甲酯(8e)
[0127][0128]
将4-甲氧基-1-萘甲酸(1.00g,4.95mmol)加入单50ml两口反应瓶中,加入10ml甲醇溶解,冰浴下搅拌,然后缓慢滴加浓硫酸1ml,滴加完毕后,升温至70℃加热回流4小时。待原料完全转化,搅拌停止,待反应液冷却至室温,减压旋干反应液,加入10ml水,乙酸乙酯(3
×
10ml)萃取,有机相用饱和nahco3和卤水分别洗涤,无水na2so4干燥,硅胶柱层析纯化(pe:ea=20:1),得白色油状产品1.01g,收率为95.3%。
[0129]1h nmr(400mhz,cdcl3)δ9.03(d,j=8.7hz,1h),8.31(t,j=11.3hz,1h),8.24(d,j=8.3hz,1h),7.63(t,j=8.4hz,1h),7.52(t,j=8.1hz,1h),6.81(d,j=8.3hz,1h),4.06(s,3h),3.97(s,3h).lc-ms(esi)m/z 271.01[m h]
.
[0130]
n-(4-甲氧基萘1-基)甲磺酰胺(8g)
[0131][0132]
取4-甲氧基萘-1胺(1.57g,9.06mmol),吡啶(0.80ml,9.97mmol)于100ml反应瓶中,冰浴下逐滴滴加甲磺酰氯(1.14ml,9.06mmol),控制温度在5℃以下,tlc监测反应。待反应结束后,加入3n naoh溶液,然后二氯甲烷萃取,再有机相用饱和食盐水洗涤,无水na2so4干燥,最后用硅胶柱层析纯化(pe:ea=8:1)。得淡黄色产品1.02g,产率为44.7%。
[0133]1h nmr(400mhz,dmso-d6):δ9.47(s,1h),8.20(dd,j=13.8,4.9hz,2h),7.72-7.57(m,1h),7.56-7.50(m,1h),7.45(d,j=8.2hz,1h),6.98(d,j=8.3hz,1h),3.99(s,3h),2.98(s,3h).lc-ms(esi)m/z 250.06[m-h]-.
[0134]
1,1,1-三氟-n-(4-甲氧基萘-1-基)甲磺酰胺(8h)
[0135][0136]
取4-甲氧基萘-1胺(1.00g,5.78mmol),三乙胺(1.78ml,11.20mmol),二氯甲烷(15ml)于100ml反应瓶中,-78℃下逐滴滴加三氟甲磺酸酐(0.97ml,5.78mmol),然后移至室温搅拌,tlc监测反应。待原料转化完全后,向反应瓶加入水淬灭,二氯甲烷萃取三次,有机相用饱和nacl溶液洗涤,无水na2so4干燥,硅胶柱层析纯化(pe:ea=10:1),得产品1.20g,产率为68.2%。
[0137]1h nmr(400mhz,dmso-d6)δ11.79(s,1h),8.23(d,j=8.3hz,1h),8.04(d,j=8.4hz,1h),7.71(t,j=7.2hz,1h),7.60(t,j=7.3hz,1h),7.46(d,j=8.3hz,1h),7.02(d,j=8.3hz,1h),4.01(s,3h).lc-ms(esi)m/z 304.03[m-h]-.
[0138]
4-(4-甲氧基萘-1-基)四氢-2h-吡喃(8i)
[0139][0140]
将1-溴-4-甲氧基萘酚(100.00mg,0.42mmol)、2-(3,6-二氢-2h-吡喃-4-基)-4,4,5,5-四甲基-1,3,2-二氧杂硼烷(79.60mg,0.50mmol)、四三苯基膦钯(97.00mg,0.08mmol),碳酸铯(410.00mg,1.26mmol),dmf 2ml,水0.5ml,氮气置换三次,90℃搅拌,tlc监测。反应结束后,待体系冷却至室温,用乙酸乙酯(10ml
×
3)萃取,有机相用饱和nacl洗涤,无水硫酸钠干燥,得到粗产品待下一步还原。
[0141]
取上一步粗产品4-(4-甲氧基萘-1-基)-3,6-二氢-2h-吡喃,加入pd/c(10%),适量甲醇溶解,体系氢气条件下(1个大气压)常温搅拌,tlc监测。待反应结束后,加水淬灭反应,用乙酸乙酯(10ml
×
3)萃取,有机相用卤水洗涤,无水硫酸钠干燥,硅胶柱层析纯化(pe:ea=10:1),得产品70.00mg,两步反应总收率为51.1%。
[0142]1h nmr(400mhz,cdcl3)δ8.33(dd,j=8.3,1.1hz,1h),8.04(d,j=8.4hz,1h),7.60-7.41(m,2h),7.27(d,j=8.0hz,1h),6.77(d,j=8.0hz,1h),4.20-4.06(m,2h),3.96(s,3h),3.75-3.59(m,2h),3.56-3.37(m,1h),2.02-1.79(m,4h).lc-ms(esi)m/z 243.13[m h]
.
[0143]
1-甲氧基-4-(3-(甲磺酰基)苯基)萘(8j)
[0144]
[0145]
称取1-溴-4甲氧基萘(0.20g,0.84mmol),(3-(甲磺酰基)苯基)苯硼酸(0.20g,1.00mmol),碳酸铯(274.00mg,2.52mmol),四三苯基膦钯(48.50mg,0.05mmol),无水dmf 10ml,水3ml于50ml反应瓶中,氮气保护,升温至95℃充分搅拌,tlc监测。待原料基本转化完全,用水和乙酸乙酯萃取三次,有机相用饱和氯化钠溶液洗涤,无水硫酸钠干燥,硅胶柱层析纯化(pe:ea=8:1),得产品0.19g,产率为73.1%。
[0146]1h nmr(400mhz,cdcl3)δ8.36(d,j=8.2hz,1h),8.06(s,1h),7.96(t,j=9.7hz,1h),7.82-7.71(m,2h),7.66(t,j=7.7hz,1h),7.57-7.41(m,2h),7.35(t,j=8.6hz,1h),6.88(d,j=7.9hz,1h),4.05(s,3h),3.11(s,3h).lc-ms(esi)m/z313.08[m h]
[0147]
1-甲氧基-2-萘甲醛衍生物(9a-h)的合成
[0148]
4-溴-1-甲氧基-2-萘甲醛(9a)
[0149][0150]
1,1-二氯甲基甲醚(0.73g,6.35mmol),ticl4(2.00g,10.60mmol),ch2cl
2 5ml加入到100ml三口反应瓶中,冰浴条件下搅拌16min,逐滴滴加1-溴4-甲氧基萘(1.00g,4.24mmol)的二氯甲烷(5ml)溶液,常温下继续搅拌,tlc监测。反应结束后,加入1mol/l的盐酸溶液,然后用ch2cl2萃取三次,有机相用饱和nacl溶液洗涤,无水硫酸钠干燥,减压蒸发溶剂,硅胶柱层析纯化(pe:ea=5:1),得白色粉末500.00mg,产率为22.4%。
[0151]1h nmr(400mhz,cdcl3)δ10.26(s,1h),9.22(d,j=8.5hz,1h),8.22(d,j=8.4hz,1h),8.11(s,1h),7.78-7.69(m,1h),7.66(dd,j=11.2,4.1hz,1h),4.09(s,3h).lc-ms(esi)m/z 266.11[m h]
.
[0152]
1-甲氧基-4-甲磺酰基-2-萘甲醛(9b)
[0153][0154]
向50ml三颈反应瓶中加入化合物1-甲氧基-4-(甲磺酰基)萘(0.50g,2.12mmol)、三氟甲烷磺酸银(1.63g,6.36mmol)、二氯甲烷10ml,反应体系氮气置换三次,-78℃下搅拌。再将1,1二氯甲基甲醚(0.73g,6.36mmol)滴加到上述反应液,十分钟后转移至室温搅拌,tlc监测。反应结束后,冰浴下缓慢加入饱和nahco3溶液,减压抽滤,滤液用乙酸乙酯(10ml)萃取三次,有机相用卤水洗涤,无水na2so4干燥,200-300目硅胶柱纯化(pe:ea=5:1),得到白色固体0.31g,收率为55.3%。
[0155]1h nmr(400mhz,cdcl3)δ10.57(s,1h),8.79(d,j=8.6hz,1h),8.75(s,1h),8.43(d,j=8.4hz,1h),7.96-7.83(m,1h),7.76(t,j=7.7hz,1h),4.24(s,3h),3.22(s,3h).lc-ms(esi)m/z 265.04[m h]
.
[0156]
3-甲酰基-4-甲氧基-1-萘甲酸甲酯(9c)
[0157][0158]
合成步骤参照9a,得淡黄色固体2.28g,收率为70.7%。
[0159]1h nmr(400mhz,cdcl3)δ10.58(s,1h),9.02(d,j=8.6hz,1h),8.61(d,j=4.0hz,1h),8.61(s,1h),7.87-7.67(m,1h),7.65-7.58(m,1h),4.19(s,3h),4.00(s,3h).lc-ms(esi)m/z 245.07[m h]
.
[0160]
n-(3-甲酰基-4-甲氧基萘-1-基)甲磺酰胺(9d)
[0161][0162]
合成步骤参照9a,得白色粉末1.50g,产率58.1%.
[0163]1h nmr(400mhz,dmso-d6)δ10.48(s,1h),9.81(s,1h),8.37-8.27(m,2h),7.87-7.78(m,1h),7.76-7.70(m,2h),4.14(s,3h),3.03(s,3h).lc-ms(esi)m/z 278.05[m-h]-.
[0164]
1,1,1-三氟-n-(3-甲酰基-4-甲氧基萘甲醛-1-基)甲磺酰胺(9e)
[0165][0166]
合成步骤参照9a,得淡黄色固体1.31g,产率33.1%。
[0167]1h nmr(400mhz,cdcl3)δ10.43(s,1h),8.23(d,j=8.3hz,1h),8.06(t,j=7.9hz,1h),7.84(s,1h),7.80-7.68(m,1h),7.65-7.56(m,1h),4.09(s,3h).lc-ms(esi)m/z 332.02[m-h]-.
[0168]
1-甲氧基-4-(四氢-2h-吡喃-4-基)-2-萘甲醛(9f)
[0169][0170]
合成步骤参照9a,得淡黄色固体3.01g,收率79.1%。
[0171]1h nmr(400mhz,cdcl3)δ10.60(s,1h),8.32(dd,j=8.3,0.8hz,1h),8.14(d,j=8.5hz,1h),7.78(s,1h),7.75-7.65(m,1h),7.63-7.58(m,1h),4.27-4.00(m,5h),3.69(td,j=11.7,2.1hz,2h),3.55-3.45(m,1h),2.08-1.86(m,4h).lc-ms(esi)m/z 271.12[m h]
.
[0172]
1-甲氧基-4-(3-(甲基磺酰基)苯基)-2-萘甲醛(9g)
[0173][0174]
合成步骤参照9a,得淡黄色固体2.33g,产率55.2%.
[0175]1h nmr(400mhz,cdcl3)δ10.65(s,1h),8.43-8.32(m,1h),8.06(d,j=1.2hz,1h),8.03(t,j=1.5hz,1h),7.82(s,1h),7.80-7.75(m,2h),7.72(t,j=7.5hz,1h),7.69-7.62(m,2h),4.22(s,3h),3.14(s,3h).lc-ms(esi)m/z 341.07[m h]
.
[0176]
1-甲氧基-4-吗啉-1-萘甲醛(9h)
[0177][0178]
将化合物4-溴-1-甲氧基-2-萘甲醛(200.00mg,0.76mmol),吗啉(0.08ml,0.906mmol),pd2(dba)3(3.68mg,0.5%mol),binap(4.70mg,0.01mmol),叔丁醇钾(143.36mg,1.28mmol)加入到25ml三口反应瓶中,氮气保护后加入甲苯10ml,升温至100℃搅拌,tlc监测。反应结束后,冷却至室温,用乙酸乙酯(10ml)萃取三次,有机相用卤水洗涤,无水na2so4干燥,200-300目硅胶柱纯化(pe:ea=5:1)。得淡黄色固体100.00mg,产率48.8%。
[0179]1h nmr(400mhz,cdcl3)δ10.58(s,1h),8.36-8.20(m,2h),7.75-7.70(m,1h),7.65-7.58(m,1h),7.47(s,1h),4.12(s,3h),3.98(dd,j=15.8,11.1hz,4h),3.22-3.04(m,4h).lc-ms(esi)m/z 272.12[m h]
.
[0180]
1-羟基-2-萘甲醛衍生物(11a-j)的合成
[0181]
1-羟基-2-萘甲醛(11a)
[0182][0183]
合成步骤参照9a,得黄色油状产物2.33g,产率30.3%。
[0184]1h nmr(400mhz,cdcl3)δ11.70(s,1h),9.00(s,1h),7.47(d,j=8.0hz,1h),6.81(d,j=8.2hz,1h),6.69(t,j=7.5hz,1h),6.58(t,j=7.6hz,1h),6.52(d,j=8.6hz,1h),6.40(d,j=8.6hz,1h).lc-ms(esi)m/z 173.10[m h]
.
[0185]
1-羟基-4-甲氧基-2-萘甲醛(11b)
ms(esi)m/z 231.05[m h]
.
[0201]
n-(3-甲酰基-4-羟基萘-1-基)甲磺酰胺(11f)
[0202][0203]
合成步骤参考11c,得淡黄色固体1.22g,收率为60.1%。
[0204]1h nmr(400mhz,dmso-d6)δ12.23(s,1h),10.24(s,1h),9.59(s,1h),8.51-8.33(m,1h),8.26(d,j=8.4hz,1h),7.87-7.77(m,1h),7.73(s,1h),7.70-7.56(m,1h),3.04(s,3h).lc-ms(esi)m/z 264.04[m-h]-.
[0205]
1,1,1-三氟-n-(3-甲酰基-4-羟基萘-1-基)甲磺酰胺(11g)
[0206][0207]
合成步骤参考11c,得淡黄色固体1.01g,收率为50.1%。
[0208]1h nmr(400mhz,dmso-d6)δ12.31(s,1h),10.28(s,1h),8.45(d,j=8.4hz,1h),8.08(d,j=8.4hz,1h),7.90(t,j=7.7hz,1h),7.80-7.65(m,2h).lc-ms(esi)m/z 318.01[m-h]-.
[0209]
1-羟基-4-(四氢-2h-吡喃-4-基)-2-萘甲醛(11h)
[0210][0211]
合成步骤参考11c,得淡黄色固体2.53g,收率为55.3%。
[0212]1h nmr(400mhz,cdcl3)δ12.54(s,1h),9.96(d,j=9.6hz,1h),8.52(d,j=7.6hz,1h),8.04(d,j=8.6hz,1h),7.78-7.67(m,1h),7.56(dt,j=19.0,5.9hz,1h),7.36(s,1h),4.17(dt,j=11.1,2.7hz,2h),3.84-3.59(m,2h),3.45(m,1h),2.14-1.75(m,4h).lc-ms(esi)m/z 257.10[m h]
.
[0213]
1-羟基-4-吗啉-2-萘甲醛(11i)
[0214][0215]
合成步骤参考11c,得淡黄色产品0.80g,产率为40.0%。
[0216]1h nmr(400mhz,cdcl3)δ12.50(s,1h),9.95(s,1h),8.59-8.14(m,2h),7.86-7.52(m,2h),7.19(d,j=57.8hz,1h),3.98(m,4h),3.06(m,4h).lc-ms(esi)m/z 258.10[m h]
.
[0217]
1-羟基-4-(3-(甲基磺酰基)苯基)-2-萘甲醛(11j)
[0218][0219]
合成步骤参考11c,得淡黄色固体1.50g,收率为66.1%。
[0220]1h nmr(400mhz,cdcl3)δ12.71(s,1h),10.01(s,1h),8.57(dd,j=8.1,0.9hz,1h),8.20-8.10(m,1h),8.05-7.88(m,1h),7.78(dt,j=7.6,1.4hz,1h),7.72(dd,j=8.3,6.8hz,2h),7.67(dt,j=3.0,1.5hz,1h),7.64(dd,j=4.7,1.6hz,1h),7.61(dt,j=11.1,2.9hz,1h),7.47(s,1h),3.14(s,3h).lc-ms(esi)m/z 327.06[m h]
.
[0221]
4-羟基-1h-吲哚-5-甲醛的合成(17)
[0222][0223]
量取5ml dmf于250ml三口反应瓶中,加入三氯氧磷(3.45g,22.56mmol),冰浴下搅拌。再称取4-羟基吲哚(1.00g,7.52mmol),用5ml dmf溶解,逐滴滴加到上述反应体系中,tlc监测反应进度。待原料转化完全后,加入冰水,用乙酸乙酯(10ml)萃取三次,有机相用卤水洗涤,无水na2so4干燥,200-300目硅胶柱纯化(pe:ea=8:1),得到目标产物0.80g,收率为69.6%。
[0224]1h nmr(400mhz,dmso-d6)δ11.79(s,1h),11.62(s,1h),10.03(s,1h),7.38(d,j=8.5hz,1h),7.36-7.33(m,1h),7.04(d,j=8.5hz,1h),6.72(m,1h).lc-ms(esi)m/z 162.05[m h]
.
[0225]
2-(2,4,5-三氟苯基)-3-硝基-2h-苯并[h]色满衍生物(13a-j)的合成
[0226]
2-(2,4,5-三氟苯基)-3-硝基-2h-苯并[h]色满(13a)
[0227][0228]
称取1-羟基-2-萘甲醛(150.00mg,0.86mmol),20ml甲苯,2,4,5-三氟苯硝基乙烯(174.70mg,0.86mmol),l-哌啶甲酸(110.90mg,0.86mmol)加入到125ml三口瓶,氮气保护,120℃过夜搅拌,溶液由淡黄色逐渐变为暗红色。冷却至室温,二氯甲烷萃取三次,无水
na2so4干燥,减压蒸发多余的甲苯,二氯甲烷溶解,拌入硅胶粉,最后使用硅胶柱层析分离纯化(pe:ea=4:1),得橙红色目标产物90.00mg,收率为28.9%。
[0229]1h nmr(400mhz,cdcl3)δ8.27(s,1h),8.11(d,j=8.3hz,1h),7.76(d,j=8.1hz,1h),7.60-7.52(m,1h),7.52-7.44(m,2h),7.35(d,j=8.5hz,1h),7.10(s,1h),6.98-6.95(m,2h).
[0230]
2-(2,4,5-三氟苯基)-3-硝基-6-甲氧基-2h-苯并[h]色满(13b)
[0231][0232]
合成方法参照13a,得橙红色固体1.55g,收率为30.2%。
[0233]1h nmr(400mhz,cdcl3)δ8.24(s,1h),8.19(t,j=9.6hz,1h),8.06(t,j=9.2hz,1h),7.63-7.45(m,2h),7.06-6.95(m,2h),6.62(s,1h),5.30(s,1h),4.00(s,3h).
[0234]
2-(2,4,5-三氟苯基)-3-硝基-6-溴-2h-苯并[h]色满(13c)
[0235][0236]
合成方法参照13a,得橙红色固体1.21g,收率为29.5%。
[0237]1h nmr(400mhz,cdcl3)δ8.20(s,1h),8.14(dd,j=8.8,2.2hz,1h),7.95(d,j=13.8hz,1h),7.67(d,j=5.8hz,1h),7.63(s,1h),7.59-7.51(m,1h),7.40-7.31(m,1h),7.13-6.98(m,2h).
[0238]
2-(2,4,5-三氟苯基)-3-硝基-6-甲磺酰基-2h-苯并[h]色满(13d)
[0239]
[0240]
合成方法参照13a,得暗红色固体1.02g,收率为10.5%。
[0241]1h nmr(400mhz,cdcl3)δ8.70-8.60(m,1h),8.30(s,1h),8.26(d,j=8.2hz,2h),7.80(dd,j=11.4,4.2hz,1h),7.63(dd,j=13.0,5.8hz,1h),7.18(s,1h),7.15-6.99(m,2h),3.22(s,3h).
[0242]
2-(2,4,5-三氟苯基)-3-硝基-6-甲酸甲酯基-2h-苯并[h]色满(13e)
[0243][0244]
合成方法参照13a,得橙红色固体2.55g,收率为41.1%。
[0245]1h nmr(400mhz,cdcl3)δ8.98(t,j=7.3hz,1h),8.28(s,1h),8.21(s,1h),8.18(d,j=8.4hz,1h),7.70(t,j=8.5hz,1h),7.57-7.51(m,1h),7.15(s,1h),7.09-6.97(m,2h),4.01(s,3h).
[0246]
2-(2,4,5-三氟苯基)-3-硝基-6-甲磺酰胺基-2h-苯并[h]色满(13f)
[0247][0248]
合成方法参照13a,得暗红色固体1.55g,收率为42.1%。
[0249]1h nmr(400mhz,cdcl3)δ8.25(s,1h),8.18(d,j=8.4hz,1h),8.01(d,j=8.5hz,1h),7.69(t,j=7.7hz,1h),7.57(dd,j=9.5,5.3hz,2h),7.12(s,1h),7.11-6.97(m,2h),6.77(s,1h),3.04(s,3h).lc-ms(esi)m/z 449.015[m-h]-.
[0250]
2-(2,4,5-三氟苯基)-3-硝基-6-(1,1,1-三氟甲基)磺酰胺基-2h-苯并[h]色满(13g)
[0251][0252]
合成方法参照13a,得暗红色固体1.05g,收率为32.0%。
[0253]1h nmr(400mhz,dmso-d6)δ8.64(s,1h),8.05(dd,j=15.8,7.0hz,2h),7.82-7.75(m,1h),7.73-7.67(m,2h),7.62(dd,j=16.5,9.2hz,2h),7.17(s,1h).lc-ms(esi)m/z 503.10[m-h]-.
[0254]
2-(2,4,5-三氟苯基)-3-硝基-6-(四氢-2h-吡喃-4-基)-2h-苯并[h]色满(13h)
[0255][0256]
合成方法参照13a,得橙红色固体1.55g,收率为42.9%。
[0257]1h nmr(400mhz,cdcl3)δ8.29(s,1h),8.18(d,j=7.8hz,1h),8.04(dd,j=21.0,6.9hz,1h),7.69-7.56(m,1h),7.50(t,j=7.6hz,1h),7.24(s,1h),7.10(s,1h),7.09-6.96(m,2h),4.41-3.92(m,2h),3.88-3.54(m,3h),3.50-3.34(m,1h),2.00-1.85(m,4h).
[0258]
2-(2,4,5-三氟苯基)-3-硝基-6-吗啉基-2h-苯并[h]色满(13i)
[0259][0260]
合成方法参照13a,得橙红色固体2.01g,收率为40.2%。
[0261]1h nmr(400mhz,cdcl3)δ8.24(d,j=16.2hz,1h),8.16(d,j=8.4hz,1h),8.12(d,j
=8.2hz,1h),7.65-7.55(m,1h),7.50(t,j=7.2hz,1h),7.08(d,j=6.7hz,1h),7.07-6.99(m,2h),6.96(s,1h),4.29-3.63(m,4h),3.30-2.85(m,4h).lc-ms(esi)m/z 443.10[m h]
.
[0262]
2-(2,4,5-三氟苯基)-3-硝基-6-(3-(甲基磺酰基)苯基)-2h-苯并[h]色满(13j)
[0263][0264]
合成方法参照13a,得产物1.55g,收率为38.1%。
[0265]1h nmr(400mhz,cdcl3)δ8.29(s,1h),8.26-8.19(m,1h),8.04(dd,j=7.0,1.3hz,2h),7.80-7.65(m,3h),7.61-7.49(m,2h),7.34(s,1h),7.15(s,1h),7.13-6.99(m,2h),3.14(s,3h).
[0266]
(9)2-(2,4,5-三氟苯基)-3-硝基-2,7-二氢吡喃并[2,3-e]吲哚的合成(18)
[0267][0268]
合成方法参照13a,得橙红色固体1.95g,收率为55.3%。
[0269]1h nmr(400mhz,dmso-d6)δ11.61(s,1h),8.54(s,1h),7.75-7.55(m,1h),7.47-7.38(m,1h),7.33-7.28(m,2h),7.13(d,j=8.4hz,1h),6.99(s,1h),6.45-6.34(s,1h).lc-ms(esi)m/z 345.01[m h]
.
[0270]
2-(2,4,5-三氟苯基)-3-硝基-3,4-二氢-2h-苯并[h]色满衍生物(14a-j)的合成
[0271]
2-(2,4,5-三氟苯基)-3-硝基-3,4-二氢-2h-苯并[h]色满(14a)
[0272][0273]
将化合物2-(2,4,5-三氟苯基)-3-硝基-2h-苯并[h]色烯(500.00mg,1.40mmol),
四氢呋喃5ml,甲醇0.5ml加入到25ml三口瓶中,冰浴下搅拌,缓慢加入nabh4粉末(266.00mg,7.00mmol),tlc监测反应进度,反应结束后,加入饱和nh4cl溶液,乙酸乙酯(10ml)萃取三次,有机相用无水na2so4干燥,减压蒸发除去溶剂。然后用乙醇5ml将上述粗品溶解,加入dipea 0.25ml,常温搅拌,tlc监测。反应结束后,乙酸乙酯(10ml)萃取三次,有机相用卤水洗涤,无水na2so4干燥,减压蒸发除去溶剂,得反式消旋体产品,待投下一步锌粉还原反应。
[0274]
14b-j的合成方法参照14a,粗品直接用于下一步反应。
[0275]
2-(2,4,5-三氟苯基)-3-硝基-2,3,4,7-四氢吡喃并[2,3-e]吲哚的合成(19)
[0276][0277]
合成方法参照14a,粗品直接用于下一步反应。
[0278]
trans-2-(2,4,5-三氟苯基)-3,4-二氢-2h-苯并[h]色满-3-胺衍生物(15a-j)的合成
[0279]
trans-2-(2,4,5-三氟苯基)-3,4-二氢-2h-苯并[h]色满-3-胺(15a)
[0280][0281]
称取化合物trans-2-(2,4,5-三氟苯基)-3-硝基-3,4-二氢-2h-苯并[h]色满(325.00mg,0.90mmol),锌粉(585.00mg,9.00mmol),6n盐酸2.4ml加入到25ml三口反应瓶中,常温下搅拌,tlc监测,反应结束后,加入饱和碳酸氢钠溶液调节ph到弱碱性(7-8),减压抽滤,滤液用乙酸乙酯和水洗涤,有机用相卤水洗涤,无水硫酸钠干燥,硅胶柱层析(200-300)纯化(pe:ea=1:1),得白色固体75.00mg,收率为25.3%。熔点:300.1-301.5℃。
[0282]1h nmr(400mhz,dmso-d6)δ7.95(d,j=7.7hz,1h),7.85(dd,j=8.6,7.3hz,1h),7.77-7.57(m,2h),7.51-7.39(m,3h),7.26(d,j=8.4hz,1h),5.03(d,j=9.1hz,1h),3.37(td,j=9.5,5.4hz,1h),3.18-2.99(m,1h),2.97-2.79(m,1h),2.03-1.44(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.43,149.46,148.76,146.83,133.20,128.18,127.90,126.23,125.90,124.41,124.17,121.41,120.52,117.73,116.07,106.58,77.46,48.65,34.97.hrms(ei):calcd for c
19
h
14
f3no[m]
m/z329.1027;found,329.1028.
[0283]
trans-2-(2,4,5-三氟苯基)-6-甲氧基-3,4-二氢-2h-苯并[h]色满-3-胺(15b)
[0284][0285]
合成方法参照15a,得白色固体22.20mg,收率20.1%。熔点:346.1-347.8℃。
[0286]1h nmr(400mhz,dmso-d6)δ8.14-8.01(m,1h),7.95-7.85(m,1h),7.76-7.54(m,2h),7.52-7.38(m,2h),6.71(s,1h),4.95(d,j=9.0hz,1h),3.93(s,3h),3.40-3.36(m,1h),3.05(dd,j=16.7,5.4hz,1h),2.86(dd,j=16.6,10.1hz,1h),1.61(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.38,149.35,149.15,146.82,142.53,126.54,125.65,125.12,124.75,124.37,121.86,121.36,117.65,115.57,106.54,105.94,77.26,56.11,48.89,35.40.hrms(ei):calcd for c
20
h
16
f3no2[m]
m/z 359.1133;found,359.1132.
[0287]
trans-2-(2,4,5-三氟苯基)-6-溴-3,4-二氢-2h-苯并[h]色满-3-胺(15c)
[0288][0289]
合成方法参照15a,得白色固体20.05mg,收率24.1%。熔点:372.5-373.9℃。
[0290]1h nmr(400mhz,dmso-d6)δ8.02(dd,j=10.0,9.1hz,2h),7.73-7.68(m,1h),7.67(s,1h),7.66-7.60(m,2h),7.54(t,j=8.1hz,1h),5.05(d,j=9.1hz,1h),3.41-3.36(m,1h),3.09(dd,j=16.7,5.2hz,1h),2.99-2.79(m,1h),1.66(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.47,149.55,148.84,146.91,131.58,130.85,128.01,126.94,126.62,125.66,123.72,122.15,117.79,117.63,112.53,106.62,77.58,48.36,34.43.hrms(ei):calcd for c
19
h
13
brf3no[m]
m/z 407.0133;found,407.0134.
[0291]
trans-2-(2,4,5-三氟苯基)-6-甲磺酰基-3,4-二氢-2h-苯并[h]色满-3-胺(15d)
[0292][0293]
合成方法参照15a,得白色固体15.10mg,收率11.5%。熔点:323.9-325.0℃。
[0294]1h nmr(400mhz,dmso-d6)δ8.60(d,j=8.6hz,1h),8.18(d,j=7.9hz,1h),8.08(s,1h),7.84-7.79(m,2h),7.75-7.64(m,2h),5.23(d,j=9.1hz,1h),3.35(s,3h),3.21(dd,j=10.5,5.2hz,1h),3.00(dd,j=16.5,10.3hz,1h),1.80(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.54,153.81,149.66,146.86,132.33,128.82,128.43,127.93,127.03,124.88,124.28,123.43,122.73,117.90,115.13,106.70,78.19,48.16,44.65,34.32.hrms(ei):calcd for c
20
h
16
f3no3s[m]
m/z407.0803;found,407.0801.
[0295]
trans-2-(2,4,5-三氟苯基)-6-甲酸甲酯基-3,4-二氢-2h-苯并[h]色满-3-胺(15e)
[0296][0297]
合成方法参照15a,得白色固体55.15mg,收率15.0%。熔点:377.1-378.5℃。
[0298]1h nmr(400mhz,dmso-d6)δ8.92(d,j=8.6hz,1h),8.21-8.03(m,2h),7.83-7.62(m,3h),7.56(t,j=7.6hz,1h),5.18(d,j=9.1hz,1h),3.96(s,3h),3.45-3.43(m,1h),3.16(dd,j=16.4,5.1hz,1h),2.95(dd,j=16.4,10.4hz,1h),1.27(s,2h).
13
c nmr(151mhz,dmso-d6)δ168.47,157.32,155.65,151.65,151.36,149.71,147.63,146.04,133.34(s),131.74,128.35,126.60,126.19,124.54,121.83,120.72,120.47,118.09,112.13(s),107.53,72.95,56.48,46.55.hrms(ei):calcd for c
21
h
16
f3no3[m]
m/z 387.1082;found,387.1080.
[0299]
trans-2-(2,4,5-三氟苯基)-6-甲磺酰胺基-3,4-二氢-2h-苯并[h]色满-3-胺(15f)
[0300][0301]
合成方法参照15a,得白色固体44.55mg,收率12.0%。熔点:376.6-378.1℃。
[0302]1h nmr(400mhz,dmso-d6)δ8.16(d,j=8.3hz,1h),7.96(d,j=8.1hz,1h),7.77-7.59(m,2h),7.51(dt,j=14.9,7.0hz,2h),7.27(s,2h),6.70(s,1h),5.05(d,j=9.1hz,1h),3.08(dd,j=16.6,5.1hz,1h),3.00(s,3h),2.89(dd,j=16.4,10.3hz,1h),1.77(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.50,149.52,147.96,146.86,130.46,126.87,126.61,126.27,125.82,124.95,124.05,123.92,121.62,117.73,115.80,106.66,77.59,48.53,34.78,22.97.hrms(ei):calcd for c
20
h
17
f3n2o3s[m]
m/z 422.0912;found,422.0911.
[0303]
trans-2-(2,4,5-三氟苯基)-6-(1,1,1-三氟甲基)磺酰胺基-3,4-二氢-2h-苯并[h]色满-3-胺(15g)
[0304][0305]
合成方法参照15a,得白色固体55.50mg,收率15.0%。熔点:380.8-381.9℃。
[0306]1h nmr(400mhz,dmso-d6)δ10.12(s,1h),8.40-8.28(m,1h),7.91(dd,j=6.5,3.0hz,1h),7.79-7.66(m,1h),7.56-7.47(m,1h),7.42(dd,j=6.4,3.3hz,2h),6.97(s,1h),5.50(d,j=7.2hz,1h),4.13(dd,j=13.1,7.0hz,1h),3.13(dd,j=17.0,5.4hz,1h),3.03(dd,j=16.9,7.3hz,1h).
13
c nmr(151mhz,dmso-d6)δ156.14,150.21,146.78,141.78,132.00,130.73,129.14,125.86,125.24,125.04,124.78,123.74,121.32,120.72,118.28,117.62,112.53,107.40,71.85,47.12,28.77.hrms(ei):calcd for c
20
h
14
f6n2o3s[m]
m/z 476.0629;found,476.0628.
[0307]
trans-2-(2,4,5-三氟苯基)-6-(四氢-2h-吡喃-4-基)-3,4-二氢-2h-苯并[h]色满-3-胺(15h)
[0308][0309]
合成方法参照15a,得白色固体60.10mg,收率15.1%。熔点:402.9-403.6℃。
[0310]1h nmr(400mhz,dmso-d6)δ8.12(d,j=8.5hz,1h),7.98(d,j=8.1hz,1h),7.64(dt,j=17.2,11.2hz,2h),7.49(dd,j=15.6,8.1hz,1h),7.46-7.39(m,1h),7.15(s,1h),4.99(d,j=9.1hz,1h),4.02(dd,j=21.1,9.0hz,2h),3.62(dd,j=15.7,9.1hz,2h),3.56-3.45(m,1h),3.05(dd,j=16.5,5.1hz,1h),2.86(dd,j=16.3,10.3hz,1h),1.85-1.70(m,5h).
13
c nmr(151mhz,dmso-d6)δ156.48,149.44,147.31,146.85,134.33,130.75,126.24,125.51,124.77,124.62,124.29,123.42,122.12,117.73,115.50,106.63,77.41,68.08,48.76,35.74,35.08,34.16.hrms(ei):calcd for c
24
h
22
f3no2[m]
m/z 413.1603;found,413.1602.
[0311]
trans-2-(2,4,5-三氟苯基)-6-吗啉基-3,4-二氢-2h-苯并[h]色满-3-胺(15i)
[0312][0313]
合成方法参照15a,得白色固体25.10mg,收率23.5%。熔点:431.9-433.2℃。
[0314]1h nmr(400mhz,dmso-d6)δ8.12(d,j=7.9hz,1h),7.93(d,j=8.0hz,1h),7.77-7.56(m,2h),7.54-7.38(m,2h),6.92(s,1h),4.97(d,j=9.1hz,1h),3.95-3.72(m,4h),3.34-3.30(m,1h),3.02(dt,j=12.0,6.0hz,1h),2.98-2.90(m,4h),2.84(dd,j=16.5,10.2hz,1h),1.61(s,2h).
13
c nmr(101mhz,dmso-d6)δ150.70,148.10,145.26,142.86,139.89,128.29,126.00,125.87,125.39,124.26,123.55,121.89,117.62,117.01,115.57,106.59,77.36,67.15,53.88,48.80,35.16.hrms(ei):calcd for c
23
h
21
f3n2o2[m]
m/z 414.1555;found,414.1554.
[0315]
trans-2-(2,4,5-三氟苯基)-6-羧基-3,4-二氢-2h-苯并[h]色满-3-胺(15j)
[0316][0317]
称取3-氨基-2-(2,4,5-三氟苯基)-3,4-二氢-2h-苯并[h]色烯-6-羧酸甲酯(20.00mg,0.05mmol),加入2ml甲醇溶解,加入氢氧化钠水溶液(6.00mg,0.15mmol),50℃回流,反应结束后,稀盐酸调节ph至中性,乙酸乙酯(10ml)萃取三次,无水na2so4干燥,硅胶柱层析纯化(pe:ea=1:2),得白色固体10.10mg,收率50.0%。熔点:484.5-485.6℃。
[0318]1h nmr(400mhz,dmso-d6)δ9.01(d,j=8.5hz,1h),8.03(d,j=6.7hz,2h),7.78-7.62(m,2h),7.59(t,j=7.1hz,1h),7.49(t,j=7.2hz,1h),5.14(d,j=9.0hz,1h),3.12(dd,j=16.4,5.1hz,2h),2.92(dd,j=16.3,10.3hz,2h),1.91(s,2h).
13
c nmr(151mhz,dmso-d6)δ172.00,156.35,154.12,149.45,143.19,132.78,129.92,129.24,128.36,128.09,127.35,126.15,123.75,122.63,117.90,116.93,106.64,77.07,48.31,34.45.hrms(ei):calcd for c
20
h
14
f3no3[m]
m/z373.0926;found,373.0925.
[0319]
trans-2-(2,4,5-三氟苯基)-6-(3-(甲基磺酰)苯基)-3,4-二氢-2h-苯并[h]色满-3-胺(15k)
[0320][0321]
合成方法参照15a,得白色固体10.50mg,收率10.1%。熔点:430.5-431.6℃。
[0322]1h nmr(400mhz,dmso-d6)δ8.19-8.08(m,1h),8.08-8.00(m,2h),7.95-7.82(m,2h),7.81-7.64(m,3h),7.60-7.48(m,2h),7.36(s,1h),5.14(d,j=9.1hz,1h),3.36(s,3h),3.18(dd,j=16.6,5.2hz,1h),2.98(dd,j=16.5,10.2hz,1h),1.73(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.49,149.59,149.03,148.75,146.88,141.66,141.49,135.45,130.60,130.50,130.09,129.70,128.32,127.08,126.17,126.04,125.09,124.60,124.02,122.04,117.74,115.92,106.67,77.73,48.60,43.97,34.75.hrms(ei):calcd for c
26
h
20
f3no3s[m]
m/z 483.1116;found,483.1115.
[0323]
(13)trans-2-(2,4,5-三氟苯基)-2,3,4,7-四氢吡喃并[2,3-e]吲哚3-胺的合成(20)
[0324][0325]
合成方法参照15a,得白色固体125.00mg,收率为33.0%。熔点:310.1-313.5℃。
[0326]1h nmr(400mhz,dmso-d6)δ11.01(s,1h),7.68-7.55(m,2h),7.22-7.13(m,1h),6.96(d,j=8.4hz,1h),6.81(d,j=8.2hz,1h),6.27(d,j=2.0hz,1h),4.93(d,j=8.9hz,1h),3.31(dd,j=8.7,4.9hz,1h),2.96(dd,j=15.7,5.2hz,1h),2.77(dd,j=15.6,10.1hz,1h),1.59(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.28,149.32,146.82,146.72,136.60,124.56,124.28,123.26,118.17,117.77,109.45,106.58,105.32,98.26,77.12,49.02,34.63.hrms(ei):calcd for c
20
h
14
f3no3[m]
m/z 318.0980;found,318.0982.
[0327]
(14)1,1,1-三氟-n-(3-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)苯基)甲磺酰胺的合成(25e)
[0328][0329]
取3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯胺(1.00g,4.76mmol),三乙胺(0.92g,9.14mmol),二氯甲烷(10ml)于100ml反应瓶中,-78℃下加如三氟甲磺酸酐(1.29g,4.76mmol),滴加完毕后移至室温继续搅拌,tlc监测反应。待原料转化完全后,向反应瓶加入水淬灭,二氯甲烷(20ml)萃取三次,有机相用卤水洗涤,无水na2so4干燥,柱层析分离纯化(pe:ea=5:1),得产品1.20g,产率为68.2%。
[0330]1h nmr(400mhz,cdcl3)δ7.65(d,j=7.1hz,1h),7.54(d,j=1.9hz,1h),7.40-7.26(m,3h),1.30-1.15(m,12h).lc-ms(esi)m/z 350.09[m-h]-.
[0331]
4-羟基-(1,1'-联苯)-3-甲醛衍生物(26a-j)的合成
[0332]
4-羟基-(1,1'-联苯)-3-甲醛(26a)
[0333][0334]
将5-溴-2-羟基苯甲醛(1.00g,5.00mmol),苯硼酸(1.22g,10.00mmol),碳酸铯(4.88g,15.00mmol),pdcl2(dppf)2(183.10mg,0.25mmol)加入到反应瓶中,甲苯30ml,水5ml溶解,氮气保护,100℃加热回流,tlc监测。反应结束后,过滤,滤液用乙酸乙酯(10ml)萃取三次,再用无水na2so4干燥,将溶液旋干,硅胶柱层析分离(pe:ea=10:1),得产品0.80g,产
率为80.1%。
[0335]1h nmr(400mhz,cdcl3)δ11.01(s,1h),9.96(s,1h),7.79-7.72(m,2h),7.54(d,j=7.3hz,2h),7.45(t,j=7.7hz,2h),7.35(t,j=7.3hz,1h),7.07(d,j=8.5hz,1h).lc-ms(esi)m/z 197.01[m-h]-.
[0336]
4-羟基-3'-(甲基磺酰基)-[1,1'-联苯]-3-甲醛(26b)
[0337][0338]
合成方法参照26a,得产物1.22g,产率90.1%。
[0339]1h nmr(400mhz,cdcl3)δ11.10(s,1h),10.02(s,1h),8.15(s,1h),7.93(t,j=8.8hz,1h),7.90-7.79(m,3h),7.74-7.65(m,1h),7.14(d,j=8.6hz,1h),3.13(s,3h).lc-ms(esi)m/z 275.10[m-h]-.
[0340]
3'-甲酰基-4'-羟基-[1,1'-联苯基]-3-羧酸甲酯(26c)
[0341][0342]
合成方法参照26a,得产物1.10g,产率为85.9%。
[0343]1h nmr(400mhz,cdcl3)δ11.05(s,1h),10.00(s,1h),8.24(t,j=1.6hz,1h),8.05-8.00(m,1h),7.84-7.78(m,2h),7.75(dd,j=3.9,2.7hz,1h),7.53(t,j=7.8hz,1h),7.10(d,j=9.3hz,1h),3.96(s,3h).lc-ms(esi)m/z 255.10[m-h]-.
[0344]
n-(3'-甲酰基-4'-羟基-[1,1'-联苯]-3-基)甲磺酰胺(26d)
[0345][0346]
合成方法参照26a,得产物1.02g,产率91.1%。
[0347]1h nmr(400mhz,cdcl3)δ11.05(s,1h),9.97(s,1h),7.83-7.70(m,2h),7.48(s,1h),7.45(t,j=7.8hz,1h),7.38(d,j=7.8hz,1h),7.32(s,1h),7.29-7.24(m,1h),7.09(t,j=12.1hz,1h),3.10(s,3h).lc-ms(esi)m/z 290.01[m-h]-.
[0348]
1,1,1-三氟-n-(3'-甲酰基-4'-羟基-[1,1'-联苯]-3-基)甲磺酰胺(26e)
[0349][0350]
合成方法参照26a,得产物1.50g,产率89.1%。
[0351]1h nmr(400mhz,dmso-d6)δ11.97(s,1h),10.94(s,1h),10.34(s,1h),7.89(d,j=2.5hz,1h),7.81(dd,j=8.6,2.5hz,1h),7.55(t,j=6.1hz,1h),7.54-7.46(m,2h),7.25(dd,j=7.9,1.0hz,1h),7.14(d,j=8.6hz,1h).lc-ms(esi)m/z 255.10[m-h]-.
[0352]
3'-甲酰基-4'-羟基-[1,1'-联苯基]-3-羧酸(26f)
[0353][0354]
合成方法参照26a,得产物1.51g,产率90.2%。
[0355]1h nmr(400mhz,dmso-d6)δ13.03(s,1h),10.78(d,j=174.9hz,1h),10.34(s,1h),8.16(s,1h),7.98(d,j=2.2hz,1h),7.95-7.87(m,3h),7.59(t,j=7.7hz,1h),7.14(d,j=8.6hz,1h).lc-ms(esi)m/z 241.10[m-h]-.
[0356]
4-羟基-3'-(1h-四唑-5-基)-[1,1'-联苯]-3-甲醛(26g)
[0357][0358]
合成方法参照26a,得产物0.51g,产率31.2%。
[0359]1h nmr(600mhz,dmso-d6)δ11.00(s,1h),10.45-10.33(m,1h),8.32(t,j=1.5hz,1h),8.06(d,j=2.5hz,1h),8.04(dd,j=11.3,4.6hz,1h),7.96(dd,j=8.6,2.5hz,1h),7.88-7.82(m,1h),7.67(t,j=7.8hz,1h),7.18(d,j=4.0hz,1h).lc-ms(esi)m/z 241.10[m-h]-.
[0360]
3'-甲酰基-4'-羟基-[1,1'-联苯]-3-甲腈(26h)
[0361][0362]
合成方法参照26a,得产物1.40g,产率85.4%。
[0363]1h nmr(400mhz,cdcl3)δ11.09(s,1h),10.00(s,1h),7.85-7.83(m,1h),7.82-7.78
(m,1h),7.78-7.71(m,2h),7.67-7.63(m,1h),7.58(t,j=7.7hz,1h),7.13(d,j=8.4hz,1h).lc-ms(esi)m/z 222.10[m-h]-.
[0364]
2',4'-二氟-4-羟基-[1,1'-联苯]-3-甲醛(26i)
[0365][0366]
合成方法参照26a,得产物1.10g,产率89.2%。
[0367]1h nmr(400mhz,cdcl3)δ11.06(s,1h),9.95(s,1h),7.76-7.60(m,2h),7.39(td,j=8.7,6.6hz,1h),7.08(d,j=8.6hz,1h),7.03-6.88(m,2h).lc-ms(esi)m/z 233.10[m-h]-.
[0368]
4-羟基-3',4'-二甲氧基-[1,1'-联苯]-3-甲醛(26j)
[0369][0370]
合成方法参照26a,得产物1.20g,产率82.2%。
[0371]1h nmr(400mhz,cdcl3)δ10.88(s,1h),9.87(s,1h),7.63(dd,j=8.5,2.3hz,1h),7.61(d,j=2.2hz,1h),7.02-6.98(m,1h),6.96(dd,j=5.3,3.1hz,2h),6.87-6.84(m,1h),3.87(s,3h),3.83(s,3h).lc-ms(esi)m/z 257.01[m-h]-.
[0372]
2-(2,4,5-三氟苯基)-3-硝基-6-溴-2h-色满的合成(22)
[0373][0374]
5-溴-2-羟基苯甲醛(1.00g,5.00mmol),20ml甲苯,2,4,5-三氟苯硝基乙烯(1.12g,5.50mmol),l-哌啶加酸(0.65g,5.00mmol),加入到100ml反应瓶中氮气保护,120℃过夜搅拌。冷却至室温,二氯甲烷萃取三次,无水na2so4干燥,减压蒸发,硅胶柱层析纯化(pe:ea=15:1),得橙红色目标产物1.50g,收率为78.1%。
[0375]1h nmr(400mhz,cdcl3)δ7.93(s,1h),7.39(d,j=2.2hz,1h),7.32(dt,j=11.9,5.9hz,1h),6.98-6.84(m,2h),6.73(s,1h),6.66(t,j=10.2hz,1h).
[0376]
2-(2,4,5-三氟苯基)-3-硝基-6-苯基-2h-色满衍生物(27a-j)的合成
[0377]
2-(2,4,5-三氟苯基)-3-硝基-6-苯基-2h-色满(27a)
[0378][0379]
合成方法参照22,得产物1.01g,产率88.4%。
[0380]1h nmr(400mhz,cdcl3)δ8.14(s,1h),7.56(dd,j=8.4,2.1hz,1h),7.54-7.51(m,2h),7.50(s,1h),7.43(t,j=7.6hz,2h),7.35(t,j=7.3hz,1h),7.09-6.94(m,2h),6.90(d,j=8.4hz,1h),6.84(s,1h).
[0381]
2-(2,4,5-三氟苯基)-3-硝基-6-(3-(甲基磺酰基)苯基)-2h-色满(27b)
[0382][0383]
合成方法参照22,得产物1.31g,产率90.4%。
[0384]1h nmr(400mhz,cdcl3)δ8.21(s,1h),8.13(t,j=1.6hz,1h),7.94(t,j=9.3hz,1h),7.89-7.80(m,1h),7.69(t,j=7.8hz,1h),7.66-7.60(m,2h),7.12-7.01(m,2h),6.99(d,j=8.0hz,1h),6.90(s,1h),3.13(s,3h).
[0385]
2-(2,4,5-三氟苯基)-3-硝基-6-(3-(甲酸甲酯基)苯基)-2h-色满(27c)
[0386][0387]
合成方法参照22,得产物1.21g,产率86.4%。
[0388]1h nmr(400mhz,cdcl3)δ8.22(s,1h),8.18(s,1h),8.03(d,j=7.8hz,1h),7.72(d,j=7.8hz,1h),7.62-7.60(m,1h),7.60(s,1h),7.52(t,j=7.8hz,1h),7.10-6.98(m,2h),6.94(d,j=9.2hz,1h),6.87(s,1h),3.95(s,3h).
[0389]
2-(2,4,5-三氟苯基)-3-硝基-6-(3-(甲磺酰胺基)苯基)-2h-色满(27d)
[0390][0391]
合成方法参照22,得产物1.11g,产率89.0%。
[0392]1h nmr(400mhz,cdcl3)δ8.20(s,1h),7.61-7.56(m,2h),7.51-7.42(m,2h),7.38(d,j=7.8hz,1h),7.23(d,j=7.6hz,1h),7.13-7.00(m,2h),6.95(d,j=9.1hz,1h),6.89(s,1h),6.85(s,1h),3.09(s,3h).lc-ms(esi)m/z 475.10[m-h]-.
[0393]
2-(2,4,5-三氟苯基)-3-硝基-6-(3-((1,1,1-三氟甲基)甲磺酰胺基)苯基)-2h-色满(27e)
[0394][0395]
合成方法参照22,得产物1.20g,产率87.0%。
[0396]1h nmr(400mhz,cdcl3)δ8.10(s,1h),7.53-7.44(m,2h),7.41-7.33(m,4h),7.18(dd,j=7.1,3.7hz,1h),7.02-6.90(m,2h),6.86(d,j=9.1hz,1h),6.79(s,1h).lc-ms(esi)m/z 529.01[m-h]-.
[0397]
2-(2,4,5-三氟苯基)-3-硝基-6-(3-(羧基)苯基)-2h-色满(27f)
[0398][0399]
合成方法参照22,得产物1.10g,产率89.0%。
[0400]1h nmr(400mhz,dmso)δ10.29(s,1h),8.48(s,1h),8.17(s,1h),7.99(d,j=1.8hz,1h),7.92(d,j=7.7hz,1h),7.87(d,j=7.8hz,1h),7.72(dd,j=8.5,1.9hz,1h),7.67-7.54(m,2h),7.48(dd,j=17.1,8.8hz,1h),6.97(d,j=8.5hz,1h),6.88(s,1h).lc-ms(esi)m/z 426.01[m-h]-.
[0401]
2-(2,4,5-三氟苯基)-3-硝基-6-(3-(四唑基)苯基)-2h-色满(27g)
[0402][0403]
合成方法参照22,得产物0.20g,产率23.1%。
[0404]1h nmr(400mhz,cdcl3)δ8.00(s,1h),7.90-7.75(m,2h),7.72-7.62(m,2h),7.57(t,j=6.9hz,1h),7.51-7.43(m,2h),6.94-6.90(m,2h),6.63(s,2h).lc-ms(esi)m/z 450.01[m-h]-.
[0405]
2-(2,4,5-三氟苯基)-3-硝基-6-(3-(氰基)苯基)-2h-色满(27h)
[0406][0407]
合成方法参照22,得产物1.11g,产率87.0%。
[0408]1h nmr(400mhz,cdcl3)δ8.10(s,1h),7.74(d,j=1.4hz,1h),7.71-7.67(m,1h),7.62-7.54(m,1h),7.52-7.46(m,3h),7.02-6.92(m,2h),6.92-6.86(m,1h),6.80(s,1h).
[0409]
2-(2,4,5-三氟苯基)-3-硝基-6-(2,4-二氟苯基)-2h-色满(27i)
[0410][0411]
合成方法参照22,得产物1.33g,产率93.1%。
[0412]1h nmr(400mhz,cdcl3)δ8.16(s,1h),7.54-7.46(m,2h),7.40-7.31(m,1h),7.11-7.08(m,2h),7.01-6.90(m,3h),6.87(s,1h),2.04(s,1h).
[0413]
2-(2,4,5-三氟苯基)-3-硝基-6-(3,4-二甲氧基苯基)-2h-色满(27j)
[0414][0415]
合成方法参照22,得产物1.43g,产率90.1%。
[0416]1h nmr(400mhz,cdcl3)δ8.07(s,1h),7.47-7.41(m,2h),6.99(dd,j=8.2,2.1hz,1h),6.97-6.92(m,2h),6.91(dd,j=7.3,4.1hz,1h),6.85(d,j=8.3hz,1h),6.81(d,j=
8.4hz,1h),6.76(s,1h),3.86(s,3h),3.83(s,3h).
[0417]
2-(2,4,5-三氟苯基)-3-硝基-6-溴-3,4-二氢-2h-色满的合成(23)
[0418][0419]
将化合物2-(2,4,5-三氟苯基)-3-硝基-6-溴-2h-色满(500.00mg,1.30mmol)加入到25ml反应瓶中,加入thf 5ml和ch3oh 0.5ml溶解,冰浴下搅拌,然后缓慢加入nabh4固体(266.00mg,7.00mmol),tlc监测反应进度,反应结束后,加入饱和nh4cl溶液,再用乙酸乙酯和水萃取,有机相用无水na2so4干燥,减压蒸发除去溶剂。乙醇5ml将上述粗品溶解,加入dipea 0.25ml,常温搅拌,tlc监测。反应结束后,然后用乙酸乙酯和水萃取三次,有机相用卤水洗涤,无水na2so4干燥,减压蒸发除去溶剂,得反式消旋体产品,用于下一步反应的原料。
[0420]
2-(2,4,5-三氟苯基)-3-硝基-6-苯基-3,4-二氢-2h-色满衍生物的合成(28a-j)
[0421]
2-(2,4,5-三氟苯基)-3-硝基-6-苯基-3,4-二氢-2h-色满(28a)
[0422][0423]
28a-j合成方法参照化合物23,粗品直接投下一步反应。
[0424]
trans-2-(2,4,5-三氟苯基)-6-溴-3,4-二氢-2h-色满-3-胺的合成(24)
[0425][0426]
称取化合物trans-2-(2,4,5-三氟苯基)-3-硝基-6-溴-3,4-二氢-2h-色满(500.00mg,1.30mmol),锌粉(845.00mg,13.00mmol),乙醇5ml,6n盐酸4ml加入到25ml三口反应瓶中,常温下搅拌,tlc监测,反应结束后,加入饱和nahco3溶液调节ph至7-8,减压抽滤,滤液用乙酸乙酯和水洗涤,有机用相卤水洗涤,无水na2so4干燥,硅胶柱层析纯化(pe:ea=1:1),得白色固体100.05mg,产率为21.6%。熔点:282.1-283.2℃。
[0427]1h nmr(400mhz,dmso-d6)δ7.66-7.54(m,2h),7.34(d,j=2.3hz,1h),7.24(dd,j=8.7,2.4hz,1h),6.77(d,j=8.7hz,1h),4.86(d,j=9.1hz,1h),3.24(td,j=9.7,5.2hz,1h),2.97(dd,j=16.6,5.1hz,1h),2.73(dd,j=16.5,10.6hz,1h),1.58(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.36,153.63,149.45,146.78,132.32,130.32,125.07,123.71,
118.51,117.79,112.43,106.52,77.25,48.02,34.42.hrms(ei):calcd for c
15
h
11
brf3no[m]
m/z 356.9976;found,356.9975.
[0428]
trans-2-(2,4,5-三氟苯基)-6-苯基-3,4-二氢-2h-色满-3-胺衍生物的合成(29a-j)
[0429]
trans-2-(2,4,5-三氟苯基)-6-苯基-3,4-二氢-2h-色满-3-胺(29a)
[0430][0431]
合成方法参照化合物24,得产物15.05mg,产率为78.5%。熔点:316.4-318.4℃。
[0432]1h nmr(400mhz,dmso-d6)δ7.64-7.60(m,3h),7.47-7.43(m,2h),7.42-7.38(m 2h),7.35-7.27(m,1h),6.89(d,j=8.4hz,1h),4.90(d,j=9.1hz,1h),3.30(d,j=4.4hz,1h),3.05(dd,j=16.4,5.1hz,1h),2.80(dd,j=16.2,10.6hz,1h),1.24(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.43,154.00,149.51,146.77,140.36,133.25,129.30,128.31,127.19,126.66,126.06,123.99,122.65,117.78,116.79,106.53,77.29,48.44,34.86.hrms(ei):calcd for c
21
h
16
f3no[m]
m/z 355.1184;found,355.1183.
[0433]
trans-2-(2,4,5-三氟苯基)-6-(3-(甲磺酰基)苯基)-3,4-二氢-2h-色满-3-胺(29b)
[0434][0435]
合成方法参照化合物24,得产物60.10mg,产率为70.0%。熔点:340.2-340.7℃。
[0436]1h nmr(400mhz,dmso-d6)δ8.13(s,1h),7.98(d,j=7.2hz,1h),7.86(d,j=7.1hz,1h),7.70(t,j=7.5hz,1h),7.67-7.55(m,3h),7.52(d,j=7.9hz,1h),6.94(d,j=8.2hz,1h),4.93(d,j=8.7hz,1h),3.35-3.27(m,4h),3.07(d,j=12.5hz,1h),2.91-2.75(m,1h),1.63(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.38,154.70,149.50,146.81,142.02,141.52,131.60,131.39,130.43,128.71,126.45,125.40,124.81,123.89,122.99,117.81,117.03,106.59,77.40,48.38,43.95,34.75.hrms(ei):calcd for c
22
h
18
f3no3s[m]
m/z 433.0959;found,433.0959.
[0437]
trans-2-(2,4,5-三氟苯基)-6-(3-(甲酸甲酯基)苯基)-3,4-二氢-2h-色满-3-胺(29c)
[0438][0439]
合成方法参照化合物24,得产物50.10mg,产率为63.0%。熔点:393.8-394.6℃。
[0440]1h nmr(400mhz,dmso-d6)δ8.15(t,j=1.6hz,1h),7.91(dd,j=7.8,1.3hz,2h),7.5-7.68(m,3h),7.50(d,j=2.1hz,1h),7.45(dd,j=8.5,2.2hz,1h),6.91(d,j=8.4hz,1h),4.91(d,j=9.1hz,1h),3.89(s,3h),3.29(dd,j=9.7,5.1hz,1h),3.07(dd,j=16.4,5.1hz,1h),2.81(dd,j=16.3,10.7hz,1h),1.59(s,2h).
13
c nmr(151mhz,dmso-d6)δ166.72,156.37,154.41,149.45,146.78,140.86,132.06,131.49,130.72,129.87,128.47,127.85,127.04,126.20,123.94,122.92,117.82,116.98,106.58,77.37,52.70,48.40,34.77.hrms(ei):calcd for c
23
h
18
f3no3[m]
m/z 413.1239;found,413.1238.
[0441]
trans-2-(2,4,5-三氟苯基)-6-(3-(甲磺酰胺基)苯基)-3,4-二氢-2h-色满-3-胺(29d)
[0442][0443]
合成方法参照化合物24,得产物40.50mg,产率为85.0%。熔点:392.8-393.5℃。
[0444]1h nmr(400mhz,dmso-d6)δ7.68-7.56(m,2h),7.43(d,j=1.7hz,1h),7.42-7.38(m,2h),7.38-7.33(m,2h),7.20-7.14(m,1h),6.93(d,j=8.4hz,1h),5.02(d,j=8.9hz,1h),3.46(m,1h),3.10(dd,j=16.5,5.1hz,1h),3.10(s,3h),2.94-2.82(m,1h),1.99(s,1h).
13
c nmr(151mhz,dmso-d6)δ172.51,170.84,156.29,152.78,150.38,146.81,140.42,134.53,129.56,128.39,126.88,122.97,122.19,121.48,120.68,119.23,118.10,117.28,107.38,72.09,46.87,28.95.hrms(ei):calcd for c
22
h
19
f3n2o3s[m]
m/z 448.1068;found,448.1071.
[0445]
trans-2-(2,4,5-三氟苯基)-6-(3-((1,1,1-三氟甲基)甲磺酰胺基)苯基)-3,4-二氢-2h-色满-3-胺(29e)
[0446][0447]
合成方法参照化合物24,得产物50.50mg,产率为89.0%。熔点:397.0-397.9℃。
[0448]1h nmr(400mhz,dmso)δ8.49-7.97(s,1h),7.72(dd,j=17.0,10.1hz,1h),7.63(dd,j=17.0,8.6hz,1h),7.50-7.37(m,2h),7.33-7.23(m,2h),7.19(d,j=7.6hz,1h),7.09-6.95(m,2h),5.38(d,j=8.0hz,1h),4.14-4.02(m,1h),3.26-3.17(m,1h),3.08(dd,j=16.3,8.7hz,1h).
13
c nmr(151mhz,dmso)δ156.37,153.94,149.72,146.80,141.48,139.38,133.07,130.28,128.36,126.30,123.23,122.37,122.01,118.66,118.07,117.82,116.99,106.80,76.38,60.23,48.13,33.48.hrms(ei):calcd for c
22
h
16
f6n2o3s[m]
m/z 502.0786;found,502.0781.
[0449]
trans-2-(2,4,5-三氟苯基)-6-(3-(羧基)苯基)-3,4-二氢-2h-色满-3-胺(29f)
[0450][0451]
合成方法参照化合物24,得产物20.50mg,产率为70.0%。熔点:500.8-501.6℃。
[0452]1h nmr(400mhz,dmso-d6)δ8.16(s,1h),7.89(d,j=7.4hz,1h),7.78(d,j=7.7hz,1h),7.70-7.56(m,2h),7.55-7.46(m,2h),7.44(d,j=8.5hz,1h),6.91(d,j=8.4hz,1h),4.95(d,j=9.1hz,1h),3.40-3.31(m,1h),3.09(dd,j=16.4,5.0hz,1h),2.84(dd,j=16.3,10.6hz,1h).
13
c nmr(151mhz,dmso-d6)δ168.47,157.32,155.65,151.65(s),151.36,149.71,147.63,146.04,133.34,131.74,128.35,126.60,126.19,124.54,121.83,120.72,120.47,118.09,112.13,107.53,72.95,56.48,46.55.hrms(ei):calcd for c
22
h
16
f3no3[m]
m/z 399.1082;found,399.1080.
[0453]
trans-2-(2,4,5-三氟苯基)-6-(3-(四唑基)苯基)-3,4-二氢-2h-色满-3-胺(29g)
[0454]
[0455]
合成方法参照化合物24,得产物10.50mg,产率为10.5%。熔点:761.6-762.8℃。
[0456]1h nmr(400mhz,dmso-d6)δ8.23(s,1h),8.10(s,1h),7.92(d,j=7.5hz,1h),7.72-7.57(m,2h),7.48(dt,j=27.8,7.6hz,4h),6.91(d,j=8.4hz,1h),4.93(d,j=9.0hz,1h),3.10(dd,j=16.4,5.0hz,1h),2.85(dd,j=15.8,10.5hz,1h),1.89(s,2h).
13
c nmr(151mhz,dmso-d6)δ156.42,153.90,149.58,146.81,140.35,133.54,133.25,130.12,129.42,128.26,126.09,125.45,124.81,124.09,123.76,122.42,117.82,116.87,106.65,76.94,48.33,34.36.hrms(ei):calcd for c
22
h
16
f3n5o[m]
m/z 423.1307;found,423.1306.
[0457]
trans-2-(2,4,5-三氟苯基)-6-(3-(氰基)苯基)-3,4-二氢-2h-色满-3-胺(29h)
[0458][0459]
合成方法参照化合物24,得产物45.05mg,产率为79.5%。熔点:405.2-406.2℃。
[0460]1h nmr(400mhz,dmso-d6)δ8.06(s,1h),7.94(d,j=8.1hz,1h),7.72(d,j=7.7hz,1h),7.66-7.53(m,4h),7.50(dd,j=8.5,2.0hz,1h),6.95(d,j=8.5hz,1h),5.16(d,j=8.6hz,1h),3.59(td,j=9.1,5.5hz,1h),3.28-3.11(m,1h),2.97(dd,j=16.5,9.8hz,1h).
13
c nmr(151mhz,dmso-d6)δ156.35,154.21,149.91,146.75,141.23,131.29,130.73,130.45,130.04,128.75,126.59,122.46,121.58,119.31,117.89,117.13,112.47,106.90,75.65,47.96,32.23.hrms(ei):calcd for c
22
h
15
f3n2o[m]
m/z 380.1136;found,380.1131.
[0461]
trans-2-(2,4,5-三氟苯基)-6-(2,4-二氟苯基)-3,4-二氢-2h-色满-3-胺(29i)
[0462][0463]
合成方法参照化合物24,得产物70.50mg,产率为80.5%。熔点:342.6-343.8℃。
[0464]1h nmr(400mhz,dmso-d6)δ7.67-7.54(m,2h),7.54-7.48(m,1h),7.34-7.27(m,2h),7.27-7.22(m,1h),7.20-7.08(m,1h),6.89(d,j=8.4hz,1h),4.92(d,j=9.1hz,1h),3.30(td,j=9.8,5.1hz,1h),3.02(dd,j=16.4,5.1hz,1h),2.79(dd,j=16.2,10.6hz,1h),1.57(s,2h).
13
c nmr(151mhz,dmso-d6)δ161.43,159.80,156.39,154.12,149.43,146.79,131.94,130.38,128.19,127.16,125.08,123.88,122.48,117.74,116.51,112.35,106.47,104.79,77.33,48.43,34.77.hrms(ei):calcd for c
21
h
14
f5no[m]
m/z 391.0996;
found,391.0995.
[0465]
trans-2-(2,4,5-三氟苯基)-6-(3,4-二甲氧基苯基)-3,4-二氢-2h-色满-3-胺(29j)
[0466][0467]
合成方法参照化合物24,得产物60.50mg,产率为81.5%。熔点:408.4-409.5℃。
[0468]1h nmr(400mhz,dmso-d6)δ7.70-7.53(m,2h),7.46-7.38(m,2h),7.17(d,j=2.0hz,1h),7.13(dd,j=8.3,2.1hz,1h),7.00(dd,j=12.7,8.7hz,1h),6.89(d,j=8.4hz,1h),5.09(d,j=8.6hz,1h),3.84(s,3h),3.78(s,3h),3.55(td,j=9.1,5.3hz,1h),3.13(dd,j=16.5,5.1hz,1h),2.92(dd,j=16.4,9.8hz,1h).
13
c nmr(151mhz,dmso-d6)δ156.34,153.05,149.83,149.49,148.52,146.82,133.65,133.10,127.98,126.11,122.82,121.27,118.76,117.90,116.78,112.64,110.56,106.90,75.69,60.23,56.02,32.60.hrms(ei):calcd for c
23
h
20
f3no3[m]
m/z 415.1395;found,415.1397.
[0469]
trans-2-(2,4,5-三氟苯基)-3-硝基-6-羟基-7-氰基-3,4-二氢-2h-苯并[f]色满(5)的合成
[0470][0471]
称取trans-2-(2,4,5-三氟苯基)-3-硝基-6-甲氧基-7-氰基-3,4-二氢-2h-苯并[f]色满(1.00g,2.41mmol)于100ml三颈瓶中,加入10ml ch2cl2溶解,-78℃下搅拌10min。加入bbr3(1.81g,7.23mmol),装置转移至常温,继续搅拌,tlc监测反应进度。原料转化完全后,冰浴下逐滴滴加ch3oh。有机相用ch2cl2(3
×
15ml)萃取,无水na2so4干燥,硅胶柱(200-300目)纯化(pe:ea=5:1),得到棕褐色产品0.75g,产率77.6%。
[0472]1h nmr(400mhz,dmso-d6)δ10.65(s,1h),8.20(s,1h),8.02-7.95(m,1h),7.65(d,j=8.9hz,1h),7.61-7.50(m,1h),7.07(s,1h),6.98(d,j=8.9hz,1h),5.89(d,j=11.0hz,1h),5.86-5.79(m,1h),3.46(d,j=6.0hz,1h),3.10(dd,j=14.5,4.6hz,1h).lc-ms(esi)m/z 399.21[m-h]-.
[0473]
trans-2-(2,4,5-三氟苯基)-3-硝基-7-氰基-3,4-二氢-2h-苯并[f]色满-6-取代衍生物(6a和6d)的合成
[0474]
trans-2-(2,4,5-三氟苯基)-3-硝基-6-(甲氧基-d3)-7-氰基-3,4-二氢-2h-苯并[f]色满(6a)
300目)纯化(pe:ea=1:1)。得到白色粉末0.25g,收率为54.3%。熔点:434.96-436.90℃。
[0486]1h nmr(400mhz,dmso-d6)δ8.45(s,1h),7.80(d,j=8.9hz,1h),7.77-7.64(m,2h),7.29(s,1h),7.10(d,j=8.9hz,1h),5.02(d,j=9.1hz,1h),3.48(dd,j=9.3,5.5hz,1h),2.88(dd,j=16.1,9.9hz,1h),1.75(s,2h).hrms(ei):calcd for c
21
h
12
d3f3n2o2[m]
m/z 387.3765;found,387.3762.
[0487]
trans-2-(2,4,5-三氟苯基)-6-乙氧基-7-氰基-3,4-二氢-2h-苯并[f]色满-3-胺(7d)
[0488][0489]
合成方法参照7a。得到白色粉末0.50g,收率为55.0%。熔点:446.23-447.20℃。
[0490]1h nmr(400mhz,dmso-d6)δ8.46(s,1h),7.80(d,j=9.0hz,1h),7.78-7.64(m,2h),7.29(s,1h),7.09(d,j=8.9hz,1h),5.02(d,j=9.2hz,1h),4.38-4.35(m,1h),3.47(d,j=4.5hz,1h),2.87(dd,j=16.3,10.0hz,1h),1.78(s,2h).hrms(ei):calcd for c
22
h
17
f3n2o2[m]
m/z 398.3852;found,398.3855.
[0491]
2-甲氧基-6-氰基-7-甲氧基-1-萘甲醛(31)
[0492][0493]
合成方法参照9a。得白色固体2.00g,产率为74.5%。
[0494]1h nmr(400mhz,dmso-d6):δ10.71(s,1h),8.77(s,1h),8.50(s,1h),8.29(d,j=8.4hz,1h),7.55(d,j=8.8hz,1h),4.09(s,3h),3.98(s,3h).lc-ms(esi)m/z 242.10[m 1]
.
[0495]
2-羟基-6-氰基-7-甲氧基-1-萘甲醛(32)
[0496][0497]
合成方法参照11a。得白色黄色固体1.50g,产率为70.0%。
[0498]1h nmr(400mhz,dmso-d6):δ12.14(s,1h),10.68(s,1h),8.58(s,1h),8.35(s,1h),8.03(d,j=9.2hz,1h),7.11(d,j=8.8hz,1h),3.93(s,3h).lc-ms(esi)m/z 296.10[m 1]
,294.10[m-1]-.
[0499]
2-(2,5-三氟苯基)-6-甲氧基-7-氰基-3-硝基-2h-苯并色满(33)
[0500][0501]
合成方法参照13a。得到橘黄色固体1.50g,收率40%。
[0502]1h nmr(400mhz,dmso-d6)δ9.13(s,1h),8.44(s,1h),7.97(d,j=9.1hz,1h),7.88(s,1h),7.35(td,j=9.4,4.5hz,1h),7.24(dd,j=23.1,8.5hz,2h),7.04(d,j=8.9hz,1h),6.99(s,1h),4.09(s,3h).lc-ms(esi)m/z 395.08[m 1]
.
[0503]
trans-2-(2,5-三氟苯基)-6-甲氧基-7-氰基-3-硝基-3,4-二氢-2h-苯并色满(34)
[0504][0505]
合成方法参照6a,得到淡黄色固体1.10g,产率为23%。
[0506]1h nmr(400mhz,cdcl3)δ8.04(s,1h),7.63(d,j=9.0hz,1h),7.02(tt,j=13.8,7.0hz,4h),6.94(s,1h),5.86(d,j=6.7hz,1h),5.28(q,j=6.5hz,1h),3.97(s,3h),3.79(dd,j=16.7,7.2hz,1h),3.38(dd,j=16.7,5.6hz,1h).lc-ms(esi)m/z 409.10[m-1]-.
[0507]
trans-2-(2,5-二氟苯基)-6-甲氧基-7-氰基-3,4-二氢-2h-苯并色满-3-胺(7c)
[0508][0509]
合成参考7a。得白色固体1.00g,收率13%。熔点:233.7-235.1℃。
[0510]1h nmr(400mhz,dmso-d6)δ8.44(s,1h),7.79(d,j=8.9hz,1h),7.43-7.28(m,3h),7.25(s,1h),7.09(d,j=8.9hz,1h),5.17(d,j=8.0hz,1h),4.04(s,3h),3.64(d,j=5.7hz,1h),2.96(dd,j=16.6,9.3hz,1h).
13
c nmr(101mhz,dmso-d6)δ157.10,154.60,136.96,136.50,130.48,129.09,123.39,117.98,117.84,117.12,116.19,116.18,116.17,115.97,112.77,102.28,99.86,76.36,56.66,47.83,29.86.hrms(esi):calcd for c
20
h
15
f2no3[m h]
367.1020,found 367.1259.purity:98.44%(t
r
14.12min).
[0511]
实施例2.生物活性测试
[0512]
1.dpp-4为应用杆状病毒表达系统bac-to-bac表达并纯化获得的蛋白酶dpp-4胞外片段(aa29-766),dpp-4可特异性水解底物ala-pro-amc生成产物amc,amc经过355nm的紫外光激发产生460nm的发射光,动态测量单位时间内460nm波长处荧光值线性变化可显示为
dpp-4的二肽基肽酶活性。
[0513]
2.将受试化合物、酶和反应缓冲液混匀,温室孵育30min后,加入底物启动反应,5分钟内连续测定460nm波长处荧光值变化。同时设以dmso替代受试化合物的溶剂对照组、以及奥格列汀阳性对照组。反应终体积为50μl,具体反应体系为:2%dmso,0.1nm dpp-4,10μm ala-pro-amc,100mm hepes ph 7.5,0.1mg/ml牛血清白蛋白(bsa)。每个样品每个浓度设2个复孔。其数据首先计算酶初速度期内单位时间荧光强度的增量(单位:rfu/sec),以此代表酶的初速度,然后计算样品各浓度组的活性百分数(%activity),公式如下:
[0514][0515]
其中v
sample
表示样品各浓度组的初速度,v
dmso
表示dmso组的初速度。以浓度的对数值对活性百分数作图,然后采用非线性回归算出拟合曲线,利用软件graphpad prism 5公式log(inhibitor)vs.response-variable slope计算得到ic
50
值
[0516]
3.化合物对dpp-4抑制ic
50
值:
[0517]
[0518]
[0519]
[0520][0521]
nd:未检测
[0522]
讨论:
[0523]
发明人经过广泛而深入的研究,设计并合成得到了一系列未见文献报道的苯并六元环衍生物,对得到的化合物进行了分子水平活性测试,得到一批能够抑制dpp-4的化合物。为由dpp-4介导的疾病的治疗奠定了基础。
[0524]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。