前体三特异性抗体构建体及其使用方法
1.相关申请的交叉引用
2.本技术要求于2019年5月7日提交的美国序列号62/844,303的权益。在先申请的全部内容和公开内容通过引用以其整体并入本技术。
3.序列表声明
4.本技术含有序列表,该序列表已经以ascii格式以电子方式提交,并通过引用以其整体并入本文。ascii副本创建于2020年3月25日,名称为p
‑
586968
‑
pc
‑
25mar2020.txt,大小为279kb。
技术领域
5.本文公开了前体三特异性抗体构建体及其用于这些前体构建体的使用方法。使用方法包括用于治疗癌症,其中前体构建体包括具有肿瘤限制性活化和多个抗原结合位点的前药。
背景技术:
6.目前已被全球药物监管机构批准用于肿瘤学环境临床应用的单克隆抗体(非缀合抗体或裸抗体)的功能已知使用以下机制的一种或组合:1)阻断细胞生长信号传导,2)阻断血液供应至癌细胞,3)直接介导细胞凋亡,4)引发免疫效应物功能,例如抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp)和补体依赖性细胞毒性(cdc)和5)促进针对肿瘤的适应性免疫。
7.单克隆抗体疗法已在临床中证明了存活益处。然而,与化疗相比,癌症患者的总缓解率较低,存活益处微乎其微(几个月)。虽然缺乏稳健临床抗癌活性的根本原因尚不完全清楚,但研究表明,癌细胞通常会迅速发展出补偿性信号传导通路以逃避细胞死亡。此外,被认为是有效的癌症起始细胞的癌症干细胞(csc)在细胞增殖方面的活性较低,因此它们倾向于更好地维持缺乏生长信号。
8.为了改善单克隆抗体的抗肿瘤活性,正在开发多特异性抗体。与经典的单克隆抗体(几种肿瘤实体的标准一线疗法)不同,这些多特异性抗体可以将肿瘤细胞和破坏肿瘤细胞的手段结合在一起,从而提高治疗效率。这些多特异性抗体为癌症患者提供了新的治疗选择。
9.另一种抗癌治疗性方法是利用t细胞。t细胞通过巡视身体以寻找新出现的癌细胞并有效且迅速地消除它们,从而在整个生命中提供对癌症的防御。已证明利用t细胞的治疗性方法至少在转移性黑素瘤、转移性肾癌、无症状转移性激素难治性前列腺癌和晚期黑素瘤的癌症治疗中是成功的。
10.肿瘤细胞毒性的另一个考虑因素是肿瘤微环境(tme)。tme包括新的靶标,可以通过增强宿主抗肿瘤免疫应答来帮助指导和改善抗体疗法的作用。例如,t细胞在抗肿瘤抗原抗体疗法中发挥出乎意料的关键作用,尽管由于在免疫缺陷小鼠中进行的研究,它们的重要性往往未被观察到。
11.用于癌症治疗的抗体疗法的缺陷是抗体与非癌症肿瘤相关抗原表达细胞的“脱靶”结合,特别是如果这种结合导致细胞毒性。因此,多特异性和双特异性抗体的“脱靶”结合对控制它们针对同样表达抗原的正常组织(即使在极低的水平)的“脱靶”活性提出了潜在的挑战。这些“脱靶”效应严重限制了多特异性和双特异性抗体疗法。许多双特异性或多特异性抗体的另一个缺点是它们的半衰期短。
12.仍然需要提供具有特异性针对肿瘤细胞的细胞毒性同时降低毒副作用并保持抗体有效性的品质的多特异性三价抗体。降低多特异性抗体的非特异性毒副作用并同时增强这些抗体的有效性,需要具有以下前体形式的抗体:(1)其接合与肿瘤细胞、肿瘤相关细胞或肿瘤细胞环境相关的靶标,以及(2)一旦定位于肿瘤微环境,其就会活化细胞毒性细胞,例如t细胞。进一步地,必须的是此类多特异性抗体不会显著降低对肿瘤或肿瘤相关靶标的免疫原性。本文所述的前体三特异性抗体构建体通过附接可调节的半衰期增强组分和阻断组分来满足这一需求,该阻断组分在抗体与肿瘤或肿瘤相关靶标结合之前抑制抗体与提供毒性的细胞接合。
技术实现要素:
13.在一个方面,本文公开了前体三特异性抗体构建体,其包括:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一调节结构域,其包括蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二调节结构域,其包括蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件(组分,component)。
14.在一个方面,本文公开了前体三特异性抗体构建体,其包括:与第一肿瘤相关抗原(taa)结合的第一结合结构域;与第二taa结合的第二结合结构域;与人cd3ε的细胞外表位结合的第三结合结构域;和调节结构域,所述调节结构域包括第一子调节结构域和第二子调节结构域任一,所述第一子调节结构域包括第一蛋白酶切割结构域和半衰期延长(hlp)结构域,所述第二子调节结构域包括第二蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件;或单个调节结构域,该单个调节结构域包括蛋白酶切割结构域、半衰期延长(hlp)结构域和降低第三结合结构域结合cd3ε的细胞外表位的能力的cap组件。
15.在一个方面,本文公开了前体三特异性抗体构建体,其包括:与第一肿瘤相关抗原(taa)结合的第一结合结构域;与第二taa结合的第二结合结构域;与人cd3ε的细胞外表位结合的第三结合结构域;和调节结构域,其包括蛋白酶切割结构域、半衰期延长(hlp)结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
16.在相关方面,第一结合结构域和所述第二结合结构域结合相同的taa。在另一个相关方面,第一结合结构域和所述第二结合结构域结合不同的taa。
17.在相关方面,第一taa或所述第二taa或所述第一taa和所述第二taa两者可以是肿瘤细胞表面抗原的细胞外表位、肿瘤微环境抗原、在肿瘤微环境(tme)中的基质抗原、tme中的血管生成抗原、tme中的血管上的抗原或tme中的细胞因子抗原,或其任何组合。在另一个相关方面,taa可以是以下之一:egfr、fcγri、fcγriia fcγriib、fcγriiib、cd28、cd137、ctla
‑
4、fas、成纤维细胞生长因子受体1(fgfr1)、fgfr2、fgfr3、fgfr4、糖皮质激素
诱导的tnfr相关(gitr)蛋白质、淋巴毒素
‑
β受体(ltβr)、toll
‑
样受体(tlr)、肿瘤坏死因子相关凋亡诱导配体
‑
受体1(trail受体1)、trail受体2、前列腺特异性膜抗原(psma)蛋白、前列腺干细胞抗原(psca)蛋白、肿瘤相关蛋白碳酸酐酶ix(caix)、表皮生长因子受体1(egfr1)、egfrviii、人表皮生长因子受体2(her2/neu;erb2)、erbb3(her3)、叶酸受体、肝配蛋白受体、pdgfra、erbb
‑
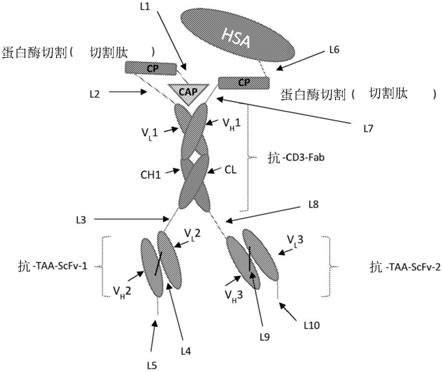
2、cd20、cd22、cd30、cd33、cd40、cd37、cd38、cd70、cd74、cd40)、cd80、cd86、cd2、p53、cmet(酪氨酸蛋白激酶met、肝细胞生长因子受体(hgfr))、mage
‑
a1、mage
‑
a2、mage
‑
a3、mage
‑
a4、mage
‑
a6、mage
‑
a10、mage
‑
a12、bage、dam
‑
6、dam
‑
10、gage
‑
1、gage
‑
2、gage
‑
8、gage
‑
3、gage
‑
4、gage
‑
5、gage
‑
6、gage
‑
7b、na88
‑
a、ny
‑
eso
‑
1、brca1、brca2、mart
‑
1、mc1r、gp100、psa、psm、酪氨酸酶、维尔姆斯肿瘤抗原(wt1)、trp
‑
1、trp
‑
2、art
‑
4、camel、cyp
‑
b、htert、htrt、ice、muc1、muc2、p
‑
钙粘蛋白、肌肉生长抑制素(gdf8)、cripto(tdgf1)、muc5ac、prame、p15、ru1、ru2、sart
‑
1、sart
‑
3、wt1、afp、β
‑
联蛋白/m、胱天蛋白酶
‑
8/m、cdk
‑
4/m、elf2m、gnt
‑
v、g250、hsp70
‑
2m、hst
‑
2、kiaa0205、mum
‑
1、mum
‑
2、mum
‑
3、肌球蛋白/m、rage、sart
‑
2、trp
‑
2/int2、707
‑
ap、膜联蛋白ii、cdc27/m、tpi/mbcr
‑
abl、etv6/aml、ldlr/fut、pml/rarα、tel/aml1、cd28、cd137、canag、间皮素、dr5、pd
‑
1、pd1l、igf
‑
1r、cxcr4、神经毡蛋白1、磷脂酰肌醇蛋白聚糖(glypicans)、epha2、cd138、b7
‑
h3、b7
‑
h4、gpa33、gpc3、sstr2、ror1、5t4和vegf
‑
r2或其任何组合。在进一步的相关方面,由所述第一结合结构域或所述第二结合结构域或两者结合的taa选自egfr、ror1、psma和5t4。在另一个相关方面,当taa抗原是egfr时,第一结合结构域或第二结合结构域或两者的氨基酸序列包含在seq id no:34、37中的任一个中叙述的氨基酸序列或其组合。在另一个相关方面,当taa抗原为ror1时,第一结合结构域或第二结合结构域或两者的氨基酸序列包含在seq id no:156和166中的任一个中叙述的氨基酸序列或其组合。在另一个相关方面,当taa抗原是psma时,第一结合结构域或第二结合结构域或两者的氨基酸序列包含在seq id no:168和170中的任一个中叙述的氨基酸序列或其组合。在另一个相关方面,当taa抗原为5t4时,第一结合结构域或第二结合结构域或两者的氨基酸序列包含在seq id no:172和174中的任一个中叙述的氨基酸序列或其组合。
18.在另一个相关方面,肿瘤微环境抗原可以是kir、lilr或tigit抗原。在另一个相关方面,肿瘤微环境中的基质抗原可以是成纤维细胞活化蛋白(fap)、α平滑肌肌动蛋白(αsma)、pdgfrα、整合素α11β1(itga11)vegf、腱生蛋白
‑
c(tenascin
‑
c)、骨膜蛋白(periostin)、成纤维细胞特异性蛋白1(s10a4、fsp1)、结蛋白、波形蛋白、帕拉丁(paladin)、尿激酶型纤维蛋白溶酶原激活剂受体相关蛋白(uparap)、半乳糖凝集素
‑
3、平足蛋白(podoplanin)、血小板、ccl2或cxcl12。在另一个相关方面,肿瘤微环境中的血管生成抗原可以是bfgf、inf或vegf。在进一步相关方面,肿瘤微环境中血管表面上的抗原包含选自cd31、cd105、cd146和cd144的内皮细胞表面抗原。在仍另一个相关方面,细胞因子抗原可以是tnf
‑
α、il
‑
6、tgf
‑
β、il
‑
10、il
‑
8、il
‑
17、il
‑
21、inf或veg。
19.在相关方面,hlp结构域包括人血清白蛋白(hsa)多肽。
20.在相关的方面,所述第二子调节结构域的cap组件包含人cd3ε的细胞外表位的氨基酸序列。在另一个相关方面,cap组件的氨基酸序列在seq id no:5或其同源物中叙述。
21.在相关方面,第一结合结构域、第二结合结构域或两者每个包含单链可变片段(scfv)。在另一个相关方面,第三结合结构域包含fab抗原结合片段。
22.在相关方面,第一和第二子调节结构域中的蛋白酶切割结构域被相同的蛋白酶切割。在另一个相关方面,第一和第二子调节结构域中的蛋白酶切割结构域被不同的蛋白酶切割。在另一个相关方面,第一和/或第二蛋白酶切割结构域包含可由丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶或基质金属蛋白酶(mmp)切割的蛋白酶可切割氨基酸序列,或者是被mmp2/9、upa、蛋白裂解酶和天冬酰胺内肽酶中的一种或多种或其任何组合切割的组合底物。在另一个相关方面,mmp可以是基质金属蛋白酶1(mmp
‑
1)、基质金属蛋白酶2(mmp
‑
2)、基质金属蛋白酶9(mmp
‑
9)或基质金属蛋白酶14(mmp
‑
14)。在另一个相关方面,丝氨酸蛋白酶可以是尿激酶型纤维蛋白溶酶原激活剂(upa)蛋白酶或膜型丝氨酸蛋白酶(mt
‑
sp1)。在另一个相关方面,被mmp2/9、upa、蛋白裂解酶和天冬酰胺内肽酶中的一个或多个切割的组合底物的氨基酸序列在seq id no:35中叙述。在进一步的相关方面中和,第一和/或第二蛋白酶切割结构域包括如下中所叙述的序列:seq id no:9(plglag)、seq id no:10(gplgmlsq)、seq id no:11(gplglwaq)、seq id no:12(gplglag)、seq id no:13(kknpaeligpvd)、或seq id no:14(kkqpaanlvaped)、或seq id no:35。在仍另一个相关方面,第一和/或第二蛋白酶切割结构域包含在seq id no:9中所叙述的序列。在还另一个方面,第一和/或第二蛋白酶切割结构域包含在seq id no:35中所叙述的序列。
23.在相关方面,第三结合结构域包含可变重链(vh3
‑
ch1)区和可变轻链(vl3
‑
cl)区;其中所述第一结合结构域位于第三结合结构域的所述vl3
‑
cl或所述vh3
‑
ch1区的c
‑
端;其中当所述第一结合结构域位于所述vl3
‑
cl区的c
‑
端时,所述第二子调节结构域位于所述vh3
‑
ch1区的c
‑
端,和当所述第一结合结构域位于所述vh3
‑
ch1区的c
‑
端时,所述第二子调节结构域位于所述vl3
‑
cl区的c
‑
端。在另一个相关方面,第三结合结构域包含可变重链(vh3)区和可变轻链(vl3)区;其中包含位于所述蛋白酶切割结构域的n
‑
端的所述hlp结构域的所述第一子调节结构域位于所述第三结合结构域的所述vh3区或所述vl3区的n
‑
端;其中当所述第一子调节结构域位于所述vl3区的n
‑
端时,包含位于所述蛋白酶切割结构域的n
‑
端的所述cap组件的所述第二子调节结构域位于所述vh3区的n
‑
端,和当所述第一子调节结构域位于所述vh3区的n
‑
端时,包含位于所述蛋白酶切割结构域的n
‑
端的所述cap组件的所述第二子调节结构域位于所述vl3区的n
‑
端。
24.在另一个方面,前体三特异性抗体构建体包含两个多肽——多肽a和多肽b,其中多肽a包含具有如下n
‑
端到c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、第三结合结构域(vh3区)、第一结合结构域(vl
‑
vh);和多肽b包含具有如下n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、第三结合结构域(vl区)、第二结合结构域(vl
‑
vh);或多肽a包含具有如下n
‑
端到c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、第三结合结构域(vh3区)、第一结合结构域(vh
‑
vl);和多肽b包含具有如下n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、第三结合结构域(vl区)、第二结合结构域(vh
‑
vl);或多肽a包含具有如下n
‑
端到c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、第三结合结构域(vl3区)、第一结合结构域(vl
‑
vh);和多肽b包含具有如下n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、第三结合结构域(vh3区)、第二结合结构域(vl
‑
vh);或多肽a包含具有如下n
‑
端到c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、第三结合结构域(vl3区)、第一结合结构域(vh
‑
vl);和多肽b包含具有如下n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、第三结合结构域(vh区)、第二结合结构域(vh
‑
vl);或多肽a包含具有如下n
‑
端到c
‑
端顺序的组件:
hlp结构域、蛋白酶切割结构域、第三结合结构域(vl3区)、第一结合结构域(vl
‑
vh);和多肽b包含具有如下n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、第三结合结构域(vh区)、第二结合结构域(vl
‑
vh);或多肽a包含具有如下n
‑
端到c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、第三结合结构域(vl3区)、第一结合结构域(vh
‑
vl);和多肽b包含具有如下n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、第三结合结构域(vh3区)、第二结合结构域(vh
‑
vl);或多肽a包含具有如下n
‑
端到c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、第三结合结构域(vh3区)、第一结合结构域(vl
‑
vh);和多肽b包含具有如下n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、第三结合结构域(vl3区)、第二结合结构域(vl
‑
vh);或多肽a包含具有如下n
‑
端到c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、第三结合结构域(vh3区)、第一结合结构域(vh
‑
vl);和多肽b包含具有如下n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、第三结合结构域(vl3区)、第二结合结构域(vh
‑
vl)。
25.在相关方面,第三结合结构域包含vl3区和vh3区,其中所述vl3区包含cdr
‑
ll(选自seq id no:107
‑
109)、cdr
‑
l2(seq id no:110)和cdr
‑
l3(选自seq id no:111
‑
112),并且所述vh3区包含cdr
‑
h1(seq id no:104)、cdr
‑
h2(seq id no:105)和cdr
‑
h3(seq id no:106)。在另一个相关方面,vl3区包含选自seq id no:75
‑
103和116中任一中叙述的氨基酸序列,或与其具有至少80%同源性的氨基酸序列。在另一个相关方面,vh3区包含在seq id no:46
‑
72和114的任一中叙述的氨基酸序列,或与其具有至少80%同源性的氨基酸序列。
26.在一个方面,本文公开的是药物组合物,其包含前体三特异性抗体构建体和药学上可接受的载体,该前体三特异性抗体构建体包含:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二肿瘤相关抗原(taa)的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
27.在一个方面,本文公开了核酸构建体,其包含编码前体三特异性抗体构建体的核酸序列,或多个核酸序列,该前体三特异性抗体构建体包含:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二肿瘤相关抗原(taa)的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
28.在一个方面,本文公开了表达载体,其包含编码本文公开的前体三特异性抗体构建体的一种或多种多肽的一种或多种核酸构建体。
29.在一个方面,本文公开了分离的宿主细胞,其包含编码前体三特异性抗体构建体的核酸序列或多个核酸序列,该前体三特异性抗体构建体包含:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二肿瘤相关抗原(taa)的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
30.在一个方面,本文公开了在需要此类治疗的受试者中治疗、防止、抑制生长、延迟疾病进展、降低肿瘤负荷、或降低癌症或肿瘤的发病率、或其任何组合的方法,其包含向受
试者施用包含前体三特异性抗体构建体的药物组合物的步骤,该前体三特异性抗体构建体包含:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二肿瘤相关抗原(taa)的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件;其中该方法在受试者中治疗、防止、抑制生长、延迟疾病进展、降低肿瘤负荷、或降低癌症或肿瘤的发病率。
31.在相关方面,与未施用本文公开的药物组合物的受试者相比,使用本文公开用于治疗有需要的受试者的方法减少微小残留病、提高缓解、提高缓解持续时间、降低肿瘤复发率、防止肿瘤或癌症的转移、或降低肿瘤或癌症的转移率、或其任何组合。在另一个相关方面,癌症或肿瘤包含实体瘤或非实体瘤,或其中癌症或肿瘤包含癌症或肿瘤的转移。在进一步的相关方面,非实体癌症或肿瘤可以是造血系统恶性肿瘤、血细胞癌、白血病、骨髓增生异常综合征、淋巴瘤、多发性骨髓瘤(浆细胞骨髓瘤)、急性淋巴细胞白血病、急性髓性白血病、慢性髓性白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤或浆细胞白血病;或其中实体瘤可以是肉瘤或癌、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文肉瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌或肿瘤、乳腺癌或肿瘤、卵巢癌或肿瘤、前列腺癌或肿瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯肿瘤(wilm's tumor)、子宫颈癌或肿瘤、子宫癌或肿瘤、睾丸癌或肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、神经鞘瘤、脑膜瘤、黑素瘤、成神经细胞瘤或视网膜母细胞瘤。
32.在一个方面,本文公开了在需要此类治疗的受试者中治疗、防止、抑制生长、延迟疾病进展、降低肿瘤负荷、或降低癌症或肿瘤的发病率、或其任何组合的方法,其包含向受试者施加药物组合物的步骤,所述组合物包含含有编码前体三特异性抗体构建体的核酸序列或多个核酸序列的核酸构建体或多个核酸构建体,该前体三特异性抗体构建体包含:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二肿瘤相关抗原(taa)的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件;其中该方法在受试者中治疗、防止、抑制生长、延迟疾病进展、降低肿瘤负荷、或降低癌症或肿瘤的发病率。
33.在相关方面,与未施用药物组合物的受试者相比,使用本文公开的用于治疗有需要的受试者的方法减少微小残留病、增加缓解、增加缓解持续时间、降低肿瘤复发率、防止肿瘤或癌症的转移、或降低肿瘤或癌症的转移率、或其任何组合。
34.在一个方面,本文公开了产生前体三特异性抗体构建体的方法,该前体三特异性抗体构建体包含:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二肿瘤相关抗原(taa)的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件;所述方法包含以下步骤:培养包含编码前体三特异性抗体构建体多肽a和b的核酸序列的宿主细
胞,表达所述多肽a和b,分离所述表达的前体双特异性抗体构建体多肽a和b,和使所述多肽a和b二聚化。
35.在相关方面,在产生前体三特异性抗体构建体的方法中,表达包含从同一宿主细胞表达或包含各自分别表达不同多肽(多肽a和多肽b)的两种宿主细胞。
附图说明
36.被视为本文所公开的前体三特异性(三体)抗体构建体的主题在说明书的结论部分被特别指出和明确要求保护。然而,当结合附图阅读时,通过参考以下详细描述可最佳地理解前体三特异性(三体)抗体构建体,在组织和使用方法方面,连同其目的、特征和优点,在附图中:
37.图1显示了具有模块化组件的前体三特异性(三体)抗体构建体的示意性实施方式,受损模块化组件例如但不限于:(1)模块化调节结构域,在某些实施方式中包括模块化功能组件和模块化蛋白酶切割肽,和(2)模块化结合结构域,在某些实施方式中包括模块化抗肿瘤相关抗原结合结构域。图1的前体三特异性(三体)抗体构建体的实施方式具有三个抗体结合结构域,其中fab部分识别cd3表面抗原,其中标识了不同结构域的组件和区域。在本文所示的实施方式中,前体三特异性(三体)抗体构建体由两个多肽形成,其中每个多肽包括抗肿瘤相关抗原(taa)结合结构域(第一和第二结合结构域),其为在每个多肽上的抗cd3 fab结合结构域的c
‑
端(第三结合结构域)。进一步的,每个多肽包括抗cd3 fab结合结构域n
‑
端的调节结构域(第一和第二子调节结构域),其中第一子调节结构域包含蛋白酶切割结构域和半衰期延长结构域(在本实施方式中,人血清白蛋白),以及第二子调节结构域包含蛋白酶切割结构域和降低第三结合结构域结合人cd3表面抗原的能力的cap组件。如本文所示,每个抗taa结合结构域都是单链可变片段(scfv)。如本文所示,scfv之一的n
‑
端到c
‑
端顺序是可变轻链区(vl2),接着是接头(l4),接着是可变重链区(vh2),接着是接头(l5),而另一个scfv的n
‑
端到c
‑
端顺序是可变重链区(vh3),接着是接头(l9),接着是可变轻链区(vl3),接着是接头(l10)。在未示出的实施方式中,scfv的n
‑
端到c
‑
端顺序可以颠倒,对于两个scfv结合结构域可以是相同的或不同的。在未示出的实施方式中,两个子调节结构域可以从它们当前的键连接到另一个多肽链,例如hsa调节结构域可以连接到fab片段的可变轻链(vl1)的n
‑
端并且cap调节结构域可以连接到fab片段的可变重链(vh1)的n
‑
端。组件之间和结构域之间的接头由“l”后跟数字标识,例如l1、l2、l3、l4、l5、l6、l7、l8、l9、l10。接头可能存在也可能不存在。vl1是结合位点三的可变轻链区,vh1是结合位点三的可变重链区。表示为hsa的椭圆形是人血清白蛋白组件。表示为cp的形状是切割肽。三角形是cap组件。
38.图2a至2f显示了本文所述的前体和活性三特异性(三体)抗体构建体的多种实施方式。图2a和2b显示包含两个抗肿瘤相关抗原结合结构域的前体三特异性抗体构建体的示意性实施方式,其中肿瘤相关抗原是egfr,其中可变区之一的n
‑
端到c
‑
端顺序是vl2
‑
l4
‑
vh2和另一个是vh3
‑
l9
‑
vl3(图2a)或一个scfv是vh2
‑
l4
‑
vl2,另一个是vl3
‑
l9
‑
vh3(图2b)。前体三特异性抗体构建体进一步包括scfv结合结构域n
‑
端的抗cd3ε fab结构域和包含蛋白酶可切割的接头的两个子调节结构域,以及人血清白蛋白(hsa)多肽序列或cd3 cap,其中在一些实施方式中,cap的氨基酸是fab结构域n
‑
端的成熟cd3ε多肽(seq id no:4)的氨
基酸1
‑
27。调节结构域中的组件的顺序是n
‑
端到c
‑
端是cap或hsa
‑
接头
‑
蛋白酶可切割的接头。l1、l2等代表不同结构域或结构域组件之间可能的接头。接头可能存在也可能不存在。图2c显示了如图2b所示的前体三特异性抗体构建体的示意图,但缺少包含半衰期延长组件(hsa)的调节结构域。图2d显示了如图2b所示的前体三特异性抗体构建体的示意图,但缺少包含cd3 cap结构域的子调节结构域。图2e显示活性三特异性(三体)抗体构建体的示意图,其中图2b的前体构建体处于活性形式并且缺乏两个子调节结构域。图2f显示前体三特异性抗体构建体的示意图,其中调节结构域包含单个调节结构域,该调节结构域包含在同一多肽上的cap结构域、hsa序列和蛋白酶可切割的接头。
39.图3a和3b显示了肿瘤组织内或前体三特异性抗体构建体的肿瘤环境内蛋白酶特异性活化的流程图,其中t细胞接合和活化仅限于肿瘤位点。图3a表示了癌症(肿瘤)微环境对前体三特异性抗体构建体的影响。前体三特异性抗体构建体包含两个蛋白酶可切割结构域,其中一个是hsa半衰期可延长多肽的c
‑
端,另一个是可以被第三(抗cd3 fab)结合结构域特异性结合的cap组件。进入已知富含癌细胞分泌的蛋白酶的癌症微环境导致蛋白酶切割和去除hsa和cap调节组件,其中在一些实施方式中,cap包含细胞外cd3ε表位。在一些实施方式中,蛋白酶可切割结构域可以被相同或不同的蛋白酶切割。所得的活化的抗体(活化的三特异性抗体构建体)现在可以结合并活化t细胞。如果前体构建体与taa结合不在肿瘤微环境中,则不会发生蛋白酶切割,也不会发生t细胞活化。前体三特异性抗体构建体的设计提供了具有三特异性结合表位的cap和hsa调节结构域的改进的蛋白酶活化控制释放。图3b表示了癌症微环境中hsa和cd3 cap的蛋白酶特异性切割,随后是t细胞活化以及活化的三体构建体与t细胞和肿瘤细胞的结合。前体三特异性抗体构建体在循环中或存在于正常组织中时保持完整,具有延长的体内半衰期。在与taa靶抗原结合后,在这种情况下为egfr,其中该靶抗原存在于肿瘤表面上(在肿瘤微环境中),蛋白酶特异性活化可能发生,导致两个子调节结构域的切割和抗cd3结合位点的暴露。与前体三特异性抗体构建体的数天至数周相比,活化的三特异性抗体构建体抗体具有降低的数小时的有限半衰期。(数据未显示)。此外,在一些实施方式中,切割和活化的三特异性抗体包含比前体构建体更小的大小,这可以改进活化的三特异性抗体肿瘤渗透。
40.图4a和4b显示了活化的三特异性(三体)抗体构建体(构建体1;vlvh)的重链(hc)多肽的氨基酸序列和编码活化的构建体重链(hc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5'到3'显示。图4a显示了活化的构建体的重链(hc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:h1f3.5
‑
g1fd抗egfr vl
‑
接头
‑
vh(seq id no:138)。图4a所示的hc多肽的组件部分的氨基酸序列包括:接头(seq id no:158)、抗cd3ε可变重链和恒定重链区1(seq id no:113),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vl(seq id no:34)
‑
接头(seq id no:39)
‑
vh(seq id no:37)链。图4b显示了编码活化的三特异性(三体)构建体的重链(hc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'的顺序和如下组件(seq id no:150)。编码图4a所示hc多肽的组件部分的核酸序列包括:接头(例如图2e的l7)(seq id no:154)、抗cd3ε可变重链和恒定重链区1(seq id no:no:155),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vl(seq id no:36)
‑
接头(seq id no:40)
‑
vh(seq id no:38)链。
41.图5a和5b显示了活化的三特异性(三体)抗体构建体(构建体1;vlvh)的轻链(lc)多肽的氨基酸序列和编码活化的构建体的轻链(lc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5'到3'显示。图5a显示了活化的构建体的轻链(lc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序如下和组件:h1f3.1
‑
λlc抗egfr vl
‑
接头
‑
vh(seq id no:139)。图5a所示的lc多肽的组件部分的氨基酸序列包括:接头(例如图2e的l2)(seq id no:158)、抗cd3ε可变轻链和λ轻链(seq id no:74),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vl(seq id no:34)
‑
接头(seq id no:40)
‑
vh(seq id no:37)链。图5b显示了编码活化的三特异性(三体)构建体的轻链(lc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:151)。编码图5a所示lc多肽的组件部分的核酸序列包括:接头(例如图2e的l2)(seq id no:154)、抗cd3ε可变轻链和λ轻链区(seq id no:159),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vl(seq id no:34)
‑
接头(seq id no:40)
‑
vh(seq id no:37)链。
42.图6a和6b显示了活化的三特异性(三体)抗体构建体(构建体2;vhvl)的重链(hc)多肽的氨基酸序列和编码活化的构建体的重链(hc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5'到3'显示。图6a显示了活化的构建体的重链(hc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:h1f3.5
‑
g1fd
‑
(vh
‑
接头
‑
vl)(seq id no:140)。图6a所示的hc多肽的组件部分的氨基酸序列包括:接头(seq id no:158)、抗cd3ε可变重链和恒定重链区1(seq id no:113),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:37)
‑
接头(seq id no:40)
‑
vl(seq id no:34)链。图6b显示了编码活化的三特异性(三体)构建体的重链(hc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:152)。编码图6a所示hc多肽的组件部分的核酸序列包括:接头(seq id no:154)、抗
‑
cd3ε可变重链和恒定重链区1(seq id no:155),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:38)
‑
接头(seq id no:40)
‑
vh(seq id no:36)链。
43.图7a和7b显示了活化的三特异性(三体)抗体构建体(构建体2;vhvl)的轻链(lc)多肽的氨基酸序列和编码活化的构建体的轻链(lc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5'到3'显示。图7a显示了活化的构建体的轻链(lc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:h1f3.1
‑
λlc
‑
抗egfr(vh
‑
接头
‑
vl)(seq id no:141)。图7a所示的lc多肽的组件部分的氨基酸序列包括:接头(seq id no:158)、抗cd3ε可变轻链和λ轻链(seq id no:74),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:37)
‑
接头(seq id no:40)
‑
vl(seq id no:34)链。图7b显示了编码活化的三特异性(三体)构建体的轻链(lc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:153)。编码图7a所示的lc多肽的组件部分的核酸序列包括:接头(seq id no:154)、抗cd3ε可变轻链和λ轻链区(seq id no:159),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,然后是抗egfr scfv vh(seq id no:38)
‑
接头(seq id no:40)
‑
vl(seq id no:36)链。
44.图8a和8b显示前体三特异性(三体)抗体构建体(构建体3;vlvh)的重链(hc)多肽的氨基酸序列和编码前体构建体的重链(hc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5'到3'显示。图8a显示了前体构建体的重链(hc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:halb
‑
g
‑
plglag(mmp2/9)
‑
(克隆)
‑
h1f3.5
‑
g1fd抗egfr vl
‑
接头
‑
vh(seq id no:130)。图8a所示的hc多肽的组件部分的氨基酸序列包括:人血清白蛋白(hsa)(seq id no:7)、mmp2/9蛋白酶可切割的接头(seq id no:160(具有可切割序列的接头)和seq id no:9(可切割序列))、抗cd3ε可变重链和恒定重链区1(seq id no:113),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,然后是抗egfr scfv vl(seq id no:34)
‑
接头(seq id no:40)
‑
vh(seq id no:37)链。图8b显示了编码前体三特异性(三体)抗体构建体的重链(hc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:142)。编码图8a所示的hc多肽的组件部分的核酸序列包括:人血清白蛋白(hsa)(seq id no:8)、mmp2/9蛋白酶可切割的接头(seq id no:161(具有可切割序列和seq id no:33(可切割序列)的接头),抗cd3ε可变重链和恒定重链区1(seq id no:155),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vl(seq id no:36)
‑
接头(seq id no:40)
‑
vh(seq id no:38)链。
45.图9a和9b显示前体三特异性(三体)抗体构建体(构建体3;vlvh)的轻链(lc)多肽的氨基酸序列和编码前体构建体的轻链(lc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5’到3’显示。图9a显示了前体构建体的轻链(lc)多肽的氨基酸序列的一个实施方式,具有n
‑
端至c
‑
端顺序和如下组件:cap
‑
h1f3.1
‑
λlc抗egfr vl
‑
接头
‑
vh mm2/9切割;(seq id no:131)。图9a所示的lc多肽的组件部分的氨基酸序列包括:cap(seq id no:5)、mmp2/9蛋白酶可切割的接头(seq id no:160和seq id no:9(可切割序列))、抗
‑
cd3ε可变轻链和λ轻链(seq id no:74),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗
‑
egfr scfv vl(seq id no:34)
‑
接头(seq id no:40)
‑
vh(seq id no:37)链。图9b显示编码前体三特异性(三体)抗体构建体的轻链(lc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:143)。编码图9a所示的lc多肽的组件部分的核酸序列包括:cap(seq id no:164)、mmp2/9蛋白酶可切割的接头(seq id no:161和seq id no:33(可切割序列))、抗
‑
cd3ε可变轻链和λ轻链区(seq id no:159),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗
‑
egfr scfv vl(seq id no:36)
‑
接头(seq id no:40)
‑
vh(seq id no:38)链。
46.图10a和10b显示前体三特异性(三体)抗体构建体(构建体4;vhvl)的重链(hc)多肽的氨基酸序列和编码前体构建体的重链(hc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5’到3’显示。图10a显示了前体构建体的重链(hc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:halb
‑
g
‑
plglag(mmp2/9)
‑
(克隆)
‑
h1f3.5
‑
g1fd抗egfr(vh
‑
接头
‑
vl)(seq id no:132)。图10a所示的hc多肽的组件部分的氨基酸序列包括:人血清白蛋白(hsa)(seq id no:7)、mmp2/9蛋白酶可切割的接头(seq id no:160和seq id no:9(可切割部分))、抗cd3ε可变重链和恒定重链区1(seq id no:113),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着
是抗egfr scfv vh(seq id no:37)
‑
接头(seq id no:40)
‑
vl(seq id no:34)链。图10b显示了编码前体三特异性(三体)抗体构建体的重链(hc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:144)。编码图10a所示的hc多肽的组件部分的核酸序列包括:人血清白蛋白(hsa)(seq id no:8)、mmp2/9蛋白酶可切割的接头(seq id no:161和seq id no:33(可切割的接头))、抗cd3ε可变重链和恒定重链区1(seq id no:155),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:38)
‑
接头(seq id no:40)
‑
vl(seq id no:36)链。
47.图11a和11b显示前体三特异性(三体)抗体构建体(构建体4;vlvh)的轻链(lc)多肽的氨基酸序列和编码前体构建体的轻链(lc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5’到3’显示。图11a显示前体构建体的轻链(lc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:cap
‑
mmp2/9切割
‑
h1f3.1
‑
λlc
‑
抗egfr(vh
‑
接头
‑
vl)(seq id no:133;质粒7)。图11a所示的lc多肽的组件部分的氨基酸序列包括:cap(seq id no:5)、mmp2/9蛋白酶可切割的接头(seq id no:160和seq id no:9(可切割的接头))、抗
‑
cd3ε可变轻链和λ轻链(seq id no:74),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗
‑
egfr scfv vh(seq id no:37)
‑
接头(seq id no:40)
‑
vl(seq id no:34)链。图11b显示了编码前体三特异性(三体)抗体构建体的轻链(lc)多肽的优化核酸序列(dna)的一个实施方式,具有5’到3’顺序和如下组件(seq id no:145)。编码图11a所示的lc多肽的组件部分的核酸序列包括:cap(seq id no:164)、mmp2/9蛋白酶可切割的接头(seq id no:161和seq id no:33(可切割序列))、抗cd3ε可变轻链和λ轻链区(seq id no:159),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:38)
‑
接头(seq id no:40)
‑
vl(seq id no:36)链。
48.图12a和12b显示不可切割(不可活化)前体三特异性(三体)抗体构建体(构建体5;vlvh)的重链(hc)多肽的氨基酸序列和编码不可切割前体构建体的重链(hc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5’到3’显示。图12a显示了不可切割前体构建体的重链(hc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:halb
‑
g
‑
plglag nc
‑
h1f3.5
‑
g1fd抗egfr vl
‑
接头
‑
vh(seq id no:134)。图12a所示的hc多肽的组件部分的氨基酸序列包括:人血清白蛋白(hsa)(seq id no:7)、不可切割的接头(seq id no:162)、抗cd3ε可变重链和恒定重链区1(seq id no:113),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vl(seq id no:34)
‑
接头(seq id no:40)
‑
vh(seq id no:37)链。图12b显示了编码不可切割前体三特异性(三体)抗体构建体的重链(hc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:146)。编码图12a所示的hc多肽的组件部分的核酸序列包括:人血清白蛋白(hsa)(seq id no:8)、不可切割的接头(seq id no:163)、抗cd3ε可变重链和恒定重链区1(seq id no:155),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vl(seq id no:36)
‑
接头(seq id no:40)
‑
vh(seq id no:38)链。
49.图13a和13b显示了不可切割前体三特异性(三体)抗体构建体(构建体5;vlvh)的轻链(lc)多肽的氨基酸序列和编码不可切割前体构建体的轻链(lc)的优化核苷酸序列的
实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5’到3’显示。图13a显示了不可切割前体构建体的轻链(lc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:cap
‑
(h1f3.1
‑
λlc抗
‑
egfr vl
‑
接头
‑
vh不可切割)(seq id no:135)。图13a所示的lc多肽的组件部分的氨基酸序列包括:cap(seq id no:5)、不可切割的接头(seq id no:162)、抗
‑
cd3ε可变轻链和λ轻链(seq id no:74),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗
‑
egfr scfv vl(seq id no:34)
‑
接头(seq id no:40)
‑
vh(seq id no:37)链。图13b显示编码不可切割前体三特异性(三体)抗体构建体的轻链(lc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:147)。编码图13a所示的lc多肽的组件部分的核酸序列包括:cap(seq id no:164)、不可切割的接头(seq id no:163)、抗cd3ε可变轻链和λ轻链区(seq id no:159),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vl(seq id no:36)
‑
接头(seq id no:40)
‑
vh(seq id no:38)链。
50.图14a和14b显示不可切割前体三特异性(三体)抗体构建体(构建体6;vhvl)的重链(hc)多肽的氨基酸序列和编码不可切割前体构建体的重链(hc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5’到3’显示。图14a显示不可切割前体构建体的重链(hc)多肽的氨基酸序列的一个实施方式,具有n
‑
端至c
‑
端顺序和如下组件:halb
‑
g
‑
plglag(nc)
‑
(克隆)
‑
h1f3.5
‑
g1fd
‑
(vh
‑
接头
‑
vl)(seq id no:136)。图14a所示的hc多肽的组件部分的氨基酸序列包括:人血清白蛋白(hsa)(seq id no:7)、不可切割的接头(seq id no:162)、抗cd3ε可变重链和恒定重链区1(seq id no:113),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:37)
‑
接头(seq id no:40)
‑
vl(seq id no:34)链。图14b显示了编码不可切割前体三特异性(三体)抗体构建体的重链(hc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:148)。编码图14a所示的hc多肽的组件部分的核酸序列包括:人血清白蛋白(hsa)(seq id no:8)、不可切割的接头(seq id no:163)、抗cd3ε可变重链和恒定重链区1(seq id no:155),接着是两个标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:38)
‑
接头(seq id no:40)
‑
vl(seq id no:36)链。
51.图15a和15b显示了不可切割前体三特异性(三体)抗体构建体(构建体6;vlvh)的轻链(lc)多肽的氨基酸序列和编码不可切割前体构建体的轻链(lc)的优化核苷酸序列的实施方式。氨基酸序列从n
‑
端到c
‑
端显示,核酸序列以5’到3’显示。图15a显示前体构建体的轻链(lc)多肽的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序和如下组件:cap(nc)
‑
h1f3.1
‑
λlc
‑
抗
‑
egfr(vh
‑
接头
‑
v)(seq id no:137)。图15a所示的lc多肽的组件部分的氨基酸序列包括:cap(seq id no:5)、不可切割的接头(seq id no:162)、抗cd3ε可变轻链和λ轻链(seq id no:74),接着是标记的半胱氨酸残基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:37)
‑
接头(seq id no:40)
‑
vl(seq id no:34)链。图15b显示了编码不可切割前体三特异性(三体)抗体构建体的轻链(lc)多肽的优化核酸序列(dna)的一个实施方式,具有5'至3'顺序和如下组件(seq id no:149)。编码图15a所示的lc多肽的组件部分的核酸序列包括:cap(seq id no:164)、不可切割的接头(seq id no:163)、抗cd3ε可变轻链和λ轻链区(seq id no:159),接着是标记的半胱氨酸残
基(标记为粗体和下划线),其可以参与二硫双键,接着是抗egfr scfv vh(seq id no:38)
‑
接头(seq id no:40)
‑
vl(seq id no:36)链。
52.图16显示了活化的三体和前体三体抗体构建体的sds
‑
page。在图16中,所有三体和前体三体构建体都通过sds
‑
page进行了分析,无论是还原(r)形式还是非还原(nr)形式。编号1是构建体1:活化的三体构建体(vl
‑
vh);编号2是构建体2:活化的三体构建体(vh
‑
vl);编号3是构建体3:前体三体构建体(vl
‑
vh);编号4是构建体4:前体三体构建体(vh
‑
vl);编号5是构建体5:不可切割前体三体构建体(vl
‑
vh);并且编号6是构建体6:不可切割前体三体构建体(vh
‑
vl)。泳道标记有构建体编号和还原(r)或非还原(nr)形式。三体分子量为100112da,由fd和λc融合组成,其mw分别为51105和49029。
53.从图16中可以看出,所有蛋白质都是纯的,并且按预期以适当的mw迁移,无论是其还原形式还是非还原形式。前体三体分子量为170390da,由fd和λc融合组成,其mw分别为117649和52762。从图16中可以看出,所有蛋白质都是纯的,并按预期以适当的mw迁移,无论是其还原形式还是非还原形式。
54.图17a
‑
17f显示活性三体和前体三体抗体构建体的分析型hplc
‑
尺寸排阻色谱法。在图17a
‑
17f中,所有三体和前体三体均通过分析型hplc
‑
尺寸排阻色谱法(sec)以其天然形式进行分析。三体分子量为100,112da,与已知mw标记物相比,以其预期大小作为单体迁移。前体三体分子量为170,390da,与已知mw标记物相比,以预期大小作为单体迁移。图17a显示构建体1的结果,17b显示构建体2的结果,17c显示构建体3的结果,17d显示构建体4的结果,17e显示构建体5的结果,17f显示构建体6的结果。
55.图18a和18b显示elisa结合研究。图18a显示了对于人egfr抗原的三体和前体三体抗体构建体的elisa结合研究。使用elisa方法测试了三体和前体三体抗体(vl
‑
vh或vh
‑
vl形式两者)对于其与egfr细胞外融合抗原(hegfr
‑
fc)的结合。如图18a可见,所有三体和前体三体形式都以相似的亲和力结合hegfr的细胞外结构域。此外,抗egfr scfv的vl
‑
vh和vh
‑
vl形式之间没有重大差异。图18b显示了使用elisa方法测试了三体和前体三体抗体对恒河猴egfr抗原三体和前体三体抗体(无论是vl
‑
vh还是vh
‑
vl形式)的elisa结合对于其与恒河猴egfr细胞外融合抗原(恒河猴egfr
‑
fc)结合。如图18b可见,所有三体和前体三体形式都以相似的亲和力结合恒河猴egfr的胞外结构域。vl
‑
vh和vh
‑
vl形式的抗egfr scfv之间没有重大差异。此外,对人和恒河猴egfr,所有三体和前体三体的结合亲和力相当。在图18a和18b的图中:构建体1由小圆圈代表,构建体2由小正方形代表,构建体3由向上的三角形代表,构建体4由倒三角形代表,构建体5由菱形代表,构建体6由大圆圈代表。
56.图19a和19b显示对人和食蟹猴(cyno)cd3ε抗原的elisa结合研究。图19a显示了三体和前三体抗体对人cd3ε抗原的elisa结合。使用elisa方法测试了三体和前三体抗体(vl
‑
vh或vh
‑
vl形式两者)对于其与人cd3ε细胞外融合抗原(人cd3ε
‑
组氨酸)的结合。从图19a中可以看出,三体抗体以亚nm亲和力结合hcd3ε,而前三体形式(切割的(c)和不切割的(nc)两者)以更高的ec50结合hcd3ε的细胞外结构域,这表明阻碍了cd3ε与其抗原结合。抗cd3ε的vl
‑
vh和vh
‑
vl形式之间没有重大差异。图19b显示了三体和前三体抗体对食蟹猴cd3ε抗原的elisa结合。使用elisa方法测试了三体和前三体抗体(vl
‑
vh或vh
‑
vl形式两者)对于其与人cd3ε细胞外融合抗原(犬cd3ε
‑
组氨酸)的结合。如图19b所示,三体抗体以亚nm亲和力结合食蟹猴cd3ε,而前三体形式(切割的(c)和不切割的(nc)两者)以更高的ec50结合hcd3ε的
细胞外结构域,这表明阻碍了cd3ε与其抗原结合。抗cd3ε的vlvh和vhvl形式之间没有重大差异。此外,对人类和恒河猴cd3ε,所有三体和前三体的结合亲和力相当。
57.图20显示了被mmp9消化的三体和前三体(vhvl)的sds
‑
page。在图20中,所有三体和前三体都被mmp9消化,并且在非还原(nr)条件下通过sds
‑
page分析了它们的切割产物。三体分子量为100112da,由fd和λc融合组成。mmp9切割对三体没有明显的活性,因为其没有任何mmp9切割序列。前三体分子量为170390da。前三体
‑
c代表在半衰期延长部分(人血清白蛋白)的c
‑
端和cd3ε cap掩蔽部分的c
‑
端具有mmp9切割序列的前三体。前三体
‑
nc代表缺乏mmp9切割序列的前三体,因此其不应被mmp9切割。可以看出,只有前三体
‑
c被mmp9切割,产生两条带——三体和半衰期延长部分(人血清白蛋白(hsa))。
58.图21a和21b显示了前三体
‑
c(vhvl)和前三体
‑
nc(vhvl)与人cd3e抗原的elisa结合:被mmp
‑
9切割。在mmp9切割之前和之后,使用elisa方法测试前三体vh
‑
vl形式抗体对于其与人cd3ε细胞外融合抗原(人cd3ε
‑
组氨酸)的结合。如图21a中可见,前三体
‑
c抗体在被mmp9切割之前不结合cd3ε,而在被mmp9切割之后,前三体
‑
c以亚nm亲和力结合hcd3ε。前三体
‑
nc抗体在mmp9切割存在或不存在的情况下均不结合cd3ε(图21b)。数据表明在前体形式中cap和hsa的阻碍导致前体与cd3ε抗原的结合非常少。一旦前三体
‑
c被mmp9切割,从而释放cd3ε的hsa和cap阻碍,与人cd3ε的结合ec50明显改进朝向nm的结合亲和力。前三体
‑
nc抗体没有被切割,因此与cd3ε几乎没有结合。
59.图22a和22b显示在具有和没有mmp
‑
9切割情况下,前三体
‑
c(vhvl)和前三体
‑
nc(vhvl)与食蟹猴cd3e抗原的elisa结合。在mmp9切割之前和之后,使用elisa方法测试前三体vh
‑
vl抗体对于其与食蟹猴cd3ε细胞外融合抗原(食蟹猴cd3ε
‑
组氨酸)的结合。如图22a中可见,前三体
‑
c抗体在被mmp9切割之前不结合cd3ε,而在被mmp9切割后,前三体
‑
c以亚nm亲和力结合hcd3ε。前三体
‑
nc抗体在mmp9切割存在或不存在的情况下都不结合食蟹猴cd3ε(图22b)。数据表明前体中cap和hsa的阻碍导致与cd3ε抗原的结合非常少。一旦前三体
‑
c被mmp9切割,从而释放食蟹猴cd3ε的hsa和cap阻碍,与人cd3ε的结合ec50明显改进朝向nm的结合亲和力。前三体
‑
nc抗体没有被切割,因此与cd3ε几乎没有结合。
60.图23显示了三体(vhvl)、前三体
‑
c(vhvl)和前三体
‑
nc(vhvl)与人cd3e抗原的elisa结合:被mmp
‑
9切割。在mmp9切割之前和之后,使用elisa方法测试三体vhvl和前三体vhvl形式抗体对于其与人cd3ε细胞外融合抗原(人cd3ε
‑
组氨酸)的结合。如图23中可见,前三体
‑
c抗体在被mmp9切割之前不结合cd3ε,而在被mmp9切割后前三体
‑
c以亚nm亲和力结合hcd3ε,类似于三体。前三体
‑
nc抗体在mmp9切割存在或不存在的情况下均不结合cd3ε。
61.数据表明前体抗体中cap和hsa的阻碍导致与cd3ε抗原的结合非常少。一旦前三体
‑
c被mmp9切割,从而释放cd3ε的hsa和cap阻碍,与人cd3ε的结合ec50明显改进朝向nm的结合亲和力。前三体
‑
nc抗体没有被切割,因此与cd3ε几乎没有结合。
62.图24显示了三体(vhvl)、前三体
‑
c(vhvl)和前三体
‑
nc(vhvl)与食蟹猴cd3e抗原的elisa结合:被mmp
‑
9切割。在mmp9切割之前和之后,使用elisa方法测试三体vhvl和前三体vhvl形式抗体对于其与食蟹猴cd3ε细胞外融合抗原(食蟹猴cd3ε
‑
组氨酸)的结合。如图24中可见,前三体
‑
c抗体在被mmp9切割之前不结合cd3ε,而在被mmp9切割后前三体
‑
c以亚nm亲和力结合hcd3ε,类似于三体。前三体
‑
nc抗体在mmp9切割存在或不存在的情况下均不结合cd3ε。
63.数据表明前体抗体中cap和hsa的阻碍导致与cd3ε抗原的结合非常少。一旦前三体
‑
c被mmp9切割,从而释放cd3ε的hsa和cap阻碍,与人cd3ε的结合ec50明显改进朝向低nm的结合亲和力。前三体
‑
nc抗体没有被切割,因此与cd3ε几乎没有结合。
64.图25显示三体(vhvl)、前三体
‑
c(vhvl)和前三体
‑
nc(vhvl)与jurkat细胞(人cd3e)的facs结合。使用facs方法测试三体vhvl和前三体vhvl形式的抗体对于其与jurkat细胞(人cd3e)的结合。从图25中可以看出,前三体
‑
c和前三体
‑
nc抗体不与jurkat细胞结合,而三体以低nm亲和力结合。数据表明前体结构的cap和has的阻碍导致与表达人cd3ε的jurkat细胞的结合非常少。一旦cd3ε的hsa和cap阻碍不存在(三体(vhvl)),与人cd3ε的结合ec50明显改进朝向低nm的结合亲和力。
65.图26a
‑
26b显示了scfv抗ror1 vl
‑
vh的氨基酸和核酸序列的实施方式。图26a显示了如下的scfv抗
‑
ror1的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vl
‑
vh,以及如下组件:抗
‑
ror1 vl、接头和抗
‑
ror1 vh(seq id no:156)。图26b显示了如下的编码scfv抗
‑
ror1的优化核酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vl
‑
vh(seq id no:157)。
66.图27a
‑
27b显示了scfv抗ror1 vh
‑
vl的氨基酸和核酸序列的实施方式。图27a显示了如下的scfv抗
‑
ror1的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vh
‑
vl,以及如下组件:抗
‑
ror1 vh、接头和抗
‑
ror1 vl(seq id no:166)。图27b显示了如下的编码scfv抗
‑
ror1的优化核酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vh
‑
vl(seq id no:167)。
67.图28a
‑
28b显示了scfv抗psma vl
‑
vh的氨基酸和核酸序列的实施方式。图28a显示了如下的scfv抗
‑
psma的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vl
‑
vh,以及如下组件:抗
‑
psma vl、接头和抗
‑
psma vh(seq id no:168)。图28b显示了如下的编码scfv抗
‑
psma的优化核酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vl
‑
vh(seq id no:169)。
68.图29a
‑
29b显示了scfv抗psma vh
‑
vl的氨基酸和核酸序列的实施方式。图29a显示了如下的scfv抗
‑
psma的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vh
‑
vl,以及如下组件:抗
‑
psma vh、接头和抗
‑
psma vl(seq id no:170)。图29b显示了如下的编码scfv抗
‑
psma的优化核酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vh
‑
vl(seq id no:171)。
69.图30a
‑
30b显示scfv抗5t4 vl
‑
vh的氨基酸和核酸序列的实施方式。图30a显示了如下的scfv抗
‑
5t4的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vl
‑
vh,以及如下组件:抗
‑
5t4 vl、接头和抗
‑
5t4 vh(seq id no:172)。图30b显示了如下的编码scfv抗5t4的优化核酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vl
‑
vh(seq id no:173)。
70.图31a
‑
31b显示了scfv抗5t4 vh
‑
vl的氨基酸和核酸序列的实施方式。图31a显示了如下的scfv抗
‑
5t4的氨基酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vh
‑
vl,以及如下组件:抗
‑
5t4 vh、接头和抗
‑
5t4 vl(seq id no:1174)。图31b显示了如下的编码scfv抗5t4的优化核酸序列的一个实施方式,具有n
‑
端到c
‑
端顺序:vh
‑
vl(seq id no:1175)。
71.图32显示被mmp9切割的egfr结合三体和前体三体抗体构建体与jurkat细胞的facs结合数据。mfi(平均荧光强度)提供了抗体结合的相对比例。分析的构建体:三体(vhvl)是实施例1的构建体2(小圆圈、正方形);前
‑
三体
‑
c(vhvl)是实施例1的构建体4(向上和向下三角形);和前
‑
三体
‑
nc(vhvl)是实施例1的构建体6(菱形和大圆圈)。
‑
mmp9和 mmp9表示mmp9蛋白酶不存在(
‑
)或存在( )。
72.图33a
‑
33b显示了施用于小鼠的egfr活化的(图33a)三体构建体和前体(图33b)三
体构建体的体内药代动力学值(pk值)。抗体构建体:三体egfr(vl
‑
vh)是实施例1的构建体1(图33a);前三体
‑
c egfr(vl
‑
vh)是实施例1的构建体3(图33b);和前三体
‑
nc egfr(vl
‑
vh)是实施例1的构建体5(图33)。以两种浓度静脉内施用构建体:0.5mg/kg和2mg/kg。结果提供了每种构建体的半衰期信息。
73.图34a
‑
34f显示了sds
‑
page结果(34a和34d)和分析型hplc
‑
尺寸排阻色谱法结果(34b图、34c表、34e图和34f表)。图34a
‑
34c显示了三体
‑
ror1(vl
‑
vh)构建体的结果,其中第一和第二结合位点两者均结合ror1并且第三结合位点是cd3ε结合位点。不存在调节臂(regulatory arms)(实施例8的构建体7)。图34d
‑
34f显示了前三体
‑
ror1(vl
‑
vh)构建体的结果,其中第一和第二结合位点两者均结合ror1并且第三结合位点是cd3ε结合位点,其中构建体包括掩蔽cd3ε结合的cap调节结构域和包含hsa的hlp调节结构域,其中两个调节结构域通过不可切割的接头在n
‑
端连接到cd3ε结合位点(实施例8的构建体11)。
74.图35a
‑
35i显示了在还原和非还原条件下的sds
‑
page结果(35a和35d和35g),以及分析型hplc
‑
尺寸排阻色谱法结果(35b图、35c表、35e图、35f表、35h图和35i表)。图35a
‑
35c显示了三体
‑
5t4(vl
‑
vh)构建体的结果,其中第一和第二结合位点两者均结合5t4并且第三结合位点是cd3ε结合位点(实施例8的构建体13)。图35d
‑
35f显示了前三体
‑
5t4(vl
‑
vh)构建体的结果,其中第一和第二结合位点两者均结合5t4并且第三结合位点是cd3ε结合位点,其中构建体包括掩蔽cd3ε结合的cap调节结构域和包含hsa的hlp调节结构域,其中两个调节结构域通过可切割的接头在n
‑
端连接到cd3ε结合位点(实施例8的构建体15)。图35g
‑
35i显示了前三体
‑
5t4(vl
‑
vh)构建体的结果,其中第一和第二结合位点两者均结合5t4并且第三结合位点是cd3ε结合位点,其中构建体包括掩蔽cd3ε结合的cap调节结构域和包含hsa的hlp调节结构域,其中两个调节结构域通过不可切割的接头在n
‑
端连接到cd3ε结合位点(实施例8的构建体17)。
75.图36显示了结合曲线,其显示了三体和前三体抗体与5t4抗原的结合。5t4
‑
三体是活化的三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且没有调节结构域。5t4
‑
pt三体
‑
c是前体三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且具有第一和第二子调节结构域,每个子调节结构域都连接到cd3ε结合结构域的fab的n
‑
端,其中调节结构域内的接头是mmp9可切割的。5t4
‑
pt三体
‑
nc是前体三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且具有第一和第二子调节结构域,每个子调节结构域都连接到cd3ε结合结构域的fab的n
‑
端,其中调节结构域内的接头是不可切割的。
76.图37显示了mmp9蛋白酶切割5t4前三体抗体构建体的sds
‑
page结果。三体
‑
5t4(vl
‑
vh)是活化的三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且没有调节结构域(实施例8的构建体13)。前三体
‑
5t4
‑
c
‑
(vl
‑
vh)是前体三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且具有第一和第二子调节结构域,每个子调节结构域都连接到cd3ε结合结构域的fab的n
‑
端,其中调节结构域内的接头是mmp9可切割的(实施例8的构建体15)。前三体
‑
5t4
‑
nc
‑
(vl
‑
vh)是前体三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且具有第一和第二子调节结构域,每个子调节结构域都连接到cd3ε结合结构域的fab的n
‑
端,其中调节结构域内的接头是不可切割的(实施例8的构建体17)。
77.图38显示结合曲线,其显示了分别在存在或不存在mmp9蛋白酶(( mmp9)或(
‑
mmp9))的情况下三体和前三体抗体构建体与人cd3ε抗原的结合。5t4
‑
三体是活化的三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且没有调节结构域。5t4
‑
pt三体
‑
c是前体三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且具有第一和第二子调节结构域,每个子调节结构域都连接到cd3ε结合结构域的fab的n
‑
端,其中调节结构域内的接头是mmp9可切割的。5t4
‑
pt三体
‑
nc是前体三体构建体,其中第一和第二结合结构域结合5t4,第三结构域结合cd3ε,并且具有第一和第二子调节结构域,每个子调节结构域都连接到cd3ε结合结构域的fab的n
‑
端,其中调节结构域内的接头是不可切割的。
78.图39显示了在存在和不存在mmp9蛋白酶的情况下,三体
‑
5t4、前三体
‑
5t4
‑
c和前三体
‑
5t4
‑
nc与jurkat细胞(人cd3e)的facs结合。
79.图40显示了三体和前体三体抗体构建体针对人5t4抗原的elisa结合研究。
80.图41显示了5t4结合三体和前体三体抗体构建体对表达人5t4的cho细胞的facs结合数据。mfi(平均荧光强度)提供了抗体结合的相对比例。
81.图42显示了5t4结合三体和前体三体抗体构建体对已知高度表达人5t4的mcf7乳腺癌细胞系的facs结合数据。mfi(平均荧光强度)提供了抗体结合的相对比例。
82.图43和44显示了5t4结合三体和前体三体抗体构建体对已知高表达人5t4的mcf7乳腺癌细胞系(图43)和nci
‑
h226肺癌细胞系(图44)的细胞毒性测定。
83.图45a
‑
45b显示前体三特异性(三体)抗体构建体的重链(hc)多肽的氨基酸序列的两个实施方式(例如图2f的hc的实施方式,其中两个scfv都结合egfr)。氨基酸序列从n
‑
端到c
‑
端显示。图45a和45b显示了前体构建体的重链(hc)多肽的氨基酸序列的实施方式,具有n
‑
端到c
‑
端顺序和如下组件:cap(粗体)、接头(斜体)、人血清白蛋白(下划线);蛋白酶切割序列(粗体和斜体);抗cd3e fab的vh1/ch1(粗体和下划线)、vl(斜体和下划线)、vh(斜体、粗体和下划线)(egfr scfv)。两个标记的半胱氨酸残基(双下划线)可以参与二硫双键。图45a中的蛋白酶切割序列是多重的蛋白酶切割序列。图45b中的蛋白酶切割序列是mmp2/9蛋白酶切割序列。图45a的氨基酸序列在seq id no:28中叙述。图45b的氨基酸序列在seq id no:31中叙述。本技术的全文中描述了组件部分的序列的实施方式。
84.图46显示了前体三特异性(三体)抗体构建体的轻链(lc)多肽的氨基酸序列的实施方式(例如图2f的lc的实施方式,其中两个scfv都结合egfr)。氨基酸序列从n
‑
端到c
‑
端显示。图46显示前体构建体的轻链(lc)多肽的氨基酸序列的一个实施方式,具有n
‑
端至c
‑
端顺序和如下组件:接头(斜体)、抗cd3e fab的vl1
‑
cl(双下划线和粗体)、vl(斜体和下划线)和vh(斜体和下划线)(其中vh是egfr scfv)。两个标记的半胱氨酸残基(双下划线)可以参与二硫双键。图46中所示的lc的氨基酸序列在seq id no:32中叙述。本技术的全文中描述了lc多肽的组件部分的氨基酸序列的实施方式。
85.图47a
‑
47b显示前体三特异性(三体)抗体构建体的重链(hc)多肽的氨基酸序列的两个实施方式(例如图2f的hc的实施方式,其中两个scfv都结合5t4)。氨基酸序列从n
‑
端到c
‑
端显示。图47a和47b显示了前体构建体的重链(hc)多肽的氨基酸序列的实施方式,具有n
‑
端到c
‑
端顺序和如下组件:cap(粗体)、接头(斜体)、人血清白蛋白(下划线);蛋白酶切割序列(粗体和斜体);抗cd3e fab的vh1/ch1(粗体和下划线)、vl(斜体和下划线)vh(斜体、粗
体和下划线)(5t4scfv)。两个标记的半胱氨酸残基(双下划线)可以参与二硫双键。图47a中的蛋白酶切割序列是多重的蛋白酶切割序列。图47b中的蛋白酶切割序列是mmp2/9蛋白酶切割序列。图47a的氨基酸序列在seq id no:118中叙述。图47b的氨基酸序列在seq id no:176中叙述。本技术全文中描述了组件部分的序列的实施方式。
86.图48显示前体三特异性(三体)抗体构建体的轻链(lc)多肽的氨基酸序列的实施方式(例如图2f的lc的实施方式,其中两个scfv都结合5t4)。氨基酸序列从n
‑
端到c
‑
端显示。图48显示前体构建体的轻链(lc)多肽的氨基酸序列的实施方式,具有n
‑
端到c
‑
端顺序和如下组件:接头(斜体)、抗cd3e fab的vl1
‑
cl(双下划线和粗体)、vl(斜体和下划线)和vh(斜体和下划线),其中vh是5t4 scfv)。两个标记的半胱氨酸残基(双下划线)可以参与二硫双键。图48中所示的lc的氨基酸序列在seq id no:177中叙述。本技术的全文中描述了lc多肽的组件部分的氨基酸序列的实施方式。
87.应当理解,为了图示的简单和清楚起见,图中所示的元件不一定按比例绘制。例如,为了清楚起见,一些元件的尺寸可能相对于其他元件被夸大。进一步地,在认为合适的情况下,附图标记可以在图中重复以指示相应或类似的元件。
具体实施方式
88.在以下详细描述中,叙述了许多具体细节以提供对前体三特异性抗体构建体的透彻理解。然而,本领域技术人员将理解,本文所示的前体构建体、其生产和使用可以在没有这些具体细节的情况下实践。在其他情况下,没有详细描述众所周知的方法、程序和部件,以免混淆本公开内容。
89.本文描述了前体三特异性抗体构建体,其包含单独的可切割掩蔽结构域和半衰期延长结构域,其中这些可切割调节结构域在肿瘤微环境(tme)之外时提供降低的前体三特异性构建体与t细胞的结合,并且提供延长的半衰期。半衰期延长可能受限于前体三特异性构建体在癌症微环境之外的时间,或者它可能延长到前体三特异性构建体驻留在癌症微环境中的时间。本文所述的前体三特异性抗体构建体具有蛋白酶可切割掩蔽结构域和蛋白酶可切割半衰期延长(hlp)结构域的优点可以是掩蔽cap和hlp结构域的改进的蛋白酶激活的控制释放。
90.t细胞结合的降低可能导致t细胞活化的降低。在一些实施方式中,本文所述的前体三特异性抗体构建体是可调节的前体构建体。本文所述的可调节前体三特异性抗体构建体可具有延长的半衰期、或降低的t细胞结合、或降低的t细胞活化、或其任何组合。
91.在一些实施方式中,本文所述的前体三特异性抗体构建体提供可调节的t细胞活化,其中前体构建体提供t细胞活化限于肿瘤微环境。在一些实施方式中,与非前体总是有活性的多价抗体相比,本文所述的前体三特异性抗体构建体具有增强的半衰期并且提供了t细胞活化仅限于肿瘤微环境。在一些实施方式中,与非前体总是有活性的多价抗体相比,本文所述的前体三特异性抗体构建体在非肿瘤微环境中具有降低的t细胞活化。
92.在一些实施方式中,与非前体三特异性抗体相比,本文所述的前体三特异性抗体构建体在非肿瘤微环境中具有延长的半衰期。在一些实施方式中,与非前体总是有活性的多价抗体相比,本文所述的前体三特异性抗体构建体在非肿瘤微环境中具有降低的t细胞结合和/或活化以及在非肿瘤微环境中具有延长的半衰期。
93.在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞。在一些实施方式中,本文所述的前体三特异性抗体构建体可与肿瘤微环境(tme)内的t细胞结合。在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞和两种不同的taa。在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞和两种不同的taa,其中taa包含肿瘤细胞表面抗原的不同细胞外表位。在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞和两种不同的taa,其中taa包含肿瘤细胞表面抗原的细胞外表位。在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞和两种不同的taa,其中taa包含肿瘤细胞表面抗原的细胞外表位和tme抗原。在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞和两种不同的taa,其中taa包含肿瘤细胞表面抗原的细胞外表位和tme中的基质抗原。在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞和两种不同的taa,其中taa包含肿瘤细胞表面抗原的细胞外表位和tme中的血管生成抗原。在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞和两种不同的taa,其中taa包含肿瘤细胞表面抗原的细胞外表位和tme中血管表面上的抗原。在一些实施方式中,血管表面上的抗原是内皮细胞表面抗原。在一些实施方式中,血管表面上的抗原是选自cd31、cd105、cd146和cd144的内皮细胞表面抗原。在一些实施方式中,本文所述的前体三特异性抗体构建体可结合t细胞和两种不同的taa,其中taa包含肿瘤细胞表面抗原的细胞外表位和tme中的细胞因子。
94.在一些实施方式中,tme中的基质抗原包含成纤维细胞活化蛋白(fap)。在一些实施方式中,tme中的基质抗原包含α平滑肌肌动蛋白(αsma)。在一些实施方式中,tme中的基质抗原包含pdgfrα。在一些实施方式中,tme中的基质抗原包含整合素α11β1(itga11)。在一些实施方式中,tme中的基质抗原包含vegf。在一些实施方式中,tme中的基质抗原包含腱生蛋白
‑
c、骨膜蛋白。在一些实施方式中,tme中的基质抗原包含成纤维细胞特异性蛋白1(s10a4、fsp1)。在一些实施方式中,tme中的基质抗原包含结蛋白。在一些实施方式中,tme中的基质抗原包含波形蛋白。在一些实施方式中,tme中的基质抗原包含帕拉丁。在一些实施方式中,tme中的基质抗原包含尿激酶型纤维蛋白溶酶原激活剂受体相关蛋白(uparap)。在一些实施方式中,tme中的基质抗原包含半乳糖凝集素
‑
3。在一些实施方式中,tme中的基质抗原包含平足蛋白。在一些实施方式中,tme中的基质抗原包含血小板。在一些实施方式中,tme中的基质抗原包含ccl2。在一些实施方式中,tme中的基质抗原包含cxcl12。在一些实施方式中,tme中的基质抗原选自成纤维细胞活化蛋白(fap)、α平滑肌肌动蛋白(αsma)、pdgfrα、整合素α11β1(itga11)vegf、腱生蛋白
‑
c、骨膜蛋白、成纤维细胞特异性蛋白1(s10a4、fsp1)、结蛋白、波形蛋白、帕拉丁、尿激酶型纤维蛋白溶酶原激活剂受体相关蛋白(uparap)、半乳糖凝集素
‑
3、平足蛋白、血小板、ccl2或cxcl12中的任何。
95.在一些实施方式中,本文描述了包含前体三特异性抗体构建体的药物组合物,该前体三特异性抗体构建体在非肿瘤微环境中提供可调节的t细胞活化。在一些实施方式中,本文描述了包含前体三特异性抗体构建体的药物组合物,该前体三特异性抗体构建体具有提高的半衰期,并提供t细胞活化限于肿瘤微环境。在一些实施方式中,本文描述了包含前体三特异性抗体构建体的药物组合物,该前体三特异性抗体构建体在非肿瘤微环境中包含延长的半衰期。在一些实施方式中,本文描述了包含前体三特异性抗体构建体的药物组合物,该前体三特异性抗体构建体在非肿瘤微环境中包含延长的半衰期,其中与在非肿瘤微
环境中的半衰期相比,在肿瘤微环境中的半衰期降低。在一些实施方式中,包含前体构建体的药物组合物包含识别t细胞和taa的构建体。在一些实施方式中,包含前体构建体的药物组合物包含识别t细胞和两种taa的构建体,其中每种taa是不同的抗原。在一些实施方式中,包含前体构建体的药物组合物包含识别t细胞和两种taa的构建体,其中该taa识别相同的抗原。
96.在一些实施方式中,本文描述了使用如本文公开的前体三特异性抗体构建体用于治疗、防止、抑制生长、延缓疾病进展、降低肿瘤负荷或降低受试者中癌症或肿瘤的发病率、或其任何组合的方法。在一些实施方式中,与未施用药物组合物的受试者相比,本文公开的治疗方法在治疗的受试者中减少微小残留病、提高缓解、提高缓解持续时间、降低肿瘤复发率、防止肿瘤或癌症的转移、或降低肿瘤或癌症的转移率、或其任何组合。
97.前体三特异性抗体构建体
98.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
99.在一些实施方式中,本文公开了前体三特异性抗体构建体,其包含:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;和调节结构域,所述调节结构域包括第一和第二子调节结构域或单个调节结构域的任一,所述第一子调节结构域包含第一蛋白酶切割结构域和半衰期延长(hlp)结构域,并且所述第二子调节结构域包含第二蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件;单个调节结构域包含蛋白酶切割结构域、半衰期延长(hlp)结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
100.在一些实施方式中,本文公开了前体三特异性抗体构建体,其包含:结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;以及调节结构域,其包含蛋白酶切割结构域、半衰期延长(hlp)结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
101.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
102.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件。
103.对于全文中描述的前体构建体,技术人员将理解,基于包含在第一和第二结合位
点中的氨基酸序列,所述构建体的模块化结构允许不同的结合配偶体。
104.技术人员会认识到前体抗体构建体是活性抗体蛋白的前体形式或“前(pro)”形式。在一些实施方式中,术语“前”与术语“前体”可互换使用,都具有相同含义和性质。
105.技术人员会理解,在一些实施方式中,全文中使用的术语“前体三特异性抗体构建体”、“前体三特异性抗体构建体”、“前体抗体”、“前体构建体”、“前体抗体构建体”、“前体三特异性抗体”、“三特异性抗体”、“抗体”、“三特异性抗体构建体”和“三特异性构建体”可以互换使用,都具有相同的性质和含义。此外地,在一些实施方式中,术语“三特异性”可以替换为术语“三体”,因为认识到本文公开的抗体构建体具有三个抗体体区,其中每个区可以结合不同的抗原(三体或三特异性)或三个结合区中的两个可结合相同抗原(三体或三特异性,其中两个特异性结合抗原相同)。因此,如上所列的术语,例如在一些实施方式中,“前体三特异性抗体构建体”可以与术语“前体三体构建体”互换使用,都具有相同的含义和性质。
106.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件,其中所述第一taa或所述第二taa或所述第一taa和所述第二taa两者包含肿瘤细胞表面抗原的细胞外表位。
107.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件,其中所述第一taa或所述第二taa或所述第一taa和所述第二taa两者包括tme。
108.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件,其中所述第一taa或所述第二taa或所述第一taa和所述第二taa两者包含tme中的基质抗原。
109.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件,其中所述第一taa或所述第二taa或所述第一taa和所述第二taa两者包含tme中的血管生成抗原。
110.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位
的能力的cap组件,其中所述第一taa或所述第二taa或所述第一taa和所述第二taa两者包含tme中血管表面上的抗原。
111.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件,其中所述第一taa或所述第二taa或所述第一taa和所述第二taa两者包含tme中的细胞因子抗原。
112.在一些实施方式中,前体三特异性抗体构建体包含结合第一肿瘤相关抗原(taa)的第一结合结构域;结合第二taa的第二结合结构域;结合人cd3ε的细胞外表位的第三结合结构域;第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合人cd3ε的细胞外表位的能力的cap组件,其中所述第一taa或所述第二taa或所述第一taa和所述第二taa两者包含肿瘤细胞表面抗原的细胞外表位或tme、或tme中的基质抗原、或tme中的血管生成抗原、或tme中血管表面上的抗原、或tme中细胞因子抗原或其任何组合。
113.技术人员会理解,在一些实施方式中,术语“肿瘤相关抗原”(taa)可包括展示在细胞表面上的分子或其部分或存在于肿瘤环境中(即在肿瘤微环境内)的分子。在一些实施方式中,taa包括细胞表面肿瘤相关抗原(taa)。在一些实施方式中,细胞是肿瘤细胞。在一些实施方式中,细胞是存在于肿瘤环境中的非肿瘤细胞,例如但不限于存在于与肿瘤或癌症相关的脉管系统组织中的细胞。在一些实施方式中,taa是肿瘤微环境中的血管生成抗原。在一些实施方式中,taa是肿瘤微环境中血管上的抗原。在一些实施方式中,细胞是存在于肿瘤环境中的基质细胞。在一些实施方式中,taa是肿瘤微环境内的基质细胞抗原。在一些实施方式中,taa包括肿瘤细胞表面抗原的细胞外表位。在一些实施方式中,taa包括细胞外基质抗原。
114.在一些实施方式中,血管生成抗原包含bfgf。在一些实施方式中,血管生成抗原包含inf。在一些实施方式中,血管生成抗原包含vegf。在一些实施方式中,血管生成抗原包含bfgf、inf或vegf。
115.在一些实施方式中,taa包含存在于tme中的抗原。在一些实施方式中,taa包含tme中的细胞因子抗原。在一些实施方式中,taa包含由肿瘤细胞分泌到tme中的分子。在一些实施方式中,taa包含由肿瘤细胞分泌到tme中的效应物分子。在一些实施方式中,效应分子包含细胞因子抗原。在一些实施方式中,效应物分子包含tme中的细胞因子抗原。
116.在一些实施方式中,tme中的细胞因子抗原包含tnf
‑
α、il
‑
6、tgf
‑
β、il
‑
10、il
‑
8、il
‑
17、il
‑
21、inf或vegf。在一些实施方式中,taa选自tnf
‑
α、il
‑
6、tgf
‑
β、il
‑
10、il
‑
8、il
‑
17、il
‑
21、inf或vegf。在一些实施方式中,用作taa的细胞因子抗原包括本领域已知的细胞因子抗原。
117.在一些实施方式中,第一taa或所述第二taa或所述第一taa和所述第二taa两者包含肿瘤细胞表面抗原的细胞外表位、肿瘤微环境抗原、肿瘤微环境(tme)中的基质抗原、tme中的血管生成抗原、tme中的血管上的抗原或tme中的细胞因子抗原、或其任何组合。
118.技术人员会理解,术语“肿瘤微环境”(tme)、“癌症微环境”和“肿瘤环境”可以互换
使用,具有相同的性质和含义并且涵盖肿瘤发展的微环境。虽然正常细胞微环境可以抑制恶性细胞生长,但肿瘤微环境中发生的改变可以协同支持细胞增殖。
119.在一些实施方式中,本文公开的前体构建体的第一结合结构域和第二结合结构域结合相同的taa。在一些实施方式中,本文公开的前体构建体的第一结合结构域和第二结合结构域结合不同的taa。在一些实施方式中,本文公开的前体构建体的第一结合结构域和第二结合结构域结合同一细胞上的不同taa。在一些实施方式中,本文公开的前体构建体的第一结合结构域和第二结合结构域结合不同细胞上的不同taa。在一些实施方式中,taa包含肿瘤细胞上的细胞表面抗原。在一些实施方式中,taa包含tme中细胞上的细胞表面抗原。
120.在一些实施方式中,第一结合结构域和第二结合结构域结合不同的taa。不同的taa可以是例如但不限于肿瘤细胞表面抗原的细胞外表位、tme抗原、tme中的基质抗原、tme中的血管生成抗原、tme中血管上的抗原或tme中的细胞因子。
121.技术人员会理解,术语“抗原”或“免疫原”包括具有免疫原性的肽、蛋白质或多肽或其任何片段。在一些实施方式中,抗原能够在哺乳动物中引发免疫应答,并因此包含至少一个并且可以包含多个表位。“抗原”分子或分子的一部分能够被选择性结合剂结合,例如fab片段的抗原结合部分或单链可变片段(scfv)的抗原结合部分。此外,“抗原”能够用于动物以产生能够结合该抗原的表位的抗体。在一些实施方式中,cap组件包含第三结合结构域结合的抗原部分。
122.术语“表位”包括任何决定簇,在某些实施方式中,多肽决定簇能够特异性结合抗taa结合结构域或抗t细胞受体结合结构域。表位是被抗体或其抗原结合片段结合的抗原区。在一些实施方式中,cap组件包含第三结合结构域结合的表位。
123.在某些实施方式中,表位决定簇包括分子的化学活性表面分组,例如氨基酸、糖侧链、磷酰基或磺酰基,并且在某些实施方式中可以具有特异性三维结构特征和/或特异性电荷特征。在某些实施方式中,当前体三特异性抗体构建体优选识别蛋白质和/或大分子的复杂混合物中的靶抗原时,该前体三特异性抗体构建体被称为特异性结合抗原。当平衡解离常数≤10
‑5、10
‑6或10
‑7m时,前体三特异性抗体构建体被称为特异性结合抗原。在一些实施方式中,平衡解离常数可以≤10
‑8m或10
‑9m。在一些进一步的实施方式中,平衡解离常数可以≤10
‑
10
m或10
‑
11
m。本文公开的抗原包括但不限于taa、cap组件和免疫效应物分子,例如人cd3ε多肽。
124.在一些实施方式中,肿瘤相关抗原(taa)是肿瘤抗原。在一些实施方式中,肿瘤抗原包含在肿瘤细胞上呈递的那些抗原。在一些实施方式中,肿瘤抗原存在于实体瘤细胞上。在一些实施方式中,肿瘤抗原是存在于非实体瘤细胞上的癌症抗原。
125.在一些实施方式中,当taa是肿瘤细胞抗原时,肿瘤细胞包括来自实体瘤的细胞。实体瘤可能是良性的(不是癌症)或者是恶性的(癌症)。不同类型的实体瘤以形成它们的细胞类型命名。实体瘤的实例是肉瘤、癌和淋巴瘤。在一些实施方式中,实体瘤是由除血液、骨髓或淋巴细胞之外的身体组织细胞的异常生长形成的赘生物(细胞的新生长)或病变(解剖结构的损伤或生理功能的紊乱)。在一些实施方式中,实体瘤由异常的细胞群组成,这些细胞群可能源自不同的组织类型,例如肝脏、结肠、乳腺或肺,并且最初在其细胞来源的器官中生长。然而,这些癌症可能会通过疾病晚期中的转移性肿瘤生长扩散到其他器官。
126.在一些实施方式中,实体瘤包括肉瘤或癌、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉
瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文肉瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌或肿瘤、乳腺癌或肿瘤、卵巢癌或肿瘤、前列腺癌或肿瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯肿瘤、子宫颈癌或肿瘤、子宫癌或肿瘤、睾丸癌或肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、神经鞘瘤、脑膜瘤、黑素瘤、成神经细胞瘤或视网膜母细胞瘤。在一些实施方式中,实体瘤包括肾上腺皮质肿瘤(腺瘤和癌)、癌、结肠直肠癌、硬纤维瘤、促纤维增生性小圆细胞肿瘤、内分泌肿瘤、尤文肉瘤、生殖细胞肿瘤、肝母细胞瘤、肝细胞癌、黑素瘤、成神经细胞瘤、骨肉瘤、视网膜母细胞瘤、横纹肌肉瘤、除横纹肌肉瘤以外的软组织肉瘤和维尔姆斯肿瘤。在一些实施方式中,实体瘤是乳腺肿瘤。在另一个实施方式中,实体瘤是前列腺癌。在另一个实施方式中,实体瘤是结肠癌。在一些实施方式中,肿瘤是脑肿瘤。在另一个实施方式中,肿瘤是胰腺肿瘤。在另一个实施方式中,肿瘤是结肠直肠肿瘤。
127.在一些实施方式中,肿瘤细胞包括来自非实体瘤,即非实体癌的细胞。在一些实施方式中,癌症可以是弥漫性癌症,其中癌症广泛扩散;不局限或受限制。在一些实施方式中,弥漫性癌症可包括非实体瘤。弥漫性癌症的实例包括白血病。白血病包括从造血组织(例如骨髓)开始并导致大量异常血细胞产生并进入血液的癌症。
128.在一些实施方式中,弥漫性癌症包括b细胞恶性肿瘤。在一些实施方式中,弥漫性癌症包括白血病。在一些实施方式中,癌症是淋巴瘤。在一些实施方式中,淋巴瘤是大b细胞淋巴瘤。
129.在一些实施方式中,弥漫性癌症或肿瘤包括血液肿瘤。在一些实施方式中,血液肿瘤是影响血液、骨髓和淋巴结的癌症类型。血液肿瘤可能源自两种主要血细胞谱系中的任一种:髓样和淋巴样细胞系。髓样细胞系通常产生粒细胞、红细胞、血小板、巨噬细胞和肥大细胞,而淋巴样细胞系产生b、t和浆细胞。淋巴瘤(例如霍奇金淋巴瘤)、淋巴细胞白血病和骨髓瘤源自淋巴系,而急性和慢性髓性白血病(aml、cml)、骨髓增生异常综合征和骨髓增生性疾病是骨髓来源的。
130.在一些实施方式中,非实体(弥漫性)癌症或肿瘤包括造血系统恶性肿瘤、血细胞癌、白血病、骨髓增生异常综合征、淋巴瘤、多发性骨髓瘤(浆细胞骨髓瘤)、急性淋巴细胞白血病、急性髓性白血病、慢性髓性白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤或浆细胞白血病。
131.在一些实施方式中,肿瘤或癌症包含肿瘤或癌症的转移。
132.在一些实施方式中,细胞表面taa位于细胞的质膜中或质膜上,使得该分子的至少一部分保持从细胞外部以三级形式可接近。在一些实施方式中,位于质膜中的细胞表面taa是跨膜蛋白,在其三级构象中包含亲水性区和疏水性区。
133.这些抗原可以与细胞外部分一起在细胞表面上呈递,该细胞外部分通常与分子的跨膜和细胞质部分组合。这些抗原有时只能由肿瘤细胞呈递,而从不由正常细胞呈递。肿瘤抗原可以专门在肿瘤细胞上表达,也可以代表与正常细胞相比的肿瘤特异性突变。在这种情况下,它们被称为肿瘤特异性抗原。更常见的是由肿瘤细胞和正常细胞呈递的抗原。在一些实施方式中,taa包括专门在肿瘤细胞上表达的抗原。在一些实施方式中,taa包括在肿瘤
细胞和正常细胞两者上表达的抗原。
134.在一些实施方式中,与正常细胞相比,taa可以在肿瘤细胞上过表达,或者由于与正常组织相比肿瘤组织的结构不太紧密,taa可易于在肿瘤细胞中抗体结合。
135.在一些实施方式中,本文所述的前体三特异性抗体构建体包含(a)scfv片段,其包含结合taa的第一结合结构域(taa结合结构域);(b)scfv片段,其包含结合taa的第二结合结构域(taa结合结构域);(c)fab片段,其包含结合人cd3ε的细胞外表位的第三结合结构域(cd3结合结构域);(d)第一子调节结构域,其包含蛋白酶切割结构域和半衰期延长(hlp)结构域;和(e)第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合cd3ε的细胞外表位的能力的cap组件。在一些实施方式中,本文所述的前体三特异性抗体构建体包含(a)scfv片段,其包含结合taa的第一结合结构域(taa结合结构域);(b)scfv片段,其包含结合taa的第二结合结构域(taa结合结构域);(c)fab片段,其包含结合人cd3ε的细胞外表位的第三结合结构域(cd3结合结构域);(d)第一子调节结构域,其包含蛋白酶切割结构域和包含人血清白蛋白(hsa)多肽的半衰期延长(hlp)结构域;和(e)第二子调节结构域,其包含蛋白酶切割结构域和降低第三结合结构域结合cd3ε的细胞外表位的能力的cap组件。
136.技术人员会理解,在一些实施方式中,前体抗体构建体包括药学活性抗体的前体或衍生物形式。在一些实施方式中,药物制剂包含前体抗体构建体。在一些实施方式中,制剂包含前体抗体构建体。在一些实施方式中,与活化的抗体相比,前体抗体构建体具有降低的不利影响。在一些实施方式中,与活化的抗体相比,前体抗体构建体具有降低的不利影响,其中前体抗体可以被酶促活化或转化为抗体的活性形式。在一些实施方式中,本文所述的前体三特异性抗体构建体抗体是前体三特异性抗体构建体。
137.在某些实施方式中,与活化的抗体相比,前体抗体构建体具有延长的半衰期。在某些实施方式中,与活化的抗体相比,前体抗体构建体具有延长的半衰期,其中前体抗体可以被酶促活化或转化为抗体的活性形式,并且与前体抗体构建体相比,活性形式具有减少的半衰期。
138.在一些实施方式中,前体抗体构建体结合t细胞的能力降低。在某些实施方式中,与活化的抗体相比,前体抗体构建体活化t细胞的能力降低。在一些实施方式中,前体抗体构建体结合t细胞的能力降低。在某些实施方式中,与活化的抗体相比,前体抗体构建体活化t细胞的能力降低,其中前体抗体可以被酶促活化或转化为抗体的活性形式。
139.在某些实施方式中,与活化抗体相比,前体抗体构建体具有延长的半衰期和降低的活化t细胞的能力两者。在某些实施方式中,与活化的抗体相比,前体抗体构建体具有延长的半衰期和降低的结合t细胞的能力两者。在某些实施方式中,与活化的抗体相比,前体抗体构建体具有延长的半衰期和降低的活化t细胞的能力两者,其中前体抗体可以被酶促活化或转化为抗体的活性形式。在某些实施方式中,与活化的抗体相比,前体抗体构建体具有延长的半衰期和降低的结合t细胞的能力,其中前体抗体可以被酶促活化或转化为抗体的活性形式。
140.在一些实施方式中,前体抗体结合t细胞的能力降低,其中包含cap组件的调节结构域被切割但包含hlp的调节结构域未被切割,其中“部分”活化的抗体可结合t细胞并保持延长的半衰期。在一些实施方式中,与完全活化的抗体相比,部分活化的前体抗体与t细胞的结合降低,其中两个调节臂都已被蛋白水解切割。在一些实施方式中,前体抗体激活t细
胞的能力降低,其中包含cap组件的调节结构域被切割但包含hlp的调节结构域未被切割,其中“部分”活化的抗体可激活t细胞并保持延长的半衰期。在一些实施方式中,与完全活化的抗体相比,在结合部分活化的前体构建体后,t细胞的活化降低,其中两个调节臂都已被蛋白水解切割。
141.在一些实施方式中,前体抗体构建体在体外合成。在一些实施方式中,当前体在非肿瘤微环境中体内(例如,在循环中)存在时,前体抗体构建体不会转化为抗体的活性形式。
142.在一些实施方式中,除抗原结合结构域之外,前体抗体构建体还包含多个调节结构域。在一些实施方式中,除抗原结合结构域之外,前体抗体构建体还包含两个调节结构域。在一些实施方式中,除抗原结合结构域之外,前体抗体构建体还包含酶促可切割调节结构域。在一些实施方式中,除抗原结合结构域之外,前体抗体构建体还包含多个调节结构域,其中所述调节结构域的一部分是酶促可切割的。在一些实施方式中,除抗原结合结构域之外,前体抗体构建体还包含两个调节结构域,其中所述调节结构域的一部分是酶促可切割的。在一些实施方式中,除三个抗原结合结构域之外,前体抗体构建体还包含两个调节结构域,其中所述调节结构域是酶促可切割的。
143.在一些实施方式中,在t细胞的细胞毒性活化之前,本文所述的前体三特异性抗体在靶向肿瘤细胞方面比靶向正常细胞方面包含增强的选择性。
144.免疫结合通常是指发生在免疫球蛋白分子和免疫球蛋白特异性的抗原之间的非共价相互作用,例如作为说明而非限制的,作为静电、离子、亲水和/或疏水吸引力或排斥力、空间力、氢键、范德华力和其他相互作用的结果。免疫结合相互作用的强度或亲和力可以用相互作用的解离常数(k
d
)表示,其中较小的k
d
代表较大的亲和力。所选多肽的免疫结合性质可以使用本领域公知的方法进行量化。一种这样的方法需要测量抗原结合位点/抗原复合物形成和解离的速率,其中这些速率取决于复合物配偶体的浓度、相互作用的亲和力,以及同样影响双向速率的几何参数。因此,“结合速率常数”(k
on
)可以通过计算浓度和实际缔合速率以及“解离速率常数”(k
off
)可以由实际解离速率确定。因此,k
off
/k
on
的比率等于解离常数k
d
。一般见davies等人(1990)annual rev.biochem.59:439
‑
473。
145.技术人员会理解,“结合结构域”或相关表达,例如“结合”或“与/对”特定靶标具有“反应性”的结构域,包括该结构域区分各自抗原和特异性与靶抗原缔合的能力。根据本公开内容的“结合结构域”或“结合区”可以是例如具有特异性识别和结合生物分子(例如细胞表面受体或肿瘤蛋白,或其组分,例如,其细胞外组分)的能力的任何蛋白质、多肽、寡肽或肽。结合结构域包括目的生物分子的任何天然存在的、合成的、半合成的或重组产生的结合配偶体。例如,并且如本文进一步描述的,结合结构域可以是抗体轻链和重链可变区,或者轻链和重链可变区可以以单链和任一方位(例如,vl
‑
vh或vh
‑
vl)连接在一起。用于标识与特定靶标特异性结合的本公开内容的结合结构域的多种测定是已知的,包括蛋白质印迹、elisa、流式细胞术或表面等离子共振分析(例如,使用biacore tm分析)。
146.在一些实施方式中,如果结合结构域或其部分以亲和力或ka(即,具体结合相互作用的平衡缔合常数,单位为1/m)(例如大于或等于约105m
‑1)结合靶分子或与靶分子缔合,则其“特异性结合”靶分子。在某些实施方式中,结合结构域或其部分以大于或等于约106m
‑1、107m
‑1、108m
‑1、109m
‑1、10
10
m
‑1、10
11
m
‑1、10
12
m
‑1或10
13
m
‑1的ka结合靶标,“高亲和力”结合结构域可包括ka为至少107m
‑1、至少108m
‑1、至少109m
‑1、至少10
10
m
‑1、至少10
11
m
‑1、至少10
12
m
‑1、至
少10
13
m
‑1或更高的那些结合结构域。可选地,亲和力可定义为具有单位m(例如,10
‑5m至10
‑
13
m或更少)的具体结合相互作用的平衡解离常数(kd)。如本文所述的结合结构域多肽及其部分的亲和力可以使用常规技术容易地确定(参见例如scatchard等人(1949)ann.n.y.acad.sci.51:660;和美国专利申请号5,283,173;5,468,614或等同物,其以全文并入本文)。
147.本文描述了说明性结合结构域。在某些实施方式中,靶分子可以是细胞表面表达的蛋白质,例如受体或肿瘤抗原。在一些实施方式中,靶分子是肿瘤相关抗原(taa)。示例性的结合结构域包括免疫球蛋白抗原结合结构域,例如scfv、sctcr、受体的细胞外结构域、细胞表面分子/受体的配体、或其受体结合结构域以及肿瘤结合蛋白。在某些实施方式中,抗原结合结构域可以是scfv、vh、vl、结构域抗体变体(dab)、骆驼科抗体(vhh)、纤连蛋白3结构域变体、锚蛋白重复变体和衍生自其他蛋白质支架的其他抗原特异性结合结构域(owen,b.(2017)nat biotechnol jul 12:35(7):602
‑
603)。
148.因此,在某些实施方式中,结合结构域包含抗体衍生的结合结构域,但可以是非抗体衍生的结合结构域。抗体衍生的结合结构域可以是抗体的片段或抗体的一个或多个片段的基因改造产物,该片段参与结合抗原。实例包括但不限于互补决定区(cdr)、可变区(fv)、重链可变区(vh)、轻链可变区(vl)、重链、轻链、单链可变区(scfv)、fab、单结构域骆驼抗体(骆驼科vhh)和单结构域抗体(dab)。
149.本公开内容提供前体三特异性抗体构建体,其包含结合细胞表面肿瘤相关抗原(taa)的第一结合结构域,例如但不限于为表皮生长因子受体(egfr)抗原的taa;和结合细胞表面肿瘤相关抗原(taa)的第二结合结构域,例如但不限于为表皮生长因子受体(egfr)抗原的第二taa;结合免疫效应物分子例如但不限于cd3ε链(cd3ε)细胞外表位的第三结合结构域;和两个调节结构域,例如但不限于包含可切割的半衰期延长结构域的一个调节结构域和包含可切割cap(掩蔽)结构域的一个调节结构域(图1和2a
‑
2b)。在一些实施方式中,前体三特异性抗体构建体包含结合细胞表面肿瘤相关抗原(taa)的第一结合结构域,例如但不限于为表皮生长因子受体(egfr)抗原的taa;和结合细胞表面肿瘤相关抗原(taa)的第二结合结构域,例如但不限于为表皮生长因子受体(egfr)抗原的第二taa;结合免疫效应物分子例如但不限于cd3ε链(cd3ε)细胞外表位的第三结合结构域;以及单个调节结构域,其包含蛋白酶切割结构域、半衰期延长(hlp)结构域和降低第三结合结构域结合(例如但不限于当第三结构域结合人cd3ε的细胞外表位时)的能力的cap组件(图2f)。
150.在一些实施方式中,前体三特异性抗体构建体包含与细胞表面肿瘤相关抗原(taa)结合的第一结合结构域,例如但不限于为表皮生长因子受体(egfr)抗原的taa;和结合细胞表面肿瘤相关抗原(taa)的第二结合结构域,例如但不限于为表皮生长因子受体(egfr)抗原的第二taa;结合免疫效应物分子例如但不限于cd3ε链(cd3ε)细胞外表位的第三结合结构域;和包含可切割cap(掩蔽)结构域的调节结构域(图2c)。在一些实施方式中,前体三特异性抗体构建体包含结合细胞表面肿瘤相关抗原(taa)的第一结合结构域,例如但不限于为表皮生长因子受体(egfr)抗原的taa;和结合细胞表面肿瘤相关抗原(taa)的第二结合结构域,例如但不限于为表皮生长因子受体(egfr)抗原的第二taa;结合免疫效应物分子例如但不限于cd3ε链(cd3ε)细胞外表位的第三结合结构域;和包含可切割的半衰期延长结构域的调节结构域(图2d)。
151.在一些实施方式中,第一和第二结合结构域各自包含单链可变片段(scfv)。技术人员会理解,scfv实际上不是抗体的片段,而是包含免疫球蛋白的可变重链(vh)和可变轻链(vl)区的融合多肽,其通过10到约25个氨基酸的短接头肽连接(图1和图2a
‑
2d和2f)。
152.在一些实施方式中,第三结合结构域包含fab片段,其中第一结合结构域附接到cl链的c
‑
末端和第二结构域附接到ch1链的c
‑
末端。可选地,第三结合结构域包含fab片段,其中第二结合结构域附接到ch1链的c
‑
末端,并且第一结构域附接到cl链的c
‑
末端处。
153.在一些实施方式中,第三结合结构域包含fab片段,其中第一调节结构域,例如cap掩蔽结构域,附接到vl链的n
‑
末端和第二调节结构域,例如hsa hlp结构域,附接到vh链的n
‑
末端处(图1、2a和2b)。在一些实施方式中,第三结合结构域包含fab片段,其中第一调节结构域,例如cap掩蔽结构域,附接到vl链的n
‑
末端和第二调节结构域,例如hsa hlp结构域,附接到vh链的n
‑
末端处。
154.在一些实施方式中,第三结合结构域包含fab片段,其中包含例如cap掩蔽结构域、hsa hlp结构域和蛋白酶接头的调节结构域附接到vh链的n
‑
末端(图2f)。在一些实施方式中,第三结合结构域包含fab片段,其中包含例如cap掩蔽结构域、hsa hlp结构域和蛋白酶接头的调节结构域附接到vl链的n
‑
末端。
155.在一些实施方式中,在第一结合结构域的scfv和第三结合结构域的cl之间可以存在接头序列。在一些实施方式中,在第一结合结构域的scfv和第三结合结构域的ch1之间可以存在接头序列。在一些实施方式中,在第二结合结构域的scfv和第三结合结构域的cl之间可以存在接头序列。在一些实施方式中,在第二结合结构域的scfv和第三结合结构域的ch1之间可以存在接头序列。在一些实施方式中,在第一结合结构域和第二结合结构域的scfv与在第三结合结构域的cl和ch1之间,可以分别存在接头序列。
156.在一些实施方式中,在第一子调节结构域与第三结合结构域的vh链之间,可以存在可切割的接头序列。在一些实施方式中,在第一子调节结构域与第三结合结构域的vl链之间,可以存在可切割的接头序列。在一些实施方式中,在第二子调节结构域与第三结合结构域的vh链之间,可以存在可切割的接头序列。在一些实施方式中,在第二子调节结构域与第三结合结构域的vl链之间,可以存在可切割的接头序列。在一些实施方式中,在第一子调节结构域和第二子调节结构域与第三结合结构域的vh和vl链之间,可以分别存在可切割的接头序列。
157.在一些实施方式中,在单个调节结构域与第三结合结构域的vh链之间,可以存在可切割的接头序列。在一些实施方式中,在单个调节结构域与第三结合结构域的vl链之间,可以存在可切割的接头序列。
158.这些通用形式是可构建的基本结构,可用于构建本文所述的前体三特异性(三体)抗体构建体(图1和图2a、2b和2f)。
159.在一些实施方式中,调节结构域包含蛋白酶可切割的接头组件和人血清白蛋白多肽(hsa)序列组件(图1、2a、2b和2d)。在一些实施方式中,仅存在包含蛋白酶可切割的接头组件和人血清白蛋白多肽(hsa)序列组件的单个调节结构域(图2d)。在一些实施方式中,仅存在包含蛋白酶可切割的接头组件、人血清白蛋白多肽(hsa)序列组件和cap组件的单个调节结构域(图2f)。在一些实施方式中,调节结构域包含蛋白酶可切割的接头组件,以及人血清白蛋白多肽序列组件和至少一种cap氨基酸组件中的一种(图1和2a
‑
2b)。在一些实施方
式中,有两个调节结构域,一个基本上由蛋白酶可切割的接头组件和人血清白蛋白多肽序列组件组成,另一个基本上由蛋白酶可切割的接头和cap氨基酸(掩蔽)组件组成(图1和2a
‑
2b)。在一些实施方式中,仅存在包含蛋白酶可切割的接头组件和cap氨基酸(掩蔽)组件的单个调节结构域(图2c)。在一些实施方式中,存在包含cap氨基酸(掩蔽)组件、蛋白酶可切割的接头组件和人血清白蛋白多肽(hsa)序列组件的单个调节结构域(图2f)。技术人员会理解接头的存在,例如图1和2a
‑
f所示构建体中展示的任何接头,会为多肽提供柔性,同时不一定为调节结构域提供必要的调节特征,例如由cap(掩蔽活性)或has组件(增加半衰期)提供。在一些实施方式中,其中接头包含蛋白酶切割接头,接头也提供调节功能,其中蛋白酶可切割的接头的切割可以去除cap(掩蔽)组件,去除半衰期延长组件,或可以去除cap(掩蔽)组件和半衰期延长组件二者。
160.在一些实施方式中,第三结合结构域抗免疫效应物分子,例如但不限于抗cd3ε链(cd3ε)细胞外表位,特异性结合cap氨基酸组件。在一些实施方式中,cap组件有效阻断前体三特异性抗体构建体与免疫效应物靶分子例如t细胞的结合。在一些实施方式中,对靶标的细胞毒性的活化被cap组件特异性地掩蔽。在一些实施方式中,其中调节结构域包含可切割cap组件,细胞毒性的活化限于肿瘤环境(图3a
‑
3b)。一些实施方式,第一或第二结合结构域靶标(例如taa)的来源包括图3b中显示的那些(右侧)。
161.在一些实施方式中,cap组件包含存在于人cd3ε多肽链内的氨基酸序列。在一些实施方式中,cap组件包含作为人cd3ε链的细胞外部分的一部分存在的氨基酸序列。在一些实施方式中,cap组件包含选自人cd3ε前体多肽的n
‑
末端的氨基酸序列的氨基酸序列。在一些实施方式中,cap组件包含选自人cd3ε成熟多肽的n
‑
末端的氨基酸序列的氨基酸序列。
162.前体人cd3ε的氨基酸序列在seq id no:1中叙述。人cd3ε以前体形式表达,其中氨基酸1
‑
21形成信号肽。成熟人cd3ε的氨基酸序列在seq id no:1的氨基酸22
‑
207中叙述,如本文seq id no:2所叙述。在一些实施方式中,人cd3ε的细胞外表位位于前体序列内,如seq id no:3所叙述。在一些实施方式中,成熟人cd3ε的细胞外表位位于前体序列的氨基酸1
‑
27内,如seq id no:4所叙述。在一些实施方式中,人cd3ε的细胞外表位位于氨基酸qdgneemggitqtpykvsisgttvilt(seq id no:5;aa1
‑
27)内。
163.在一些实施方式中,cap组件的氨基酸序列在seq id no:5或其同源物中叙述。在一些实施方式中,cap组件的氨基酸序列是在seq id no:4或其同源物中选择的连续序列。
164.在一些实施方式中,seq id no:5或选自seq id no:4的cap序列的同源物包含与氨基酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽。
165.在一些实施方式中,同源物包含与人cd3ε同源多肽或其部分至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。
166.技术人员会理解,术语“同源性”及其语法形式包括两个或更多个结构之间的相似度。术语“同源序列”是指大分子中具有相似单体顺序的区域。当与核酸序列相关使用时,术语“同源性”是指两个或更多个核酸序列(例如,基因)或其片段之间的相似度。通常,两个或
更多个核酸序列之间的相似度是指两个或更多个核酸序列的两个或更多个核苷酸碱基(或其他基因型特征)的组成、顺序或排列的相似度。术语“同源核酸”通常是指包含在核苷酸碱基组成、排列或顺序方面具有相似度的核苷酸序列的核酸。两个或更多个核酸可以是相同或不同的种类或组。当与核酸序列相关使用时,术语“同源性百分比”通常是指两个或更多个核酸的核苷酸序列之间的相似度百分比。
167.当与多肽(或蛋白质)序列相关使用时,术语“同源性”是指两个或更多个多肽(或蛋白质)序列(例如基因)或其片段之间的相似度。通常,两个或更多个多肽(或蛋白质)序列之间的相似度是指两个或更多个多肽(或蛋白质)的两个或更多个氨基酸的组成、顺序或排列的相似度。两个或更多个多肽(或蛋白质)可以是相同或不同的种类或组。当与多肽(或蛋白质)序列相关使用时,术语“同源性百分比”通常是指两个或更多个多肽(或蛋白质)序列的氨基酸序列之间的相似度百分比。术语“同源多肽”或“同源蛋白质”通常分别指具有相似氨基酸序列和功能的多肽或蛋白质。此类同源多肽或蛋白质可通过具有相似的氨基酸序列和功能而相关,但使用本文所述技术从不同或相同物种衍生或进化。
168.在一些实施方式中,同源物包含与本文所公开的多肽或其部分至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。在一些实施方式中,同源物包含与本文所公开的核酸序列或其部分至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的核苷酸序列,如使用国家生物技术信息中心(ncbi)的blastn软件使用默认参数确定的。
169.在一些实施方式中,同源性还包括其及其生物活性多肽片段的缺失、插入或取代变体,包括氨基酸取代。在一个实施方式中,变体包含保守取代、或缺失、插入或取代——其不显著改变本文所述的感兴趣多肽组件的三维结构。在一些实施方式中,缺失、插入或取代不改变本文公开的感兴趣多肽组件的感兴趣功能。
170.在一些实施方式中,同源性还包括其及其生物活性多肽片段的缺失、插入或取代变体,包括氨基酸取代。在一个实施方式中,变体包含保守取代、或缺失、插入或取代——其不显著改变cap组件的三维结构,例如存在于cap组件中的人cd3ε多肽的部分,尤其是在第三结合结构域识别和结合的表位的区域中。在一些实施方式中,缺失、插入或取代不改变cap组件的感兴趣功能,在一些实施方式中,其结合第三结合结构域,或降低t细胞结合,或降低t细胞活化,或其任何组合。
171.在一些实施方式中,cap组件的长度是6
‑
110个氨基酸。在一些实施方式中,cap组件的长度在约6
‑
10个氨基酸之间。在一些实施方式中,cap组件的长度在约10
‑
20个氨基酸之间。在一些实施方式中,cap组件的长度在约20
‑
30个氨基酸之间。在一些实施方式中,cap组件的长度在约20
‑
40个氨基酸之间。在一些实施方式中,cap组件的长度在约30
‑
40个氨基酸之间。在一些实施方式中,cap组件的长度在约40
‑
60个氨基酸之间。在一些实施方式中,cap组件的长度在约60
‑
80个氨基酸之间。在一些实施方式中,cap组件的长度在约80
‑
100个氨基酸之间。在一些实施方式中,cap组件的长度在约80
‑
110个氨基酸之间。
172.在一些实施方式中,cap组件的长度是6个氨基酸。在一些实施方式中,cap组件的
长度是7个氨基酸。在一些实施方式中,cap组件的长度是8个氨基酸。在一些实施方式中,cap组件的长度是9个氨基酸。在一些实施方式中,cap组件的长度是10个氨基酸。在一些实施方式中,cap组件的长度是11个氨基酸。在一些实施方式中,cap组件的长度是12个氨基酸。在一些实施方式中,cap组件的长度是13个氨基酸。在一些实施方式中,cap组件的长度是14个氨基酸。
173.在一些实施方式中,cap组件的长度是15个氨基酸。在一些实施方式中,cap组件的长度是16个氨基酸。在一些实施方式中,cap组件的长度是17个氨基酸。在一些实施方式中,cap组件的长度是18个氨基酸。在一些实施方式中,cap组件的长度是19个氨基酸。在一些实施方式中,cap组件的长度是20个氨基酸。在一些实施方式中,cap组件的长度是21个氨基酸。在一些实施方式中,cap组件的长度是22个氨基酸。在一些实施方式中,cap组件的长度是23个氨基酸。在一些实施方式中,cap组件的长度是24个氨基酸。在一些实施方式中,cap组件的长度是25个氨基酸。在一些实施方式中,cap组件的长度是26个氨基酸。在一些实施方式中,cap组件的长度是27个氨基酸。在一些实施方式中,cap组件的长度是28个氨基酸。在一些实施方式中,cap组件的长度是29个氨基酸。在一些实施方式中,cap组件的长度是30个氨基酸。在一些实施方式中,cap组件的长度是31、32、33、34、35、36、37、38、39或40个氨基酸。
174.在一些实施方式中,cap组件特异性结合第三结合区,从而降低前体构建体的t细胞结合。在一些实施方式中,cap组件特异性结合第三结合区,从而抑制前体构建体的t细胞结合。在一些实施方式中,cap组件特异性结合第三结合区,从而降低前体构建体的t细胞活化。在一些实施方式中,cap组件特异性结合第三结合区,从而抑制前体构建体的t细胞活化。
175.在一些实施方式中,调节结构域包含可切割的半衰期延长结构域。在一些实施方式中,可切割的半衰期延长结构域包含hsa多肽。
176.在一些实施方式中,调节结构域的组件之间存在接头。在一些实施方式中,在调节结构域和fab片段的vh链的n
‑
端之间存在接头。在一些实施方式中,在调节结构域和fab片段的vl链的n
‑
端之间存在接头。在一些实施方式中,在调节结构域和fab片段的vh链的n
‑
端之间存在接头,并且在调节结构域和fab片段的vl链的n
‑
端之间存在接头。在一些实施方式中,调节结构域的组件与fab片段多肽的n
‑
端之间的接头是可切割的接头。在一些实施方式中,调节结构域的组件和fab多肽之间的任何接头是可切割的接头。在一些实施方式中,调节结构域的组件与fab多肽之间的接头是不可切割的(图1、2a
‑
2d和3a
‑
3b)。
177.在一些实施方式中,调节结构域包含可切割的半衰期延长结构域——其包含蛋白酶可切割结构域和人血清白蛋白多肽(hsa)。在一些实施方式中,调节结构域中的组件顺序是(n
‑
端到c
‑
端)hsa
‑
l
‑
蛋白酶可切割结构域,其中l是可能的接头氨基酸序列(图1、2a、2b和2d)。在一些实施方式中,调节结构域包含切割调节结构域——其含有cap氨基酸(掩蔽)组件、蛋白酶可切割结构域和人血清白蛋白多肽(hsa)。在一些实施方式中,调节结构域中的组件顺序是(n
‑
端到c
‑
端)cap
‑
l
‑
hsa
‑
l
‑
蛋白酶可切割结构域,其中l是可能的接头氨基酸序列(图2f)。在一些实施方式中,其中蛋白酶可切割结构域在hsa多肽序列的c
‑
端,前体构建体具有可调节的增强的半衰期,其中前体构建体在体内循环中且在不存在肿瘤微环境的情况下具有增强的半衰期。
178.在一些实施方式中,调节结构域包含可切割的半衰期延长结构域——其包含蛋白酶可切割结构域和cap掩蔽结构域。在一些实施方式中,调节结构域中的组件顺序是(n
‑
端到c
‑
端)cap
‑
l
‑
蛋白酶可切割结构域,其中l是可能的接头氨基酸序列(图1、2a、2b和2c)。在一些实施方式中,调节结构域中的组件顺序是(n
‑
端到c
‑
端)cap
‑
l
‑
hsa
‑
l
‑
蛋白酶可切割结构域,其中l是可能的接头氨基酸序列。在前体抗体进入肿瘤微环境之前,三特异性前体构建体被有效阻止与免疫效应物靶分子结合。
179.在一些实施方式中,具有包含可切割的半衰期延长结构域和cap掩蔽结构域的一个调节结构域。在一些实施方式中,具有两个调节结构域:一个包含可切割的半衰期延长结构域,一个包含可切割的cap掩蔽结构域。在一些实施方式中,具有三个调节结构域:一个包含可切割的半衰期延长结构域,和两个包含可切割的cap掩蔽结构域。具有hsa调节结构域和至少一个cap调节结构域的前体三特异性构建体具有可调节的增强的半衰期,其中前体三特异性抗体构建体具有增强的半衰期并被有效阻止与至少一种免疫效应物靶分子的结合。在体内循环中和没有肿瘤环境的情况下,半衰期可能会增强。在一些实施方式中,前体三特异性抗体构建体对细胞毒性的活化限于肿瘤环境。在一些实施方式中,前体构建体在体内循环中保持增强的半衰期,并且在非肿瘤环境下在体内循环中有效地阻止与免疫效应物靶分子的结合(图3a
‑
3b)。在一些实施方式中,对靶标的细胞毒性的活化被在循环中和不存在肿瘤环境下的前体构建体的cap组件特异性掩蔽,并且前体构建体在体内循环中和在不存在或存在肿瘤环境的情况下包含增强的半衰期。在一些实施方式中,细胞毒性的活化限于肿瘤环境。
180.在一些实施方式中,对靶标的细胞毒性的活化被循环中和非肿瘤环境中的cap组件特异性掩蔽。在一些实施方式中,细胞毒性的活化限于肿瘤环境。在一些实施方式中,t细胞的活化被cap组件特异性掩蔽。
181.在一些实施方式中,hsa组件的氨基酸序列在seq id no:6中叙述。在一些实施方式中,hsa组件的氨基酸序列在seq id no:7中叙述。
182.在一些实施方式中,hsa组件的氨基酸序列是本领域已知的任何hsa多肽序列或其部分,或其同源物。在一些实施方式中,前体三特异性抗体构建体的hsa组件包括,例如但不限于,在已知数据库中(例如为国家生物技术信息中心(ncbi)或swiss
‑
prot的部分的蛋白质数据库)公开的任何人白蛋白序列,其中序列可被特异性标识为人或可被标识为合成构建体。
183.在一些实施方式中,hsa组件由seq id no:8中叙述的核苷酸序列编码。
184.在一些实施方式中,hsa组件的核酸序列是本领域已知的任何hsa核苷酸序列或其部分,或其同源物。在一些实施方式中,前体三特异性抗体构建体的hsa组件包含编码例如但不限于在已知数据库(例如为国家生物技术信息中心(ncbi)或swiss
‑
prot的部分的蛋白质数据库)中公开的任何人白蛋白序列的核酸序列,其中序列可被特异性标识为人或可被标识为合成构建体。
185.在一些实施方式中,hsa组件的同源物包含与氨基酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽。在一些实施方式中,同源物包含与has多肽或其部分至少50%、至少55%、至少60%、至少65%、至
少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。在一些实施方式中,编码hsa组件的同源物包含与核酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的核苷酸。在一些实施方式中,同源物编码与has多肽或其部分至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。
186.在一些实施方式中,同源性还包括其及其生物活性多肽片段的缺失、插入或取代变体,包括氨基酸取代。在一个实施方式中,变体包含保守取代、或缺失、插入或取代——其不显著改变hsa组件的三维结构。在一些实施方式中,缺失、插入或取代不改变hsa组件的感兴趣功能,在一些实施方式中,其提供半衰期延长结构域。
187.本文公开的前体三特异性抗体构建体的调节结构域的实施方式的线性表示包括但不限于(n
‑
端至c
‑
端)
188.(1)cap
‑
l
‑
蛋白酶可切割结构域
‑
l,其中l可能存在或可能不存在;
189.(2)hsa
‑
l
‑
蛋白酶可切割结构域
‑
l,其中l可能存在或可能不存在;
190.(3)cap
‑
l
‑
不可切割结构域
‑
l,其中l可能存在或可能不存在;
191.(4)hsa
‑
l
‑
不可切割结构域
‑
l,其中l可能存在或可能不存在;
192.(5)蛋白酶可切割结构域
‑
l
‑
cap;
193.(6)蛋白酶可切割结构域
‑
l
‑
hsa;
194.(7)不可切割结构域
‑
l
‑
cap;和
195.(8)不可切割结构域
‑
l
‑
hsa。
196.在一些实施方式中,本文公开的前体三特异性抗体构建体包含具有提高的治疗窗的前体构建体,其中其受限的存在提供靶向广泛的新靶标或提供改进的活性或其组合的能力,例如但不仅限于,仅在癌症微环境中活化t细胞的能力,并根据癌症类型靶向癌症特异性taa,以及由该癌症类型结合该癌症类型产生的蛋白酶唯一表达的特异性taa。在一些实施方式中,前体构建体具有仅在tme中活化t细胞的能力并且靶向存在于tme中的癌症特异性taa和不同的taa。
197.如本文所用,多肽的“c
‑
端”等,例如羧基
‑
端、羧
‑
端、c
‑
端尾部、c
‑
末端或cooh
‑
端)是氨基酸链(蛋白质或多肽)的末端,由游离羧基(
‑
cooh)终止。当蛋白质从信使rna翻译时,其从n
‑
端到c
‑
端产生。书写肽序列的惯例是把c
‑
末端放在右边,从n
‑
到c
‑
端书写序列。在一些实施方式中,多肽的c
‑
末端包括至多肽的最后一个氨基酸残基,该氨基酸残基贡献其胺基以与其相邻氨基酸残基的羧基形成肽键。
198.如本文所用,多肽的“n
‑
端”等,例如氨基
‑
端、nh2‑
端、n
‑
末端或胺
‑
端)是蛋白质或多肽的开始,其指位于多肽末端处的游离胺基(
‑
nh2)。通常,胺基与蛋白质中的另一个羧基键合以使其成为链,但由于蛋白质的末端在2个区中仅有1个被链化,因此游离胺基指的是n
‑
端。如上所述,按照惯例,肽序列在ltr语言中从n
‑
端到c
‑
端,从左到右书写。这将翻译方向与文本方向相关联(因为当蛋白质从信使rna翻译时,它是从n
‑
端到c
‑
端产生的——氨基
酸被添加到羰基端)。在一些实施方式中,多肽的n
‑
末端包含多肽的第一氨基酸,该氨基酸贡献其羧基以与其相邻氨基酸残基的胺基形成肽键。
199.技术人员会理解,接头组件可包括通过一种或多种化学键连接或通过一种或多种接头间接连接的氨基酸肽。任何合适的化学键均可用于进行直接连接,其包括但不限于共价键如肽键和二硫键,非共价键如氢键、疏水键、离子键和范德华键。
[0200]“共价键”在本文中是指共享一个或多个电子的两个原子之间的稳定缔合。共价键的实例包括但不限于肽键和二硫键。如本文所用,“肽键”是指氨基酸的羧基与相邻氨基酸的胺基之间形成的共价键。如本文所用,“二硫键”是指在两个硫原子之间形成的共价键。二硫键可以由两个硫醇基团的氧化形成。在某些实施方式中,共价连接是通过共价键的直接连接。在某些实施方式中,共价连接是通过肽键或二硫键的直接连接。
[0201]“非共价键”在本文中是指不涉及电子共享的两个分子或两个化学基团之间的吸引相互作用。非共价键的实例包括但不限于氢键、疏水键、离子键和范德华键。“氢键”在本文中是指第一分子/基团的氢原子和第二分子/基团的电负性原子之间的吸引力。“疏水键”在本文中是指引起疏水或非极性分子/基团在水性环境中聚集或缔合在一起的力。“离子键”在本文中是指阳离子和阴离子之间的吸引。“范德华键”在本文中是指在电子分布中具有瞬时随机波动的两个相邻分子/基团之间的非特异性吸引力。在某些实施方式中,共价连接是通过非共价键的直接连接。在某些实施方式中,共价连接是通过氢键、疏水键、离子键或范德华键的直接连接。
[0202]
技术人员会理解本文所述的蛋白酶可切割的结构域包括包含蛋白酶切割位点的接头。因此,术语“蛋白酶可切割的结构域”和“蛋白酶可切割的接头”在本文中可互换使用,都具有相同的含义和性质。
[0203]
技术人员会理解,术语“肿瘤微环境”、“癌症微环境”、“tme”和“肿瘤环境”可以互换使用,具有相同的性质和含义并且涵盖肿瘤发展的微环境。虽然正常细胞微环境可以抑制恶性细胞生长,但肿瘤微环境中发生的改变可协同地支持细胞增殖。
[0204]
肿瘤塑造其微环境并支持肿瘤细胞和非恶性细胞的发育。肿瘤微环境通过干扰细胞募集和血管构建所需的信号传导通路来影响血管生成。在缺氧条件下募集用于血管生成的内皮祖细胞(epc)也与转移相关。在一些实施方式中,taa包含与血管生成相关的细胞表面抗原。在一些实施方式中,taa被癌细胞过表达。在一些实施方式中,taa在胚胎细胞上表达。在一些实施方式中,taa在胚胎细胞和癌细胞上表达,但在正常成人细胞上不表达或仅极小表达。在一些实施方式中,taa在实体瘤细胞上表达。在一些实施方式中,taa在非实体癌细胞上表达。在一些实施方式中,taa在血管生成组织细胞上表达。
[0205]
此外,肿瘤分泌的蛋白质通过贡献降解细胞外基质并影响细胞运动和粘附的生长因子和蛋白酶来改变微环境。基质细胞分泌ecm蛋白、细胞因子、生长因子、蛋白酶、蛋白酶抑制剂和内切糖苷酶,如乙酰肝素酶。基质金属蛋白酶(mmp)是与癌症发展密切相关的重要分泌蛋白。与正常上皮细胞相比,肿瘤相关上皮细胞以更高水平表达mmp。在一些实施方式中,与非肿瘤环境相比,肿瘤的微环境包含提高的蛋白酶活性。
[0206]
图3a和3b提供了前体三特异性抗体构建体的非限制性实例,其在体内循环中和存在于非肿瘤环境中时可具有增强的半衰期。进一步地,在前体构建体处于非肿瘤环境中时,前体三特异性抗体构建体的抗cd3第三结合结构域被阻断,并且可能不与靶t细胞相互作用
或结合。在一些实施方式中,如图3a中的剪刀所示并且就在图3b中的t细胞活化之前,癌症微环境提供前体三特异性抗体构建体的蛋白酶切割,这去除了半衰期延长调节结构域(hsa)和cd3ε cap调节结构域,导致存在活化的egfr(2scfvs)xcd3ε抗体(图2e)和t细胞活化。
[0207]
在一些实施方式中,蛋白酶可切割结构域包含蛋白酶可切割氨基酸序列(可切割的肽/可切割的接头;cp),其包含可被丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶或基质金属蛋白酶(mmp)可切割序列可切割的肽。在一些实施方式中,蛋白酶可切割结构域包含蛋白酶可切割氨基酸序列(可切割的肽/可切割的接头;cp),其包含为多种不同蛋白酶切割的底物的肽。在一些实施方式中,蛋白酶可切割结构域包含蛋白酶可切割氨基酸序列(可切割的肽/可切割的接头;cp),其包含为mmp2/mmp9蛋白酶或尿激酶型纤维蛋白溶酶原激活剂(upa)蛋白酶,或蛋白裂解酶,或天冬酰胺内肽酶蛋白酶切割的底物的肽。在一些实施方式中,丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、upa蛋白酶、蛋白裂解酶、天冬酰胺内肽酶蛋白酶或基质金属蛋白酶(mmp)在肿瘤微环境中以更高水平表达。在一些实施方式中,基质金属蛋白酶在肿瘤微环境中以更高水平表达。
[0208]
在一些实施方式中,蛋白酶可切割序列是mmp可切割序列。在一些实施方式中,基质金属蛋白酶可切割序列可以是基质金属蛋白酶1(mmp
‑
1)、基质金属蛋白酶2(mmp
‑
2)、基质金属蛋白酶9(mmp
‑
9)或基质金属蛋白酶14(mmp
‑
14)可切割序列。
[0209]
在一些实施方式中,蛋白酶可切割序列是upa(尿激酶型纤维蛋白溶酶原激活剂)可切割序列。在一些实施方式中,蛋白酶可切割序列是mt
‑
sp1(蛋白裂解酶)可切割序列。
[0210]
在一些实施方式中,蛋白酶可切割序列是mmp、upa、蛋白裂解酶和天冬酰胺内肽酶可切割序列。
[0211]
在一些实施方式中,蛋白酶可切割结构域包含长度是1至10个氨基酸的氨基酸序列。在一些实施方式中,蛋白酶可切割结构域的长度是1至20个氨基酸。
[0212]
在一些实施方式中,蛋白酶可切割结构域包含蛋白酶底物切割序列,例如但不限于mmp底物切割序列。大多数mmp可以切割底物中众所周知的plglag肽序列(seq id no:9)。可以被mmp切割的底物序列已被广泛研究。蛋白酶底物切割序列是指可以被蛋白酶处理切割的肽序列。mmp底物序列是指可以通过与mmp一起温育而被切割的肽序列。seq id no:9是通常使用的mmp底物切割序列(参见例如,jiang,pnas(2004)101:17867
‑
72;olson,pnas(2010)107:4311
‑
6)。在另一个实施方式中,蛋白酶切割位点被mmp
‑
2、mmp
‑
9或其组合识别。在又一个实施方式中,蛋白酶位点包含gplgmlsq(seq id no:10)、gplglwaq(seq id no:11)、gplglag(seq id no:12)、kknpaeligpvd(seq id no:13)、kkqpaanlvaped(seq id no:14)、gplgiagq(seq id no:15)或pvglig(seq id no:16)中叙述的序列。在一些实施方式中,蛋白酶切割位点包括本领域已知的对存在于肿瘤环境中的蛋白酶敏感的任何蛋白酶切割位点(蛋白酶可切割的肽;cp),例如不限于eckhard,u等人matrix biol.jan;49:37
‑
60中公开的蛋白酶切割位点。
[0213]
在一些实施方式中,包含upa可切割序列的蛋白酶可切割序列包含如nsgrav(seq id no:17)、sgrsa(seq id no:18)、lggsgrsanaile(seq id no:19)、sgrs(seq id no:20)、ggsgrsank(seq id no:21)、lggsgrsanailec(seq id no:22)、gggrr(seq id no:23)、tgrgps(seq id no:24)、lsgrsdnh(seq id no:25)、或pltgrsgg(seq id no:26)中叙述的
序列。
[0214]
在一些实施方式中,包含蛋白裂解酶可切割序列的蛋白酶可切割序列包含如qrrvvgg(seq id no:27)、qar,aanl(seq id no:29)、ptnl(seq id no:30)、ptn、或san中叙述的序列。
[0215]
在一些实施方式中,可切割的肽由seq id no:33:ccactgggcctggccggc中叙述的核酸序列编码。
[0216]
在一些实施方式中,用作mmp2/9、upa、蛋白裂解酶和天冬酰胺内肽酶可切割序列的底物的蛋白酶可切割序列的氨基酸序列在plglagsgrsdnh(seq id no:35)中叙述。在一些实施方式中,前体构建体中包含的所有蛋白酶可切割序列包含seq id no:35。在一些实施方式中,前体构建体中包含的蛋白酶可切割序列中的至少一个包含seq id no:35。在一些实施方式中,前体构建体中包含的蛋白酶可切割序列中的至少2个包含seq id no:35。在一些实施方式中,前体构建体中包含的蛋白酶可切割序列中的至少3个包含seq id no:35。
[0217]
在一些实施方式中,调节结构域一的蛋白酶可切割的肽组件的序列与调节结构域二的蛋白酶可切割的肽组件相同。在一些实施方式中,调节结构域一的蛋白酶可切割的肽组件的序列与调节结构域二的蛋白酶可切割的肽组件不同。在一些实施方式中,切割调节结构域一的可切割的肽组件的蛋白酶与切割调节结构域二的蛋白酶可切割的肽组件的蛋白酶相同。在一些实施方式中,切割调节结构域一的可切割的肽组件的蛋白酶与切割调节结构域二的蛋白酶可切割的肽组件的蛋白酶不相同。
[0218]
在一些实施方式中,切割第一和第二子调节结构域的蛋白酶是mmp蛋白酶。在一些实施方式中,切割第一和第二子调节结构域的蛋白酶是upa蛋白酶。在一些实施方式中,切割第一和第二子调节结构域的蛋白酶是蛋白裂解酶蛋白酶。在一些实施方式中,第一或第二子调节结构域之一被mmp蛋白酶切割,而另一个调节结构域被非mmp蛋白酶切割。在一些实施方式中,第一或第二子调节结构域之一被mmp蛋白酶切割,而另一个调节结构域被upa蛋白酶切割。在一些实施方式中,第一或第二子调节结构域之一被mmp蛋白酶切割,而另一个调节结构域被蛋白裂解酶蛋白酶切割。在一些实施方式中,第一或第二子调节结构域之一被一个mmp蛋白酶切割,而另一个调节结构域被另一mmp蛋白酶切割。
[0219]
稳定的接头或蛋白酶不可切割的接头是指不属于已知蛋白酶底物序列的接头肽序列,因此在与蛋白酶一起温育时不会导致显著的切割产物形成。
[0220]
在一些实施方式中,接头的切割底物(或切割序列)可包括可用作蛋白酶(通常为细胞外蛋白酶)的底物的氨基酸序列。在其他实施方式中,切割序列包含能够形成二硫键的半胱氨酸
‑
半胱氨酸对,其可以通过还原剂的作用被切割。在其他实施方式中,切割序列包含能够在光解时被切割的底物。
[0221]
切割底物位于蛋白酶可切割结构域内,使得当切割底物被切割剂(例如,接头的切割底物被蛋白酶切割和/或半胱氨酸
‑
半胱氨酸二硫键通过暴露于还原剂经由还原被破坏)或被光诱导的光解切割时,在靶标存在下,产生具有如本文所述的多种功能性质的切割产物。在一些实施方式中,切割产物具有减少的半衰期。在一些实施方式中,切割产物具有活化t细胞的能力(图3a
‑
3b)。
[0222]
切割结构域的切割底物可以基于共定位于患病组织中或表达融合部分的结合结构域的感兴趣靶抗原的细胞表面上的蛋白酶进行选择。已知多种不同条件,其中感兴趣靶
标与蛋白酶共定位,其中蛋白酶的底物是本领域已知的。在癌症的实例中,靶组织可以是癌组织,具体是实体瘤的癌组织。文献中报道了在许多癌症(例如实体瘤)中具有已知底物的蛋白酶的提高的水平。参见,例如,[la rocca et al,(2004)british j.of cancer 90(7):1414
‑
1421.radisky es,front biosci(landmark ed).2015 jun 1;20:1144
‑
63;miao c,et al.,oncotarget.2017 may9;8(19):32309
‑
32321]。疾病的非限制性实例包括:所有类型的癌症(乳腺癌、肺癌、结肠直肠癌、前列腺癌、头颈癌、胰腺癌等)、类风湿性关节炎、克罗恩病、黑素瘤、sle、心血管损伤、局部缺血等。此外,抗
‑
血管生成靶标,例如vegf,是已知的。
[0223]
在一些实施方式中,当选择第一或第二结合结构域的taa使得其能够结合肿瘤抗原时,用于接头的合适的切割底物序列将是包含蛋白酶可切割的肽底物的切割底物序列,该蛋白酶存在于癌症治疗位点,即肿瘤微环境,与非癌组织相比,其具体以升高的水平在癌症治疗位点处存在。
[0224]
在一些实施方式中,本文公开的前体构建体的第一或第二、或第一和第二结合结构域两者可以结合taa,例如egfr,并且切割底物序列可以是基质金属蛋白酶(mmp)底物,因此是可通过mmp切割的。在其他实施方式中,taa包含ror1并且切割底物序列可以是蛋白裂解酶(mt
‑
sp1、tadg
‑
15、epithin、st14)底物,因此可被蛋白裂解酶切割。在其他实施方式中,前体构建体的第一或第二、或第一和第二结合结构域可以结合感兴趣靶标,并且可切割结构域中存在的切割底物可以是例如天冬酰胺内肽酶、纤维蛋白溶酶、tmprss
‑
3/4、mmp
‑
9、mt1
‑
mmp、组织蛋白酶、胱天蛋白酶、人中性粒细胞弹性蛋白酶、β
‑
分泌酶、upa或psa。在其他实施方式中,在癌症以外的疾病例如多发性硬化或类风湿性关节炎中,切割结构域被其他疾病特异性蛋白酶切割。
[0225]
在一些实施方式中,前体三特异性抗体构建体可以通过第一或第二、或第一和第二结合结构域两者结合taa,其中调节臂的可切割结构域保持未切割,并因此由于cap组件的存在,前体构建体或部分切割的前体构建体的第三结合结构域可能对靶cd3ε抗原特异性地不可用。在一些实施方式中,前体三特异性抗体构建体可以通过第一或第二、或第一和第二结合结构域两者结合taa,其中调节臂的可切割结构域保持未切割,其中由于半衰期延长结构域(例如hsa多肽序列),前体构建体或部分切割的前体构建体具有增强的半衰期,并且第三结合结构域对靶cd3ε抗原可用或部分可用。在一些实施方式中,前体三特异性抗体构建体可以通过第一或第二、或第一和第二结合结构域两者结合taa,其中两个调节臂的可切割结构域保持未切割,其中有由于半衰期延长结构域(例如,hsa多肽序列),前体构建体具有增强的半衰期,并且由于cap组件的存在,第三结合结构域对于靶cd3ε抗原保持特异性不可用。
[0226]
在一些实施方式中,前体三特异性抗体构建体的任何组件部分之间存在接头(l)(图1和2a
‑
2d)。在一些实施方式中,前体构建体的接头(例如,fab的vl和vh与调节结构域之间的接头)包含可切割结构域接头。在一些实施方式中,对于每个接头,独立地选择被切割的能力。在一些实施方式中,对于每个接头,独立地选择被蛋白酶切割的能力。在一些实施方式中,接头可被蛋白酶切割。在一些实施方式中,接头不可被蛋白酶切割。在一些实施方式中,fab的ch1或cl与第一结合结构域的scfv之间的接头包含不可切割的接头。在一些实施方式中,fab的ch1或cl与第二结合结构域的scfv之间的接头包含不可切割的接头。
[0227]
技术人员会理解,在一些实施方式中,接头包含两个活性组件之间或活性组件的
两个区之间的间隔区。
[0228]
技术人员会理解,可切割结构域包含含有酶切割位点的线性氨基酸序列,并且在某些实施方式中可称为“可切割的接头”或“接头”或“可切割的肽”或“cp”,其中本文公开的接头可以是可切割的或不可切割的。
[0229]
在一些实施方式中,接头存在于fab片段的恒定重链(ch1)的c
‑
端。在一些实施方式中,接头存在于fab片段的恒定轻链(cl)的c
‑
端。在一些实施方式中,ch1的c
‑
端接头是可切割的。在一些实施方式中,ch1的c
‑
端接头是不可切割的。在一些实施方式中,cl的c
‑
端接头是可切割的。在一些实施方式中,cl的c
‑
端接头是不可切割的。
[0230]
在一些实施方式中,接头是单个氨基酸。在一些实施方式中,可切割的接头包含在seq id no:9
‑
32任一个中叙述的氨基酸序列。在一些实施方式中,可切割的接头由seq id no:33中叙述的核酸序列编码。在一些实施方式中,可切割的接头由seq id no:35中叙述的核酸序列编码。
[0231]
在一些实施方式中,不可切割的接头包含在seq id no:162中叙述的氨基酸序列。在一些实施方式中,不可切割的接头由seq id no:163中叙述的核酸序列编码。
[0232]
对于酶蛋白酶的特异性切割,在酶和切割底物之间进行接触。当包含结合taa的第一和第二结合结构域、结合cd3ε的细胞外表位的第三结合结构域和包含可切割的接头的两个调节结构域的前体构建体存在足够的酶活性时,可切割结构域可以被切割。足够的酶活性可以指酶与具有切割位点的蛋白酶可切割结构域接触并实现切割的能力。在一些实施方式中,酶可能在前体构建体附近但由于其他细胞因素或酶的蛋白质修饰而不能切割。
[0233]
在一些实施方式中,可切割结构域底物可包括但不限于可被一种或多种以下酶或蛋白酶切割的底物:adam10;胱天蛋白酶8、组织蛋白酶、mmp 8、adam12、胱天蛋白酶9、fap、mmp 9、adam17、胱天蛋白酶10、颗粒酶b、mmp 13、adamts、胱天蛋白酶11、胍基苯甲酸酶(guanidinobenzotase)(gb)、mmp 14、adamts5、胱天蛋白酶12、hepsin、mt
‑
sp1、bace、胱天蛋白酶13、人中性粒细胞弹性蛋白酶脑啡肽酶(hne)、胱天蛋白酶、胱天蛋白酶14、天冬酰胺内肽酶、ns3/4a、胱天蛋白酶1、组织蛋白酶、蛋白裂解酶2、纤维蛋白溶酶、胱天蛋白酶2、组织蛋白酶a、穿膜肽酶、psa、胱天蛋白酶3、组织蛋白酶b、mmp 1、psma、胱天蛋白酶4、组织蛋白酶d、mmp 2、tace、胱天蛋白酶5、组织蛋白酶e、mmp 3、tmprss 3/4、胱天蛋白酶6、组织蛋白酶k、mmp 7、upa、胱天蛋白酶7、蛋白裂解酶(mt
‑
sp1、tadg
‑
15、epithin、st14)和mt1
‑
mmp。
[0234]
在另一个实施方式中,切割底物可涉及半胱氨酸对的二硫键,因此其可被还原剂切割,例如但不限于细胞还原剂,例如谷胱甘肽(gsh)、硫氧还蛋白、nadph、黄素、抗坏血酸等,它们可以大量存在于实体瘤的组织中或实体瘤周围。
[0235]
用于本文的可切割的接头的其他合适的蛋白酶切割位点是本领域已知的,或者可以使用例如由turk等人,2001nature biotechnology 19,661
‑
667描述的方法来标识。
[0236]
在一些实施方式中,前体三特异性抗体构建体的第一结合结构域、第二结合结构域和第三结合结构域都可以结合它们各自的人和非黑猩猩灵长类动物靶分子。因此,第一结合结构域和/或第二结合结构域结合人细胞表面肿瘤相关抗原(taa)和非黑猩猩灵长类动物中细胞表面taa的相应同源物。非黑猩猩灵长类动物中人细胞表面taa同源物的标识和确定是本领域技术人员众所周知的,并且可以例如在通过序列比对执行。第三结合结构域可以结合包含人cd3ε的细胞外表位的抗原,并且可以结合非黑猩猩灵长类动物中cd3ε的相
应同源物。在一些实施方式中,第一或第二或第三结合结构域,或其任何组合,也结合它们各自的黑猩猩靶分子。
[0237]
技术人员会理解,在一些实施方式中,细胞表面肿瘤相关抗原(taa)包括展示在细胞表面上的分子。在一些实施方式中,细胞是肿瘤细胞。在一些实施方式中,细胞是存在于肿瘤环境中的非肿瘤细胞,例如但不限于存在于与肿瘤或癌症相关的脉管系统组织内的细胞。
[0238]
技术人员会理解,术语“抗原”或“免疫原”包括具有免疫原性的肽、蛋白质、多肽。在一些实施方式中,抗原能够在哺乳动物中引发免疫应答,因此含有至少一个并且可以含有多个表位。“抗原”分子或分子的部分能够被选择性结合剂结合,例如fab片段的抗原结合部分或scfv片段的抗原结合部分。此外,“抗原”能够用于动物以产生能够结合该抗原的表位的抗体。在一些实施方式中,cap组件包含第二结合结构域结合的抗原的部分。
[0239]
在某些实施方式中,术语“表位”包括能够特异性结合taa或免疫球蛋白或t细胞受体的任何决定簇。表位是被抗体或其抗原结合片段结合的抗原区。在一些实施方式中,cap组件包含第三结合结构域结合的表位。
[0240]
在某些实施方式中,表位决定簇包括分子的化学活性表面分组,例如氨基酸、糖侧链、磷酰基或磺酰基,并且在某些实施方式中可以具有特异性三维结构特征和/或特异性电荷特征。在某些实施方式中,当前体三特异性抗体构建体优先识别蛋白质和/或大分子的复杂混合物中的靶抗原时,该前体三特异性抗体构建体被称为特异性结合抗原。当平衡解离常数≤10
‑5、10
‑6或10
‑7m时,前体三特异性抗体构建体被称为特异性结合抗原。在一些实施方式中,平衡解离常数可以≤10
‑8m或10
‑9m。在一些进一步的实施方式中,平衡解离常数可以≤10
‑
10
m或10
‑
11
m。本文公开的抗原包括但不限于taa、cap组件和免疫效应物分子,例如人cd3ε多肽。
[0241]
在一些实施方式中,肿瘤相关抗原(taa)是肿瘤抗原。在一些实施方式中,肿瘤抗原包含在肿瘤细胞上呈递的那些抗原。在一些实施方式中,肿瘤抗原存在于实体瘤细胞上。在一些实施方式中,肿瘤抗原是存在于非实体瘤细胞上的癌抗原。
[0242]
在一些实施方式中,当taa是肿瘤细胞抗原时,肿瘤细胞包括来自实体瘤的细胞。实体瘤可能是良性的(不是癌症),也可能是恶性的(癌症)。不同类型的实体瘤以形成它们的细胞类型命名。实体瘤的实例是肉瘤、癌和淋巴瘤。在一些实施方式中,实体瘤是由除血液、骨髓或淋巴细胞之外的身体组织细胞的异常生长形成的赘生物(细胞的新生长)或病变(解剖结构的损伤或生理功能的紊乱)。在一些实施方式中,实体瘤由异常的细胞群组成,这些细胞群可能源自不同的组织类型,例如肝脏、结肠、乳腺或肺,并且最初在其细胞来源的器官中生长。然而,这些癌症可能会通过疾病晚期的转移性肿瘤生长扩散到其他器官。
[0243]
在一些实施方式中,实体瘤包括肉瘤或癌、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文肉瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌或肿瘤、乳腺癌或肿瘤、卵巢癌或肿瘤、前列腺癌或肿瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯肿瘤、子宫颈癌或肿瘤、子宫癌或肿瘤、睾丸癌或肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管
细胞瘤、听神经瘤、少突神经胶质瘤、神经鞘瘤、脑膜瘤、黑素瘤、成神经细胞瘤或视网膜母细胞瘤。在一些实施方式中,实体瘤包括肾上腺皮质肿瘤(腺瘤和癌)、癌、结肠直肠癌、硬纤维瘤、促纤维增生性小圆细胞肿瘤、内分泌肿瘤、尤文肉瘤、生殖细胞肿瘤、肝母细胞瘤、肝细胞癌、黑素瘤、成神经细胞瘤、骨肉瘤、视网膜母细胞瘤、横纹肌肉瘤、除横纹肌肉瘤以外的软组织肉瘤和维尔姆斯肿瘤。在一些实施方式中,实体瘤是乳腺肿瘤。在另一个实施方式中,实体瘤是前列腺癌。在另一个实施方式中,实体瘤是结肠癌。在一些实施方式中,肿瘤是脑肿瘤。在另一个实施方式中,肿瘤是胰腺肿瘤。在另一个实施方式中,肿瘤是结肠直肠肿瘤。
[0244]
在一些实施方式中,肿瘤细胞包括来自非实体瘤,即非实体癌的细胞。在一些实施方式中,癌症可以是弥漫性癌症,其中癌症广泛扩散;不局限或受限制。在一些实施方式中,弥漫性癌症可包括非实体瘤。弥漫性癌症的实例包括白血病。白血病包括从造血组织(例如骨髓)开始并导致大量异常血细胞产生并进入血液的癌症。
[0245]
在一些实施方式中,弥漫性癌症包括b细胞恶性肿瘤。在一些实施方式中,弥漫性癌症包括白血病。在一些实施方式中,癌症是淋巴瘤。在一些实施方式中,淋巴瘤是大b细胞淋巴瘤。
[0246]
在一些实施方式中,弥漫性癌症或肿瘤包括血液肿瘤。在一些实施方式中,血液肿瘤是影响血液、骨髓和淋巴结的癌症类型。血液肿瘤可能源自两种主要血细胞谱系中的任一种:髓样和淋巴样细胞系。髓样细胞系通常产生粒细胞、红细胞、血小板、巨噬细胞和肥大细胞,而淋巴样细胞系产生b、t和浆细胞。淋巴瘤(例如霍奇金淋巴瘤)、淋巴细胞白血病和骨髓瘤源自淋巴系,而急性和慢性髓性白血病(aml、cml)、骨髓增生异常综合征和骨髓增生性疾病是骨髓来源的。
[0247]
在一些实施方式中,非实体(弥漫性)癌症或肿瘤包括造血系统恶性肿瘤、血细胞癌、白血病、骨髓增生异常综合征、淋巴瘤、多发性骨髓瘤(浆细胞骨髓瘤)、急性淋巴细胞白血病、急性髓性白血病、慢性髓性白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤或浆细胞白血病。
[0248]
在一些实施方式中,肿瘤或癌症包含肿瘤或癌症的转移。
[0249]
在一些实施方式中,细胞表面taa位于细胞的质膜中或质膜上,使得该分子的至少一部分保持从细胞外部以三级形式可接近。在一些实施方式中,位于质膜中的细胞表面taa是跨膜蛋白,在其三级构象中包含亲水性区和疏水性区。
[0250]
这些抗原可以与细胞外部分一起在细胞表面上呈递,该细胞外部分通常与分子的跨膜和细胞质部分组合。这些抗原有时只能由肿瘤细胞呈递,而从不由正常细胞呈递。肿瘤抗原可以专门在肿瘤细胞上表达,也可以代表与正常细胞相比的肿瘤特异性突变。在这种情况下,它们被称为肿瘤特异性抗原。更常见的是由肿瘤细胞和正常细胞呈递的抗原。在一些实施方式中,taa包括专门在肿瘤细胞上表达的抗原。在一些实施方式中,taa包括在肿瘤细胞和正常细胞两者上表达的抗原。
[0251]
在一些实施方式中,与正常细胞相比,taa可以在肿瘤细胞上过表达,或者由于与正常组织相比肿瘤组织的结构不太紧密,taa可易于在肿瘤细胞中抗体结合。
[0252]
在一些实施方式中,结合细胞表面taa的第一结合结构域或第二结合结构域或两者包含结合人taa的氨基酸序列。在一些实施方式中,抗scfv包括重链可变区和轻链可变区,其中每个区进一步包括互补决定区(cdr)。在一些实施方式中,结合细胞表面taa的第一
结合结构域或第二结合结构域或两者包含在scfv可变轻链(vh)区和scfv可变重链(vh)区之间的接头。在一些实施方式中,结合细胞表面taa的第一结合结构域或第二结合结构域包含scfv片段与第三结合结构域的cl区的c端之间的接头。在一些实施方式中,结合细胞表面taa的第一结合结构域或第二结合结构域包含scfv片段与第三结合结构域的ch1区的c端之间的接头。在一些实施方式中,结合细胞表面taa的第一结合结构域包含scfv片段与第三结合结构域的ch1区的c
‑
端之间的接头,并且结合细胞表面taa的第二结合结构域包含scfv片段和第三结合结构域的cl区的c
‑
端之间的接头。在一些实施方式中,结合细胞表面taa的第一结合结构域包含在scfv片段与第三结合结构域的cl区的c
‑
端之间的接头,并且结合细胞表面taa的第二结合结构域包含在scfv片段和第三结合结构域的ch1区的c
‑
端之间的接头。
[0253]
图2a
‑
2f显示实施方式,其中taa是egfr(第一和第二结合结构域包含抗egfr scfv)。技术人员会理解,在其他实施方式中,taa可以是本领域已知的taa,例如但不限于包含以下的taa:fcγri、fcγriia、fcγriib、fcγriiib、cd28、cd137、ctla
‑
4、fas、成纤维细胞生长因子受体1(fgfr1)、fgfr2、fgfr3、fgfr4、糖皮质激素诱导的tnfr相关(gitr)蛋白、淋巴毒素
‑
β受体(ltβr)、toll样受体(tlr)、肿瘤坏死因子相关凋亡诱导配体
‑
受体1(trail受体1)和trail受体2、前列腺特异性膜抗原(psma)蛋白、前列腺干细胞抗原(psca)蛋白、肿瘤相关蛋白碳酸酐酶ix(caix)、表皮生长因子受体1(egfr1)、egfrviii、人表皮生长因子受体2(her2/neu;erb2)、erbb3(也称为her3)、叶酸受体、肝配蛋白受体、pdgfra、erbb
‑
2、cd20、cd22、cd30、cd33、cd40、cd37、cd38、cd70、cd74、cd40)、cd80、cd86、cd2、p53、cmet(也称为酪氨酸蛋白激酶met或肝细胞生长因子受体(hgfr))、mage
‑
a1、mage
‑
a2、mage
‑
a3、mage
‑
a4、mage
‑
a6、mage
‑
a10、mage
‑
a12、bage、dam
‑
6、dam
‑
10、gage
‑
1、gage
‑
2、gage
‑
8、gage
‑
3、gage
‑
4、gage
‑
5、gage
‑
6、gage
‑
7b、na88
‑
a、ny
‑
eso
‑
1、brca1、brca2、mart
‑
1、mc1r、gp100、psa、psm、psma、酪氨酸酶、维尔姆斯肿瘤抗原(wt1)、trp
‑
1、trp
‑
2、art
‑
4、camel、cyp
‑
b、htert、htrt、ice、muc1、muc2、p
‑
钙粘蛋白、肌肉生长抑制素(gdf8)、cripto(tdgf1)、muc5ac、prame、p15、ru1、ru2、sart
‑
1、sart
‑
3、wt1、afp、β
‑
联蛋白/m、胱天蛋白酶
‑
8/m、cdk
‑
4/m、elf2m、gnt
‑
v、g250、hsp70
‑
2m、hst
‑
2、kiaa0205、mum
‑
1、mum
‑
2、mum
‑
3、肌球蛋白/m、rage、sart
‑
2、trp
‑
2/int2、707
‑
ap、膜联蛋白ii、cdc27/m、tpi/mbcr
‑
abl、etv6/aml、ldlr/fut、pml/rarα、tel/aml1、cd28、cd137、canag、间皮素、dr5、pd
‑
1、pd1l、igf
‑
1r、cxcr4、神经毡蛋白1、磷脂酰肌醇蛋白聚糖、epha2、cd138、b7
‑
h3、b7
‑
h4、gpa33、gpc3、sstr2、ror1、5t4或vegf
‑
r2。在一些实施方式中,taa包括psma、cd30、b7
‑
h3、b7
‑
h4、gpa33、her2、p
‑
钙粘蛋白、gp100、dr5、gpc3、sstr2、间皮素、ror1、5t4、叶酸受体或egfr。在一些实施方式中,taa包含egfr。在一些实施方式中,taa包含ror1。在一些实施方式中,taa包含psma。在一些实施方式中,taa包含5t4。
[0254]
可以设计三特异性抗体以结合至少一种肿瘤相关抗原(taa),在一些实施方式中其包含肿瘤细胞表面抗原、t细胞抗原和第二taa,目的是抗体结合和杀死肿瘤细胞(比正常细胞更有选择性),并最终提高单特异性试剂的功效和安全性,其中三特异性抗体包含结合至少一种细胞表面肿瘤相关抗原(taa)的结合结构域、结合第二taa的结合结构域和结合t细胞的细胞外表位的结合结构域。然而,这种三特异性抗体不能调节结合顺序,因此可能在结合taa之前或不存在结合taa时结合t细胞,其中由活化的t细胞提供的细胞毒性实际上可能通过非特异性导致非肿瘤细胞死亡而导致有害的副作用。在一些实施方式中,taa包含人
抗原。
[0255]
在一些实施方式中,tme抗原包含kir、lilr或tigit抗原。
[0256]
在一些实施方式中,结合细胞表面taa的第一结合结构域或第二结合结构域或两者结合多肽靶标,其在一些实施方式中与一种或多种具体癌症或疾病状况相关,例如但不限于包含以下的taa:fcγri、fcγriia、fcγriib、fcγriiib、cd28、cd137、ctla
‑
4、fas、成纤维细胞生长因子受体1(fgfr1)、fgfr2、fgfr3、fgfr4、糖皮质激素诱导的tnfr相关(gitr)蛋白、淋巴毒素
‑
β受体(ltβr)、toll样受体(tlr)、肿瘤坏死因子相关凋亡诱导配体
‑
受体1(trail受体1;多种恶性肿瘤,包括卵巢癌和结肠直肠癌)和trail受体2、前列腺特异性膜抗原(psma;前列腺癌)蛋白、前列腺干细胞抗原(psca)蛋白(前列腺腺癌)、ca125(多种癌症,包括卵巢癌)、肿瘤相关蛋白碳酸酐酶ix(caix;多种癌症,包括肾细胞癌)、表皮生长因子受体1(egfr1;上皮恶性肿瘤)、egfr(非小细胞肺癌、上皮卵巢癌、结肠直肠癌、头颈癌、乳腺癌、肺癌、食道癌)、egfrviii、人表皮生长因子受体2(her2/neu;erb2;上皮恶性肿瘤)、erbb3(也称为her3(上皮恶性肿瘤))、叶酸受体、肝配蛋白受体、pdgfra(上皮恶性肿瘤)、erbb
‑
2、cd20(b细胞,自身免疫性、过敏性或恶性)、cd22(b细胞,自身免疫性或恶性)、cd30(b细胞恶性肿瘤)、cd33(髓样恶性肿瘤)、cd40、cd37、cd38、cd70(b细胞,自身免疫性、过敏性或恶性)、cd74(b细胞,自身免疫性、过敏性或恶性)、cd40(b细胞,自身免疫性、过敏性或恶性);cd80(b细胞,自身免疫性、过敏性或恶性)、cd86(b细胞,自身免疫性、过敏性或恶性)、cd2(t细胞)、p53、cmet(也称为酪氨酸蛋白激酶met或肝细胞生长因子受体(hgfr;胃肠道和肝脏恶性肿瘤))、mage
‑
a1、mage
‑
a2、mage
‑
a3、mage
‑
a4、mage
‑
a6、mage
‑
a10、mage
‑
a12、bage、dam
‑
6、dam
‑
10、gage
‑
1、gage
‑
2、gage
‑
8、gage
‑
3、gage
‑
4、gage
‑
5、gage
‑
6、gage
‑
7b、na88
‑
a、ny
‑
eso
‑
1、brca1、brca2、mart
‑
1、mc1r、gp100、psa、psm、酪氨酸酶、维尔姆斯肿瘤抗原(wt1)、trp
‑
1、trp
‑
2、art
‑
4、camel、cyp
‑
b、htert、htrt、ice、muc1(上皮恶性肿瘤)、muc2、p
‑
钙粘蛋白(上皮恶性肿瘤,包括乳腺癌)、肌生长抑制素(gdf8)(多种肿瘤,包括肉瘤、卵巢癌和胰腺癌)、cripto(tdgf1)(上皮恶性肿瘤,包括结肠癌、乳腺癌、肺癌、卵巢癌和胰腺癌)、acvrl1/alk1(多种恶性肿瘤,包括白血病和淋巴瘤)、muc5ac(上皮恶性肿瘤,包括乳腺腺癌)、prame、p15、ru1、ru2、sart
‑
1、sart
‑
3、wt1、afp、β
‑
联蛋白/m、胱天蛋白酶
‑
8/m、cdk
‑
4/m、elf2m、gnt
‑
v、g250、hsp70
‑
2m、hst
‑
2、kiaa0205、mum
‑
1、mum
‑
2、mum
‑
3、肌球蛋白/m、rage、sart
‑
2、trp
‑
2/int2、707
‑
ap、膜联蛋白ii、cdc27/m、tpi/mbcr
‑
abl、etv6/aml、ldlr/fut、pml/rarα、tel/aml1、cd28、cd137(b细胞或t细胞,自身免疫性、过敏性或恶性)、canag(肿瘤,例如结肠癌和胰腺癌)、间皮素(许多肿瘤,包括间皮瘤和卵巢和胰腺癌)、dr5(多种恶性肿瘤,包括卵巢癌和结肠直肠癌)、pd
‑
1(b细胞,自身免疫性、过敏性或恶性)、pd1l(多种恶性肿瘤,包括上皮腺癌)、igf
‑
1r(大多数恶性肿瘤,包括上皮腺癌)、cxcr4(b细胞或t细胞、自身免疫性、过敏性或恶性)、神经毡蛋白1(上皮恶性肿瘤,包括肺癌)、磷脂酰肌醇蛋白聚糖(多种癌症,包括肝癌、脑癌和乳腺癌)、epha2(多种癌症,包括成神经细胞瘤、黑素瘤、乳腺癌和小细胞肺癌)、cd138(骨髓瘤)、b7
‑
h3(csc、基质、nsclc、膀胱肿瘤、间皮瘤、黑素瘤)、gpa33(结肠直肠癌)、gpc3(肝癌、肺癌、食管癌、胃癌、头颈癌)、sstr2(神经内分泌肿瘤、gist)、ror1(血液癌、胰腺癌、卵巢癌、肾细胞癌、nsclc和三阴性乳腺癌)、5t4(间皮瘤、胃癌、卵巢癌、肾癌、nsclc中的癌症干细胞、头颈癌)或vegf
‑
r2(与包括上皮腺癌在内的大多数恶性肿瘤相关的脉管系统)。有害的靶细胞或与所呈递的taa相关的癌细胞的实例包括
在括号中的斜体中。
[0257]
在一些实施方式中,taa选自egfr、ror1、psma和5t4。在一些实施方式中,第一结合结构域包含结合人egfr(抗
‑
hegfr)、或人ror1(抗
‑
ror1)、或人psma(抗
‑
psma)或人5t4(抗
‑
5t4)的scfv。
[0258]
在一些实施方式中,taa是egfr。在一些实施方式中,第一结合结构域包含结合人egfr的scfv(抗hegfr)。在一些实施方式中,抗hegfr
‑
scfv轻链可变区(vl)的氨基酸序列在seq id no:34中叙述。在一些实施方式中,抗hegfr scfv vl序列包含seq id no:34的同源物。
[0259]
在一些实施方式中,抗hegfr
‑
scfv轻链可变区(vl)由seq id no:36中叙述的核酸序列编码。在一些实施方式中,抗hegfr
‑
scfv轻链可变区(vl)由seq id no:36中叙述的核酸序列的同源物编码。
[0260]
在一些实施方式中,抗hegfr
‑
scfv重链可变区(vh)的氨基酸序列在seq id no:37中叙述。在一些实施方式中,抗hegfr scfv vh序列包含seq id no:37的同源物。
[0261]
在一些实施方式中,抗hegfr
‑
scfv重链可变区(vh)由seq id no:38中叙述的核酸序列编码。在一些实施方式中,抗hegfr
‑
scfv重链可变区(vh1)由seq id no:38中叙述的核酸序列的同源物编码。
[0262]
在一些实施方式中,抗egfr scfv包含vl和vh区之间的接头。在一些实施方式中,vl和vh区之间的接头包括本文公开的任何接头。在一些实施方式中,抗egfr scfv的vl和vh区之间的接头的氨基酸序列由seq id no:39叙述。在一些实施方式中,抗
‑
egfr scfv的vl和vh区之间的接头包含seq id no:39的同源物。在一些实施方式中,抗egfr scfv的vl和vh区之间的接头由seq id no:40中叙述的核酸序列编码。在一些实施方式中,抗egfr scfv的vl和vh区之间的接头由seq id no:40中叙述的核酸序列的同源物编码。
[0263]
在一些实施方式中,抗egfr scfv的组件包含vl
‑
接头
‑
vh顺序(n
‑
端至c
‑
端)(图8a和9a)。在一些实施方式中,抗
‑
egfr scfv的组件包含vh
‑
接头
‑
vl顺序(n
‑
端到c
‑
端)(图8b和9b)。
[0264]
在一些实施方式中,包括接头序列的抗egfr scfv序列包含序列seq id no:41。在一些实施方式中,包括接头序列的抗egfr scfv包含seq id no:41的同源物。
[0265]
在一些实施方式中,包括接头序列的抗egfr scfv序列包含序列seq id no:42。在一些实施方式中,包括接头序列的抗egfr scfv包含seq id no:42的同源物。
[0266]
在一些实施方式中,抗
‑
hror1
‑
scfv、或抗
‑
psma
‑
scfv、或抗
‑
5t4
‑
scfv轻链可变区的氨基酸序列在下表1中叙述:
[0267]
表1:编码抗
‑
hror1
‑
scfv、或抗
‑
psma
‑
scfv、或抗
‑
5t4
‑
scfv的氨基酸序列和优化的核苷酸序列
[0268]
抗原结合(抗
‑
抗原)seq id no:ror1(vl
‑
vh)156ror1(vl
‑
vh)157ror1(vh
‑
vl)166ror1(vh
‑
vl)167psma(vl
‑
vh)168
psma(vl
‑
vh)169psma(vh
‑
vl)170psma(vh
‑
vl)1715t4(vl
‑
vh)1725t4(vl
‑
vh)1735t4(vh
‑
vl)1745t4(vh
‑
vl)175
[0269]
在一些实施方式中,同源物包含与抗egfr scfv的氨基酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽。在一些实施方式中,同源物包含与抗egfr scfv、或任何抗ror1 scfv、或抗psma scfv、或抗5t4scfv的氨基酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的多肽。
[0270]
在一些实施方式中,编码包含接头序列的抗egfr scfv的核苷酸序列包含序列seq id no:43。在一些实施方式中,包含接头序列的抗egfr scfv包含seq id no:43的同源物。
[0271]
在一些实施方式中,编码包含接头序列的抗egfr scfv的核苷酸序列包含序列seq id no:44。在一些实施方式中,包含接头序列的抗egfr scfv包含seq id no:44的同源物。
[0272]
在一些实施方式中,同源物包含与抗egfr scfv的核酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽。在一些实施方式中,同源物包含与抗egfr scfv或任何抗ror1 scfv、或抗psma scfv、或抗5t4scfv的核酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的核苷酸。
[0273]
在一些实施方式中,本文分别公开了抗hegfr scfv vl(seq id no:34或seq id no:35)或抗hegfr scfv vh(seq id no:37)或抗hegfr scfv(seq id no:41)或抗hegfr scfv(seq id no:42)的同源物,入使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。在一些实施方式中,本文分别公开了编码抗hegfr scfv vl(seq id no:36)或抗hegfr scfv vh(seq id no:38)或抗hegfr scfv(seq id no:43)或抗hegfr scfv(seq id no:44)的核苷酸序列的同源物,入使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。
[0274]
在一些实施方式中,本文公开了抗hror1 scfv vl
‑
vh(seq id no:156)或抗hror1 scfv vh
‑
vl(seq id no:169)的同源物,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。在一些实施方式中,本文公开了编码抗
‑
hror1 scfv vl
‑
vh(seq id no:157)或抗
‑
hror1 scfv vh
‑
vl(seq id no:167)的核苷酸序列的同源物,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。
[0275]
在一些实施方式中,本文公开了抗hpsma scfv vl
‑
vh(seq id no:168)或抗hpsma scfv vh
‑
vl(seq id no:170)的同源物,如使用国家生物技术信息中心(ncbi)的blastp软
件使用默认参数确定的。在一些实施方式中,本文公开了编码抗
‑
hpsma scfv vl
‑
vh(seq id no:169)或抗
‑
hpsma scfv vh
‑
vl(seq id no:171)的核苷酸序列的同源物,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。
[0276]
在一些实施方式中,本文公开了抗h5t4scfv vl
‑
vh(seq id no:172)或抗h5t4 scfv vh
‑
vl(seq id no:174)的同源物,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。在一些实施方式中,本文公开了编码抗h5t4scfv vl
‑
vh(seq id no:173)或抗h5t4 scfv vh
‑
vl(seq id no:174)的核苷酸序列的同源物,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。
[0277]
在一些实施方式中,同源性还包括其及其生物活性多肽片段的缺失、插入或取代变体,包括氨基酸取代。在一个实施方式中,变体包含保守取代、或缺失、插入或取代——其不显著改变感兴趣多肽的三维结构,例如第一结合结构域的vl或vh区,具体是在cdr表位结合区的区域中。在一些实施方式中,缺失、插入或取代不改变存在于前体构建体的第一和第二结合结构域或第一和第二结合结构域两者中的抗hegfr vl或抗hegfr vh或抗egfr scfv的感兴趣的功能,其在一些实施方式中结合靶肿瘤细胞上的egfr。在一些实施方式中,缺失、插入或取代不改变存在于前体构建体的第一或第二结合结构域或第一和第二结合结构域两者中的抗ror1 scfv、或抗psma、或抗5t4scfv的感兴趣功能,其在一些实施方式中分别结合靶肿瘤细胞上的ror1、psma或5t4。
[0278]
在一些实施方式中,结合细胞表面肿瘤相关抗原的第一或第二结合结构域或第一和第二结合结构域两者包括seq id no:34中叙述的序列或其同源物。在一些实施方式中,结合细胞表面肿瘤相关抗原的第一或第二结合结构域或第一和第二结合结构域两者包括seq id no:37中叙述的序列或其同源物。
[0279]
在一些实施方式中,结合细胞表面肿瘤相关抗原的第一或第二结合结构域或第一和第二结合结构域包括seq id no:34、37、156、166、168、170、172或174的任一中叙述的序列或其同源物。
[0280]
在一些实施方式中,结合细胞表面肿瘤相关抗原的第一或第二结合结构域或第一和第二结合结构域包括seq id no:41中叙述的序列或其同源物。在一些实施方式中,结合细胞表面肿瘤相关抗原的第一或第二结合结构域或第一和第二结合结构域包括seq id no:42中叙述的序列或其同源物。
[0281]
在一些实施方式中,结合细胞表面肿瘤相关抗原的第一或第二结合结构域或第一和第二结合结构域两者由包括seq id no:36、38、157、167、169、171、173或175中任一项叙述的序列的核苷酸序列或其同源物编码。
[0282]
在一些实施方式中,结合细胞表面肿瘤相关抗原的第一或第二结合结构域或第一和第二结合结构域由包括seq id no:36中叙述的序列或其同源物,和seq id no:38中叙述的序列的核苷酸序列或其同源物编码。
[0283]
在一些实施方式中,结合细胞表面肿瘤相关抗原的第一或第二结合结构域或第一和第二结合结构域由包括seq id no:43中叙述的序列的核苷酸序列或其同源物编码。在一些实施方式中,结合细胞表面肿瘤相关抗原结合的第一或第二结合结构域或第一和第二结合结构域包括seq id no:44中叙述的序列或其同源物。
[0284]
在一些实施方式中,编码前体三特异性抗体构建体多肽的核苷酸序列针对哺乳动
物转录和翻译进行优化。在一些实施方式中,编码前体三特异性抗体构建体多肽的第一结合结构域或第二结合结构域或第一和第二结合结构域两者的核苷酸序列针对哺乳动物转录和翻译进行优化。在一些实施方式中,针对哺乳动物转录和翻译优化第一结合结构域或第二结合结构域或第一和第二结合结构域的vl或vh或vl和vh区两者的核苷酸序列。
[0285]
在另一个实施方式中,本文提供的taa是血管生成抗原,其在活化的周皮细胞和肿瘤血管生成脉管系统的周皮细胞两者上表达,后者与体内新血管形成相关。血管生成抗原是本领域已知的,参见例如wo2010/102140,其通过引用并入本文。例如,血管生成抗原可以选自:血管生成素
‑
1(ang1)、血管生成素3、血管生成素4、血管生成素6;del
‑
1;成纤维细胞生长因子:酸性(afgf)和碱性(bfgf);卵泡抑素;粒细胞集落刺激因子(g
‑
csf);肝细胞生长因子(hgf)/扩散因子(sf);白细胞介素
‑
8(il
‑
8);瘦素;中期因子(midkine);胎盘生长因子;血小板衍生内皮细胞生长因子(pd
‑
ecgf);血小板衍生生长因子
‑
bb(pdgf
‑
bb);多效生长因子(pleiotrophin)(ptn);颗粒蛋白前体(progranulin);增殖蛋白(proliferin);生存素(survivin);转化生长因子
‑
α(tgf
‑
α);转化生长因子
‑
β(tgf
‑
β);肿瘤坏死因子
‑
α(tnf
‑
α);血管内皮生长因子(vegf)/血管通透因子(vpf)。
[0286]
如上所述和全文中所述,在一些实施方式中,第一结合结构域或第二结合结构域,或第一和第二结合结构域(taa结合结构域)包含单链可变片段(scfv)。
[0287]
在一些实施方式中,第三结合结构域(cd3ε的细胞外表位结合结构域)包含fab片段。在全文中更详细地描述了前体三特异性抗体构建体的组件的具体结构顺序,例如包含在多肽a和多肽b中。
[0288]
在一些实施方式中,前体三特异性抗体构建体在其核心处包含fab片段,其在一些实施方式中包含第三结合结构域。本领域技术人员将理解,fab片段是抗体的抗原结合片段。fab由免疫球蛋白重链和免疫球蛋白轻链的一个恒定区和一个可变区组成。重链恒定(ch1)和可变(vh)区与轻链可变(vl)和恒定(cl)区异二聚化,并且通常通过重链和轻链恒定区之间的二硫键共价连接(参见例如,图1和2a
‑
2b和2f中的图,以及在图8a、9a、10a、11a、45a
‑
45b、46、47a
‑
47b和48中显示的氨基酸序列,其中表明在前体构建体的多肽a和b之间(以粗体和下划线突出显示)可以形成二硫键(cys
‑
ss
‑
cys键)的半胱氨酸残基。编码这些cys残基的密码子显示在图8b、9b、10b和11b中显示的核酸序列中(以粗体和下划线突出显示)。因此,技术人员会理解,关于抗体的术语“fab”通常包括由通过二硫键结合到单个重链的可变区和第一恒定区的单个轻链(可变区和恒定区两者)组成的抗体的部分。
[0289]
本领域技术人员将认识到,重链和轻链之间的二硫键是优选的,但对于功能不是必需的(orcutt等人(2010),peds,23:221
‑
228)。因此,在某些实施方式中,本文公开的fab片段可以不包含二硫键。在这方面,重链和轻链可以以这样的方式改造,以便在不需要二硫键的情况下稳定地相互作用。例如,在某些实施方式中,重链或轻链可以被改造以去除半胱氨酸残基,并且其中重链和轻链仍然稳定地相互作用并发挥fab的功能。在一些实施方式中,进行突变以促进重链和轻链之间的稳定相互作用。例如,“杵臼结构(knobs into hole)”改造策略可用于促进fab的重链和轻链之间的二聚化(参见例如,1996 protein engineering,9:617
‑
621)。使用这种策略,通过用较大的侧链替换相互作用结构域之间的界面处的小氨基酸侧链来创建“杵(knob)”。通过用较小的侧链替换较大的侧链,在相互作用的分子之间的界面处产生相应的“臼(hole)”。因此,还考虑在本文中使用为特定目的而
设计的变体fab片段,例如,ch1和/或cl的恒定域中的氨基酸变化,以及去除二硫键或添加用于纯化的标签。
[0290]
在一些实施方式中,fab片段内的可变区和恒定区的构型可能不同于在天然fab中发现的构型。换而言之,在一个实施方式中,可变区和恒定区的方位可以是一条链中的vh
‑
cl和另一vl
‑
ch1(shaefer等人(2011),pnas,108:111870
‑
92)。此类修饰的fab片段仍然起到结合其特异性靶抗原的功能,并且预期用于本文公开的前体构建体中。因此,就此而言,构成fab的可变区和恒定区被认为是模块化的。
[0291]
在某些实施方式中,本公开内容的fab片段衍生自单克隆抗体并且可以衍生自任何类型的抗体,包括iga、igm、igd、igg、ige及其亚型,例如iggl、igg2、igg3和igg4。轻链结构域可衍生自κ或λ链。本文使用的fab片段可以重组制备。
[0292]
如本领域公知的,抗体是免疫球蛋白分子,能够通过位于免疫球蛋白分子可变区中的至少一个表位识别位点特异性结合靶标,例如碳水化合物、多核苷酸、脂质、多肽等。技术人员会理解,术语“抗体”不仅包括完整的多克隆或单克隆抗体,还包括人源化抗体、嵌合抗体、包括缺乏fc区的抗体片段的抗体片段,以及包含抗原结合位点或所需特异性的片段(表位识别位点)的免疫球蛋白分子的任何其他修饰构型,该片段括scfv片段和fab片段。在一些实施方式中,本文所述的前体抗体构建体缺乏fc区。
[0293]
如本文公开的fab片段包含由免疫球蛋白重链可变区和免疫球蛋白轻链可变区(分别为vh和vl)组成的抗原结合部分(第三结合结构域)。类似地,上述scfv片段(第一或第二结合结构域)包含由免疫球蛋白重链可变区和免疫球蛋白轻链可变区(分别为vh和vl)组成的抗原结合部分。更具体地,如本文所用,术语“抗原结合部分”是指包含免疫球蛋白重链和/或轻链的至少一个cdr的多肽片段,其结合感兴趣靶抗原,例如第一或第二结合区的taa,或第三结合区的cd3分子。在这方面,本文所述的前体构建体的抗原结合部分可以包含结合感兴趣靶抗原的亲本抗体的vh和vl序列的1、2、3、4、5或所有6个cdr。在某些实施方式中,前体三特异性抗体构建体的scfv片段(第一或第二结合结构域,或第一和第二结合结构域两者)的抗原结合部分结合taa,例如但不限于人egfr。在某些实施方式中,前体三特异性抗体构建体的fab片段的抗原结合部分结合cd3。
[0294]
在某些实施方式中,本文所述的前体三特异性抗体构建体的特异性vh和/或vl可用于筛选互补可变区的文库以标识具有所需性质的vh/vl,例如对感兴趣靶抗原的提高的亲和力。此类方法描述于例如portolano等人,j.immunol.(1993)150:880
‑
887;clarkson等人,nature(1991)352:624
‑
628中。
[0295]
也可以使用其他方法来混合和匹配cdr以标识具有所需结合活性的fab(例如结合cd3或如本文针对前体三特异性抗体构建体中存在的其他结合结构域描述的其他感兴趣靶抗原)。例如:klimka等人,british journal of cancer(2000)83:252
‑
260,描述了使用小鼠vl和人vh文库的筛选过程,其中cdr3和fr4保留自小鼠vh。获得抗体后,针对人vl文库筛选vh以获得结合抗原的抗体。beiboer等人,j.mol.biol.(2000)296:833
‑
849描述了使用完整小鼠重链和人轻链文库的筛选过程。在获得抗体后,将一个vl与保留小鼠cdr3的人vh文库结合。获得了能够结合抗原的抗体。rader等人,pnas(1998)95:8910
‑
8915描述了类似于上述beiboer等人的过程。
[0296]
这些刚刚描述的技术本身在本领域中是已知的。然而,技术人员将能够使用此类
技术使用本领域的常规方法根据本文所述公开内容的数个实施方式获得抗体的抗原结合片段。
[0297]
本文还公开了用于获得对靶抗原(例如,cd3或本文别处针对本文所述的结合结构域的靶标的任何靶抗原)特异性的抗体抗原结合结构域的方法,方法包含通过在本文列出的vh结构域的氨基酸序列中添加、缺失、取代或插入一个或多个氨基酸提供vh结构域,其是vh结构域的氨基酸序列变体,任选地将因此提供的vh结构域与一种或多种vl结构域组合,和测试vh结构域或一种或多种vh/vl组合以标识特异性结合成员或抗体抗原结合结构域,其对感兴趣靶抗原(例如cd3)是特异性的,并且任选地具有一种或多种期望性质。vl结构域可具有基本上如本文所列的氨基酸序列。在将本文所公开的vl结构域的一种或多种序列变体与一种或多种vh结构域组合中可以采用类似的方法。
[0298]
技术人员会理解,“特异性结合”或“优先结合”(本文中可互换使用)抗体或多肽的表位是本领域熟知的术语,并且确定这种特异性或优先结合的方法也为本领域熟知的。如果与可选的细胞或物质相比,分子与特定细胞或物质以更频繁、更迅速、更长的持续时间和/或更大亲和力地反应或缔合,则称该分子表现出“特异性结合”或“优先结合”。如果抗体或其fab或scfv与靶标的结合比其与他物质的结合具有更大亲和力、抗体亲抗原性、更迅速和/或更长的持续时间,则其“特异性结合”或“优先结合”靶标。例如,特异性结合或优先结合cd3表位的抗体是如此抗体,其结合一种cd3表位比其结合其他cd3表位或非cd3表位具有更大亲和力、抗体亲抗原性、更迅速和/或更长的持续时间。通过阅读该定义还可以理解,例如,特异性或优先结合第一靶标的抗体(或部分或表位)可以或不可以特异性结合或优先结合第二靶标。因此,“特异性结合”或“优先结合”并不一定需要(尽管可包括)排他性结合。通常(但不一定),提及结合意味着优先结合。
[0299]
在某些实施方式中,如本文所述的fab片段(第三结合结构域)的抗原结合部分包括重链和轻链cdr组,其分别插入重链和轻链构架区(fr)组之间,所述构架区(fr)组提供了对cdr的支撑并限定了cdr相对于彼此的空间关系。如本文所用,术语“cdr组”是指重链或轻链v区的三个高变区。从重链或轻链的n
‑
端开始,这些区域分别表示为“cdr1”、“cdr2”和“cdr3”。因此,抗原结合位点包括六个cdr,包含来自重链和轻链v区中的每一个的cdr组。包含单个cdr(例如,cdr1、cdr2或cdr3)的多肽在本文中称为“分子识别单元”。许多抗原
‑
抗体复合物的晶体学分析表明,cdr的氨基酸残基与结合抗原形成广泛接触,其中最广泛的抗原接触是与重链cdr3。因此,分子识别单元主要负责抗原结合位点的特异性。
[0300]
如本文所用,术语“fr组”是指构成重链或轻链v区的cdr组的cdr的四个侧翼氨基酸序列。一些fr残基可能会接触结合的抗原;然而,fr主要负责将v区折叠成抗原结合位点,特别是与cdr直接相邻的fr残基。在fr中,某些氨基酸残基和某些结构特征是非常高度保守的。在这方面,所有v区序列都含有约90个氨基酸残基的内部二硫环。当v区折叠成结合位点时,cdr显示为形成抗原结合表面的突出的环基序。公认的是,存在fr的保守结构区,其会影响cdr环成为某些“经典(canonical)”结构的折叠形状——与精确的cdr氨基酸序列无关。此外,已知某些fr残基参与了稳定抗体重链和轻链相互作用的非共价的域间接触。
[0301]
免疫球蛋白可变区的结构和位置可以通过参考kabat,e.a.等人,sequences of proteins of immunological interest.4th edition.us department of health and human services.1987及其更新(现在可在互联网(mmune.bme.nwu.edu)上获得)确定。
[0302]
技术人员会认识到,术语“单克隆抗体”包括同质抗体群,其中单克隆抗体由参与表位选择性结合的氨基酸(天然存在的和非天然存在的)组成。单克隆抗体具有高度特异性,直接针对单个表位。术语“单克隆抗体”不仅包括完整的单克隆抗体和全长的单克隆抗体,还包括其片段(例如fab、fab'、f(ab')2、fv)、单链(scfv)、其变体、包含抗原结合部分的融合蛋白、人源化单克隆抗体、嵌合单克隆抗体和任何其他修饰构型的免疫球蛋白分子(该免疫球蛋白分子包含具有所需特异性和结合表位能力的抗原结合片段(表位识别位点))。这并非意图限制抗体的来源或其制备方式(例如,通过杂交瘤、噬菌体选择、重组表达、转基因动物等)。该术语包括如本文所述的完整的免疫球蛋白以及片段等。
[0303]
蛋白水解酶木瓜蛋白酶优先切割igg分子以产生几个片段,其中两个(f(ab)片段)每个都包含含有完整的抗原结合位点的共价异二聚体。胃蛋白酶能够切割igg分子以提供几个片段,包括包含两个抗原结合位点的f(ab')2片段。根据本文公开的某些实施方式使用的fv片段可以通过igm的优先蛋白水解切割产生,并且在少数情况下由igg或iga免疫球蛋白分子的优先蛋白水解切割产生。然而,fv片段更普遍地使用本领域已知的重组技术衍生。fv片段包括非共价vh::vl异源二聚体,其包括保留了天然抗体分子的大部分抗原识别和结合能力的抗原结合位点。inbar等人(1972)proc.nat.acad.sci.usa 69:2659
‑
2662;hochman等人(1976)biochem 15:2706
‑
2710;和ehrlich等人(1980)biochem 19:4091
‑
4096。
[0304]
在本公开的一些实施方式中,包含第三结合结构域的fab片段结合cd3。在本公开的一些实施方式中,包含第三结合结构域的fab片段结合cd3ε。
[0305]“t细胞受体”(tcr)是在t细胞表面发现的一种分子,它与cd3一起通常负责识别结合主要组织相容性复合物(mhc)分子的抗原。大多数t细胞中,其由高度可变的(α)和(β)链的二硫键连接的异二聚体组成。在其他t细胞中,表达了由可变y和(δ)链组成的可选的受体。tcr的每条链都是免疫球蛋白超家族的成员,并且拥有一个n
‑
端免疫球蛋白可变区、一个免疫球蛋白恒定区、一个跨膜区和位于c
‑
端的短的胞质尾(参见abbas和lichtman,cellular and molecular immunology(5th ed.),editor:saunders,philadelphia,2003;janeway et ai,immunobiology:the immune system in health and disease,4th ed.,current biology publications,p 148,149,and 172,1999)。本公开中使用的tcr可以来自多种动物物种,包括人、小鼠、大鼠或其他哺乳动物。
[0306]“抗tcr fab”或“抗tcr前体双特异性抗体构建体”是指fab或包含fab的前体三特异性抗体构建体,其特异性结合tcr分子或其单独链之一(例如,tcr(α)、tcr(β)、tcry或tcr(δ)链)。在某些实施方式中,抗tcr fab结合tcr(α)、tcr(β)或两者。技术人员会理解,在一些实施方式中,术语“抗tcr fab”可包括本文所述的前体三特异性抗体构建体的第三结合结构域。在一些实施方式中,术语“抗tcr fab”可包括前体构建体,其中提及第三结合结构域的结合属性。
[0307]“cd3”在本领域中已知为六链的多蛋白复合物(参见,smith
‑
garvin等人,annu rev immunol.2009;27:591
‑
619)。在哺乳动物中,该复合物包含cd3(γ)链、cd3(δ)链、两条cd3(epsilon;ε)链和cd3(ζ)链的同型二聚体。cd3(γ)、cd3(δ)和cd3(ε)链是含有单个免疫球蛋白结构域的免疫球蛋白超家族的高度相关的细胞表面蛋白。cd3(γ)、cd3(δ)和cd3(ε)链的跨膜区带负电荷,这是允许这些链与带正电荷的t细胞受体链缔合的特征。cd3(γ)、
cd3(δ)和cd3(ε)链的细胞内尾部各含有单个保守基序,被称为基于免疫受体酪氨酸活化基序或itam,而每条cd3(ζ)链具有三个。不希望受理论束缚,认为itam对于tcr复合物的信号传导能力是重要的。本公开中使用的cd3可以来自多种动物物种,包括人、小鼠、大鼠或其他哺乳动物。
[0308]
如本文所用,“抗cd3 fab”是指包含特异性结合单独cd3链(例如,cd3(γ)链、cd3(δ)链或cd3(epsilon;ε)链)或由两条或更多条单独cd3链形成的复合物(例如,多于一条cd3(ε)链的复合物、cd3(γ)和cd3(ε)链的复合物、cd3(δ)和cd3(ε)链的复合物)的第三结合结构域的fab。在某些实施方式中,抗cd3 fab特异性结合cd3(γ)、cd3(δ)或cd 3(ε)或其任何组合,并且在某些实施方式中,特异性结合cd3(ε)。在一些实施方式中,抗cd3 fab结合cd3ε的n
‑
端。在一些实施方式中,抗cd3 fab结合cd3ε的细胞外表位。
[0309]
在一些实施方式中,抗cd3 fab结合包含在cd3ε的氨基酸1
‑
27内的表位。在一些实施方式中,抗cd3 fab结合cd3ε的氨基酸1
‑
27。在一些实施方式中,抗cd3 fab结合人cd3ε的氨基酸1
‑
27。cd3ε的氨基酸1
‑
27在seq id no:5中叙述。
[0310]
技术人员会理解,在一些实施方式中,术语“抗cd3 fab”可包括本文所述的前体三特异性抗体构建体的第三结合结构域。在一些实施方式中,术语“抗cd3 fab”可包括前体构建体,其中提及第三结合结构域的结合属性。
[0311]
在一些实施方式中,前体构建体的第三结合结构域包含fab。在一些实施方式中,当涉及前体构建体的第三结合结构域时,将使用术语“fab”,其中该术语包括前体构建体的第三结合结构域。在一些实施方式中,术语“fab”可以与短语“第三结合结构域”互换使用,都具有相同性质和含义。
[0312]
在一些实施方式中,前体三特异性抗体构建体包含结合cd3ε的细胞外表位的第三结合结构域。在一些实施方式中,前体三特异性抗体构建体包含结合cd3ε的n
‑
端的第三结合结构域。在一些实施方式中,前体三特异性抗体构建体包含结合具有cd3ε的氨基酸1
‑
27的表位的第三结合结构域。在一些实施方式中,抗cd3 fab结合cd3ε的氨基酸1
‑
27。在一些实施方式中,抗cd3 fab结合人cd3ε的氨基酸1
‑
27。cd3ε的氨基酸1
‑
27在seq id no:5中叙述。
[0313]
如本文所用,“tcr复合物”是指通过cd3与tcr缔合形成的复合物。例如,tcr复合物可以由cd3(γ)链、cd3(δ)链、两条cd3(ε)链、cd3(ζ)链的同源二聚体、tcr(α)链和tcr(β)链组成。可选地,tcr复合物可以由cd3(γ)链、cd3(δ)链、两条cd3(ε)链、cd 3(ζ)链的同源二聚体、tcry链和tcr(δ)链组成。
[0314]
如本文所用,“tcr复合物的组件”是指tcr链(即,tcr(α)、tcr(β)、tcry或tcr(δ))、cd3链(即,cd3(γ)、cd3(δ)、cd3(ε)或cd3(ζ))、或由两条或更多条tcr链或cd3链形成的复合物(例如,tcr(α)和tcr(β)的复合物,tcry和tcr(δ)的复合物、cd3(ε)和cd3(δ)的复合物、cd3(γ)和cd3(ε)的复合物,或tcr(α)、tcr(β)、cd3(γ)、cd3(δ)和两条cd3(ε)链的亚tcr复合物)。
[0315]
作为背景,tcr复合物通常负责启动对与mhc分子结合的抗原的t细胞应答。据信,认为肽:mhc配体与tcr和共受体(即cd4或cd8)的结合将tcr复合物、共受体和cd45酪氨酸磷酸酶聚集在一起。这允许cd45去除抑制性磷酸基团,从而活化lck和fyn蛋白激酶。这些蛋白激酶的活化导致cd3(ζ)链上itam的磷酸化,这又使这些链能够结合胞质内酪氨酸激酶zap
‑
70。随后通过磷酸化活化结合的zap
‑
70触发三个信号传导通路,其中两个由plc
‑
(γ)的磷酸化和活化启动,然后将磷脂酰肌醇磷酸(pip)切割为二酰基甘油(dag)和三磷酸肌醇(ip3)。dag活化蛋白激酶c导致转录因子nfkb的活化。由于ip3的作用,细胞内游离ca
2
的突然增加活化了细胞质磷酸酶—钙调磷酸酶,这使得转录因子nfat(活化t细胞的核因子)从细胞质易位到细胞核中。nfat的完整转录活性还需要ap
‑
1转录因子家族的成员;fos和jun转录调节因子家族成员的二聚体。
[0316]
由活化的zap
‑
70启动的第三信号传导通路是ras的活化和随后的map激酶级联的活化。这最终导致fos的活化和因此ap
‑
1转录因子的活化。nfkb、nfat和ap
‑
1共同作用于t细胞染色体,启动导致t细胞分化、增殖和效应物作用的新基因转录。参见pitcher等人,2003.,trends in immunol.24,554
‑
560;smith
‑
garvin等人,annu rev immunol.2009;27:591
‑
619。
[0317]
在某些实施方式中,fab特异性结合单独的人cd3链(例如人cd3(γ)链、人cd3(δ)链或人cd3(ε)链)或两种或更多种的单独的人cd3链的组合(例如,人cd3(γ)和人cd3(ε)的复合物或人cd3(δ)和人cd3(ε)的复合物)。在某些实施方式中,fab特异性结合人cd3(ε)链。在某些实施方式中,fab特异性结合人cd3(ε)链的细胞外表位。在某些实施方式中,fab特异性结合seq id no:3内的表位。
[0318]
在某些实施方式中,第三结合结构域特异性结合单独的人cd3链(例如人cd3(γ)链、人cd3(δ)链或人cd3(ε)链)或两种或更多种的单独的人cd3链的组合(例如,人cd3(γ)和人cd3(ε)的复合物或人cd3(δ)和人cd3(ε)的复合物)。在某些实施方式中,第三结合结构域特异性结合人cd3(ε)链。在某些实施方式中,第三结合结构域特异性结合人cd3(ε)链的细胞外表位。在某些实施方式中,第三结合结构域特异性结合seq id no:3内的表位。
[0319]
在某些其他实施方式中,包含第三结合结构域的本公开内容的fab特异性结合tcr(α)、tcr(β)或由tcr(α)和tcr(β)形成的异二聚体。在某些实施方式中,fab特异性结合人tcr(α)、人tcr(β)或由人tcr(α)和人tcr(β)形成的异二聚体中的一种或多种。
[0320]
在某些实施方式中,包含第三结合结构域的本公开的fab结合由一条或多条cd3链与一条或多条tcr链形成的复合物,例如由cd3(γ)链、cd3(δ)链、cd3(ε)链、tcr(α)链或tcr(β)链或其任何组合形成的复合物。在其他实施方式中,本公开内容的fab结合由一条cd3(γ)链、一条cd3(δ)链、两条cd3(ε)链、一条tcr(α)链和一条tcr(β)链形成的复合物。在进一步的实施方式中,本公开内容的fab结合由一条或多条人cd3链与一条或多条人tcr链形成的复合物,例如由人cd3(γ)链、人cd3(δ)链、人cd3(ε)、人tcr(α)链或人tcr(β)链或其任何组合形成的复合物。在某些实施方式中,本公开内容的fab结合由一条人cd3(γ)链、一条人cd3(δ)链、两条人cd3(ε)链、一条人tcr(α)链和一条人tcr(β)链形成的复合物。
[0321]
本公开内容的fab可以如本文所述或通过本领域已知的多种方法产生(参见例如美国专利号6,291,161;6,291,158)。fab的来源包括来自不同物种的单克隆抗体核酸序列(其可以被转换为抗体、fv、scfv或fab,例如在噬菌体文库中),所述物种包括人、骆驼科动物(来自骆驼、单峰驼或美洲驼;hamers
‑
casterman等人(1993)nature,363:446 and nguyen等人(1998)j.mol.biol.,275:413)、鲨鱼(roux等人(1998)proc.nat’l.acad.sci.(usa)95:11804),fish(nguyen等人(2002)immunogenetics,54:39)、啮齿动物、鸟类或羊。
[0322]
与猴cd3具有交叉反应性的抗人cd3抗体是特别理想的,例如sp34小鼠单克隆抗
体,其特异性结合变性形式的人cd3(蛋白质印迹或斑点印迹)和天然形式(在t细胞上)的人cd3(pressano,s.the embo j.4:337
‑
344,1985;alarcon,b.embo j.10:903
‑
912,1991)。sp34小鼠单克隆抗体还结合cd3c单独转染的cos细胞以及cd3ε/γ或cd3ε/δ双重转染子(salmeron a.等人,j.immunol.147:3047
‑
52,1991)。sp34抗体也会与非人灵长类动物交叉反应(yoshino n.等人,exp.anim 49:97
‑
110,2000;conrad m l.等人,cytometry 71a:925
‑
33,2007)。此外,在交联时,sp34活化t细胞(yang等人,j.immunol.137:1097
‑
1100,1986)。与猴cd3的交叉反应性很重要,因为这允许直接使用临床候选物在非人类灵长类动物中进行毒性研究,而不是在黑猩猩中或使用替代分子。因此,在本公开内容的前体双特异性抗体构建体中使用此类交叉反应性抗cd3 fab的毒性研究提供更相关的安全性评估。
[0323]
其他示例性抗cd3抗体包括cris
‑
7单克隆抗体(reinherz,e.l.等人(eds.),leukocyte typing ii.,springer verlag,new york,(1986))、bc3单克隆抗体(anasetti等人(1990)j.exp.med.172:1691)、okt3(ortho multicenter transplant study group(1985)n.engl.j.med.313:337)及其衍生物如okt3 ala
‑
ala(herold等人(2003)j.clin.invest.11:409)、维西珠单抗(visilizumab)(carpenter等人(2002)blood 99:2712)和145
‑
2c11单克隆抗体(hirsch等人(1988)j.immunol.140:3766)。考虑用于本文的进一步cd3结合分子包括ucht
‑
1(beverley,p c and callard,r.e.(1981)eur.j.immunol.11:329
‑
334)和wo2004/106380;wo2010/037838;wo2008/119567;wo2007/042261;wo2010/0150918中描述的cd3结合分子,其全部内容并入本文中。
[0324]
在一些实施方式中,包含抗cd3ε结合活性的第三结合区的氨基酸序列包含本领域已知的任何抗cd3ε序列。在一些实施方式中,包含与抗cd3ε或其衍生物或其抗体片段的结合活性的第三结合区的氨基酸序列包含本领域已知的任何抗cd3ε序列。已知的抗cd3ε氨基酸序列的实例可见于例如但不限于美国专利号:9,822,180;9,493,563;9,587,021;9,562,073;美国公开申请号:2013/0129729;2017/0247476;2016/0194399;2010/0150918;2018/0112011;和wo2017/162587,其全部内容包含在本文中。
[0325]
示例性的抗tcr抗体是h57单克隆抗体(lavasani等人(2007)scandinavian journal of immunology 65:39
‑
47)。
[0326]
fab片段的抗原结合片段序列(例如,重链和轻链可变区序列)可在公共数据库中获得,或使用传统的杂交瘤开发策略组件在常规系统(例如,小鼠、humab小鼠.rtm.、tc小鼠.tm.、km
‑
小鼠.rtm.、美洲驼、鸡、大鼠、仓鼠、兔等)中使用cd3链、tcr组分或其他fab结合靶标作为免疫原,可用于开发用于本文的fab。本领域技术人员将理解,fab片段可以使用本领域已知的多种技术产生,包括抗体展示技术,例如噬菌体、酵母、核糖体和mrna展示技术;b细胞培养技术如slam技术;或针对从免疫动物受试者或免疫人类受试者分离的b细胞或血浆b细胞使用高通量基因测序技术。
[0327]
在一些实施方式中,本文公开的第三结合结构域(fab)包含人源化fr氨基酸序列和小鼠单克隆抗体的cdr氨基酸序列的天然序列。其中fr序列已被人源化而cdr氨基酸序列仍为sp34小鼠单克隆抗体的那些的抗cd3ε氨基酸序列的实例在国际申请公开号wo2007/042261中公开,其全部内容并入本文。
[0328]
包含在本公开内容的前体双特异性抗体构建体中的示例性第三结合结构域(例如但不限于抗cd3ε fab)序列包括vh、ch1、vl和cl氨基酸序列,以及编码它们的多核苷酸,如
下表1和表2分别所示。包含第三结合结构域的氨基酸序列包括如下叙述的那些:seq id no:46
‑
72和114(vh)和75
‑
103和116(vl),包括其cdr,例如在seq id no:104
‑
112中叙述的那些。在一些实施方式中,包含在本公开内容的前体三特异性抗体构建体内的第三结合结构域(例如,fab)序列包括如表2中叙述的vh、ch1、vl和cl氨基酸序列,或其同源物。在一些实施方式中,seq id no:46
‑
72和114以及75
‑
103和116的同源物保持它们的cdr区,例如在seq id no:104
‑
112中叙述的。
[0329]
表2:抗cd3 vh、vl、hc、lc和cdr及其组合的氨基酸序列。
[0330]
[0331]
[0332][0333]
在一些实施方式中,第三结合结构域结合cd3ε多肽。在一些实施方式中,第三结合结构域结合人cd3ε多肽的细胞外结构域。在一些实施方式中,第三结合结构域包含fab片段,其包含含有cdr
‑
h1、cdr
‑
h2和cdr
‑
h3的可变重链区(vh)和含有cdr
‑
l1、cdr
‑
l2和cdr
‑
l3的可变轻链区(vl),其中第三结合结构域结合人cd3ε多肽的细胞外结构域。在一些实施方式中,第三结合结构域结合seq id no:3内的表位。在一些实施方式中,第三结合结构域结合seq id no:5。
[0334]
在一些实施方式中,抗人cd3ε cdr
‑
h1的氨基酸序列在seq id no:104中叙述。在一些实施方式中,抗人cd3ε cdr
‑
h2的氨基酸序列在seq id no:105中叙述。在一些实施方式中,抗人cd3ε cdr
‑
h3的氨基酸序列在seq id no:106中叙述。在一些实施方式中,抗人cd3ε cdr
‑
l1的氨基酸序列在seq id no:107
‑
109的任一中叙述。在一些实施方式中,抗人cd3 3ε cdr
‑
l1的氨基酸序列在seq id no:110中叙述。在一些实施方式中,抗人cd3 3ε cdr
‑
l1的氨基酸序列在seq id no:111
‑
112中叙述。
[0335]
在一些实施方式中,第三结合结构域包含fab片段,其包含结合人cd3ε多肽的细胞外结构域的可变重链区(vh)和可变轻链区(vl)。在一些实施方式中,抗人cd3ε的vh和vl的氨基酸序列选自seq id no:46
‑
72和114(vh)和75
‑
103和116(vl)中任一所叙述的氨基酸序列。在一些实施方式中,抗人cd3ε的vh和vl的氨基酸序列包含选自seq id no:46
‑
72和114(vh)和75
‑
103和116(vl)中任一所叙述的氨基酸序列的序列同源物。
[0336]
在一些实施方式中,人cd3ε第三结合结构域(vh1)的vh的氨基酸序列选自seq id no:75
‑
103和116中的任一中叙述的氨基酸序列或其同源物。在一些实施方式中,人cd3ε第三结合结构域(vl1)的vl的氨基酸序列选自seq id no:75
‑
103和116中的任一中叙述的氨基酸序列或其同源物。
[0337]
在一些实施方式中,同源物包含与抗cd3ε的可变轻链或可变重链的氨基酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽。在一些实施方式中,同源物包含与抗cd3ε的可变轻链或可变重链的氨基酸序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的多肽。在一些实施方式中,同源物包括分别与抗人cd3ε的vh或抗人cd3ε的vl至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少91%、至少93%、至少95%、至少96%、至少97%、至少98%或至少99%同源的多肽,如使用国家生物技术信息中心(ncbi)的blastp软件使用默认参数确定的。
[0338]
在一些实施方式中,同源性还包括其及其生物活性多肽片段的缺失、插入或取代变体,包括氨基酸取代。在一个实施方式中,变体包含保守取代、或缺失、插入或取代——其不显著改变感兴趣多肽的三维结构,例如vl或vh区,具体是在cdr表位结合区的区域中。在一些实施方式中,缺失、插入或取代不改变抗人cd3ε fab的感兴趣功能,在一些实施方式
中,其结合靶t细胞上的cd3ε序列。
[0339]
在一些实施方式中,结合cd3ε细胞外表位vh1的第三结合结构域包括在seq id no:46
‑
72和114中叙述的序列或其同源物。在一些实施方式中,结合cd3ε细胞外表位vl1的第二结合结构域包括在seq id no:75
‑
103和116中叙述的序列或其同源物。在一些实施方式中,结合cd3ε细胞外表位的第三结合结构域包含选自seq id no:46
‑
72、74和114中叙述的序列或其同源物,以及选自seq id no:75
‑
103、113、115和116中叙述的序列或其同源物。在一些实施方式中,结合cd3ε细胞外表位的第三结合结构域包含在seq id no:113中叙述的序列或其同源物,以及在seq id no:74中叙述的序列或其同源物。
[0340]
在一些实施方式中,第三结合结构域vl区包含如针对cdr
‑
l1(选自seq id no:107
‑
109)、cdr
‑
l2(seq id no:110)和cdr
‑
l3(选自seq id no:111和112)所叙述的氨基酸序列,并且第三结合结构域vh区包含cdr
‑
h1(seq id no:104)、cdr
‑
h2(seq id no:105)和cdr
‑
h3(seq id no:106)。
[0341]
在前体三特异性抗体构建体的一些实施方式中,第三结合结构域的vl区包含在seq id no:75
‑
103和116中任一所叙述的氨基酸序列,或具有与其至少80%同源性的氨基酸序列。在一些实施方式中,包含具有与其至少80%同源性的氨基酸序列的第三结合的vl区包含具有至少80%同源性的构架序列,其中cdr区在所选氨基酸序列(seq id no:107
‑
112)中“原样(as is)”。
[0342]
在前体三特异性抗体构建体的一些实施方式中,第三结合的vh区包含在seq id no:46
‑
72和114中任一所叙述的氨基酸序列,或具有与其至少80%同源性的氨基酸序列。在一些实施方式中,包含具有与其至少80%同源性的氨基酸序列的第三结合的vh区包含具有至少80%同源性的构架序列,其中cdr区在所选氨基酸序列(seq id no:104
‑
106)中“原样”。
[0343]
在一些实施方式中,第一结合结构域包含人源化结合结构域。在一些实施方式中,第二结合结构域包含人源化结合结构域。在一些实施方式中,第三结合结构域包含人源化结合结构域。在一些实施方式中,第一、或第二或第三结合结构域、或其任何组合包含人源化结合结构域。
[0344]
如技术人员将理解的和如本文所述的,在一些实施方式中,完整抗体包含两条重链和两条轻链,每条重链由可变区和第一、第二和第三恒定区组成,而每条轻链由可变区和恒定区组成。哺乳动物重链被分类为α、δ、ε、γ和μ,和哺乳动物轻链被分类为λ或κ。包含α、δ、ε、γ和μ重链的免疫球蛋白被分类为免疫球蛋白(ig)a、igd、ige、igg和igm。完整的抗体形成“y”形。y的茎由结合在一起的两条重链的第二和第三恒定区(对于ige和igm,第四个恒定区)组成,并且在铰链中形成二硫键(链间)。重链γ、α和δ具有由三个串联(成直线)的ig结构域组成的恒定区和用于增加柔性的铰链区;重链μ和ε具有由四个免疫球蛋白结构域组成的恒定区。第二和第三恒定区分别称为“ch2结构域”和“ch3结构域”。y的每个臂包括与单条轻链的可变区和恒定区结合的单条重链的可变区和第一恒定区。轻链和重链的可变区负责抗原结合。
[0345]
关于抗体的“互补决定区”或“cdr”是指抗体重链或轻链可变区中的高度可变环。cdr可以与抗原构象相互作用并在很大程度上决定与抗原的结合(尽管已知一些构架区参与结合)。重链可变区和轻链可变区各包含3个cdr。cdr可以通过常规方法限定或标识,例如
根据kabat等人的序列(wu,t t和kabat,e.a.,j exp med.132(2):211
‑
50,(1970);borden,p.and kabat e.a.,pnas,84:2440
‑
2443(1987);kabat,e.a.et al,sequences of proteins of immunological interest,diane出版社出版,19922),或根据chothia等人的结构(choithia,c.and lesk,a.m.,j.mol.biol.,196(4):901
‑
917(1987),choithia,c.et al,nature,342:877
‑
883(1989))。
[0346]
关于抗体的“重链可变区”或“vh”是指重链的片段,其含有插入在称为构架区的侧翼段之间的三个cdr,其比cdr更高度保守并形成支架以支撑cdr。
[0347]
关于抗体的“轻链可变区”或“vl”是指轻链的片段,其含有插入构架区之间的三个cdr。
[0348]
关于抗体的“fv”是指带有完整抗原结合位点的抗体的最小片段。fv片段由与单条重链的可变区结合的单条轻链的可变区组成。
[0349]
关于抗体的“单链fv抗体”或“scfv”是指由直接或通过肽接头序列彼此连接的轻链可变区和重链可变区组成的改造的抗体。
[0350]
如本文所用,“单结构域骆驼抗体”或“骆驼科vhh”是指重链抗体的已知最小的抗原结合单元(koch
‑
nolte等人,faseb j.,21:3490
‑
3498(2007))。“重链抗体”或“骆驼科抗体”是指含有两个vh结构域且不含轻链的抗体(riechmann l.等人,j.immunol.methods 231:25
‑
38(1999);wo94/04678;wo94/25591;美国专利号6,005,079)。
[0351]“单结构域抗体”或“dab”是指由抗体重链可变区(vh结构域)或抗体轻链可变区(vl结构域)组成的抗体片段(holt,l.,et al,trends in biotechnology,21(11):484
‑
490)。
[0352]
如本文所用,术语“二硫键”是指重链片段和轻链片段通过一个或多个二硫键结合。通过连接两个片段中的硫醇基团,可以在两个片段之间形成一个或多个二硫键。在某些实施方式中,一个或多个二硫键可以分别在重链片段和轻链片段的一个或多个半胱氨酸残基之间形成。
[0353]“可变区连接序列”是将重链可变区连接到轻链可变区并提供了与两个亚结合结构域的相互作用相容的接头功能的氨基酸序列,使得所得多肽保持了对与包含相同轻链和重链可变区的抗体相同的靶分子的特异性结合亲和力。在某些实施方式中,可用于连接结合结构域与免疫球蛋白ch2或ch3区多肽的铰链可用作可变区连接序列。
[0354]
在一些实施方式中,第三结合结构域包含可变重链(vh)区和可变轻链(vl)区,其中所述第一或第二子调节结构域位于所述第三结合结构域的所述vl区或vh区的n
‑
端。在一些实施方式中,第三结合结构域包含可变重链(vh)区和可变轻链(vl)区,其中所述第一子调节结构域位于所述第三结合结构域的所述vl区的n
‑
端,并且第二子调节结构域位于所述第三结合结构域的所述vh区的n
‑
端。在一些实施方式中,第三结合结构域包含可变重链(vh)区和可变轻链(vl)区,其中所述第一子调节结构域位于第三结合结构域的所述vh区的n
‑
端,并且第二子调节结构域位于第三结合结构域的所述vl区的n
‑
端。
[0355]
在一些实施方式中,第三结合结构域包含恒定重链(chl)区和恒定轻链(cl)区,其中所述第一或第二结合结构域位于所述第三结合结构域的所述chl区或cl区的c
‑
端。在一些实施方式中,第三结合结构域包含恒定重链(chl)区和恒定轻链(cl)区,其中所述第一结合结构域位于所述第三结合结构域的所述cl区的c
‑
端,和第二结合结构域位于所述第三结
合结构域的所述ch1区的c
‑
端。在一些实施方式中,第三结合结构域包含恒定重链(chl)区和恒定轻链(cl)区,其中所述第一结合结构域位于第三结合结构域的所述chl区的c
‑
端,和第二结合结构域位于第三结合结构域的所述cl区的c
‑
端。技术人员会理解,第一和第二子调节结构域位于vh和vl的n
‑
端,其中当第一子调节结构域位于vh的n
‑
端时,则第二子调节结构域位于vl的n
‑
端,反之亦然,当第二子调节结构域位于第三结合结构域的vh的n端时,则第一子调节结构域位于第三结合结构域的vl的n
‑
端。类似地,技术人员会理解第一和第二结合结构域位于第三结合结构域的chl和cl结构域的c
‑
端,其中当第一结合结构域位于chl的c
‑
端时,第二结合结构域位于cl的c
‑
端,反之亦然,当第二结合结构域位于ch1的c
‑
端时,第一结合结构域位于第三结合结构域的cl的c
‑
端。
[0356]
结合结构域的可选来源可包括编码随机肽文库的序列或编码可选非抗体支架的环区中的改造的氨基酸多样性的序列,该支架例如纤维蛋白原结构域(参见,例如,weisel等人(1985)science 230:1388)、kunitz结构域(参见例如美国专利号6,423,498)、脂质运载蛋白结构域(参见,例如,wo2006/095164)、v样结构域(参见例如美国专利申请公开号2007/0065431)、c型凝集素结构域(zelensky和gredy(2005)febs j.272:6179)或fcab.tm.(参见,例如,pct专利申请公开号wo 2007/098934;wo 2006/072620)等。
[0357]
如图1和2a
‑
2f所描绘的,scfv是具体说明性的结合结构域。在一些实施方式中包含scfv片段的第一或第二结合结构域、或第一和第二结合结构域两者可结合多种靶分子中的任一种,其包括但不限于:fcγri、fcγriia、fcγriib、fcγriiib、cd28、cd137、ctla
‑
4、fas、成纤维细胞生长因子受体1(fgfr1)、fgfr2、fgfr3、fgfr4、糖皮质激素诱导的tnfr相关(gitr)蛋白、淋巴毒素
‑
β受体(ltβr)、toll样受体(tlr)、肿瘤坏死因子相关凋亡诱导配体
‑
受体1(trail受体1)和trail受体2、前列腺特异性膜抗原(psma)蛋白、前列腺干细胞抗原(psca)蛋白、肿瘤相关蛋白碳酸酐酶ix(caix)、表皮生长因子受体1(egfr1)、egfrviii、人表皮生长因子受体2(her2/neu;erb2)、erbb3(也称为her3)、叶酸受体、肝配蛋白受体、pdgfra、erbb
‑
2、cd20、cd22、cd30、cd33、cd40、cd37、cd38、cd70、cd74、cd40)、cd80、cd86、cd2、p53、cmet(也称为酪氨酸蛋白激酶met或肝细胞生长因子受体(hgfr))、mage
‑
a1、mage
‑
a2、mage
‑
a3、mage
‑
a4、mage
‑
a6、mage
‑
a10、mage
‑
a12、bage、dam
‑
6、dam
‑
10、gage
‑
1、gage
‑
2、gage
‑
8、gage
‑
3、gage
‑
4、gage
‑
5、gage
‑
6、gage
‑
7b、na88
‑
a、ny
‑
eso
‑
1、brca1、brca2、mart
‑
1、mc1r、gp100、psa、psm、酪氨酸酶、维尔姆斯肿瘤抗原(wt1)、trp
‑
1、trp
‑
2、art
‑
4、camel、cyp
‑
b、htert、htrt、ice、muc1、muc2、p
‑
钙粘蛋白、肌肉生长抑制素(gdf8)、cripto(tdgf1)、muc5ac、prame、p15、ru1、ru2、sart
‑
1、sart
‑
3、wt1、afp、β
‑
联蛋白/m、胱天蛋白酶
‑
8/m、cdk
‑
4/m、elf2m、gnt
‑
v、g250、hsp70
‑
2m、hst
‑
2、kiaa0205、mum
‑
1、mum
‑
2、mum
‑
3、肌球蛋白/m、rage、sart
‑
2、trp
‑
2/int2、707
‑
ap、膜联蛋白ii、cdc27/m、tpi/mbcr
‑
abl、etv6/aml、ldlr/fut、pml/rarα、tel/aml1、cd28、cd137、canag、间皮素、dr5、pd
‑
1、pd1l、igf
‑
1r、cxcr4、神经毡蛋白1、磷脂酰肌醇蛋白聚糖、epha2、cd138、b7
‑
h3、b7
‑
h4、gpa33、gpc3、sstr2、ror1、5t4或vegf
‑
r2。在一些实施方式中,taa包括psma、cd30、b7
‑
h3、b7
‑
h4、gpa33、her2、p
‑
钙粘蛋白、gp100、dr5、gpc3、sstr2、间皮素、ror1、5t4、叶酸受体或egfr。在一些实施方式中,taa选自psma、ror1、5t4和egfr。这些和其他肿瘤蛋白或肿瘤相关蛋白是技术人员已知的。
[0358]
在某些实施方式中,第一或第二结合结构域、或第一和第二结合结构域两者特异性结合与疾病状况相关的抗原靶标。疾病状况可包括生理病症、病理病症和美容病症。说明
性病症的实例包括但不限于癌症、炎性紊乱、同种异体移植物、i型糖尿病、ii型糖尿病和多发性硬化。
[0359]
在一些实施方式中,前体三特异性抗体构建体的具体结构组件包含第一和第二结合结构域(例如但不限于scfv片段)、第三结合结构域(例如但不限于fab片段)、接头区、以及第一和第二子调节结构域,如已在本文中详细描述的,其中所述调节结构域可各自包含蛋白酶可切割结构域和hsa多肽序列或蛋白酶可切割结构域和cap组件、和接头或其任何组合。
[0360]
在一些实施方式中,前体三特异性抗体构建体包含两种多肽。在一些实施方式中,可以基于第三结合结构域的重链(hc)或轻链(lc)组件来标识这些多肽。在一些实施方式中,这些多肽可被标识为多肽a和多肽b。在一些实施方式中,多肽a包含hc多肽且多肽b包含lc多肽。在其他实施方式中,多肽a包含lc多肽且多肽b包含hc多肽。
[0361]
在一些实施方式中,本文所述的前体三特异性抗体构建体包含含有可变重链(vh)区和可变轻链(vl)区的第三结合结构域;其中第一结合结构域位于第三结合结构域的所述cl或所述ch1区的c
‑
端;其中当所述第一结合结构域位于所述cl区的c
‑
端时,所述第二结合结构域位于所述ch1区的c
‑
端,并且当所述第一结合结构域位于所述ch1区的c
‑
端时,所述第二结合结构域位于所述cl区的c端。在一些实施方式中,本文所述的前体三特异性抗体构建体包含含有可变重链(vh)区和可变轻链(vl)区的第三结合结构域;
[0362]
其中所述第一和第二结合结构域如上所述定位,和
[0363]
其中包含位于所述蛋白酶切割结构域n
‑
端的所述hlp结构域的所述第一子调节结构域位于所述第三结合结构域的所述vh区或所述vl区的n
‑
端;
[0364]
其中(a)当所述第一子调节结构域位于所述vl区的n
‑
端时,包含位于所述蛋白酶切割结构域n
‑
端的所述cap组件的所述第二子调节结构域位于所述vh区的n
‑
端,和(b)当所述第一子调节结构域位于所述vh区的n
‑
端时,包含位于所述蛋白酶切割结构域的n
‑
端的所述cap组件的所述第二子调节结构域位于所述vl区的n
‑
端。
[0365]
为了在以下示意性描述中清楚起见,第一和第二抗
‑
taa结合位点将由术语“taa”代表并且抗
‑
cd3第三结合位点将由术语“cd3”代表。
[0366]
在一些实施方式中,本文所述的前体三特异性抗体构建体包含两种多肽——多肽a和多肽b,其中多肽a包含具有n
‑
端至c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、cd3第三结合结构域vh
‑
ch1区、第一结合结构域(vl
‑
vh);和多肽b包含具有从n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、cd3第三结合结构域vl
‑
cl区、第二结合结构域(vl
‑
vh)。在一些实施方式中,本文所述的前体三特异性抗体构建体包含如下两种多肽(顺序为n
‑
端至c
‑
端):
[0367]
多肽a:hlp
‑
l
‑
cp
‑
l
‑
cd3vh
‑
l
‑
cd3ch1
‑
l
‑
taa vl
‑
l
‑
taa vh
[0368]
多肽b:cap
‑
l
‑
cp
‑
l
‑
cd3vl
‑
l
‑
cd3cl
‑
l
‑
taa vl
‑
l
‑
taa vh,
[0369]
其中“l”是接头,其在每个实施方式中可能存在或可能不存在。
[0370]
在一些实施方式中,本文所述的前体三特异性抗体构建体包含两种多肽——多肽a和多肽b,其中多肽a包含具有n
‑
端至c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、cd3第三结合结构域vh
‑
ch1区、第一结合结构域(vh
‑
vl);和多肽b包含具有从n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、cd3第三结合结构域vl
‑
cl区、第二结合结构域(vl
‑
vh)。在一些实施方式中,本文所述的前体三特异性抗体构建体包含如下两种多肽(顺序为n
‑
端至c
‑
端)
[0371]
多肽a:hlp
‑
l
‑
cp
‑
l
‑
cd3vh
‑
l
‑
cd3ch1
‑
l
‑
taa vh
‑
l
‑
taa vl
[0372]
多肽b:cap
‑
l
‑
cp
‑
l
‑
cd3vl
‑
l
‑
cd3cl
‑
l
‑
taa vl
‑
l
‑
taa vh,
[0373]
其中“l”是接头,其在每个实施方式中可能存在也可能不存在(图1)。
[0374]
在一些实施方式中,本文所述的前体三特异性抗体构建体包含两种多肽——多肽a和多肽b,其中多肽a包含具有n
‑
端至c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、cd3第三结合结构域vh
‑
ch1区、第一结合结构域(vh
‑
vl);和多肽b包含具有从n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、cd3第三结合结构域vl
‑
cl区、第二结合结构域(vh
‑
vl)。在一些实施方式中,本文所述的前体三特异性抗体构建体包含如下两种多肽(顺序为n
‑
端至c
‑
端)
[0375]
多肽a:hlp
‑
l
‑
cp
‑
l
‑
cd3vh
‑
l
‑
cd3ch1
‑
l
‑
taa vh
‑
l
‑
taa vl
[0376]
多肽b:ap
‑
l
‑
cp
‑
l
‑
cd3vl
‑
l
‑
cd3cl
‑
l
‑
taa vh
‑
l
‑
taa vl,
[0377]
其中“l”是接头,其在每个实施方式中可能存在或可能不存在。
[0378]
在一些实施方式中,本文所述的前体三特异性抗体构建体包含两种多肽——多肽a和多肽b,其中多肽a包含具有n
‑
端至c
‑
端顺序的组件:hlp结构域、蛋白酶切割结构域、cd3第三结合结构域vh
‑
ch1区、第一结合结构域(vl
‑
vh);和多肽b包含具有从n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、cd3第三结合结构域vl
‑
cl区、第二结合结构域(vh
‑
vl)。在一些实施方式中,本文所述的前体三特异性抗体构建体包含如下两种多肽(顺序为n
‑
端至c
‑
端)
[0379]
多肽a:hlp
‑
l
‑
cp
‑
l
‑
cd3vh
‑
l
‑
cd3ch1
‑
l
‑
taa vl
‑
l
‑
taa vh
[0380]
多肽b:cap
‑
l
‑
cp
‑
l
‑
cd3vl
‑
l
‑
cd3cl
‑
l
‑
taa vh
‑
l
‑
taa vl,
[0381]
其中“l”是接头,其在每个实施方式中可能存在或可能不存在。
[0382]
上述四种构建体提供了三特异性前体抗体构建体的非限制性实例,其中第一或第二结合区的scfv内vl和vh的位置是交替的。技术人员将理解这些可选位置也将包含在以下实施方式中,其中scfv表示为vl
‑
vh,以便说明组件的其他可选非限制性组合。
[0383]
在一些实施方式中,本文所述的前体三特异性抗体构建体包含两种多肽——多肽a和多肽b,其中多肽a包含具有n
‑
端至c
‑
端顺序的组件:cap结构域、蛋白酶切割结构域、cd3第三结合结构域vh
‑
ch1区、第一结合结构域(vl
‑
vh);和多肽b包含具有从n
‑
端到c
‑
端顺序的组件:hlp组件、蛋白酶切割结构域、cd3第三结合结构域vl
‑
cl区、第二结合结构域(vl
‑
vh)。在一些实施方式中,本文所述的前体三特异性抗体构建体包含如下两种多肽(顺序为n
‑
端至c
‑
端)
[0384]
多肽a:cap
‑
l
‑
cp
‑
l
‑
cd3vh
‑
l
‑
cd3ch1
‑
l
‑
taa vl
‑
l
‑
taa vh
[0385]
多肽b:hlp
‑
l
‑
cp
‑
l
‑
cd3vl
‑
l
‑
cd3cl
‑
l
‑
taa vl
‑
l
‑
taa vh,
[0386]
其中“l”是接头,其在每个实施方式中可能存在或可能不存在。
[0387]
上述构建体提供了三特异性前体抗体构建体的非限制性实例,其中两个调节结构域的位置是交替的。技术人员会理解,这些可选位置也可以包含在其他实施方式中,其中调节结构域位置表示为hlp结构域是hc的组件,和cap是lc的组件,且scfv表示为vl
‑
vh,以便说明组件的其他可选性非限制性组合。
[0388]
在一些实施方式中,本文所述的前体三特异性抗体构建体包含两种多肽——多肽a和多肽b,其中多肽a包含具有n
‑
端至c
‑
端的顺序的组件:hlp结构域、蛋白酶切割结构域、cd3第三结合结构域vl
‑
cl区、第一结合结构域(vl
‑
vh);和多肽b包含具有从n
‑
端到c
‑
端顺序的组件:cap组件、蛋白酶切割结构域、cd3第三结合结构域vh
‑
ch1区、第二结合结构域(vl
‑
vh)。在一些实施方式中,本文所述的前体三特异性抗体构建体包含如下两种多肽(顺序为n
‑
端至c
‑
端)
[0389]
多肽a:hlp
‑
l
‑
cp
‑
l
‑
cd3vl
‑
l
‑
cd3cl
‑
l
‑
taa vh
‑
l
‑
taa vl
[0390]
多肽b:cap
‑
l
‑
cp
‑
l
‑
cd3vh
‑
l
‑
cd3ch1
‑
l
‑
taa vh
‑
l
‑
taa vl,
[0391]
其中“l”是接头,其在每个实施方式中可能存在或可能不存在。
[0392]
本领域技术人员会理解,名称“多肽a”和“多肽b”仅仅是表示两条异源多肽链的名称,因此名称本身可以互换或改变,例如,多肽1和多肽2。进一步地,该术语包括的是一起形成前体三特异性抗体构建体的两种结构不同的多肽链,如本文所述。进一步地,技术人员会理解本文所述的前体构建体的模块化性质,其中模块可以用一个取代另一个,其中它们提供相似或不同的活性。例如,但不限于,scfv可能必须以n
‑
端至c
‑
端vl
‑
vh或vh
‑
vl排序;或调节结构域可以包括cap组件或hlp结构域。
[0393]
组件的顺序可以如以上非限制性实例中所示交替,其中在一些实施方式中,第一或第二子调节结构域是hc或lc两者之一的组件并且可以位于第三结合结构域的n
‑
端,并且第一或第二结合结构域包含scfv,其中scfv的组件(vl、l和vh)是独立排序的vl
‑
l
‑
vh或vh
‑
l
‑
vl,其位于第三结合结构域的c
‑
端,并且分别是hc或lc两者之一的组件。
[0394]
技术人员会理解,取决于前体构建体的所期望的功能性,前体构建体可以包括不同的调节结构域。例如,三特异性前体构建体可以仅包含单个调节结构域,hlp结构域或cap结构域两者之一(分别参见图2c和2d)。
[0395]
在某些实施方式中,第一或第二结合结构域、或第一和第二结合结构域两者,或第一或第二子调节结构域、或第一和第二子调节结构域两者,或其组合直接连接至第三结合结构域(例如fab)的vh
‑
ch1或vl
‑
cl的各自末端(即,在其间没有添加另外的氨基酸)。在其他实施方式中,与第三结合结构域(例如fab)的连接包括使用如上所述的接头(具有如下所述的另外的氨基酸)。在一些实施方式中,可能需要从给定的第一或第二结合结构域或两者,和/或第一或第二子调节结构域或两者的c
‑
端缺失数个氨基酸(例如,1
‑
3个氨基酸或1
‑
10个氨基酸;例如,1、2、3、4、5、6、7、8、9或10个氨基酸),这取决于第三结合结构域靶标和细胞表面上的第一和第二结合结构域靶标的周围空间(即,例如,t细胞细胞表面上的cd3ε靶标的易接性)。
[0396]
在其他实施方式中,可能需要从第三结合结构域的重链和/或轻链的n
‑
端缺失数个氨基酸(例如,1
‑
3个氨基酸或1
‑
10个氨基酸;例如,1、2、3、4、5、6、7、8、9或10个氨基酸)。在仍进一步的实施方式中,可能需要从第一或第二结合结构域或两者的n
‑
端,和/或第一或第二子调节结构域或两者的c
‑
端缺失数个氨基酸(例如,1
‑
3个氨基酸或1
‑
10个氨基酸;例如,1、2、3、4、5、6、7、8、9或10个氨基酸),并同时从第三结合结构域链(vh
‑
ch1或vl
‑
cl)的从n
‑
端和/或c
‑
端缺失数个氨基酸(例如,1
‑
3个氨基酸或1
‑
10个氨基酸;例如,1、2、3、4、5、6、7、8、9或10个氨基酸)。第一或第二结合结构域和/或第一或第二子调节结构域与第三结合结构域vh
‑
ch1和vl
‑
cl链之间的连接的长度和序列可以相同或不同。
[0397]
第一或第二结合结构域或两者、和/或第一或第二子调节结构域或两者与第三结合结构域vh
‑
ch1和vl
‑
cl链之间的连接可以根据需要利用缺失和接头的组合。如本领域技术人员将理解的,第三结合结构域vh
‑
ch1和vl
‑
cl链与第一或第二结合结构域或两者和/或第一或第二子调节结构域或两者之间的连接可以使用本领域已知的和本文所述的方法被相应地调整并测试所期望的功能性(例如,结合亲和力、t细胞活性)。
[0398]
如本文所述,结构域之间或结构域内组件之间的连接包括接头。在一些实施方式中,结构域之间存在接头。在一些实施方式中,结构域之间没有接头。在一些实施方式中,构成结构域的组件之间存在接头。在一些实施方式中,构成结构域的组件之间不存在接头。
[0399]
图1和2a
‑
2d和2f图示了在本文公开的前体三特异性抗体构建体的实施方式中接头可以存在的位置。
[0400]
在一些实施方式中,第一或第二结合结构域或两者与第三结合结构域vh
‑
ch1或vl
‑
cl之间的接头的长度是1
‑
10个氨基酸。在其他实施方式中,第一或第二结合结构域或两者与第三结合结构域vh
‑
ch1或vl
‑
cl之间的接头的长度是1
‑
20或20个氨基酸。就此而言,接头的长度可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸。在进一步的实施方式中,接头的长度可以是21、22、23、24、25、26、27、28、29或30个氨基酸。
[0401]
在一些实施方式中,第一或第二子调节结构域或两者与第三结合结构域vh
‑
ch1或vl
‑
cl之间的接头的长度是1
‑
10个氨基酸。在其他实施方式中,第一或第二子调节结构域或两者与第三结合结构域vh
‑
ch1或vl
‑
cl之间的接头的长度是1
‑
20或20个氨基酸。就此而言,接头的长度可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸。在进一步的实施方式中,接头的长度可以是21、22、23、24、25、26、27、28、29或30个氨基酸。
[0402]
在一些实施方式中,第一或第二结合结构域或两者内的组件之间的接头的长度是1
‑
10个氨基酸。在其他实施方式中,第一或第二结合结构域或两者内的组件之间的接头的长度是1
‑
20或20个氨基酸。就此而言,组件之间的接头的长度可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸。在进一步的实施方式中,组件之间的接头的长度可以是21、22、23、24、25、26、27、28、29或30个氨基酸。
[0403]
在一些实施方式中,第一或第二子调节结构域或两者内的组件之间的接头的长度是1
‑
10个氨基酸,其中应理解不同组件之间的接头不需要具有相同的长度。在其他实施方式中,第一或第二子调节结构域或两者内的组件之间的接头的长度是1
‑
20或20个氨基酸,其中应理解不同组件之间的接头不需要具有相同的长度。就此而言,每组组件之间的接头的长度可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸。在进一步的实施方式中,每组组件之间的接头的长度可以是21、22、23、24、25、26、27、28、29或30个氨基酸。
[0404]
在一些实施方式中,在hc或lc fab多肽组件vh和ch1内的组件与多肽组件vl和cl内的组件之间分别存在接头。在一些实施方式中,接头的长度是1
‑
10个氨基酸,其中应当理解不同组件之间的接头不需要具有相同的长度。在其他实施方式中,第三结合结构域内的组件之间的接头的长度是1
‑
20或20个氨基酸,其中应当理解不同组件之间的接头不需要具有相同的长度。就此而言,每组组件之间的接头的长度可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸。在进一步的实施方式中,每组组件之间的接头的长度可以是21、22、23、24、25、26、27、28、29或30个氨基酸。
[0405]
在某些实施方式中,适用于本文所述的前体构建体的接头是柔性接头。可以容易地选择合适的接头并且可以具有任何合适的不同长度,例如从1个氨基酸(例如gly)到20个氨基酸、从2个氨基酸到15个氨基酸、从3个氨基酸到12个氨基酸氨基酸,包括4个氨基酸到10个氨基酸、5个氨基酸到9个氨基酸、6个氨基酸到8个氨基酸或7个氨基酸到8个氨基酸,可以是1、2、3、4、5、6或7个氨基酸。
[0406]
在一些实施方式中,柔性接头包括甘氨酸聚合物(g)n、甘氨酸
‑
丝氨酸聚合物(包括例如(gs)n、(gsggs)n(seq id no:119)和(gggs)n(seq id no:120),其中n是至少1的整数)、甘氨酸
‑
丙氨酸聚合物、丙氨酸
‑
丝氨酸聚合物和本领域已知的其他柔性接头。甘氨酸和甘氨酸
‑
丝氨酸聚合物是相对非结构化的,因此可能能够作为组件之间的中性系链。甘氨酸比丙氨酸显著更接近phi
‑
psi空间,并且比具有更长侧链的残基的限制要少得多(参见scheraga,rev.computational chem.11173
‑
142(1992))。在一些实施方式中,柔性接头包括但不限于gly
‑
gly
‑
ser
‑
gly(ggsg;seq id no:121)、gly
‑
gly
‑
ser
‑
gly
‑
gly(ggsgg;seq id no:122)、gly
‑
ser
‑
gly
‑
ser
‑
gly(gsgsg;seq id no:123)、gly
‑
ser
‑
gly
‑
gly
‑
gly(gsggg;seq id no:124)、gly
‑
gly
‑
gly
‑
ser
‑
gly(gggsg;seq id no:125)、gly
‑
ser
‑
ser
‑
ser
‑
gly(gsssg;seq id no:126)等。普通技术人员将认识到前体三特异性抗体构建体的设计可包括全部或部分柔性的接头,使得接头可包括柔性接头以及一种或多种赋予较低柔性结构的部分以提供期望的前体三特异性抗体构建体结构。
[0407]
在一些实施方式中,前体构建体中使用的柔性接头包括本领域已知的任何柔性接头。在一些实施方式中,柔性接头包括柔性非结构化接头。至少在以下中描述了本领域已知的接头:chengcheng liu,ju xin chin,dong
‑
yup lee;synlinker:an integrated system for designing linkers and synthetic fusion proteins,bioinformatics,volume 31,issue 22,15 november 2015,pages 3700
–
3702;fusion protein linkers:property,design and functionality chen x et al,adv drug deliv rev.2013 oct;65(10):1357
‑
69;the linker data base provided by the centre for integrative bioinformatics vrije universiteit amsterdam(http://www.ibi.vu.nl/programs/linkerdbwww);和剑桥晶体数据中心(the cambridge crystallographic data centre)提供的csd接头数据库(linker database)(https://www.ccdc.cam.ac.uk/solutions/partnersoftware/csdlinkerdatabase/)。
[0408]
在某些实施方式中,第三结合结构域和第一或第二结合结构域或两者、或第一或第二子调节结构域或两者(结合与调节结构域)之间的接头是稳定接头(不可被蛋白酶具体是mmp切割)。在某些实施方式中,接头是肽接头。
[0409]
在一些实施方式中,第三结合结构域vh
‑
ch1或vl
‑
cl链与第一或第二子调节结构域或两者之间的接头包含蛋白酶底物切割序列,例如mmp底物切割序列。在一些实施方式中,第三结合结构域vh
‑
ch1或vl
‑
cl链与第一或第二子调节结构域或两者之间的接头包含蛋白酶底物切割序列,例如mmp2/9、upa、蛋白裂解酶和天冬酰胺内肽酶底物切割序列。底物中seq id no:9的肽序列可以被大多数mmp切割。底物中seq id no:35的肽序列可以被mmp2/9、upa、蛋白裂解酶和天冬酰胺内肽酶切割。
[0410]
蛋白酶底物切割序列是指可以被蛋白酶处理而切割的肽序列。mmp底物序列是指可以通过与mmp一起温育而被切割的肽序列。seq id no:9是常用的mmp底物切割序列(参见
例如,jiang,pnas(2004)101:17867
‑
72;olson,pnas(2010)107:4311
‑
6)。在另一个实施方式中,蛋白酶切割位点被mmp
‑
2、mmp
‑
9或其组合识别。在仍一个实施方式中,蛋白酶位点包含选自(seq id no:9、seq id no:10、seq id no:11和seq id no:35)的序列。在进一步的实施方式中,蛋白酶位点包含在seq id no:35中叙述的序列。
[0411]
在一些实施方式中,所有蛋白酶位点包含相同的蛋白水解序列。在其他实施方式中,前体构建体的蛋白酶位点不同。前体构建体内蛋白水解序列的差异可以提供对前体或部分活化构建体的功能的另外的调节。
[0412]
稳定的接头或蛋白酶不可切割的接头是指不属于已知蛋白酶底物序列的接头肽序列,和因此在与蛋白酶一起温育时不会导致显著的切割产物形成。
[0413]
在一些实施方式中,接头的切割底物(或切割序列或蛋白酶切割结构域)可包括可用作蛋白酶(通常为细胞外蛋白酶)的底物的氨基酸序列。在其他实施方式中,切割序列包含能够形成二硫键的半胱氨酸
‑
半胱氨酸对,其可以通过还原剂的作用被切割。在其他实施方式中,切割序列包含能够在光解时被切割的底物。
[0414]
切割底物位于接头中,使得当切割底物被切割剂(例如,接头的切割底物被蛋白酶切割和/或半胱氨酸
‑
半胱氨酸二硫键通过暴露于还原剂经由还原被破坏)或通过光诱导的光解切割时,在靶标存在下,产生具有如本文所述的多种功能性质的切割产物。
[0415]
接头的切割底物可以基于共定位于患病组织中或表达融合部分的结合结构域的感兴趣靶抗原的细胞表面上的蛋白酶来选择。已知多种不同病症,其中感兴趣靶标与蛋白酶共定位,其中蛋白酶的底物是本领域已知的。在癌症的实例中,靶组织可以是癌组织,具体是实体瘤的癌组织。文献中报道了在许多癌症(例如实体瘤)中具有已知底物的蛋白酶水平增加(参见,例如,la rocca等人,(2004)british j.of cancer 90(7):1414
‑
1421)。疾病的非限制性实例包括:所有类型的癌症(乳腺癌、肺癌、结肠直肠癌、前列腺癌、头颈癌、胰腺癌等)、类风湿性关节炎、克罗恩病、黑素瘤、sle、心血管损伤、局部缺血等。此外,抗
‑
血管生成靶标,例如vegf,是已知的。因此,在选择本公开内容的前体三特异性抗体构建体的融合部分的结合结构域以使其能够结合taa时,蛋白酶可切割的接头的合适切割底物序列将是包含肽底物的切割底物序列,该肽底物可被存在于癌性治疗部位特别是与非癌性组织相比以升高的水平存在于癌治疗部位的蛋白酶切割。
[0416]
在一些实施方式中,前体三特异性抗体构建体的第一或第二结合结构域或两者可以结合例如her2,并且切割底物序列可以是基质金属蛋白酶(mmp)底物,因此可被mmp切割。在其他实施方式中,前体三特异性抗体构建体中融合部分的第一或第二结合结构域或两者可以结合感兴趣靶标或两种感兴趣靶标,并且在接头中存在的切割底物可以是,例如,天冬酰胺内肽酶、纤维蛋白溶酶、tmprss
‑
3/4、mmp
‑
9、mt1
‑
mmp、组织蛋白酶、胱天蛋白酶、人中性粒细胞弹性蛋白酶、β
‑
分泌酶、upa或psa。在其他实施方式中,前体三特异性抗体构建体中融合部分的第一或第二结合结构域或两者可以结合感兴趣靶标或两种感兴趣靶标,并且在接头中存在的切割底物可以是,例如,mmp2/9、天冬酰胺内肽酶、upa和蛋白裂解酶的组合。在一些实施方式中,前体三特异性抗体构建体中融合部分的第一或第二结合结构域或两者可结合感兴趣靶标或两种感兴趣靶标,并且在接头中存在的切割底物包含mmp2/9、天冬酰胺内肽酶、upa和蛋白裂解酶的组合,如seq id no:35所示。在其他实施方式中,在癌症以外的疾病例如多发性硬化或类风湿性关节炎中,切割底物被其他疾病特异性蛋白酶切割。
[0417]
未修饰或未切割的接头可允许系留(tether)结合结构域(第一、第二或第三,或其组合)和调节结构域(第一或第二,或两者)。
[0418]
前体三特异性抗体构建体的接头(例如,第三结合结构域的ch1或cl与第一或第二结合结构域或两者之间的接头,以及第三结合结构域的vh或vl与第一或第二子调节结构域或两者之间的接头,可包含相同的切割底物或可包含不同的切割底物,例如,第一接头可包含第一切割底物和第二接头可包含第二切割底物等。切割底物可以是相同酶的不同底物(例如对酶表现出不同的结合亲和力),或不同酶的不同底物,或者切割底物之一可以是酶底物而切割底物的另一种可以是光解底物,或切割底物的另一种可以是用于还原的底物,或其任何组合。
[0419]
在一些实施方式中,一些接头可以是不可切割的,而其他接头是可切割的接头。例如但不限于fab ch1和cl与第一和第二结合结构域之间的接头是不可切割的,而fab vh和vl与第一和第二子调节结构域之间的接头是可切割的。技术人员会理解,接头的组合数量有限,并且在一些实施方式中,每个接头可以是可切割的或不可切割的。因此,在一些实施方式中,第三结合结构域与第一或第二子调节结构域或两者之间的接头是可切割的,而第三结合结构域与第一或第二结合结构域或两者之间的接头不可切割的。
[0420]
对于酶的特异性切割,在酶和切割底物之间进行接触。当前体三特异性抗体构建体存在于包含足够酶活性的微环境中时,切割底物可被切割。足够的酶活性可以指酶与具有切割底物的接头接触并实现切割的能力。很容易想象,酶可能在前体三特异性抗体构建体附近,但由于其他细胞因素或酶的蛋白质修饰而不能切割。
[0421]
在一些实施方式中,底物可包括但不限于可被一种或多种以下酶或蛋白酶切割的底物:adam10;胱天蛋白酶8、组织蛋白酶s、mmp 8、adam12、胱天蛋白酶9、fap、mmp 9、adam17、胱天蛋白酶10、颗粒酶b、mmp
‑
13、adamts、胱天蛋白酶11、胍基苯甲酸酶(gb)、mmp 14、adamts5、胱天蛋白酶12、hepsin、mt
‑
sp1、bace、胱天蛋白酶13、人中性粒细胞弹性蛋白酶脑啡肽酶(hne)、胱天蛋白酶、胱天蛋白酶14、天冬酰胺内肽酶、ns3/4a、胱天蛋白酶1、组织蛋白酶、蛋白裂解酶2、纤维蛋白溶酶、胱天蛋白酶2、组织蛋白酶a、穿膜肽酶、psa、胱天蛋白酶3、组织蛋白酶b、mmp 1、psma、胱天蛋白酶4、组织蛋白酶d、mmp 2、tace、胱天蛋白酶5、组织蛋白酶e、mmp 3、tmprss 3/4、胱天蛋白酶6、组织蛋白酶k、mmp 7、upa、胱天蛋白酶7、蛋白裂解酶(mt
‑
sp1、tadg
‑
15、epithin、st14)和mt1
‑
mmp。
[0422]
在其他实施方式中,切割底物可涉及半胱氨酸对的二硫键,其因此可被还原剂切割,例如但不限于细胞还原剂,例如谷胱甘肽(gsh)、硫氧还蛋白、nadph、黄素、抗坏血酸等,它们可以大量存在于实体瘤的组织中或实体瘤周围。
[0423]
用于本文的可切割的接头的其他合适的蛋白酶切割位点是本领域已知的,或者可以使用例如由turk等人,2001nature biotechnology 19,661
‑
667描述的方法标识。
[0424]
在某些实施方式中,接头可以是肽接头、含硫醇残基的肽接头例如半胱氨酸残基、聚合物接头或化学接头。在某些实施方式中,前体三特异性抗体构建体包含接头,其中接头的一端共价连接至第一或第二结合结构域或两者的融合部分的n
‑
端,且接头的另一端共价连接到第三结合结构域的ch1或cl的c
‑
端。
[0425]
在一些实施方式中,结构域之间或结构域内的组件之间仅存在一个或几个氨基酸。在某些实施方式中,前体三特异性抗体构建体的两种结构域之间,例如结合结构域和接
头多肽之间,可以存在一个或几个氨基酸残基,例如由前体构建体的构建体设计产生的氨基酸残基(例如,在构建编码多肽链(多肽a和多肽b)的核酸分子期间使用限制酶位点产生的氨基酸残基)。如本文所述,此类氨基酸残基可称为“连接氨基酸”或“连接氨基酸残基”,或“肽接头”。
[0426]
在某些说明性实施方式中,肽接头是1至5个氨基酸之间、5至10个氨基酸之间、5至25个氨基酸之间、5至50个氨基酸之间、10至25个氨基酸之间、10至50个氨基酸之间、10至100个氨基酸或任何介于其间的氨基酸范围。在其他说明性实施方式中,肽接头的长度包含约1、5、10、15、20、25、30、35、40、45、50或更多个氨基酸。
[0427]
此类连接氨基酸连接前体三特异性抗体构建体的任意的结构域或结构域内的组件。在某些实施方式中,一种或多种连接氨基酸是如本文定义的铰链或铰链的一部分。在某些实施方式中,可用于将重链可变区连接到轻链可变区的可变区连接序列可用作肽接头。
[0428]
在一个说明性的实施方式中,肽接头序列包含例如gly、asn和ser残基。其他接近中性的氨基酸,例如thr和ala,也可以包括在接头序列中。
[0429]
可用作接头的其他氨基酸序列包括在maratea等人gene 40:39 46(1985);murphy等人,proc.natl.acad.sci.usa 83:8258 8262(1986);美国专利号4,935,233和美国专利号4,751,180中公开的那些中,在此以其整体并入本文。
[0430]
其他示例性接头可以包括,例如,glu
‑
gly
‑
lys
‑
ser
‑
ser
‑
gly
‑
ser
‑
gly
‑
ser
‑
glu
‑
ser
‑
lys
‑
val
‑
asp(egkssgsgseskvd;seq id no:127)(chaudhary等人,1990,proc.natl.acad.sci.u.s.a.87:1066
‑
1070)和lys
‑
glu
‑
ser
‑
gly
‑
ser
‑
val
‑
ser
‑
ser
‑
glu
‑
gln
‑
leu
‑
ala
‑
gln
‑
phe
‑
arg
‑
ser
‑
leu
‑
asp(kesgsvsseqlaqfrsld;seq id no:128)(bird等人,1988,science 242:423
‑
426)。
[0431]
在一些实施方式中,当hc和lc多肽(多肽a和b)具有可用于分隔功能结构域和防止空间干扰的非必需n
‑
端氨基酸区时,不需要接头序列。本公开内容的前体三特异性抗体构建体的编码序列或结构域可以在没有任何连接氨基酸的情况下直接融合或通过使用由例如重复1至3次的五聚体gly
‑
gly
‑
gly
‑
gly
‑
ser(ggggs;seq id no:129)组成的柔性多接头。通过插入vh和vl之间,这样的接头已用于构建单链抗体(scfv)(bird等人,1988,science 242:423
‑
426;huston等人,1988,proc.natl.acad.sci.u.s.a.85:5979
‑
5883)。
[0432]
在某些实施方式中,肽接头被设计成能够实现在形成单链抗体可变区的两个β
‑
折叠之间的正确相互作用。可以使用任何合适的接头来形成间接连接,例如但不限于肽接头、聚合物接头和化学接头。在某些实施方式中,共价连接是通过肽接头的间接连接。
[0433]
如本文所述,前体三特异性抗体构建体的区别特征是前体构建体不依赖空间阻碍来降低或抑制第三结合结构域的结合亲和力。在本文所述的前体构建体的情况下,结合亲和力的降低或抑制是由于前体构建体的cap组件与第三结合结构域之间的特异性结合。相反,us2012/0321626中描述的蛋白质仅依赖于降低特异性的三维结构,其中多肽可能形成也可能不形成这种三维结构,因此它们对降低或抑制与第二结合区的抗体靶标的结合缺乏任何特异性。与包括掩膜的其他多特异性或三特异性抗体相比的进一步区别特征是前体三特异性抗体构建体对与第三结合结构域的靶标结合的降低或抑制也可以被暂时控制,其中当前体构建体在体内循环中或在非肿瘤微环境中时,可以维持与第三结合结构域的靶标结合的降低或抑制。这可以降低由于使用缺乏这种时间调节的多特异性或双特异性抗体引起
的不良副作用。
[0434]
在一些实施方式中,本公开内容的前体三特异性抗体构建体包含含有在seq id no:130中叙述的氨基酸序列或其同源物的多肽a(hc多肽);和含有在seq id no:131中叙述的氨基酸序列的多肽b(lc多肽)。在一些实施方式中,本公开内容的前体三特异性抗体构建体包含含有在seq id no:132中叙述的氨基酸序列或其同源物的多肽a(hc多肽);和含有在seq id no:133中叙述的氨基酸序列的多肽b(lc多肽)。
[0435]
在一些实施方式中,本公开内容的前体三特异性抗体构建体包含由seq id no:142中叙述的核苷酸序列或其同源物编码的多肽a(hc多肽);和包含由seq id no:143中叙述的核苷酸序列编码的多肽b(lc多肽)。在一些实施方式中,本公开内容的前体三特异性抗体构建体包含由seq id no:144中叙述的核苷酸序列或其同源物编码的多肽a(hc多肽);和包含由seq id no:145中叙述的核苷酸序列编码的多肽b(lc多肽)。
[0436]
前体三特异性抗体构建体的功能性
[0437]
在一些实施方式中,本文公开的前体三特异性抗体构建体具有许多独特的特征并且这些特征可用于开发在药物安全性、功效和可制造性方面具有所期望属性的人治疗剂。在一些实施方式中,本公开内容的前体三特异性抗体构建体包含结合细胞表面肿瘤相关抗原(taa)的第一和第二结合结构域、结合人cd3ε的细胞外表位的第三结合结构域和两个调节结构域,其具有许多独特的特征,这些特征可用于开发在药物安全性、功效和可制造性方面具有期望属性的人治疗剂。这些特征已经在上面详细描述并且在此不必重复。本领域技术人员将理解如下文所述的用途,包括如上所述的前体三特异性抗体构建体的许多实施方式的用途。
[0438]
如本文所述,可以在本公开内容的前体三特异性抗体构建体有利地使用包括可调节延长的半衰期、t细胞结合的调节性降低(t细胞活化的降低)或其组合的前体构建体性质以掩蔽t细胞结合,直到前体三特异性抗体构建体处于合适的微环境中(例如,在肿瘤附近)。在一些实施方式中,药物组合物包含如本文所述的前体三特异性抗体构建体和药学上可接受的载体。
[0439]
技术人员会认识到,在一些实施方式中,术语“前体三特异性抗体构建体”可以与术语“药物”互换使用,都具有相同含义和性质。在一些实施方式中,包含前体三特异性抗体构建体的药物包含药物组合物。
[0440]
在一些实施方式中,本文公开的前体三特异性抗体包含结合taa的第一和第二结合结构域、结合人cd3ε的细胞外表位的第三结合结构域和两个调节结构域。前体三特异性抗体提供了全文中所述的独特性质,所述前体三特异性抗体包含结合taa的第一和第二结合结构域、结合人cd3ε的细胞外表位的第三结合结构域和两个调节结构域,该调节结构域包含例如包含蛋白酶可切割结构域的可切割和人血清白蛋白(hsa)多肽的半衰期延长结构域(第一子调节结构域),和包含蛋白酶可切割结构域和cap区的可切割的掩蔽结构域(第二子调节结构域)。
[0441]
本公开的前体三特异性抗体构建体起到增强药物稳定性、特异性、选择性、效价和安全性以及药物施用便利性的作用。在某些实施方式中,当第三结合结构域在表达时——不具有与其n
‑
端(vh或vl链)融合并包含cap区的调节结构域的情况下,其能够以可溶重组形式(通常是受体蛋白的胞外结构域,例如t细胞受体组件,如cd3)以及在细胞表面上结合
其靶抗原。在某些实施方式中,当第三结合结构域在表达时——具有与其n
‑
端(vl或vh链)融合并包含cap区的调节结构域以及与c
‑
端(cl或ch1链)融合的第一和第二结合结构域的情况下,与存在于缺乏包含cap区的调节结构域的构建体中的第三结合结构域相比,在药物的药理学浓度(已处理的患者中多肽的浓度)下,第三结合结构域与在t细胞表面上呈递的其特异性抗原没有结合或结合降低。在不存在由第三结合结构域结合靶抗原的情况下,缺乏与t细胞表面抗原的结合或大大降低的结合可以由cap组件特异性阻断抗原结合位点导致的亲和力明显降低来解释。
[0442]
在没有第一或第二结合结构域或两者结合的taa靶抗原的情况下,缺乏与细胞表面抗原(例如t细胞上的抗原)的结合或大大降低的结合可被视为使用前体三特异性抗体构建体作为人治疗剂的期望性质。重要的是要注意,单独的前体三特异性抗体构建体(在没有肿瘤靶细胞的情况下)与例如t细胞的结合缺乏或显著降低的结合可以,1)明显改进不期望的全身性t细胞活化,从而明显改进药物安全性情况;2)明显改进皮下药物施用途径的可行性;3)明显提高血液循环中高药物浓度的药物耐受性。进一步的,由包含前体构建体的半衰期延长组件(例如,hsa多肽)的第二调节结构域提供的可调节的时间调节可确保前体构建体在循环中的延长存在,直到药物存在于taa靶细胞的环境(例如,肿瘤靶细胞微环境)时。
[0443]
需要注意的是,抗体(如okt3或ucht
‑
1)经由构象表位的t细胞结合可能会转导部分信号传导,导致不需要的t细胞活化(引起细胞因子风暴)或t细胞无反应性(导致t
‑
细胞不能杀死肿瘤细胞)。可以想象,在没有cd3交联的情况下,mu
‑
1f3、hu
‑
1f3及其结合cd3线性表位的变体不太可能诱导t细胞信号传导。这种性质可能有利于降低当使用okt3和ucht
‑
1样抗体时出现的全身性副作用。
[0444]
还重要的是注意到,一旦前体三特异性抗体构建体中包含cap区的调节结构域或其包含cap区的部分被蛋白酶切割,其功能使得在第三抗原结合位点处(例如,cd3ε结合位点)的特异性结合抑制被去除,使得它随后能够以高亲和力结合其靶标,特别是在细胞表面上表达的靶抗原。因此,在蛋白酶可切割的接头中的切割底物序列处切割后(从而释放包含cap区的调节结构域并释放包含hlp的调节结构域),前体三特异性抗体构建体被转化为更有效的肿瘤和t细胞之间的交联接头(图3a和3b)。在一些实施方式中,包含hlp的调节结构域未被切割,但前体构建体被转化为肿瘤和t细胞之间更有效的交联接头。
[0445]
类似地,一旦包含能够与前体三特异性抗体构建体中的第一或第二结合区缔合的cap区的调节结构域被蛋白酶切割,其功能使得在第一或第二抗原结合位点处的特异性结合抑制被去除,使得它能够以高亲和力与其靶标结合。
[0446]
此外,重要的是要注意,一旦taa第一或第二结合结构域或两者结合到其靶抗原,则前体三特异性抗体构建体分子就会高度集中在肿瘤细胞表面,以产生基于高抗体亲抗原性与t细胞上的第三结合结构域靶标(例如cd3)的结合。因此,只有在taa第一或第二结合结构域或两者都存在的情况下,第三抗原结合结构域才能够结合其靶标,用于使前体三特异性抗体构建体作为肿瘤和t细胞之间的交联接头发挥作用。
[0447]
本公开内容的前体三特异性抗体构建体的性质允许在循环中相对高剂量的前体三特异性抗体构建体持续增强的时间段,而没有不想要的副作用(例如,前体三特异性抗体构建体在循环中不与第三结合结构域靶抗原(例如,cd3)结合)。这也允许降低给药频率并通过浓度梯度驱动的扩散促进组织渗透。
[0448]
本公开内容的前体三特异性抗体构建体的性质还允许皮下施用的潜力,这可以增强接近靶标。进一步的,尽管在某些实施方式中,前体三特异性抗体构建体在没有蛋白酶处理的情况下允许交联,但在某些实施方式中,在蛋白酶处理后,结合活性和肿瘤杀伤效价明显提高。
[0449]
在一个实施方式中,由vh和vl形成的第三结合结构域抗原结合结构域通过chl和cl异二聚化结构域稳定,并通过chl和cl之间的二硫键或其他稳定相互作用(例如,杵/臼相互作用)进一步稳定。
[0450]
在一些实施方式中,前体三特异性抗体构建体中的第三结合结构域被cap调节结构域在其n
‑
端特异性阻断,使得与第三结合结构域靶抗原的结合(具体是当涉及细胞表面靶抗原时)以统计学上显著的方式(即,相对于本领域技术人员已知的适当对照;例如,与不具有在其n
‑
端(vh和vl两者之一)包含cap组件的调节结构域的形式的相同第三结合结构域相比)被特异性降低或抑制。在进一步的实施方式中,前体三特异性抗体构建体中的第三结合结构域被特异性阻断,从而与不具有在其n
‑
端(vh和vl两者之一)包含cap组件的调节结构域的形式的相同的第三结合结构域相比,与所期望抗原的结合(具体是当涉及细胞表面靶抗原时)降低至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍、15倍、20倍、30倍、或100倍、或1000倍、或10000倍。
[0451]
在某些实施方式中,前体构建体中第三结合结构域(例如,cd3ε抗原结合结构域)的亲和力低于500nm。在进一步的实施方式中,前体构建体的第三结合结构域抗原结合的亲和力证明没有显著的可检测结合,如使用facs或其他结合测量方法(例如,细胞结合elisa)在人中使用的治疗剂的浓度范围下测量的。在一个实施方式中,少于1%的靶细胞群(例如,cd3 细胞)将被治疗浓度(这是在不存在肿瘤细胞微环境的情况下)的前体构建体的第三结合结构域结合。在一个实施方式中,少于5%的靶细胞群将被治疗浓度的前体三特异性抗体构建体结合。在仍另一个实施方式中,少于10%的靶细胞群将被治疗浓度的前体三特异性抗体构建体结合。
[0452]
存在于肿瘤组织(肿瘤微环境)中的蛋白酶,具体是mmp水平升高,将在蛋白酶可切割的接头的mmp底物切割位点处生成切割产物。因为接头的蛋白酶底物序列的切割导致可以在第三结合结构域抗原结合区处被结合的cap组件释放,与第三结合结构域细胞表面靶标的结合将完全恢复或至少部分恢复。可以使用facs、基于细胞的elisa)或技术人员已知的其他细胞结合技术来证明恢复的结合。
[0453]
技术人员会理解,与在第三结合结构域的n
‑
端存在的调节结构域的cap组件不存在的情况下的结合相比,术语“明显降低的亲和力”可包括第三结合结构域抗原结合结构域的结合降低至少30%。降低的百分比可以是,例如但不限于,30%、约40%、约50%、约60%、约70%、约80%、约90%或约99%或更大。检测结合的方法是技术人员已知的并且可以使用facs、细胞结合elisa或使用放射性同种型标记抗体的细胞结合来进行。
[0454]
用于如本文所述的本公开内容的前体三特异性抗体构建体中的第三结合结构域的实施方式是抗cd3ε结构域。在这方面,前体三特异性抗体构建体起作用使得当taa第一结合结构域或第二taa结合结构域或第一和第二结合结构域两者结合肿瘤相关抗原时,前体构建体存在于包括蛋白酶的肿瘤微环境中,其中可切割的调节结构域被切割,释放cap抗cd3ε结合组件,使得第三结合结构域现在能够与传递的t细胞的cd3ε结合,使得重定向t细
胞并活化它们以杀死肿瘤细胞或肿瘤相关细胞(图3b)。在另一个实施方式中,活化的三特异性抗体构建体(本文也称为活化的三特异性抗体构建体(图2e),其中第三结合结构域片段结合免疫效应物分子,例如cd3ε)可以当经由通过taa第一或第二结合结构域或两者结合的taa(例如,肿瘤抗原)在肿瘤细胞表面上聚簇时表现出抗体亲抗原性效应。因此,由于抗体亲抗原性,第三结合结构域对免疫细胞的明显结合可以提高。因此,活化的三特异性抗体构建体能够桥接免疫细胞和肿瘤细胞,从而介导抗肿瘤活性。另外地,与前体构建体相比,活化的tr特异性抗体构建体可能由于尺寸减小而具有改进的肿瘤渗透。
[0455]
在某些实施方式中,前体三特异性抗体构建体分别与taa或两种taa结合,而不与cd3ε结合,因此t细胞不会被活化。在一些实施方式中,这种与cd3ε抗原结合的缺乏可能是非肿瘤细胞上存在一种或多种taa的结果。在一些实施方式中,这种与cd3ε抗原结合的缺乏可能是非肿瘤微环境中细胞上存在一种或多种taa的结果。因此,在非肿瘤环境中和在某些实施方式中,与一种或多种taa结合的前体构建体可因此不能被活化(即,包含cap或其部分的调节结构域不会被切割)。这避免在非肿瘤细胞环境中活化t细胞的前体构建体可能发生的显著副作用和组织损伤。然而,在肿瘤微环境中,当cd3和肿瘤表面抗原同时结合到活化的三特异性抗体构建体,和当结合复合物的多个拷贝锚定并聚簇在肿瘤细胞表面时,t细胞在携带肿瘤表面抗原的癌细胞附近被活化,从而显著增强t细胞局部杀伤肿瘤的效率并避免由于细胞因子风暴引起的副作用。
[0456]
在某些实施方式中,为cd3ε的第三结合结构域抗原靶标和为细胞表面肿瘤相关抗原的第一或第二结合结构域抗原或两者的组合包含在前体构建体中,其由半衰期增强调节结构域进行时间调节,和活性由cap调节结构域调节,一旦前体构建体定位到肿瘤微环境中,它们的组合提供增强的t细胞杀伤肿瘤效果。在某些实施方式中,第三结合结构域抗原靶标和第一或第二结合结构域抗原靶标或两者的组合可以分别是fcγr和taa,一旦前体构建体被定位至肿瘤微环境,则其组合可以诱导表达fcγr的免疫细胞以杀死肿瘤细胞。
[0457]
因此,在一些实施方式中,本公开内容的前体三特异性抗体构建体包含结合tcr或其组件例如cd3多肽的第三结合结构域。如上所述,本公开内容的前体三特异性抗体构建体不结合第三结合结构域靶抗原,除非在接头切割事件之后,其中释放cap组件或不存在包含在前体构建体中的cap组件。
[0458]
因此,在某些实施方式中,本公开内容的前体三特异性抗体构建体在第三结合结构域处不存在靶抗原接合的情况下不活化t细胞。与在表达taa第一或第二结合结构域靶抗原的细胞(例如,合适的肿瘤细胞/细胞系;肿瘤微环境)的存在下t细胞的活化相比,如果前体三特异性抗体构建体不会导致活化t细胞百分比的统计学显著提高,则前体三特异性抗体构建体“不会或最低限度地或名义上活化t细胞”,如在至少一种体外或体内测定中所测定的。此类测定是本领域已知的并且包括但不限于增殖测定、ctl铬释放测定(参见例如,lavie等人,(2000)international immunology 12(4):479
‑
486)、elispot测定、细胞内细胞因子染色测定和如其他例如,current protocols in immunology,john wiley & sons,new york,ny(2009)中描述的其他测定。在某些实施方式中,使用体外引发的t细胞活化测定来测量t细胞活化。
[0459]
因此,在相关方面,本公开内容提供了检测由活化的前体三特异性抗体构建体诱导的t细胞活化的方法,所述前体三特异性抗体构建体包含特异性结合taa的第一或第二结
合结构域或两者,特异性结合tcr复合物的第三结合结构域和两个子调节结构域,其中在存在肿瘤微环境下的情况下,前体构建体被活化。在一些实施方式中,前体构建体的活化包括切割两个子调节结构域。在一些实施方式中,前体构建体的活化包括切割一个调节结构域。在一些实施方式中,前体构建体的活化包括切割包含cap组件的完整调节结构域。在一些实施方式中,前体构建体的活化包括切割调节结构域的部分,其中调节结构域的该部分包含cap组件。在一些实施方式中,前体构建体的活化包括切割包含hlp组件的完整调节结构域。在一些实施方式中,前体构建体的活化包括切割调节结构域的部分,其中调节结构域的该部分包含hlp组件。在一些实施方式中,前体构建体的活化包括切割两个调节结构域,一个包含cap组件和另一个包含hsa组件。
[0460]
在一些实施方式中,用于检测t细胞活化的方法包括(a)提供抗原或有丝分裂原触发的t细胞,(b)用包含特异性结合tcr复合物或其组件的第三结合结构域的前体三特异性抗体构建体处理步骤(a)的触发的t细胞(在暴露于肿瘤微环境并切割调节性cap结构域或其部分后),和(c)检测已在步骤(b)中处理的触发的t细胞的活化。
[0461]
如本文所用,术语“有丝分裂原”是指在不同特异性或克隆来源的淋巴细胞中诱导有丝分裂的化学物质。可用于触发t细胞的示例性有丝分裂原包括植物血凝素(pha)、伴刀豆球蛋白a(cona)、脂多糖(lps)、美洲商陆有丝分裂原(pwm)和乙酸肉豆蔻佛波醇(pma)。载有抗原的珠子或pbmc也可用于触发t细胞。
[0462]
在本文提供的用于检测t细胞活化的方法的某些实施方式中,包含与tcr复合物或其组件特异性结合的第三结合结构域的前体三特异性抗体构建体包含结合肿瘤相关抗原的第一和第二结合结构域或两者,或其中一个结合两个子调节结构域,其中一个提供增强的半衰期延长性质,和第二个提供t细胞结合特性的降低、t细胞活化性质的降低或其任何组合。在某些实施方式中,本文提供的用于检测t细胞活化的方法在肿瘤和非肿瘤微环境中进行。
[0463]
t细胞的活化可以通过测量本领域已知的活化标志物例如cd25、cd40配体和cd69的表达来检测。活化的t细胞也可以通过细胞增殖测定,例如cfse标记和胸苷摄取测定(adams(1969)exp.cell res.56:55)进行检测。t细胞效应物功能(例如,细胞杀伤)可以通过例如铬释放测定或使用荧光染料(例如tp3)的基于facs的测定来测量。在相关方面,t细胞活化和细胞溶解活性可以通过t细胞和肿瘤细胞之间的溶解突触形成来测量。可以在细胞溶解突触中检测效应物分子,如颗粒酶和穿孔素(porforin)。
[0464]
在另一个相关方面,t细胞活化可以通过细胞因子释放来测量。用于检测由前体三特异性抗体构建体——所述前体三特异性抗体构建体包含特异性结合tcr复合物或其组分的第三结合结构域——诱导的细胞因子释放的方法可以包括组件:(a)提供触发的t细胞,(b)用包含特异性结合tcr复合物或其组件的第三结合结构域的前体三特异性抗体构建体处理步骤(a)的触发的t细胞,(c)在肿瘤微环境中例如和与taa第一或第二结合结构域或两者的抗原靶标相关的肿瘤细胞一起温育前体构建体,和(d)检测细胞因子从已在步骤(b)中处理的触发的t细胞中的释放。在一些实施方式中,在存在或不存在表达靶肿瘤抗原的合适癌细胞或细胞系的情况下进行实验,该靶肿瘤抗原由前体三特异性抗体构建体的第一或第二结合结构域或两者中存在的结合结构域结合(步骤c)。
[0465]
在本文提供的检测细胞因子释放的方法的某些实施方式中,在存在或不存在表达
靶肿瘤抗原的合适癌细胞或细胞系的情况下进行包含特异性结合tcr复合物或其组件的第三结合结构域的前体三特异性抗体构建体,该把肿瘤抗原由前体三特异性抗体构建体的第一或第二结合结构域或两者中存在的结合结构域结合。
[0466]
在某些实施方式中,本公开内容的前体三特异性抗体构建体不诱导细胞因子风暴或不诱导足以诱导毒副作用的细胞因子释放。如果,在本领域已知或本文提供的至少一种体外或体内测定中,在不存在taa靶细胞或适当的接头切割剂(如蛋白酶)的情况下,前体三特异性抗体构建体不会导致至少一种细胞因子(包括ifnγ);在某些实施方式中,至少两种细胞因子(包括ifnγ和tnfα或il
‑
6和tnfα);在一个实施方式中,三种细胞因子(包括il
‑
6、ifnγ和tnfα);在另一个实施方式中,四种细胞因子(包括il
‑
2、il
‑
6、ifnγ和tnfα);在又一个实施方式中,至少五种细胞因子(包括il
‑
2、il
‑
6、il
‑
10、ifnγ和tnfα)(在不存在taa靶细胞(例如,适当的癌细胞系)或适当的接头切割剂的情况下从处理的细胞中释放,其与存在适当的taa靶细胞或接头切割剂的情况下从处理的细胞中释放相比较)的数量统计学上显著增加,则前体三特异性抗体构建体“不诱导细胞因子风暴”(也称为“诱导不可检测的、极少的或最小的细胞因子释放”或“不诱导或诱导最小可检测的细胞因子释放”)。临床上,细胞因子释放综合征的特点是发热、寒战、皮疹、恶心,有时会出现呼吸困难和心动过速,这与某些细胞因子的最大释放是平行的,例如ifnγ、il
‑
2、il
‑
6和肿瘤坏死因子α。可在体外测定或体内测试释放的细胞因子包括g
‑
csf、gm
‑
csf、il
‑
2、il
‑
4、il
‑
5、il
‑
6、il
‑
10、il
‑
13、il
‑
17、ip
‑
10、kc、mcp1、ifnγ和tnfα;并且在另一个实施方式中包括il
‑
2、il
‑
6、il
‑
10、ifnγ和tnfα。
[0467]
在进一步的实施方式中,本公开的前体三特异性抗体构建体引起细胞例如t细胞中钙通量的增加。如果在适当taa靶细胞(例如,癌细胞)或接头切割剂存在的情况下用于活化t细胞,与在不存在合适的taa靶细胞或接头切割剂的情况下处理的细胞相比,前体三特异性抗体构建体导致处理的细胞的钙通量统计学上显著的、快速的增加(在处理后的300秒内、或200秒内、或100秒内),如在本领域已知的或本文提供体外测量中测定的,则前体三特异性抗体构建体会导致“钙增加”[0468]
在进一步的实施方式中,本公开的前体三特异性抗体构建体诱导tcr信号转导途径中的分子的磷酸化。“tcr信号转导途径”是指通过肽:mhc配体与tcr及其共受体(cd4或cd8)的结合而启动的信号转导途径。“tcr信号转导途径中的分子”是指直接参与tcr信号转导途径的分子,例如其磷酸化状态(例如,无论该分子是否被磷酸化),其与另一分子的结合亲和力或其酶活性,响应于肽:mhc配体与tcr及其共受体结合的信号已发生改变的分子。tcr信号转导途径中的示例性分子包括tcr复合物或其组件(例如cd3链)、zap
‑
70、fyn、lck、磷脂酶c
‑
γ、蛋白激酶c、转录因子nf.κb、钙调磷酸酶、转录因子nfat、鸟嘌呤核苷酸交换因子(gef)、ras、map激酶激酶激酶(mapkkk)、map激酶激酶(mapkk)、map激酶(erk1/2)和fos。
[0469]
在本领域已知的体外或体内测定或受体信号传导测定中,如果本公开内容的前体三特异性抗体构建体仅在存在表达taa抗原的细胞(例如,表达被第一结合结构域结合的肿瘤抗原的癌细胞,或当taa存在于非肿瘤细胞上时,存在表达能够切割调节结构域的蛋白酶可切割结构域的肿瘤细胞)或接头切割剂的情况下,导致tcr信号转导途径中分子磷酸化的统计学上显著增加(例如cd3链、zap
‑
70和erk1/2),则前体三特异性抗体构建体“诱导tcr信号转导途径中的分子的磷酸化”。本领域已知的大多数受体信号传导测定的结果使用免疫
组织化学方法例如蛋白质印迹或荧光显微镜检查来确定。
[0470]
类似地,本公开的活化前体三特异性抗体构建体可在暴露于肿瘤细胞微环境或暴露于能够切割调节结构域(一个或多个)的蛋白酶可切割组件的一种或多种蛋白酶后诱导t细胞杀死taa靶细胞,例如支持肿瘤细胞生长和维持的肿瘤细胞或血管细胞。组件这种细胞杀伤可以使用本领域已知的多种测定法来测量,包括铬释放测定法。
[0471]
本公开的前体三特异性抗体构建体的特异性和功能可以通过将前体三特异性抗体构建体与合适的测试样品接触,并且在某些实施方式中用合适的蛋白酶处理前体三特异性抗体构建体(所述蛋白酶被认为对接头中的切割识别位点是特异性的),并且分析切割产物进行测试。蛋白酶可以是分离的,例如从癌细胞中分离,或者它们可以重组制备,例如遵循darket等人(j.biol.chem.254:2307
‑
2312(1988))的程序。切割产物可以例如基于大小、抗原性或活性来标识。前体三特异性抗体构建体的毒性可以通过对前体三特异性抗体构建体及其切割产物进行体外细胞毒性、增殖、结合或技术人员已知的其他适当测定来研究。切割产物的毒性可以使用核糖体灭活测定来确定(westby等人,bioconjugate chem.3:377
‑
382(1992))。切割产物对蛋白质合成的影响可以使用部分确定的无细胞系统在体外翻译的标准化测定中测量,该部分确定的无细胞系统由例如作为核糖体来源的网织红细胞裂解物和多种必需辅因子(如mrna模板和氨基酸)组成。在混合物中使用放射性标记的氨基酸允许对并入三氯乙酸可沉淀的蛋白质中的游离氨基酸前体进行定量。可以方便地使用兔网织红细胞裂解物(o'hare,febs lett.273:200
‑
204(1990))。
[0472]
可以使用癌细胞系、t细胞系或分离的pbmc或t细胞在体外容易地测试本文公开的活化前体三特异性抗体构建体破坏癌细胞和/或活化t细胞的能力。本公开的前体三特异性抗体构建体的效果可以通过例如通过癌细胞的选择性裂解证明来确定。此外,可以通过单独使用本公开内容的前体双特异性抗体构建体或在蛋白酶特异性抑制剂的存在下比较细胞增殖的抑制来测试蛋白酶特异性。此类蛋白酶抑制剂可包括mmp
‑
2/mmp
‑
9抑制剂gm1489、gm6001和gi
‑
1至gi
‑
iv。
[0473]
毒性也可以基于细胞活力来测量,例如可以比较暴露于前体三特异性抗体构建体的正常培养物和癌细胞培养物的活力。细胞活力可以通过已知技术来评估,例如台盼蓝排除测定。也可以基于细胞裂解来测量毒性,例如可以比较暴露于前体双特异性抗体构建体的正常培养物和癌细胞培养物的裂解。细胞裂解可以通过已知技术进行评估,例如铬(cr)释放测定或死细胞指示剂染料(碘化丙啶、to
‑
pro
‑
3碘化物)。
[0474]
前体双特异性抗体构建体组件
[0475]
本公开内容提供前体三特异性抗体构建体多肽。如上文详细描述的,在一些实施方式中,前体三特异性抗体构建体包含两种多肽:多肽a和多肽b。示例性的多肽和编码它们的多核苷酸在seq id no:131(多肽a的多肽序列)、132(多肽b的多肽序列)、143(编码多肽a的多核苷酸序列)和144(编码多肽b的多核苷酸序列)中提供。在一些实施方式中,示例性的多肽和编码它们的多核苷酸在seq id no:133(多肽a的多肽序列)、134(多肽b的多肽序列)、145(编码多肽a的多核苷酸序列)和146(编码多肽b的多核苷酸序列)中提供。
[0476]
本领域技术人员将理解术语“多肽”、“蛋白质”和“肽”和“糖蛋白”可互换使用并且包涵不限于任何特定长度的氨基酸聚合物。该术语不排除修饰,例如十四烷基化、硫酸化、糖基化、磷酸化以及信号序列的添加或缺失。术语“多肽”或“蛋白质”可包括一条或多条氨
基酸链,其中每条链包含通过肽键共价连接的氨基酸,并且其中所述多肽或蛋白质可包含通过肽键非共价和/或共价连接在一起的多条链,具有天然蛋白质的序列(即由天然存在的和特别是非重组细胞或基因改造或重组细胞产生的蛋白质),并且包含具有天然蛋白质氨基酸序列的分子,或具有来自天然序列的一种或多种氨基酸的缺失、添加和/或取代的分子。术语“多肽”和“蛋白质”可以包括本公开内容的前体三特异性抗体构建体的多肽a或多肽b及其异源二聚体,或具有如本文公开内容的前体双特异性抗体构建体的一个或多个氨基酸的缺失、添加和/或取代的序列。因此,“多肽”或“蛋白质”可以包含氨基酸链的一条链(称为“单体”)或多条链(称为“多聚体”)。
[0477]
本文所指的术语“分离的蛋白质”包括主题蛋白质(1)不含在自然界中通常与其一起发现的至少一些其他蛋白质,(2)基本上不含来自相同来源,例如,来自同一物种的其他蛋白质,(3)由来自不同物种的细胞表达,(4)已与至少约50%的多核苷酸、脂质、碳水化合物或在自然界中与之相关的其他材料分离,(5)与“分离的蛋白质”在自然界中缔合的蛋白质部分不缔合(通过共价或非共价相互作用),(6)与自然界中不与之缔合的多肽可操作地缔合(通过共价或非共价相互作用),或(7)在自然界中不存在。这种分离的蛋白质可以由基因组dna、cdna、mrna或其他rna编码,可以是合成来源的,或其任何组合。在某些实施方式中,分离的蛋白质基本上不含在其自然环境中发现的会干扰其使用(治疗、诊断、预防、研究或其他)的蛋白质或多肽或其他污染物。
[0478]
术语“多肽片段”包括多肽,其可以是单体或多聚体,具有天然存在或重组产生的多肽的氨基端缺失、羧基端缺失和/或内部缺失或取代。在某些实施方式中,多肽片段可包含长度为至少5个至约500个氨基酸的氨基酸链。应当理解,在某些实施方式中,片段的长度是至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、55、60、65、70、75、80、85、90、95、100、110、150、200、250、300、350、400或450个氨基酸长度。具体有用的多肽片段包括功能结构域,该功能结构域包括抗原结合结构域或抗体片段。在抗cd3或其他抗体的情况下,有用的片段包括但不限于:cdr区,具体是重链或轻链的cdr3区;重链或轻链的可变区;抗体链的一部分或仅包括两个cdr的其可变区;等等。
[0479]
多肽可以在蛋白质的n
‑
端包含信号(或前导)序列,其在共翻译或翻译后指导蛋白质的转移。多肽也可以与接头或其他序列进行框内融合或缀合以易于合成、纯化或标识多肽(例如,聚组氨酸),或增强多肽与固体支撑物的结合。
[0480]
考虑了本文所述的前体三特异性抗体构建体的氨基酸序列修饰(一种或多种)。例如,可能期望改进前体三特异性抗体构建体的结合亲和力和/或其他生物学特性。例如,可以通过将适当的核苷酸变化引入编码前体三特异性抗体构建体多肽或其结构域的多核苷酸中,或通过肽合成来制备接头序列或其结合结构域或其调节组件(一种或多种)的氨基酸序列变体。此类修饰包括,例如,前体三特异性抗体构建体多肽的氨基酸序列内的残基的缺失和/或插入和/或取代。可以进行缺失、插入和取代的任何组合以获得最终的前体三特异性抗体构建体多肽,前提是最终构建体具有所期望的特征,例如通过第一或第二结合结构域或两者或第三结合结构域特异性结合感兴趣靶抗原、或通过包含在调节结构域中的hsa多肽增强的半衰期、或通过包含cap组件的调节结构域特异性结合第三结合结构域、或通过一种或多种蛋白酶切割结构域(接头)的蛋白酶切割。氨基酸变化还可以改变前体三特异性
抗体构建体多肽的翻译后过程,例如改变糖基化位点的数量或位置。针对本文公开的多肽的上述任何变化和修饰可包括在本文呈现的前体三特异性抗体构建体中。
[0481]
本公开提供了本文公开的前体三特异性抗体构建体多肽的变体。在某些实施方式中,此类变体前体三特异性抗体构建体多肽包含变体结合结构域或其片段、或抗原结合片段、或taa结合片段、或结合结构域的cdr,结合感兴趣靶标至少约50%、至少约70%,在某些实施方式中至少约90%,以及给定的参考或野生型序列,包括本文具体叙述的任何此类序列。在进一步的实施方式中,此类变体以比本文所述的参考序列或野生型序列更高的亲和力结合靶抗原(例如定量结合至少约105%、106%、107%、108%、109%或110%)以及本文具体叙述的参考序列。在某些实施方式中,此类变体前体三特异性抗体构建体多肽包含变体调节结构域或其片段、或hsa组件、或cap组件或其片段,其中所述变体具有至少约50%、至少约70%和在某些实施方式中至少约90%的参考或野生型调节结构域或组件的活性,包括本文具体叙述的任何此类序列。
[0482]
在某些实施方式中,本公开提供了本文公开的前体三特异性抗体构建体或其多肽的变体,其中此类变体包含关于vh和vl链之间的二硫键已被修饰的第三结合结构域。本领域技术人员将认识到,在某些实施方式中,在本文所述的前体三特异性抗体构建体中使用的在一些实施方式中包含fab片段的第三结合结构域可以不包含二硫键。在这方面,重链和轻链可以以这样的方式改造,以便在不需要二硫键的情况下稳定地相互作用。例如,在某些实施方式中,重链或轻链可以被改造以去除半胱氨酸残基并且其中重链和轻链仍然稳定地相互作用并作为结合结构域发挥作用,例如fab片段。在一些实施方式中,进行突变以促进重链和轻链之间的稳定相互作用。例如,“杵臼结构”改造策略可用于促进fab第二结合结构域的重链和轻链之间的二聚化(参见例如,1996protein engineering,9:617
‑
621)。因此,还考虑本文使用的是设计用于特定目的(例如去除二硫键、添加标签用于纯化等)的第三结合结构域(例如fab片段)的变体氨基酸序列。
[0483]
在具体实施方式中,主题前体三特异性抗体构建体多肽可具有:与本文所述的前体三特异性抗体构建体多肽至少80%同一性、至少95%同一性、至少90%同一性、至少95%同一性或至少98%同一性或99%同一性的氨基酸序列。
[0484]
代表性多肽的三维结构的确定可以通过常规方法进行,使得用选定的天然或非天然氨基酸进行一个或多个氨基酸的取代、添加、缺失或插入可以虚拟建模,目的是确定如此衍生的结构变体是否保留本文公开种类的空间填充性质。例如,参见donate等人,1994 prot.sci.3:2378;bradley等人,science 309:1868
‑
1871(2005);schueler
‑
furman等人,science 310:638(2005);dietz等人,proc.nat.acad.sci.usa 103:1244(2006);dodson等人,nature 450:176(2007);qian等人,nature 450:259(2007);raman等人science 327:1014
‑
1018(2010)。可用于这些和相关实施方式的计算机算法的一些另外的非限制性实例包括vmd,它是用于使用3
‑
d图形和内置脚本显示、绘制和分析大型生物分子系统的分子可视化程序(参见the theoretical and computational biophysics group,university of illinois at urbana
‑
champagne的网页ks.uiuc.edu/research/vmd/)。许多其他计算机程序是本领域已知的并且对技术人员可用,并且其允许从能量最小化构象的空间填充模型(范德华半径)确定原子尺寸;grid,其试图确定对不同化学基团的高亲和力区,从而增强结合;monte carlo搜索,其计算数学比对;以及charmm(brooks等人(1983)j.comput.chem.4:
187
‑
217)和amber(weiner et al(1981)j.comput.chem.106:765),其评估力场计算和分析(另参见eisenfield等人(1991)am.j.physiol.261:c376
‑
386;lybrand(1991)j.pharm.belg.46:49
‑
54;froimowitz(1990)biotechniques 8:640
‑
644;burbam等人(1990)proteins 7:99
‑
111;pedersen(1985)environ.health perspect.61:185
‑
190;和kini等人(1991)j.biomol.struct.dyn.9:475
‑
488)。各种合适的计算的计算机程序也是可商购的,例如来自schrodinger(munich,germany)。
[0485]
编码前体双特异性抗体构建体组件、载体、宿主细胞的多核苷酸和产生前体双特异性抗体构建体的方法
[0486]
本公开在某些实施方式中进一步提供了编码如本文所述的多肽前体三特异性抗体构建体的分离的核酸。示例性多核苷酸及其片段在下表3中提供。核酸包括dna和rna。这些和相关的实施方式可以包括编码如本文所述的前体三特异性抗体构建体的多核苷酸。如本文所用,术语“分离的多核苷酸”应指基因组、cdna或合成来源的多核苷酸或其一些组合,凭借其来源,分离的多核苷酸(1)不与多核苷酸的全部或部分相缔合,其中分离的多核苷酸是在自然界中发现的,(2)与其在自然界中不连接的多核苷酸连接,或(3)在自然界中没有作为更大序列的一部分存在。
[0487]
技术人员会理解,在一些实施方式中,术语“多核苷酸”和“核酸序列”可以互换使用,都具有相同的含义和性质。
[0488]
在一些实施方式中,分离的核酸序列编码如本文全文详细公开的前体三特异性抗体构建体的多肽a和多肽b。在一些实施方式中,分离的核酸序列编码前体三特异性抗体构建体的多肽a,如上文详细描述的。在一些实施方式中,分离的核酸序列编码前体三特异性抗体构建体的多肽b,如上文详细描述的。在一些实施方式中,多肽a和b形成包含如本文所述的前体构建体的异二聚体,所述前体构建体包含(a)结合细胞表面肿瘤相关抗原(taa结合结构域)或taa的第一和第二结合结构域;(b)结合人cd3ε的细胞外表位的第三结合结构域(cd3结合结构域);(c)两种可切割的子调节结构域,一个包含半衰期延长结构域,另一个包含cap掩蔽结构域。
[0489]
表3:编码抗cd3 vh、vl、hc、lc、抗egfr、调节组件及其组合的核苷酸序列(也参见以下实施例1中的核苷酸序列)。
[0490]
seq id no说明155抗
‑
cd3ε vh
‑
ch1159抗
‑
cd3ε vl
‑
cl36抗
‑
egfr vl38抗
‑
egfr vh43抗
‑
egfr vl
‑
l
‑
vh44抗
‑
egfr vh
‑
l
‑
vl8hsa164cap33mmp可切割序列
[0491]
术语“可操作地连接”包括该术语所应用的组件处于允许它们在合适条件下执行其固有功能的关系中。例如,“可操作地连接”至蛋白质编码序列的转录控制序列与其连接,
使得在与控制序列的转录活性相容的条件下实现蛋白质编码序列的表达。
[0492]
如本文所用,术语“控制序列”包括可影响与其连接或可操作连接的编码序列的表达、加工或细胞内定位的多核苷酸序列。这种控制序列的性质可能取决于宿主生物。在具体实施方式中,原核生物的转录控制序列可包括启动子、核糖体结合位点和转录终止序列。在其他具体实施方式中,真核生物的转录控制序列可包括含有一个或多个转录因子识别位点的启动子、转录增强子序列、转录终止序列和聚腺苷酸化序列。在某些实施方式中,“控制序列”可以包括前导序列和/或融合伴侣序列。
[0493]
如本文所用,术语“多核苷酸”包括单链或双链核酸聚合物。在某些实施方式中,构成多核苷酸的核苷酸可以是核糖核苷酸或脱氧核糖核苷酸或任一类型修饰形式的核苷酸。所述修饰包括碱基修饰例如溴尿苷、核糖修饰例如阿拉伯糖苷和2',3'
‑
双脱氧核糖和核苷酸间链接修饰例如硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺基硫代磷酸酯(phosphoroanilothioate)、苯胺基磷酸酯(phoshoraniladate)和氨基磷酸酯。术语“多核苷酸”具体包括单链和双链形式的dna。
[0494]
术语“天然存在的核苷酸”包括脱氧核糖核苷酸和核糖核苷酸。术语“修饰的核苷酸”包括具有修饰或取代的糖基团等的核苷酸。术语“寡核苷酸键”包括寡核苷酸链接,例如硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺基硫代磷酸酯、苯胺基磷酸酯、氨基磷酸酯等。参见,例如,laplanche等人,1986,nucl.acids res.,14:9081;stec等人,1984,j.am.chem.soc.,106:6077;stein等人,1988,nucl.acids res.,16:3209;zon等人,1991,anti
‑
cancer drug design,6:539;zon等人,1991,oligonucleotides and analogues:a practical approach,pp.87
‑
108(f.eckstein,ed.),oxford university press,oxford england;stec等人,美国专利号5,151,510;uhlmann and peyman,1990,chemical reviews,90:543,出于任何目的通过引用将其公开内容并入本文。寡核苷酸可包括可检测标记物以能够实现检测寡核苷酸或其杂交。
[0495]
在其他相关实施方式中,多核苷酸变体可与编码本文所述的前体三特异性抗体构建体或其结构域的多核苷酸序列具有基本上的同一性。例如,多核苷酸可以是如下的多核苷酸:使用本文所述的方法(例如,使用标准参数的blast分析,如下所述),与参考多核苷酸序列,例如编码本文所述的前体双特异性抗体构建体或其结构域的序列相比,包含至少70%序列同一性,优选至少75%、80%、85%、90%、95%、96%、97%、98%或99%或更高的序列同一性。本领域技术人员将认识到,通过考虑密码子简并性、氨基酸相似性、阅读框定位等,可以适当地调整这些值以确定由两个核苷酸序列编码的蛋白质的对应同一性。
[0496]
通常,多核苷酸变体将包含一种或多种取代、添加、缺失和/或插入,优选使得结合结构域的结合亲和力、或第一或第二或第三结合结构域的结合亲和力、或由变体多核苷酸编码的前体三特异性抗体构建体多肽的功能相对于由本文具体叙述的多核苷酸序列编码的未修饰的参考蛋白质基本上没有减少。
[0497]
在某些其他相关实施方式中,多核苷酸片段可以包含与编码如本文所述的前体三特异性抗体构建体多肽或其结构域的序列相同或互补的不同长度的连续序列段或基本上由其组成。例如,提供这样的多核苷酸,其包含编码前体三特异性抗体构建体多肽或其结构域(例如本文公开的第一结合结构域或第二结合结构域或第三结合结构域或第一子调节结构域或第二子调节结构域,或其组件)的序列的至少约5、6、7、8、9、10、11、12、13、14、15、16、
17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、200、300、400、500或1000个或更多个连续核苷酸以及它们之间的所有中间长度,或基本上由其组成。很容易理解,在这种情况下,“中间长度”是指引用值之间的任何长度,例如50、51、52、53等;100、101、102、103等;150、151、152、153等;包括200
‑
500;500
‑
1,000等等之间的所有整数。本文描述的多核苷酸序列可以在一端或两端通过添加天然序列中未发现的另外的核苷酸延伸。这个另外的序列可以由编码本文所述的前体三特异性抗体构建体多肽或其结构域或组件部分的多核苷酸的任一端处或在编码本文所述的前体三特异性抗体构建体多肽或其结构域或组件部分的多核苷酸的两端处的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸组成。
[0498]
在另一个实施方式中,提供了能够在中等至高度严格条件下与如本文提供的编码前体三特异性抗体构建体多肽或其结构域或组件部分(例如第一结合结构域或第二结合结构域或第三结合结构域或第一子调节结构域或第二子调节结构域,或其组件部分)的多核苷酸序列或其片段或其互补序列杂交的多核苷酸。杂交技术是分子生物学领域众所周知的。为了说明性目的,用于测试本文提供的多核苷酸与其他多核苷酸的杂交的合适的中等严格条件包括在5
×
ssc、0.5%sds、1.0mm edta(ph 8.0)的溶液中预洗涤;在50℃
‑
60℃,5
×
ssc中杂交过夜;然后在65℃下用含有0.1%sds的2
×
ssc、0.5
×
ssc和0.2
×
ssc的每个洗涤20分钟,洗涤两次。本领域技术人员将理解,可以容易地操纵杂交的严格性,例如通过改变杂交溶液的盐含量和/或进行杂交的温度。例如,在另一个实施方式中,合适的高度严格杂交条件包括上述那些,除了将杂交温度增加到例如60℃
‑
65℃或65℃
‑
70℃。
[0499]
在某些实施方式中,上述多核苷酸,例如多核苷酸变体、片段和杂交序列,编码前体三特异性抗体构建体多肽或其结构域或其组件部分,例如第一或第二结合结构域或两者(例如,结合人egfr的scfv),或第三结合结构域(例如结合cd3ε的fab片段),或包含延长半衰期的hsa多肽的调节结构域,或包含特异性结合第三结合结构域的cap组件的调节结构域。在其他实施方式中,此类多核苷酸编码前体三特异性抗体构建体多肽或其结构域或组件(其至少约50%,至少约70%,并且在某些实施方式中,至少约90%地结合cd3和/或肿瘤相关抗原)以及本文具体叙述的前体三特异性抗体构建体多肽序列。在其他实施方式中,此类多核苷酸编码前体三特异性抗体构建体多肽或其结构域或组件(其至少约50%、至少约70%,并且在某些实施方式中,至少约90%延长前体构建体的半衰期)以及本文具体叙述的前体三特异性抗体构建体多肽序列。在其他实施方式中,此类多核苷酸编码前体三特异性抗体构建体多肽或其结构域或组件(其至少约50%,至少约70%,并且在某些实施方式中,至少约90%特异性结合前体构建体的第三结合位点)以及本文具体叙述的前体三特异性抗体构建体多肽序列。在进一步的实施方式中,此类多核苷酸编码前体三特异性抗体构建体多肽或其结构域(其例如以比本文叙述的前体三特异性抗体构建体多肽或其结构域更大的亲和力结合cd3和/或肿瘤相关抗原,例如,在数量上至少约105%、106%、107%、108%、109%或110%的结合)以及本文具体叙述的前体三特异性抗体构建体多肽或其结构域序列。
[0500]
如本文其他地方所述,可以通过常规方法进行代表性多肽(例如,如本文提供的变体前体三特异性抗体构建体及其多肽,例如如本文提供的具有第一taa结合结构域和第二
taa结合结构域和第三cd3ε结合结构域的前体三特异性抗体构建体)的三维结构的确定,使得用选定的天然或非天然氨基酸进行一个或多个氨基酸的取代、添加、缺失或插入可以虚拟建模,目的是确定如此衍生的结构变体是否保留目前公开种类的空间填充特性。本领域技术人员已知多种计算机程序,用于确定例如抗体或其抗原结合片段内的适当的氨基酸取代(或编码氨基酸序列的适当的多核苷酸),从而例如维持亲和力,或获得更好的亲和力。
[0501]
本文所述的多核苷酸或其片段,无论编码序列本身的长度如何,都可以与其他dna序列组合(例如启动子、聚腺苷酸化信号、另外的限制性酶切位点、多克隆位点、其他编码片段等),使得它们的总长度可能会有很大差异。因此预期,可以使用几乎任何长度的核酸片段,其总长度优选地受在预期重组dna方案中制备和使用的容易程度的限制。例如考虑长度是约10,000、约5,000、约3000、约2,000、约1,000、约500、约200、约100、约50个碱基对等等(包括所有中间长度)的说明性多核苷酸区段是有用的。
[0502]
当比较多核苷酸序列时,如果两个序列中的核苷酸序列在如下所述的进行最大对应比对时是相同的,则称两个序列是“同一的”。两个序列之间的比较通常通过在比较窗上比较序列来标识和比较序列相似性的局部区域来进行的。如本文所用,“比较窗”是指至少约20个连续位置的区段,通常为30至约75、40至约50个连续位置的区段,其中可将序列与具有相同数量连续位置的参考序列最佳比对(对齐,align)后,可将两者进行比较。
[0503]
可使用lasergene生物信息学软件(dnastar,inc.,madison,wis.)套装中的megalign程序,使用默认参数进行用于比较的序列的最佳比对。该程序体现了以下参考文献中描述的几种比对方案:dayhoff,m.o.(1978)a model of evolutionary change in proteins
‑‑
matrices for detecting distant relationships.in dayhoff,m.o.(ed.)atlas of protein sequence and structure,national biomedical research foundation,washington d.c.vol.5,suppl.3,pp.345
‑
358;hein j.,unified approach to alignment and phylogenes,pp.626
‑
645(1990);methods in enzymology vol.183,academic press,inc.,san diego,calif.;higgins,d.g.and sharp,p.m.,cabios 5:151
‑
153(1989);myers,e.w.and muller w.,cabios 4:11
‑
17(1988);robinson,e.d.,comb.theor 11:105(1971);santou,n.nes,m.,mol.biol.evol.4:406
‑
425(1987);sneath,p.h.a.and sokal,r.r.,numerical taxonomy
‑‑
the principles and practice of numerical taxonomy,freeman press,san francisco,calif.(1973);wilbur,w.j.and lipman,d.j.,proc.natl.acad.,sci.usa 80:726
‑
730(1983)。
[0504]
可选地,可以通过以下来进行用于比较的序列的最佳比对:smith和waterman,add apl.math 2:482(1981)的局部同一性算法,needleman和wunsch,j.mol.48:443(1970)的同一性比对算法,pearson和lipman proc.natl.acad.sci.usa 85:2444(1988)的相似性搜索方法,这些算法的计算机化实施(wisconsin遗传学软件包中的gap、bestfit、blast、fasta和tfasta,genetics computer group(gcg),575science dr.,madison,wis.),或通过检查。
[0505]
适用于确定序列同一性百分比和序列相似性的算法的一个实例是blast和blast2.0算法,它们在altschul等人,nucl.acids res.25:3389
‑
3402(1977),和altschul等人,j.mol.biol.215:403
‑
410(1990)中分别描述。blast和blast 2.0可使用例如本文所述的参数,以确定两个或多个多核苷酸之间的序列同一性百分比。通过国家生物技术信息
中心可公开获得执行blast分析的软件。在一个说明性实例中,对于核苷酸序列,可以使用参数m(一对配对残基的奖励分数;总是>0)和n(错配残基的惩罚分数;总是<0)来计算累积分数。在以下情况下,将停止在每个方向的字符命中延伸:累积比对分数从其最大实现值下降数量x时;由于一个或多个负评分残基比对的累积,使累积分数变为零或更低;或到达任一序列的末端时。blast算法参数w、t和x决定了比对的灵敏度和速度。blastn程序(用于核苷酸序列)使用以下作为默认:字长(w)为11,期望(e)为10,以及blosum62评分矩阵(参见henikoff和henikoff,proc.natl.acad.sci.usa 89:10915(1989))比对,(b)为50,期望(e)为10,m=5,n=
‑
4以及两条链的比较。
[0506]
在某些实施方式中,通过在至少20个位置的比较窗上比较两个最佳比对序列来确定“序列同一性百分比”,其中,与用于两个序列的最佳比对的参考序列(不包含添加或缺失)相比,比较窗中的多核苷酸序列的部分可以包含20%或更少,通常为5%至15%,或10%至12%的添加或缺失(即,间隙)。通过以下来计算百分比:确定两个序列中出现相同核酸碱基的位置数以产生匹配位置数,将匹配位置数除以参考序列中的位置总数(即窗的大小)并将结果乘以100以得出序列同一性的百分比。
[0507]
本领域普通技术人员将理解,由于遗传密码的简并性,有许多编码如本文所述的前体双特异性抗体构建体的核苷酸序列。这些多核苷酸中的一些与编码前体三特异性抗体构建体多肽或其结构域或组件(例如形成结合cd3和/或肿瘤相关抗原的前体双特异性抗体构建体)的天然或原始多核苷酸序列的核苷酸序列具有最小序列同一性。尽管如此,由于密码子使用的差异而变化的多核苷酸被本公开内容明确考虑。在某些实施方式中,特别考虑了针对哺乳动物表达进行密码子优化的序列。
[0508]
因此,在本文公开的另一个实施方式中,诱变方法,例如位点特异性诱变,可用于制备本文所述的前体三特异性抗体构建体多肽的变体和/或衍生物。通过这种方法,多肽序列中的特异性修饰可以通过编码它们的潜在多核苷酸的诱变来进行。这些技术提供了制备和测试序列变体的直接方法,例如,通过将一个或多个核苷酸序列变化引入到多核苷酸中,来并入一种或多种前述的考虑。
[0509]
位点特异性诱变允许通过使用编码所需突变的dna序列的特异性寡核苷酸序列以及足够数量的相邻核苷酸来产生突变体,以提供足够大小和序列复杂性的引物序列,来在穿过(traversed)的缺失连接两侧形成稳定的双螺旋。可以在选定的多核苷酸序列中使用突变来改善、改变、减少、修饰或以其他方式变化多核苷酸本身的性质,和/或改变所编码多肽的性质、活性、组成、稳定性或一级序列。
[0510]
在某些实施方式中,考虑诱变编码如本文所公开前体三特异性抗体构建体多肽或其结构域或其组件部分的多核苷酸序列,以便改变编码的多肽/结构域/组件的一种或多种性质,例如第一结合结构域或第二结合结构域或第三结合结构域的结合亲和力,或第一或第二子调节结构域或其组件的功能。位点特异性诱变技术是本领域众所周知的,并且广泛用于产生多肽和多核苷酸二者的变体。例如,位点特异性诱变常用于改变dna分子的特定部分。在此类实施方式中,使用长度通常包含约14至约25个核苷酸的引物,其中在被改变的序列连接的两侧上具有约5至约10个残基。
[0511]
本领域技术人员将理解,位点特异性诱变技术经常使用以单链和双链形式存在的噬菌体载体。可用于定点诱变的典型载体包括载体,例如m13噬菌体。这些噬菌体可容易地
商购获得并且它们的用途通常对本领域技术人员而言是熟知的。双链质粒也常用于定点诱变,其消除了将感兴趣基因从质粒转移到噬菌体的步骤。
[0512]
通常,根据本文的定点诱变通过首先获得单链载体或将双链载体的两条链融解分开来进行,该载体在其序列中包括编码所需肽的dna序列。通常以合成制备具有所需突变序列的寡核苷酸引物。然后将该引物与单链载体退火,并经历dna聚合酶如大肠杆菌聚合酶iklenow片段的作用,以完成携带突变的链的合成。因此,形成了异源双螺旋,其中一条链编码原始的非突变序列,而第二条链携带所期望的突变。然后将该异源双螺旋用于转化合适的细胞,例如大肠杆菌细胞,并选择包括携带突变序列排列的重组载体的克隆。
[0513]
使用定点诱变制备选定的编码肽的dna区段的序列变体提供了产生潜在有用种类的方法,而不是限制性的,因为还有其他方法可以获得肽和编码它们的dna序列的序列变体。例如,可以用诱变剂如羟胺处理编码所期望的肽序列的重组载体以获得序列变体。在maloy等人,1994;segal,1976;prokop and bajpai,1991;kuby,1994;和maniatis等人,1982的教导中可以找到关于这些方法和方案的具体细节,出于该目的,每一篇都通过引用并入本文。
[0514]
如本文所用,术语“寡核苷酸定向诱变程序”包括模板依赖性过程和载体介导的增殖,其导致特定核酸分子的浓度相对于其初始浓度提高,或导致特可检测的信号的浓度(例如扩增)提高。如本文所用,术语“寡核苷酸定向诱变程序”包括涉及引物分子的模板依赖性延伸的过程。术语“模板依赖过程”包涵rna或dna分子的核酸合成,其中新合成的核酸链的序列由众所周知的互补碱基配对原则规定(参见,例如,watson,1987)。通常,载体介导的方法涉及将核酸片段引入dna或rna载体、载体的克隆扩增和扩增的核酸片段的回收。此类方法的实例由美国专利号4,237,224提供,具体地通过引用以其整体并入本文。
[0515]
在用于产生多肽变体的另一种方法中,可以采用如美国专利号5,837,458中所述的递归序列重组。在该方法中,进行重组和筛选或选择的迭代循环以“进化”具有例如增加的结合亲和力的单独的多核苷酸变体。某些实施方式还提供质粒、载体、转录或表达盒形式的构建体,其包含如本文所述的至少一种多核苷酸。
[0516]
在某些实施方式中,将分离的多核苷酸插入到载体中。本文所用的术语“载体”涵盖其中可以共价插入编码蛋白质的多核苷酸以引起该蛋白质表达和/或多核苷酸克隆的媒介。可以使用本领域已知的任何合适的方法将分离的多核苷酸插入载体中,例如但不限于,可以使用合适的限制酶消化载体,然后可以将其与具有匹配限制性末端的分离的多核苷酸连接。
[0517]
合适载体的实例包括但不限于质粒,噬菌粒,粘粒、人工染色体例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1衍生的人工染色体(pac),噬菌体例如λ噬菌体或m13噬菌体,和动物病毒。可用作载体的动物病毒类别的实例包括但不限于逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(例如,单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒和乳头多瘤空泡病毒(例如,sv40)。
[0518]
为了表达多肽,可以将载体引入宿主细胞以允许多肽在宿主细胞内表达。表达载体可含有多种用于控制表达的元件,其包括但不限于启动子序列、转录起始序列、增强子序列、可选择标记物和信号序列。本领域普通技术人员可以适当地选择这些元件。例如,可以选择启动子序列以促进多核苷酸在载体中的转录。合适的启动子序列包括但不限于t7启动
子、t3启动子、sp6启动子、β
‑
肌动蛋白启动子、ef1a启动子、cmv启动子和sv40启动子。可选择增强子序列以增强多核苷酸的转录。可以选择可选择标记物以允许将插入载体的宿主细胞从未插入载体的宿主细胞中选择,例如,可选择标记物可以是赋予抗生素抗性的基因。可以选择信号序列以允许表达的多肽被转运到宿主细胞之外。
[0519]
载体还可包括帮助其进入细胞的材料,包括但不限于病毒颗粒、脂质体或蛋白质包被。
[0520]
在一些实施方式中,表达载体包含编码前体构建体的多肽或编码前体构建体的多肽内的结构域或编码前体构建体的多肽内的结构域的组件部分的分离的核酸序列。结合结构域及其组件已在上文中详细描述。
[0521]
在一些实施方式中,表达载体包含编码多肽a的分离的核酸序列。在一些实施方式中,表达载体包含编码多肽b的分离的核酸序列。在一些实施方式中,表达载体包含编码多肽a的部分的分离的核酸序列。在一些实施方式中,表达载体包含编码多肽b的部分的分离的核酸序列。在一些实施方式中,表达载体包含编码第一结合结构域的分离的核酸序列。在一些实施方式中,表达载体包含编码第一结合结构域的scfv的分离的核酸序列。在一些实施方式中,表达载体包含编码第二结合结构域的scfv的分离的核酸序列。在一些实施方式中,表达载体包含编码第一结合结构域的scfv的部分的分离的核酸序列。在一些实施方式中,表达载体包含编码第二结合结构域的scfv的部分的分离的核酸序列。在一些实施方式中,表达载体包含编码egfr结合结构域的分离的核酸序列。在一些实施方式中,表达载体包含编码egfr scfv结合结构域的分离的核酸序列。在一些实施方式中,表达载体包含编码cd3ε结合结构域的vh区的分离的核酸序列。在一些实施方式中,表达载体包含编码cd3ε结合结构域的vl区的分离的核酸序列。在一些实施方式中,表达载体包含编码cap调节结构域的分离的核酸序列。在一些实施方式中,表达载体包含编码hsa调节结构域的分离的核酸序列。在一些实施方式中,表达载体包含编码调节结构域的组件部分的分离的核酸序列。在一些实施方式中,表达载体包含编码调节结构域的cap组件的分离的核酸序列。在一些实施方式中,表达载体包含编码调节结构域的hsa组件的分离的核酸序列。在一些实施方式中,表达载体包含编码调节结构域的cap组件的分离的核酸序列和包括蛋白酶可切割的接头的一个或多个接头。在一些实施方式中,表达载体包含编码调节结构域的hsa组件的分离的核酸序列和包括蛋白酶可切割的接头的一个或多个接头。
[0522]
对于多核苷酸的克隆,可以将载体引入宿主细胞(分离的宿主细胞)中以允许载体自身复制并由此扩增包含在其中的多核苷酸的拷贝。克隆载体可包含序列组件,通常包括但不限于复制起点、启动子序列、转录起始序列、增强子序列和可选择标记物。本领域普通技术人员可以适当地选择这些元件。例如,可以选择复制起点以促进载体在宿主细胞中的自主复制。
[0523]
在某些实施方式中,本公开提供含有本文提供的载体的分离的宿主细胞。含有载体的宿主细胞可用于表达或克隆包含在载体中的多核苷酸(一种或多种)。
[0524]
合适的宿主细胞可包括但不限于原核细胞、真菌细胞、酵母细胞或高等真核细胞例如哺乳动物细胞。
[0525]
用于此目的的合适原核细胞包括但不限于真细菌,例如革兰氏阴性或革兰氏阳性生物体,例如肠杆菌科,诸如埃希氏菌属(escherichia)例如大肠杆菌、肠杆菌、欧文氏菌、
克雷伯氏菌、变形杆菌、沙门氏菌例如鼠伤寒沙门氏菌、沙雷氏菌例如粘质沙雷氏菌、和志贺氏菌,以及芽孢杆菌例如枯草芽孢杆菌和地衣芽孢杆菌、假单胞菌例如铜绿假单胞菌和链霉菌。
[0526]
在本领域中已充分确立抗体和抗原结合片段在原核细胞如大肠杆菌中的表达。对于综述,例如参见pluckthun,a.bio/technology 9:545
‑
551(1991)。本领域技术人员也可以将培养的真核细胞中表达作为产生抗体或其抗原结合片段的选项,参见最近的综述,例如ref,m.e.(1993)curr.opinion biotech.4:573
‑
576;trill j.j.等人(1995)curr.opinion biotech 6:553
‑
560。
[0527]
用于此目的的合适的真菌细胞包括但不限于丝状真菌和酵母。真菌细胞的说明性实例包括酿酒酵母、普通面包酵母、裂殖酵母(schizosaccharomyces pombe)、克鲁维酵母宿主例如乳酸克鲁维酵母、脆弱克鲁维酵母(atcc 12,424)、保加利亚克鲁维酵母(atcc 16,045)、威克克鲁维酵母(k.wickeramii,atcc24,178)、瓦提克鲁维酵母(k.waltii,atcc56,500)、果蝇克鲁维酵母菌(k.drosophilarum,atcc36,906)、耐热克鲁维酵母(k.thermotoierans)和马克斯克鲁维酵母(k.marxianus);耶氏酵母(ep 402,226);毕赤酵母(ep 183,070);假丝酵母(candida);里氏木霉(trichoderma reesia,ep244,234);粗超脉孢菌(neurospora crassa);许旺酵母属(schwanniomyces)例如西方许旺酵母(schwanniomyces occidentalis);和丝状真菌,例如脉孢菌属(neurospora)、青霉菌属(penicillium)、弯颈霉属(tolypocladium)和曲霉属(aspergillus)宿主,例如沟巢曲霉(a.nidulans)和黑曲霉(a.niger)。
[0528]
高等真核细胞,特别是源自多细胞生物体的那些,可用于表达本文提供的糖基化多肽。合适的高等真核细胞包括但不限于无脊椎动物细胞和昆虫细胞,以及脊椎动物细胞。无脊椎动物细胞的实例包括植物和昆虫细胞。许多杆状病毒株和变体以及来自宿主如草地贪夜蛾(毛虫)、埃及伊蚊(蚊子)、白纹伊蚊(蚊子)、黑腹果蝇(果蚬)和家蚕的相应的允许昆虫宿主细胞已被标识。多种用于转染的病毒株是可公开获得的,例如,苜蓿银纹夜蛾npv的k
‑
1变体和家蚕npv的bm
‑
5株,并且此类病毒可用作本文所述的病毒,具体是用于转染草地贪夜蛾细胞。棉花、玉米、马铃薯、大豆、矮牵牛、番茄和烟草的植物细胞培养物也可用作宿主。脊椎动物细胞的实例包括哺乳动物宿主细胞系,例如由sv40转化的猴肾cv1细胞系(cos
‑
7,atcc crl 1651);人胚胎肾细胞系(为悬浮培养物中生长亚克隆的293或293细胞,graham等人,j.gen virol.36:59(1977));幼仓鼠肾细胞(bhk,atcc ccl 10);中国仓鼠卵巢细胞/
‑
dhfr(cho,urlaub等人,proc.natl.acad.sci.usa 77:4216(1980));小鼠sertoli细胞(tm4,mather,biol.reprod.23:243
‑
251(1980));猴肾细胞(cv1 atcc ccl 70);非洲绿猴肾细胞(vero
‑
76,atcc crk
‑
1587);人宫颈癌细胞(hela,atcc ccl 2);犬肾细胞(mdck,atcc ccl 34);buffalo大鼠肝细胞(brl 3a,atcc crl 1442);人肺细胞(w138,atcc ccl 75);人肝细胞(hep g2,hb 8065);小鼠乳腺肿瘤(mmt 060562,atcc ccl51);tri细胞(mather等人,annals n.y.acad.sci.383:44
‑
68(1982));mrc 5细胞;fs4细胞;和人肝癌细胞系(hep g2)。
[0529]
可以使用本领域已知的任何合适的方法将载体引入宿主细胞,所述方法包括但不限于deae
‑
葡聚糖介导的递送、磷酸钙沉淀法、阳离子脂质介导的递送、脂质体介导的转染、电穿孔、微粒轰击、受体介导的基因递送,由多赖氨酸、组蛋白、壳聚糖和肽介导的递送。用
于感兴趣载体表达的细胞转染和转化的标准方法是本领域公知的。
[0530]
在某些实施方式中,宿主细胞包含编码第一多肽的第一载体和编码第二多肽的第二载体。在某些实施方式中,第一载体和第二载体可以相同或不同。在某些实施方式中,第一多肽和第二多肽可以相同或不同。
[0531]
在某些实施方式中,宿主细胞包含编码多肽a的第一载体和编码多肽b的第二载体。在某些实施方式中,第一载体和第二载体可以相同或不同。在某些实施方式中,多肽a和多肽b可以在同一载体上编码。
[0532]
在一些实施方式中,分离的细胞包含如本文公开的分离的核酸序列。在一些实施方式中,分离的细胞包含如本文公开的两种分离的核酸序列,其中一种核酸编码多肽a而另一种核酸编码多肽b。在一些实施方式中,分离的细胞包含如本文公开的两种表达载体,其中一种载体包含编码多肽a的核酸,而另一个载体包含编码多肽b的核酸。
[0533]
在某些实施例中,第一载体和第二载体可以同时或可以不同时引入。在某些实施方式中,可以将第一载体和第二载体一起引入宿主细胞。在某些实施方式中,可以首先将第一载体引入宿主细胞,然后可以引入第二载体。在某些实施方式中,可以将第一载体引入宿主细胞中,然后将其建立表达第一多肽的稳定细胞系,然后可以将第二载体引入稳定的细胞系中。
[0534]
在某些实施方式中,宿主细胞包含编码第一多肽和第二多肽的载体。
[0535]
在某些实施方式中,本公开内容提供表达本文提供的多肽的方法,包含在表达载体中插入的多核苷酸的条件下培养含有载体的宿主细胞。
[0536]
用于表达多核苷酸的合适条件可以包括但不限于合适的培养基、培养基中宿主细胞的合适密度、存在必需营养物质、存在补充因子、合适的温度和湿度以及不存在微生物污染物。本领域普通技术人员可以适当地选择用于表达目的的适当条件。
[0537]
在一些实施方式中,产生前体三特异性抗体构建体的方法,所述前体三特异性抗体构建体包括(a)结合细胞表面肿瘤相关抗原的第一结合结构域(taa结合结构域);(b)结合细胞表面肿瘤相关抗原的第二结合结构域(taa结合结构域);(c)结合人cd3ε的细胞外表位的第三结合结构域(cd3结合结构域);(d)cap调节结构域;和(e)hsa调节结构域,该方法包括培养包含编码前体三特异性抗体构建体的多肽a和多肽b的核酸序列的一种或多种细胞的步骤,其中所述前体三特异性抗体构建体多肽被表达和分离,并且其中所述分离的多肽a和b形成异源二聚体。如本文详细公开的,编码多肽a和b的分离的核酸序列可以包含在载体中,其中使用相同的载体或不同的载体。在一些实施方式中,每个多肽可以从不同的宿主细胞中表达,其中二聚化在组件多肽a和b的分离或纯化之后发生。在一些实施方式中,多肽a和b可以从相同的宿主细胞表达,其中二聚化在培养中或在组件多肽a和b的分离或纯化之后发生。
[0538]
在某些实施方式中,宿主细胞中表达的多肽可形成二聚体并因此产生前体三特异性抗体构建体二聚体,例如包含多肽a和多肽b的异源二聚体。在某些实施方式中,其中宿主细胞表达第一多核苷酸和第二多核苷酸,第一多核苷酸(a)和第二多核苷酸(b)可以形成为异源二聚体的多肽复合物。
[0539]
在某些实施方式中,多肽复合物可在宿主细胞内形成。例如,异源二聚体可以在相关酶和/或辅因子的帮助下在宿主细胞内形成。在某些实施方式中,多肽复合物可以分泌到
细胞外。在某些实施方式中,第一多肽(a)和第二多肽(b)可以分泌到宿主细胞外并在宿主细胞外形成异源二聚体。
[0540]
在某些实施方式中,第一多肽和第二多肽可以分别表达并允许在合适的条件下二聚化。例如,可以将第一多肽(a)和第二多肽(b)在合适的缓冲液中组合并且允许第一蛋白质单体(a)和第二蛋白质单体(b)通过适当的相互作用例如疏水相互作用来二聚化。对于另一个实例,第一多肽(a)和第二多肽(b)可以在含有酶和/或辅因子的合适缓冲液中组合,该酶和/或辅因子可以促进第一多肽(a)和第二多肽(b)的二聚化。对于另一个实例,第一多肽(a)和第二多肽(a)可以在合适的媒介中组合并允许它们在合适的试剂和/或催化剂的存在下彼此反应。
[0541]
在某些实施方式中,第一多肽(a)和第二多肽(b)可以通过dna合成和pcr生成。在某些实施方式中,生成的序列可以被亚克隆到表达载体中。在某些实施方式中,生成的序列可以被亚克隆到两种表达载体中。在某些实施方式中,所述表达载体是质粒。在某些实施方式中,所述质粒是基于ptt5的质粒。
[0542]
在某些实施方式中,通过共转染编码第一多肽(a)和第二多肽(b)的表达载体或通过将编码两者的表达载体转染到合适的细胞中来进行瞬时表达。技术人员会理解,对于此目的有多种可以使用的转染方法和方案。在某些实施方式中,使用pei方法进行转染或共转染。在某些实施方式中,将3l摇瓶中约2.3
×
106/ml的1l cho细胞用作宿主。通过将2mg总dna和4mg pei在100ml optimem培养基(invitrogen)中的混合物加入细胞并轻轻混合以开始转染。然后将细胞在120rpm、37℃和8%co2的培养箱摇床中培养8
‑
10天。24小时后和之后每2
‑
3天进行一次蛋白胨和葡萄糖的补充,这取决于细胞密度和活力。当细胞活力降低到<70%时,在第8
‑
10天终止细胞培养。然后收获条件培养基用于蛋白质纯化。
[0543]
可以使用任何合适的方法收集表达的多肽(a)和(b)和/或多肽复合物。多肽(a)和(b)和/或多肽复合物可以在细胞内、细胞周质空间中表达或分泌到细胞外进入培养基中。如果多肽(a)和(b)和/或多肽复合物在细胞内表达,则可以裂解含有多肽(a)和(b)和/或多肽复合物的宿主细胞并且可以通过离心或超滤去除不需要的碎片从裂解液中分离多肽和/或多肽复合物。如果多肽(a)和(b)和/或多肽复合物被分泌到大肠杆菌的细胞周质空间中,则可以在例如醋酸钠(ph 3.5)、edta和苯甲基磺酰氟(pmsf)试剂存在下在约30分钟内解冻细胞浆,并可以通过离心去除细胞碎片(carter等人,biotechnology 10:163
‑
167(1992))。如果多肽(a)和(b)和/或多肽复合物被分泌到培养基中,则可以使用市售蛋白质浓缩过滤器例如amincon或millipore pellicon超滤器收集并浓缩细胞培养物的上清液。在收集和浓缩步骤中可以包含蛋白酶抑制剂和/或抗生素以抑制蛋白质降解和/或污染微生物的生长。
[0544]
可以通过合适的方法进一步纯化表达的多肽(a)和(b)和/或多肽复合物,所述方法例如但不限于亲和色谱法、羟基磷灰石层析法、尺寸排阻色谱法、凝胶电泳、透析、在离子交换柱上的离子交换分级、乙醇沉淀、反相hplc、硅胶色谱法、肝素琼脂糖色谱法、阴离子或阳离子交换树脂色谱法(如聚天冬氨酸柱)、色谱聚焦法、sds
‑
page和硫酸铵沉淀(参见,综述,bonner,p.l.,protein purification,taylor & francis,2007出版;janson,j.c.,等人,protein purification:principles,high resolution methods and applications,wiley
‑
vch,1998出版)。
[0545]
在某些实施方式中,多肽(a)和(b)和/或多肽二聚体复合物可通过亲和色谱法来纯化。在某些实施方式中,蛋白a层析或蛋白a/g(蛋白a和蛋白g的融合蛋白)层析可用于纯化包含源自抗体ch2结构域和/或ch3结构域的组件的多肽和/或多肽复合物(lindmark等人,j.immunol.meth.62:1
‑
13(1983));zettlit,k.a.,antibody engineering,part v,531
‑
535,2010)。在某些实施方式中,本文公开的前体三特异性抗体构建体不结合蛋白a。在某些实施方式中,蛋白g层析可用于纯化包含iggγ3重链的多肽和/或多肽复合物(guss等人,embo j.5:15671575(1986))。在某些实施方式中,蛋白l层析可用于纯化包含k轻链的多肽和/或多肽复合物(sudhir,p.,antigen engineering protocols,第26章,humana press,1995出版;nilson,bhk等人,j.biol.chem.,267,2234
‑
2239(1992))。亲和配体附接的基质通常是琼脂糖,但也可以使用其他基质。相比使用琼脂糖可实现的,机械稳定的基质,例如可控孔玻璃或聚(苯乙烯二乙烯)苯可实现更快的流速和更短的处理时间。当抗体包含ch3结构域时,bakerbond abx树脂(j.t.baker,phillipsburg,n.j.)可用于纯化。
[0546]
在任何初步纯化步骤(一个或多个)之后,包含前体三特异性抗体构建体和污染物的混合物可以使用ph在约2.5
‑
4.5之间的洗脱缓冲液进行低ph疏水相互作用层析,优选在低盐浓度下进行(例如,约0
‑
0.25m盐)。
[0547]
在某些实施方式中,多肽(a)和(b)和/或多肽二聚体复合物可以通过亲和色谱法和尺寸排阻色谱法(sec)来纯化。技术人员会理解,有许多方法和方案适用于该目的。在某些实施方式中,使用akta纯仪器(ge lifesciences)通过亲和色谱法和sec进行蛋白质纯化。在某些实施方式中,通过使收获的上清液通过captureselect
tm ch1
‑
xl亲和基质(thermo scientific)柱来实现前体双特异性抗体的亲和捕获。用pbs洗涤柱子后,用0.1m甘氨酸,ph 2.5来洗脱蛋白质,并立即用1/6体积的1m tris
‑
hcl,ph 8.0来中和。然后使用amicon 30kd浓缩器(merck millipore)将亲和纯化的蛋白质浓缩至5
‑
10mg/ml,并在用pbs平衡的superdex200柱(ge lifesciences)上进行sec纯化。然后收集蛋白质级分并使用sds
‑
page和hplc
‑
sec进行分析。
[0548]
前体三特异性抗体构建体的使用方法
[0549]
在一些实施方式中,本文所述的是包含如本文所述的前体三特异性抗体构建体的组合物以及在多种治疗设置中施用此类组合物。
[0550]
本文描述的前体三特异性抗体构建体以纯的形式或以合适的药物组合物的形式的施用,可以通过用于提供类似功效的药剂的任何可接受的施用模式来进行。药物组合物可以通过将前体三特异性抗体构建体或包含前体三特异性抗体构建体的组合物与适当的生理学上可接受的载体、稀释剂或赋形剂组合来制备,并且可以配制成固体、半固体、液体或气体形式的制剂,例如片剂、胶囊剂、粉剂、颗粒剂、软膏剂、溶液、栓剂、注射剂、吸入剂、凝胶剂、微球和气溶胶。此外,其他药物活性成分(包括本文其他地方描述的其他抗癌剂)和/或合适的赋形剂(例如盐、缓冲剂和稳定剂)可以但不是必须的存在于组合物中。可以通过多种不同途径实现施用,包括口服、肠胃外、鼻内、静脉内、皮内、皮下或局部。在一些实施方式中,施用模式取决于待治疗或预防的病症的性质。施用后减少、抑制、预防或延迟癌症进展和/或转移的量被认为是有效的。技术人员会理解,术语“生理学上可接受的载体、稀释剂或赋形剂”在一些实施方式中可以与术语“药学上可接受的载体”互换使用,都具有相同含义和性质。
[0551]
在一些实施方式中,本文所述的药物组合物包含编码前体三特异性抗体构建体的核苷酸序列。在一些实施方式中,编码本文公开的前体构建体的核苷酸序列包含单个线性核苷酸序列。在一些实施方式中,编码本文公开的前体构建体的核苷酸序列包含两种核苷酸序列。在一些实施方式中,编码本文公开的前体构建体的核苷酸序列包含存在于同一载体上的两种核苷酸序列。在一些实施方式中,编码本文公开的前体构建体的核苷酸序列包含存在于不同载体上的两种核苷酸序列。
[0552]
在一些实施方式中,核苷酸序列编码多肽a和多肽b。在一些实施方式中,相同的一核苷酸序列编码多肽a和多肽b。在一些实施方式中,不同的核苷酸序列编码多肽a和多肽b。在一些实施方式中,一个核苷酸序列编码多肽a,和另一个核苷酸序列编码多肽b。在一些实施方式中,一个核苷酸序列编码多肽a,和另一个核苷酸序列编码多肽b,在它们之间具有蛋白酶切割序列,因此允许多肽a和多肽b异源二聚化,如在duperret ek等人,cancer res,oct.4(doi:10.1158/0008
‑
5472.can
‑
18
‑
1429)中所述。在一些实施方式中,治疗、防止、抑制生长、延缓疾病进展、降低肿瘤负荷或降低受试者中癌症或肿瘤的发病率,或其任何组合的方法包括对有需要的受试者施用包含前体三特异性抗体构建体的药物组合物的步骤,该前体三特异性抗体构建体包含(a)结合细胞表面肿瘤相关抗原的第一结合结构域(taa结合结构域);(b)结合细胞表面肿瘤相关抗原的第二结合结构域(taa结合结构域);(c)结合人cd3ε的细胞外表位的第三结合结构域(cd3结合结构域);(d)cap调节结构域;和(e)has调节结构域,其中与未施用所述药物组合物的受试者相比,该方法治疗、防止、抑制生长、延缓疾病进展、降低肿瘤负荷、或降低所述受试者中癌症或肿瘤的发病率、或降低微小残留病、提高缓解、增加缓解持续时间、降低肿瘤复发率、防止所述肿瘤或所述癌症的转移、或降低所述肿瘤或所述癌症的转移率、或其任何组合。
[0553]
在一些实施方式中,治疗、防止、抑制生长、延缓疾病进展、降低肿瘤负荷或降低受试者中癌症或肿瘤的发病率或其任何组合的方法包括向有需要的受试者施用包括编码前体双特异性抗体构建体的核苷酸序列的药物组合物,该前体双特异性抗体构建体包含(a)结合细胞表面肿瘤相关抗原的第一结合结构域(taa结合结构域);(b)结合细胞表面肿瘤相关抗原的第二结合结构域(taa结合结构域);(c)结合人cd3ε的细胞外表位的第三结合结构域(cd3结合结构域);(d)cap调节结构域;和(e)hsa调节结构域,其中与未施用所述药物组合物的受试者相比,该方法治疗、防止、抑制生长、延缓疾病进展、降低肿瘤负荷或降低所述受试者中癌症或肿瘤的发病率、或降低微小残留病、提高缓解、提高缓解持续时间、降低肿瘤复发率、防止所述肿瘤或所述癌症的转移、或降低所述肿瘤或所述癌症的转移率、或其任何组合。
[0554]
技术人员会理解,在一些实施方式中,术语“治疗”及其语法形式可以涵盖针对本文所述的肿瘤或癌症的治疗性处理和预防性或防止性措施,其中目的是防止或减轻如本文所述的靶向的肿瘤或癌症。因此,在本文公开的方法的一些实施方式中,治疗可包括直接影响或治愈、制止、抑制、预防、降低其严重性、延迟其发作、降低与疾病、紊乱或病症相关的症状,或其组合;例如,当所述疾病或紊乱包括癌症或肿瘤时。因此,在一些实施方式中,“治疗”包括防止、延迟进展、抑制生长、延迟疾病进展、降低肿瘤负荷、降低发病率、加速缓解、诱导缓解、增加缓解、加速恢复、增加疗效或降低对可选的疗法的抗性或其组合。在一些实施方式中,“防止”包括延迟症状发作、防止疾病复发、减少复发发作的次数或频率、提高症
状发作之间的潜伏期,或其组合。在一些实施方式中,“制止”或“抑制”包括降低症状的严重性、降低急性发作的严重性、减低症状的数量、降低疾病相关症状的发病率、降低症状的潜伏期、改善症状、降低继发性症状、降低继发性感染、延长患者存活期或其组合。
[0555]
在一些实施方式中,降低了癌症或肿瘤的大小。在一些实施方式中,降低了癌症或肿瘤的生长速率。在一些实施方式中,降低了癌症或肿瘤的大小或生长速率或其组合。在一些实施方式中,提高了有需要的受试者的存活率。在一些实施方式中,降低了癌症或肿瘤的大小或生长速率或其组合,或其中提高了有需要的受试者的存活率,或其组合。
[0556]
在一些实施方式中,有需要的受试者是人类受试者。在一些实施方式中,有需要的受试者是人类儿童。在一些实施方式中,有需要的受试者是成年人。在一些实施方式中,有需要的受试者是人类婴儿。
[0557]
在某些实施方式中,施用的量足以导致肿瘤消退,如活肿瘤量的统计学上显著减少(例如,肿瘤质量减少至少50%),或通过改变(例如,具有统计学显著性的减少)扫描维度所指示。在其他实施方式中,如熟练的临床医生已知的,施用的量足以导致疾病症状的临床相关减少。
[0558]
精确剂量和治疗持续时间是所治疗疾病的函数,并且可以使用已知的测试方案或通过在本领域已知的模型系统中测试组合物并由此推断而凭经验确定。也可以进行控制的临床试验。剂量也可以随着要减轻的病症的严重程度而变化。通常配制和施用药物组合物以发挥治疗上有用的效果同时最小化不期望的副作用。组合物可以施用一次或可以分成多个较小的剂量以间隔的时间施用。对于任何特定对象,可根据个人需要随时间调整具体剂量方案。
[0559]
包含前体三特异性抗体构建体的组合物可以单独施用或与其他已知的癌症治疗例如放射疗法、化学疗法、移植、免疫疗法、激素疗法、光动力疗法等组合施用。在一些实施方式中,包含编码前体双特异性抗体构建体的核苷酸序列的组合物可单独施用或与其他已知癌症治疗如放射疗法、化学疗法、移植、免疫疗法、激素疗法、光动力疗法等组合施用。所述组合物还可与抗生素组合施用。
[0560]
因此,施用这些和相关药物组合物的典型途径包括但不限于口服、局部、透皮、吸入、肠胃外、舌下、口腔、直肠、阴道和鼻内。本文使用的术语肠胃外包括皮下注射、静脉内、肌肉内、胸骨内注射或输注技术。根据如本文所述的某些实施方式的药物组合物被配制以使得在向患者施用组合物时其中包含的活性成分是生物可利用的。将施用至受试者或患者的组合物可以采用一种或多种剂量单位的形式,其中例如,片剂可以是单个剂量单位,以及气溶胶形式的本文所述的前体三特异性抗体构建体的容器可容纳多个剂量单位。制备此类剂型的实际方法对本领域技术人员而言是已知的或将是显而易见的;例如,参见remington:the science and practice of pharmacy,20th edition(philadelphia college of pharmacy and science,2000)。在任何情况下,待施用的组合物将包含治疗有效量的本公开的前体双特异性抗体构建体,用于根据本文的教导治疗感兴趣的疾病或病症。
[0561]
药物组合物可以是固体或液体的形式。在一个实施方式中,药学上可接受的载体(一种或多种)是微粒,使得组合物是例如片剂或粉剂形式。药学上可接受的载体(一种或多种)可以是液体,组合物是例如口服油、可注射液体或气溶胶,其可用于例如吸入施用。当用
于口服施用时,药物组合物优选是固体或液体形式,其中半固体、半液体、悬浮液和凝胶形式包括在本文中视为固体或液体的形式内。
[0562]
作为用于口服施用的固体组合物,药物组合物可以配制成粉剂、颗粒剂、压缩片剂、丸剂、胶囊剂、咀嚼胶、薄片等。这种固体组合物通常含有一种或多种惰性稀释剂或可食用的药学上可接受的载体。此外,可以存在以下一种或多种:粘合剂,例如羧甲基纤维素、乙基纤维素、微晶纤维素、黄蓍胶或明胶;赋形剂,例如淀粉、乳糖或糊精;崩解剂,例如藻酸、藻酸钠、羧甲基淀粉钠(primogel)、玉米淀粉等;润滑剂,如硬脂酸镁或sterotex;助流剂,例如胶体二氧化硅;甜味剂,例如蔗糖或糖精;调味剂,例如薄荷、水杨酸甲酯或橙调味剂;和着色剂。当药物组合物为胶囊形式时,例如,明胶胶囊,除上述类型的材料外,其还可以含有液体药学上可接受的载体,例如聚乙二醇或油。
[0563]
药物组合物可以是液体形式,例如酏剂、糖浆、溶液、乳液或悬浮液。作为两个实例,液体可以用于口服施用或用于通过注射递送。当旨在用于口服施用时,除本发明的化合物外,优选的组合物还含有甜味剂、防腐剂、染料/染色剂和增味剂中的一种或多种。在旨在通过注射施用的组合物中,可以包括表面活性剂、防腐剂、润湿剂、分散剂、悬浮剂、缓冲剂、稳定剂和等渗剂中的一种或多种。
[0564]
液体药物组合物,无论其是溶液、悬浮液或其他类似形式,都可包括以下佐剂中的一种或多种:无菌稀释剂,例如注射用水、盐水溶液优选生理盐水、林格氏溶液、等渗氯化钠、不挥发油如可作为溶剂或悬浮介质的合成甘油单酯或甘油二酯、聚乙二醇、甘油、丙二醇或其他溶剂;抗菌剂,如苯甲醇或羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,例如乙二胺四乙酸;缓冲剂,例如醋酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的试剂,如氯化钠或右旋糖。肠胃外制剂可以封装在安瓿、一次性注射器或由玻璃或塑料制成的多剂量小瓶中。生理盐水是优选的佐剂。可注射的药物组合物优选是无菌的。
[0565]
旨在用于肠胃外或口服施用的液体药物组合物应含有一定量的如本文公开的前体三特异性抗体构建体,从而获得合适的剂量。通常,该量是组合物中至少0.01%的前体双特异性抗体构建体。当旨在用于口服施用时,该量可以在组合物重量的0.1%至约70%之间变化。某些口服药物组合物含有约4%至约75%的前体双特异性抗体构建体。在某些实施方式中,制备根据本文所述实施方式的药物组合物和制剂,使得肠胃外剂量单位在稀释前含有0.01至10重量%的前体三特异性抗体构建体。
[0566]
药物组合物可以旨在用于局部施用,在这种情况下,药学上可接受的载体可以适当地包括溶液、乳液、软膏或凝胶基质。例如,基质可包含以下一种或多种:凡士林、羊毛脂、聚乙二醇、蜂蜡、矿物油、稀释剂如水和醇、以及乳化剂和稳定剂。用于局部施用的药物组合物中可以存在增稠剂。如果旨在用于透皮施用,则该组合物可包括透皮贴剂或离子电渗疗法装置。药物组合物可以以例如栓剂的形式旨在用于直肠施用,其将在直肠中融化并释放药物。用于直肠施用的组合物可含有油脂性基质作为合适的无刺激性赋形剂。此类基质包括但不限于羊毛脂、可可脂和聚乙二醇。
[0567]
药物组合物可包括改变固体或液体剂量单位的物理形式的多种材料。例如,组合物可包括在活性成分周围形成包衣外壳的材料。形成包衣外壳的材料通常是惰性的,并且可以选自例如糖、虫胶和其他肠溶的包衣剂。可选地,活性成分可被包裹在明胶胶囊中。固体或液体形式的药物组合物可包括结合本文公开的抗体的试剂,从而有助于化合物的递
送。可以以这种能力起作用的合适试剂包括其他单克隆或多克隆抗体、一种或多种蛋白质或脂质体。药物组合物可基本上由可作为气溶胶施用的剂量单位组成。术语气溶胶用于表示范围从胶体性质的系统到由加压包装组成的系统的多种系统。可以通过液化或压缩气体或通过分配活性成分的合适泵系统进行递送。气溶胶可以单相、双相或三相系统递送以便递送活性成分(一种或多种)。气溶胶的递送包括必要的容器、活化剂、阀、子容器等,它们一起可以形成试剂盒。本领域普通技术人员无需过多实验即可确定优选的气溶胶。
[0568]
药物组合物可以通过制药领域中熟知的方法制备。例如,旨在通过注射施用的药物组合物可以通过将包含如本文所述的前体三特异性抗体构建体和任选的盐、缓冲剂和/或稳定剂中的一种或多种的组合物与无菌的、蒸馏的水组合以形成溶液。可以添加表面活性剂以促进均匀溶液或悬浮液的形成。表面活性剂是与前体双特异性抗体构建体组合物非共价相互作用以促进前体双特异性抗体构建体在水性递送系统中溶解或均匀悬浮的化合物。
[0569]
组合物可以以治疗有效量施用,其将根据多种因素而变化,所述因素包括所采用的具体化合物(例如前体双特异性抗体构建体)的活性;化合物的代谢稳定性和作用时间;患者的年龄、体重、一般健康状况、性别和饮食;施用模式和时间;排泄率;药物组合;具体紊乱或病症的严重程度;和经历疗法的对象。通常,治疗有效的日剂量为(对于70千克的哺乳动物)约0.001mg/kg(即0.07mg)至约100mg/kg(即7.0克);优选地,治疗有效剂量为(对于70kg的哺乳动物)约0.01mg/kg(即0.7mg)至约50mg/kg(即3.5g);更优选地,治疗有效剂量为(对于70kg的哺乳动物)约1mg/kg(即70mg)至约25mg/kg(即1.75g)。
[0570]
包含本公开内容的前体三特异性抗体构建体或包含编码前体三特异性抗体构建体的核苷酸序列的组合物也可以与一种或多种其他治疗剂的施用同时、在其之前或在其之后施用。此类组合疗法可包括施用包含如本文公开的化合物和一种或多种另外的活性剂的单一药物剂型,以及施用包含如本文公开的前体三特异性抗体构建体和其各自独立的药物剂型的每种活性剂。例如,如本文所述的前体三特异性抗体构建体或包含编码前体三特异性抗体构建体的核苷酸序列和其他活性剂可以以单一口服剂量组合物(例如片剂或胶囊剂)一起施用于患者,或以单独的口服剂型施用每种药剂。类似地,本文所述的前体三特异性抗体构建体或包含编码前体三特异性抗体构建体的核苷酸序列和其他活性剂可以以单一胃肠外剂量组合物(例如盐水溶液或其他生理上可接受的溶液)一起施用至患者,或以单独的肠胃外剂型施用每种药剂。当使用单独的剂型时,包含前体三特异性抗体构建体或包含编码前体三特异性抗体构建体的核苷酸序列的组合物和一种或多种另外的活性剂可以基本上同时(即同时地),或在单独交错的时间(即依次地和以任何顺序)施用;组合疗法被理解为包括所有这些方案。
[0571]
因此,在某些实施方式中,还考虑施用本公开内容的前体三特异性抗体构建体组合物或包含编码前体三特异性抗体构建体的核苷酸序列与一种或多种其他治疗剂组合。此类治疗剂可在本领域中被接受作为针对如本文所述的特定疾病状态的标准治疗,例如癌症、炎性紊乱、同种异体移植、i型糖尿病和多发性硬化。考虑的示例性治疗剂包括细胞因子、生长因子、类固醇、nsaid、dmard、抗炎剂、化疗剂、放疗剂或其他活性剂和辅助剂。
[0572]
在某些实施方式中,本文公开的前体三特异性抗体构建体或包含编码前体三特异性抗体构建体的核苷酸序列可以与任何数量的化疗剂联合施用。化疗剂的实例包括烷化
acid);2
‑
乙基肼;甲基苄肼(procarbazine);psk.rtm;雷佐生(razoxane);西佐喃(sizofuran);锗螺胺(spirogermanium);细格孢氮杂酸(tenuazonic acid);三亚胺醌(triaziquone);2,2',2"
‑
三氯三乙胺;乌拉坦(urethan);长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露醇氮芥(mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolactol);哌泊溴烷(pipobroman);gacytosine;阿糖胞苷(arabinoside)(“ara
‑
c”);环磷酰胺;噻替哌;紫杉烷,例如紫杉醇(taxol.rtm.,bristol
‑
myers squibb oncology,princeton,nj)和多西他塞(doxetaxel)(taxotere.rtm.,rhne
‑
poulenc rorer,antony,france);苯丁酸氮芥(chlorambucil);吉西他滨;6
‑
硫鸟嘌呤;巯基嘌呤;甲氨喋呤;铂类似物,例如顺铂和卡铂;长春碱(vinblastine)、铂;依托泊苷(etoposide)(vp
‑
16);异环磷酰胺(ifosfamide);丝裂霉素c(mitomycin c);米托蒽醌(mitoxantrone);长春新喊(vincristine);长春瑞宾(vinorelbine);诺维本(navelbine);诺安托(novantrone);替尼泊苷(teniposide);柔红霉素(daunomycin);氨基蝶呤;希罗达(xeloda);伊班膦酸盐(ibandronate);cpt
‑
11;拓扑异构酶抑制剂rfs2000;二氟甲基鸟氨酸(dmfo);视黄酸酸衍生物,例如targretin.tm.(贝沙罗汀(bexarotene))、panretin.tm.(阿利维a酸(alitretinoin));ontak.tm.(地尼白介素(denileukin diftitox));埃斯波霉素(esperamicin);卡培他滨;以及任何上述物质的药学上可接受的盐、酸或衍生物。该定义中还包括用于调节或抑制激素对肿瘤的作用的抗激素剂,例如抗雌激素,包括例如他莫昔芬、雷洛昔芬、芳香酶抑制4(5)
‑
咪唑、4
‑
羟基他莫昔芬(4
‑
hydroxytamoxifen)、曲沃昔芬(trioxifene)、雷洛西芬(keoxifene)、ly117018、奥那司酮(onapristone)和托瑞米芬(toremifene)(fareston);和抗雄激素类,例如氟他米特(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、亮丙瑞林、戈舍瑞林等;以及任何上述物质的药学上可接受的盐、酸或衍生物。
[0573]
多种其他治疗剂可与本文所述的前体三特异性抗体构建体联合使用。在一个实施方式中,前体三特异性抗体构建体或包含编码前体三特异性抗体构建体的核苷酸序列与抗炎剂一起施用。抗炎剂或药物包括但不限于类固醇和糖皮质激素(包括倍他米松、布地奈德、地塞米松、醋酸氢化可的松、氢化可的松、氢化可的松、甲泼尼龙、泼尼松龙、泼尼松、曲安西龙)、非甾体抗炎药(nsaids),包括阿司匹林、布洛芬、萘普生、甲氨蝶呤、柳氮磺胺吡啶、来氟米特、抗tnf药物、环磷酰胺和霉酚酸酯(mycophenolate)。
[0574]
包含本文所述前体三特异性抗体构建体或包含编码前体三特异性抗体构建体的核苷酸序列的组合物可施用于患有本文所述疾病的个体,所述疾病包括但不限于癌症和自身免疫性疾病和炎性疾病。为了在体内用于治疗人类疾病,通常在施用前,将前体三特异性抗体构建体或包含编码本文所述的前体三特异性抗体构建体的核苷酸序列并入药物组合物中。药物组合物包含前体三特异性抗体构建体或包含编码本文所述的前体三特异性抗体构建体的核苷酸序列的一种或多种组合如本文其他地方描述的药学上可接受的载体或赋形剂。为了制备药物组合物,将有效量的前体三特异性抗体构建体或包含编码前体三特异性抗体构建体的核苷酸序列的一种或多种与本领域技术人员已知的适用于具体施用模式的任何药学上可接受的载体(一种或多种)或赋形剂混合。
[0575]
药学上可接受的载体可以是液体、半液体或固体。用于肠胃外、皮内、皮下或局部应用的溶液或悬浮液可包括例如无菌稀释剂(例如水)、盐水溶液、不挥发性油、聚乙二醇、
甘油、丙二醇或其他合成溶剂;抗菌剂(例如苯甲醇和对羟基苯甲酸甲酯、苯酚或甲酚、汞、氯丁醇、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯、硫柳汞、苯扎氯铵和苄索氯铵);抗氧化剂(如抗坏血酸和亚硫酸氢钠;甲硫氨酸、硫代硫酸钠、铂、过氧化氢酶、柠檬酸、半胱氨酸、硫代甘油、巯基乙酸、硫代山梨醇、丁基羟基茴香醚、丁基羟基甲苯和/或没食子酸丙酯)和螯合剂(如乙二胺四乙酸)(edta));缓冲液(例如醋酸盐、柠檬酸盐和磷酸盐)。如果静脉内施用,合适的药学上可接受的载体包括生理盐水或磷酸盐缓冲盐水(pbs),以及含有增稠剂和增溶剂如葡萄糖、聚乙二醇、聚丙二醇及其混合物的溶液。
[0576]
包含如本文所述的前体三特异性抗体构建体的组合物可以用药学上可接受的载体制备(例如定时释放制剂或包衣),所述载体保护前体三特异性抗体构建体免于从体内快速消除。此类药学上可接受的载体包括控释制剂,例如但不限于植入物和微囊化递送系统,以及可生物降解的、生物相容性聚合物,例如乙烯醋酸乙烯酯、聚酐、聚乙醇酸、聚原酸酯、聚乳酸和本领域普通技术人员已知的其他物质。
[0577]
本前体三特异性抗体构建体可用于治疗多种癌症或肿瘤。在一些实施方式中,癌症或肿瘤包括实体瘤。在一些实施方式中,癌症或肿瘤包括非实体瘤。在一些实施方式中,癌症或肿瘤包括癌症或肿瘤的转移。
[0578]
例如,通过向癌症患者施用治疗有效量的本文公开的前体双特异性抗体构建体或编码前体三特异性抗体构建体的核苷酸序列,治疗癌症的方法的一些实施方式涉及癌症,其包括但不限于黑素瘤、非霍奇金淋巴瘤、霍奇金病、白血病、浆细胞瘤、肉瘤、神经胶质瘤、胸腺瘤、乳腺癌、前列腺癌、结肠直肠癌、肾癌、肾细胞癌、子宫癌、胰腺癌、食道癌、脑癌、肺癌、卵巢癌、宫颈癌、睾丸癌、胃癌、食道癌、多发性骨髓瘤、肝细胞癌、急性淋巴细胞癌白血病(all)、急性髓性白血病(aml)、慢性髓性白血病(cml)和慢性淋巴细胞白血病(cll)或其他癌症。
[0579]
实体瘤可能是良性的(不是癌症),也可能是恶性的(癌症)。不同类型的实体瘤以形成它们的细胞类型命名。可为其提供治疗的实体瘤的实例包括肉瘤、癌和淋巴瘤。在一些实施方式中,可为其提供治疗的实体瘤包括由除血液、骨髓或淋巴细胞以外的身体组织细胞的异常生长形成的赘生物(细胞的新生长)或病变(解剖结构的损伤或生理功能的紊乱)。在一些实施方式中,可为其提供治疗的实体瘤由异常细胞团组成,这些细胞团可源自不同组织类型,例如肝脏、结肠、乳腺或肺,并且最初在其细胞来源的器官中生长。然而,这种癌症可能会通过疾病晚期的转移性肿瘤生长扩散到其他器官。
[0580]
在治疗癌症或肿瘤的方法的一些实施方式中,实体瘤包括肉瘤或癌、肾上腺皮质肿瘤(腺瘤和癌)、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文肉瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌或肿瘤、乳腺癌或肿瘤、卵巢癌或肿瘤、前列腺癌或肿瘤、鳞状细胞癌、肺鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、结肠直肠癌、硬纤维瘤、促纤维增生性小圆细胞肿瘤、内分泌肿瘤、生殖细胞肿瘤、肝母细胞瘤、肝细胞癌、黑素瘤、成神经细胞瘤、骨肉瘤、视网膜母细胞瘤、横纹肌肉瘤、除横纹肌肉瘤以外的软组织肉瘤、维尔姆斯肿瘤、子宫颈癌或肿瘤、子宫癌或肿瘤、睾丸癌或肿瘤、肺癌、小细胞肺癌、肛门癌、胶质母细胞瘤、头颈部上皮肿瘤、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、成神经管细
胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、神经鞘瘤、脑膜瘤、黑素瘤、成神经细胞瘤或视网膜母细胞瘤。
[0581]
在治疗癌症或肿瘤的方法的一些实施方式中,肿瘤或癌症包括非实体瘤,即非实体癌。在一些实施方式中,治疗癌症或肿瘤的方法可以是针对弥漫性癌症,其中癌症广泛扩散;不局限或受限制。在一些实施方式中,弥漫性癌症可包括非实体瘤。弥漫性癌症的实例包括白血病。白血病包括从造血组织(例如骨髓)开始并导致大量异常血细胞产生并进入血液的癌症。
[0582]
在治疗癌症或肿瘤的方法的一些实施方式中,弥漫性癌症包括b细胞恶性肿瘤。在一些实施方式中,弥漫性癌症包括白血病。在一些实施方式中,癌症是淋巴瘤。在一些实施方式中,淋巴瘤是大b细胞淋巴瘤。
[0583]
在治疗癌症或肿瘤的方法的一些实施方式中,弥漫性癌症或肿瘤包括血液肿瘤。在一些实施方式中,血液肿瘤是影响血液、骨髓和淋巴结的癌症类型。血液肿瘤可能源自两种主要血细胞谱系中的任一种:髓样和淋巴样细胞系。髓样细胞系通常产生粒细胞、红细胞、血小板、巨噬细胞和肥大细胞,而淋巴样细胞系产生b、t和浆细胞。淋巴瘤(例如霍奇金淋巴瘤)、淋巴细胞白血病和骨髓瘤源自淋巴样系,而急性和慢性髓性白血病(aml、cml)、骨髓增生异常综合征和骨髓增生性疾病是骨髓来源的。
[0584]
在治疗癌症或肿瘤的方法的一些实施方式中,非实体(弥漫性)癌症或肿瘤包括造血系统恶性肿瘤、血细胞癌、白血病、骨髓增生异常综合征、淋巴瘤、多发性骨髓瘤(浆细胞骨髓瘤)、急性淋巴细胞白血病、急性髓性白血病、慢性髓性白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤或浆细胞白血病。
[0585]
在施用后,以统计学上显著的方式(即,相对于对本领域技术人员而言已知的适当对照)抑制、防止、降低癌症发病率、降低肿瘤负荷或延迟癌症的生长、进展和/或转移的量被认为是有效的。
[0586]
另一个实施方式提供了通过向癌症患者施用治疗有效量的本文公开的前体三特异性抗体构建体或编码前体双特异性抗体构建体的核苷酸序列来防止癌症转移的方法,该癌症包括但不限于如上文公开的实体或非实体肿瘤或癌症(例如,在施用后,以统计学上显著的方式(即,相对于对本领域技术人员而言已知的适当对照)抑制、防止、延迟癌症的转移))。
[0587]
另一个实施方式提供了通过向癌症患者施用治疗有效量的本文公开的前体三特异性抗体构建体或编码前体双特异性抗体构建体的核苷酸序列来防止癌症的方法,该癌症包括但不限于如上文公开的实体或非实体肿瘤。
[0588]
另一个实施方式提供了通过向患有这些疾病中的一种或多种的患者施用治疗有效量的本文公开的前体双特异性抗体构建体或编码前体三特异性抗体构建体的核苷酸序列来治疗、抑制肿瘤或癌症进展的方法,该肿瘤或癌症包括但不限于如上文公开的实体或非实体肿瘤或癌症。
[0589]
在一个实施方式中,本公开内容提供了引导t细胞活化的方法,该方法包括向有需要的患者施用有效量的前体三特异性抗体构建体,该前体三特异性抗体构建体包含如本文所述的cd3结合结构域,其能够特异性结合tcrα、tcrβ、cd3γ、cd3δ、cd3ε或其组合,和特异性结合taa靶标(例如肿瘤特异性抗原(例如,egfr)或在期望t细胞活化的位点或细胞处选
择的其他抗原)的taa第一或第二结合结构域或两者,其中在一些实施方式中,第一或第二结合结构域结合cap调节结构域和hsa调节结构域,如上文所述。
[0590]
虽然本文已经说明和描述了本发明的某些特征,但是本领域普通技术人员现在将想到许多修改、取代、变化和等同物。因此,应当理解,所附权利要求旨在涵盖落入本发明的真正精神内的所有此类修改和变化。
[0591]
实施例
[0592]
实施例1:前体和活性三特异性抗体构建体的产生
[0593]
目的
[0594]
本研究的目的是生产功能性三特异性(活性)和前体三特异性抗体构建体。
[0595]
方法
[0596]
基因合成及质粒构建
[0597]
抗体构建体(前体和活化的三体抗体构建体)的重链(hc多肽)和轻链(lc多肽)的编码序列通过dna合成和pcr生成,随后被亚克隆到基于ptt5的质粒(nrc biotechnology research institute)用于在哺乳动物细胞系统中的蛋白质表达。通过dna测序确认表达载体中的基因序列。代表重链多肽(hc多肽)和轻链多肽(lc多肽)的多肽的命名基于构建体的fab组件。
[0598]
生成了六种不同的egfr抗体构建体:三体(vlvh)、前三体。
[0599]
构建体1:
[0600]
三特异性可变轻链
‑
可变重链(vlvh),包含抗cd3ε(fab部分)和两条抗egfr可变轻(vl)和可变重(vh)单链可变片段(scfv)链,其以n'
‑
xxx
‑
xxx
‑
xxx
‑
c'的方式排序。hc多肽是有序的n'
‑
接头
‑
(抗
‑
cd3εvh1
‑
接头
‑
ch1)
‑
接头
‑
(抗
‑
egfr vl2
‑
接头
‑
vh2)
‑
接头
‑
c'。hc多肽的氨基酸序列是seq id no:138(图4a)。编码构建体1的hc多肽的核苷酸序列在seq id no:150和图4b中叙述。
[0601]
轻链(lc)多肽是有序的n'
‑
接头
‑
(抗
‑
cd3εvl1
‑
接头
‑
cl)
‑
接头
‑
(抗
‑
egfr vl3
‑
接头
‑
vh3)
‑
接头
‑
c'。构建体1的lc多肽的氨基酸序列是seq id no:139(图5a)。编码构建体1的lc多肽的核苷酸序列是seq id no:151(图5b)。
[0602]
构建体2:
[0603]
三特异性可变重链
‑
可变轻链(vhvl),包含抗cd3ε(fab部分)和两条抗egfr vh和vl单链可变片段(scfv)链,以n'
‑
xxx
‑
xxx
‑
xxx
‑
c的方式排序。
[0604]
构建体2的hc多肽链是有序的n'
‑
接头
‑
(抗
‑
cd3εvh1
‑
接头
‑
ch1)
‑
接头
‑
(抗
‑
egfr vh2
‑
接头
‑
vl2)
‑
接头
‑
c'。构建体2的hc多肽链的氨基酸序列是seq id no:140(图6a)。编码构建体2的hc多肽重链的核苷酸序列是seq id no:152(图6b)。
[0605]
构建体2的lc多肽链是有序的n'
‑
接头
‑
(抗
‑
cd3εvl1
‑
接头
‑
cl)
‑
接头
‑
(抗
‑
egfr vh3
‑
接头
‑
vl3)
‑
接头
‑
c'。构建体2的lc多肽链的氨基酸序列是seq id no:141(图7a)。构建体2的lc多肽链的核苷酸序列是seq id no:153(图7b)。
[0606]
构建体3:
[0607]
前体三体特异性可变轻链
‑
可变重链(vlvh),包含抗cd3ε(fab部分)、两条抗egfr vl和vh单链可变片段(scfv)链和由mmp9/2可切割序列连接的两个子调节结构域,以n'
‑
xxx
‑
xxx
‑
xxx
‑
c'的方式排序。
[0608]
构建体3的hc多肽链是有序的n'人血清白蛋白(hsa)
‑
接头
‑
蛋白酶切割肽(mmp2/9)
‑
接头
‑
(抗
‑
cd3εvh1
‑
接头
‑
ch1)
‑
接头
‑
(抗
‑
egfr vl3
‑
接头
‑
vh3)
‑
接头
‑
c'。构建体3的hc多肽链的氨基酸序列是seq id no:130(图8a)。编码构建体3的hc多肽的核苷酸序列是seq id no:142(图8b)。
[0609]
构建体3的lc多肽链为有序的n'cap
‑
接头
‑
蛋白酶切割肽(mmp2/9)
‑
接头
‑
(抗
‑
cd3εvl1
‑
接头
‑
cl1)
‑
接头
‑
(抗
‑
egfr vl2
‑
接头
‑
vh2)
‑
接头
‑
c'。构建体3的lc多肽链的氨基酸序列是seq id no:131(图9a)。构建体3的lc的核苷酸序列是seq id no:143(图9b)。
[0610]
构建体4
[0611]
前体三特异性构建体可变重链可变轻链链(vhvl),包含抗cd3ε(fab部分)、两条抗egfr vl和vh单链可变片段(scfv)链和由mmp9/2可切割序列连接的两个子调节结构域,以n'
‑
xxx
‑
xxx
‑
xxx
‑
c'的方式排序。
[0612]
构建体4的hc多肽是有序的n'
‑
人血清白蛋白(hsa)
‑
接头
‑
蛋白酶可切割的肽mmp2/9
‑
接头
‑
vh1
‑
接头
‑
ch1
‑
接头
‑
vh3
‑
接头
‑
vl3
‑
接头。构建体4的hc多肽链的氨基酸序列是seq id no:132(图10a)。
[0613]
构建体4的hc多肽的核苷酸序列是seq id no:144(图10b)。
[0614]
构建体4的lc多肽是有序的n'
‑
cap
‑
接头
‑
蛋白酶可切割的肽mmp2/9
‑
接头
‑
vl1
‑
接头
‑
cl
‑
接头
‑
vh2
‑
接头
‑
vl2
‑
接头。构建体4的lc多肽链的氨基酸序列是seq id no:133(图11a)。
[0615]
构建体4的lc多肽链的核苷酸序列是seq id no:145(图11b)。
[0616]
构建体5
[0617]
前体三特异性不可切割(nc)可变轻链可变重链(vlvh),包含抗cd3ε(fab部分)、两条抗egfr vl和vh单链可变片段(scfv)链和两个子调节结构域(不包括mmp9/2可切割序列),以n'
‑
xxx
‑
xxx
‑
xxx
‑
c'的方式排序。
[0618]
构建体5的hc多肽是有序的n'
‑
人血清白蛋白(hsa)
‑
接头
‑
vh1
‑
接头
‑
ch1
‑
接头
‑
vl3
‑
接头
‑
vh3
‑
接头。构建体5的hc多肽链的氨基酸序列是seq id no:134(图12a)。
[0619]
构建体5的hc多肽的核苷酸序列是seq id no:146(图12b)。
[0620]
构建体5的lc多肽是有序的n'
‑
cap
‑
接头
‑
vl1
‑
接头
‑
cl
‑
接头
‑
vl2
‑
接头
‑
vh2
‑
接头。构建体5的lc多肽链的氨基酸序列是seq id no:135(图13a)。
[0621]
构建体5的lc多肽链的核苷酸序列是seq id no:147(图13b)。
[0622]
构建体6
[0623]
前体三特异性不可切割(nc)可变重链可变轻链(vhvl),包含抗cd3ε(fab部分)、两条抗egfr vl和vh单链可变片段(scfv)链和两个子调节结构域(不包括mmp9/2可切割序列),以n'
‑
xxx
‑
xxx
‑
xxx
‑
c'的方式排序。
[0624]
构建体6的hc多肽是有序的n'
‑
人血清白蛋白(hsa)
‑
接头
‑
vh1
‑
接头
‑
ch1
‑
接头
‑
vh3
‑
接头
‑
vl3
‑
接头。构建体6的hc多肽链的氨基酸序列是seq id no:136(图14a)。
[0625]
编码构建体6的hc多肽的核苷酸序列是seq id no:148(图14b)。
[0626]
构建体6的lc多肽是有序的n'
‑
cap
‑
接头
‑
vl1
‑
接头
‑
cl
‑
接头
‑
vh2
‑
接头
‑
vl2
‑
接头。构建体6的lc多肽链的氨基酸序列是seq id no:137(图15a)。
[0627]
编码构建体6的lc多肽的核苷酸序列是seq id no:149(图15b)。
[0628]
图2f的构建体,靶向egfr或5t4
[0629]
图2f的构建体的hc多肽是有序的n
‑
端至c
‑
端cap、接头、人血清白蛋白、蛋白酶切割序列、抗cd3e fab的vh1/ch1、v、vh(egfr或5t4scfv)。两种标记的半胱氨酸残基(双下划线)可以参与二硫双键。图2f的构建体的hc多肽链的氨基酸序列在seq id no:28和31中叙述,其中scfv靶向egfr(图45a和45b)。图2f的构建体的hc多肽链的氨基酸序列在seq id no:118和176中叙述,其中scfv靶标是5t4(图47a和47b)。
[0630]
图2f的构建体的lc多肽是有序的如下n
‑
端到c
‑
端cap排序:接头、抗cd3e fab的vl1
‑
cl、vl和vh(egfr或5t4scfv)。两种标记的半胱氨酸残基(双下划线)可以参与二硫双键。图2f的构建体的lc多肽链的氨基酸序列在seq id no:32中叙述,其中scfv靶标是egfr(图46)。图2f的构建体的lc多肽链的氨基酸序列在seq id no:177中叙述,其中scfv靶标是5t4(图48)。
[0631]
抗体构建体的表达
[0632]
抗体构建体的瞬时表达通过使用聚乙烯亚胺(pei)方法将配对的重链(hc)和轻链(lc)多肽构建体共转染到cho细胞中进行。简而言之,将3l摇瓶中约2.3
×
106/ml的1l的cho细胞用作宿主。通过将2mg总dna和4mg pei在100ml optimem培养基(invitrogen)中的混合物加入细胞并轻轻混合来开始转染。然后将细胞在120rpm、37℃和8%co2的培养箱摇床中培养8
‑
10天。24小时后和之后每2
‑
3天进行一次蛋白胨和葡萄糖的补充,这取决于细胞密度和活力。当细胞存活率降低到<70%时,在第8
‑
10天细胞培养终止。收获用于蛋白质纯化的条件培养基。
[0633]
抗体构建体的纯化
[0634]
使用akta纯仪器(ge lifesciences)通过亲和色谱法和大小排阻(sec)进行蛋白质纯化。通过将收获的上清液通过captureselect
tm
ch1
‑
xl亲和基质(thermo scientific)柱来实现抗体的亲和捕获。用pbs洗涤柱子后,用0.1m甘氨酸、ph 2.5来洗脱蛋白质,并立即用1/6体积的1m tris
‑
hcl,ph 8.0来中和。然后使用amicon 30kd浓缩器(merck millipore)将亲和纯化的蛋白质浓缩至5
‑
10mg/ml,并在用pbs平衡的superdex200柱(ge lifesciences)上进行sec纯化。收集蛋白质级分并使用sds
‑
page和hplc
‑
sec进行分析。
[0635]
前体三特异性抗体构建体的sec
‑
hplc分析
[0636]
使用tsk g3000swxl柱(tosoh instruments)、shimadzu lc
‑
10hplc仪器(shimadzu corp.)和对于igg的常用条件(即流动相缓冲液、pbs;流速,1ml/min;运行周期,30分钟;在pbs中稀释的1mg/ml的蛋白质样品浓度;和20μl/注射/运行)来进行分析型sec
‑
hplc。
[0637]
结果
[0638]
通过sds
‑
page证实前体三特异性和三特异性分子量
[0639]
所有三特异性和前体三特异性构建体的还原和非还原sds
‑
page证实了它们的预期分子量。三特异性构建体的预测分子量为100,112da,fd部分的分子量为51,105da,而λc部分的分子量为49,029da。sds
‑
page证实产生的三体构建体是纯的,因为它们根据其预测的分子量迁移,无论是其还原形式还是非还原形式(图16)。前体三特异性构建体的预测分子量为170,390da,fd的分子量为117,649da,和λc融合的分子量为52,762da。sds
‑
page证实产生的前体三体是纯的,因为它们根据预测的分子量迁移,无论是其还原形式还是非还原
形式(图16)。
[0640]
通过分析型hplc尺寸排阻色谱法证实前体三特异性和三特异性分子量
[0641]
分析型hplc尺寸排阻色谱法表明,所有三特异性构建体都作为单体迁移,并根据其预测的100,112da分子量(图17a和17b)。类似地,所有前体三特异性构建体都作为单体迁移,并根据其预测的170,390da分子量(图17c、17d、17e和17f)。
[0642]
实施例2:三特异性和前体三特异性构建体与egfr和cd3e抗原的结合
[0643]
目的
[0644]
这些实验的目的是确定三特异性和前体三特异性构建体的egfr和cd3e结合亲和力。
[0645]
方法
[0646]
三特异性和前体三特异性抗原结合的elisa检测
[0647]
egfr抗原hegfr
‑
fc(目录号344
‑
er
‑
050,bio
‑
techne)和恒河猴egfr
‑
fc(目录号egr
‑
c5252,acro biosystems))在pbs中稀释至0.05ug/ml浓度。人cd3ε(hcd3ε
‑
组氨酸(目录号10977
‑
h08s,sino biological)和食蟹猴cd3ε(目录号cde
‑
c5226,acro biosystems))在pbs中稀释至0.01μg/ml浓度。elisa板(cat#9018,corning)孔中填充100μl抗原悬浮液。在4℃下将板温育过夜。孔用250μl的1%bsa的bst溶液在37℃下封闭1小时,然后用pbst洗涤4次。所有洗涤均使用biotek(elx 405)完成。将所有构建体抗体稀释至15μg/ml并用3倍系列稀释度(12个点,包括0μg/ml)制备。将100μl/孔稀释的抗体构建体溶液加入板中并在37℃下温育1小时。用pbst洗涤板4次,然后加入100μl/孔抗人κ轻链
‑
hrp抗体(1:10000),37℃下温育0.5小时。用pbst洗涤孔4次,然后加入100μl/孔的tmb底物并将板在rt下温育5分钟。加入100μl/孔的1.0n hcl以终止反应。使用elisa读板器在450nm波长(spectramax m5e)下读取板。使用graphpad prism 5软件通过使用非线性回归(曲线拟合)进行数据分析:log(激动剂)对响应,激动剂是抗体浓度(nm)并且响应是od值。
[0648]
结果
[0649]
三特异性和前体三特异性抗体与人egfr抗原的结合
[0650]
使用egfr细胞外融合抗原(hegfr
‑
fc)通过elisa测试vlvh和vhvl形式的三特异性和前体三特异性抗体与人egfr的结合。发现三特异性和前体三特异性构建体以相似的亲和力结合hegfr的细胞外结构域(图18a)。此外,在构建体的vlvh和vhvl形式之间没有发现hegfr结合亲和力的差异(图18a)。
[0651]
三特异性和前体三特异性抗体与恒河猴egfr抗原的结合
[0652]
使用egfr细胞外融合抗原(恒河猴egfr
‑
fc)通过elisa测试vlvh和vhvl形式的三特异性和前体三特异性抗体与恒河猴egfr的结合。发现三特异性和前体三特异性构建体以相似的亲和力结合恒河猴egfr的细胞外结构域(图18b)。此外,在构建体的vlvh和vhvl形式之间没有发现恒河猴egfr结合亲和力的差异(图18b)。此外,所有三特异性和前体三特异性构建体与人和恒河猴egfr的结合亲和力相似。
[0653]
三特异性和前体三特异性抗体与人cd3ε抗原的结合
[0654]
使用cd3ε细胞外融合抗原(人cd3ε
‑
组氨酸)通过elisa测试vlvh和vhvl形式的三特异性和前体三特异性抗体与人cd3ε的结合。三特异性构建体以亚纳摩尔浓度结合人cd3ε,而切割的(c)和不切割的(nc)前体三特异性构建体以高得多的半最大有效浓度(ec50)结
合人cd3ε。这表明cd3ε帽对人cd3ε抗原的阻碍(图7a)。此外,在构建体的vlvh和vhvl形式之间没有发现人cd3ε结合亲和力的差异(图19a)。
[0655]
三特异性和前体三特异性抗体与食蟹猴cd3ε抗原的结合
[0656]
使用cd3ε细胞外融合抗原(食蟹猴cd3ε
‑
组氨酸)通过elisa测试vlvh和vhvl形式的三特异性和前体三特异性抗体与食蟹猴cd3ε的结合。三特异性构建体以亚纳摩尔浓度结合食蟹猴cd3ε,而切割的(c)和不切割的(nc)前体三特异性构建体以高得多的半最大有效浓度(ec50)结合食蟹猴cd3ε。这表明cd3ε帽对食蟹猴cd3ε抗原的阻碍(图7b)。此外,在构建体的vlvh和vhvl形式之间没有发现人cd3ε结合亲和力的差异(图19b)。此外,所有三特异性和前体三特异性构建体与人类和食蟹猴cd3ε的结合亲和力相似。
[0657]
实施例3:mmp9对三特异性和前体三特异性抗体构建体的消化
[0658]
目的
[0659]
本研究的目的是确认mmp9对前体三特异性抗体构建体的消化。
[0660]
方法
[0661]
体外mmp9切割
[0662]
首先,通过在1mm apma中以终浓度为100μg/ml rhmmp9在测定缓冲液(50mm tris、10mm cacl2、150mm nacl、0.05%brij35(w/v)、ph 7.5(tcnb))中添加apma(#a9563,sigma),并在37℃下温育24小时来活化rhmmp9(911
‑
mp,techne)。然后将活化的rhmmp9与前体三特异性和三特异性抗体(rhmmp9 1μg/ml;抗体266.7μg/ml)在测定缓冲液中在室温下温育过夜。混合物用于elisa结合测定、facs结合测定和sds
‑
page。
[0663]
结果
[0664]
将三特异性和前体三特异性构建体与mmp9一起温育,并且在非还原条件下通过sds
‑
page分析切割产物。与mmp9一起温育对三特异性构建体没有明显的活性,因为该构建体没有mmp9切割序列。因此,三特异性构建体的sds
‑
page显示了完整分子的分子量,其为100,112da(图20)。
[0665]
前体三特异性
‑
c是前体三特异性构建体,在半衰期延长部分人血清白蛋白(hsa)的c
‑
端和cd3ε cap掩蔽部分的c
‑
端两者具有mmp9切割序列部分。前体三特异性
‑
c构建体与mmp9的温育产生两个条带,最重的条带含有切割的三特异性部分,而最轻的条带含有半衰期延长部分has(图20)。
[0666]
前体三特异性
‑
nc是缺乏mmp9切割序列的前体三特异性构建体。因此,它不应被mmp9切割。与mmp9一起温育对预期分子量为170,390da的前体三特异性
‑
nc单个条带没有影响。
[0667]
实施例4:切割和不切割前体三特异性构建体与人cd3ε抗原的结合
[0668]
目的
[0669]
本研究的目的是研究mmp9切割对前体三特异性构建体与人cd3ε抗原结合的影响。
[0670]
方法
[0671]
如实施例3中所述的使用mmp9。如实施例2中所述的进行elisa测定。
[0672]
结果
[0673]
使用人cd3ε细胞外融合抗原(人cd3ε
‑
组氨酸)通过elisa测试前体三特异性
‑
c(vhvl)和前体三特异性
‑
nc(vhvl)构建体与人cd3ε的结合。在由mmp9切割的构建体和未由
mmp9切割的构建体中评估与cd3ε的结合。
[0674]
不切割的前体三特异性
‑
c构建体不结合人cd3ε,而mmp9切割的前体三特异性
‑
c构建体以亚纳摩尔浓度结合人cd3ε(图21a)。前体三特异性
‑
nc构建体在与mmp9温育之前或之后都不结合cd3ε(图21b)。
[0675]
这个数据表明cap和has的阻碍导致前体三特异性
‑
c与人cd3ε的结合非常少。一旦前体三特异性
‑
c被mmp9切割,前体三特异性
‑
c结合人cd3ε的ec50明显地朝向纳摩尔级的结合亲和力改进。前体三特异性
‑
nc缺乏mmp9切割序列,并因此即使在与mmp9温育之后也不结合人cd3ε。
[0676]
实施例5:切割的和不切割的前体三特异性构建体与食蟹猴cd3ε抗原的结合
[0677]
目的
[0678]
本研究的目的是研究mmp9切割对前体三特异性构建体与食蟹猴cd3ε抗原结合的影响。
[0679]
方法
[0680]
如实施例3中所述的使用mmp9。如实施例2中所述的进行elisa测定。
[0681]
结果
[0682]
使用食蟹猴cd3ε细胞外融合抗原(食蟹猴cd3ε
‑
组氨酸)通过elisa方法测试前体三特异性
‑
c(vhvl)和前体三特异性
‑
nc(vhvl)构建体与食蟹猴cd3ε的结合。在由mmp9切割的构建体和未由mmp9切割的构建体中评估与cd3ε的结合。
[0683]
不切割的前体三特异性
‑
c构建体不结合食蟹猴cd3ε
‑
组氨酸,而mmp9切割的前体三特异性
‑
c构建体以亚纳摩尔浓度结合食蟹猴cd3ε
‑
组氨酸(图22a)。前体三特异性
‑
nc构建体在与mmp9温育之前或之后都不结合食蟹猴cd3ε
‑
组氨酸(图22b)。
[0684]
这个数据表明cap和hsa的阻碍导致前体三特异性
‑
c与食蟹猴cd3ε的结合非常少。一旦前体三特异性
‑
c被mmp9切割,前体三特异性
‑
c结合食蟹猴cd3ε的ec50就会明显地朝向纳摩尔级的结合亲和力改进。前体三特异性
‑
nc缺乏mmp9切割序列,并因此即使在与mmp9温育后也不结合食蟹猴cd3ε。
[0685]
实施例6:切割的三特异性构建体和前体三特异性构建体与人或食蟹猴cd3ε抗原的结合
[0686]
目的
[0687]
本研究的目的是比较切割的前体三特异性构建体和三特异性构建体的cd3ε结合亲和力。
[0688]
方法
[0689]
如实施例3中所述的使用mmp9。如实施例2中所述的进行elisa测定。
[0690]
结果
[0691]
使用人cd3ε细胞外融合抗原(人cd3ε
‑
组氨酸)通过elisa测试前体三特异性
‑
c(vhvl)和前体三特异性
‑
nc(vhvl)和三特异性(vhvl)构建体与人cd3ε的结合。在由mmp9切割的构建体和未由mmp9切割的构建体中评估与cd3ε的结合。用食蟹猴cd3ε进行了类似的分析。
[0692]
不切割的前体三特异性
‑
c构建体不结合人cd3ε
‑
组氨酸,而mmp9切割的前体三特异性
‑
c构建体以亚纳摩尔浓度结合人cd3ε
‑
组氨酸,类似于三特异性构建体(图23)。前体三
特异性
‑
nc构建体在与mmp9温育之前或之后都不结合食蟹猴cd3ε
‑
组氨酸(图23)。类似地,不切割的前体三特异性
‑
c构建体不结合食蟹猴cd3ε
‑
组氨酸,而mmp9切割的前体三特异性
‑
c构建体以亚纳摩尔浓度结合食蟹猴cd3ε
‑
组氨酸,类似于三特异性构建体(图24)。前体三特异性
‑
nc构建体在与mmp9温育之前或之后都不结合食蟹猴cd3ε
‑
组氨酸(图24)。
[0693]
这个数据表明cap和hsa的阻碍导致前体三特异性
‑
c与人类或食蟹猴cd3ε的结合非常少。一旦前体三特异性
‑
c被mmp9切割,前体三特异性
‑
c结合人或食蟹猴cd3ε的ec50就会明显地朝向纳摩尔级的结合亲和力改进。前体三特异性
‑
nc缺乏mmp9切割序列,并因此即使在与mmp9温育后也不结合人或食蟹猴cd3ε。
[0694]
实施例7:切割的三特异性和前体三特异性构建体与表达人cd3ε的细胞的结合
[0695]
目的
[0696]
本研究的目的是确定抗体构建体与表达人cd3ε抗原的细胞的结合。
[0697]
方法
[0698]
结合癌细胞的抗体构建体的facs分析
[0699]
用tryple express enzyme(目录号12604
‑
013,life technology)消化细胞。收获的细胞以1000rpm离心5分钟,并弃去上清液。将细胞以2
×
106细胞/ml的浓度悬浮在facs缓冲液(pbs中2%的fbs)中,并将100μl/孔的细胞悬浮液加入板(目录号3799,corning)中。板以2000rpm离心5分钟,并弃去上清液。以100μl/孔的一抗(抗hcd3,目录号a05
‑
001,cp产生;抗hegfr,目录号10001
‑
mm08,sino biological)在终浓度(2μg/ml、1μg/ml和0μg/ml)下悬浮细胞并在4℃下温育30分钟。以2000rpm、4℃离心板5min,并弃上清。然后,用170μl facs缓冲液洗涤细胞3次。用终浓度为2μg/ml的二抗(抗小鼠igg(h l)
‑
alexa fluor 488,目录号a
‑
21202,thermofisher)以100μl/孔重新悬浮细胞,并在4℃下避光30min。在2000rpm、4℃下离心板5min,并弃上清。然后用facs缓冲液洗涤细胞3次并用facs分析样品。
[0700]
结果
[0701]
通过facs检测三特异性(vhvl)、前体三特异性
‑
c(vhvl)和前体三特异性
‑
nc(vhvl)与表达人cd3e的jurkat细胞的结合。
[0702]
前体三特异性
‑
c和前体三特异性
‑
nc构建体不结合jurkat细胞,而三特异性构建体以纳摩尔浓度结合jurkat细胞(图25)。
[0703]
这个数据表明cap和hsa的阻碍导致未切割的前体三特异性构建体与表达cd3e的细胞的结合非常少。相反,在缺乏hsa和cap阻碍的三特异性构建体中,cd3e明显改进到纳摩尔级的结合亲和力。
[0704]
实施例8:前体和活性三特异性抗体构建体(抗ror1、抗psma和抗5t4)的产生
[0705]
目的
[0706]
本研究的目的是生产功能性三特异性(活性)和前体三特异性抗体构建体,它们将结合ror1抗原、psma抗原或5t4抗原。
[0707]
方法
[0708]
基因合成和质粒构建、抗体构建体的表达、抗体构建体的纯化和抗体构建体的sec
‑
hplc分析按实施例1进行,除了其中在分别针对抗ror1、抗psma抗原或抗5t4抗原在上表1中呈现的抗体构建体中使用的第1和第2结合结构域的核苷酸序列外。类似地,除了第一和第二结合结构域之外,构建体的氨基酸序列与实施例1的构建体1
‑
6的氨基酸序列相似,
其中氨基酸序列是分别针对抗
‑
ror1、抗
‑
psma抗原或抗5t4结合位点生成的在上表1中呈现的那些序列。表4中列出了产生的构建体。
[0709]
表4:生产的三体和前三体ror1、psma和5t4构建体。
[0710]
[0711]
[0712]
[0713]
[0714][0715]
结果:虽然上述所有构建体都已产生,但本文包括显示不同构建体的分子量和纯度的数据样本。对于未显示的构建体,发现了类似的结果。图34a
‑
34c显示构建体7(三体
‑
ror1(vl
‑
vh))的分子量和纯度。图34d
‑
34f显示构建体11(前
‑
三体
‑
nc
‑
ror1(vl
‑
vh))的分子量和纯度)。图35a
‑
35c显示构建体19(三体
‑
5t4(vl
‑
vh))的分子量和纯度。图35d
‑
35f显示构建体21(前
‑
三体
‑
c
‑
5t4(vl
‑
vh))的分子量和纯度。图35g
‑
35i显示了构建体23(前
‑
三体
‑
nc
‑
5t4(vl
‑
vh))的分子量和纯度。
[0716]
实施例9:egfr前体三特异性构建体的体外和体内表征
[0717]
目的
[0718]
本研究的目的是在体外和体内进一步表征egfr前体和活性三特异性抗体构建体的性质。
[0719]
方法
[0720]
构建体:如上文实施例1中所述。
[0721]
facs分析:如上文实施例7中所述。
[0722]
体外mmp9切割:通过在具有终浓度(rhmmp9 100μg/ml;apma 1mm)的测定缓冲液(50mm tris、10mm cacl2、150mm nacl、0.05%brij35(w/v)、ph 7.5(tcnb))中添加apma(#a9563,sigma),并在37℃下温育24小时,来活化rhmmp9(911
‑
mp,bio
‑
techne)。活化的rhmmp9与三体前体和活化的抗体构建体(rhmmp9 1μg/ml;抗体266.7μg/ml)在测定缓冲液中在室温下温育过夜。该混合物用于elisa结合测定、facs结合测定和sds
‑
page。
[0723]
小鼠药代动力学分析:以iv
‑
2mg/kg、iv
‑
0.5mg/kg两种剂量向雄性c57bl/6小鼠静脉注射(iv)三体
‑
egfr(vhvl;构建体2)、前三体
‑
c
‑
egfr(vhvl;构建体4)和前三体
‑
nc
‑
egfr(vhvl;构建体6)。在如下时间取样:第0天:给药前、10分钟、1、2、4、8小时和第1、2、4、7、10和14天(12个时间点,血清生成的半连续出血(semi
‑
serial bleeding))。将huegfr
‑
ecd
‑
fc为捕获试剂和将抗fab抗体为检测试剂来进行分析。
[0724]
结果
[0725]
图32清楚地表明,在没有被mmp9蛋白酶切割的情况下,观察到前体三特异性抗体构建体与jurkat细胞表面egfr几乎没有结合(朝上的三角形
‑
具有可切割调节臂的前三体,未添加mmp9[构建体4],菱形
‑
具有不可切割调节臂的前三体,未添加mmp9[构建体6],大圆圈
‑
具有不可切割调节臂的前三体[构建体6],添加了mmp9)。被mmp9切割的前三体构建体4的jurkat细胞结合,虽然显著高于不存在mmp9的情况,但并未完全达到在缺乏调节结构域的构建体中观察到的结合水平。由于该实验是在封闭系统中进行的,因此切割的cap调节结构域可能与活化的构建体保持平衡,并因此仍可能部分结合抗cd3ε,从而部分阻碍了与细胞上抗原的结合。活化的三体构建体2(小圆圈/正方形)的结合不受mmp9蛋白酶存在与否的影响。
[0726]
图33a、33b和33c中显示的体内药代动力学数据清楚地表示,与缺乏这种调节性hsa结构域的抗体构建体相比,包含调节性hsa结构域的前体构建体半衰期提高。缺乏调节结构域(三体egfr(vl
‑
vh))的构建体1(图33a)的半衰期结果是:iv
‑
0.5mg/kg=t
1/2
天0.201和iv
‑
2.0mg/kg=t
1/2
天0.286。虽然具有可切割(构建体3;图33b)或不可切割(构建体5;图33c)臂(前三体egfr(vl
‑
vh))的前三体构建体的半衰期结果是:构建体3:iv
‑
0.5mg/kg=t
1/2
天0.595和iv
‑
2.0mg/kg=t
1/2
天0.651;和构建体5:iv
‑
0.5mg/kg=t
1/2
天0.713和iv
‑
2.0mg/kg=t
1/2
天0.604。
[0727]
因此,具有可切割的半衰期延长和cap掩蔽调节结构域的前三体构建体可以在体内停留更长时间,直到到达目的肿瘤微环境,其中调节臂可以被切割。然后在肿瘤微环境中切割hsa可切割调节结构域后,三体构建体的半衰期将缩短。此处描述的前体构建体的这种受调节的半衰期提供的优势是抗体保持在循环中直到它到达其目的地,例如,其中可切割的调节臂被切割的肿瘤微环境,然后一旦提供治疗功能(活化t细胞)从循环中移除。
[0728]
实施例10:切割的和不切割的前体5t4三特异性构建体与人cd3ε抗原的结合
[0729]
目的
[0730]
本研究的目的是研究mmp9切割对前体5t4三特异性构建体与人cd3ε抗原结合的影响。
[0731]
方法
[0732]
如实施例3中所述的使用mmp9。如实施例2中所述的进行elisa测定。
[0733]
结果
[0734]
图36显示调节臂(可切割或不可切割)的不存在或存在仅最低程度地影响前三特异性和前三特异性构建体与人cd3ε抗原的结合(5t4
‑
三体,圆圈,构建体13(vl
‑
vh);可切割的5t4
‑
pt三体
‑
c,构建体15(vl
‑
vh);和不可切割的5t4
‑
pt三体
‑
nc,构建体17(vl
‑
vh))。
[0735]
通过sds
‑
page观察到所用构建体的结构和大小差异。包括mmp9蛋白酶与不同构建体表明只有前三体
‑
5t4
‑
c(vl
‑
vh)构建体15受到蛋白酶包括的影响,其中调节臂从构建体上切割下来(图37)。
[0736]
在存在( mmp9)或不存在(
‑
mmp9)mmp9蛋白酶的情况下对结合人cd3ε抗原的影响显示在图38中。如上箭头所示,图38的结合曲线结果显示活化的5t4三体构建体13(有(正方形)或没有mmp9(小圆圈))与在mmp9存在下(向下三角形)温育的前体5t4三体构建体15之间的几乎等效结合。这与下箭头指示的图38的结果形成对比,其显示在不存在mmp9的情况下构建体15(向上三角形)和在存在或不存在mmp9(分别为菱形和大圆圈)的情况下构建体17最低程度的结合cd3ε。
[0737]
实施例11:5t4和egfr三特异性构建体与人cd3ε抗原的后续分析
[0738]
目的:进一步分析如实施例10中所述的5t4三特异性前体构建体。
[0739]
结果:
[0740]
图39显示了在存在和不存在mmp9蛋白酶的情况下,三体
‑
5t4、前三体
‑
5t4
‑
c和前三体
‑
5t4
‑
nc与jurkat细胞(人cd3e)的facs结合。
[0741]
从图39中可以看出,前三体
‑
c和前三体
‑
nc抗体在不存在mmp9切割的情况下不与jurkat细胞结合,而三体以低nm亲和力结合。在mmp9存在的情况下,发现前三体
‑
c与jurkat细胞上的cd3e结合,而前三体
‑
nc不与jurkat细胞结合。数据表明前体结构的cap和has的阻碍导致与表达人cd3ε的jurkat细胞的结合非常少。一旦cd3ε的hsa和cap阻碍不存在(三体,要么不存在,要么被mmp9切割,针对人cd3ε的结合ec50明显地朝向低nm结合亲和力改进。
[0742]
图40显示elisa结合研究。图40显示了针对人5t4抗原的三体和前体三体抗体构建体的elisa结合研究。使用elisa方法测试了三体和前体三体抗体对于其与5t4细胞外融合抗原(5t4
‑
fc)的结合。
[0743]
从图40中可以看出,所有三体和前体三体形式都以相似的亲和力结合h5t4的细胞外结构域。
[0744]
图41显示了5t4结合三体和前体三体抗体构建体与表达人5t4的cho细胞的facs结合数据。mfi(平均荧光强度)提供了抗体结合的相对比例。
[0745]
图41的结果显示所有三体和前体三体形式都以相似的亲和力结合cho
‑
h5t4。
[0746]
图42显示了5t4结合三体和前体三体抗体构建体与已知高度表达人5t4的mcf7乳腺癌细胞系的facs结合数据。mfi(平均荧光强度)提供了抗体结合的相对比例。
[0747]
图42中显示的结果表明,所有三体和前体三体形式都以相似的亲和力与mcf7结合。
[0748]
如下获得图43和44中所示的结果:简而言之,人pbmc购自allcells。通过使用cd3 t细胞分离试剂盒(stemcell)进行磁活化细胞分选,从人pbmc中阴性选择和纯化cd3 t细
胞。纯化的t细胞作为效应物细胞,和人类细胞系mcf
‑
7和nci
‑
h226作为靶细胞。在ldh释放测定中测试细胞溶解活性。简而言之,靶细胞(t)与效应物细胞(e)在96孔u型底板中以10:1的e:t比例共温育,以10000个靶细胞/孔重复。为了测试细胞溶解活性,将5t4
‑
三体和5t4
‑
前三体
‑
nc按系列稀释度添加到孔中。在37℃和5%co2下温育24小时后,收集上清液,根据制造商手册用cytotox 96非放射性细胞毒性测定试剂盒(promega,g1780)中的试剂处理。读数是490nm或492nm下的吸光度(molecular devices)。具体裂解的百分比计算如下:%细胞毒性=(实验的
‑
仅e
‑
仅t)/(t最大值
‑
仅t)
×
100。在存在随试剂盒供应的裂解缓冲液的情况下通过裂解来确定最大释放。
[0749]
图43和44中显示的结果表明,与包含不可切割的接头的构建体相比,可切割调节结构域的存在轻微提高了构建体的细胞毒性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

