作为rsk抑制剂的嘧啶并恶嗪衍生物及其应用
技术领域
1.本发明涉及药物化学领域;具体地说,本发明涉及新型的嘧啶并恶嗪衍生物,其合成方法及其作为rsk抑制剂在治疗肿瘤相关疾病的药物中的应用。
背景技术:
2.心血管疾病、癌症、呼吸系统疾病以及糖尿病这四种疾病类型是非传染性疾病(ncds)的主要组成成分。目前人类死亡的主要原因是非传染性疾病,且由非传染性疾病中的心血管疾病导致人类死亡的人数最多,而癌症是关系人类生存的第二大致死原因。传统治疗癌症的手段主要有三种:手术、放疗和化疗。近年来,随着科学技术的发展,靶向治疗和免疫疗法也逐步成为治疗癌症的有效手段。靶向治疗主要是小分子药物或单克隆抗体治疗,它们通过干扰特定的蛋白质来控制肿瘤细胞在体内生长和扩散,从而治疗癌症。随着科研人员对癌症相关蛋白了解的越来越多,设计靶向这些蛋白的小分子药物进行癌症治疗也变得越来越有希望。
3.ras-mapk信号通路参与调节多种癌症类型,rsk作为其最下游的效应因子,它的异常表达和活性与多种疾病的发生和发展有关。ras-mapk信号通路在生长因子、有丝分裂原激素和神经递质刺激下被激活。细胞表面受体激活导致tyr激酶自身磷酸化增强,并产生生长因子受体结合蛋白-2(grb2)的对接位点,其将受体连接到无血清的鸟嘌呤核苷酸交换因子(sos)。sos催化gtp结合到ras。gtp结合ras并激活其效应物raf激酶。raf磷酸化并激活mapk和细胞外信号调节激酶(mek1/2)。核糖体s6激酶(rsk)直接由erk1/2和3-磷酸肌醇依赖性激酶-1(pdk1)磷酸化并激活。活化的rsk仍然是膜相关的,游离于细胞质中,或转运到细胞核中,介导细胞的分化、增殖、存活及原癌基因的转化等。ras信号转导通路具有促进细胞增殖和保护细胞免受凋亡的作用,对人类肿瘤的发生、发展及生物学行为的维持具有重要的意义。
4.p90核糖体s6蛋白激酶(ribosomal s6 kinase,rsk)是在组织中广泛表达的丝氨酸/苏氨酸激酶家族成员,作为ras信号转导通路下游的重要调控因子,在肿瘤的发生和发展中起重要作用。在哺乳动物中,其有四个亚型,rsk1、rsk2、rsk3和rsk4。四个亚型均有两个功能不同的激酶结构域:n端激酶结构域(n-terminal kinase domain,ntkd)和c端激酶结构域(c-terminal kinase domain,ctkd)以及一个连接区(linker)。在c末端尾部包含特异性的细胞外信号调节激酶(extracellular signal regulated kinase,erk)结合部位,该部位与erk结合后使rsk进一步处于erk的调控之下。
5.目前临床上还没有靶向rsk的药物,在研的rsk小分子抑制剂主要包括两类,一类是rsk2选择性抑制剂包括sl0101、cmk等,另一类是rsk的泛抑制剂包括bid-1870、fmk、ljh308、ljh685等,这些小分子抑制剂均为进入临床研究。
6.因此,研究开发靶向rsk的药物具有重大的临床意义和应用前景。
技术实现要素:
7.本发明的目的是提供嘧啶并恶嗪衍生物作为rsk抑制剂。
8.本发明的另一目的是提供包含上述化合物的药物组合物。
9.本发明还有一目的是提供上述化合物在制备治疗rsk相关疾病或抑制rsk蛋白激酶的药物中的用途。
10.在第一方面,本发明提供通式i所示的化合物或其药学上可接受的盐:
[0011][0012]
r1选自下组:氢、任选取代的c
1-c
10
烷基、任选取代的c
3-c8环烷基、任选取代的c
2-c6链烯基、任选取代的c
3-c6环烯基、任选取代的c
3-c8内酯基、c
1-c
10
酰胺基、任选取代的c
1-c
10
酰胺基、任选取代的c
5-c
10
芳基、任选取代的c
3-c8杂环基、任选取代的芳杂环基;
[0013]
r2、r4分别独自选自:氢、任选取代的c
1-c
10
烷基,任选取代的c
1-c
10
烷氧基;
[0014]
r3选自下组:氢、任选取代的c
1-c
10
烷基、任选取代的c 3-c8环烷基、任选取代的c
5-c
10
芳基、任选取代的c
3-c8杂环基。
[0015]
x选自o、nh、nr5或ch2;
[0016]
r5选自下组:h、任选取代的c
1-c
10
烷基、任选取代的c
1-c
10
烷基甲酰基、任选取代的芳基甲酰基。
[0017]
在具体的实施方式中,所述化合物如通式ii所示:
[0018][0019]
式中
[0020]
r1选自下组:氢、任选取代的c
1-c
10
烷基、任选取代的c
3-c8环烷基、任选取代的c
2-c6链烯基、任选取代的c
3-c6环烯基、任选取代的c
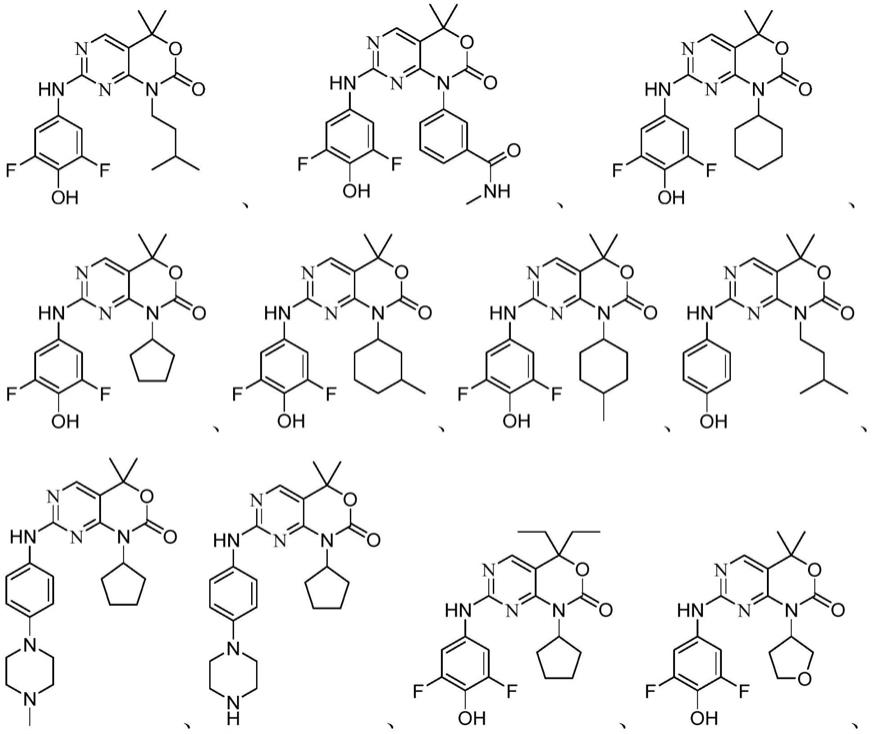
5-c
10
芳基、任选取代的c
3-c8杂环基、任选取代的芳杂环基;
[0021]
r2、r4分别独自选自下组:氢、任选取代的c
1-c
10
烷基,任选取代的c
1-c
10
烷氧基;
[0022]
r6选自下组:氢、卤素(优选f)、羟基、任选取代的c
1-c3烷氧基、任选取代的c
1-c3烷基、任选取代的c
3-c8环烷基、任选取代的c
2-c6链烯基、任选取代的c
3-c6环烯基、cooh、任选取代的c
1-c3烷氧甲酰基、任选取代的氨基甲酰基、任选取代的c
5-c
10
芳基、任选取代的芳杂环基;
[0023]
m选自1-5。
[0024]
在优选的实施方式中,所述r6位于其所取代的苯基的间位或对位。
[0025]
在具体的实施方式中,所述的化合物中,
[0026]
r1选自下组:任选取代的c
1-c
10
烷基、任选取代的c
3-c8环烷基、任选取代的c
5-c
10
芳基。
[0027]
在具体的实施方式中,所述化合物是选自下组的化合物或其药学上可接受的盐:
[0028][0029][0030]
在具体的实施方式中,所述的化合物中,
[0031]
r1选自下组:任选取代的c
1-c
10
烷基、任选取代的c
3-c8环烷基、任选取代的c
3-c8杂环基;
[0032]
r2、r4分别独自选自下组:氢、任选取代的c
1-c
10
烷基,任选取代的c
1-c
10
烷氧基;
[0033]
r6选自下组:氢、卤素(优选f)、羟基、任选取代的c
1-c3烷氧基、任选取代的c
1-c3烷
基、任选取代的c
3-c8环烷基、任选取代的氨基甲酰基;
[0034]
m选自1-3。
[0035]
在优选的实施方式中,所述的取代是被c
1-c3烷基、c
1-c3烷氧基、卤素、羟基、硝基、c
3-c5环烷基、c
3-c5杂环基、c
5-c7芳基、任选取代的氨基甲酰基、任选取代的烷酰基氨基取代。
[0036]
在具体的实施方式中,所述化合物是选自下组的化合物或其药学上可接受的盐:
[0037][0038]
优选优选
[0039]
在第二方面,本发明提供一种药物组合物,所述药物组合物含有第一方面所述的
化合物或其药学上可接受的盐,以及药学上可接受的载体或赋形剂。
[0040]
在优选的实施方式中,所述药物组合物是适于口服的剂型,包括但不限于片剂、溶液剂、混悬液、胶囊剂、颗粒剂、粉剂。
[0041]
在第三方面,本发明提供第一方面所述的化合物在制备治疗或预防rsk蛋白激酶介导的疾病的药物,或抑制rsk蛋白激酶的药物中的用途,或抑制rsk1、rsk2、rsk3、rsk4之一的药物中的用途。
[0042]
在具体的实施方式中,所述rsk蛋白激酶介导的疾病为癌症。
[0043]
在具体的实施方式中,所述癌症选自下组:食管癌、肾细胞癌、胰腺癌、结肠癌、乳腺癌、肺癌、前列腺癌、卵巢癌、子宫内膜癌、头颈部鳞状细胞癌、急性髓系白血病和实体瘤;或者rsk1和rsk4参与调控的乳腺癌、rsk3和rsk4参与调控的卵巢癌、rsk1和rsk2参与调控的前列腺癌、rsk1、rsk2和rsk4参与调控的肺癌、rsk2参与调控的头颈部鳞状细胞癌和急性髓系白血病、rsk4参与调控的食管癌、肾癌、子宫内膜癌、结肠癌等癌症和实体瘤。
[0044]
在第四方面,本发明提供利用第一方面所述的化合物治疗或预防rsk蛋白激酶介导的疾病方法。
[0045]
在优选的实施方式中,所述rsk蛋白激酶介导的疾病为癌症;优选地,所述癌症选自下组:rsk1和rsk4参与调控的乳腺癌、rsk3和rsk4参与调控的卵巢癌、rsk1和rsk2参与调控的前列腺癌、rsk1、rsk2和rsk4参与调控的肺癌、rsk2参与调控的头颈部鳞状细胞癌和急性髓系白血病、rsk4参与调控的食管癌、肾癌、子宫内膜癌、结肠癌等癌症和实体瘤。
[0046]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
[0047]
发明人经过广泛而深入的研究,发现一批结构全新的嘧啶并恶嗪衍生物,这些衍生物能够抑制rsk激酶活性,其中一些化合物对rsk激酶抑制活性的ic
50
值能够达到nm级别。在此基础上完成了本发明。
[0048]
本发明人合成了具有rsk抑制活性的候选化合物。对得到的候选化合物进行结构优化,设计并合成了一系列未见文献报道的嘧啶并[4,5-d][1,3]恶嗪-2-酮类化合物,并进行了结构表征。对此系列化合物进行了分子水平的活性测试,得到一批能够抑制rsk激酶活性的化合物。其中化合物004对rsk1-4激酶抑制活性ic
50
分别为22.3、13.6、16.6和10nm。
[0049]
术语定义
[0050]
本文中涉及到的一些基团定义如下:
[0051]
本文中,“烷基”指碳链长度为1-10个碳原子的饱和的支链或直链或环烷基,优选的烷基包括长1-5个、1-2个、1-6个、1-4个、3-8个碳原子不等的烷基。烷基的例子包括但不限于:甲基、乙基、正丙基、异丙基、正丁基、异丁基、庚基等。烷基可以被1个或多个取代基取代,例如被卤素或卤代烷基取代。例如,烷基可以是被1-4个氟原子取代的烷基,或者烷基可以是被氟代烷基取代的烷基。
[0052]
本文中,“链烯基”通常表示具有至少一个双键的单价烃基,通常含有2-8个碳原子,优选含有2-6个碳原子,可以是直链或支链。链烯基的例子包括但不限于乙烯基、丙烯
基、异丙烯基、丁烯基、异丁烯基、己烯基等等。
[0053]
本文中,“酯基”通常表示具有至少一个酯基的羧酸衍生物,通常含有3-8个碳原子,优选含有3-6个碳原子,可以是直链或支链。酯基的例子包括但不限于甲酸甲酯、甲酸乙酯、乙酸甲酯、乙酸乙酯、乙酸丙酯等等。
[0054]
本文中,“羟基”指碳链长度为1-10个碳原子的支链或直链醇,通常含有1-10个碳原子,优选含有1-6个碳原子,可以是直链或支链。酯羟基的例子包括但不限于1-羟基正丁基、1-羟基异丁基等等。
[0055]
本文中,“酰氨基”指结构式为
“-
r
’-
nh-c(o)-r”的基团,其中,r’可选自氢或烷基,r可选自烷基、链烯基、炔基、被nr
c
r
d
取代的烷基、被nr
c
r
d
取代的链烯基和nr
c
r
d
取代的炔基、被卤素取代的烷基、被氰基取代的链烯基,其中,r
c
和r
d
可选自烷基和链烯基。
[0056]
本文中,“芳基”指含有6到14个碳原子的单环、双环或三环芳族基团,包括苯基、萘基、菲基、蒽基、茚基、茀基、四氢化萘基、二氢化茚基等。芳基可任选地被1-5个(例如,1、2、3、4或5个)选自以下的取代基取代:卤素、c
1-4
醛基、c
1-6
烷基、氰基、硝基、氨基、酰胺基、羟基、羟甲基、卤素取代的烷基(例如三氟甲基)、卤素取代的烷氧基(例如三氟甲氧基)、羧基、c
1-4
烷氧基、乙氧甲酰基、n(ch3)和c
1-4
酰基等、杂环基或杂芳基等。
[0057]
本文所用“杂环基”包括但不限于含有1-3个选自o、s或n的杂原子的5元或6元杂环基团,包括但不限于呋喃基、噻吩基、吡咯基、吡咯烷基、吡唑基、咪唑基、三唑基、噁唑基、吡喃基、吡啶基、嘧啶基、吡嗪基、哌啶基、吗啉基等。
[0058]
本文中,“芳杂环基”是指含有5-14个环原子,并且有6个、10个或14个电子在环体系上共用。而且所含环原子是碳原子和从氧、氮、硫中任选的1-3个杂原子。有用的芳杂环基包括哌嗪基、吗啉基、哌啶基、吡咯烷基、噻吩基、呋喃基、吡喃基、吡咯基、咪唑基、吡唑基、吡啶基、包括但不限制于嘧啶基等。芳杂环基可任选地被1-5个(例如,1、2、3、4或5个)选自以下的取代基取代:卤素、c
1-4
醛基、c
1-6
直链或支链烷基、氰基、硝基、氨基、羟基、羟甲基、卤素取代的烷基(例如三氟甲基)、卤素取代的烷氧基(例如三氟甲氧基)、羧基、c
1-4
烷氧基、乙氧甲酰基、n(ch3)和c
1-4
酰基。
[0059]
本文中,“烷氧基”指被烷基取代的氧基。优选的烷氧基是长1-6个碳原子的烷氧基,更优选为长1-3个碳原子的烷氧基。烷氧基的例子包括但不限于:甲氧基、乙氧基、丙氧基等。烷氧基可以被1个或多个取代基取代,例如被卤素或卤代烷基取代。例如,烷氧基可以是被1-4个氟原子取代的烷基,或者烷基可以是被氟代烷基取代的烷基。
[0060]
本文中,“卤素”指氟、氯、溴或碘。
[0061]
本文中,“任选取代的”指其所修饰的取代基可任选地被1-5个(例如,1、2、3、4或5个)选自以下的取代基取代:卤素、c
1-4
醛基、c
1-6
直链或支链烷基、氰基、硝基、氨基、羟基、羟甲基、卤素取代的烷基(例如三氟甲基)、卤素取代的烷氧基(例如三氟甲氧基)、羧基、c
1-4
烷氧基、乙氧甲酰基、n(ch3)和c
1-4
酰基。
[0062]
在优选的实施方式中,所述的取代是指被c
1-c3烷基、c
1-c3烷氧基、卤素、羟基、硝基、c
3-c5环烷基、c
3-c5杂环基、c
5-c7芳基、任选取代的氨基甲酰基、任选取代的烷酰基氨基取代。
[0063]
本发明的化合物
[0064]
为提供具有rsk抑制活性的候选化合物,本发明提供了通式i所示的化合物或其药
学上可接受的盐:
[0065][0066]
式i中的r1、r2、r3、r4、r5、和x如上文所述。
[0067]
在通式i所示化合物中,r3优选为芳基,更优选苯基。因此,在优选的实施方式中,本发明提供通式ii所示化合物:
[0068][0069]
式ii中的r1、r2、r4、r6和m如上文所述。
[0070]
优选地,通式ii所示的化合物中,所述r6位于其所取代的苯基的间位或对位。
[0071]
此外,在通式i所示化合物中,r1优选为任选取代的烷基、任选取代的环烷基、任选取代的芳基。
[0072]
因此,在具体的实施方式中,本发明提供选自下组的化合物或其药学上可接受的盐:
[0073]
[0074][0075]
在优选的实施方式中,本发明的化合物是以下化合物:
[0076]
[0077][0078]
更优选更优选
[0079]
在本发明的化合物的基础上,本发明提供一种药物组合物,该组合物含有治疗有效量的本发明的化合物或其药学上可接受的盐,以及药学上可接受的载体或赋形剂。
[0080]
本发明化合物的药学上可接受的盐的例子包括但不限于无机和有机酸盐,例如盐酸盐、氢溴酸盐、硫酸盐、柠檬酸盐、乳酸盐、酒石酸盐、马来酸盐、富马酸盐、扁桃酸盐和草酸盐;以及与碱例如钠羟基、三(羟基甲基)胺基甲烷(tris,胺丁三醇)和n-甲基葡糖胺形成的无机和有机碱盐。
[0081]
本发明的药物组合物可被配制成适合各种给药途径的制剂形式,包括但不限于被配制成用于肠外,皮下,静脉,肌肉,腹腔内,透皮,口腔,鞘内,颅内,鼻腔或外用途径给药的形式,用于治疗肿瘤和其他疾病。给药量是有效地改善或消除一个或多个病症的药量。对于特定疾病的治疗,有效量是足以改善或以某些方式减轻与疾病有关的症状的药量。这样的药量可作为单一剂量施用,或者可依据有效的治疗方案给药。给药量也许可治愈疾病,但是给药通常是为了改善疾病的症状。一般需要反复给药来实现所需的症状改善。药的剂量将根据病人的年龄,健康与体重,并行治疗的种类,治疗的频率,以及所需治疗效益来决定。
[0082]
本发明的药物制剂可以给予任何哺乳动物,只要他们能获得本发明化合物的治疗效果。在这些哺乳动物中最为重要的是人类。
[0083]
本发明的化合物或其药物组合物可用于治疗各种rsk蛋白激酶介导的疾病。本文中,由rsk蛋白及其介导的疾病为各种癌症。所述癌症包括但不限于:rsk1和rsk4参与调控的乳腺癌、rsk3和rsk4参与调控的卵巢癌、rsk1和rsk2参与调控的前列腺癌、rsk1、rsk2和
rsk4参与调控的肺癌、rsk2参与调控的头颈部鳞状细胞癌和急性髓系白血病、rsk4参与调控的食管癌、肾癌、子宫内膜癌、结肠癌等癌症和实体瘤
[0084]
本发明的药物制剂可用已知的方式制造。例如,由传统的混合,制粒,制锭,溶解,或冷冻干燥过程制造。制造口服制剂时,可结合固体辅料和活性化合物,选择性研磨混合物。如果需要或必要时加入适量助剂后,加工颗粒混合物,获得片剂或锭剂芯。
[0085]
合适的辅料特别是填料,例如糖类如乳糖或蔗糖,甘露醇或山梨醇;纤维素制剂或钙磷酸盐,例如磷酸三钙或磷酸氢钙;以及粘结剂,例如淀粉糊,包括玉米淀粉,小麦淀粉,大米淀粉,马铃薯淀粉,明胶,黄芪胶,甲基纤维素,羟丙基甲基纤维素,羧甲基纤维素钠,或聚乙烯吡咯烷酮。如果需要,可增加崩解剂,比如上面提到的淀粉,以及羧甲基淀粉,交联聚乙烯吡咯烷酮,琼脂,或褐藻酸或其盐,如海藻酸钠。辅助剂特别是流动调节剂和润滑剂,例如,硅石,滑石,硬脂酸盐类,如镁硬脂酸钙,硬脂酸或聚乙二醇。如果需要,可以給锭剂核芯提供可以抵抗胃液的合适包衣。为此,可以应用浓缩糖类溶液。这个溶液可以含有阿拉伯树胶,滑石,聚乙烯吡咯烷酮,聚乙二醇和/或二氧化钛,漆溶液和合适的有机溶剂或溶剂混合物。为了制备耐胃液的包衣,可使用适当的纤维素溶液,例如醋酸纤维素邻苯二甲酸或羟丙基甲基纤维素邻苯二甲酸。可向药片或锭剂核芯的包衣加入染料或色素。例如,用于识别或为了表征活性成分剂量的组合。
[0086]
基于上述化合物和药物组合物,本发明进一步提供一种治疗rsk蛋白及么介导的疾病的方法,该方法包括给予需要的对象以本发明的化合物或药物组合物。
[0087]
给药方法包括但不限于本领域周知的各种给药方法,可根据患者的实际情况加以确定。这些方法包括但不限于肠外、皮下、静脉、肌肉、腹腔内、透皮、口腔、鞘内、颅内、鼻腔或外用途径给药。
[0088]
本发明也包括本发明化合物在制备预防或治疗rsk介导的疾病或抑制rsk4活性的药物中的用途。
[0089]
本发明的优点:
[0090]
1.本发明提供的化合物是一种结构全新的嘧啶并[4,5-d][1,3]恶嗪-2-酮类化合物;
[0091]
2.本发明提供的化合物对rsk蛋白激酶具有优异的抑制活性;
[0092]
3.本发明提供的化合物为开发能抑制靶向rsk的药物奠定了基础,具备极大的产业化和商品化前景以及市场价值,经济效益显著。
[0093]
以下结合具体实施案例对本发明的技术方案进一步描述,但以下实施案例不构成对本发明的限制,所有依据本发明的原理和技术手段采用的各种施用方法,均属于本发明范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0094]
材料与方法
[0095]
本发明的嘧啶并[4,5-d][1,3]恶嗪-2-酮类化合物的合成如下所示:
[0096][0097]
试剂和条件:(a)dipea,ch3cn,回流;(b)ch3mgbr/ch3ch2mgbr,无水thf,0℃,(c)cdi,k2co3,无水ch3cn,室温;(d)三氟乙酸,异丙醇,回流。
[0098]
实施例1
[0099]
上述步骤a-d的具体合成方法如下:
[0100]
1.2-氯-4-异戊胺基嘧啶-5-甲酸乙酯的合成
[0101][0102]
称量2,4-二氯嘧啶-5-甲酸乙酯(3.00g,13.57mmol),dipea(0.79ml)于100ml圆底烧瓶中,加入乙腈溶解。另取3-甲基丁胺(1.18g,13.57mmol)滴加至圆底烧瓶中,滴加完全后升温至回流。tlc跟踪至原料转化完全。冷却至室温,旋转蒸发除去溶剂,产物经300-400目硅胶柱层析(pe/ea=50/1,v/v)分离,得到2-氯-4-异戊胺基嘧啶-5-甲酸乙酯无色油状物2.48g,收率67.2%。
[0103]1h nmr(400mhz,cdcl3):δ8.64(s,1h),8.35(s,1h),4.36(q,j=7.2hz,2h),3.55(q,j=6.0hz,2h),1.75-1.65(m,1h),1.54(q,j=7.2hz,2h),1.39(t,j=7.6hz,3h),0.96(d,j=6.8hz,6h).lc-ms:m/z:272.2(m h)
[0104]
2.2-(2-氯-4-(异戊胺基)嘧啶-5-基)丙-2-醇的合成
[0105][0106]
称量2-氯-4-异戊胺基嘧啶-5-甲酸乙酯(1.90g,6.99mmol)于250ml两口烧瓶中,加入无水四氢呋喃溶解。氩气保护,冰浴下搅拌10min。向上述反应液中分批加入甲基溴化镁溶液30ml(1m in thf),冰浴下反应。tlc跟踪至原料转化完全。反应结束后,加入饱和氯化铵水溶液淬灭反应,乙酸乙酯萃取,收集有机层,无水硫酸钠干燥,旋转蒸发除去溶剂,产物经300-400目硅胶柱层析(dcm/meoh=200/1,v/v)分离,得到2-(2-氯-4-(异戊胺基)嘧
啶-5-基)丙-2-醇白色固体1.22g,收率67.8%。
[0107]1h nmr(400mhz,dmso-d6):δ7.61(s,1h),7.27(s,1h),3.50-3.45(m,2h),1.70-1.64(m,1h),1.58(s,6h),1.51(q,j=7.2hz,2h),0.95(d,j=6.8hz,6h).lc-ms:m/z:258.2(m h)
.
[0108]
3.7-氯-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮的合成
[0109][0110]
称量2-(2-氯-4-(异戊胺基)嘧啶-5-基)丙-2-醇(0.20g,0.78mmol),碳酸钾(0.16g,1.17mmol),1,1
’-
羰基二咪唑(0.22g,1.55mmol)于50ml两口烧瓶中,加入无水乙腈溶解。氩气保护。tlc跟踪至原料转化完全。反应结束后,加入冰水淬灭反应,乙酸乙酯萃取,收集有机层,无水硫酸钠干燥,旋转蒸发除去溶剂,产物经300-400目硅胶柱层析(dcm/meoh=200/3,v/v)分离,得到7-氯-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮白色固体0.20g,收率90.9%。
[0111]1h nmr(400mhz,dmso-d6):δ8.18(s,1h),4.10(d,j=7.6hz,2h),1.71(s,6h),1.70-1.62(m,1h),1.61-1.56(m,2h),0.99(d,j=6.4hz,6h).lc-ms:m/z:284.1(m h)
.
[0112]
4.7-((3,5-二氟-4-羟基苯基)氨基)-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮合成
[0113][0114]
称量7-氯-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(0.10g,0.35mmol),4-氨基-2,6-二氟苯酚(0.06g,0.42mmol)于50ml两口烧瓶中,加入异丙醇溶解,氩气保护,滴加三氟乙酸(0.03mml,0.53mmol),滴加完全后升温至回流。tlc跟踪至原料转化完全。反应结束后,旋转蒸发除去溶剂,产物经300-400目硅胶柱层析(dcm/meoh=100/1,v/v)分离,得到7-((3,5-二氟-4-羟基苯基)氨基)-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮灰白色固体0.055g,收率40.0%。
[0115]1h nmr(400mhz,dmso-d6):δ9.75(s,1h),9.64(s,1h),8.31(s,1h),7.42(d,j=9.6hz,2h),3.98(t,j=6.8hz,2h),1.63(s,6h),1.57-1.53(m,3h),0.93(d,j=6.4hz,6h).hrms(esi):计算值c
19
h
22
f2n4o3[m h]
393.1738,实验值393.1737.
[0116]
以下化合物(化合物002-013)均按照上述步骤a-d的方法合成得到:
[0117]
3-(7-((3,5-二氟-4-羟基苯基)氨基)-4,4-二甲基-2-氧代-2h-嘧啶[4,5-d][1,3]恶嗪-1(4h)-基)-n-甲基苯甲酰胺(化合物002)
[0118][0119]1h nmr(400mhz,dmso-d6):1h nmr(400mhz,dmso-d6):δ9.72(s,1h),9.47(s,1h),8.50(d,j=4.4hz,1h),8.43(s,1h),8.00(d,j=6.0hz,1h),7.90(s,1h),7.64(dd,j1=4.4hz,j2=7.6hz,1h),7.62(s,1h),6.92(d,j=0.8hz,2h),2.79(d,j=4.4hz,3h),1.79(s,6h).hrms(esi)计算值c
22
h
19
f2n5o4[m h]
456.1483,实验值456.1482.
[0120]
1-环己基-7-((3,5-二氟-4-羟基苯基)氨基)-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物003)
[0121][0122]1h nmr(400mhz,dmso-d6):1h nmr(400mhz,dmso-d6):δ10.14(s,1h),8.34(s,1h),7.40(d,j=10.0hz,2h),4.60-4.54(m,1h),2.30-2.21(m,2h),1.84-1.81(m,2h),1.75-1.73(m,2h),1.62(s,6h),1.38-1.29(m,2h),1.23-1.11(m,2h).hrms(esi)计算值c
20
h
22
f2n4o3[m h]
405.1738,实验值405.1739。
[0123]
1-环戊基-7-((3,5-二氟-4-羟基苯基)氨基)-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物004)
[0124][0125]1h nmr(400mhz,dmso-d6):1h nmr(400mhz,dmso-d6):δ10.07(s,1h),8.34(s,1h),7.41(d,j=10.0hz,2h),5.17-5.08(m,1h),2.12-2.03(m,2h),1.90-1.87(m,2h),1.85-1.79(m,2h),1.63(s,6h),1.59-1.54(m,2h).hrms(esi)计算值c
19
h
21
f2n4o3[m h]
391.1582,实验值391.1583。
[0126]
7-((3,5-二氟-4-羟基苯基)氨基)-4,4-二甲基-1-(3-甲基环己基)-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物005)
[0127][0128]1h nmr(400mhz,dmso-d6):1h nmr(400mhz,dmso-d6):δ9.76(s,1h),9.70(s,1h),8.31(s,1h),7.41(d,j=9.2hz,2h),4.65-4.60(m,1h),2.23-2.17(m,1h),2.04-1.95(m,1h),1.84-1.81(m,1h),1.73-1.67(m,2h),1.61(s,6h),1.56-1.52(m,2h),1.23-1.22(m,2h),0.93(d,j=6.0hz,3h).hrms(esi)计算值c
21
h
25
f2n4o3[m h]
419.1895,实验值419.1894。
[0129]
7-((3,5-二氟-4-羟基苯基)氨基)-4,4-二甲基-1-(4-甲基环己基)-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物006)
[0130][0131]1h nmr(400mhz,dmso-d6)δ9.77(s,2h),8.30(s,1h),7.42(d,j=8.8hz,2h),4.67-4.58(m,1h),2.35-2.32(m,2h),1.80-1.77(m,2h),1.73-1.71(m,2h),1.61(s,6h),1.51-1.42(m,1h),1.13-1.04(m,2h),0.91(d,j=4.4hz,3h).hrms(esi)计算值c
21
h
25
f2n4o3[m h]
419.1895,实验值419.1896。
[0132]
7-((4-羟基苯基)氨基)-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物007)
[0133][0134]1h nmr(400mhz,dmso-d6)δ10.37(s,1h),8.33(s,1h),7.35(d,j=8.8hz,2h),6.78(d,j=8.8hz,2h),3.89(t,j=7.2hz,2h),1.63(s,6h),1.59-1.53(m,1h),1.50-1.45(m,2h),0.88(d,j=6.4hz,6h).hrms(esi)计算值c
19
h
25
n4o3[m h]
357.1927,实验值357.1928。
[0135]
1-环戊基-4,4-二甲基-7-((4-(4-甲基哌嗪-1-基)苯基)氨基)-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物008)
2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物011)
[0145][0146]1h nmr(400mhz,dmso-d6):δ10.02(s,1h),9.36(s,1h),8.36(s,1h),7.41(d,j=10.0hz,2h),5.43-5.35(m,1h),4.01-3.96(m,2h),3.84-3.80(m,2h),2.33-2.56(m,1h),2.20-2.11(m,1h),1.64(s,6h).hrms(esi)计算值c
18
h
19
f2n4o4[m h]
393.1374,实验值393.1375。
[0147]
1-环戊基-4,4-二甲基-7-((3,4,5-三氟苯基)氨基)-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物012)
[0148][0149]1h nmr(400mhz,dmso-d6):δ10.13(s,1h),8.38(s,1h),7.67(dd,j1=6.4hz,j2=10.8hz,2h),5.18-5.09(m,1h),2.10-2.03(m,2h),1.91-1.86(m,4h),1.63(s,6h),1.58-1.56(m,2h).hrms(esi)计算值c
19
h
20
f3n4o2[m h]
393.1538,实验值393.1537。
[0150]
1-环戊基-7-((3,5-二氟-4-(三氟甲基)苯基)氨基)-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(化合物013)
[0151][0152]1h nmr(400mhz,dmso-d6):δ10.56(s,1h),8.45(s,1h),7.72(d,j=13.2hz,2h),5.23-5.11(m,1h),2.11-2.04(m,2h),1.93-1.90(m,4h),1.64(s,6h),1.60-1.57(m,2h).hrms(esi)计算值c
20
h
20
f5n4o2[m h]
443.1506,实验值443.1505。
[0153]
化合物014的具体合成方法如下:
[0154][0155]
试剂和条件:(a)-(d)如前所述;(e)ch3i,cs2co3,dmf,室温。
[0156]
7-((3,5-二氟-4-甲氧基苯基)氨基)-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮的合成
[0157][0158]
称取7-((3,5-二氟-4-羟基苯基)氨基)-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮(0.10g,0.25mmol)、cs2co3(0.01g,0.38mmol)于10ml单口烧瓶,加入5ml dmf溶解,室温下搅拌滴加碘甲烷(20μl,0.31mmol,搅拌1h。tlc跟踪至原料转化,加入冰水,二氯甲烷萃取,收集有机相,旋干,粗品经硅胶柱层析分离(dcm/ch3oh=150:1,v/v),得7-((3,5-二氟-4-甲氧基苯基)氨基)-1-异戊基-4,4-二甲基-1,4-二氢-2h-嘧啶[4,5-d][1,3]恶嗪-2-酮90mg,产率86.9%。
[0159]1h nmr(400mhz,dmso-d6):δ9.95(s,1h),8.34(s,1h),7.50(d,j=11.2hz,2h),3.99(t,j=7.6hz,2h),3.85(s,3h),1.69-1.65(m,1h),1.63(s,6h),1.57-1.51(m,2h),0.93(d,j=6.8hz,6h).hrms(esi)计算值c
20
h
25
f2n4o3[m h]
407.1895,实验值407.1896.
[0160]
实施例2.生物活性测试
[0161]
本发明提供的化合物对rsk4激酶活性的体外抑制效果实验如下进行,rsk1-3采用与rsk4相同的方法(kashem,m.a.et al.j.biomol.screen.12,70-83):
[0162]
体外酶活性分析:
[0163]
所有酶反应均在30℃下进行40分钟。50μl反应混合物包含40mm tris、ph 7.4、10mm mgcl2、0.1mg/ml bsa、1mm dtt、10μm atp、0.2ug/ml激酶和100μm脂质底物。将化合物在10%dmso中稀释,并将5μl稀释液添加到50μl反应中,以使在所有反应中dmso的最终浓度为1%。向反应体系中加入kinase-glo试剂用其进行检测。它通过定量激酶反应后溶液中残留的atp量来测量激酶活性。使用非线性回归计算ic
50
值,每次实验均重复2次以上。
[0164]
测试结果如下表1所示。
[0165]
表1:嘧啶并[4,5-d][1,3]恶嗪-2-酮类化合物对rsk4的抑制活性
[0166][0167]
[0168]
[0169][0170]
表二:化合物004对rsk1-4的抑制活性
[0171][0172]
讨论:
[0173]
发明人经过广泛而深入的研究,设计并合成得到了一系列未见文献报道的嘧啶并[4,5-d][1,3]恶嗪-2-酮类化合物,对得到的化合物进行了分子水平活性测试,得到一批能够抑制rsk蛋白激酶的化合物。为由rsk蛋白激酶介导的癌症的治疗奠定了基础。
[0174]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。