蛋白质zmbzipc3在调控植物耐盐抗旱性中的应用
技术领域
1.本发明涉及生物技术领域。具体涉及蛋白质zmbzipc3在调控植物耐盐抗旱性中的应用。
背景技术:
2.全球干旱与半干旱地区占陆地总面积的三分之一以上,而具有灌溉条件的耕地仅占地球总面积的百分之三左右,极大制约了全球粮食生产。干旱已成为影响全球粮食产量的主要因素,现在受旱面积逐年扩大,且自然环境恶化导致土地沙漠化和草原退化加剧。面对植物与作物生长环境的日益恶化,植物生物学家和农学家越来越关注和研究植物抗逆问题,力求解析植物如何抵御各种逆境及其机制,以期培育出产量高、品质好、抗逆强的农作物品种。
3.玉米是世界上三大栽培作物之一,用做饲料、食品、深加工和工业原料。作为中国重要的粮食作物,播种面积已达4200万公顷以上,年产量达2.59亿吨。玉米是需水量较大的作物,关键生长时期缺水会严重影响产量。中国西北、西南、华北、东北等主要玉米产区的玉米农田多为依靠自然降水的旱地,干旱频发,影响玉米产量的稳定性。选育抗旱玉米品种成为提高玉米产量的重要途径之一。从分子水平上解析玉米耐旱相关机制,克隆、发掘及鉴定玉米中耐旱相关的功能基因或转录因子,利用基因工程手段高效培育抗旱优良品种,对提高作物产量有现实意义。
技术实现要素:
4.本发明所要解决的技术问题为如何提高植物的耐逆性,尤其是耐盐性和抗旱性,以进一步提高植物的生长。
5.为解决上述技术问题,本发明首先提供了一种蛋白质在调控植物抗旱性和/或耐盐性中的应用,所述蛋白质来源于玉米(zea mays l.),名称为zmbzipc3蛋白或蛋白质 zmbzipc3,所述蛋白质为如下a1)或a2)或a3)任一所示:
6.a1)氨基酸序列如seq id no.2所示的蛋白质;
7.a2)seq id no.2所示的氨基酸序列的n端或/和c端连接蛋白标签得到的融合蛋白;
8.a3)将seq id no.2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有90%以上的同一性且功能相同的蛋白质。
9.其中,seq id no.2由410个氨基酸残基组成。
10.上述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
11.上述应用中,蛋白标签(protein-tag)是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述蛋白标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
12.上述应用中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检
索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级 blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和 lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
13.上述应用中,所述90%以上的同一性可为至少91%、92%、95%、96%、98%、 99%或100%的同一性。
14.与上述蛋白质zmbzipc3相关的生物材料在调控植物抗旱性和/或耐盐性中的应用也在本发明的保护范围之内:所述生物材料为下述c1)-c10)中的任一种:
15.c1)编码蛋白质zmbzipc3的核酸分子;
16.c2)含有c1)所述核酸分子的表达盒;
17.c3)含有c1)所述核酸分子的重组载体、或含有c2)所述表达盒的重组载体;
18.c4)含有c1)所述核酸分子的重组微生物、或含有c2)所述表达盒的重组微生物、或含有c3)所述重组载体的重组微生物;
19.c5)含有c1)所述核酸分子的转基因植物细胞系、或含有c2)所述表达盒的转基因植物细胞系、或含有c3)所述重组载体的转基因植物细胞系;
20.c6)含有c1)所述核酸分子的转基因植物组织、或含有c2)所述表达盒的转基因植物组织、或含有c3)所述重组载体的转基因植物组织;
21.c7)含有c1)所述核酸分子的转基因植物器官、或含有c2)所述表达盒的转基因植物器官、或含有c3)所述重组载体的转基因植物器官;
22.c8)含有c1)所述核酸分子的转基因植株、或含有c2)所述表达盒的转基因植株、或含有c3)所述重组载体的转基因植株;
23.c9)由c8)所述转基因植株的可再生细胞产生的组织培养物;
24.c10)由c9)所述组织培养物产生的原生质体。
25.其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
26.上述生物材料中,c1)编码蛋白质zmbzipc3的核酸分子具体可为如下d1)或 d2)或d3)中任一所示:
27.d1)seq id no.1第51-1283位所示的dna分子;
28.d2)编码序列为seq id no.1第51-1283位所示的dna分子;
29.d3)在严格条件下与d1)或d2)限定的dna分子杂交,且编码蛋白质zmbzipc3 的dna分子。
30.其中,seq id no.1由1493个核苷酸组成,其编码序列为seq id no.1自5
′
末端起第51位-第1283位,编码氨基酸序列如seq id no.2所示的蛋白。
31.所述严格条件是在2
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min。
32.上述生物材料中,c2)所述的表达盒是含有编码蛋白质zmbzipc3的核酸分子的表达盒(即zmbzipc3基因表达盒),指能够在宿主细胞中表达蛋白质zmbzipc3的dna 分子,该dna分子不但可包括启动zmbzipc3基因转录的启动子,还可包括终止 zmbzipc3基因转录的
终止子。进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子,组织、器官和发育特异的启动子和诱导型启动子。启动子的例子包括但不限于:花椰菜花叶病毒的组成型启动子35s;来自西红柿的创伤诱导型启动子,亮氨酸氨基肽酶("lap",chao等人(1999)plant physiol 120:979-992);来自烟草的化学诱导型启动子,发病机理相关1(pr1)(由水杨酸和bth (苯并噻二唑-7-硫代羟酸s-甲酯)诱导);西红柿蛋白酶抑制剂ii启动子(pin2) 或lap启动子(均可用茉莉酮酸曱酯诱导);热休克启动子(美国专利5,187,267);四环素诱导型启动子(美国专利5,057,422);种子特异性启动子,如谷子种子特异性启动子pf128(cn101063139b(中国专利2007 1 0099169.7)),种子贮存蛋白质特异的启动子(例如,菜豆球蛋白、napin,oleosin和大豆beta conglycin的启动子(beachy 等人(1985)embo j.4:3047-3053)。它们可单独使用或与其它的植物启动子结合使用。此处引用的所有参考文献均全文引用。合适的转录终止子包括但不限于:农杆菌胭脂碱合成酶终止子(nos终止子)、花椰菜花叶病毒camv 35s终止子、tml终止子、豌豆rbcs e9终止子和胭脂氨酸和章鱼氨酸合酶终止子(参见,例如:odell等人 (i
985
)nature 313:810;rosenberg等人(1987)gene,56:125;guerineau等人(1991) mol.gen.genet,262:141;proudfoot(1991)cell,64:671;sanfacon等人genes dev., 5:141;mogen等人(1990)plant cell,2:1261;munroe等人(1990)gene,91:151;ballad 等人(1989)nucleic acids res.17:7891;joshi等人(1987)nucleic acid res.,15:9627)。
33.在本发明具体的实施方式中,所述zmbzipc3基因表达盒的序列如seq id no.4 所示,依次包含pleela载体上的启动子35ss(seq id no.4自5
′
端第36-720位)、 zmbzipc3基因的编码序列(seq id no.4自5
′
端第1140-2373位,对应seq id no.1 第51-1283位)和终止子pa35s(seq id no.4自5
′
端第2593-2810位)。
34.上述生物材料中,c3)所述重组载体可含有seq id no.1所示的用于编码蛋白质 zmbzipc3(即含有所述zmbzipc3基因)的dna分子。
35.可用植物表达载体构建含有所述zmbzipc3基因表达盒的重组载体。所述植物表达载体可为gateway系统载体或双元农杆菌载体等,如pleela、pgwb411、pgwb412、 pgwb405、pbin438、pcambia1300、pcambia1302、pcambia2300、pcambia2301、 pcambia1301、pbi121、pcambia1391-xa或pcambia1391-xb。使用zmbzipc3 构建重组载体时,在其转录起始核苷酸前可加上任何一种增强型、组成型、组织特异型或诱导型启动子,如花椰菜花叶病毒(camv)35s启动子、泛生素基因ubiqutin 启动子(pubi)等,它们可单独使用或与其它的植物启动子结合使用;此外,使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。
36.为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(gus 基因、萤光素酶基因等)、具有抗性的抗生素标记物(庆大霉素标记物、卡那霉素标记物等)或是抗化学试剂标记基因(如抗除莠剂基因)等。
37.在本发明具体的实施方式中,所述重组载体为pleela 35ss::zmbzipc3过表达载
体或pu130 35ss::zmbzipc3过表达载体。所述pleela 35ss::zmbzipc3过表达载体是将 pleela载体的attr1与attr2位点间序列替换为seq id no.3所示的dna分子,且保持其它序列不变得到的载体;所述pu130 35ss::zmbzipc3过表达载体为将seq idno.4所示的zmbzipc3基因表达盒插入pu130载体的hindⅲ识别位点间,且保持 pu130载体的其他序列不变得到的载体。
38.上述生物材料中,c4)所述重组微生物具体可为酵母、细菌、藻和真菌。
39.上述生物材料中,c7)所述转基因植物器官可为转基因植物的根、茎、叶、花、果实和种子。
40.上述生物材料中,c9)所述组织培养物可来源于根、茎、叶、花、果实、种子、花粉、胚和花药。
41.上述生物材料中,所述转基因植物细胞系、转基因植物组织和转基因植物器官均不包括繁殖材料。
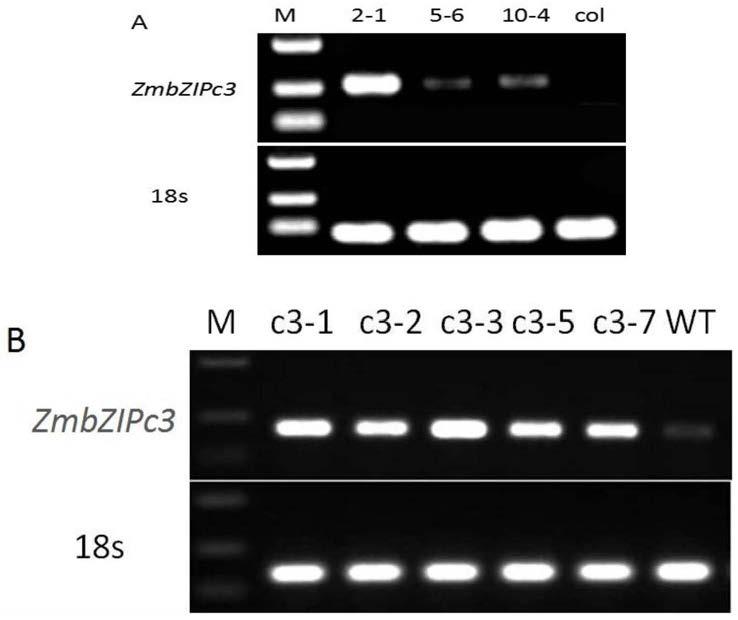
42.上述蛋白质zmbzipc3或其生物材料在植物育种中的应用也在本发明的保护范围之内。
43.上述应用中,植物育种中的应用具体可为将含有所述蛋白质zmbzipc3或与所述蛋白质zmbzipc3相关的生物材料(如蛋白质zmbzipc3编码基因zmbzipc3)的植物与其它植物进行杂交以进行植物育种。
44.上述应用中,所述调控植物的抗旱性为提高植物的抗旱性,所述调控植物的耐盐性为提高植物的耐盐性。
45.本发明进一步提供了提供一种培育抗旱性和/或耐盐性高的转基因植物的方法。
46.本发明培育抗旱性和/或耐盐性高的转基因植物的方法,包括提高目的植物中蛋白质zmbzipc3的基因的表达量和/或所述蛋白质zmbzipc3的含量和/或所述蛋白质 zmbzipc3的活性,得到转基因植物;所述转基因植物的抗旱性和/或耐盐性高于所述目的植物。
47.上述方法中,所述提高目的植物中蛋白质zmbzipc3的基因的表达量和/或所述蛋白质zmbzipc3的含量和/或所述蛋白质zmbzipc3的活性的方法为在目的植物中表达或过表达蛋白质zmbzipc3。
48.上述方法中,所述表达或过表达的方法为将蛋白质zmbzipc3的编码基因导入目的植物。
49.上述方法中,将蛋白质zmbzipc3的编码基因导入目的植物可通过携带有本发明 zmbzipc3基因的植物表达载体导入目的植物中。携带有本发明zmbzipc3的植物表达载体可通过使用农杆菌介导、ti质粒、ri质粒、植物病毒载体、直接dna转化、微注射、电导等常规生物学方法转化植物细胞或组织,并将转化的植物细胞或组织培育成植株。
50.上述方法中,所述蛋白质zmbzipc3的编码基因的核苷酸序列是seq id no.1所示的dna分子。
51.在本发明具体的实施方式中,所述携带有本发明基因zmbzipc3的植物表达载体可为pleela 35ss::zmbzipc3过表达载体或pu130 35ss::zmbzipc3过表达载体。所述 pleela 35ss::zmbzipc3过表达载体是将pleela载体的attr1与attr2位点间序列替换为seq id no.3所示的dna分子,且保持其它序列不变得到的载体;所述pu13035ss::zmbzipc3过表达
载体为将seq id no.4所示的zmbzipc3基因表达盒插入 pu130载体的hindⅲ识别位点间,且保持pu130载体的其他序列不变得到的载体。
52.本发明中,所述提高植物的抗旱性或抗旱性高具体体现在对aba(脱落酸)敏感及在干旱条件下植物存活率高、植物萎蔫率低、根系生长快和气孔开度小等。
53.本发明中,所述植物是如下e1)-e6)中的任一种:
54.e1)双子叶植物;
55.e2)单子叶植物;
56.e3)十字花科植物;
57.e4)拟南芥(arabidopsis thaliana);
58.e5)禾本科植物;
59.e6)玉米(zea mays)。
60.上述蛋白质zmbzipc3和与上述蛋白质zmbzipc3相关的生物材料也在本发明的保护范围之内。
61.本发明从玉米中克隆得到一个与抗旱性相关的zmbzipc3基因。将zmbzipc3基因转入到拟南芥中发现,zmbzipc3基因可提高渗透胁迫抗性,提高拟南芥对盐胁迫的耐受性,降低拟南芥气孔开度,减缓失水速率,利于植物抗旱保水;将zmbzipc3基因在玉米中过表达发现:zmbzipc3基因通过影响玉米的萌发期、苗期的生长发育,进而提高玉米耐旱性及产量。因此,本发明对于提高植物耐旱性,稳定作物产量,鉴定及培育优良作物新品种具有重要意义。
附图说明
62.图1为转zmbzipc3拟南芥的表达量鉴定(a)和转zmbzipc3玉米的表达量鉴定(b)。
63.图2为转zmbzipc3拟南芥渗透胁迫下生长情况(a和b)和根长的比较情况(c)。
64.图3为转zmbzipc3拟南芥盐胁迫下生长情况。
65.图4为aba处理条件下转zmbzipc3拟南芥种子萌发情况;其中,a为无aba的 1/2ms培养基中转zmbzipc3拟南芥种子萌发情况,b为添加了0.25μm aba的1/2 ms培养基中转zmbzipc3拟南芥种子萌发情况,c为添加了0.5μm aba的1/2ms 培养基中转zmbzipc3拟南芥种子萌发情况,d为添加了1μm aba的1/2ms培养基中转zmbzipc3拟南芥种子萌发情况。
66.图5为aba处理条件下转zmbzipc3拟南芥苗期生长情况;其中,a为无aba的 1/2ms培养基中转zmbzipc3拟南芥幼苗生长情况,b为添加了0.1μm aba的1/2ms 培养基中转zmbzipc3拟南芥幼苗生长情况,c为添加了1μm aba的1/2ms培养基中转zmbzipc3拟南芥幼苗生长情况。
67.图6为转zmbzipc3拟南芥土壤干旱胁迫下生长情况。
68.图7为转zmbzipc3拟南芥叶片干旱胁迫下气孔开度对比结果。
69.图8为过表达zmbzipc3玉米萌发期干旱胁迫下的种子发芽情况(a)和抗旱指数 (b)。
70.图9为过表达zmbzipc3玉米萌发期干旱胁迫下根部观察情况。
71.图10为过表达zmbzipc3玉米苗期干旱胁迫下的生长情况鉴定;a为幼苗生长至三叶一心期;b为第一次复水处理72h后的生长情况;c为第二次干旱处理进入萎蔫状态;d为第
二次复水处理72h的生长情况。
72.图1-7中,co1代表野生型拟南芥col-0,2-1代表转zmbzipc3拟南芥株系oe 2-1、 5-6代表转zmbzipc3拟南芥株系oe 5-6和10-4代表转zmbzipc3拟南芥株系oe 10-4。
73.图1、图8-10中,wt代表野生型玉米c01,c3-1代表转zmbzipc3拟南芥株系 oe c3-1、c3-3代表转zmbzipc3拟南芥株系oe c3-3、c3-5代表转zmbzipc3拟南芥株系oe c3-5和c3-7代表转zmbzipc3拟南芥株系oe c3-7。
具体实施方式
74.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
75.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
76.下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
77.下述实施例中的pentr/d-topo载体是invitrogen公司的产品。
78.下述实施例中的植物表达载体pleela记载于非专利文献“a novel role for histonemethyltransferase kyp/suvh4 in the control of arabidopsis primary seed dormancy,newphytologist(2012)193:605-616”,公众可从中国科学院植物研究所获得,以重复本技术实验,不可作为其它用途使用。。
79.下述实施例中的玉米自交系b73,记载于非专利文献“zea mays l.;zmbzip60 mrna is spliced in maize in response to er stress,bmc research notes(2012)5:144.”,公众可从中国科学院植物研究所获得,以重复本技术实验,不可作为其它用途使用。
80.下述实施例中的pu130载体记载于文献“development of novelglyphosate-tolerant japonica rice lines:a step toward commercial release.cui y,et al. front.plant sci.(2016)7:1218”中,公众可从中国科学院植物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用;公众也可从中国种子集团有限公司生命科学技术中心获得。
81.下述实施例中的根癌农杆菌gv3101(agrobacterium tumefaciens strain gv3101):记载于文献“binary agrobacterium vectors for plant transformation,m bevanin,nucleicacids research(1984)12(22):8711-8721”中,公众可从中国科学院植物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
82.下述实施例中的拟南芥col-0记载于文献“arabidopsis,a useful weed.meyerowitzem,cell(1989):263-270”中,公众可从中国科学院植物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
83.实施例1、zmbzipc3基因的获得
84.1、cdna的获得
85.提取三叶一心期玉米自交系b73的总rna,将其反转录为cdna。
86.2、pcr扩增
87.以步骤1获得的cdna为模板,采用引物f和引物r进行pcr扩增,得到pcr 产物。引物
序列如下:
88.f:5'
–
cctcgatccggaatggagcg-3'
89.r:5'-cagtgagcagccagcacacg-3'
90.3、pcr产物的测序
91.将seq id no.1所示的基因命名为zmbzipc3基因。对步骤2获得的pcr产物进行测序。测序结果表明:pcr产物为大小为1382bp的dna片段,该dna片段的核苷酸序列如seq id no.1所示第38-1419位,包含seq id no.1第51-1283位所示的 zmbzipc3基因的编码序列。zmbzipc3基因编码的蛋白的命名为zmbzipc3蛋白, zmbzipc3蛋白由410个氨基酸残基组成,其氨基酸序列如seq id no.2所示。
92.实施例2、转zmbzic3拟南芥的获得及其表型分析
93.一、转zmbzipc3拟南芥的获得
94.1、重组表达载体的获得
95.(1)以实施例1步骤1获得的cdna为模板,采用实施例1中的引物f和引物r 进行pcr扩增,得到pcr产物。该pcr产物包含seq id no.1自5
′
端第51-1283位所示的zmbzipc3基因的编码序列。
96.(2)利用gateway方法将步骤(1)获得的pcr产物连入中间载体pentr/d-topo 中,然后通过同源重组的方法利用invitrogen公司的gateway@enzyme mix将pcr产物重组至pleela载体中,构建得到pleela 35ss::zmbzipc3过表达载体。具体方法参照gateway@enzyme mix说明书中的详细步骤。
97.(3)将pleela 35ss::zmbzic3过表达载体转化大肠杆菌dh5α,37℃过夜培养,挑取单克隆进行菌落pcr验证,并测序。
98.测序结果表明:pleela 35ss::zmbzipc3即是将pleela载体的attr1与attr2位点间序列替换为seq id no.3所示的dna分子,且保持其它序列不变得到的。过表达载体为将seq id no.3所示的dna分子重组至pleela载体中得到的载体。其中,seqid no.3第51-1283位所示的dna分子为zmbzipc3基因的cds序列(对应于seq idno.1第51-1283位),即pleela载体中成功连入zmbzipc3基因。pleela 35ss::zmbzipc3 过表达载体表达zmbzipc3蛋白。
99.2、重组农杆菌的获得
100.利用电击法将pleela 35ss::zmbzipc3过表达载体转入根癌农杆菌gv3101,得到重组农杆菌gv3101/pleela 35ss::zmbzipc3,菌落pcr鉴定后扩大培养。
101.3、转基因拟南芥的获得
102.采用拟南芥浸花法(具体方法参考非专利文献“clough sj,bent af(1998).floraldip:a simplified method for agrobacterium-mediated transformation of arabidopsisthaliana.plant j 16,735-743”中的方法)用步骤2得到的重组农杆菌gv3101/pleela35ss::zmbzipc3侵染拟南芥col-0,得到t0代转基因拟南芥种子。然后将得到的t0代转基因拟南芥种子置于含有10μg/ml草胺磷的1/2ms固体培养基上进行阳性苗的筛选,将具有抗性的阳性苗移至培养间培养(培养条件如下:温度22℃,16h光照/8 小时黑暗),得到t1代转基因拟南芥种子。再将t1代转基因拟南芥种子置于含有 10μg/ml草胺磷的1/2ms培养基固体上培养,选取成活率为3/4(即分离比为3:1)的 t1代成活苗于培养间培
养,收获t2代转基因拟南芥种子。最后将t2代转基因拟南芥种子置于含有10μg/ml草胺磷的1/2ms固体培养基中,将全部成活的t2代成活苗移至培养间培养,得到t3代转基因拟南芥种子(即为纯合株系),经过培养得到三个t3代转基因拟南芥纯合株系,分别命名为t3代转基因拟南芥纯合株系oe 2-1、oe 5-6 和oe 10-4,用于进一步的试验。
103.4、转基因拟南芥的鉴定
104.选取步骤3得到的t3代转基因拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4和野生型拟南芥col-0,分别提取叶片总rna,以此为模板,利用引物rt-zmbzipc3-f和引物rt-zmbzipc3-r以及引物18s-f和引物18s-r(18s基因为内参基因)进行rt-pcr 扩增,并进行电泳分析,从而对zmbzipc3基因在转基因拟南芥中的表达量进行分析。
105.引物序列如下:
106.rt-zmbzipc3-f:5'-aactggaggcacaggtagcaca-3';
107.rt-zmbzipc3-r:5'-tatcagaggcggagtcagaagg-3';
108.18s-f:5
’-
cttagttggtggagcgatttg-3’;
109.18s-r:5
’-
cctgttattgcctcaaacttcc-3。
110.结果如图1中a所示,从图中可以看出:野生型拟南芥col-0(col)中无目的条带,转基因拟南芥oe 2-1、oe 5-6和oe 10-4中均有目的条带,且亮度为oe 2-1>oe10-4>oe 5-6,说明oe 2-1、oe 5-6和oe 10-4均为阳性转zmbzipc3拟南芥纯合株系,且zmbzipc3基因表达量为oe 2-1>oe 5-6>oe 10-4。
111.二、转zmbzipc3拟南芥的表型分析
112.植物材料如下:野生型拟南芥col-0(col)、t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4。
113.1、先用75%乙醇对植物材料种子处理1min,然后用10%次氯酸钠消毒15min,再用灭菌蒸馏水清洗5遍后于4℃低温处理3天。低温处理后将种子分别点播于1/2ms 固体培养基、25%peg渗透过夜的1/2ms固体培养基、添加了60mm cacl2的1/2ms 固体培养基、添加了150mm nacl2的1/2ms固体培养基上,置于22
±
3℃、50%湿度、 16h光照/8h黑暗条件下培养,生长2周左右观察生长表型并对根长进行统计。
114.1/2ms固体培养基和25%peg渗透过夜的1/2ms固体培养基的生长表型和根长如图2所示,在1/2ms固体培养基中,野生型拟南芥col-0(col)与t3代阳性转zmbzipc3 拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4的生长表型和根长相当;而在25%peg渗透过夜的1/2ms固体培养基中,与野生型拟南芥col-0(col)相比,t3代阳性转 zmbzipc3拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4的生长表型和根长具有明显的优势。
115.1/2ms固体培养基和添加了60mm cacl2的1/2ms固体培养基的生长表型和根长如图3所示,在1/2ms固体培养基中,野生型拟南芥col-0(col)与t3代阳性转zmbzipc3 拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4的生长表型和根长相当(图3中a所示);在添加了60mm cacl2的1/2ms固体培养基中,与野生型拟南芥col-0(col)相比,在 60mm cacl2的胁迫下,株系oe 2-1生长弱于野生型,株系oe 5-6和oe10-4生长稍强于野生型(图3中b所示),因此,尚不能断定zmbzipc3过表达转基因拟南芥是否对cacl2胁迫敏感。
116.1/2ms固体培养基和添加了150mm nacl2的1/2ms固体培养基的生长表型和根长如图3所示,在1/2ms固体培养基中,野生型拟南芥col-0(col)与t3代阳性转 zmbzipc3拟南芥
纯合株系oe 2-1、oe 5-6和oe 10-4的生长表型和根长相当(图3 中a所示);在添加了150mm nacl2的1/2ms固体培养基中,在150mm nacl的胁迫下,t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4的生长强于野生型拟南芥col-0(col)(图3中c所示),因此,推测zmbzipc3过表达转基因拟南芥对nacl胁迫具有抗性。
117.以上结果说明转zmbzipc3拟南芥株系具有较明显的抗peg表型和抗盐胁迫表型。
118.2、先用75%乙醇对植物材料种子处理1min,然后用10%次氯酸钠消毒15min,再用灭菌蒸馏水清洗5遍后于4℃低温处理3天。低温处理后将种子分别点播于1/2ms (ck)及添加了0.25μm、0.5μm、1μm aba的1/2ms培养基上,培养10-12d,利用体视显微镜(品牌:optec),每天统计萌发率。结果如图4所示,在无aba的1/2 ms培养基上(图4中a所示),t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1的萌发率略低于野生型拟南芥col-0(col),但在4-5d后萌发率均可达到100%;在添加了0.25μm aba的1/2ms培养基上(图4中b所示),t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1萌发率在3-5d为60%~70%,明显低于野生型拟南芥col-0 (80%~90%);在添加了0.5μm aba的1/2ms培养基上(图4中c所示),t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1和oe 5-6萌发率在第5d时仅为45%左右,明显地低于野生型拟南芥col-0(80%);在添加了1μm aba的1/2ms培养基上(图 4中d所示),野生型拟南芥col-0与t3代阳性转zmbzipc3拟南芥株系萌发率均受到抑制,且转zmbzipc3拟南芥株系oe2-1在3-7d的萌发速率明显低于野生型。上述结果表明t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4萌发率对 aba较野生型拟南芥col-0敏感。
119.将t3代阳性转zmbzipc3拟南芥株系oe 2-1、oe 5-6和oe 10-4及野生型拟南芥col-0的种子,吸胀、低温放置3d后,分别点播于1/2ms培养基及含0.1μm和1μmaba的1/2ms培养基上,培养两周后观察幼苗生长情况,拍照。结果如图5所示,在1/2ms培养基和含0.1μm aba的1/2ms培养基上,t3代阳性转zmbzipc3拟南芥株系oe 2-1、oe 5-6和oe 10-4与野生型拟南芥col-0生长情况无明显差异(图5中 a和b所示);而在含1μm aba的1/2ms培养基上,与野生型拟南芥col-0相比, t3代阳性转zmbzipc3拟南芥株系oe 2-1生长受到比较明显的抑制(图5中c所示)。表明转zmbzipc3拟南芥纯合株系苗期生长对aba较野生型拟南芥col-0(col)敏感。
120.以上结果表明zmbzipc3基因在aba信号转导途径中起正调控作用。
121.3、先用75%乙醇对植物材料种子处理1min,然后用10%次氯酸钠消毒15min,再用灭菌蒸馏水清洗5遍后于4℃低温处理3天。低温处理后将种子分别点播于1/2ms 固体培养基上,置于22
±
3℃、50%湿度、16h光照/8h黑暗条件下培养,选取大小一致的拟南芥转移至土壤中(将营养土:蛭石=1:2装入八孔穴盘,每穴装土80g,用6l水浸土,充分浸泡4h后倾到多余的水;每穴移苗16株,每4穴为一组,分别为野生型拟南芥col-0、t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4,且分别设置干旱组和对照组),置于20
±
3℃,16h光照/8h黑暗的恒温培养室内。对照组正常施水,结果如图6所示,对照组转zmbzipc3拟南芥纯合株系oe 2-1、oe 5-6 和oe 10-4同野生型拟南芥col-0长势一致。干旱组自转移至土壤中即停止浇水,正常生长16d时土壤开始进入干旱,此时观察生长状态并拍照,并于干旱7d、干旱14d 时分别观察记录。结果如图6所示,干旱组植株干旱到14d时野生型拟南芥col-0叶片已经全部萎蔫,过表达zmbzipc3转基因株系的萎蔫率则为oe 2-1<oe 10-4<oe5-6,复水3d后,野生型拟南芥col-0植株复水存活率为13%,oe 2-1存活率为82%, oe 5-6
存活率为38%,oe 10-4存活率为69%。复水存活率大小依次为oe 2-1>oe10-4>oe 2-1>col,此趋势也与zmbzipc3基因表达量一致,说明过表达zmbzipc3的转基因拟南芥株系的抗旱性明显优于野生型拟南芥col-0。
122.4、先用75%乙醇对植物材料种子处理1min,然后用10%次氯酸钠消毒15min,再用灭菌蒸馏水清洗5遍后,于4℃低温处理3天。低温处理后将种子分别点播于1/2ms 固体培养基上,置于22
±
3℃、50%湿度、16h光照/8h黑暗条件下培养。选取野生型拟南芥col-0(wt)、t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4 长势相当的拟南芥,每种植物材料分为三组,对离体叶片进行不同时间的干旱处理,包括干旱0、0.25、0.5、1、2、4h,取样经faa固定后脱色,制作水装片,并在正置显微镜(nikco 80i)下观察气孔情况。干旱0、1、4h的气孔情况结果如图7所示,t3代阳性转zmbzipc3拟南芥纯合株系oe 2-1、oe 5-6和oe 10-4的叶片气孔开度小,植株的失水速率慢,表明过表达zmbzipc3有利于植物的保水抗旱功能。
123.综上所述,表明zmbzipc3与抗旱性、盐胁迫等抗逆性相关。
124.实施例3、转zmbzipc3玉米的获得及其表型分析
125.一、转zmbzipc3玉米的获得
126.1、重组表达载体的获得
127.(1)以实施例2中的pleela 35ss::zmbzipc3过表达载体为模板,采用引物f2和引物r2进行pcr扩增,得到zmbzipc3基因表达盒。引物序列如下:
128.f:5'-cccaagcttgggttcccgccttcggtttgg-3';
129.r:5'-cccaagcttgggccttgctcgtcggtgatgta-3'。
130.zmbzipc3基因表达盒的序列如seq id no.4所示,依次包含pleela载体上的启动子35ss(seq id no.4自5
′
端第36-720位)、zmbzipc3基因的编码序列(seq id no.4 自5
′
端第1141-2373位,对应seq id no.1自5
′
端第51-1283位)和终止子pa35s(seqid no.4自5
′
端第2593-2810位)。
131.(2)利用hindⅲ(takara)单酶切的方法将zmbzipc3基因表达盒插入pu130 载体中,构建得到pu130 35ss::zmbzipc3过表达载体。
132.(3)将pu130 35ss::zmbzipc3过表达载体转化大肠杆菌dh5α,37℃过夜培养,挑取单克隆进行菌落pcr验证并测序。
133.测序结果表明:pu130 35ss::zmbzipc3过表达载体为将seq id no.4所示的 zmbzipc3基因表达盒插入pu130载体的hindⅲ识别位点间,且保持pu130载体的其他序列不变得到的载体。pu130 35ss::zmbzipc3过表达载体表达zmbzipc3蛋白。
134.2、转基因玉米的获得
135.将测序正确的pu130 35ss::zmbzipc3过表达载体委托中国种子集团有限公司生命科学技术中心采用农杆菌介导的方法进行玉米转化受体玉米植株,受体玉米植株为玉米c01(属pb群)(购自中国种子集团有限公司生命科学技术中心),得到t0代转 zmbzipc3玉米;t0代转zmbzipc3玉米与其受体玉米测交得到的玉米种子为t1代转 zmbzipc3玉米,该t1代转zmbzipc3玉米的基因型为aa:aa=1:1。经过连续自交,获得t3代基因型为aa的纯合株系,将鉴定为t3代基因型aa的转zmbzipc3玉米 (即t3代纯合的转zmbzipc3玉米)种子进行下述zmbzipc3基因表达量测定。
136.3、转基因玉米的zmbzipc3基因表达量测定
137.分别提取三叶一心期t3代纯合的转zmbzipc3玉米和野生型玉米c01叶片的总 rna,以此为模板,利用引物rt-zmbzipc3-f和引物rt-zmbzipc3-r以及引物18s-f 和引物18s-r(18s基因为内参基因)进行半定量pcr(real-time pcr)扩增,从而对 zmbzipc3基因在转zmbzipc3玉米中的表达量进行分析(引物序列与实施例2中一致)。
138.结果如图1中b所示,以野生型玉米c01(wt)中zmbzipc3基因的表达量为参照,转zmbzipc3玉米中zmbzipc3基因表达量均大于野生型玉米c01(wt),其中,阳性t3代转zmbzipc3玉米株系的zmbzipc3基因表达量oe c3-3>oe c3-1>oec3-5>oe c3-7>oe c3-2,最终选择过表达zmbzipc3纯合株系c3-1、c3-3、c3-5、c3-7 进行后续实验。
139.二、转zmbzipc3玉米的表型分析
140.植物材料如下:野生型玉米c01植株(wt)及过表达zmbzipc3纯合株系c3-1、 c3-3、c3-5、c3-7。
141.1、选取野生型玉米c01(wt)、过表达zmbzipc3纯合株系c3-1、c3-3、c3-5、 c3-7进行萌发期干旱实验。参照《玉米抗旱性鉴定技术规范》河北省地方标准。分别进行胁迫培养(即处理组):每个重复20粒,4个重复,加入20ul聚乙二醇-6000溶液 (溶剂为蒸馏水),双层滤纸为芽床。对照培养(即对照组):20粒一个重复,4个重复,加入20μl去离子水,双层滤纸为芽床。使用直径为10cm的圆形培养皿,在恒温培养箱(25℃恒温关照/黑暗培养16h/8h)进行培养,于2、4、6、8d观察种子发芽情况和种子萌发抗旱指数。
142.种子萌发抗旱指数按如下式(1)进行计算:
143.gdri=pis/pic
×
100%
………………………………………………………
(1)
144.pi=1.00
×
nd2 0.75
×
nd4 0.50
×
nd6 0.25
×
nd8
……………………………ꢀ
(2)
145.pi
c
=1.00
×
nd2
ck
0.75
×
nd4
ck
0.50
×
nd6
ck
0.25
×
nd8
ck
……………
(3)
146.pi
s
=1.00
×
nd2
s
0.75
×
nd4
s
0.50
×
nd6
s
0.25
×
nd8
s
…………………………
(4)
147.式中:
148.pi—种子萌发指数,nd2、nd4、nd6、nd8分别为第2d、4d、6d、和8d时的种子萌发率;
149.pi
c
—对照种子萌发指数(式(3)中ck代表对照条件);
150.pi
s
—胁迫条件下的种子萌发指数(式(4)中s代表胁迫条件);
151.gdri—种子萌发抗旱指数。
152.种子发芽情况和种子萌发抗旱指数结果如图8中a和b所示,过表达zmbzipc3 纯合株系oe c3-1、oe c3-5、oe c3-7的抗旱指数均显著高于野生型玉米c01(wt);于萌发第9天观察不同玉米株系的根系生长状况,结果如图9所示,在胁迫培养条件下,过表达zmbzipc3纯合株系oe c3-1、oe c3-5、oe c3-7的主根明显长于野生型玉米c01(wt),侧根数也多于野生型玉米c01(wt)。
153.上述表明过表达zmbzipc3株系萌发期抗旱能力优于野生型玉米c01。
154.2、选取株系野生型玉米c01(wt)、过表达zmbzipc3纯合株系oe c3-1、oe c3-5、 oe c3-7,进行苗期干旱培养。采用土壤种植培养,在16cm
×
16cm规格的盆中,各株系分别设置对照组和处理组,各株系的苗基数均为20株,设置三次重复。其中对照组整个生长期正常浇水,处理组幼苗生长至三叶一心期左右开始进行干旱处理(图10 中a),即停止浇水,开始观察幼苗萎蔫情况并记录,待幼苗全部表现为萎蔫状态时,进行第一次复水处理,复水72h后
观察幼苗存活情况(图10中b)。自第一次复水结束,开始进行第二次干旱处理,同样在幼苗全部进入萎蔫状态后(图10中c)进行第二次复水处理,72h观察幼苗存活率,结果如图10中d所示,经过两次干旱复水,各株系存活率分别为oe c3-5(60%)>oe c3-7(40%)>wt(10%),过表达zmbzipc3 纯合株系的反复干旱复水存活率均高于野生型玉米c01(wt),且趋势同各株系表达量趋势一致,表明过表达zmbzipc3株系苗期抗旱能力优于野生型玉米c01(wt)。
155.综合上述实验,表明过表达zmbzipc3能够提高玉米萌发期、苗期的耐旱性。
156.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。