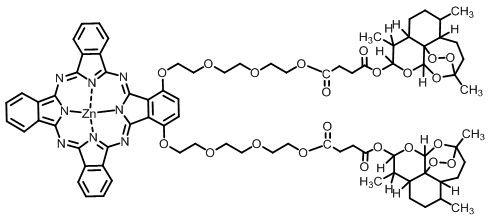
用作声动力/光动力敏化剂的酞菁
‑
青蒿素偶联物及其制备方法和应用
技术领域
1.本发明属于功能材料以及药物领域,具体涉及一种用作声动力/光动力敏化剂的酞菁
‑
青蒿素偶联物及其制备方法和应用。
背景技术:
2.声动力治疗(sdt)源于光动力治疗(pdt),已成为一种新型的非侵袭性癌症治疗方式,它采用低强度超声代替pdt中使用的光作为激发源,诱导声敏化剂的激活,产生活性氧(ros),导致癌细胞和肿瘤组织的损伤,除了像pdt一样具有非侵入性和特定的靶向选择性外,sdt还得益于超声对组织的高渗透深度,可以直达并治疗深部肿瘤组织,而治疗深度是pdt的致命弱点之一。
3.sdt的治疗效果在很大程度上取决于声敏剂的性能,人们在开发各种声敏剂方面做了大量的工作。目前有机声敏化剂主要来源于光敏化剂,如血卟啉单甲醚(hmme)、原卟啉ix (ppix)、氯卟啉e6 (ce6)、卟啉钠(dvdms)、酞菁等,但是这些光敏化剂的声敏化效果有待提高,自身的声动力治疗有待提高。因此,研究开发新型有高效的声敏剂,对于推动声动力治疗在临床应用具有重要的价值。
技术实现要素:
4.本发明的目的在于提供了一种酞菁
‑
青蒿素偶联物及其在制造声动力/光动力敏化剂及制药领域应用。所制得的偶联物不仅具有良好的声动力治疗活性,而且也显示出优异的协同声/光动力治疗抗肿瘤活性,具有显著的优势。
5.为实现上述目的,本发明采用如下技术方案:本发明的目的之一是提供一种酞菁
‑
青蒿素偶联物,包括酞菁锌
‑
青蒿素偶联物或酞菁硅
‑
青蒿素偶联物,其在水中能够发生自组装,形成100
‑
200nm的纳米颗粒。
6.本发明所述酞菁锌
‑
青蒿素偶联物具体包括以下几类:(1)单取代酞菁锌
‑
青蒿素偶联物,其结构式为:(ⅰ)或
(ⅱ)。
7.(2)二取代酞菁锌
‑
青蒿素偶联物,其结构式为:(ⅲ)。
8.(3)四取代酞菁锌
‑
青蒿素偶联物,其结构式为:(ⅳ)或
(vi)。
10.本发明的目的之二是保护上述酞菁
‑
青蒿素偶联物的制备方法,(1)单取代酞菁锌
‑
青蒿素偶联物
ꢀⅰꢀ
或
ꢀⅱꢀ
是以青蒿琥酯和结构如下式所述酞菁锌(pre i或pre ii)为原料,以1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐为缩合剂、4
‑
二甲氨基吡啶为催化剂,以二氯甲烷为溶剂, 10
‑
35℃条件下搅拌反应12
‑
48 h,通过减压去除溶剂。进而通过硅胶柱和尺寸排阻色谱柱进行纯化。其中,所用酞菁锌pre
ꢀⅰ
或pre
ꢀⅱ
、青蒿琥酯、1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐和4
ꢀ‑
(二甲胺基)吡啶的投料摩尔比为1:(1~12):(1~20):(1~20)。
11.preⅰ或pre
ꢀⅱ
。(2)二取代酞菁锌
‑
青蒿琥酯偶联物(ⅲ)是以青蒿琥酯和酞菁锌pre
ꢀⅲ
(结构如下式所示)为原料,以1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐为缩合剂、4
‑
二甲氨基吡啶为催化剂,以二氯甲烷为溶剂,10
‑
35℃ 搅拌反应12
‑
48 h,通过减压去除溶剂,进而通过硅胶柱和尺寸排阻色谱柱进行纯化。其中,所用酞菁锌pre
ꢀⅲ
、青蒿琥酯、1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐和4
ꢀ‑
(二甲胺基)吡啶的投料摩尔比为1:(2~24):(1~20):(1~
20)。
[0012] preiii。
[0013]
(3)四取代酞菁锌
‑
青蒿琥酯偶联物
ꢀⅳꢀ
或
ꢀⅴꢀ
是以青蒿琥酯和结构如下式所述的酞菁锌(pre
ꢀⅳꢀ
或pre v)为原料,以1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐为缩合剂、4
‑
二甲氨基吡啶为催化剂,以二氯甲烷为溶剂,10
‑
35℃条件下搅拌反应12
‑
48 h,通过减压去除溶剂。进而通过硅胶柱和尺寸排阻色谱柱进行纯化。其中,所用酞菁锌pre
ꢀⅳ
或pre
ꢀⅴ
、青蒿琥酯、1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐和4
ꢀ‑
(二甲胺基)吡啶的投料摩尔比为1:(4~48):(1~20):(1~20)。
[0014]
pre iv或
ꢀ
pre v。
[0015]
(4)酞菁硅
‑
青蒿琥酯偶联物(
ⅵ
)是以青蒿琥酯和酞菁硅(pre
ꢀⅵ
,结构如下式所示)为原料,以1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐为缩合剂、4
‑
二甲氨基吡啶为催化剂,以二氯甲烷为溶剂, 10
‑
35℃ 搅拌反应12
‑
48 h,通过减压去除溶剂。进而通过硅胶柱和尺寸排阻色谱进行纯化。其中,所用酞菁硅、青蒿琥酯、1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐和4
ꢀ‑
(二甲胺基)吡啶的投料摩尔比为1:(2~24):(1~20):(1~20)。
[0016] pre
ꢀⅵ
。
[0017]
本发明的目的之三是保护上述酞菁
‑
青蒿素偶联物自组装体纳米材料制备:利用n,n
‑
二甲基甲酰胺(或二甲基亚砜、四氢呋喃)溶解酞菁
‑
青蒿素偶联物制成1
‑
2mm的溶液,将溶液滴加至水溶液中,搅拌均匀可得纳米颗粒溶液。将上述纳米颗粒溶液冷冻干燥可得粉末状的纳米材料。
3.66
‑
3.61 (m, 2h)。hrms(esi) m/z calcd for c
14
h
16
n2o4na [m na]
299.1002;found: 299.0992。
[0030]
(2)单取代酞菁锌pre
ꢀⅰ
()的合成:称取3
‑
(2
‑
(2
‑
羟基乙氧基)乙氧基)乙氧基邻苯二甲腈 (1 mmol),邻苯二腈(4~10 mmol,此实施例选6 mmol)。以正戊醇(10~40 ml,此实施例选20 ml)为反应溶剂,搅拌升温至130℃反应30min。少量多次地加入催化剂金属锂(10~100 mmol,此实施例选35mmol),反应1
‑
5 h。反应充分后再加入醋酸锌(1~10 mmol,此实施例选2 mmol)继续反应5
‑
12 h。反应完毕后,将溶液旋蒸旋蒸去除溶剂。用二氯甲烷(dcm)溶解产物,硅藻土过滤收集滤液,减压旋蒸旋蒸去除溶剂。产物用dcm溶解过100
‑
200目硅胶柱进行纯化,二氯甲烷:乙酸乙酯(体积比1:1)为洗脱剂收集绿色组分,旋蒸旋蒸去除溶剂溶液。用尺寸排阻色谱柱x3进一步纯化,收集深绿色液体。旋蒸旋蒸去除溶剂得到深绿色固体产物,产率19%。
[0031]
表征数据:1h nmr (400 mhz, cdcl3, ppm): 9.49
‑
9.25 (m, 6h), 8.99 (d, 1h, j = 4.8 hz), 8.27
‑
8.11 (m, 7h), 7.77 (d, 1h, j = 2.4 hz), 4.89 (t, 2h, j = 4.8 hz), 4.57 (s, 1h), 4.42 (t, 2h, j = 4.8 hz), 4.09 (t, 2h, j = 4.8 hz), 3.77 (t, 2h, j = 4.8 hz), 3.49 (t, 4h, j = 4.8 hz). hrms(esi) m/z calcd for c
38
h
28
n8o4zn [m na] 747.1417; found: 747.1417。
[0032]
实施例2(1)3
‑
(2
‑
羟基乙氧基)乙巯基邻苯二腈()的合成:将(5~50 mmol,此实施例选10 mmol)2
‑
巯基乙氧基乙醇和碳酸钾(10~40 mmol,此实施例选20 mmol)加入到dmf(10~50 ml,此实施例选35ml)中,搅拌10分钟(氮气保护,流速和搅拌速度放慢),再加入3
‑
硝基邻苯二腈(5mmol),氮气氛围保护下室温搅拌12
‑
24h。tlc检测反映情况,反应完成后,旋蒸浓缩反应溶液,将浓缩液加入到冰水中析出黄色固体,用布氏漏斗抽滤收集滤饼并用真空干燥箱干燥所得固体产品,产率86.65%。
[0033]
表征数据:1h nmr (400 mhz, dmso
‑
d6) δ 7.74 (dd, j = 7.6, 1.3 hz, 1h), 7.65
‑
7.57 (m, 2h), 3.78 (t, j = 6.2 hz, 2h), 3.73
‑
3.70 (m, 2h), 3.61
‑
3.57 (m, 2h), 3.29 (t, j = 6.2 hz, 2h). hrms(esi) m/z calcd for c
12
h
12
n2o2s [m na]
271.0512; found: 271.0503。
[0034]
(2)单取代酞菁锌preⅱ()的合成:称取3
‑
(2
‑
羟基乙氧基)乙巯基邻苯二腈(1.41mmol),邻苯二腈(4.23~16.92mmol,此实施例选8.88mmol)。以正戊醇(10~40ml,此实施例选20ml)为反应溶剂,搅拌升温至130℃反应30min。少量多次地加入催化剂金属锂(10~100mmol,此实施例选35mmol),反应1
‑
5h。反应充分后再加入醋酸锌(1~10mmol,此实施例选2mmol)继续反应5
‑
12h。反应完毕后,将溶液旋蒸旋蒸去除溶剂。用二氯甲烷(dcm)溶解产物,硅藻土过滤收集滤液,减压旋蒸旋蒸去除溶剂。产物用dcm溶解过100
‑
200目硅胶柱进行纯化,dcm:meoh(甲醇)=50:1收集第一带绿色组分,浓缩旋蒸去除溶剂溶液。用尺寸排阻色谱柱x3进一步纯化,收集第一带,旋蒸得到深绿色液体。旋蒸旋蒸去除溶剂得到深绿色固体产物,产率7.80%。
[0035]
表征数据:1hnmr(400mhz,dmso
‑
d6)δ9.25
‑
9.04(m,6h),8.81(s,1h),8.23
‑
8.09(m,6h),7.96
‑
7.83(m,2h),4.81(d,1h,j=4.8hz),4.08(t,2h,j=6.8hz),3.76
‑
3.70(m,4h),3.66(t,j=6.4hz,2h).hrms(esi)m/zcalcdforc
36
h
24
n8o2szn[m cl]
‑
731.0717;found:731.0718。
[0036]
实施例3(1)3,6
–
二
–
(2
‑
(2
‑
羟基乙氧基)乙氧基)乙氧基邻苯二甲腈()的合成:量取三乙二醇(100~300mmol,此实施例选180mmol),三乙胺(2~10ml,此实施例选5ml)加入到装有二氯甲烷(10~30ml,此实施例选20ml)的双颈瓶中,在0℃的条件下搅拌20min;称量对甲基苯磺酰氯(30mmol)加二氯甲烷(5~30ml,此实施例选20ml)溶解,缓慢加入至恒压滴液漏斗中(保持0
°
c反应条件),滴加完毕后,将体系温度缓慢升到室温,继续搅拌反应12~48小时,最优18小时。停止反应,加水洗涤,dcm萃取三次,收集有机相,加无水硫酸钠干燥,过滤硫酸钠,旋蒸干燥得到产品。进一步用硅胶纯化(乙酸乙酯:二氯甲烷=8:2),收集目标物,旋蒸浓缩得到透明油状液体。称量所得产品(10~40mmol,此实施例选20mmol),1,4
‑
二羟基邻苯二腈(6.48mmol),碳酸钾(1~30mmol,此实施例选10mmol),加入到100ml双颈瓶中,加入dmf(10~40ml,此实施例选20ml),在氮气保护下,90℃搅拌反应12~48小时。tlc检测反应完全后,旋蒸浓缩反应液,加入水洗涤,用乙酸乙酯萃取,收集有机相,同样进行反向萃取,加无水硫酸钠干燥,过滤硫酸钠,旋蒸干燥得到产品,产率43%。
[0037]
表征数据:1hnmr(400mhz,dmso)δ7.66(s,2h),4.57(t,j=5.3hz,2h),4.31(s,4h),3.78(s,4h),3.62(d,j=3.7hz,4h),3.55(d,j=3.3hz,4h),3.52
–
3.45(m,4h),3.43(d,j=4.9hz,4h)。
(m, 1 h), 7.43 (d, j = 8.3 hz, 1 h), 7.32 (d, j = 7.5 hz, 1 h), 5.20 (s, 4 h), 4.91 (s, 4 h), 4.63
‑
4.51 (m, 4 h), 4.42 (s, 2 h), 4.38
‑
4.32 (m, 2 h), 4.20 (s, 2 h), 4.08 (s, 2 h), 3.87 (d, j = 4.2 hz, 2 h), 3.83
‑
3.76 (m, 6 h), 3.68
‑ꢀ
3.54 (m, 8 h), 3.51 (s, 8 h), 3.46
‑
3.39 (m, 8 h).hrms(esi): m/z calcd for c
56
h
65
n8o
16 zn [m h] 1169.3810, found: 1169.3826。
[0042]
实施例5四取代酞菁锌pre
ꢀⅴ
()的合成:称取 3
‑
(2
‑
羟基乙氧基)乙巯基邻苯二腈(1mmol)于正戊醇(10~50 ml,此实施例选20ml)中,120℃下搅拌反应,分批加入金属锂(10~100 mmol,此实施例选35mmol),n2保护下搅拌1
‑
5h;加入醋酸锌(1~10 mmol,此实施例选2 mmol),继续搅拌5
‑
12h。停止反应,将反应液冷却至室温,旋蒸去除溶剂,过硅胶柱(二氯甲烷:甲醇=50:1)纯化,收集绿色组分。过 尺寸排阻色谱柱x3,收集第一带绿色组分,干燥得目标产物,产率15.2%。
[0043]
表征数据:1h nmr (400 mhz, dmso, ppm): 9.12
‑
8.91 (m, 4h), 8.14
‑
7.90 (m, 8h), 4.80
‑
4.69 (m, 4h), 4.15
‑
3.98 (m, 8h), 3.84
‑
3.48 (m, 24h). hrms(esi) m/z calcd for c
48
h
48
n8o8s4zn [m cl]
‑ 1093.1433; found: 1093.1469。
[0044]
实施例6酞菁硅pre
ꢀⅵ
()的合成:
称取二氯硅酞菁(1 mmol),三乙二醇 (2~20 mmol,此实施例选6mmol),nah(1~5 mmol,此实施例选1.7mmol),甲苯(10~40 ml,此实施例选20 ml),110
°
c 下通氮气,回流 12~48小时。停止反应,蒸干溶剂,加入 100ml 水,超声,用 0.45μm 的有机膜过滤,除去未反应的配体,滤饼用 10ml dmf 溶解,用 0.45μm 的有机膜过滤,滤饼为未反应的二氯硅酞菁,减压旋蒸滤液去除溶剂,得到粗产品。过硅胶柱进一步纯化,以乙酸乙酯为洗脱剂,收集目标组分,真空干燥后深蓝色固体,产率19.7%。
[0045]
表征数据:1h nmr (400 mhz, cdcl3, ppm): 9.68
‑
9.65(m, 8h); 8.36
‑
8.34 (m, 8h); 3.32 (t, 4h, j = 4.0hz); 2.95 (t, 4h, j =7.2hz); 2.42 (t, 4h, j = 6.0hz); 1.52 (t, 4h, j = 6.4hz); 0.48 (t, 4h, j =4.8hz); 1.90 (t, 4h, j =4.0hz). hrms(esi) m/z calcd for c
44
h
42
n8o8si [m na]
861.2787; found: 861.2779。
[0046]
实施例7单取代酞菁锌
‑
青蒿素偶联物ⅰ()的合成:将青蒿琥酯 (0.04~0.48 mmol, 此实施例选0.17 mmol)、1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐 (0.04~0.40 mmol, 此实施例选0.21 mmol)和4
ꢀ‑
(二甲胺基)吡啶 (0.04~0.40 mmol, 此实施例选0.63 mmol)加入到单取代酞菁锌pre
ꢀⅰꢀ
(0.04 mmol)的n,n
‑
二甲基甲酰胺(dmf)溶液(20 ml)中,室温搅拌12
‑
24 h,通过减压去除溶剂。将残渣溶解在二氯甲烷中,以二氯甲烷:乙酸乙酯(体积比1:1)为洗脱液,通过硅胶柱层析纯化。粗产物在尺寸排阻色谱柱x3上进行进一步纯化,得到蓝绿色固体,产率55.4%。
[0047]
表征数据:1h nmr (500 mhz, dmso
‑
d6) δ 9.39
‑
9.27 (m, 5h), 8.95
‑
8.94 (m, 1h), 8.22
‑
8.09 (m, 7h), 7.86
‑
7.71 (m, 2h), 4.84 (s, 2h), 4.42 (s, 2h), 3.96 (s, 4h), 3.75 (s, 2h), 3.61 (s, 2h), 3.45
‑
3.41 (m, 1h), 1.97 (d, j = 2.2 hz, 2h), 1.75
‑
1.69 (m, 2h), 1.46
‑
1.33 (m, 2h), 1.30
‑
1.06 (m, 10h), 1.01
‑
0.91 (m, 3h), 0.83
‑
0.76 (m, 3h), 0.49
‑
0.47 (m, 4h). hrms (esi) m/z calcd for c
57
h
54
n8o
11
zn [m h] 1091.3276; found: 1091.3328。
[0048]
实施例8单取代酞菁锌
‑
青蒿素偶联物ⅱ()的合成:称取单取代酞菁锌pre
ꢀⅱꢀ
(0.05mmol) 、 青 蒿 琥 酯 (0.05~0.60 mmol, 此实
施例选 0.2mmol) 和1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐 (0.05~1.00 mmol, 此实施例选0.4mmol)和4
ꢀ‑
(二甲胺基)吡啶(0.05~1.00 mmol, 此实施例选0.5mmol)加入到装有 10ml(10~50 ml, 此实施例选10 ml) 二氯甲烷的圆底烧瓶中,室温下搅拌 4h。tlc 检测反应完全后,旋蒸去除溶剂后进行硅胶柱层析,以乙酸乙酯为洗脱剂,收集目标组分,旋蒸干燥;进一步通过尺寸排阻色谱柱x3纯化,得到蓝绿色固体,产率55.4%。
[0049]
表征数据:1h nmr (400 mhz, dmso): 9.28
ꢀ–ꢀ
9.10 (m, 6h), 8.87 (d, 1h, j = 7.2 hz), 8.24
ꢀ–ꢀ
8.12 (m, 6h), 7.98 (t, 1h, j = 6.8 hz), 7.88 (d, 1h, j = 7.6 hz), 5.57 (d, 1h, j = 6.0 hz), 5.37 (s, 1h), 4.34 (s, 2h), 4.10 (t, 2h, j = 6.4 hz), 3.90 (s, 2h), 3.68 (t, 2h, j = 6.4 hz), 2.68 (s, 4h), 2.00 (s, 1h), 1.36 (m, 2h), 1.22 (m, 12h), 0.65 (d, 3h, j = 7.2 hz), 0.56 (d, 3h, j = 6.0 hz). hrms(esi) m/z calcd for c
55
h
50
n8o9szn [m cl]
‑ 1099.2384; found: 1099.2438。
[0050]
实施例9二取代酞菁锌
‑
青蒿素偶联物ⅲ()的合成:将青蒿琥酯 (0.06~0.72 mmol,此实施例选0.14 mmol)、1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐 (0.03~0.60 mmol, 此实施例选0.17 mmol)和4
ꢀ‑
(二甲胺基)吡啶 (0.03~0.60 mmol, 此实施例选0.17 mmol)加入到20 ml二取代酞菁锌pre
ꢀⅲꢀ
(0.03 mmol)的dmf溶液中,室温搅拌20 h,通过真空旋转蒸发去除溶剂。将残渣溶解在二氯甲烷中,以乙酸乙酯为洗脱液,通过硅胶柱层析纯化,获粗产物。进一步在尺寸排阻色谱柱x3进行纯化,得到蓝绿色产物,产率48.9%。
[0051]
表征数据:1h nmr (400 mhz, dmso) δ 9.38
‑
9.29 (m, 6h), 8.24
‑
8.21 (m, 6h), 7.67
‑
7.65 (m, 2h), 5.52 (s, 2h), 5.34 (s, 2h), 4.88 (s, 4h), 4.40 (s, 4h), 4.12
‑
4.05 (m, 8h), 3.79
‑
3.70 (m, 8h), 2.26
‑
1.69 (m, 10h), 1.24
‑
1.16 (m, 30h), 0.60
‑
0.59 (d, j = 5.6 hz, 14h). hrms (esi) m/z calcd for c
82
h
98
n8o
22
zn [m h] 1605.5690; found: 1605.5729。
[0052]
实施例10四取代酞菁锌
‑
青蒿琥酯偶联物ⅳ(
)的合成:将青蒿琥酯 (0.24~2.88 mmol,此实施例选0.75 mmol)、1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐 (0.06~1.20 mmol, 此实施例选0.63 mmol)和4
ꢀ‑
(二甲胺基)吡啶 (0.06~1.20 mmol,此实施例选 0.63 mmol)加入到20 ml四取代酞菁锌pre
ꢀⅳꢀ
(0.06 mmol)的二氯甲烷中溶液中,室温搅拌反应18 h,通过真空旋转蒸发去除溶剂。将残渣溶解在二氯甲烷中,以二氯甲烷为洗脱液,通过硅胶柱层析纯化,获得粗产物。进一步通过尺寸排阻色谱柱x3进行纯化,得到蓝绿色产物,产率23.9%。
[0053]
表征数据:1h nmr (400 mhz, dmso) δ 9.20
‑
8.93 (m, 4h), 8.15 (m, 4h), 7.93
‑
7.68 (m, 4h), 5.59
‑
5.57 (m, 3h), 5.45
‑
5.41 (m, 3h), 5.20 (s, 3h), 4.92 (s, 3h), 4.43 (s, 3h), 4.23
‑
4.01 (m, 10h), 3.81 (s, 5h), 3.70 (s, 3h), 3.60 (s, 5h), 3.52 (s, 9h), 2.59 (s, 12h), 2.20
‑
2.02 (m, 10h), 1.87 (s, 4h), 1.62 (s, 8h), 1.37 (s, 12h), 1.30
‑
1.21 (m, 24h), 0.89 (d, j = 6.1 hz, 5h), 0.82
‑
0.50 (m, 19h). hrms (esi) m/z calcd for c
134
h
174
n8o
44
zn [m h] 2635.0552; found: 2635.0435。
[0054]
实施例11
四取代酞菁锌
‑
青蒿素偶联物
ⅴ
()的合成:准确称取四取代酞菁pre
ꢀⅴ
(0.03mmol)、青蒿琥酯(0.12~1.44 mmol, 此实施例选0.528mmol)和 1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐 (0.03~0.60 mmol, 此实施例选0.28mmol)和4
ꢀ‑
(二甲胺基)吡啶(0.03~0.60 mmol, 此实施例选0.35mmol)加入到 10ml(10~50 ml, 此实施例选10 ml) 二氯甲烷 中,室温下搅拌 反应12
‑
242h。tlc 检测反应完全后,浓缩旋蒸去除溶剂。以乙酸乙酯为洗脱剂通过硅胶柱纯化,收集目标组分,真空旋转蒸发去除溶剂。进一步通过尺寸排阻色谱柱x3进行纯化,得到蓝绿色产物,产率62.4%。
[0055]
表征数据:1h nmr (400 mhz, dmso, ppm): 1
h nmr (400 mhz, dmso) δ 9.12
‑
9.05 (m, 4h), 8.28
‑
8.06 (m, 4h), 7.86
‑
7.76 (m, 4h), 5.64
‑
5.54 (m, 4h), 5.47
‑
5.39 (m, 2h), 5.20 (s, 2h), 4.92 (s, 4h), 4.43 (s, 4h), 4.26
‑
4.00 (m, 12h), 3.87
‑
3.76 (m, 6h), 3.70 (s, 4h), 3.60
‑
3.44 (m, 16h), 2.67
‑
2.51 (m, 16h), 2.22
‑
2.16 (m, 4h), 2.06
‑
1.95 (m, 4h), 1.93
‑
1.80 (m, 4h), 1.70
‑
1.55 (m, 6h), 1.35
‑
1.15 (m, 38h), 1.02
‑
0.94 (m, 4h), 0.77
‑
0.60 (m, 26h). hrms(esi) m/z calcd for c
124
h
152
n8o
36
s4zn [m na h]
2546.8471; found: 2546.8464。
[0056]
实施例12
酞菁硅
‑
青蒿素偶联物
ⅵ
()的合成:将青蒿琥酯 (0.08~0.96 mmol, 此实施例选0.35 mmol)、1
‑
乙基
‑3‑
(3
‑
二甲氨基丙基)羧二亚胺盐酸盐 (0.04~0.80 mmol, 此实施例选0.28 mmol)和4
ꢀ‑
(二甲胺基)吡啶 (0.04~0.80 mmol, 此实施例选0.35 mmol)加入到20 ml酞菁硅pre
ꢀⅵꢀ
(0.04 mmol)的二氯甲烷中溶液中,室温搅拌18 h,通过减压去除溶剂。将残渣溶解在二氯甲烷中,以二氯甲烷为洗脱液,通过硅胶柱层析纯化。粗产物在尺寸排阻色谱柱x3进一步纯化,得到蓝色,产率63.20%。
[0057]
表征数据:1h nmr (400 mhz, dmso
‑
d6) δ 9.68 (d, j = 8.6hz, 8h); 8.86 (d, j = 8.4 hz, 8h); 5.62 (s, 2h); 5.51 (s, 2h); 3.75
‑
3.73 (m, 4h); 2.91
‑
2.88 (m, 4h); 2.73
‑
2.50 (m, 4h); 2.43
‑
2.39 (m, 4h); 2.35
‑
2.32 (m, 4h); 1.98 (s, 4h); 1.76 (s, 4h); 1.61
‑
1.56 (m, j =4.0 hz, 6h); 1.41 (s, 4h); 1.37
‑
1.35 (m, 8h); 0.90
‑
0.85 (m, 12h); 0.65 (d, j=8.0 hz,4h), 0.36
‑
0.35 (m,6h); 0.34
‑
0.31 (m,4h); 2.06
‑
2.04 (m,4h). hrms (esi) m/z calcd for c
82
h
94
n8o
22
si [m na ]
1593.6146; found:1593.6106。
[0058]
实施例13将实施例7
‑
12所合成的酞菁
‑
青蒿素偶联物溶于n,n
‑
二甲基甲酰胺(或二甲基亚砜、四氢呋喃)制成1
‑
2mm的母液。
[0059]
滴加该母液至纯水(或磷酸盐缓冲溶液)中,使酞菁
‑
青蒿素偶联物浓度为5
‑
50μm(优选10 μm),搅拌均匀可得均匀的水溶液。通过动态光散射粒度分析仪测定发现,上述酞菁
‑
青蒿素偶联物在水中均可以发生自组装,形成均一的纳米颗粒,粒径大小为100
‑
200 nm左右。将上述纳米颗粒溶液冷冻干燥可得粉末状的纳米材料。透射电镜测试也表明其自组装纳米颗粒的存在。
[0060]
如果将母液滴加至2.0%蓖麻油衍生物水溶液(wt%)中,动态光散射粒度分析观察不到100
‑
200nm的纳米颗粒。这说明在2.0%蓖麻油水溶液中,上述酞菁
‑
青蒿素偶联物可能主要以单体形式存在,不能构成纳米自装体。
[0061]
实施例14将实施例7
‑
12所合成的酞菁
‑
青蒿素偶联物分别溶于dmf,配制成1 mm的母液,再分别稀释到去离子水中,测试它们在超声激发下或光激发下产生活性氧总量(ros)。以常见敏化剂二氢卟吩作为参比。
[0062]
活性氧总量测试采用水解的2,7
‑
二氯荧光素二乙酸酯(dcfh
‑
da)作为荧光探针。测试时,将dcfh
‑
da溶液与0.1 mol/l的氢氧化钠溶液混合避光反应30 min后,用ph 7.4的pbs溶液稀释成为浓度为200 mm的母液。
[0063]
在石英比色皿中配置总量为2 ml的酞菁(4 μm)和上述活化好的活性氧探针(5 μm)的混合去离子水溶液,对比色皿进行光照或超声照射,测定不同光照(或超声照射)时间下活性氧探针荧光强度的变化情况(488 nm激发,扫描范围在500 nm
‑
600 nm处的荧光)。将 522 nm处的相对荧光强度(f
‑
f0/f0)与光照时间(t)作图,得到线性关系的斜率,斜率越大说明产生ros的能力越强。
[0064]
其中,光照条件是:光照波长为≥610 nm的红光,光照功率为15 mw/cm2,≥610 nm的红光是通过500 w的卤素灯连接隔热水槽加大于610 nm的滤光片来提供的。超声照射条件是:超声频率为1 mhz,超声功率为1.5 w/cm2。
[0065]
测试结果见表1。
[0066]
从表1可见,酞菁
‑
青蒿素偶联物在水溶液中具有高的声动力产生活性氧能力(超声照射下产生活性氧能力),高于常见敏化剂ce6 5~6倍。相同条件下,酞菁锌
‑
青蒿素偶联物iv的超声照射下产生ros的相对速率(5.68)大于相应浓度的酞菁锌preiv(4.0)和青蒿琥
酯(0.90),显示了酞菁锌
‑
青蒿素偶联物具有良好的酞菁锌和青蒿琥酯协同声动力产生活性氧能力。同时,酞菁锌
‑
青蒿素偶联物也具有一定的光动力产生ros的活性,其中偶联物iii、v和vi的光动力产生ros活性与常见敏化剂ce6相当。可见,本发明提供的酞菁
‑
青蒿素偶联物同时具备声动力活性和光动力活性,在声动力治疗和声/光动力治疗中具有显著的应用价值。
[0067]
另一方面,酞菁锌preiv(4μm)和青蒿琥酯(16μm)的混合溶液在超声照射下产生ros的相对速率为4.3,显著低于相应的酞菁
‑
青蒿素偶联物iv产生ros的相对速率(5.68),进一步说明酞菁
‑
青蒿素共价偶联物的优势。
[0068]
实施例15参照实施例14比较了部分酞菁
‑
青蒿素偶联物在水中和在2.0%蓖麻油水溶液中的超声激发下产生活性氧(ros)能力,结果见表2。
[0069]
从表2可见,酞菁
‑
青蒿素偶联物在水中的声动力产生ros能力均显著高于它们在2.0%蓖麻油水溶液中的声动力产生ros能力(高出50倍)。在2.0%蓖麻油水溶液中,酞菁
‑
青蒿素偶联物的声动力产生ros能力极低。在如上所述,酞菁
‑
青蒿素偶联物在水中聚集形成自组装纳米体,而在2.0%蓖麻油水溶液中主要以单体形式存在。表2的结果说明,酞菁
‑
青蒿素偶联物的自装体显著有利于它们的声动力活性的产生,这可能与纳米体的存在可以降低超声的空化阈值有关。
[0070]
实施例16将实施例4所得酞菁锌pre
ꢀⅳ
和实施例10所得酞菁
‑
青蒿素偶联物iv溶于dmf中,制成2mm的化合物母液。用去离子水将母液稀释浓度为80
ꢀµ
m的水溶液。接着用含10%小牛血清的dmed培养液稀释成1,2,4,8,16
ꢀµ
m的浓度梯度。测试它们对人肝癌细胞hepg2的声动力抗癌活性、光动力抗癌活性和光/声联合治疗抗癌活性。
[0071]
在细胞培养板中接种处于对数生长期的hepg2细胞(每板细胞的数量约为1
×
105个),在37 ℃、5% co2进行培养,24 h后移出培养液,将癌细胞分别在含有不同浓度偶联物的培养液中培养2小时,之后弃培养液,用pbs缓冲溶液清洗细胞后,加入新的培养液(不含上述所述偶联物)。
[0072]
对于光照实验组(光动力治疗组),使用红光(波长λ≥610 nm,15 mw/cm2)对细胞照射30分钟;对于不照光组,将细胞置于暗处30分钟。
[0073]
对于超声照射组(声动力治疗组),用超声仪(1.5 w/cm2,1.0 mhz)对细胞进行超
声2分钟。对于不照射超声组,将细胞置于暗处2分钟。
[0074]
对于光照 超声实验组(光动力和声动力联合治疗组),用超声仪(1.5 w/cm2,1.0 mhz)对细胞进行超声。超声结束后,对细胞进行光照30 min(λ≥610 nm,15 mw/cm2)。对于不进行光和超声照射组,将细胞置于暗处32分钟。
[0075]
进而通过mtt法计算实验组的细胞存活率,详细实验步骤参见eur. j. med. chem., 2018, 155, 24
‑
33。实验结果见表3。从中可见,酞菁锌
‑
青蒿素偶联物iv显示了高的声动力抗癌活性,ic
50
值(半数致死浓度,即杀死50%癌细胞所需的药物浓度)为2.0 μm,高于相应的酞菁锌pre
ꢀⅳ
。同时,酞菁锌
‑
青蒿素偶联物iv也显示了一定的光动力抗癌活性,而且具有显著的光动力和声动力联合抗癌效应,其联合治疗组ic
50
值降低至0.7 μm。
[0076]
另一方面,在同样光照 超声照射条件下,酞菁锌
‑
青蒿素偶联物ⅳ(1μm)对癌细胞的抑制率为70%,而酞菁锌pre
ꢀⅳ
(1μm)和青蒿琥酯混合物(4μm)的混合物对癌细胞的抑制率仅为30%,这说明酞菁锌
‑
青蒿素偶联物ⅳ的抗癌活性明显高于酞菁锌pre
ꢀⅳ
和青蒿琥酯混合物,显示了共价偶联物的优势。
[0077]
实施例17将实施例10的酞菁
‑
青蒿素偶联物iv溶于dmf,配置成2 mm的母液,再用水进行稀释,制成浓度为100 μm的药剂水溶液。测试其对种有肝癌细胞(h22)的固体瘤的km小鼠的荧光成像情况。
[0078]
对种有h22的荷瘤小鼠尾静脉注射100 μl浓度为100 μm的上述药剂水溶液。使用小动物荧光成像仪监测上述药物在小鼠肿瘤部位的富集情况,24小时后对小鼠进行解剖,使用小动物荧光成像仪监测药物在小鼠各个组织器官的分布情况。详细实验步骤参见acs appl. mater. interfaces 2019, 11, 36435
−
36443。
[0079]
在体荧光成像实验结果表明:酞菁锌
‑
青蒿素偶联物ⅳ有较强的肿瘤靶向能力。在静脉注射酞菁锌
‑
青蒿素偶联物ⅳ后,逐渐在肿瘤部位观察到荧光(790nm左右),在12小时达到峰值,而且只能在肿瘤部位看到荧光。24小时后,小鼠进行解剖获取各器官,并观察它们的荧光成像情况,小鼠的肿瘤部位可以观察到较为明显的荧光,肝脏和肾脏中也能检测到少许荧光,表明酞菁锌
‑
青蒿素偶联物ⅳ具有较高的肿瘤组织靶向性。
[0080]
实施例20将h22荷瘤icr小鼠随机分为以下实验组:空白(生理盐水)组;单独超声照射组;单
独激光照射组;单独酞菁锌
‑
青蒿素偶联物ⅳ组;)酞菁锌
‑
青蒿素偶联物ⅳ 超声治疗组(声动力治疗组);酞菁锌
‑
青蒿素偶联物
ⅳꢀ
激光治疗组(光动力治疗组);酞菁锌
‑
青蒿素偶联物
ⅳꢀ
激光 超声治疗组(联合治疗组)。药物组经小鼠静脉注射酞菁锌
‑
青蒿素偶联物ⅳ,剂量为100μm的酞菁锌
‑
青蒿素偶联物ⅳ水溶液100μl。空白组静脉注射100μl的生理盐水。注射药物12小时后,超声治疗组对肿瘤进行超声 (1 mhz, 50% 占空比, 1.5 w/cm2)照射10 分钟;光动力治疗组对肿瘤进行激光照射(685 nm,0.33 w/cm2)10分钟;光动力 声动力治疗组对肿瘤进行激光照射(685 nm,0.33 w/cm2)10分钟后,进行超声照射(1 mhz, 50% 占空比, 1.5 w/cm2)10分钟。第二天给予相同的治疗。每2天测量小鼠的体重和肿瘤体积,总共14天。参考文献方法(acs appl. mater. inter. 2019, 11, 36435
−
36443)计算抑瘤率。
[0081]
实验结果表明:(1)单纯给药组、单纯激光照射组、单纯超声照射组对小鼠肿瘤均无明显抑制效应。(2)给药 超声照射组(声动力治疗组)显示了良好的抑制肿瘤生长的作用,抑瘤率可达60.4 %;给药 激光照射组(光动力治疗组)显示了一定的抑制肿瘤生长活性,抑瘤率达37.5%。(3)给药 超声 激光照射组(光动力和声动力联合治疗组),显示了极高的抑制肿瘤生长活性,抑瘤率高达98% (p<0.001)。
[0082]
同时实验结果还表明,单纯给药组、给药 激光组、给药 超声组、给药 激光组 超声组的小鼠在14天内体重呈增加趋势,说明酞菁
‑
青蒿素偶联物对小鼠均没有明显毒性,具有良好的生物相容性。
[0083]
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
