一种基于外泌体的光控信号放大技术及其在microrna检测及成像中的应用
技术领域
1.本发明属于基因检测领域,具体涉及一种基于外泌体的光控信号放大技术及其在microrna检测及成像中的应用。
背景技术:
2.microrna(mirna)是一类长度约为19~23个碱基长度的非编码rna,广泛参与动物、植物以及细菌病毒的后转录过程,调节基因的表达。mirna的异常表达可能与疾病的发生有关,尤其与癌症关联密切,可以作为一种成熟的肿瘤标志物。在一些临床治疗中,mirna也会被作为潜在的基因治疗及药物治疗的靶点,具有极为广阔的利用范围。而灵敏可靠的mirna检测方法则是mirna的进一步研究和开发的必要基础。
3.相关技术中,mirna体外检测方法仍存在诸多缺陷,例如,常规的mirna体外检测方法的检测结果均是平均表达值,无法反映mirna在单个细胞的表达水平。而其他相对先进的方法,如荧光原位杂交技术(fish),在低浓度目标检测时灵敏度较低,对样品的要求较高,适用性差。使用滚环扩增方法结合fish 荧光成像技术,虽然在一定程度上可实现细胞内的高灵敏可视化检测,但需要引入聚合酶,从而无法实现活细胞内成像检测,极大的限制了应用范围。
4.因此,为了解决相关技术中存在的缺陷,提高mirna检测方法的准确性,开发一种能够适用于活细胞及胞外体系的适用性强的mirna检测方法,对于mirna的进一步研究和开发、以及疾病诊断与治疗具有重要意义。
技术实现要素:
5.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种基于外泌体的光控信号放大技术(lrt
‑
hcr),该方法能够以外泌体作为探针递送载体,将探针提送至活细胞内,该方法具有较高的转染效率,生物相容性好,细胞内的杂交链反应(hcr)产物能够聚集在外泌体上实现信号的再一次放大,从而提高细胞内成像的灵敏度。
6.本发明的第一个方面,提供一种检测核酸分子的探针组合。
7.根据本发明的第一个方面,在本发明的一些实施方式中,所述探针组合中包括发卡链h1、发卡链h2和发卡链h3;
8.所述发卡链h1从5’到3’依次包括:序列a,序列b,序列c和序列d;
9.所述序列a、b能够与靶核酸互补;
10.所述序列b能够与序列d互补;
11.所述序列c、d与所述发卡链h2的5’端序列互补;
12.所述发卡链h2从5’到3’依次包括:序列e,序列f,序列g和序列h;
13.所述序列f与所述序列h互补;
14.所述序列g、h与所述发卡链h3的3’端序列互补;
15.所述发卡链h3从5’到3’依次包括:序列i,序列j,序列k和序列l;
16.所述序列i与所述序列k互补;
17.所述序列l、k与所述发卡链h2的序列g、h互补。
18.其中,序列a为:tcaaca;序列b为tcagtctgataagcta(seqidno.1);序列c为aatctctatctaccctac(seqidno.2);序列d为agcttatcagact(seqidno.3);序列e为gctgta;序列f为gggtagatagagattt(seqidno.4);序列g为aaatca;序列h为tatcaaaatctctatctaccc(seqidno.5);序列i为aaatctctatctacccta(seqidno.6);序列j为cagctt;序列k为tgggtagatagagattt(seqidno.7);序列l为tgatatgat(seqidno.8)。
19.各序列对应关系如说明书附图图1所示。
20.在本发明的一些优选实施方式中,当待测核酸为mir
‑
21时,发卡链h1、h2和h3,其具体的核苷酸序列为:
21.发卡链h1:5
’‑
tcaacatcagtctgataagctaaatctctatctaccctacagcttatcagact
‑3’
(seqidno.10);
22.发卡链h2:5
’‑
gctgtagggtagatagagatttaaatcatatcaaaatctctatctaccc
‑3’
(seqidno.11);
23.发卡链h3:5
’‑
aaatctctatctaccctacagctttgggtagatagagattttgatatgat
‑3’
(seqidno.12)。
24.在本发明的一些优选实施方式中,所述发卡链h2上修饰有第一荧光基团,所述发卡链h3上修饰有第二荧光基团,且所述第一荧光基团与所述第二荧光基团之间能发生荧光共振能量转移。
25.在本发明的一些更优选实施方式中,所述第一荧光基团为fam;所述第二荧光基团为羧基罗丹明(tamra)。
26.在本发明的一些优选实施方式中,所述发卡链h1的3’端连接有胆固醇基团。
27.外泌体是一种具有磷脂双分子层的小囊泡,通过在发卡链上连接疏水基团胆固醇可以将发卡链自发嵌入到外泌体膜上,从而实现了外泌体自组装负载探针进入细胞。
28.发卡链h1作为外泌体上的锚定链,其3’端连接的胆固醇基团chol会与外泌体膜结合,从而将发卡链h1锚定在外泌体上。而且发卡链h1受到mir
‑
21引发后会产生粘性末端,产生的粘性末端能够引发h2、h3进入级联杂交反应。而在整个hcr体系中,发卡链h2和h3是重复循环的扩增单元。
29.在本发明的一些优选实施方式中,发卡链h1的完整序列为:5
’‑
tcaacatcagtctgataagctaaatctctatctaccctacagcttatcagactttttt
‑
chol
‑3’
。
30.连接有tamra的发卡链h3的序列为:5
’‑
aaatctctatctaccctacagc
‑
tamra
‑
tttgggtagatagagattttgatatgat
‑3’
。
31.根据本发明的第一个方面,在本发明的一些实施方式中,所述发卡链h2在3’端依次连接光控基团和胆固醇基团;所述发卡链h3在3’端依次连接光控基团和胆固醇基团。
32.根据本发明的第一个方面,在本发明的一些实施方式中,所述光控基团具有紫外照射断键特性。
33.光控发卡链h2和h3是在发卡链h2和h3的基础上设计得到的,具有设计方案为:在发
卡链h2和h3的3’末端碱基上依次端连接修饰性序列tt、光控基团(pc
‑
linker基团)、修饰性序列tt和胆固醇基团c hol。
34.最终,得到的光控发卡链h2的序列为:5
’‑
fam
‑
gctgtagggtagatagagatttaaatcatatcaaa atctctatctaccctt
‑
pc
‑
linker
‑
tt
‑
chol
‑3’
。
35.光控发卡链h3的序列为:5
’‑
aaatctctatctaccctacagc
‑
tamra
‑
tttgggtagatagagattt tgatatgattt
‑
pc
‑
linker
‑
tt
‑
chol
‑3’
。
36.在本发明的一些优选实施方式中,所述光控基团包括pc
‑
linker。
37.在本发明的一些更优选实施方式中,所述光控基团为pc
‑
linker。光控基团pc
‑
linker在特定波长照射下能够发生磷酯键断裂,从而使得光控发卡链的dna碱基序列段与胆固醇分离。
38.在整体方案上,为实现探针进入细胞后能够从外泌体上脱离,探针与胆固醇基团之间还连接了光敏基团pc
‑
linker。通过紫外光照射,探针能够从外泌体上脱落进入游离状态,在目标mirna存在时,引发hcr。为使hcr产物重新聚集到外泌体上,增强荧光可视化,发卡链h1作为目标mirna的底物,同时h1未修饰pc
‑
linker使其不会受光照影响,能够一直固定于外泌体上,循环扩增结合发卡链h2、h3,实现重复增长。发卡链h2、h3则修饰了pc
‑
linker。当目标mirna存在时,hcr产生的双链随反应进行而不断回收聚集到外泌体上,再次拉近供体和受体荧光的距离,使区域内荧光密度增加,提高细胞内成像效果。
39.本发明的第二个方面,提供一种核酸分子的检测方法,包括如下步骤:
40.(1)将外泌体与本发明第一个方面所述的探针组合混合孵育;
41.(2)加入待测样品和镁盐,紫外线照射,继续孵育;
42.(3)检测荧光信号强度,计算待测样品中核酸分子的含量。
43.在本发明的一些优选实施方式中,所述检测方法同于非诊断目的。
44.杂交链反应(hcr)是一种基于发夹结构的探针实现恒温信号放大的方法。当目标mirna存在时,能够引发发夹探针进行级联杂交,实现信号放大。在发夹探针上分别存在供体和受体荧光基团,通过供体与受体之间的荧光共振能量转移(fret),实现可视化检测。但常规的hcr是一个线性扩增反应,在扩增后期受制于动力学影响,反应效率低,信号增强依赖双链的引发延长。因此,针对细胞内mirna高灵敏成像,本发明以外泌体为载体,结合hcr扩增技术,不需要酶参与,实现了细胞内的可控释放以及回收信号放大,相比传统hcr具有更好的检测与活细胞成像效果。而且灵敏度高,操作简单,在细胞成像领域具有极高的应用价值。
45.如说明书附图图2所示,本发明的方法原理为:通过发卡链上的疏水基团使三个发卡链固定于外泌体膜上,将载有探针的外泌体与细胞孵育后,紫外光照一定时间,使光控发卡链h2、h3上的光控基团断裂 (光剪切),使探针从外泌体上切下,当存在目标mirna时,三个发卡链与目标mirna发生hcr反应,由于发卡链h1不含光控基团,依然会固定在外泌体上,因此会在外泌体膜上进行hcr回收荧光聚集,从而可以通过激光共聚焦显微镜实现较好的细胞成像效果。
46.在本发明的一些优选实施方式中,光控发卡链h2和光控发卡链h3的摩尔浓度比例为1:1。
47.根据本发明的第二个方面,在本发明的一些实施方式中,所述mg
2
盐为硫酸镁,其
作用为:促进链杂交反应。
48.根据本发明的第二个方面,在本发明的一些实施方式中,所述检测方法的检测体系具体为:
49.组分含量发卡链h1终浓度200nm光控发卡链h2终浓度500nm光控发卡链h3终浓度500nm外泌体终浓度7.2
×
10
10
个/mlmgso4溶液终浓度5mm待测mirna0.5μl1
×
pbs(ph=7.4)补足至50μl
50.具体程序为:先将外泌体与发卡链h1、光控发卡链h2和h3室温孵育30min,然后加入待测mirna、 mgso4溶液,uv照射5min,在37℃继续孵育4h。
51.根据本发明的第二个方面,在本发明的一些实施方式中,所述检测方法可针对于任意核酸分子,在本发明实施例中,仅以mir
‑
21作为示例。
52.本发明的第三个方面,提供一种核酸分子检测试剂盒,该核酸分子检测试剂盒中包括本发明第一个方面所述的探针组合。
53.根据本发明的第三个方面,在本发明的一些实施方式中,所述核酸分子检测试剂盒中还包括外泌体和 mgso4溶液。
54.本发明的第四个方面,提供本发明第一个方面所述的探针组合在核酸分子定性或定量检测中的应用。
55.根据本发明的第四个方面,在本发明的一些实施方式中,所述应用适用于活细胞内的核酸分子定性或定量检测。
56.本发明的第五个方面,提供本发明第一个方面所述的探针组合在活细胞细胞成像中的应用。
57.本发明利用良好生物相容性及高转运效率的外泌体为转运工具,通过设计三发卡探针,并结合外泌体的回收聚集、光控hcr放大策略,实现了细胞内mirna成像分析。其在转运方式上,巧妙利用外泌体膜的疏水特性,不破坏外泌体,即可实现探针负载;在可控性上,为实现发夹脱落,引入pc
‑
linker基团,在空间与时间上具有更高的自由度,可远端实现探针剪切脱落;而且进入细胞内的外泌体还可以继续作为 hcr聚集位点,聚集更多的荧光信号并产生更强的fret,从而利用荧光释放位置聚集进一步增强了细胞成像效果,使其可以得到活细胞内的细胞成像。
58.本发明的有益效果是:
59.1.本发明中的探针可以以外泌体为转运载体,具有较高的生物相容性,对细胞活性几乎无影响。
60.2.本发明中的探针(发卡链)部分修饰了pc
‑
linker,在空间与时间上具有更高的自由度,可远端实现探针剪切脱落,实现了细胞内的可控释放。
61.3.本发明中的lrt
‑
hcr方法基于外泌体负载三条发卡链,通过光控释放和外泌体膜锚定,利用hcr 扩增实现了外泌体上荧光聚集,使荧光信号进一步放大,提高了检测灵敏
度。
62.4.本发明中的检测方法相对于传统hcr具有更强的荧光信号,同时可应用于活细胞的细胞内成像,成像效果好,成像质量显著提高。
附图说明
63.图1为本发明实施例中的发卡链h1、发卡链h2和发卡链h3中的序列对应关系图;
64.图2为本发明实施例中的基于外泌体回收放大的光控三探针体外检测体系(lrt
‑
hcr)的方法原理图;
65.图3为发卡链h2与h3不同浓度比例时fret强度(s/b)的荧光柱状图;
66.图4为不同组分下的hcr合成产物电泳表征图;
67.图5为mir
‑
21不同梯度浓度时的hcr荧光发射图谱;
68.图6为hcr方法检测mir
‑
21的标准曲线;
69.图7为hcr方法对不同样品的检测特异性对比图;
70.图8为经过0~5min的uv照射后光控发卡链h2的凝胶电泳图;
71.图9为光控发卡链h2光照前后的质谱图,其中,a为光照前的质谱图,b为光照后的质谱图;
72.图10为不同uv照射时间下的细胞存活率对比图;
73.图11为本发明实施例中提取得到的外泌体sem图;
74.图12为本发明实施例中提取得到的外泌体的nta分析曲线;
75.图13为本发明实施例中提取得到的外泌体的western blot电泳图;
76.图14为外泌体锚定h2发夹探针后上清的荧光强度变化曲线图;
77.图15为不同组分情况下的clsm成像图,其中,a为加入光控发卡链h2和h3以及外泌体的组,b 为加入外泌体和未修饰胆固醇基团的发卡链h2的组,c为仅加入光控发卡链h2未加入外泌体的组,比例尺为20μm;
78.图16为外泌体负载探针(hp
‑
exo)在不同的细胞转染时间下的clsm成像,比例尺为20μm;
79.图17为pkh67标记外泌体转染细胞clms成像,比例尺为20μm,其中,红框为放大图;
80.图18为不同浓度的外泌体对细胞存活率的影响;
81.图19为外泌体与脂质体转染mcf
‑
7细胞的细胞存活率对比图;
82.图20为外泌体与脂质体转染mcf
‑
7细胞的clsm成像(a)及其对应的荧光强度对比图(b),比例尺为20μm;
83.图21为不同溶液的荧光曲线图(a)及其对应的荧光强度对比图(b),其中,i表示第一实验组上清, ii表示第二实验组上清,iii表示将第二实验组得到的外泌体uv照射后再次离心后的上清;
84.图22为lrt
‑
hcr方法沉淀与上清(条带1和2)和t
‑
hcr方法沉淀与上清(条带3和4)的电泳图;
85.图23为lrt
‑
hcr和t
‑
hcr检测不同浓度的mir
‑
21的对比图;
86.图24为不同检测方法或用药情况下的mcf
‑
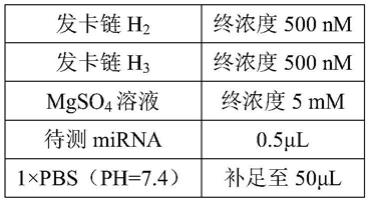
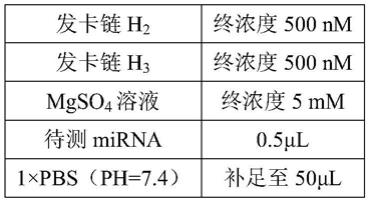
7细胞内mir
‑
21的clsm成像图;
87.图25为不同检测方法或用药情况下的荧光情况对比图;
88.图26为基于外泌体与脂质体的hcr检测clsm成像图(a)及其对应的荧光强度对比图(b);
89.图27为基于本发明实施例中的lrt
‑
hcr方法在mcf
‑
7、mcf
‑
10a、a549细胞内mir
‑
21的clsm 成像;
90.图28为基于本发明实施例中的lrt
‑
hcr方法在mcf
‑
7、mcf
‑
10a、a549细胞内的荧光强度对比图;
91.图29为qrt
‑
pcr方法检测mcf
‑
7、mcf
‑
10a、a549细胞内mir
‑
21的相对表达量对比图。
具体实施方式
92.为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。
93.所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材和试剂。
94.下述实施例以mir
‑
21为实验对象,仅用于说明本发明实施例中的检测方法对于mirna检测的可行性和准确性,本领域技术人员需要的理解的是,本发明实施例中的检测方法的可适用检测对象包括但不限于 mir
‑
21等任意mirna。
95.其中,下述实施例中的mir
‑
21的核苷酸序列为:
[0096]5’‑
uagcuuaucagacugauguuga
‑3’
(seq id no.9)。
[0097]
一种三探针体外检测体系
[0098]
本实施例中的三探针体外检测体系如表1所示。
[0099]
表1三探针体外检测体系
[0100][0101][0102]
其中,3个发卡链h1、h2和h3,其具体的核苷酸序列为:
[0103]
发卡链h1:5
’‑
tcaacatcagtctgataagctaaatctctatctaccctacagcttatcagact
‑3’
(se q id no.10);
[0104]
发卡链h2:5
’‑
gctgtagggtagatagagatttaaatcatatcaaaatctctatctaccc
‑3’
(seq id no.11);
[0105]
发卡链h3:5
’‑
aaatctctatctaccctacagctttgggtagatagagattttgatatgat
‑3’
(seq i d no.12)。
[0106]
其中,发卡链h2的5’端连接有荧光基团fam,当然,本领域技术人员可以根据实际
使用需求,替换为其他常用荧光基团。
[0107]
连接有fam的发卡链h2的序列为:5
’‑
fam
‑
tcaacatcagtctgataagctaaatctctatctaccc tacagcttatcagact
‑3’
。
[0108]
发卡链h3的第23位碱基t(5
’→3’
)上连接有一个荧光基团羧基罗丹明(tamra),当然,本领域技术人员可以根据实际使用需求,替换为其他常用的荧光基团。
[0109]
连接有tamra的发卡链h3的序列为:5
’‑
aaatctctatctaccctacagc
‑
tamra
‑
tttgggtaga tagagattttgatatgat
‑3’
。
[0110]
本实施例中的待测mirna为mir
‑
21。
[0111]
检测程序为:配置如表1所示检测体系后,在37℃下孵育4h,然后采集溶液的荧光信号(本实施例使用f
‑
7000荧光测试仪),扫描区间505
‑
640nm,电压700v,狭缝5nm。
[0112]
杂交链反应(hcr)发卡链的配合比例
[0113]
在上述实施例的检测方法中,发卡链h1作为外泌体上的锚定链,其3’端连接的胆固醇基团chol会与外泌体膜结合,从而将发卡链h1锚定在外泌体上。而且发卡链h1受到mir
‑
21引发后会产生粘性末端,产生的粘性末端能够引发h2、h3进入级联杂交反应。而在整个hcr体系中,发卡链h2和h3是重复循环的扩增单元。
[0114]
为了确保hcr的持续进行以及反应效率的最大化,发明人对h2:h3的比例进行优化测试。
[0115]
测试方法为:
[0116]
固定h1的浓度为200nm,分别设置h2:h3摩尔浓度比例为1:2、1:1和2:1三组,并分别设置空白对照。加入适量mir
‑
21,5mm的mgso4,用pbs补足使得总反应体积为50μl,在37℃下孵育4h,收集荧光共振能量转移强度数据。
[0117]
结果如图3所示。
[0118]
可以发现,在三组实验中,仅当h2:h3为1:1时,出现靶标信号,且与空白对照产生较大的信号差,因此,选择h2:h3的最佳摩尔浓度比例为1:1。
[0119]
三探针体外检测体系hcr体外扩增电泳验证
[0120]
配制10%的非变性凝胶电泳,取上述实施例中得到的hcr反应产物在80v电压下进行电泳实验。
[0121]
各实验组的反应体系如表2所示。
[0122]
表2各实验组反应体系
[0123][0124]
选择25~500bp碱基的dna片段为marker对照。
[0125]
结果如图4所示。
[0126]
可以发现,实验组1(仅使用h2和h3)和实验组2(仅使用h1、h2和h3)中的电泳条带均
未出现高 bp条带,表明上述实施例中的hcr扩增具有较好的背景。而加入待测样品mir
‑
21后(实验组3和4),在高bp区域出现了大量条带,表明较多的扩增产物产生,而当待测样品浓度较低时(实验组3),hcr产物量较少,符合反应原理,说明反应体系设置合理。
[0127]
三探针体外检测体系的体外检测标准曲线测定
[0128]
以mir
‑
21作为检测样品,梯度配制不同浓度的mir
‑
21稀释液,其浓度分别为:0nm、0.005nm、0.01 nm、0.05nm、0.1nm、0.5nm、1nm、5nm、10nm、50nm、100nm。
[0129]
分别将不同浓度的mir
‑
21按照表1所示的检测体系进行混合,在37℃下孵育4h,然后使用f
‑
7000 荧光测试仪收集溶液的荧光信号,扫描区间505
‑
640nm,电压700v,狭缝均设置为5nm。根据荧光信号结果绘制标准曲线图。
[0130]
结果如图5和6所示。
[0131]
从图5可以看出,在所有的检测样品的图谱中,588nm处的峰为归一化后的荧光共振能量转移(fret) 信号,且该信号强度随mir
‑
21浓度升高而逐渐增强。以受体荧光强度值f
a
与供体荧光强度值f
d
的比值 (f
a
/f
d
)与mir
‑
21浓度对数的比值绘制标准曲线,发现该检测方法在0.005
‑
100nm浓度范围内均具有良好的线性关系,其线性方程为:
[0132]
y=0.091
×
logc
mir
‑
21
0.469;
[0133]
其中,c
mir
‑
21
为mir
‑
21的浓度,r2=0.997。
[0134]
三探针体外检测体系的特异性检测
[0135]
为了验证上述三探针体外检测体系的特异性,设计两组单碱基错配目标物mismatch a和mismatch b。
[0136]
其中,mismatch a的核苷酸序列为:
[0137]5’‑
taacttatcagactgatgttga
‑3’
(seq id no.13)。
[0138]
其相对于待测样品mir
‑
21的错配碱基为第三位的碱基g,mismatch a将mir
‑
21的第三位碱基g替换为a(seq id no.13加粗下划线的a)。
[0139]
mismatch b的核苷酸序列为:
[0140]5’‑
tagcttatcggactgatgttga
‑3’
(seq id no.14)。
[0141]
其相对于待测样品mir
‑
21的错配碱基为第十位的碱基a,mismatch a将mir
‑
21的第十位碱基a替换为g(seq id no.14加粗下划线的g)。
[0142]
按照表1所示的体系,分别投入终浓度为100nm的mir
‑
21、mismatch a(a
‑
mis组)和mismatch b (b
‑
mis组),在37℃下孵育4h,然后使用f
‑
7000荧光测试仪收集溶液的荧光信号,扫描区间505
‑
640nm,电压700v,狭缝均设置为5nm。同时,设置空白对照(blank)。
[0143]
结果如图7所示。
[0144]
可以发现,在4个试验组中,仅在mir
‑
21存在时,fret信号强度较高,且与其他各组的信号存在显著差异。而使用单碱基错配序列(a
‑
mis组和b
‑
mis组)和无靶标(无mir
‑
21)时,荧光信号均较低,且根据进一步计算可知,两组单碱基错配目标物mismatch a和mismatch b的干扰系数分别仅为1.7
×
10
‑4和 8.8
×
10
‑5,干扰性可以忽略,表明单碱基的错配对于检测体系的特异性并无影响,上述实施例中的三探针体外检测体系的特异性极为优异。
[0145]
三探针体外检测体系的光控性能测试
[0146]
通过对2个发卡链h2和h3进行修饰可以获得光控发卡链h2和h3。对发卡链光剪切操
作后,通过对发卡链的分子量变化、碱基键的断裂分离以及荧光强度的变化来考察光控效果。而发卡链h1未修饰光控基团,因此不受光控的影响。
[0147]
光控发卡链h2和h3是在发卡链h2和h3的基础上设计得到的,具有设计方案为:在发卡链h2和h3的3’末端碱基上依次端连接修饰性序列tt、光控基团(pc
‑
linker基团)、修饰性序列tt和胆固醇基团chol,所用pc
‑
linker基团、胆固醇基团(chol)均为上海生工合成dna序列时一并修饰在dna上。
[0148]
最终,得到的光控发卡链h2的序列为:5
’‑
fam
‑
gctgtagggtagatagagatttaaatcatatcaaa atctctatctaccctt
‑
pc
‑
linker
‑
tt
‑
chol
‑3’
。
[0149]
光控发卡链h3的序列为:5
’‑
aaatctctatctaccctacagc
‑
tamra
‑
tttgggtagatagagattt tgatatgattt
‑
pc
‑
linker
‑
tt
‑
chol
‑3’
。
[0150]
其中,为了考察h1的持续固定特点对hcr体系的影响,也设计了光控发卡链h1作为参照序列。具体方法为:在第一个修饰性序列tt后插入光控基团pc
‑
linker。
[0151]
光控发卡链h1的完整序列为:5
’‑
tcaacatcagtctgataagctaaatctctatctaccctacagctt atcagactttt
‑
(pc
‑
linker)tt
‑
chol
‑3’
。
[0152]
(1)发卡链的光控(光剪切)性能:
[0153]
上述实施例中的光控发卡链h1、h2和h3均具有光剪切性能,光控基团pc
‑
linker在特定波长照射下能够发生磷酯键断裂,从而使得光控发卡链的dna碱基序列段与胆固醇分离。
[0154]
为了验证并进一步优化三探针体外检测体系的光控性能,以光控发卡链h2作为示例,发明人使用uv 灯(360nm,8w)对光控发卡链h2进行不同时长的照射,以获得最佳的光控(光剪切)时间。
[0155]
分别将使用uv灯(360nm,8w)照射了不同时间(0min、1min、2min、3min、4min、5min)的光控发卡链h2,然后使用凝胶电泳对照射后的产物进行分析(以25~500bp碱基的dna为marker),并辅以基质辅助激光解析离子化飞行时间质谱(maldi
‑
tof)质谱进行验证。
[0156]
结果如图8和9所示。
[0157]
从图8中可以看出,未经过uv照射的光控发卡链h2的凝胶电泳条带处于略高bp区域,质谱图证实了其在17728m/z处有未剪切前的峰出现。而在照射1min后,凝胶电泳条带高bp区域和低bp区域均有条带产生,说明光照使光控发卡链h2发生断裂,形成了低碱基数量的序列。探针照射5min后,凝胶电泳条带仅在低bp区域出现条带,而且质谱图中也仅存在16465m/z较低的峰存在,表明光控发卡链h2已经被完全剪切。
[0158]
上述测试能够完全说明基于光控发卡链h2的三探针体外检测体系具有良好的光控性能,发卡的释放完全可以通过光照来实现控制。
[0159]
(2)光控三探针体外检测体系的可行性:
[0160]
由于上述实施例中的三探针体外检测体系可以采用光(uv)控制,而uv对细胞有一定杀伤力,因此,为了能够验证光控三探针体外检测体系对于活细胞样品检测的适用性,还需要测试uv照射时间对细胞存活率的影响。
[0161]
具体检测步骤如下:
[0162]
在在96孔板内铺4组mcf
‑
7细胞(人乳腺癌细胞,3000个/孔),每组做5个平行,在37℃下孵育过夜,4组分别对细胞光照0、5、10、20min,继续培养24h,然后使用mtt法测试细胞
毒性。mtt法的具体操作步骤按照本领域常规操作进行。
[0163]
结果如图10所示。
[0164]
可以发现,以未经uv照射组(0min)的细胞存活率为基准(100%),在细胞经uv照射5min后仍有95%以上的存活率,细胞存活率整体随照射时间的延长呈现下降的趋势。而上述实施例中的光控发卡链 h2经过5min的uv照射已可以实现完全剪切,从而实现以外泌体负载发卡链时发卡链的释放,而在此时间节点内,细胞存活率并不会发生显著变化,因此,可以说明上述实施例中的光控三探针体外检测体系完全可以适用于活细胞样品的检测。
[0165]
基于外泌体回收放大的光控三探针体外检测体系
[0166]
本实施例中的基于外泌体回收放大的光控三探针检测体系是建立在上述光控三探针体外检测体系上的。
[0167]
其具体检测方法为:
[0168]
(1)提取外泌体:
[0169]
使用75t培养瓶传代mcf
‑
10a细胞(人正常乳腺细胞),以dmem完全培养基孵育至60%的贴壁密度。弃去上清并用pbs清洗3次,然后用无血清的dmem培养基继续孵育细胞12h(去除残余血清分泌外泌体的影响)。再次弃去上清并用pbs清洗3次,用无外泌体的血清(exo
‑
fbs)配制dmem培养基孵育细胞48h。收集上清进行离心处理(300g离心10min),以除去样品中的残余细胞。收集上清,以2000 g离心10min,以除去样品中的死细胞等。收集上清,以10000g离心30min,以除去样品中的细胞碎片等。收集上清,以130000g低温离心70min,沉淀样品中的外泌体。弃去上清液,加入适量pbs均匀吹打离心沉淀物,待其均匀分散在pbs中,然后以130000g再次离心70min。弃去上清,用200μl 1
×
pbs 缓冲液重悬离心沉淀物,保存于
‑
80℃超低温冰箱中备用。
[0170]
当然,本领域技术人员也可以使用其他常规方法提取外泌体样品。
[0171]
为进一步验证该步骤已成功提取到外泌体,使用扫描电镜(sem)对本实施例中提取得到的外泌体的形貌进行表征,同时,使用纳米颗粒跟踪分析仪(nta)对外泌体浓度、大小进行表征;使用蛋白印迹法 (western blot)对外泌体上的蛋白进行检测(以彩色预染蛋白质分子量标准品(分子量为10~180kd,来自于碧云天生工技术)作为marker)。
[0172]
结果如图11~13所示。
[0173]
sem结果显示,上述实施例提取得到的外泌体在电镜图下表现大小均一;而nta结果显示外泌体粒径分布在60~250nm范围内,平均直径为157.8nm,浓度为1.42
×
10
12
ml
‑1。电泳结果显示上述实施例提取得到的外泌体表面能够检测到cd63蛋白,而cd63是外泌体表面常见的蛋白标志物,因此可以确定上述实施例提取得到的产物为mcf
‑
10a细胞的外泌体。
[0174]
(2)外泌体负载探针(hp
‑
exo)的制备:
[0175]
本实施例中的基于外泌体回收放大的光控三探针检测体系需要外泌体负载三探针系统(发卡链h1、光控发卡链h2和h3)进入细胞内,以实现活细胞内的检测,因此,测定外泌体负载探针的效率是验证该检测方法可行性其中一环。
[0176]
取200μl pbs,加入光控发卡链h2(终浓度为500nm),然后分别加入外泌体至终浓度分别为0个/ml、 1.5
×
10
10
个/ml、3
×
10
10
个/ml、6
×
10
10
个/ml和12
×
10
10
个/ml。130000g下离心70min,测定上清液的荧光强度。
[0177]
结果如图14所示。
[0178]
可以发现,随着外泌体用量的增多,上清液荧光强度逐渐降低,由于溶液均经过离心,因此,可以说明外泌体的增多使更多的发卡链h1锚定到外泌体膜上,并进一步连接光控发卡链h2和h3,从而残留在上清液中的光控发卡链h2和h3变少,荧光强度降低。当外泌体浓度上升至3
×
10
10
个/ml时,荧光下降趋势减缓,说明此时外泌体用量增加没有明显提高探针负载效率,经计算,此时的外泌体负载探针效率为68.3%。
[0179]
为了进一步验证光控发卡链锚定外泌体膜上,取200μl pbs,加入光控发卡链h2和h3(终浓度均为 500nm),然后分别加入外泌体至终浓度为3
×
10
10
个/ml,室温孵育30min,在激光共聚焦显微镜(clsm) 下对外泌体溶液进行荧光成像。
[0180]
以未加入外泌体的组为空白组,以加入外泌体和未修饰胆固醇基团的发卡链h2的组为对照组。
[0181]
结果如图15所示。
[0182]
可以发现,仅光控发卡链h2和h3以及外泌体同时存在的组(图15中a)在显微镜下有荧光出现,说明外泌体负载了探针,实现了荧光基团的富集。游离的光控发卡链h2和h3则无荧光。而空白组和对照组均在clsm下几乎没有荧光出现,从而表明光控发卡链上修饰疏水基团胆固醇可以将其锚定在外泌体上。
[0183]
(3)将负载有三探针的外泌体转染至细胞中,通过光照在细胞内部释放三探针,实现细胞内hcr检测待测mirna。
[0184]
其中,为了验证该体系能在活细胞中有效执行,发明人采用下述实验进行验证。
[0185]
①
外泌体递送探针的可行性:
[0186]
配制含有终浓度为3
×
10
10
个/ml的外泌体和终浓度为500nm的光控发卡链h2的pbs溶液,室温孵育30min。将溶液加入mcf
‑
7细胞中,在37℃继续孵育一定时间(0、30、60、90min),利用细胞成像技术在在激光共聚焦显微镜(clsm)观察细胞内外的荧光分布情况。
[0187]
结果如图16所示。
[0188]
可以发现,将外泌体负载探针(hp
‑
exo)与mcf
‑
7细胞混合后,随着孵育时间延长,细胞摄取的外泌体数量也在不断增多,由于外泌体负载有带有荧光基团的光控发卡链h2,因此,细胞内释放的荧光也越来越强。同时,在细胞外残留的外泌体也随之变少,细胞在60min左右即可实现充足的外泌体摄取量,因此,可以选择60min作为细胞转染时间。
[0189]
为了进一步验证外泌体在进入细胞后是否仍有完整的球形膜结构,使用pkh67(外泌体膜染料)对外泌体膜进行染色标记,离心去除多余染料并重悬外泌体。将染色后的外泌体与mcf
‑
7细胞混合,孵育6h 使细胞充分摄入外泌体,使用激光共聚焦显微镜(clsm)观察细胞内的染色情况。
[0190]
结果如图17所示。
[0191]
mcf
‑
7细胞摄取外泌体后仍具有不同程度的荧光信号,在高倍镜下,荧光主要以亮点的形式呈现,表明外泌体在被细胞摄入后,基本保持着球形的膜结构,从而能够保证连接于其膜表面的三探针不会发生脱离或脱落的情况。
[0192]
同时,使用mtt法测定外泌体的细胞毒性:在96孔板内铺4组mcf
‑
7细胞(3000个/孔),每组做5 个平行,在37℃下孵育过夜,4组分别加入终浓度为0、1.5
×
10
10
、3
×
10
10
、6
×
10
10
、9
×
10
10
、12
×
10
10
个/ml的外泌体,继续培养24h,利用酶标仪测试570nm波长下的吸光度,并计算细胞的存活率。
[0193]
结果如图18所示。
[0194]
可以发现,在本实施例中所测的外泌体浓度范围内,细胞存活率与不加入外泌体的组并无显著差异性,当外泌体终浓度为3
×
10
10
个/ml时,细胞仍有98.7%的活性,继续增加至12
×
10
10
个/ml时,细胞依然保持很高存活率,说明外泌体是一种良好的生物相容性转运载体,基于外泌体的递送可以保证上述实施例中的检测方法能适用于活细胞内的检测。
[0195]
②
外泌体与脂质体转染细胞的对比:
[0196]
为了说明上述实施例中的检测方法使用外泌体作为运载体的合理性,发明人使用了常规方法中的脂质体作为对照,对比两者在活细胞体系中的适用度差异。
[0197]
具体实验步骤如下:
[0198]
在96孔板内铺3组mcf
‑
7细胞(3000个/孔),每组5个平行,在37℃下孵育过夜,3组分别加入pbs、终浓度为3
×
10
10
个/ml的外泌体和终浓度为3
×
10
10
个/ml的脂质体lipo 3000(购自碧云天生物技术有限公司),继续培养24h。使用mtt法测量细胞存活率。
[0199]
结果如图19所示。
[0200]
可以发现,外泌体对细胞几乎没有细胞毒性,而脂质体lipo 3000毒性较大,细胞存活率仅为77.5%。
[0201]
进一步设置两组实验组,组1将终浓度为3
×
10
10
个/ml的外泌体和终浓度为500nm的光控发卡链 h2混合,室温孵育30min。组2将终浓度为3
×
10
10
个/ml的脂质体lipo 3000与终浓度为500nm的光控发卡链h2分别先与减血清培养基(购自赛默飞世尔科技有限公司)混合5min,然后将混合后的脂质体lipo3000与光控发卡链h2混合孵育20min。然后将组1和组2分别加至mcf
‑
7细胞中,37℃孵育1h后使用 pbs清洗三次,clsm观察细胞成像。同时,设置空白对照。
[0202]
结果如图20所示。
[0203]
可以发现,外泌体组在细胞内分布良好,未发生粘连或者聚团现象;而脂质体组则容易粘附在细胞膜表面,呈团聚现象,不利于检测的准确性,由此可见,外泌体具有更好的生物相容性与转染效率。
[0204]
②
光控发卡链的释放:
[0205]
为测定hp
‑
exo上已锚定的光控发卡链的光剪切释放效果,仍使用上述实施例中测定上清液荧光强度的方法评估释放效率。
[0206]
本实施例共设置两组实验组,第一组为:取200μl pbs,加入终浓度为500nm的光控发卡链h2。第二组为:取200μl pbs,加入终浓度为500nm的光控发卡链h2和终浓度为3
×
10
10
个/ml的外泌体。两实验组均在室温下孵育30min,缓慢震荡,130000g下离心70min,测量上清液荧光。
[0207]
结果如图21所示。
[0208]
在图21中,i表示第一组(荧光曲线),ii表示第二组(荧光曲线)。而iii则表示将离心得到的外泌体沉淀重悬并使用uv照射后再次离心测量上清液荧光后的数据(荧光曲线)。对比i和ii,可以发现外泌体与光控发卡链h2共混孵育后,上清液荧光强度显著降低,表明外泌体负载了探针。而对比ii和iii,则显示出了在对负载了探针的外泌体进行uv剪切后,溶液荧光恢复,表明外泌体表面的光控发卡链h2脱落并分散于溶液,经计算,光控发卡链h2的释放率约为95.5%。
[0209]
为了进一步展示光控对于体系的影响,设置基于外泌体回收放大的光控三探针检测体系(lrt
‑
hcr) 与全剪切三探针检测体系(t
‑
hcr,作为对照,发卡链h1含有光控基团并在光照后无法锚定在外泌体上),基于外泌体回收放大的光控三探针检测体系如表3所示。
[0210]
表3基于外泌体回收放大的光控三探针检测体系(lrt
‑
hcr)
[0211]
组分含量发卡链h1终浓度200nm光控发卡链h2终浓度500nm光控发卡链h3终浓度500nm外泌体终浓度7.2
×
10
10
个/mlmgso4溶液终浓度5mm待测mirna0.5μl1
×
pbs(ph=7.4)补足至50μl
[0212]
本实施例中的待测mirna为mir
‑
21。
[0213]
对照组的检测程序为:先将外泌体与光控发卡链h1(此h1具有pc
‑
linker基团)、h2和h3室温孵育 30min,然后加入待测mirna(mir
‑
21)、mgso4溶液,uv照射5min,在37℃下孵育4h。
[0214]
实验组的检测程序为:先将外泌体与发卡链h1(此h1不具有pc
‑
linker基团)、光控发卡链h2和h3室温孵育30min,然后加入待测mirna(mir
‑
21)、mgso4溶液,uv照射5min,在37℃继续孵育4h。
[0215]
实验组与对照组的区别在于:发卡链h1是否能够稳定锚定在外泌体上(即是否能被光剪切下来)。
[0216]
对实验组和对照组溶液进行离心,离心后将上清与沉淀分别进行凝胶电泳检测(marker为25~500bp 碱基的dna),结果如图22所示。
[0217]
可以发现,lrt
‑
hcr体系离心所得的外泌体沉淀包含大量扩增产物(条带1),而上清中几乎不存在扩增产物(条带2);对于t
‑
hcr体系(有外泌体的全剪切),扩增产物主要在上清中(条带4),外泌体沉淀中几乎不存在扩增产物(条带3),因此,可以说明基于外泌体回收放大的光控三探针检测体系 (lrt
‑
hcr)因发卡链h1锚定于外泌体,能够有效的将游离光控发卡链h2、h3通过链杂交反应回收至外泌体上,即可回收扩增产物,从而便于后续细胞内荧光聚集成像。
[0218]
②
基于外泌体回收放大的光控三探针检测体系(lrt
‑
hcr)的体外检测效果:
[0219]
以全剪切三探针(光控发卡h1,h2,h3)检测体系(t
‑
hcr)作为对照,检测lrt
‑
hcr的体外检测效果。
[0220]
lrt
‑
hcr的检测体系如表3所示。
[0221]
具体为:按照表3所示体系,先将外泌体与发卡链h1、光控发卡链h2和h3室温孵育30min,然后加入终浓度为0、10nm、100nm的待测样品(本实施例中为mir
‑
21),uv照射5min,37℃继续孵育4h,测定fret荧光强度。
[0222]
t
‑
hcr与lrt
‑
hcr的区别在于:发卡h1替换成了光控发卡h1实现全剪切。
[0223]
结果如图23所示。
[0224]
可以发现,本实施例中的lrt
‑
hcr相比于全剪切的t
‑
hcr反应体系,其信号强度更
强,说明使用外泌体进行回收信号放大的效果显著,尤其是对于10nm及100nm检测样品浓度下,fret强度均有十分显著的提升。
[0225]
lrt
‑
hcr在活细胞检测中的应用
[0226]
(1)lrt
‑
hcr活细胞检测体系的构建:
[0227]
为了验证lrt
‑
hcr体系在活细胞检测中的适用性,发明人构建下述实验进行测试:
[0228]
实验组1(不进行光控):按照表3所示体系,先将外泌体(终浓度7.2
×
10
10
个/ml)与发卡链h1、光控发卡链h2和h3(终浓度分别为200nm、500nm和500nm)室温孵育30min,然后室温缓慢震荡孵育 30min,加至mcf
‑
7细胞中,37℃孵育5h。
[0229]
实验组2:按照表3所示体系,先将外泌体(终浓度7.2
×
10
10
个/ml)与发卡链h1、光控发卡链h2和h3(终浓度分别为200nm、500nm和500nm)室温孵育30min,分别加至三组mcf
‑
7细胞中,37℃孵育1h,uv照射5min后,继续孵育4h。
[0230]
其中,实验组2中的三组mcf
‑
7细胞分别为:不做任何处理的对照组细胞;加入他莫昔芬(下调mir
‑
21 表达量)提前孵育24h的细胞;加入雌二醇(上调mir
‑
21表达量)提前孵育24h的细胞。
[0231]
实验组3:按照表3所示体系,先将外泌体(终浓度7.2
×
10
10
个/ml)与发卡链h1、光控发卡链h2和h3(终浓度分别为200nm、500nm和500nm)室温孵育30min,然后加至mcf
‑
7细胞中,37℃孵育 1h,uv照射5min后,继续孵育4h。
[0232]
实验组1~3在完成孵育后均用pbs清洗三次,在clsm下观察荧光情况。
[0233]
结果如图24~25所示。
[0234]
可以发现,在未设置uv照射时间的实验组1中,fret信号非常低,说明外泌体表面负载的探针未能脱落,从而无法参与hcr反应。而在实验组3中,当发卡链h1与疏水胆固醇之间修饰上pc
‑
linker后,此时发卡链h1即为光控发卡链h1,uv照射会导致光控发卡链h1、h2和h3同时从外泌体表面脱落,发生类似于上述的t
‑
hcr扩增反应,由于没有连接在外泌体上,从而无法实现回收聚集作用,使得实验组3 得到的信号比实验组2中的lrt
‑
hcr弱,且两者的信号存在显著差异性。在实验组2中,使用他莫昔芬和雌二醇处理细胞的目的在于调控mcf
‑
7细胞内mir
‑
21表达量,从而进一步验证实验组2中的检测准确性,可以发现,在实验组2中,其细胞内fret荧光强度正确的反映出了mir
‑
21表达量变化,且荧光强度也显著强于实验组1和3,因此,可以说明lrt
‑
hcr方法能够灵敏地检测出癌细胞内靶标基因的表达变化水平。
[0235]
(2)lrt
‑
hcr对于不同转染工具(运载体)的选择性:
[0236]
实验组:按照表3所示体系,先将外泌体(终浓度为7.2
×
10
10
个/ml)与发卡链h1、光控发卡链h2和h3混合,室温缓慢震荡孵育30min。
[0237]
对照组:按照表3所示体系,将外泌体替换为脂质体lipo 3000(终浓度为7.2
×
10
10
个/ml),但需要注意的是,脂质体lipo 3000与光控发卡链需要分别先与减血清培养基(购自赛默飞世尔科技有限公司) 混合5min,然后将混合后的脂质体lipo 3000与光控发卡链混合孵育20min。
[0238]
将实验组和对照组分别加入至mcf
‑
7细胞中进行转染,37℃孵育1h后,实验组用uv照射5min,然后实验组和对照组继续孵育4h,使用pbs清洗三次,clsm观察细胞成像。
[0239]
结果如图26所示。
[0240]
可以发现,外泌体与脂质体lipo 3000均能转染至mcf
‑
7细胞内,均具有较好的转染效果,但使用脂质体lipo 3000转染细胞,细胞内的荧光大部分出现细胞膜上,或在细胞内粘成一团,从而容易导致假阳性荧光信号。而基于外泌体的lrt
‑
hcr方法产生的荧光信号比基于脂质体lipo 3000的检测方法转染效果更好,荧光分散性更佳,因此基于外泌体的lrt
‑
hcr方法可以适用于mirna检测成像方面,且外泌体对于lrt
‑
hcr方法是一个极佳的转运载体。
[0241]
(2)lrt
‑
hcr方法对于不同细胞的适用性:
[0242]
按照表3所示体系(将pbs替换为dmem),先将外泌体(终浓度7.2
×
10
10
个/ml)与发卡链h1、光控发卡链h2和h3(终浓度分别为200nm、500nm和500nm)室温孵育30min,分别以mcf
‑
7、mcf
‑
10a 和a549细胞作为测试对象,评估lrt
‑
hcr方法对于不同细胞的适用性。
[0243]
在外泌体与发卡链h1、光控发卡链h2和h3室温孵育30min后,分别加入含有mcf
‑
7、mcf
‑
10a和 a549细胞(细胞含量约为1
×
105个)的培养皿中,37℃孵育1h,uv照射5min后,继续孵育4h。使用clsm观察细胞成像。
[0244]
结果如图27和28所示。
[0245]
mcf
‑
7乳腺癌细胞相比正常乳腺上皮细胞mcf
‑
10a,其存在mir
‑
21高表达的情况,而利用lrt
‑
hcr 方法检测这两种细胞内的mir
‑
21表达量时,mcf
‑
7的fret荧光信号比mcf
‑
10a细胞内的fret荧光信号强,在mir
‑
21同样高表达的肺癌上皮细胞a549中,lrt
‑
hcr方法所得到的fret荧光信号也较高,说明lrt
‑
hcr方法可用于癌细胞与正常细胞内成像区分。
[0246]
使用qrt
‑
pcr方法检测mcf
‑
7、mcf
‑
10a、a549细胞内mir
‑
21的相对表达量,用于检测mir
‑
21 的引物为:
[0247]
mir
‑
21f:5
’‑
acactccagctgggtagcttatcagactga
‑3’
(seq id no.15);
[0248]
mir
‑
21r:5
’‑
ctcaactggtgtcgtggagtcggcaattcagttgagtcaacatca
‑3’
(seq idno.16)。
[0249]
将mcf
‑
7,mcf
‑
10a与a549细胞约1
×
106个/孔铺在6孔板上,孵育24小时。使用细胞mirna提取试剂盒(购自美基生物)提取细胞内的总rna。使用逆转录试剂盒(购自诺唯赞生物)对2μg的rna 进行逆转录得到cdna。使用mirna染料法定量预混液(购自诺唯赞生物)进行rt
‑
qpcr扩增。
[0250]
检测结果如图29所示。
[0251]
可以发现,使用qrt
‑
pcr方法定量检测mcf
‑
7、mcf
‑
10a、a549细胞内mir
‑
21的相对表达量,其结果与lrt
‑
hcr方法所得到的荧光信号强度差异相似,各细胞内所存在的mir
‑
21含量差异与lrt
‑
hcr 方法所得结果一致,说明lrt
‑
hcr方法检测灵敏度高,可应用于不同类型活细胞内mirna成像并能准确反应其靶标基因的含量水平。
[0252]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。