用于在靶向性载体中无瘢痕引入靶向修饰的方法
1.相关申请的交叉引用
2.本技术要求于2019年4月4日提交的美国申请第62/829,327号的权益,所述美国申请出于所有目的整体并入本文。
3.对序列表的引用通过efs web作为文本文件提交
4.写入文件544999seqlist.txt中的序列表为20.7千字节,创建于2020年3月21日,并且特此通过引用并入。
背景技术:
5.在创建转基因动物系时,无缝dna构建尤其重要,因为由限制位点或其它操纵产生的瘢痕如果落在对调控很重要的区域,可能对基因表达产生负面影响。靶向哺乳动物基因组通常需要构建具有长dna臂的大靶向性载体以指导同源重组,以及用于选择胚胎干细胞克隆的抗生素抗性盒。正确靶向的克隆体通常含有构建载体所需的多个瘢痕,更不用说抗性盒本身了。对于基因消融,这些病变可能与最终结果(无效等位基因)无关,但相邻基因的表达总是有可能受到不利影响。对于敲除以外的修饰,如敲入,靶向基因座的可靠表达通常对所讨论的研究很重要。
6.具体地,人源化,即用人对应物直接置换小鼠基因,需要小鼠与人序列之间的无缝连接,以便小鼠转录机制能够可靠地复制新等位基因的表达。必须注意在不影响基因调控的非编码区域中掩埋构建瘢痕和选择盒。随着动物模型变得越来越复杂,可以在现有模型之上添加更多修饰,如在人源化等位基因之上添加人致病突变。另外的变化然后可以向已经高度工程化的小鼠基因座添加甚至更多的瘢痕和另一个选择盒,从而增加表达被改变的可能性,并且小鼠模型对于人类疾病将不可靠。从构建的角度来看,即使两个盒对不同的选择进行编码,由于共享盒元件如启动子和poly(a)信号之间的不期望的重组,将新盒添加到已经含有一个盒的载体可能会变得复杂。因此,需要新的方法来简化携带多种变化(如人源化等位基因和层置在顶部的疾病突变)的靶向的生成,并使结合到最终动物模型中的瘢痕最小化。
技术实现要素:
7.提供了在预先存在的靶向性载体中无瘢痕引入靶向基因修饰的方法。
8.在一个方面,一些此类方法包括:(a)在细菌细胞群中进行所述预先存在的靶向性载体与修饰盒之间的细菌同源重组,其中所述修饰盒包括所述靶向基因修饰并且包括插入核酸,所述插入核酸侧接有与所述预先存在的靶向性载体中的5'靶序列相对应的5'同源臂和与所述预先存在的载体中的3'靶序列相对应的3'同源臂,其中所述插入核酸从5'到3'包括:(i)第一重复序列;(ii)用于第一核酸酶试剂的第一靶位点;(iii)选择盒;(iv)用于第二核酸酶试剂的第二靶位点;以及(v)与所述第一重复序列相同的第二重复序列;(b)选择包括包含所述选择盒的经修饰靶向性载体的细菌细胞;(c)用所述第一核酸酶试剂切割所述经修饰靶向性载体中的所述第一靶位点并用所述第二核酸酶试剂切割所述经修饰靶向
性载体中的所述第二靶位点以去除所述选择盒并暴露所述经修饰靶向性载体中的所述第一重复序列和所述第二重复序列;以及(d)在分子内体外组装反应中将所暴露的第一重复序列与所暴露的第二重复序列组装以产生包括所述无瘢痕靶向基因修饰的所述靶向性载体,其中包括所述无瘢痕靶向基因修饰的所述靶向性载体中既不存在用于所述第一核酸酶试剂的所述第一靶位点,也不存在针对所述第二核酸酶试剂的所述第二靶位点,而是仅存在所述重复序列的单个拷贝。
9.在一些此类方法中,所述重复序列与所述预先存在的靶向性载体中的序列相同。在一些此类方法中,所述靶向基因修饰包括插入,并且所述重复序列与所述插入的5'端或3'端相同。
10.在一些此类方法中,所述重复序列的长度为至少约20个核苷酸。任选地,所述重复序列的长度介于约20个核苷酸与约100个核苷酸之间。
11.在一些此类方法中,所述修饰盒是线性双链核酸。在一些此类方法中,所述修饰盒的长度为约1kb到约15kb。在一些此类方法中,所述5'同源臂和所述3'同源臂各自的长度为至少约35个核苷酸。在一些此类方法中,所述5'同源臂和所述3'同源臂各自的长度介于约35个核苷酸与约500个核苷酸之间。
12.在一些此类方法中,所述第一核酸酶试剂和/或所述第二核酸酶试剂是稀有切割核酸酶试剂。在一些此类方法中,所述预先存在的靶向性载体中不存在所述第一靶位点和/或所述第二靶位点。在一些此类方法中,所述第一靶位点与所述第二靶位点相同,并且所述第一核酸酶试剂与所述第二核酸酶试剂相同。
13.在一些此类方法中,所述第一核酸酶试剂和/或所述第二核酸酶试剂包括稀有切割限制酶。任选地,所述稀有切割限制酶是noti、xmaiii、sstii、sall、nrui、nhei、nb.bbvci、bbvci、asci、asisi、fsei、paci、pmei、sbfi、sgrai、swai、bspqi、sapi、sfii、cspci、absi、ccini、fspai、maubi、mrei、mssi、palai、rgai、rigi、sdai、sfaai、sgfi、sgrdi、sgsi、smii、srfi、sse2321、sse83871、lgui、pcisi、aari、ajui、aloi、bari、ppii或psri。
14.在一些此类方法中,所述第一核酸酶试剂和/或所述第二核酸酶试剂是成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,crispr)相关(cas)蛋白和向导rna(grna)、锌指核酸酶(zfn)、转录激活子样效应子核酸酶(transcription activator
‑
like effector nuclease,talen)或经工程化的大范围核酸酶。任选地,所述第一核酸酶试剂和/或所述第二核酸酶试剂所述cas蛋白和所述grna,其中所述cas蛋白是cas9,并且其中所述grna包括靶向的crispr rna(crrna)和反式激活cripsr rna(tracrrna)。
15.在一些此类方法中,所述靶向基因修饰包括所述5'同源臂或所述3'同源臂中的修饰。在一些此类方法中,所述靶向基因修饰包括所述插入核酸中的修饰。在一些此类方法中,所述靶向基因修饰包括点突变、缺失、插入、置换或其组合。
16.在一些此类方法中,所述选择盒赋予对抗生素的抗性。任选地,所述选择盒赋予对氨苄青霉素、氯霉素、四环素、卡那霉素、大观霉素、链霉素、羧苄青霉素、博来霉素、红霉素或多粘菌素b的抗性。
17.在一些此类方法中,所述预先存在的靶向性载体是长度为至少约10kb的大靶向性载体。任选地,所述预先存在的靶向性载体的长度为至少约100kb。
18.在一些此类方法中,所述预先存在的靶向性载体包括第二选择盒。任选地,所述第二选择盒赋予对抗生素的抗性。任选地,所述修饰盒中的所述选择盒和所述预先存在的靶向性载体中的所述第二选择盒各自赋予对不同抗生素的抗性。任选地,所述第二选择盒允许在细菌细胞和哺乳动物细胞两者中进行选择。
19.在一些此类方法中,步骤(c)在体外发生。
20.在一些此类方法中,步骤(d)包括:(i)使所述经修饰靶向性载体与核酸外切酶接触以暴露所述第一重复序列与所述第二重复序列之间的互补序列;(ii)对所暴露的互补序列进行退火;(iii)延长经退火的互补序列的3'端;以及(iv)连接所述经退火的互补序列。任选地,步骤(d)包括将所述经修饰靶向性载体与核酸外切酶、dna聚合酶和dna连接酶一起温育。
21.一些此类方法进一步包括:(e)在步骤(d)中的所述体外组装之后,用所述第一核酸酶试剂和所述第二核酸酶试剂处理所述靶向性载体,以验证既不存在用于所述第一核酸酶试剂的所述第一靶位点,也不存在针对所述第二核酸酶试剂的所述第二靶位点。
22.在另一方面,一些此类方法包括:(a)在细菌细胞群中进行所述预先存在的靶向性载体与缺失盒之间的细菌同源重组,其中所述缺失盒包括插入核酸,所述插入核酸侧接有与所述预先存在的靶向性载体中的5'靶序列相对应的5'同源臂和与所述预先存在的载体中的3'靶序列相对应的3'同源臂,其中所述5'靶序列和所述3'靶序列侧接所述预先存在的靶向性载体的要引入所述靶向基因修饰的区域,并且其中所述插入核酸从5'到3'包括:(i)用于第一核酸酶试剂的第一靶位点;(ii)选择盒;以及(iii)用于第二核酸酶试剂的第二靶位点;(b)选择包括包含所述选择盒的经修饰靶向性载体的细菌细胞;(c)用所述第一核酸酶试剂切割所述经修饰靶向性载体中的所述第一靶位点并用所述第二核酸酶试剂切割所述经修饰靶向性载体中的所述第二靶位点以去除所述选择盒并暴露所述经修饰靶向性载体中的上游末端序列和下游末端序列;以及(d)在体外组装反应中将所述经切割靶向性载体与包括所述靶向基因修饰的修饰盒组装以产生包括所述无瘢痕靶向基因修饰的所述靶向性载体,所述靶向基因修饰侧接有与所述经修饰靶向性载体中的上游末端序列重叠的上游末端序列和与所述经修饰靶向性载体中的下游末端序列重叠的下游末端序列,其中包括所述无瘢痕靶向基因修饰的所述靶向性载体中既不存在用于所述第一核酸酶试剂的所述第一靶位点,也不存在针对所述第二核酸酶试剂的所述第二靶位点。
23.在一些此类方法中,所述缺失盒的长度为约1kb到约15kb。在一些此类方法中,所述5'同源臂和所述3'同源臂各自的长度为至少约35个核苷酸。任选地,所述5'同源臂和所述3'同源臂各自的长度介于约35个核苷酸与约500个核苷酸之间。在一些此类方法中,所述缺失盒是线性双链核酸。
24.在一些此类方法中,所述第一核酸酶试剂和/或所述第二核酸酶试剂是稀有切割核酸酶试剂。在一些此类方法中,所述预先存在的靶向性载体中不存在所述第一靶位点和/或所述第二靶位点。在一些此类方法中,所述第一靶位点与所述第二靶位点相同,并且所述第一核酸酶试剂与所述第二核酸酶试剂相同。
25.在一些此类方法中,所述第一核酸酶试剂和/或所述第二核酸酶试剂包括稀有切割限制酶。任选地,所述稀有切割限制酶是noti、xmaiii、sstii、sall、nrui、nhei、nb.bbvci、bbvci、asci、asisi、fsei、paci、pmei、sbfi、sgrai、swai、bspqi、sapi、sfii、
cspci、absi、ccini、fspai、maubi、mrei、mssi、palai、rgai、rigi、sdai、sfaai、sgfi、sgrdi、sgsi、smii、srfi、sse2321、sse83871、lgui、pcisi、aari、ajui、aloi、bari、ppii或psri。
26.在一些此类方法中,所述第一核酸酶试剂和/或所述第二核酸酶试剂是成簇的规律间隔的短回文重复序列(crispr)相关(cas)蛋白和向导rna(grna)、锌指核酸酶(zfn)、转录激活子样效应子核酸酶(talen)或经工程化的大范围核酸酶。任选地,所述第一核酸酶试剂和/或所述第二核酸酶试剂所述cas蛋白和所述grna,其中所述cas蛋白是cas9,并且其中所述grna包括靶向的crispr rna(crrna)和反式激活cripsr rna(tracrrna)。
27.在一些此类方法中,所述选择盒赋予对抗生素的抗性。任选地,所述选择盒赋予对氨苄青霉素、氯霉素、四环素、卡那霉素、大观霉素、链霉素、羧苄青霉素、博来霉素、红霉素或多粘菌素b的抗性。
28.在一些此类方法中,所述预先存在的靶向性载体是长度为至少10kb的大靶向性载体。任选地,所述预先存在的靶向性载体的长度为至少100kb。
29.在一些此类方法中,所述预先存在的靶向性载体包括第二选择盒。任选地,所述第二选择盒赋予对抗生素的抗性。任选地,所述缺失盒中的所述选择盒和所述预先存在的靶向性载体中的所述第二选择盒各自赋予对不同抗生素的抗性。任选地,所述第二选择盒允许在细菌细胞和哺乳动物细胞两者中进行选择。
30.在一些此类方法中,所述修饰盒中的所述上游末端序列与所述经修饰靶向性载体中的所述上游末端序列之间的重叠长度和/或所述修饰盒中的所述下游末端序列与所述经修饰靶向性载体中的所述下游末端序列之间的重叠长度的长度为至少约20个核苷酸。在一些此类方法中,所述修饰盒中的所述上游末端序列与所述经修饰靶向性载体中的所述上游末端序列之间的重叠长度和/或所述修饰盒中的所述下游末端序列与所述经修饰靶向性载体中的所述下游末端序列之间的重叠长度的长度介于约20个核苷酸与约100个核苷酸之间。
31.在一些此类方法中,其中步骤(c)在体外发生。
32.在一些此类方法中,步骤(d)包括:(i)使所述经切割靶向性载体和所述修饰盒与核酸外切酶接触,以暴露所述经修饰靶向性载体中的所述末端序列与所述修饰盒中的所述末端序列之间的互补序列;(ii)对所暴露的互补序列进行退火;(iii)延长经退火的互补序列的3'端;以及(iv)连接所述经退火的互补序列。任选地,步骤(d)包括将所述经切割靶向性载体和所述修饰盒与核酸外切酶、dna聚合酶和dna连接酶一起温育。
33.在一些此类方法中,所述修饰盒是线性双链核酸。在一些此类方法中,所述修饰盒的长度为至少约200个核苷酸。在一些此类方法中,所述修饰盒修饰盒为无法直接合成或通过聚合酶链式反应产生的大小。在一些此类方法中,所述修饰盒的长度为至少约10kb。
34.在一些此类方法中,所述靶向基因修饰包括点突变、缺失、插入、置换或其组合。
35.一些此类方法进一步包括:(e)在步骤(d)中的所述体外组装之后,用所述第一核酸酶试剂和所述第二核酸酶试剂处理所述靶向性载体,以验证既不存在用于所述第一核酸酶试剂的所述第一靶位点,也不存在针对所述第二核酸酶试剂的所述第二靶位点。
附图说明
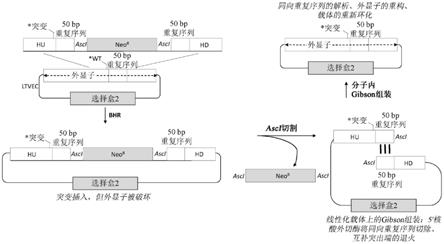
36.图1(未按比例)示出了用于通过细菌同源重组和分子内gibson组装在大靶向性载
体中无瘢痕引入点突变的方法的示意图。
37.图2(未按比例)示出了在图1中的示意图中所示方法中使用的合成核酸的示意图。
38.图3(未按比例)示出了用于通过细菌同源重组和分子间gibson组装在大靶向性载体中无瘢痕引入点突变的方法的示意图。
39.图4a
‑
4b示出了使用经修饰的小鼠bac作为载体和自缺失盒技术的从载体构建(图4a)到f1小鼠生成(图4b)的传统靶向策略。通过小鼠鱼精蛋白表达的cre重组酶的缺失盒会留下含有单个loxp的78bp瘢痕。
40.定义
41.本文可互换使用的术语“蛋白质”、“多肽”、和“肽”包含任何长度的聚合形式的氨基酸,包含编码氨基酸和非编码氨基酸以及以化学方式或生物化学方式修饰的氨基酸或以化学方式或生物化学方式衍生的氨基酸。这些术语还包含已经修饰的聚合物,如具有经修饰的肽主链的多肽。术语“结构域”是指具有特定功能或结构的蛋白质或多肽的任何部分。
42.本文可互换使用的术语“核酸”和“多核苷酸”包含任何长度的聚合形式的核苷酸,包含核糖核苷酸、脱氧核糖核苷酸、或其类似物或经修饰的版本。所述核苷酸包含单链、双链和多链dna或rna、基因组dna、cdna、dna
‑
rna杂交体以及包括嘌呤碱基、嘧啶碱基或其它天然的、以化学方式修饰的、以生物化学方式修饰的、非天然的或衍生的核苷酸碱基的聚合物。
43.术语“靶向性载体”是指可以通过同源重组、非同源末端连接介导的连接或任何其它重组方式引入到细胞基因组中的靶位置的重组核酸。
44.术语“野生型”包含具有在正常(与突变、患病、改变等相比)状态或情况下发现的结构和/或活性的实体。野生型基因和多肽通常以多种不同形式(例如,等位基因)存在。
45.术语“内源序列”是指天然存在于细胞或非人动物内的核酸序列。例如,非人动物的内源性rosa26序列是指天然存在于非人动物的rosa26基因座处的天然rosa26序列。
[0046]“外源”分子或序列包含通常不以所述形式或位置(例如,基因组基因座)存在于细胞中的分子或序列。正常存在包含关于细胞的特定发育阶段和环境条件的存在。例如,外源分子或序列可以包含细胞内对应的内源序列的突变版本,如内源序列的人源化版本,或者可以包含与细胞内的内源序列相对应但形式不同(即,不在染色体内)的序列。相比之下,“内源”分子或序列包含在特定环境条件下在特定发育阶段在特定细胞中通常以所述形式和位置存在的分子或序列。
[0047]
当在核酸或蛋白质的上下文中使用时,术语“异源的”指示核酸或蛋白质包括在同一分子中并非天然地一起出现的至少两个段。例如,当关于核酸的段或蛋白质的段使用时,术语“异源的”指示核酸或蛋白质包括在自然界中未发现彼此处于相同关系(例如,连接在一起)的两个或更多个子序列。作为一个实例,核酸载体的“异源”区域是在自然界中未发现与另一分子相关联的另一核酸分子内或与其连接的核酸的段。例如,核酸载体的异源区域可以包含编码序列,所述编码序列侧接有在自然界中未发现与编码序列相关联的序列。同样,蛋白质的“异源”区是在自然界中未发现与另一肽分子相关联的另一个肽分子内或与其连接的氨基酸的段(例如,融合蛋白或带有标签的蛋白质)。类似地,核酸或蛋白质可以包括异源标记或异源分泌或定位序列。
[0048]“密码子优化”利用密码子的简并性,如指定氨基酸的三碱基对密码子组合的多样
性所展示的,并且通常包含通过用宿主细胞的基因中更频繁或最频繁使用的密码子置换天然序列的至少一个密码子同时维持天然氨基酸序列来修饰核酸序列以在特定宿主细胞中增强表达的过程。例如,与天然存在的核酸序列相比,可以修饰对cas9蛋白进行编码的核酸以置换在给定的原核或真核细胞中具有更高使用频率的密码子,包含细菌细胞、酵母细胞、人细胞、非人细胞、哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞、仓鼠细胞或任何其它宿主细胞。密码子使用表很容易获得,例如,在“密码子使用数据库”中。这些表可以通过多种方式进行调整。参见nakamura等人,(2000)《核酸研究(nucleic acids research)》28:292,所述文献出于所有目的整体并入本文。也可获得用于在特定宿主中表达的特定序列的密码子优化的计算机算法(参见例如《基因伪造(gene forge)》)。
[0049]
术语“基因座”是指基因(或重要序列)、dna序列、多肽编码序列的特定位置或在生物体的基因组的染色体上的定位。例如,rosa26基因座可以指rosa26基因、rosa26 dna序列的特定位置或rosa26在生物体的基因组的染色体上的定位,所述位置已被标识为此类序列所驻留的位置。“rosa26基因座”可以包括rosa26基因的调控元件,包含例如增强子、启动子、5'和/或3'非翻译区(utr)或其组合。
[0050]
术语“基因”是指染色体中对产物(例如,rna产物和/或多肽产物)进行编码的dna序列并包含被非编码内含子中断的编码区和5'端和3'端两者上的邻近编码区定位的序列,使得基因对应于全长mrna(包含5'和3'未翻译序列)。术语“基因”还包含其它非编码序列,包含调控序列(例如,启动子、增强子和转录因子结合位点)、聚腺苷酸化信号、内部核糖体进入位点、沉默子、绝缘序列和基质连接区。这些序列可以靠近基因的编码区(例如,在10kb内)或处于远处位点处,并且其影响基因的转录和翻译的水平或速率。
[0051]“启动子”是dna的调控区,其通常包括能够指导rna聚合酶ii在针对特定多核苷酸序列的适当转录起始位点处起始rna合成的tata盒。启动子可以另外包括影响转录起始速率的其它区域。本文所公开的启动子序列调节可操作连接的多核苷酸的转录。启动子可以在本文所公开的细胞类型中的一种或多种细胞类型(例如,原核细胞或真核细胞(如哺乳动物细胞)或其组合)中具有活性。启动子可以是例如组成型活性启动子、条件型启动子、诱导型启动子、时间受限启动子(例如,受发育调控的启动子)或空间受限启动子(例如,细胞特异性启动子或组织特异性启动子)。启动子的实例可以例如在wo 2013/176772中找到,所述文献出于所有目的整体并入本文。
[0052]“可操作的连接”或“可操作地连接”包含将两种或更多种组分(例如,启动子和另一种序列元件)并置使得两种组分正常发挥功能,并使得组分中的至少一种组分能够介导施加在另一组分中的至少一种组分上的功能。例如,如果启动子响应于存在或不存在一种或多种转录调控因子而控制编码序列的转录水平,则所述启动子可以与编码序列可操作地连接。可操作的连接可以包含这些彼此相邻或以反式作用的序列(例如,调控序列可以在一定距离处起作用以控制编码序列的转录)。
[0053]
核酸的“互补性”意味着由于其核碱基团的取向,一条核酸链中的核苷酸序列与另一条相对核酸链上的序列形成氢键。dna中的互补碱基通常是a与t和c与g。在rna中,其通常是c与g和u与a。互补可以是完美的或者实质性的/足够的。两个核酸之间的完美互补意味着所述两个核酸可以形成双链体,其中双链体中的每个碱基都通过沃森
‑
克里克配对(watson
‑
crick pairing)与互补碱基键合。“基本上”或“足够”互补意味着一条链中的序列
与相对链中的序列不完全和/或完全互补,但两条链上的碱基之间发生足够的键合以在一组杂交条件下形成稳定的杂合复合物(例如,盐浓度和温度)。此类条件可以通过使用序列和标准数学计算来预测杂交链的tm(熔融温度),或通过使用常规方法的tm经验测定来预测。tm包含在两条核酸链之间形成的杂交复合物群变性50%(即,双链核酸分子群半解离成单链)时的温度。在低于tm的温度下,杂交复合物的形成是有利的,而在高于tm的温度下,杂交复合物中的链的熔融或分离是有利的。可以通过使用例如tm=81.5 0.41(%g c)来估计在1m nacl水溶液中具有已知g c含量的核酸的tm,尽管其它已知的tm计算考虑了核酸结构特性。
[0054]
尽管碱基之间的失配是可能的,但是杂交要求所述两个核酸含有互补序列。适用于两种核酸之间的杂交的条件取决于核酸的长度和互补程度,这是众所周知的变量。两个核苷酸序列之间的互补程度越大,具有这些序列的核酸杂交体的解链温度(tm)值就越大。对于具有短互补性段(例如,互补性超过35个或更少、30个或更少、25个或更少、22个或更少、20个或更少或18个或更少的核苷酸)的核酸之间的杂交,失配的位置变得很重要(参见sambrook等人,同上,11.7
‑
11.8)。通常,可杂交核酸的长度为至少约10个核苷酸。可杂交核酸的示例性最小长度包含至少约15个核苷酸、至少约20个核苷酸、至少约22个核苷酸、至少约25个核苷酸和至少约30个核苷酸。此外,可以根据如互补区的长度和互补程度等因素,根据需要调整温度和洗涤溶液盐浓度。
[0055]
多核苷酸序列不需要与其靶核酸的序列100%互补才能特异性杂交。此外,多核苷酸可以在一个或多个段上杂交,使得插入或相邻段不参与杂交事件(例如,环结构或发夹结构)。多核苷酸(例如,grna)可以包括与其靶向的靶核酸序列内的靶区域的至少70%、至少80%、至少90%、至少95%、至少99%或100%的序列互补性。例如,其中20个核苷酸中的18个与靶区域互补并因此特异性杂交的grna将表示90%的互补性。在此实施例中,剩余的非互补核苷酸可以与互补核苷酸成簇或散布并且不需要彼此相邻或与互补核苷酸相邻。
[0056]
可以使用默认设置,使用blast程序(基本局部比对搜索工具)和powerblast程序(altschul等人,(1990)《分子生物学杂志(j.mol.biol.)》215:403
‑
410;zhang和madden(1997)《基因组研究(genome res.)》7:649
‑
656,所述文献中的每个文献出于所有目的整体并入本文)或通过使用gap程序(麦迪逊威斯康星州的大学研究园的遗传学计算机组的unix版本8的威斯康星州序列分析包(wisconsin sequence analysis package,version 8for unix,genetics computer group,university research park,madison wis.))来常规确定核酸内特定核酸序列段之间的互补性百分比,其使用smith和waterman(1981)《应用数学进展(adv.appl.math.)》2:482
‑
489的算法,所述文献出于所有目的整体并入本文。
[0057]
本文所提供的方法和组合物采用多种不同的组分。贯穿说明书的一些组分可以具有活性变体和片段。此类组分包含例如cas蛋白、crispr rna、tracrrna和向导rna。这些组分中的每个组分的生物活性在本文其它地方描述。术语“功能性”是指蛋白质或核酸(或其片段或变体)表现出生物活性或功能的先天能力。此类生物活性或功能可以包含例如cas蛋白结合向导rna和靶dna序列的能力。与原始的相比,功能片段或变体的生物学功能可以相同或实际上可以改变(例如,关于其特异性或选择性或功效),但保留基本生物学功能。
[0058]
术语“变体”是指与群体中最普遍的序列不同(例如,相差一个核苷酸)的核苷酸序列或与群体中最普遍的序列不同(例如,相差一个氨基酸)的蛋白质序列。
[0059]
当提及蛋白质时,术语“片段”意指比全长蛋白质更短或具有更少氨基酸的蛋白质。当提及核酸时,术语“片段”意指比全长核酸更短或具有更少核苷酸的核酸。片段可以是例如n端片段(即,去除蛋白质的c端的一部分)、c端片段(即,去除蛋白质的n端的一部分)或内部片段。
[0060]“序列同一性”或“同一性”在两个多核苷酸或多肽序列的上下文中是指当在指定的比较窗口上出于最大对应进行比对时两个序列中相同的残基。当提及蛋白质的序列同一性的百分比时,不相同的残基位置通常因保守性氨基酸取代而不同,其中氨基酸残基被具有类似化学性质(例如,电荷或疏水性)的其它氨基酸残基取代,并且因此不改变分子的功能性质。当序列的保守性取代不同时,可以将百分比序列同一性向上调整以校正取代的保守性质。因此类保守性取代而不同的序列被视为具有“序列类似性”或“类似性”。用于进行这种调整的方法众所周知。通常,这涉及将保守性取代计为部分失配而不是完全失配,由此增加百分比序列同一性。因此,例如,在给定相同氨基酸的评分为1并且给定非保守性取代的评分为零的情况下,保守性取代的所得评分介于零与1之间。例如,如在项目pc/gene(加利福尼亚州山景城的intelligenetics公司(intelligenetics,mountain view,california))中所实施的,计算保守性取代的评分。
[0061]“序列同一性百分比”包含通过在比较窗口上比较两个最佳比对序列确定的值(完全匹配残基的最大数量),其中在比较窗口中的多核苷酸序列部分与参考序列(不包括添加物或缺失部分)相比可以包括添加物或缺失部分(即,缺口),以实现两个序列的最佳比对。通过确定在两个序列中出现相同核酸碱基或氨基酸残基的位置数计算百分比来得到匹配位置数,用匹配位置数除以比较窗口中的位置总数,并将结果乘以100以得到序列同一性的百分比。除非另有说明(例如较短的序列包含连接的异源序列),否则所述比较窗口为两个所比较序列中较短序列的全长。
[0062]
除非另有说明,否则序列同一性/类似性值包含使用以下参数使用第10版gap获得的值:使用gap权重50和长度权重3以及nwsgapdna.cmp评分矩阵的核苷酸序列的同一性%和类似性%;使用gap权重8和长度权重2以及blosum62评分矩阵的氨基酸序列的同一性%和类似性%;或其任何等效程序。“等效程序”包含当与第10版gap生成的对应比对进行比较时针对所讨论的任何两个序列产生具有相同核苷酸或氨基酸残基匹配和相同百分比序列同一性的比对的任何序列比较程序。
[0063]
术语“保守性氨基酸取代”是指用具有类似大小、电荷或极性的不同氨基酸取代序列中正常存在的氨基酸。保守性取代的实例包含用非极性(疏水性)残基如异亮氨酸、缬氨酸或亮氨酸取代另一种非极性残基。同样,保守性取代的实例包含用一种极性(亲水性)残基取代另一种极性残基,如精氨酸与赖氨酸之间的极性残基、谷氨酰胺与天冬酰胺之间的极性残基或甘氨酸与丝氨酸之间的极性残基。另外,用碱性残基如赖氨酸、精氨酸或组氨酸取代另一种碱性残基或者用一种酸性残基如天冬氨酸或谷氨酸取代另一种酸性残基是保守性取代的另外的实例。非保守性取代的实例包含用非极性(疏水性)氨基酸残基如异亮氨酸、缬氨酸、亮氨酸、丙氨酸或甲硫氨酸取代极性(亲水性)残基如半胱氨酸、谷氨酰胺、谷氨酸或赖氨酸和/或用极性残基取代非极性残基。典型的氨基酸分类总结如下表1。
[0064]
表1:氨基酸分类.
[0065][0066]“同源”序列(例如,核酸序列)包含与已知参考序列相同或基本上类似的序列,使得其例如与已知参考序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性。同源序列可以包含例如直系同源序列和旁系同源序列。例如,同源基因通常通过物种形成事件(直系同源基因)或基因复制事件(旁系同源基因)从共同祖先dna序列遗传下来。“直系同源”基因包含不同物种中通过物种形成从共同祖先基因进化而来的基因。直系同源物通常在进化过程中保留相同的功能。“旁系同源”基因包含通过基因组内的复制相关的基因。旁系同源物可以在进化过程中进化出新的功能。
[0067]
术语“体外(in vitro)”包含人工环境以及在人工环境(例如,试管)内发生的过程或反应。术语“体内(in vivo)”包含自然环境(例如,细胞、生物体或身体)以及在自然环境内发生的过程或反应。术语“离体(ex vivo)”包含已从个体身体去除的细胞以及在此类细胞内发生的过程或反应。
[0068]
响应于双链断裂(dsb)的修复主要通过以下两个保守的dna修复途径发生:同源重组(hr)和非同源末端连接(nhej)。参见kasparek和humphrey(2011)《细胞与发育生物学(cell&dev.biol.)》22:886
‑
897,所述文献出于所有目的整体并入本文。同样,由外源供体核酸介导的靶核酸的修复可以包含两个多核苷酸之间基因信息交换的任何过程。
[0069]
术语“重组”包含所述两个多核苷酸之间基因信息交换的任何过程,并且可以通过任何机制发生。重组可以通过同源定向修复(hdr)或同源重组(hr)发生。hdr或hr包含一种可能需要核苷酸序列同源性的核酸修复形式,使用“供体”分子作为模板来修复“靶”分子(即,经历双链断裂的分子),并引导将基因信息从供体转移到靶标。不希望受任何特定理论的束缚,这种转移可以涉及在断裂的靶标与供体之间形成的异源双链dna的失配校正和/或“合成依赖性链退火(synthesis
‑
dependent strand annealing)”,其中供体用于重新合成将成为靶标的一部分的基因信息和/或相关过程。在一些情况下,供体多核苷酸、供体多核
苷酸的一部分、供体多核苷酸的拷贝或者供体多核苷酸的拷贝的一部分整合到靶dna中。参见wang等人,(2013)《细胞(cell)》153:910
‑
918;mandalos等人,(2012)《公共科学图书馆综合(plos one)》7:e45768:1
‑
9;和wang等人,(2013)《自然生物技术(nat biotechnol.)》31:530
‑
532,所述文献中的每个文献出于所有目的整体并入本文。
[0070]“包括”或“包含”一个或多个所列举的元件的组合物或方法可以包含其它未具体列举的元件。例如,“包括”或“包含”蛋白质的组合物可以单独含有蛋白质或与其它成分组合的蛋白质。过渡短语“基本上由
……
组成”意味着权利要求的范围应被解释为涵盖权利要求中所列举的指定的元件以及对所要求保护的本发明的基本和新颖特性没有实质性影响的元件。因此,当在本发明的权利要求中使用时,术语“基本上由
……
组成”不应被解释为等同于“包括”。
[0071]“任选的”或“任选地”意味着随后描述的事件或情况可能会或可能不会发生,并且所述描述包含事件发生的实例和事件未发生的实例。
[0072]
数值范围的指定包含所述范围内或定义所述范围的所有整数以及由所述范围内的整数定义的所有子范围。
[0073]
除非从上下文中明显看出,否则术语“约”涵盖规定值的标准测量误差范围(例如,sem)内的值。
[0074]
术语“和/或”是指并且涵盖相关联的所列项中的一个或多个所列项的任何和所有可能组合以及在以替代性方案(“或”)解释时组合的缺少。
[0075]
术语“或”是指特定列表中的任何一个成员,并且也包含所述列表中成员的任何组合。
[0076]
除非上下文另外明确指明,否则本文中的单数形式“一个/一种(a/an)”和“所述(the)”包含复数个提及物。例如,术语“一种蛋白质”或“至少一种蛋白质”可以包含多种蛋白质,包含其混合物。
[0077]
统计学上显著意指p≤0.05。
具体实施方式
[0078]
i.概述
[0079]
本文提供了用于在预先存在的靶向性载体中引入无瘢痕靶向基因修饰的方法。所述方法可以使用细菌同源重组(bhr)和体外组装方法(分子内或分子间)的组合,以无瘢痕方式将此类靶向基因修饰引入到靶向性载体中。术语无瘢痕是指通过反应没有将变化或不期望的序列引入到组装的dna中的事实。组合的序列将对应于期望的确切序列,其中通过bhr或体外组装程序没有引入变化或人工制品。
[0080]
用于确定基因功能的最有效方法之一涉及在小鼠胚胎干(es)细胞(或其它非人动物es细胞)中故意地工程化基因突变,并且然后生成具有对应的基因变化的小鼠(或其它非人动物)。两个限制性步骤是基因靶向性载体的生成和随后稀有es细胞克隆的选择,其中靶向性载体已正确改变基因。为了在es细胞中产生期望的基因改变,必须首先将改变引入到靶向性载体中,所述靶向性载体随后用于通过同源重组置换es细胞中的天然基因。
[0081]
在创建转基因动物系时,无瘢痕dna构建尤其重要,因为由限制位点或其它操纵产生的瘢痕如果落在对调控很重要的区域,可能对基因表达产生负面影响。靶向哺乳动物基
因组通常需要构建具有长dna臂的大靶向性载体以指导同源重组,以及用于选择胚胎干细胞克隆的抗生素抗性盒。正确靶向的克隆体通常含有构建载体所需的多个瘢痕,以及抗性盒本身。即使用自缺失盒技术,通常也无法避免在经修饰的基因座中留下外源序列“瘢痕”。参见例如图4a
‑
4b。此类瘢痕可能影响靶向基因座的可靠表达,或者甚至影响相邻基因的表达。随着动物模型变得越来越复杂,可以在现有模型之上添加更多修饰,如在人源化等位基因上添加人致病突变。另外的变化然后可以向已经高度工程化的小鼠基因座添加甚至更多的瘢痕和另一个选择盒,从而增加表达被改变的可能性,并且小鼠模型将不可靠。另外,即使两个盒对不同的选择进行编码,由于共享盒元件如启动子和poly(a)信号之间的不期望的重组,将新盒添加到已经含有一个盒的载体可能会变得复杂。然而,此类选择盒很重要,因此不必浪费时间和资源来筛选数千个es细胞克隆以获得期望的修饰。
[0082]
可替代地,使用初始靶向性载体来产生和筛选包括来自初始靶向性载体的修饰的经修饰的es细胞,并且然后用第二靶向性载体(例如,ssodn)重新靶向那些细胞以对已靶向基因座进行第二修饰是耗时的,并且重新靶向(例如,用ssodn)可能导致不期望的修饰,如不期望的插入、不期望的缺失、不期望的点突变或与基因组其它地方的转基因插入偶联的无靶向。
[0083]
本文所公开的方法提供了用于在制备靶向性载体的阶段对预先存在的靶向性载体进行修饰的高效且无瘢痕的方法,而不是必须产生和筛选包括初始预先存在的靶向性载体的es细胞,并且然后重新靶向那些细胞以对已靶向基因座进行第二修饰。
[0084]
ii.通过细菌同源重组和分子内体外组装在靶向性载体中无瘢痕引入靶向修饰
[0085]
本文所公开的用于在预先存在的靶向性载体中无瘢痕引入靶向基因修饰的一些方法利用用于分子内组装的体外组装方法。作为一个实例,此类方法可以包括在细菌细胞群中进行所述预先存在的靶向性载体与修饰盒之间的细菌同源重组。所述修饰盒可以包括插入核酸,所述插入核酸侧接有与所述预先存在的靶向性载体中的5'靶序列相对应的5'同源臂和与所述预先存在的载体中的3'靶序列相对应的3'同源臂。所述插入核酸可以包括选择盒,所述选择盒侧接有针对一种或多种核酸酶试剂(例如,稀有切割核酸酶试剂)的靶位点和重复序列。例如,所述插入核酸从5'到3'可以包括:(1)第一重复序列;(2)用于第一核酸酶试剂的第一靶位点;(3)选择盒;(4)用于第二核酸酶试剂的第二靶位点;以及(5)第二重复序列。
[0086]
所述预先存在的靶向性载体可以是任何大小的任何类型的靶向性载体。在具体实例中,所述预先存在的靶向性载体是长度为至少约10kb的大靶向性载体(ltvec)。在另一实例中,所述修饰盒的长度为至少约100kb。靶向性载体和大靶向性载体在本文其它地方更详细地讨论。
[0087]
所述修饰盒可以为线性核酸或环状核酸,其可以为单链核酸或双链核酸,并且可以包括脱氧核糖核酸(dna)或核糖核酸(rna)。在一个具体实例中,所述修饰盒是线性双链dna。
[0088]
所述修饰盒中的所述同源臂在本文中被称为5'和3'(即,上游和下游)同源臂。此术语涉及修饰盒内的同源臂与核酸插入的相对位置。5'和3'同源臂对应于要修饰的预先存在的靶向性载体内的区域,在本文中分别被称为“5'靶序列”和“3'靶序列”。
[0089]
当两个区域彼此共享足够水平的序列同一性以充当同源重组反应的底物(例如,
细菌同源重组)时,同源臂和靶序列彼此“对应”或“相对应”。术语“同源性”包含与对应的序列相同或共享序列同一性的dna序列。给定靶序列与在外源修复模板中发现的对应的同源臂之间的序列同一性可以是允许同源重组发生的任何程度的序列同一性。例如,外源修复模板(或其片段)的同源臂与靶序列(或其片段)共享的序列同一性的量可以是至少50%、55%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,使得序列经历同源重组。此外,同源臂与对应的靶序列之间的对应的同源区可以是足以促进同源重组的任何长度。例如,同源臂可以是适于细菌同源重组的任何大小。例如,同源臂可以是至少约35个核苷酸、至少约40个核苷酸、至少约50个核苷酸、至少约60个核苷酸、至少约70个核苷酸、至少约80个核苷酸、至少约90个核苷酸、至少约100个核苷酸。例如,同源臂可以介于约35个核苷酸与500个核苷酸之间,介于约75个核苷酸与约500个核苷酸之间,或介于约50个核苷酸与约200个核苷酸之间(例如,约100个核苷酸)。作为另一个实例,同源臂的长度可以介于约35个核苷酸到约2.5kb之间,长度介于约35个核苷酸到约1.5kb之间,或长度介于约35个到约500个核苷酸之间。例如,给定的同源臂(或同源臂中的每个同源臂)和/或对应的靶序列包括的对应的同源区的长度可以介于约35个到约40个、约40个到约50个、约50个到约60个、约60个到约70个、约70个到约80个、约80个到约90个、约90个到约100个、约100个到约150个、约150个到约200个、约200个到约250个、约250个到约300个、约300个到约350个、约350个到约400个、约400个到约450个或约450个到约500个核苷酸之间,使得同源臂具有足够的同源性以与靶核酸内的对应的靶序列经历同源重组。可替代地,给定的同源臂(或同源臂中的每个同源臂)和/或对应的靶序列包括的对应的同源区的长度可以介于约0.5kb到约1kb之间、约1kb到约1.5kb之间、约1.5kb到约2kb之间或约2kb到约2.5kb之间。例如,同源臂的长度可以是各自约100个核苷酸。同源臂可以是对称的(每个长度的大小大约相同),或者可以是不对称的(一个比另一个长)。
[0090]
修饰盒可以具有任何长度。例如,修饰盒可以为约10kb到约400kb、约20kb到约400kb、约20kb到约30kb、约30kb到约40kb、约40kb到约50kb、约50kb到约75kb、约75kb到约100kb、约100kb到125kb、约125kb到约150kb、约150kb到约175kb、约175kb到约200kb、约200kb到约225kb、约225kb到约250kb、约250kb到约275kb或约275kb到约300kb、约200kb到约300kb、约300kb到约350kb或约350kb到约400kb。在一个实例中,修饰盒的长度可以为至少约100kb或100kb。修饰盒也可以为约50kb到约500kb、约100kb到约125kb、约300kb到约325kb、约325kb到约350kb、约350kb到约375kb、约375kb到约400kb、约400kb到约425kb、约425kb到约450kb、约450kb到约475kb或约475kb到约500kb。可替代地,修饰盒可以是至少10kb、至少15kb、至少20kb、至少30kb、至少40kb、至少50kb、至少60kb、至少70kb、至少80kb、至少90kb、至少100kb、至少150kb、至少200kb、至少250kb、至少300kb、至少350kb、至少400kb、至少450kb或至少500kb或更大。在一个实例中,修饰盒的长度介于约1kb与约15kb之间或长度介于约1kb与约10kb之间(例如,约1.2kb、约5kb、约8kb或约15kb)。
[0091]
修饰盒可以包括靶向基因修饰。例如,靶向基因修饰可以在5'同源臂或3'同源臂(例如,不会对同源臂与靶序列重组的能力产生负面影响的小的修饰,如点突变或小的缺失、插入或置换)。可替代地,靶向基因修饰可以在插入核酸中(例如,当靶向基因修饰是插入或置换时)。如果唯一的靶向基因修饰是缺失,则5'同源臂和3'同源臂可以被设计成分别
靶向5'和3'靶序列,所述靶序列侧接预先存在的靶向性载体中的靶向缺失的序列。作为一个实例,靶向基因修饰可以在插入核酸的第一重复序列和/或第二重复序列中。可能的靶向基因修饰的类型在本文其它地方更详细地公开。一些实例包含点突变、缺失、插入、置换或其组合。
[0092]
修饰盒中的第一重复序列和第二重复序列彼此可以相同。重复序列可以与预先存在的靶向性载体中的序列相同。可替代地,在靶向基因修饰包括插入(例如,单独的插入或插入与缺失(即,置换)组合)的情况下,重复序列可以与插入的5'端或3'端相同。
[0093]
重复序列可以是任何合适的大小,以用于体外组装反应中第一重复序列与第二重复序列之间的随后组装。作为一个实例,重复序列可以包括至少约20个核苷酸、至少约30个核苷酸、至少约40个核苷酸或至少约50个核苷酸。作为另一个实例,重复序列的长度可以介于约20个核苷酸与约100个核苷酸之间、介于约20个核苷酸与约90个核苷酸之间、介于约0个核苷酸与约80个核苷酸之间、介于约20个核苷酸与约70个核苷酸之间、介于约20个核苷酸与约60个核苷酸之间、介于约20个核苷酸与约50个核苷酸之间、介于约20个核苷酸与约40个核苷酸之间、介于约30个核苷酸与约60个核苷酸之间或介于约40个核苷酸与约50个核苷酸之间。在具体实例中,重复序列的长度可以介于约40个核苷酸与约50个核苷酸之间(例如,约40个核苷酸或约50个核苷酸)。
[0094]
在细菌同源重组之后,可以选择包括包含选择盒(并且包括靶向基因修饰)的经修饰靶向性载体的细菌细胞。选择盒和选择方法的实例在本文其它地方更详细地公开。在具体实例中,选择盒赋予对抗生素的抗性。例如,所述选择盒可以赋予对以下中的任一个的抗性:氨苄青霉素、氯霉素、四环素、卡那霉素、大观霉素、链霉素、羧苄青霉素、博来霉素、红霉素或多粘菌素b。在一些方法中,预先存在的靶向性载体还包括第二选择盒。例如,第二选择盒也可以赋予抗生素抗性。修饰盒中的选择盒和预先存在的靶向性载体中的第二选择盒可以各自赋予对不同抗生素的抗性。例如,修饰盒中的选择盒可以赋予对第一抗生素的抗性,并且预先存在的靶向性载体中的第二选择盒可以赋予对第二不同抗生素的抗性。在一些方法中,第二选择盒可以允许在细菌细胞和真核或哺乳动物细胞两者中进行选择。
[0095]
在选择之后,可以用第一核酸酶试剂切割经修饰靶向性载体中的第一靶位点并用第二核酸酶试剂切割经修饰靶向性载体中的第二靶位点以去除选择盒并暴露经修饰靶向性载体中的第一重复序列和第二重复序列。例如,此步骤可以在体外进行。作为实例,可以在细菌同源重组和选择之后从细菌细胞中分离dna,在这之后,可以在体外用第一核酸酶试剂切割经修饰靶向性载体中的第一靶位点并在体外用第二核酸酶试剂切割经修饰靶向性载体中的第二靶位点以去除选择盒并经修饰靶向性载体中的暴露第一重复序列和第二重复序列。
[0096]
第一核酸酶试剂和/或第二核酸酶试剂可以是如本文其它地方所描述的稀有切割核酸酶试剂。例如,在一些方法中,预先存在的靶向性载体中存在第一靶位点和/或第二靶位点。第一靶位点与第二靶位点可以不同或者第一靶位点可以与第二靶位点相同,并且第一核酸酶试剂可以与第二核酸酶试剂相同。第一核酸酶试剂和/或第二核酸酶试剂可以产生平端、5'突出端或3'突出端。在一个实例中,第一核酸酶试剂和/或第二核酸酶试剂产生3'突出端。
[0097]
在一个具体实例中,第一核酸酶试剂和/或第二核酸酶试剂是限制酶或稀有切割
限制酶。稀有切割限制酶的实例在本文其它地方公开,但可以包含例如noti、xmaiii、sstii、sall、nrui、nhei、nb.bbvci、bbvci、asci、asisi、fsei、paci、pmei、sbfi、sgrai、swai、bspqi、sapi、sfii、cspci、absi、ccini、fspai、maubi、mrei、mssi、palai、rgai、rigi、sdai、sfaai、sgfi、sgrdi、sgsi、smii、srfi、sse2321、sse83871、lgui、pcisi、aari、ajui、aloi、bari、ppii和psri。
[0098]
在另一具体实例中,第一核酸酶试剂和/或第二核酸酶试剂可以是工程化核酸酶试剂。例如,核酸酶试剂可以是成簇的规律间隔的短回文重复序列(crispr)相关(cas)蛋白和向导rna(grna)(例如,cas9和包括crispr rna(crrna)和反式激活crispr rna(tracrrna)的grna)、锌指核酸酶(zfn)、转录激活子样效应子核酸酶(talen)或经工程化的大范围核酸酶。
[0099]
在切割/消化之后,可以在分子内体外组装反应中将所暴露的第一重复序列与所暴露的第二重复序列组装以产生包括无瘢痕靶向基因修饰的靶向性载体。例如,在一些此类方法中,包括无瘢痕靶向基因修饰的靶向性载体中既不存在用于第一核酸酶试剂的第一靶位点,也不存在用于第二核酸酶试剂的第二靶位点(即,在体外组装之后)。同样,在一些这样的方法中,仅包括无瘢痕靶向基因修饰的靶向性载体中存在重复序列的单个拷贝(即,在体外组装之后)。
[0100]
可以使用任何合适的体外组装方法。在一个具体实例中,体外组装步骤可以包括将经修饰靶向性载体与核酸外切酶、dna聚合酶和dna连接酶一起温育。例如,体外组装方法可以包括:使经修饰靶向性载体与核酸外切酶接触以暴露第一重复序列与第二重复序列之间的互补序列;对所暴露的互补序列进行退火;延长所退火的互补序列的3'端;以及连接所退火的互补序列。体外组装方法的实例在本文其它地方更详细地讨论。
[0101]
在一些方法中,为了减少背景,可以用第一核酸酶试剂和/或第二核酸酶试剂处理通过体外组装产生的载体以减少背景(例如,通过切割未成功组装并且因此仍含有用于第一核酸酶试剂或第二核酸酶试剂的靶位点的任何靶向性载体)。此类步骤可以帮助验证即不存在用于第一核酸酶试剂的第一靶位点,也不存在用于第二核酸酶试剂的第二靶位点。
[0102]
iii.通过细菌同源重组和分子间体外组装在靶向性载体中无瘢痕引入靶向修饰
[0103]
本文所公开的用于在预先存在的靶向性载体中无瘢痕引入靶向基因修饰的其它方法利用用于分子间组装的体外组装方法。作为一个实例,此类方法可以包括在细菌细胞群中进行所述预先存在的靶向性载体与缺失盒之间的细菌同源重组。所述缺失盒可以包括插入核酸,所述插入核酸侧接有与所述预先存在的靶向性载体中的5'靶序列相对应的5'同源臂和与所述预先存在的载体中的3'靶序列相对应的3'同源臂。所述5'靶序列和所述3'靶序列侧接所述预先存在的靶向性载体的要引入所述靶向基因修饰的区域。所述插入核酸可以包括选择盒,所述选择盒侧接有针对一种或多种核酸酶试剂(例如,稀有切割核酸酶试剂)的靶位点。例如,所述插入核酸从5'到3'可以包括:(1)用于第一核酸酶试剂的第一靶位点;(2)选择盒;以及(3)用于第二核酸酶试剂的第二靶位点。
[0104]
所述预先存在的靶向性载体可以是任何大小的任何类型的靶向性载体。在具体实例中,所述预先存在的靶向性载体是长度为至少约10kb的大靶向性载体(ltvec)。在另一实例中,所述修饰盒的长度为至少约100kb。靶向性载体在本文其它地方更详细地讨论。
[0105]
所述缺失盒可以为线性核酸或环状核酸,其可以为单链核酸或双链核酸,并且可
以包括脱氧核糖核酸(dna)或核糖核酸(rna)。在一个具体实例中,所述修饰盒是线性双链dna。
[0106]
所述缺失盒中的所述同源臂在本文中被称为5'和3'(即,上游和下游)同源臂。此术语涉及缺失盒内的同源臂与核酸插入的相对位置。5'和3'同源臂对应于要修饰的预先存在的靶向性载体内的区域,在本文中分别被称为“5'靶序列”和“3'靶序列”。
[0107]
当两个区域彼此共享足够水平的序列同一性以充当同源重组反应的底物(例如,细菌同源重组)时,同源臂和靶序列彼此“对应”或“相对应”。术语“同源性”包含与对应的序列相同或共享序列同一性的dna序列。给定靶序列与在外源修复模板中发现的对应的同源臂之间的序列同一性可以是允许同源重组发生的任何程度的序列同一性。例如,外源修复模板(或其片段)的同源臂与靶序列(或其片段)共享的序列同一性的量可以是至少50%、55%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,使得序列经历同源重组。此外,同源臂与对应的靶序列之间的对应的同源区可以是足以促进同源重组的任何长度。例如,同源臂可以是适于细菌同源重组的任何大小。例如,同源臂可以是至少约35个核苷酸、至少约40个核苷酸、至少约50个核苷酸、至少约60个核苷酸、至少约70个核苷酸、至少约80个核苷酸、至少约90个核苷酸、至少约100个核苷酸。例如,同源臂可以介于约35个核苷酸与500个核苷酸之间,介于约75个核苷酸与约500个核苷酸之间,或介于约50个核苷酸与约200个核苷酸之间(例如,约100个核苷酸)。作为另一个实例,同源臂的长度可以介于约35个核苷酸到约2.5kb之间,长度介于约35个核苷酸到约1.5kb之间,或长度介于约35个到约500个核苷酸之间。例如,给定的同源臂(或同源臂中的每个同源臂)和/或对应的靶序列包括的对应的同源区的长度可以介于约35个到约40个、约40个到约50个、约50个到约60个、约60个到约70个、约70个到约80个、约80个到约90个、约90个到约100个、约100个到约150个、约150个到约200个、约200个到约250个、约250个到约300个、约300个到约350个、约350个到约400个、约400个到约450个或约450个到约500个核苷酸之间,使得同源臂具有足够的同源性以与靶核酸内的对应的靶序列经历同源重组。可替代地,给定的同源臂(或同源臂中的每个同源臂)和/或对应的靶序列包括的对应的同源区的长度可以介于约0.5kb到约1kb之间、约1kb到约1.5kb之间、约1.5kb到约2kb之间或约2kb到约2.5kb之间。例如,同源臂的长度可以是各自约100个核苷酸。同源臂可以是对称的(每个长度的大小大约相同),或者可以是不对称的(一个比另一个长)。
[0108]
缺失盒可以具有任何长度。例如,缺失盒可以为约10kb到约400kb、约20kb到约400kb、约20kb到约30kb、约30kb到约40kb、约40kb到约50kb、约50kb到约75kb、约75kb到约100kb、约100kb到125kb、约125kb到约150kb、约150kb到约175kb、约175kb到约200kb、约200kb到约225kb、约225kb到约250kb、约250kb到约275kb或约275kb到约300kb、约200kb到约300kb、约300kb到约350kb或约350kb到约400kb。在一个实例中,缺失盒的长度可以为至少约100kb或100kb。缺失盒也可以为约50kb到约500kb、约100kb到约125kb、约300kb到约325kb、约325kb到约350kb、约350kb到约375kb、约375kb到约400kb、约400kb到约425kb、约425kb到约450kb、约450kb到约475kb或约475kb到约500kb。可替代地,缺失盒可以是至少10kb、至少15kb、至少20kb、至少30kb、至少40kb、至少50kb、至少60kb、至少70kb、至少80kb、至少90kb、至少100kb、至少150kb、至少200kb、至少250kb、至少300kb、至少350kb、至少
400kb、至少450kb或至少500kb或更大。在一个实例中,缺失盒的长度介于约1kb与约15kb之间或长度介于约1kb与约10kb之间(例如,约1.2kb、约5kb、约8kb或约15kb)。
[0109]
在细菌同源重组之后,可以选择包括包含选择盒的经修饰靶向性载体的细菌细胞。选择盒和选择方法的实例在本文其它地方更详细地公开。在具体实例中,选择盒赋予对抗生素的抗性。例如,所述选择盒可以赋予对以下中的任一个的抗性:氨苄青霉素、氯霉素、四环素、卡那霉素、大观霉素、链霉素、羧苄青霉素、博来霉素、红霉素或多粘菌素b。在一些方法中,预先存在的靶向性载体还包括第二选择盒。例如,第二选择盒也可以赋予抗生素抗性。缺失盒中的选择盒和预先存在的靶向性载体中的第二选择盒可以各自赋予对不同抗生素的抗性。例如,缺失盒中的选择盒可以赋予对第一抗生素的抗性,并且预先存在的靶向性载体中的第二选择盒可以赋予对第二不同抗生素的抗性。在一些方法中,第二选择盒可以允许在细菌细胞和真核或哺乳动物细胞两者中进行选择。
[0110]
在选择之后,可以用第一核酸酶试剂切割经修饰靶向性载体中的第一靶位点并用第二核酸酶试剂切割经修饰靶向性载体中的第二靶位点以去除选择盒并暴露经修饰靶向性载体中的上游末端序列和下游末端序列。例如,此步骤可以在体外进行。作为实例,可以在细菌同源重组和选择之后从细菌细胞中分离dna,在这之后,可以在体外用第一核酸酶试剂切割经修饰靶向性载体中的第一靶位点并在体外用第二核酸酶试剂切割经修饰靶向性载体中的第二靶位点以去除选择盒并暴露经修饰靶向性载体中的上游末端序列和下游末端序列。
[0111]
第一核酸酶试剂和/或第二核酸酶试剂可以是如本文其它地方所描述的稀有切割核酸酶试剂。例如,在一些方法中,预先存在的靶向性载体中存在第一靶位点和/或第二靶位点。第一靶位点与第二靶位点可以不同或者第一靶位点可以与第二靶位点相同,并且第一核酸酶试剂可以与第二核酸酶试剂相同。第一核酸酶试剂和/或第二核酸酶试剂可以产生平端、5'突出端或3'突出端。在一个实例中,第一核酸酶试剂和/或第二核酸酶试剂产生3'突出端。
[0112]
在一个具体实例中,第一核酸酶试剂和/或第二核酸酶试剂是限制酶或稀有切割限制酶。稀有切割限制酶的实例在本文其它地方公开,但可以包含例如noti、xmaiii、sstii、sall、nrui、nhei、nb.bbvci、bbvci、asci、asisi、fsei、paci、pmei、sbfi、sgrai、swai、bspqi、sapi、sfii、cspci、absi、ccini、fspai、maubi、mrei、mssi、palai、rgai、rigi、sdai、sfaai、sgfi、sgrdi、sgsi、smii、srfi、sse2321、sse83871、lgui、pcisi、aari、ajui、aloi、bari、ppii和psri。
[0113]
在另一具体实例中,第一核酸酶试剂和/或第二核酸酶试剂可以是工程化核酸酶试剂。例如,核酸酶试剂可以是成簇的规律间隔的短回文重复序列(crispr)相关(cas)蛋白和向导rna(grna)(例如,cas9和包括crispr rna(crrna)和反式激活crispr rna(tracrrna)的grna)、锌指核酸酶(zfn)、转录激活子样效应子核酸酶(talen)或经工程化的大范围核酸酶。
[0114]
在切割/消化之后,可以在体外分子间组装反应中将经切割靶向性载体与包括靶向基因修饰的修饰盒组装以产生包括所述无瘢痕靶向基因修饰的所述靶向性载体,所述靶向基因修饰侧接有与经修饰靶向性载体中的上游末端序列重叠的上游末端序列和与经修饰靶向性载体中的下游末端序列重叠的下游末端序列。例如,在一些此类方法中,包括无瘢
痕靶向基因修饰的靶向性载体中既不存在用于第一核酸酶试剂的第一靶位点,也不存在用于第二核酸酶试剂的第二靶位点。
[0115]
可以使用任何合适的体外组装方法。在一个具体实例中,体外组装步骤可以包括将经切割靶向性载体和修饰盒与核酸外切酶、dna聚合酶和dna连接酶一起温育。例如,体外组装方法可以包括:使经切割靶向性载体和修饰盒与核酸外切酶接触,以暴露经修饰靶向性载体中的末端序列与修饰盒中的末端序列之间的互补序列;对所暴露的互补序列进行退火;延长退火的互补序列的3'端;以及连接所退火的互补序列。
[0116]
所述修饰盒可以为线性核酸或环状核酸,其可以为单链核酸或双链核酸,并且可以包括脱氧核糖核酸(dna)或核糖核酸(rna)。在一个具体实例中,所述修饰盒是线性双链dna。
[0117]
修饰盒可以具有任何长度。例如,修饰盒可以为约10kb到约400kb、约20kb到约400kb、约20kb到约30kb、约30kb到约40kb、约40kb到约50kb、约50kb到约75kb、约75kb到约100kb、约100kb到125kb、约125kb到约150kb、约150kb到约175kb、约175kb到约200kb、约200kb到约225kb、约225kb到约250kb、约250kb到约275kb或约275kb到约300kb、约200kb到约300kb、约300kb到约350kb或约350kb到约400kb。在一个实例中,修饰盒的长度可以为至少约100kb或100kb。修饰盒也可以为约50kb到约500kb、约100kb到约125kb、约300kb到约325kb、约325kb到约350kb、约350kb到约375kb、约375kb到约400kb、约400kb到约425kb、约425kb到约450kb、约450kb到约475kb或约475kb到约500kb。可替代地,修饰盒可以是至少10kb、至少15kb、至少20kb、至少30kb、至少40kb、至少50kb、至少60kb、至少70kb、至少80kb、至少90kb、至少100kb、至少150kb、至少200kb、至少250kb、至少300kb、至少350kb、至少400kb、至少450kb或至少500kb或更大。在一个具体实例中,修饰盒的长度介于约400bp与约2kb之间。在另一个实例中,修饰盒的长度介于约1kb与约15kb之间或长度介于约1kb与约10kb之间(例如,约1.2kb、约5kb、约8kb或约15kb)。在一个具体实例中,修饰盒的长度为至少约200个核苷酸。在另一个具体实例中,修饰盒为无法直接合成或通过聚合酶链式反应产生的大小。例如,修饰盒的长度可以为至少约5kb、至少约10kb、至少约15kb、至少约20kb、至少约25kb或至少约30kb。
[0118]
对于体外组装反应,修饰盒中的上游末端序列与经修饰靶向性载体中的上游末端序列之间的重叠长度和/或修饰盒中的下游末端序列与经修饰靶向性载体中的下游末端序列之间的重叠长度可以为任何合适的长度。作为一个实例,重叠长度可以包括至少约20个核苷酸、至少约30个核苷酸、至少约40个核苷酸或至少约50个核苷酸。作为另一个实例,重叠长度可以介于约20个核苷酸与约100个核苷酸之间、介于约20个核苷酸与约90个核苷酸之间、介于约0个核苷酸与约80个核苷酸之间、介于约20个核苷酸与约70个核苷酸之间、介于约20个核苷酸与约60个核苷酸之间、介于约20个核苷酸与约50个核苷酸之间、介于约20个核苷酸与约40个核苷酸之间、介于约30个核苷酸与约60个核苷酸之间或介于约40个核苷酸与约50个核苷酸之间。在具体实例中,重叠长度可以介于约40个核苷酸与约50个核苷酸之间(例如,约40个核苷酸或约50个核苷酸)。
[0119]
修饰盒可以包括靶向基因修饰。靶向基因修饰的类型在本文其它地方更详细地公开。一些实例包含点突变、缺失、插入、置换或其组合。
[0120]
在一些方法中,为了减少背景,可以用第一核酸酶试剂和/或第二核酸酶试剂处理
通过体外组装产生的载体以减少背景(例如,通过切割任何未成功组装并因此仍含有用于第一核酸酶试剂或第二核酸酶试剂的靶位点的靶向性载体)。此类步骤可以帮助验证即不存在用于第一核酸酶试剂的第一靶位点,也不存在用于第二核酸酶试剂的第二靶位点。
[0121]
iv.细菌同源重组
[0122]
任何合适的细菌同源重组(bhr)方法均可以用于本文所公开的方法中。细菌同源重组涉及在如大肠杆菌等细菌细胞中介导同源重组的基因的瞬时和受控表达,由此允许细菌介导修饰盒与共享短同源段的靶向性载体(例如,大靶向性载体)之间的重组。参见例如us2004/0018626和valenzuela等人,(2003)《自然生物技术》21(6):652
‑
659,所述文献中的每个文献整体并入本文。
[0123]
短同源段可以包括上游同源区和下游同源区。同源区可以是适于细菌同源重组的任何大小。例如,同源区可以是适于细菌同源重组的任何大小。例如,同源区可以是至少约35个核苷酸、至少约40个核苷酸、至少约50个核苷酸、至少约60个核苷酸、至少约70个核苷酸、至少约80个核苷酸、至少约90个核苷酸、至少约100个核苷酸。例如,同源区可以介于约35个核苷酸与500个核苷酸之间,介于约75个核苷酸与约500个核苷酸之间,或介于约50个核苷酸与约200个核苷酸之间(例如,约100个核苷酸)。作为另一个实例,同源区的长度可以介于约35个核苷酸到约2.5kb之间,长度介于约35个核苷酸到约1.5kb之间,或长度介于约35个到约500个核苷酸之间。例如,同源区的长度可以介于约35个到约40个、约40个到约50个、约50个到约60个、约60个到约70个、约70个到约80个、约80个到约90个、约90个到约100个、约100个到约150个、约150个到约200个、约200个到约250个、约250个到约300个、约300个到约350个、约350个到约400个、约400个到约450个或约450个到约500个核苷酸之间。可替代地,给定的同源区的长度可以介于约0.5kb到约1kb之间、约1kb到约1.5kb之间、约1.5kb到约2kb之间或约2kb到约2.5kb之间。例如,同源区的长度可以是约100个核苷酸。
[0124]
使用细菌同源重组修饰靶向性载体的技术可以在多种系统中进行(参见例如yang等人,(1997)《自然生物技术》15:859
‑
65;muyrers等人,(1999)《核酸研究》27:1555
‑
1557;angrand等人,(1999)《核酸研究》,27:e16;narayanan等人,(1999)《基因疗法(gene ther.)》,6:442
‑
447;以及yu等人,(2000)《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)》97:5978
‑
5983,所述文献中的每个文献出于所有目的整体并入本文)。一个实例是et克隆(zhang等人,(1998)《自然遗传学(nat.genet.)》20:123
‑
128和narayanan等人,(1999)《基因疗法》,6:442
‑
447,所述文献中的每个文献出于所有目的整体并入本文)以及此技术的变体(yu等人,(2000)《美国国家科学院院刊》97:5978
‑
5983,所述文献出于所有目的整体并入本文)。et是指进行同源重组反应的rece和rect蛋白。rece是从5'到3'修剪一条线性双链dna链核酸外切酶,从而留下带有3'单链突出端的线性双链片段。这种单链突出端被rect蛋白包被,所述蛋白具有单链dna(ssdna)结合活性。et克隆使用大肠杆菌进行,所述大肠杆菌瞬时表达rece和rect的大肠杆菌基因产物以及噬菌体λ(λ)蛋白λgam。λgam蛋白是保护供体dna片段免于被recbc核酸外切酶系统降解所必需的,并且是在recbc
宿主如常用的大肠杆菌菌株dh10b中进行高效et克隆所必需的。
[0125]
v.体外组装
[0126]
可以用于在有效连接dna分子以形成基本上完整的dna分子的条件下组装至少两个核酸或单个核酸的至少两个末端的任何体外组装方法可以用于本文所描述的方法中。体
外组装方法的一些非限制性实例包含使用限制酶的标准组装、融合组装、序列和连接酶独立克隆(slic)、gibson组装和金门组装。参见例如lee等人,(2013)《分子细胞(mol.cells)》35:359
‑
370,所述文献出于所有目的整体并入本文。
[0127]
合适的体外组装方法的一个实例是用于通过核酸外切酶(例如,5'核酸外切酶)、dna聚合酶和dna连接酶的协同作用组装重叠的dna分子的等温单反应方法。具有重叠末端的核酸(或具有重叠末端的单个线性核酸)可以与连接酶、核酸外切酶和dna聚合酶组合。例如,共享末端序列重叠的两个相邻dna片段可以在一步等温反应中连接成共价密封的分子。在具体的实例中,两个或更多个要组装的dna分子可以在单个容器中与以下在体外接触:(a)缺乏3'核酸外切酶活性的分离的非热稳定性5'到3'核酸外切酶(例如,非进行性核酸外切酶,其咀嚼双链dna分子的末端以暴露包括重叠区的单链突出端);(b)拥挤剂(除其它功能外,其可以加速核酸退火,从而使单链突出端特异性退火(杂交));(c)具有3'核酸外切酶活性的分离的热稳定非链置换dna聚合酶或所述dna聚合酶与缺乏3'核酸外切酶活性的第二dna聚合酶的混合物(以填充退火分子中剩余的单链缺口,通过延长退火区的3'端);(d)分离的热稳定连接酶(其密封(连接)由此形成的切口);(e)dntp的混合物;以及(f)在有效连接所述两个或更多个dna分子以在一步反应中形成第一组装的dsdna分子的条件下的合适缓冲液。对于单链分子,核酸外切酶可以但不必被省略。在具体的实例中,t5核酸外切酶从双链dna分子的5'端去除核苷酸,互补的单链dna突出端被退火,并且phusion dna聚合酶填充缺口,并且taq dna连接酶密封切口。参见例如us 2010/0035768、us 2015/0376628、wo 2015/200334和gibson等人,(2009)《自然方法(nat.methods)》6(5):343
‑
345,所述文献中的每个文献出于所有目的整体并入本文。
[0128]
当第一单链核酸和第二单链核酸的相应末端彼此互补时,所述第一单链核酸和所述第二单链核酸具有重叠末端。当第一核酸链的5'端与第二核酸链的3'端互补时,第一双链核酸和第二双链核酸具有重叠末端,并且反之亦然。例如,对于双链重叠末端序列,一条核酸链可以与对应的另一条核酸链具有至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%的同一性。在本文所公开的方法中,要组装的dsdna分子链的5'端与另一dsdna分子链的3'端共享重叠末端序列。术语重叠末端序列包含dsdna分子的两条链。因此,当重叠序列的互补区以来自要组装的所述两个多核苷酸的5'和3'端的单链突出端存在时,来自重叠区的一条链可以与其互补链特异性杂交。核酸外切酶可以用于从5'或3'端去除核苷酸以创建突出末端序列。
[0129]
重叠区的长度可以足够长,使得区域在任何被组装的核酸内仅出现一次。因此,防止了其它多核苷酸与末端序列退火,并且组装可以对靶核酸具有特异性。作为一个实例,重叠长度可以包括至少约20个核苷酸、至少约30个核苷酸、至少约40个核苷酸或至少约50个核苷酸。作为另一个实例,重叠长度可以介于约20个核苷酸与约100个核苷酸之间、介于约20个核苷酸与约90个核苷酸之间、介于约0个核苷酸与约80个核苷酸之间、介于约20个核苷酸与约70个核苷酸之间、介于约20个核苷酸与约60个核苷酸之间、介于约20个核苷酸与约50个核苷酸之间、介于约20个核苷酸与约40个核苷酸之间、介于约30个核苷酸与约60个核苷酸之间或介于约40个核苷酸与约50个核苷酸之间。在具体实例中,重叠长度可以介于约40个核苷酸与约50个核苷酸之间(例如,约40个核苷酸或约50个核苷酸)。
[0130]
重叠序列可以与核酸外切酶接触以暴露重叠序列之间的互补序列(例如,互补单
链序列)。核酸外切酶消化可以在有效去除(咀嚼)足够数量的核苷酸以允许暴露的单链互补区域的特异性退火的条件下进行。通常,重叠区域的一部分或整个重叠区域被咀嚼,留下包括重叠区域的一部分或整个重叠区域的突出物。在一些方法中,核酸外切酶消化可以在不存在dntp的情况下由聚合酶(例如,t5 dna聚合酶)进行,而在其它方法中,核酸外切酶消化可以在存在缺乏聚合酶活性的dntp的情况下由核酸外切酶进行(例如,核酸外切酶iii)。
[0131]
在本文所公开的方法中,可以使用多种5'到3'双链特异性脱氧核糖核酸外切酶中的任一种来咀嚼核酸的末端。术语5'核酸外切酶在本文中有时用于指5'到3'脱氧核糖核酸外切酶。非进行性核酸外切酶是指在每次dna结合事件期间降解有限数量(例如,仅少数)核苷酸的核酸外切酶。用5'核酸外切酶消化在dna分子中产生3'单链突出端。体外组装方法中使用的5'核酸外切酶可能缺乏3'核酸外切酶活性,可以产生5'磷酸末端,并且可以从5'磷酸化末端和非磷酸化末端两者开始降解。本文所描述的体外组装方法中使用的核酸外切酶可以从分子的5'端开始消化,无论其是平端,或者具有小的5'或3'凹端。合适的核酸外切酶是众所周知的并且包含例如噬菌体t5核酸外切酶(噬菌体t5基因d15产物)、噬菌体λ核酸外切酶、rac原噬菌体的rece、来自大肠杆菌的核酸外切酶viii、噬菌体t7核酸外切酶(噬菌体t7基因6产物)或参与同源重组反应的各种5'核酸外切酶中的任一种。作为一个实例,核酸外切酶是t5核酸外切酶或λ核酸外切酶。在一个具体实例中,核酸外切酶是t5核酸外切酶。在另一个具体实例中,核酸外切酶不是噬菌体t7核酸外切酶。
[0132]
在重叠区很长的情况下,可以仅需要咀嚼所述区域的一部分,前提是由此产生的单链突出端具有足够的长度和碱基含量,以便在反应条件下进行特异性地退火。术语特异性地退火包含这样的情况,其中一对特定的单链突出端将优先地(或排他地)彼此退火,而不是与反应混合物中存在的其它单链突出端(例如,非互补突出端)退火。优先地意味着至少约95%的突出端将与互补突出端退火。通常,重叠的同源区(单链突出端或其互补物)含有相同的序列。然而,可以使用部分相同的序列,前提是单链突出端可以在反应条件下特异性地退火。
[0133]
在单链dna(例如,当要连接的dna分子是dsdna时,由核酸外切酶的作用产生的突出端或通过在每条链的不同靶位点处产生切口而产生的突出端)退火之后,由核酸外切酶留下的单链缺口可以用合适的非链置换的dna聚合酶填充,并且因此形成的切口可以用连接酶密封。如本文所使用的非链置换dna聚合酶是这样的dna聚合酶:当所述dna聚合酶在拷贝dsdna分子的过程中遇到位于所述dna聚合酶的路径中的dna链时,所述dna聚合酶终止dna的合成,或者所述dna聚合酶一边拷贝一边使遇到的dna链降解,同时填充由此产生的缺口,由此产生移动的切口(切口平移)。
[0134]
在第一多核苷酸的单链与第二多核苷酸的互补链退火之后,第一多核苷酸的3'端可以基于第二多核苷酸链的模板来延长,并且第二多核苷酸链的3'端可以基于第一多核苷酸链的模板来延长。通过延长每个多核苷酸的互补3'端,可以组装多核苷酸。在组装之后,来自一个片段的一条链的延长的3'端与来自另一个片段的一条链的相邻5'端之间的切口可以通过连接密封。更具体地,第一多核苷酸的延长的3'端的羟基可以与第二多核苷酸的5'端的磷酸基连接,并且第二多核苷酸的延长的3'端的羟基可以与第一多核苷酸的5'端的磷酸基连接。
[0135]
连接反应可以通过多种合适的热稳定dna连接酶中的任一种进行。合适的连接酶
是美国专利第6,576,453号所公开的例如taq连接酶、扩增酶热稳定dna连接酶或热稳定连接酶,所述文献出于所有目的整体并入本文。
[0136]
反应混合物中合适量的如peg等拥挤剂可以允许、增强或促进分子拥挤。此类拥挤剂可以使溶液的组分彼此更紧密地接触。例如,要重组的dna分子可以靠得更近;这可以促进单链突出端的退火。合适的拥挤剂是已知的并且包含多种众所周知的大分子,如聚合物如聚乙二醇(peg)、ficoll如ficoll 70或葡聚糖如葡聚糖70。
[0137]
组装反应混合物中存在的反应组分(如盐、缓冲液、合适的能源(如atp或nad)、反应混合物的ph等)对于单个酶(核酸外切酶、聚合酶和连接酶)可能不是最佳的,但可以充当对整个反应组有效的折衷。
[0138]
vi.靶向性载体和大靶向性载体(ltvec)
[0139]
在本文所公开的方法中使用的靶向性载体可以是任何合适的靶向性载体。靶向性载体可以包括脱氧核糖核酸(dna)或核糖核酸(rna),其可以是单链或双链,并且可以是线性或环状形式。靶向性载体可以是细菌人工染色体(bac)、经修饰的bac或bac的片段。所述靶向性载体可以包括人dna、啮齿动物dna(例如,小鼠dna或大鼠dna)、合成dna或其任何组合。
[0140]
在本文所公开的方法中使用的一些靶向性载体是大靶向性载体(ltvec)。ltvec包含包括同源臂的靶向性载体,所述同源臂对应于并且源自比旨在在细胞中进行同源重组的其它方法通常所使用的那些核酸序列更大的核酸序列。ltvec还包含包括核酸插入的靶向性载体,所述核酸插入的核酸序列大于旨在在细胞中进行同源重组的其它方法通常所使用的核酸序列。例如,ltvec可以对由于其大小限制而无法由传统的基于质粒的靶向性载体容纳的大基因座进行修饰。例如,在不存在由核酸酶试剂(例如,cas蛋白)诱导的切口或双链断裂的情况下,靶向基因座可以是(即,5'和3'同源臂可以对应于)使用常规方法不可靶向或只能错误靶向或仅以显著低效率靶向的细胞的基因座。ltvec的实例包含源自细菌人工染色体(bac)、人类人工染色体或酵母人工染色体(yac)的载体。ltvec的非限制性实例及其制造方法描述于例如美国专利第6,586,251号;第6,596,541号;和第7,105,348号;以及wo 2002/036789中,所述文献中的每个文献出于所有目的整体并入本文。ltvec可以是线性形式或环状形式。ltvec可以是任何长度,并且通常长度为至少10kb。ltvec的大小可能太大而无法通过常规测定例如southern印迹和长距离(例如,1kb到5kb)pcr筛选靶向事件。
[0141]
在本文所公开的方法中使用的靶向性载体(例如,ltvec)可以是任何长度。例如,靶向性载体可以为约10kb到约400kb、约20kb到约400kb、约20kb到约30kb、约30kb到约40kb、约40kb到约50kb、约50kb到约75kb、约75kb到约100kb、约100kb到125kb、约125kb到约150kb、约150kb到约175kb、约175kb到约200kb、约200kb到约225kb、约225kb到约250kb、约250kb到约275kb或约275kb到约300kb、约200kb到约300kb、约300kb到约350kb或约350kb到约400kb。在一个实例中,靶向性载体的长度可以为至少约100kb或100kb。靶向性载体也可以为约50kb到约500kb、约100kb到约125kb、约300kb到约325kb、约325kb到约350kb、约350kb到约375kb、约375kb到约400kb、约400kb到约425kb、约425kb到约450kb、约450kb到约475kb或约475kb到约500kb。可替代地,靶向性载体可以是至少10kb、至少15kb、至少20kb、至少30kb、至少40kb、至少50kb、至少60kb、至少70kb、至少80kb、至少90kb、至少100kb、至少150kb、至少200kb、至少250kb、至少300kb、至少350kb、至少400kb、至少450kb或至少500kb
或更大。
[0142]
vii.核酸酶试剂
[0143]
任何稀有切割核酸酶试剂均可以在本文所公开的方法中使用。稀有切割核酸酶试剂是具有在基因组中很少出现的靶序列或识别序列的核酸酶试剂。类似地,可以使用具有不出现在本文所描述的靶向性载体中的预期切割位点之外的靶序列或识别序列的任何核酸酶试剂。例如,可以使用在本文所描述的方法中不具有预先存在的靶向性载体中的靶序列或识别序列的任何核酸酶试剂。
[0144]
可以在本文所公开的方法和组合物中使用如上文所描述的在期望的靶序列处诱导切口或双链断裂的任何核酸酶试剂。可以采用天然存在的或天然的核酸酶试剂,只要所述核酸酶试剂在期望的靶序列中诱导切口或双链断裂即可。可替代地,可以采用经修饰的或工程化核酸酶试剂。“工程化核酸酶试剂”包含从其天然形式工程化(进行修饰或源自所述天然形式)以特异性地识别和诱导期望的靶序列中的切口或双链断裂的核酸酶。因此,工程化核酸酶试剂可以源自天然的、天然存在的核酸酶试剂,或者可以人工产生或合成。工程化核酸酶可以在例如靶序列中诱导切口或双链断裂,其中靶序列不是由天然(非工程化或未修饰的)核酸酶试剂识别的序列。核酸酶试剂的修饰可以少至蛋白质切割剂中的一个氨基酸或核酸切割剂中的一个核苷酸。在靶序列或其它dna中产生切口或双链断裂在本文中可以被称为“切割(cutting)”或“切割(cleaving)”靶序列或其它dna。
[0145]
还提供了示例性靶序列的活性变体和片段。此类活性变体可以包括与给定的靶序列具有至少65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性,其中活性变体保留生物活性并因此能够以序列特异性方式被核酸酶试剂识别和切割。由核酸酶试剂测量靶序列双链断裂的测定是众所周知的。参见例如frendwey等人,(2010)《酶学方法(methods in enzymology)》476:295
‑
307,所述文献出于所有目的整体并入本文。
[0146]
还提供了核酸酶试剂(即,工程化核酸酶试剂)的活性变体和片段。此类活性变体可以包括与天然核酸酶试剂具有至少65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性,其中活性变体保留在期望的靶序列处切割的能力并因此保留切口或双链断裂诱导活性。例如,本文所描述的核酸酶试剂中的任何核酸酶试剂都可以从天然核酸内切酶序列进行修饰,并被设计成在未被天然核酸酶试剂识别的靶序列处识别和诱导切口或双链断裂。因此,一些工程化核酸酶具有特异性以在不同于对应的天然核酸酶试剂靶序列的靶序列处诱导切口或双链断裂。对切口或双链断裂诱导活性的测定是已知的,并且通常测量内切核酸酶对含有靶序列的dna底物的总体活性和特异性。
[0147]
核酸酶靶序列包含由核酸酶试剂诱导切口或双链断裂的dna序列。靶序列的长度可以变化,并且包含例如对于锌指核酸酶(zfn)对为约30
‑
36bp(即,对于每个zfn为约15
‑
18bp),对于转录激活子样效应子核酸酶(talen)为约36bp,或者对于crispr/cas9向导rna为约20bp的靶序列。
[0148]
a.限制酶
[0149]
适于在本文所公开的方法中使用的核酸酶试剂可以包括限制性内切核酸酶,其包含i型、ii型、iii型和iv型内切核酸酶。i型和iii型限制性内切核酸酶识别特定的识别位
点,但通常在离核酸酶结合位点的可变位置处切割,所述核酸酶结合位点可以距切割位点(识别位点)数百个碱基对。在ii型系统中,限制活性独立于任何甲基化酶活性,并且切割通常发生在结合位点内或其附近的特定位点处。大多数ii型酶切割回文序列,然而,iia型酶识别非回文识别位点并在识别位点之外进行切割,iib型酶在识别位点之外的两个位点切割序列两次,并且iis型酶识别非对称识别位点并在一侧进行切割,并在距识别位点约1
‑
20个核苷酸的限定的距离处进行切割。iv型限制酶靶向甲基化dna。限制酶在例如以下中进一步描述和分类:rebase数据库(rebase.neb.com上的网页;roberts等人,(2003)《核酸研究》31:418
‑
20);roberts等人,(2003)《核酸研究》31:1805
‑
12;以及belfort等人,(2002)在《移动dna(mobile dna)》ii中,第761
‑
783页,编辑,craigie等人,(华盛顿特区的asm出版社(asm press,washington,dc)),所述文献中的每个文献整体并入本文。
[0150]
在一些方法中,使用了稀有切割限制酶。稀有切割限制酶是指具有在基因组中很少出现的靶位点或识别位点的酶。通过用限制酶切割假设的随机基因组产生的限制片段的大小可以为近似4
n
,其中n是酶识别位点中的核苷酸数量。例如,具有由7个核苷酸组成的识别位点的酶每47bp切割一次基因组,从而产生约16,384bp的片段。通常,稀有切割酶具有包括6个或更多个核苷酸的识别位点。例如,稀有切割酶可以具有包括6个、7个、8个、9个、10个、11个、12个、13个、14个或15个核苷酸或由其组成的识别位点。稀有切割限制酶的实例包含noti(gcggccgc)、xmaiii(cggccg)、sstii(ccgcgg)、sall(gtcgac)、nrui(tcgcga)、nhei(gctagc)、nb.bbvci(cctcagc)、bbvci(cctcagc)、asci(ggcgcgcc)、asisi(gcgatcgc)、fsei(ggccggcc)、paci(ttaattaa)、pmei(gtttaaac)、sbfi(cctgcagg)、sgrai(crccggyg)、swai(atttaaat)、bspqi(gctcttc)、sapi(gctcttc)、sfii(ggccnnnnnggcc)、cspci(caannnnngtgg)、absi(cctcgagg)、ccini(gcggccgc)、fspai(rtgcgcay)、maubi(cgcgcgcg)、mrei(cgccggcg)、mssi(gtttaaac)、palai(ggcgcgcc)、rgai(gcgatcgc)、rigi(ggccggcc)、sdai(cctgcagg)、sfaai(gcgatcgc)、sgfi(gcgatcgc)、sgrdi(cgtcgacg)、sgsi(ggcgcgcc)、smii(atttaaat)、srfi(gcccgggc)、sse2321(cgccggcg)、sse83871(cctgcagg)、lgui(gctcttc)、pcisi(gctcttc)、aari(cacctgc)、ajui(gaannnnnnnttgg)、aloi(gaacnnnnnntcc)、bari(gaagnnnnnntac)、ppii(gaacnnnnnctc)、psri(gaacnnnnnntac)等等。
[0151]
b.crispr/cas系统
[0152]
成簇的规律间隔的短回文重复序列(crispr)/crispr相关(cas)系统也可以用作本文所公开的方法中的稀有切割核酸酶试剂。crispr/cas系统包含转录物和其它参与cas基因表达或指导其活性的元件。crispr/cas系统可以是例如i型、ii型、iii型系统或v型系统(例如,v
‑
a亚型或v
‑
b亚型)。在本文所公开的组合物和方法中使用的crispr/cas系统可以是非天然存在的。“非天然存在的”系统包含任何表明人手参与的任何事物,如系统的一种或多种组分从其天然存在的状态改变或突变,至少基本上不含至少一种与其在自然界中天然相关联的其它组分,或与至少一种与其不天然相关联的其它组分相关联。例如,一些crispr/cas系统采用包括非天然一起存在的grna和cas蛋白的非天然存在的crispr复合物,采用非天然存在的cas蛋白,或者采用非天然存在的grna。
[0153]
cas蛋白以及对cas蛋白进行编码的多核苷酸。cas蛋白通常包括至少一个可以与向导rna(grna)相互作用的rna识别或结合结构域。cas蛋白还可以包括核酸酶结构域(例
如,dnase结构域或rnase结构域)、dna结合结构域、解旋酶结构域、蛋白质
‑
蛋白质相互作用结构域、二聚化结构域和其它结构域。一些此类结构域(例如,dnase结构域)可以来自天然cas蛋白。可以添加其它此类结构域以制备经修饰的cas蛋白。核酸酶结构域对核酸切割具有催化活性,所述核酸切割包含核酸分子的共价键的断裂。切割可以产生平端或交错末端,并且可以是单链或双链。例如,野生型cas9蛋白通常会产生平切割产物。可替代地,野生型cpf1蛋白(例如,fncpf1)可以产生具有5核苷酸5'突出端的切割产物,其中切割发生在来自非靶向链上的pam序列的第18个碱基对之后和基于靶向链的第23个碱基对之后。cas蛋白可以具有完整的切割活性以在靶基因组基因座处产生双链断裂(例如,具有平端的双链断裂),或者可以是在靶基因组基因座处产生单链断裂的切口酶。
[0154]
cas蛋白的实例包含cas1、cas1b、cas2、cas3、cas4、cas5、cas5e(casd)、cas6、cas6e、cas6f、cas7、cas8a1、cas8a2、cas8b、cas8c、cas9(csn1或csx12)、cas10、cas10d、casf、casg、cash、csy1、csy2、csy3、cse1(casa)、cse2(casb)、cse3(case)、cse4(casc)、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csx15、csf1、csf2、csf3、csf4和cu1966及其同源物或经修饰的版本。
[0155]
示例性cas蛋白是cas9蛋白或源自cas9蛋白的蛋白。cas9蛋白来自ii型crispr/cas系统,并且通常共享具有保守架构的四个关键基序。基序1、2和4是ruvc样基序,并且基序3是hnh基序。示例性cas9蛋白来自酿脓链球菌(streptococcus pyogenes)、嗜热链球菌(streptococcus thermophilus)、链球菌(streptococcus sp.)、金黄色葡萄球菌(staphylococcus aureus)、达松维尔拟诺卡氏菌(nocardiopsis dassonvillei)、始旋链霉菌(streptomyces pristinaespiralis)、绿产色链霉菌(streptomyces viridochromogenes)、绿产色链霉菌、链孢囊菌(streptosporangium roseum)、链孢囊菌、酸热脂环酸杆菌(alicyclobacillus acidocaldarius)、假蕈状芽孢杆菌(bacillus pseudomycoides)、硒化芽孢杆菌(bacillus selenitireducens)、西伯利亚微小杆菌(exiguobacterium sibiricum)、德氏乳酸杆菌(lactobacillus delbrueckii)、唾液乳杆菌(lactobacillus salivarius)、海洋微颤蓝细菌(microscilla marina)、伯克霍尔德氏菌(burkholderiales bacterium)、食萘极地单胞菌(polaromonas naphthalenivorans)、极地单胞菌(polaromonas sp.)、瓦氏鳄球藻(crocosphaera watsonii)、蓝丝菌(cyanothece sp.)、铜绿微囊藻(microcystis aeruginosa)、聚球藻(synechococcus sp.)、阿拉伯糖醋酸杆菌(acetohalobium arabaticum)、德根斯产氨菌(ammonifex degensii)、热解纤维素菌(caldicelulosiruptor becscii)、候选金矿菌(candidatus desulforudis)、肉毒杆菌(clostridium botulinum)、艰难梭菌(clostridium difficile)、大芬戈尔德菌(finegoldia magna)、嗜热厌氧钠杆菌(natranaerobius thermophilus)、丙酸降解菌(pelotomaculum thermopropionicum)、喜温嗜酸硫杆菌(acidithiobacillus caldus)、嗜酸氧化亚铁硫杆菌(acidithiobacillus ferrooxidans)、酒色异着色菌(allochromatium vinosum)、海杆菌(marinobacter sp.)、嗜盐亚硝化球菌(nitrosococcus halophilus)、瓦氏亚硝化球菌(nitrosococcus watsoni)、假交替单胞菌(pseudoalteromonas haloplanktis)、消旋纤线杆菌(ktedonobacter racemifer)、甲烷盐菌(methanohalobium evestigatum)、鱼腥藻
(anabaena variabilis)、泡沫节球藻(nodularia spumigena)、念珠藻(nostoc sp.)、极大节旋藻(arthrospira maxima)、最大节螺藻(arthrospira platensis)、节旋藻(arthrospira sp.)、林氏藻(lyngbya sp.)、原型微鞘藻(microcoleus chthonoplastes)、颤藻(oscillatoria sp.)、移动石袍菌(petrotoga mobilis)、非洲栖热腔菌(thermosipho africanus)、深海阿卡罗虎尾草(acaryochloris marina)、脑膜炎奈瑟氏球菌(neisseria meningitidis)或空肠弯曲杆菌(campylobacter jejuni)。cas9家族成员的另外的实例描述于wo 2014/131833中,所述文献出于所有目的整体并入本文。来自酿脓链球菌(s.pyogenes)的cas9(spcas9)(指定swissprot登录号q99zw2)是示例性cas9蛋白。来自金黄色葡萄球(s.aureus)的cas9(sacas9)(指定uniprot登录号j7rua5)是另一示例性cas9蛋白。来自空肠弯曲杆菌的cas9(cjcas9)(指定uniprot登录号q0p897)是另一示例性cas9蛋白。参见例如kim等人,(2017)《自然通讯(nat.commun.)》8:14500,所述文献出于所有目的整体并入本文。sacas9小于spcas9,并且cjcas9小于sacas9和spcas9两者。来自脑膜炎奈瑟氏球菌的cas9(nme2cas9)是另一种示例性cas9蛋白。参见例如edraki等人,(2019)《分子细胞(mol.cell)》73(4):714
‑
726,所述文献出于所有目的整体并入本文。来自嗜热链球菌的cas9蛋白(例如,由crispr1基因座编码的嗜热链球菌lmd
‑
9cas9(st1cas9)或来自crispr3基因座的嗜热链球菌cas9(st3cas9))是其它示例性cas9蛋白。来自新凶手弗朗西丝菌(francisella novicida)(fncas9)的cas9或识别置换性pam(e1369r/e1449h/r1556a取代)的rha新凶手弗朗西斯菌cas9变体是其它示例性cas9蛋白。这些和其它示例性cas9蛋白在例如cebrian
‑
serrano和davies(2017)《哺乳动物细胞基因组(mamm.genome)》28(7):247
‑
261中进行了概述,所述文献出于所有目的整体并入本文。示例性cas9蛋白序列可以包括seq id no:1、基本上由其组成或由其组成。对cas9蛋白进行编码的示例性dna可以包括seq id no:2、基本上由其组成或由其组成。
[0156]
cas蛋白的另一个实例是cpf1(来自普氏菌(prevotella)和弗朗西斯菌(francisella)1的crispr)蛋白。cpf1是大蛋白质(约1300个氨基酸),其含有与cas9的对应的结构域同源的ruvc样核酸酶结构域,以及与特征性富含精氨酸的cas9簇的对应物。然而,与含有包含hnh结构域在内的长插入的cas9相比,cpf1缺乏存在于cas9蛋白中的hnh核酸酶结构域,并且ruvc样结构域在cpf1序列中是连续的。参见例如zetsche等人,(2015)《分子细胞》163(3):759
‑
771,所述文献出于所有目的整体并入本文。示例性cpf1蛋白来自土拉热弗朗西斯菌(francisella tularensis)1、新凶手土拉热弗朗西斯菌亚种(francisella tularensis subsp.novicida)、阿尔伯普氏菌(prevotella albensis)、毛螺菌科细菌(lachnospiraceae bacterium)mc2017 1、解蛋白丁酸弧菌(butyrivibrio proteoclasticus)、异域菌门细菌(peregrinibacteria bacterium)gw2011_gwa2_33_10、俭菌超门细菌(parcubacteria bacterium)gw2011_gwc2_44_17、丙酸氧化菌(smithella sp.)scadc、氨基酸球菌(acidaminococcus sp.)bv3l6、毛螺菌科细菌ma2020、候选白蚁甲烷枝原体(candidatus methanoplasma termitum)、挑剔真杆菌(eubacterium eligens)、牛眼莫拉氏菌(moraxella bovoculi)237、良吉氏钩端螺旋体(leptospira inadai)、毛螺菌科细菌nd2006、牙龈卟啉单胞菌(porphyromonas crevioricanis)3、解糖胨普雷沃(prevotella disiens)和猕猴卟啉单胞菌(porphyromonas macacae)。来自新凶手弗朗西斯菌u112的cpf1(fncpf1;指定uniprot登录号a0q7q2)是示例性cpf1蛋白。
[0157]
cas蛋白可以是野生型蛋白(即,自然界中存在的那些)、经修饰的cas蛋白(即,cas蛋白变体)或野生型或经修饰的cas蛋白的片段。就野生型或经修饰的cas蛋白的催化活性而言,cas蛋白也可以是活性变体或片段。就催化活性而言,活性变体或片段可以包括与野生型或经修饰的cas蛋白或其部分具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性,其中活性变体保留在期望的切割位点处切割的能力,并因此保留切口诱导或双链断裂诱导活性。对切口诱导或双链断裂诱导活性的测定是已知的,并且通常测量cas蛋白对含有切割位点的dna底物的总体活性和特异性。
[0158]
可以修饰cas蛋白以增加或减少核酸结合亲和力、核酸结合特异性和酶活性中的一种或多种。也可以修饰cas蛋白以改变蛋白质的任何其它活性或性质,如稳定性。例如,可以修饰、缺失或灭活cas蛋白的一个或多个核酸酶结构域,或者可以截短cas蛋白以去除对蛋白质功能不是必需的结构域或优化(例如,增强或减少)cas蛋白的活性或性质。
[0159]
经修饰的cas蛋白的一个实例是经修饰的spcas9
‑
hf1蛋白,其是酿脓链球菌cas9的高保真变体,具有旨在减少非特异性dna接触的改变(n497a/r661a/q695a/q926a)。参见例如kleinstiver等人,(2016)《自然(nature)》529(7587):490
‑
495,所述文献出于所有目的整体并入本文。经修饰的cas蛋白的另一个实例是经修饰的espcas9变体(k848a/k1003a/r1060a),旨在减少脱靶效应。参见例如slaymaker等人,(2016)《科学(science)》351(6268):84
‑
88,所述文献出于所有目的整体并入本文。其它spcas9变体包含k855a和k810a/k1003a/r1060a。这些和其它经修饰的cas蛋白在例如cebrian
‑
serrano和davies(2017)《哺乳动物细胞基因组》28(7):247
‑
261中进行了概述,所述文献出于所有目的整体并入本文。经修饰的cas9蛋白的另一个实例是xcas9,其是可以识别更大范围的pam序列的spcas9变体。参见例如hu等人,(2018)《自然》556:57
‑
63,所述文献出于所有目的整体并入本文。
[0160]
cas蛋白可以包括至少一个核酸酶结构域,如dnase结构域。例如,野生型cpf1蛋白通常包括ruvc样结构域,其切割靶dna的两条链,可能是二聚体配置。cas蛋白还可以包括至少两个核酸酶结构域,如dnase结构域。例如,野生型cas9蛋白通常包括ruvc样核酸酶结构域和hnh样核酸酶结构域。ruvc和hnh结构域可以各自切割不同的双链dna链,从而在dna中形成双链断裂。参见例如jinek等人,(2012)《科学》337:816
‑
821,所述文献出于所有目的整体并入本文。
[0161]
核酸酶结构域中的一个或多个核酸酶结构域可以缺失或突变,使得其不再具有功能或具有降低的核酸酶活性。例如,如果cas9蛋白中的核酸酶结构域之一缺失或突变,则产生的cas9蛋白可以被称为切口酶,并且可以在双链靶dna内产生单链断裂,但不会产生双链断裂(即,其可以切割互补链或非互补链,但不能同时切割两者)。将cas9转化为切口酶的突变的一个实例是来自酿脓链球菌的cas9的ruvc结构域中的d10a(cas9的位置10处的天冬氨酸
‑
丙氨酸)突变。同样,来自酿脓链球菌的cas9的hnh结构域中的h939a(氨基酸位置839处的组氨酸
‑
丙氨酸)、h840a(氨基酸位置840处的组氨酸
‑
丙氨酸)或n863a(氨基酸位置n863处的天冬酰胺
‑
丙氨酸)可以将cas9转化为切口酶。将cas9转化为切口酶的突变的其它实例包含来自嗜热链球菌的cas9的对应的突变。参见例如sapranauskas等人,(2011)《核酸研究》39(21):9275
‑
9282以及wo 2013/141680,所述文献中的每个文献出于所有目的整体并入本文。可以使用如定点诱变、pcr介导的诱变或总基因合成等方法产生此类突变。产生切口酶的突变的其它实例可以在例如wo 2013/176772和wo 2013/142578中找到,所述文献中
的每个文献出于所有目的整体并入本文。
[0162]
xcas9的催化结构域中的失活突变的实例与上述针对spcas9的突变相同。金黄色葡萄球菌cas9蛋白的催化结构域中的失活突变的实例也是已知的。例如,金黄色葡萄球菌cas9酶(sacas9)可以包括位置n580处的取代(例如,n580a取代)以产生切口酶。可替代地,sacas9酶可以包括位置d10处的取代(例如,d10a取代)以产生切口酶。参见例如wo 2016/106236,所述文献出于所有目的整体并入本文。nme2cas9的催化结构域中的失活突变的实例也是已知的(例如,d16a和h588a的组合)。st1cas9的催化结构域中的失活突变的实例也是已知的(例如,d9a、d598a、h599a和n622a的组合)。st3cas9的催化结构域中的失活突变的实例也是已知的(例如,d10a和n870a的组合)。cjcas9的催化结构域中的失活突变的实例也是已知的(例如,d8a和h559a的组合)。fncas9和rhafncas9的催化结构域中的失活突变的实例也是已知的(例如,n995a)。
[0163]
cpf1蛋白的催化结构域中的失活突变的实例也是已知的。关于来自新凶手弗朗西斯菌u112(fncpf1)的cpf1蛋白、氨基酸球菌bv3l6(ascpf1)、毛螺菌科细菌nd2006(lbcpf1)和牛眼莫拉氏菌237(mbcpf1 cpf1),此类突变可以包含在ascpf1的位置908、993或1263或cpf1直系同源物中的对应的位置,或lbcpf1的位置832、925、947或1180或cpf1直系同源物中的对应位置处的突变。此类突变可以包含例如ascpf1的突变d908a、e993a和d1263a或cpf1直系同源物中的对应的突变或lbcpf1的d832a、e925a、d947a和d1180a或cpf1直系同源物中的对应的突变中的一个或多个突变。参见例如us 2016/0208243,所述文献出于所有目的整体并入本文。
[0164]
cas蛋白也可以作为融合蛋白与异源多肽可操作地连接。例如,cas蛋白可以与切割结构域融合。参见wo 2014/089290,所述文献出于所有目的整体并入本文。cas蛋白也可以与异源多肽融合,提供增加或减少的稳定性。融合结构域或异源多肽可以定位在n端、c端或cas蛋白内部。
[0165]
作为一个实例,cas蛋白可以与一种或多种提供亚细胞定位的异源多肽融合。此类异源多肽可以包含例如一种或多种核定位信号(nls),如用于靶向细胞核的单分sv40 nls和/或双分α
‑
输入蛋白nls、用于靶向线粒体的线粒体定位信号、er保留信号等等。参见例如lange等人,(2007)《生物化学杂志(j.biol.chem.)》282(8):5101
‑
5105,所述文献出于所有目的整体并入本文。此类亚细胞定位信号可以定位在n端处、c端处或cas蛋白内的任何位置处。nls可以包括碱性氨基酸的段,并且可以是单分序列或双分序列。任选地,cas蛋白可以包括两个或更多个nls,包含n端处的nls(例如,α
‑
输入蛋白nls或单分nls)和c端处的nls(例如,sv40 nls或双分nls)。cas蛋白还可以包括n端处的两个或更多个nls和/或c端处的两个或更多个nls。
[0166]
cas蛋白也可以与细胞穿透结构域或蛋白质转导结构域可操作地连接。例如,细胞穿透结构域可以源自hiv
‑
1tat蛋白、来自人类乙型肝炎病毒的tlm细胞穿透基序、mpg、pep
‑
1、vp22、来自单纯性疱疹病毒的细胞穿透肽、或聚精氨酸肽序列。参见例如wo 2014/089290和wo 2013/176772中,所述文献中的每个文献出于所有目的整体并入本文。细胞穿透结构域可以定位在n端处、c端处或cas蛋白内的任何位置处。
[0167]
可以修饰提供作为mrna的cas蛋白以提高稳定性和/或免疫原性特性。可以对mrna内的一种或多种核苷进行修饰。对mrna核碱基的化学修饰的实例包含假尿苷、1
‑
甲基
‑
假尿
苷和5
‑
甲基
‑
胞苷。例如,可以使用含有n1
‑
甲基假尿苷的封端和聚腺苷酸化的cas mrna。同样,cas mrna可以通过使用同义密码子使尿苷缺失来修饰。
[0168]
向导rna。“向导rna”或“grna”是与cas蛋白(例如,cas9蛋白)结合并将cas蛋白靶向靶dna内的特定位置的rna分子。向导rna可以包括两个段:“dna靶向段”和“蛋白质结合段”。“段”包含分子的一部分或区域,如rna中的核苷酸的连续段。一些grna,如用于cas9的grna,可以包括两个单独的rna分子:“激活子
‑
rna”(例如,tracrrna)和“靶向子
‑
rna”(例如,crispr rna或crrna)。其它grna是单个rna分子(单个rna多核苷酸),其也可以被称为“单分子grna”、“单向导rna”或“sgrna”。参见例如wo 2013/176772、wo 2014/065596、wo 2014/089290、wo 2014/093622、wo 2014/099750、wo 2013/142578和wo 2014/131833,所述文献中的每个文献出于所有目的整体并入本文。例如,对于cas9,单向导rna可以包括(例如,通过接头)与tracrrna融合的crrna。例如,对于cpf1,仅需要一个crrna来实现与靶序列的结合和/或切割。术语“向导rna”和“grna”包含双分子(即,模块化)grna和单分子grna两者。
[0169]
示例性双分子grna包括crrna样(“crispr rna”或“靶向子
‑
rna”或“crrna”或“crrna重复序列”)分子和对应的tracrrna样(“反式作用型crispr rna”或“激活子
‑
rna”)或“tracrrna”)分子。crrna包括grna的dna靶向段(单链)和形成grna的蛋白质结合段的dsrna双链体的一半的核苷酸段(即,crrna尾部)两者。定位在dna靶向段下游(3')的crrna尾部的实例包括guuuuagagcuaugcu(seq id no:3)、基本上由其组成或由其组成。本文所公开的dna靶向段中的任何段都可以与seq id no:3的5'端连接以形成crrna。
[0170]
对应的tracrrna(激活子
‑
rna)包括形成grna的蛋白质结合段的dsrna双链体的另一半核苷酸段。crrna的核苷酸段与tracrrna的核苷酸段互补并且与其杂交,以形成grna的蛋白质结合结构域的dsrna双链体。如此,每个crrna可以被视为具有对应的tracrrna。tracrrna序列的实例包括agcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuu(seq id no:4)、基本上由其组成、或由其组成。tracrrna序列的其它实例包括aaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu(seq id no:12)或guuggaaccauucaaaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seq id no:13)、基本上由其组成、或由其组成。
[0171]
在需要crrna和tracrrna两者的系统中,crrna和对应的tracrrna杂交以形成grna。在需要仅crrna的系统中,crrna可以是grna。crrna另外提供与靶dna的互补链杂交的单链dna靶向段。如果用于细胞内的修饰,给定的crrna或tracrrna分子的确切序列可以被设计成特定于将使用rna分子的物种。参见例如mali等人,(2013)《科学》339(6121):823
‑
826;jinek等人,(2012)《科学》337(6096):816
‑
821;hwang等人,(2013)《自然生物技术》31(3):227
‑
229;jiang等人,(2013)《自然生物技术》31(3):233
‑
239;以及cong等人,(2013)《科学》339(6121):819
‑
823,所述文献中的每个文献出于所有目的整体并入本文。
[0172]
给定grna的dna靶向段(crrna)包括与靶dna的互补链上的序列互补的核苷酸序列,如下文更详细描述。grna的dna靶向段通过杂交(即,碱基配对)以序列特异性方式与靶dna相互作用。如此,dna靶向段的核苷酸序列可以有所不同,并确定了靶dna内的grna和靶dna将相互作用的位置。可以修饰受试者grna的dna靶向段以与靶dna内的任何期望序列杂交。天然存在的crrna因crispr/cas系统和生物体而异,但通常含有长度介于21个到72个核
苷酸之间的靶向段,所述靶向段侧接有两个长度介于21个到46个核苷酸之间的同向重复序列(dr)(参见例如wo 2014/131833,所述文献出于所有目的整体并入本文)。在酿脓链球菌的情况下,dr长36个核苷酸,并且靶向段长30个核苷酸。定位在3'处的dr与对应的tracrrna互补并杂交,所述tracrrna进而与cas蛋白结合。
[0173]
dna靶向段具有的长度可以例如为至少约12个、15个、17个、18个、19个、20个、25个、30个、35个或40个核苷酸。此类dna靶向段具有的长度可以例如为约12个到约100个、约12个到约80个、约12个到约50个、约12个到约40个、约12个到约30个、约12个到约25个或约12个到约20个核苷酸。例如,dna靶向段可以为约15个到约25个核苷酸(例如,约17个到约20个核苷酸或约17个、18个、19个或20个核苷酸)。参见例如us 2016/0024523,所述文献出于所有目的整体并入本文。对于来自酿脓链球菌的cas9,典型的dna靶向段的长度介于16个与20个核苷酸之间或长度介于17个与20个核苷酸之间。对于来自金黄色葡萄球菌的cas9,典型的dna靶向段的长度介于21个与23个核苷酸之间。对于cpf1,典型的dna靶向段的长度为至少16个核苷酸或长度为至少18个核苷酸。
[0174]
tracrrna可以是任何形式(例如,全长tracrrna或活性部分tracrrna)和不同长度。其可以包含原始转录物或经处理的形式。例如,tracrrna(作为单向导rna的一部分或作为双分子grna的一部分的单独分子)可以包括野生型tracrrna序列的一部分(例如,野生型tracrrna序列的约或多于约20个、26个、32个、45个、48个、54个、63个、67个、85个或更多个核苷酸)、基本上由其组成或由其组成。来自酿脓链球菌的野生型tracrrna序列的实例包含171核苷酸版本、89核苷酸版本、75核苷酸版本和65核苷酸版本。参见例如deltcheva等人,(2011)《自然》471(7340):602
‑
607;wo 2014/093661,所述文献中的每个文献出于所有目的整体并入本文。单向导rna(sgrna)中的tracrrna的实例包含在 48、 54、 67和 85版本的sgrna中发现的tracrrna段,其中“ n”表示至多 n的野生型tracrrna核苷酸包含在sgrna中。参见us 8,697,359,所述文献出于所有目的整体并入本文。
[0175]
向导rna的dna靶向段与靶dna的互补链之间的互补性百分比可以是至少60%(例如,至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%)。dna靶向段与靶dna的互补链之间的互补性百分比在约20个连续核苷酸上可以为至少60%。作为实例,dna靶向段与靶dna的互补链之间的互补性百分比在靶dna的互补链的5'端处的14个连续核苷酸上可以是100%,并且在其余部分低至0%。在这种情况下,可以认为dna靶向段的长度为14个核苷酸。作为另一个实例,dna靶向段与靶dna的互补链之间的互补性百分比在靶dna的互补链的5'端处的七个连续核苷酸上可以是100%,并且在其余部分低至0%。在这种情况下,可以认为dna靶向段的长度为7个核苷酸。在一些向导rna中,dna靶向段内的至少17个核苷酸与靶dna的互补链互补。例如,dna靶向段的长度可以是20个核苷酸并且可以包括与靶dna的互补链的1个、2个或3个失配。在一个实例中,失配不邻近对应于原间隔子相邻基序(pam)序列的互补链的区域(即,pam序列的反向补体)(例如,失配位于向导rna的dna靶向段的5'端,或失配距离对应于pam序列的互补链的区域至少2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个或19个碱基对)。
[0176]
grna的蛋白质结合段可以包括彼此互补的两个核苷酸段。蛋白质结合段的互补核苷酸杂交以形成双链rna双链体(dsrna)。受试者grna的蛋白质结合段与cas蛋白相互作用,
并且grna通过dna靶向段将结合的cas蛋白引导到靶dna内的特定核苷酸序列。
[0177]
单向导rna可以包括与支架序列(即,向导rna的蛋白质结合序列或cas结合序列)连接的dna靶向段。例如,此类向导rna可以具有5'dna靶向段和3'支架序列。示例性支架序列包括以下、基本上由其组成或由其组成:guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcu(版本1;seq id no:5);guuggaaccauucaaaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(版本2;seq id no:6);guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(版本3;seq id no:7);以及guuuaagagcuaugcuggaaacagcauagcaaguuuaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(版本4;seq id no:8)。其它示例性支架序列包括以下、基本上由其组成或由其组成:guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuuuu(版本5;seq id no:14);guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu(版本6;seq id no:15);或者guuuaagagcuaugcuggaaacagcauagcaaguuuaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuuu(版本7;seq id no:16)。靶向任何向导rna靶序列的向导rna可以包含例如与向导rna的3'端上的示例性向导rna支架序列中的任何支架序列融合的向导rna5'端上的dna靶向段。换句话说,dna靶向段可以与seq id no:5
‑
8中的任一个的5'端连接以形成单个向导rna(嵌合向导rna)。同样,dna靶向段可以与seq id no:14
‑
16中的任一个的5'端连接以形成单个向导rna(嵌合向导rna)。如本文其它地方所公开的向导rna版本1、2、3和4是指分别与支架版本1、2、3和4连接的dna靶向段(即,向导序列或向导)。如本文其它地方所公开的向导rna版本5、6和7是指分别与支架版本5、6和7连接的dna靶向段(即,向导序列或向导)。
[0178]
向导rna可以包含提供另外的期望特征的修饰或序列(例如,经修饰或经调控的稳定性;亚细胞靶向;用荧光标记追踪;蛋白质或蛋白质复合物的结合位点;等等)。此类修饰的实例包含例如5'帽(例如,7
‑
甲基鸟苷酸帽(m7g));3'聚腺苷酸化尾部(即,3'poly(a)尾部);核糖开关序列(例如,以允许调控稳定性和/或调控蛋白质和/或蛋白质复合物的可及性);稳定性控制序列;形成dsrna双链体(即,发夹)的序列;将rna靶向亚细胞位置(例如,细胞核、线粒体、叶绿体等等)的修饰或序列;提供用于追踪的修饰或序列(例如,与荧光分子直接缀合、与促进荧光检测的部分缀合、允许荧光检测的序列等等);为蛋白质(例如,作用于dna的蛋白质,包含dna甲基转移酶、dna去甲基化酶、组蛋白乙酰转移酶、组蛋白去乙酰化酶等等)提供结合位点的修饰或序列;及其组合。修饰的其它实例包含工程化茎环双链体结构、工程化凸起区、茎环双链体结构的工程化发夹3'或其任何组合。参见例如us 2015/0376586,所述文献出于所有目的整体并入本文。凸起可以是由crrna样区和最小tracrrna样区组成的双链体内的核苷酸的未配对区。凸起在双链体的一侧可以包括未配对的5'
‑
xxxy
‑
3',其中x是任何嘌呤,并且y可以包括可以与相对链上的核苷酸形成摇摆对的核苷酸;并且在双链体的另一侧包括未配对核苷酸区。
[0179]
未修饰的核酸可能易于降解。外源核酸也可以诱导先天免疫应答。修饰可以有助于引入稳定性并降低免疫原性。向导rna可以包括经修饰的核苷和经修饰的核苷酸,包含例如以下中的一种或多种:(1)磷酸二酯骨架键中的非连接磷酸氧中的一个或两个和/或连接磷酸氧中的一个或多个的改变或置换;(2)核糖成分的改变或置换,如核糖上的2'羟基的改
变或置换;(3)用“脱磷”接头大规模置换磷酸部分;(4)天然存在的核碱基的修饰或置换;(5)核糖磷酸骨架的置换或修饰;(6)寡核苷酸的3'端或5'端的修饰(例如,末端磷酸基的去除、修饰或置换或部分的缀合);以及(7)糖的修饰。其它可能的向导rna修饰包含尿嘧啶或聚尿嘧啶束(poly
‑
uracil tracts)的修饰或置换。参见例如wo 2015/048577和us 2016/0237455中,所述文献中的每个文献出于所有目的整体并入本文。可以对如cas mrna等cas编码核酸进行类似的修饰。
[0180]
作为一个实例,向导rna的5'或3'端的核苷酸可以包含硫代磷酸酯键(例如,碱基可以具有经修饰的磷酸酯基,即,硫代磷酸酯基)。例如,向导rna可以在向导rna的5'或3'端处的2个、3个或4个末端核苷酸之间包含硫代磷酸酯键。作为另一个实例,向导rna的5'和/或3'端的核苷酸可以具有2'
‑
o
‑
甲基修饰。例如,向导rna可以在向导rna的5'和/或3'端(例如,5'端)处的2个、3个或4个末端核苷酸处包含2'
‑
o
‑
甲基修饰。参见例如wo 2017/173054 a1和finn等人,(2018)《细胞报告(cell rep.)》22(9):2227
‑
2235,所述文献中的每个文献出于所有目的整体并入本文。在一个具体实例中,向导rna在前三个5'和3'端rna残基处包括2'
‑
o
‑
甲基类似物和3'硫代磷酸酯核苷酸间键。在另一个具体实例中,向导rna被修饰使得所有不与cas9蛋白相互作用的2'oh基团被2'
‑
o
‑
甲基类似物置换,并且与cas9的相互作用最小的向导rna的尾部区用5'和3'硫代磷酸酯核苷酸间键修饰。参见例如yin等人,(2017)《自然生物技术》35(12):1179
‑
1187,所述文献出于所有目的整体并入本文。经修饰的向导rna的其它实例在例如wo 2018/107028 a1中提供,所述文献出于所有目的整体并入本文。
[0181]
grna可以通过各种其它方法制备。例如,可以使用例如t7 rna聚合酶通过体外转录制备grna(参见例如wo 2014/089290和wo 2014/065596中,所述文献中的每个文献出于所有目的整体并入本文)。向导rna也可以是通过化学合成制备的合成产生的分子。例如,可以化学合成向导rna以在前三个5'和3'端rna残基处包含2'
‑
o
‑
甲基类似物和3'硫代磷酸酯核苷酸间键。
[0182]
向导rna靶序列。用于向导rna的靶dna包含存在于dna中的核酸序列,grna的dna靶向段将与其结合,前提是存在足够的结合条件。合适的dna/rna结合条件包含细胞中通常存在的生理条件。其它合适的dna/rna结合条件(例如,无细胞系统中的条件)是本领域已知的(参见例如《分子克隆:实验室手册(molecular cloning:a laboratory manual)》,第3版.(sambrook等人,海港实验室出版社(harbor laboratory press)2001),所述文献出于所有目的整体并入本文)。与grna互补并杂交的靶dna链可以被称为“互补链”,并且与“互补链”互补的靶dna链(并且因此不与cas蛋白或grna互补)可以被称为“非互补链”或“模板链”。
[0183]
靶dna包含向导rna与其杂交的互补链上的序列和非互补链上的对应的序列(例如,邻近原间隔子相邻基序(pam))两者。如本文所使用的术语“向导rna靶序列”特指非互补链上的序列,其对应于向导rna在互补链上与其杂交的序列(即,其反向补体)。换句话说,向导rna靶序列是指邻近pam的非互补链上的序列(例如,在cas9的情况下,pam的上游或5')。向导rna靶序列相当于向导rna的dna靶向段,但带有胸腺嘧啶而不是尿嘧啶。作为一个实例,spcas9酶的向导rna靶序列可以指非互补链上的5'
‑
ngg
‑
3'pam上游的序列。向导rna被设计成与靶dna的互补链互补,其中向导rna的dna靶向段与靶dna的互补链之间的杂交促进crispr复合物的形成。不一定需要完全互补性,只要有足够的互补性来引起杂交并促进
crispr复合物的形成。如果在本文中将向导rna称为靶向向导rna靶序列,则意味着向导rna与靶dna的互补链序列杂交,所述互补链序列是向导rna靶序列在非互补链上的反向补体。
[0184]
靶dna或向导rna靶序列可以包括任何多核苷酸,并且可以定位在例如细胞的细胞核或细胞质中或细胞的细胞器内,如线粒体或叶绿体。靶dna或向导rna靶序列可以是细胞内源性或外源性的任何核酸序列。向导rna靶序列可以是对基因产物(例如,蛋白质)进行编码的序列或非编码序列(例如,调控序列)或可以包含两者。
[0185]
由cas蛋白对靶dna的位点特异性结合和切割可以发生在由以下两者确定的位置处:(i)向导rna与靶dna的互补链之间的碱基配对互补性和(ii)短基序,被称为原间隔子相邻基序(pam),位于靶dna的非互补链中。pam可以侧接向导rna靶序列。任选地,向导rna靶序列可以在3'端侧接有pam(例如,对于cas9)。可替代地,向导rna靶序列可以在5'端侧接有pam(例如,对于cpf1)。例如,cas蛋白的切割位点可以是pam序列上游或下游(例如,在向导rna靶序列内)的约1个到约10个或约2个到约5个碱基对(例如,3个碱基对)处。在spcas9的情况下,pam序列(即,非互补链上的pam序列)可以是5'
‑
n1gg
‑
3',其中n1是任何dna核苷酸,并且其中pam紧邻靶dna的非互补链上的向导rna靶序列的3'。如此,对应于互补链上pam的序列(即,反向补体)将是5'
‑
ccn2‑
3',其中n2是任何dna核苷酸并且紧邻靶dna的互补链上的向导rna的dna靶向段与其杂交的序列的5'。在一些此类情况下,n1和n2可以是互补的并且n1‑
n2碱基对可以是任何碱基对(例如,n1=c并且n2=g;n1=g并且n2=c;n1=a并且n2=t;或者n1=t并且n2=a)。在来自金黄色葡萄球菌的cas9的情况下,pam可以是nngrrt或nngrr,其中n可以是a、g、c或t,并且r可以是g或a。在来自空肠弯曲杆菌的cas9的情况下,pam可以是例如nnnnacac或nnnnryac,其中n可以是a、g、c或t,并且r可以是g或a。在一些情况下(例如,对于fncpf1),pam序列可以是5'端上游并具有序列5'
‑
ttn
‑
3'。
[0186]
向导rna靶序列的实例是紧接在spcas9蛋白识别的ngg基序之前的20核苷酸dna序列。例如,向导rna靶序列加pam的两个实例是gn
19
ngg(seq id no:9)或n
20
ngg(seq id no:10)。参见例如wo 2014/165825,所述文献出于所有目的整体并入本文。5'端的鸟嘌呤可以促进细胞中rna聚合酶的转录。向导rna靶序列加pam的其它实例可以包含5'端处的两个鸟嘌呤核苷酸(例如,ggn
20
ngg;seq id no:11)以促进体外t7聚合酶的高效转录。参见例如wo 2014/065596,所述文献出于所有目的整体并入本文。其它向导rna靶序列加上pam可以具有长度介于4
‑
22个核苷酸之间的seq id no:9
‑
11,包含5'g或gg或3'gg或ngg。又其它向导rna靶序列加上pam可以具有长度介于14个与20个核苷酸之间的seq id nos:9
‑
11。
[0187]
与靶dna杂交的crispr复合物的形成可以导致在与向导rna靶序列相对应的区域内或其附近的靶dna的一条链或两条链的切割(即,靶dna的非互补链上的向导rna靶序列和向导rna与其杂交的互补链上的反向补体)。例如,切割位点可以位于向导rna靶序列内(例如,在相对于pam序列的限定位置处)。“切割位点”包含cas蛋白产生单链断裂或双链断裂的靶dna的位置。切割位点可以位于仅一条链上(例如,当使用切口酶时)或位于双链dna的两条链上。切割位点可以在两条链上的相同位置处(产生平端;例如,cas9))或可以在每条链上的不同位点处(产生交错末端(即,突出端);例如,cpf1)。可以例如通过使用两种cas蛋白产生交错末端,其中每一种在不同链的不同切割位点处产生单链断裂,由此产生双链断裂。例如,第一切口酶可以在双链dna(dsdna)的第一链上产生单链断裂,并且第二切口酶可以在dsdna的第二链上产生单链断裂,从而产生突出序列。在一些情况下,第一链上的切口酶
的向导rna靶序列或切割位点与第二链上的切口酶的向导rna靶序列或切割位点相隔至少2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个、25个、30个、40个、50个、75个、100个、250个、500个或1,000个碱基对。
[0188]
c.其它核酸酶试剂
[0189]
任何其它类型的已知的稀有切割核酸酶试剂也可以在本文所公开的方法中使用。这种核酸酶试剂的一个实例是转录激活子样效应子核酸酶(talen)。tal效应子核酸酶是可以用于在dna中的特定靶序列处进行双链断裂的一类序列特异性核酸酶。tal效应子核酸酶是通过将天然的或工程化转录激活子样(tal)效应子或其功能部分融合到核酸内切酶例如foki的催化结构域而产生的。独特的模块化tal效应子dna结合结构域允许设计具有潜在任何给定dna识别特异性的蛋白质。因此,tal效应子核酸酶的dna结合结构域可以被工程化以识别特定的dna靶位点,并且因此用于在期望的靶序列处进行双链断裂。参见wo 2010/079430;morbitzer等人,(2010)《美国国家科学院院刊》107(50):21617
‑
21622;scholze和boch(2010)《毒力(virulence)》1:428
‑
432;christian等人,《遗传学(genetics)》(2010)186:757
‑
761;li等人,(2010)《核酸研究》(2010)39(1):359
‑
372;以及miller等人,(2011)《自然生物技术(nat.biotechnol.)》29:143
‑
148,所述文献中的每个文献出于所有目的整体并入本文。
[0190]
合适的tal核酸酶的实例和用于制备合适的tal核酸酶的方法公开于例如us 2011/0239315、us 2011/0269234、us 2011/0145940、us 2003/0232410、us 2005/0208489、us 2005/0026157、us 2005/0064474、us 2006/0188987和us 2006/0063231中,所述文献中的每个文献出于所有目的整体并入本文。
[0191]
在一些talen中,talen的每个单体包括通过两个高变残基识别单个碱基对的33
‑
35个tal重复序列。talen可以是嵌合蛋白,所述嵌合蛋白包括与如foki核酸内切酶等独立核酸酶可操作地连接的基于tal重复序列的dna结合结构域。例如,核酸酶试剂可以包括第一基于tal重复序列的dna结合结构域和第二基于tal重复序列的dna结合结构域,其中第一和第二基于tal重复序列的dna结合结构域中的每一个与foki核酸酶可操作地连接,其中第一和第二基于tal重复序列的dna结合结构域识别由不同长度(12
‑
20bp)的间隔子序列分开的靶dna序列的每条链中的两个连续靶dna序列,并且其中foki核酸酶亚基二聚化以产生使靶序列上的双链断裂的活性核酸酶。
[0192]
合适的核酸酶试剂的另一个实例是锌指核酸酶(zfn)。在一些zfn中,zfn的每个单体包括3个或更多个基于锌指的dna结合结构域,其中每个基于锌指的dna结合结构域与3bp亚位点结合。在其它zfn中,zfn是包括基于锌指的dna结合结构域的嵌合蛋白,所述结合结构域与如foki核酸内切酶等独立的核酸酶可操作地连接。例如,核酸酶试剂可以包括第一zfn和第二zfn,其中第一zfn和第二zfn各自与foki核酸酶亚基可操作地连接,其中第一zfn和第二zfn识别由约5
‑
7bp间隔子分开的靶dna序列中的每条链中的两个连续靶dna序列,并且其中foki核酸酶亚基二聚化以产生使双链断裂的活性核酸酶。参见例如us 2006/0246567;us 2008/0182332;us 2002/0081614;us 2003/0021776;wo 2002/057308;us 2013/0123484;us 2010/0291048;wo 2011/017293;以及gaj等人,(2013)《生物科技趋势(trends biotechnol.)》31(7):397
‑
405,所述文献中的每个文献出于所有目的整体并入本文。
[0193]
合适的核酸酶试剂的另一种类型是经工程化的大范围核酸酶。大范围核酸酶基于保守序列基序分类为四个家族,这些家族是laglidadg、giy
‑
yig、h
‑
n
‑
h和his
‑
cys盒家族。这些基序参与金属离子的配位和磷酸二酯键的水解。大范围核酸酶因其长的靶序列以及在其dna底物中耐受一些序列多态性而著称。大范围核酸酶结构域、结构和功能是已知的,参见例如guhan和muniyappa(2003)《生物化学与分子生物学评论(crit.rev.biochem.mol.biol.)》38:199
‑
248;lucas等人,(2001)《核酸研究》29:960
‑
9;jurica和stoddard,(1999)《细胞分子生命科学(cell.mol.life sci.)》55:1304
‑
26;stoddard(2006)《生物物理学季评(q.rev.biophys.)》38:49
‑
95;以及moure等人,(2002)《自然结构生物学(nat.struct.biol.)》9:764,所述文献中的每个文献出于所有目的整体并入本文。在一些实例中,使用天然存在的变体和/或工程化衍生的大范围核酸酶。用于修饰动力学、辅因子相互作用、表达、最佳条件和/或靶序列特异性和筛选活性的方法是已知的。参见例如epinat等人,(2003)《核酸研究》31:2952
‑
62;chevalier等人,(2002)《分子细胞(mol.cell)》10:895
‑
905;gimble等人(2003)《分子生物学(mol.biol.)》334:993
‑
1008;seligman等人,(2002)《核酸研究》30:3870
‑
9;sussman等人,(2004)《分子生物学杂志》342:31
‑
41;rosen等人,(2006)《核酸研究》34:4791
‑
800;chames等人,(2005)《核酸研究》33:e178;smith等人,(2006)《核酸研究》34:e149;gruen等人,(2002)《核酸研究》30:e29;chen和zhao(2005)《核酸研究》33:e154;wo 2005/105989;wo 2003/078619;wo 2006/097854;wo 2006/097853;wo 2006/097784;以及wo 2004/031346,所述文献中的每个文献出于所有目的整体并入本文。
[0194]
可以使用任何大范围核酸酶,包含例如i
‑
scei、i
‑
sceii、i
‑
sceiii、i
‑
sceiv、i
‑
scev、i
‑
scevi、i
‑
scevii、i
‑
ceui、i
‑
ceuaiip、i
‑
crei、i
‑
crepsbip、i
‑
crepsbiip、i
‑
crepsbiiip、i
‑
crepsbivp、i
‑
tlii、i
‑
ppoi、pi
‑
pspi、f
‑
scei、f
‑
sceii、f
‑
suvi、f
‑
tevi、f
‑
tevii、i
‑
amai、i
‑
anii、i
‑
chui、i
‑
cmoei、i
‑
cpai、i
‑
cpaii、i
‑
csmi、i
‑
cvui、i
‑
cvuaip、i
‑
ddii、i
‑
ddiii、i
‑
diri、i
‑
dmoi、i
‑
hmui、i
‑
hmuii、i
‑
hsnip、i
‑
llai、i
‑
msoi、i
‑
naai、i
‑
nani、i
‑
nciip、i
‑
ngrip、i
‑
niti、i
‑
njai、i
‑
nsp236ip、i
‑
paki、i
‑
pboip、i
‑
pcuip、i
‑
pcuai、i
‑
pcuvi、i
‑
pgrip、i
‑
pobip、i
‑
pori、i
‑
poriip、i
‑
pbpip、i
‑
spbetaip、i
‑
scai、i
‑
sexip、i
‑
sneip、i
‑
spomi、i
‑
spomcp、i
‑
spomip、i
‑
spomiip、i
‑
squip、i
‑
ssp6803i、i
‑
sthphijp、i
‑
sthphist3p、i
‑
sthphiste3bp、i
‑
tdeip、i
‑
tevi、i
‑
tevii、i
‑
teviii、i
‑
uarap、i
‑
uarhgpaip、i
‑
uarhgpa13p、i
‑
vinip、i
‑
zbiip、pi
‑
mtui、pi
‑
mtuhip pi
‑
mtuhiip、pi
‑
pfui、pi
‑
pfuii、pi
‑
pkoi、pi
‑
pkoii、pi
‑
rma43812ip、pi
‑
spbetaip、pi
‑
scei、pi
‑
tfui、pi
‑
tfuii、pi
‑
thyi、pi
‑
tlii、pi
‑
tliii或其任何活性变体或片段。
[0195]
大范围核酸酶可以识别例如12个到40个碱基对的双链dna序列。在一些情况下,大范围核酸酶识别基因组中一个完美匹配的靶序列。一些大范围核酸酶是归巢核酸酶。归巢核酸酶的一种类型是归巢核酸酶的laglidadg家族,包含例如i
‑
scei、i
‑
crei和i
‑
dmol。
[0196]
viii.选择盒
[0197]
任何合适的选择盒可以在本文所描述的方法中使用。术语选择盒是指包括一个或多个表达控制序列(例如,用于在细菌细胞中表达的启动子和/或其它调控序列,如增强子、转录后调控元件和poly(a)序列)的表达盒,所述一个或多个表达控制序列与对可选择标志物进行编码的核酸可操作地连接。选择盒可以允许在细菌细胞中进行选择,或者其可以允
许在细菌和真核或哺乳动物细胞两者中进行选择。作为一个实例,可以使用如新霉素磷酸转移酶等基因。新霉素磷酸转移酶赋予原核细胞中的卡那霉素抗性和真核细胞中的g418抗性。这种基因可以与例如组合真核启动子(例如,真核磷酸甘油酸激酶(pgk)启动子)和原核启动子(例如,原核em7启动子)的双启动子系统组合使用。
[0198]
可以在本文所描述的方法中使用的一些选择盒可以赋予对抗生素的抗性,否则所述抗生素将杀伤或抑制细菌细胞的生长。例如,选择盒可以赋予对卡那霉素、大观霉素、链霉素、氨苄青霉素、羧苄青霉素、博来霉素、红霉素、多粘菌素b、四环素或氯霉素的抗性。赋予对这些抗生素和其它抗生素抗性的这种选择盒和基因是众所周知的。可以通过用抗生素处理细胞来选择包括选择盒的细胞。那些对抗生素具有抗性的细胞包括选择盒。
[0199]
其它选择盒可以包括可以用于选择包括预期修饰的细胞的报告基因。术语报告基因是指具有对基因产物(通常是酶)进行编码的序列的核酸,当将包括与异源启动子和/或增强子元件可操作地连接的报告基因序列的构建体引入到细胞中时,所述基因产物易于测定且定量测定含有(或可以制备成含有)启动子和/或增强子元件激活所必需的因子。报告基因的实例包含但不限于对荧光蛋白进行编码的基因。报告蛋白是指由报告基因编码的蛋白质。
[0200]
荧光报告蛋白是基于荧光可检测的报告蛋白,其中荧光可以直接来自报告蛋白、报告蛋白在荧光底物上的活性、或针对与荧光标记的化合物的结合具有亲和力的蛋白质。荧光蛋白的实例包含绿色荧光蛋白(例如,gfp、gfp
‑
2、taggfp、turbogfp、egfp、emerald、azami绿、monomer azami绿、copgfp、acegfp和zsgreenl)、黄色荧光蛋白(例如,yfp、eyfp、柠檬黄、venus、ypet、phiyfp和zsyellowl)、蓝色荧光蛋白(例如,bfp、ebfp、ebfp2、石青、mkalamal、gfpuv、天蓝色和t
‑
天蓝色)、青色荧光蛋白(例如,cfp、ecfp、蔚蓝色、cypet、amcyanl和midoriishi
‑
青色)、红色荧光蛋白(例如,rfp、mkate、mkate2、mplum、dsred单体、mcherry、mrfp1、dsred
‑
表达、dsred2、dsred
‑
单体、hcred
‑
tandem、hcredl、asred2、eqfp611、mraspberry、mstrawberry和jred)、橙色荧光蛋白(例如,morange、mko、kusabira
‑
橙色、单体kusabira
‑
橙色、mtangerine和tdtomato),以及可以通过流式细胞术方法检测到存在于细胞中的任何其它合适的荧光蛋白。可以例如通过分选包括由基因编码的荧光报告蛋白的细胞来选择包括荧光报告基因的细胞。
[0201]
ix.靶向修饰
[0202]
可以使用本文所描述的方法引入各种类型的靶向基因修饰。此类靶向基因修饰可以包含例如一个或多个核苷酸的插入、一个或多个核苷酸的缺失或一个或多个核苷酸的取代(置换)。此类插入、缺失或置换可以导致例如点突变、所关注的核酸序列或其部分的敲除、所关注的核酸序列或其部分的敲入、用异源或外源核酸序列置换内源核酸序列、用同源或直系同源核酸序列置换内源核酸序列(例如,结构域交换、外显子交换、内含子交换、调控序列交换或基因交换)、调控元件(例如,启动子或增强子)的改变、错义突变、无义突变、移码突变、截短突变、无效突变或其组合。例如,可以改变(例如,缺失、插入或取代)至少1个、2个、3个、4个、5个、7个、8个、9个、10个或更多个核苷酸以形成靶向基因修饰。如本文其它地方所公开的,缺失、插入或取代可以是任何大小。参见例如wang等人,(2013)《细胞》153:910
‑
918;mandalos等人,(2012)《公共科学图书馆综合》7:e45768;以及wang等人,(2013)《自然生物技术》31:530
‑
532,所述文献中的每个文献整体并入本文。
[0203]
缺失、插入或置换可以是任何长度。缺失、插入或置换的核酸可以是例如约1bp到约5bp、约5bp到约10bp、约10bp到约50bp、约50bp到约100bp、约100bp到约200bp、约200bp到约300bp、约300bp到约400bp、约400bp到约500bp、约500bp到约1kb、约1kb到约5kb、约5kb到约10kb、约10kb到约20kb、约20kb到约40kb、约40kb到约60kb、约60kb到约80kb、约80kb到约100kb、约100kb到约150kb或约150kb到约200kb、约200kb到约300kb、约300kb到约400kb或约400kb到约500kb。
[0204]
出于所有目的,上文或下文引用的所有专利申请、网站、其它公开、登录号等都以全文引用的方式并入,其程度如同每个单独的项目被单独并且具体地指出通过引用的方式并入。如果序列的不同版本与不同时间的登录号相关联,则意指在本技术的有效提交日期与所述登录号相关联的版本。有效提交日期是指实际提交日期或提及登录号的优先权申请的提交日期(在适用情况下)中较早的日期。同样,如果公开、网站等的不同版本在不同时间发布,除非另有说明,否则指在申请的有效提交日期最近发布的版本。除非另外具体说明,否则本发明的任何特征、步骤、元件、实施例或方面都可以与任何其它特征、步骤、元件、实施例或方面结合使用。尽管为了清楚和理解起见,已通过图解和实例方式详细地对本发明进行了描述,但显而易见的是,可以在所附权利要求的范围内进行某些改变和修改。
[0205]
序列简要说明
[0206]
使用核苷酸碱基的标准字母缩写和氨基酸的三字母代码示出随附序列表中列出的核苷酸和氨基酸序列。核苷酸序列遵循从序列的5'端开始并且向前(即,在每行中从左到右)到达3'端的标准惯例。每个核苷酸序列仅示出一条链,但任何提及的显示链均应理解为包含互补链。当提供对氨基酸序列进行编码的核苷酸序列时,应理解还提供了对相同氨基酸序列进行编码的其密码子简并变体。氨基酸序列遵循从序列的氨基末端开始并且向前(即,在每行中从左到右)到达羧基末端的标准惯例。
[0207]
表2:序列说明。
[0208]
seq id no类型描述1蛋白质cas9蛋白2dnacas9 dna3rnacrrna尾部4rnatracrrna5rnagrna支架v16rnagrna支架v27rnagrna支架v38rnagrna支架v49dna向导rna靶序列加pam v110dna向导rna靶序列加pam v211dna向导rna靶序列加pam v312rnatracrrnav213rnatracrrnav314rnagrna支架v515rnagrna支架v6
16rnagrna支架v7
[0209]
实例
[0210]
实例1:通过细菌同源重组和分子内gibson组装在大靶向性载体中无瘢痕引入靶向修饰
[0211]
gibson组装技术将具有同源末端的dna段连接成单个分子。其不同于由限制酶产生的互补交错末端之间的传统连接,因为可以使用任何最小大小的互补序列。由于通过限制性位点克隆通常导致外源dna瘢痕(酶识别位点)结合到最终产物中,因此gibson组装是有利的,因为其可以是无缝的。
[0212]
gibson组装反应是等温的,并且涉及三种不同的酶:t5核酸外切酶、dna聚合酶和连接酶。参见例如us 2010/0035768、us 2015/0376628、wo 2015/200334和gibson等人,(2009)《自然
‑
方法》6(5):343
‑
345,所述文献中的每个文献出于所有目的整体并入本文。由于通过t5核酸外切酶实现的5'到3'核酸外切酶活性,反应开始于单链dna末端的产生。具有互补单链末端的dna片段然后通过简单的碱基配对规则对齐,并且dna聚合酶填充从5'到3'移动的缺口。dna连接酶密封最后的切口,并且结果是无缝的双链dna分子。四十个碱基对的互补末端已被证明是有效的,并且实际序列通常并不重要。起始片段可以通过pcr、限制性或直接合成产生。
[0213]
在创建转基因动物系时,无缝dna构建尤其重要,因为由限制位点或其它操纵产生的瘢痕如果落在对调控很重要的区域,可能对基因表达产生负面影响。靶向哺乳动物基因组通常需要构建具有长dna臂的大靶向性载体以指导同源重组,以及用于选择胚胎干细胞克隆的抗生素抗性盒。正确靶向的克隆体通常含有构建载体所需的多个瘢痕,更不用说抗性盒本身了。对于基因消融,这些病变可能与最终结果(无效等位基因)无关,但相邻基因的表达总是有可能受到不利影响。对于敲除以外的修饰,如敲入(例如,报告基因或突变等位基因),靶向基因座的可靠表达通常对所讨论的研究很重要。gibson组装可以消除对其中一些瘢痕的需要,并且甚至在一些情况下促进载体本身的构建,但可能很难找到独特的限制位点。
[0214]
人源化,即用人对应物直接置换小鼠基因,具体地需要小鼠与人序列之间的无缝连接,以便小鼠转录机制能够可靠地复制新等位基因的表达。必须注意在不影响基因调控的非编码区域中掩埋构建瘢痕和选择盒。随着动物模型变得越来越复杂,可以在现有模型之上添加更多修饰,如在人源化等位基因上添加人致病突变。另外的变化然后可以向已经高度工程化的小鼠基因座添加甚至更多的瘢痕和另一个选择盒,从而增加表达被改变的可能性,并且小鼠模型对于人类疾病将不可靠。从构建的角度来看,即使两个盒对不同的选择进行编码,由于共享盒元件如启动子和poly(a)信号之间的不期望的重组,将新盒添加到已经含有一个盒的载体可能会变得复杂。
[0215]
鉴于这些障碍,开发了一些方法来简化产生携带多种变化的靶向性载体,如人源化等位基因和层置在顶部的疾病突变。这些方法使构建更容易,并使结合到最终动物模型中的瘢痕最小化。
[0216]
在第一种方法中,合成侧接有短(<500bp)同源臂的一小段携带期望突变的dna。在期望的突变下游的若干个碱基对,选择并复制40
‑
50个碱基对区域,以产生同向重复序列,以侧接与抗性盒侧接的稀有限制性位点或cas9向导rna靶序列。然后通过重组工程技术将
此小构建体与已建立的小鼠靶向性载体(如人源化靶向性载体,具有自己的抗性盒)进行同源重组。在确认期望的突变被结合后,用稀有切割器/cas9向导切割新载体,去掉盒并暴露40
‑
50个碱基对同向重复序列。gibson组装然后在分子内反应中无缝密封断裂。所得靶向性载体现在携带期望的突变,并且除了最初存在于人源化中的那些之外,没有另外的瘢痕或盒。
[0217]
在具体的实例中,产生了等位基因,所述等位基因将点突变结合到包括人源化靶基因1的靶向性构建体(大靶向性载体)中。参见图1。目标是高效且无缝地产生包括具有点突变的人源化靶基因1的大靶向性载体,而不必重新靶向包括人源化靶基因1的人源化小鼠胚胎干(es)细胞,以便在那些人源化小鼠es细胞中引入点突变。初始靶向性构建体含有从起始密码子到终止密码子的人靶基因1基因组序列,包含所有内含子,以置换从起始密码子到终止密码子的对应的小鼠靶基因1的小鼠基因组序列。另外,靶向性构建体中的插入核酸包括poly(a)序列下游的自缺失潮霉素抗性盒。然后如上文所描述的用点突变和正好在点突变下游的新霉素抗性盒修饰此起始人源化载体,所述新霉素抗性盒侧接有asci限制性位点和人靶基因1序列的50个碱基对同向重复序列。然后合成核酸以包括侧接有稀有限制性位点(asci)的em7新霉素盒和来自要引入突变的外显子的50bp同向重复序列以及上游和下游同源框,包含上游同源框中的要引入的突变。参见图2。将新霉素抗性盒插入到外显子的中间进行突变,但由于方法是无缝的,因此在方法结束时重演了外显子。用hindiii通过切割使核酸线性化,并使用细菌同源重组将线性化合成核酸插入到包括人源化靶基因1的大靶向性载体中。参见例如us 2004/0018626和valenzuela等人,(2003)《自然生物技术》21(6):652
‑
659,所述文献中的每个文献整体并入本文。将新霉素盒用asci切除,这去掉了新霉素盒并暴露同向重复序列。然后通过分子内gibson组装重新密封构建体,这将同向重复序列分解为单个拷贝,使外显子(现在包括突变)完好无损,没有瘢痕。在gibson组装之后,再次用asci消化反应,以切割在gibson组装期间未缺失asci位点的任何内容,由此减少背景。最终测序证实了点突变的存在,并且原始靶向性载体没有另外的变化。将新的经修饰的载体电穿孔到小鼠胚胎干细胞中,并且通过taqman鉴定阳性克隆,然后进行桑格测序(sanger sequencing)以确认点突变的掺入。
[0218]
实例2:通过细菌同源重组和分子间gibson组装在大靶向性载体中无瘢痕引入靶向修饰
[0219]
在第二种方法中,通过两个通用步骤将期望的突变引入到细菌人工染色体(bac)dna中。在第一步中,使用在每一侧侧接有稀有切割限制酶位点的选择盒通过细菌同源重组使bac中的所关注的区域(突变的每一侧跨度约100
‑
200bp的区域)缺失。在第二步中,将bac缺失通过gibson组装用期望的突变序列使用约200
‑
500bp的dna片段置换,所述dna片段具有与邻近稀有切割位点的靶向bac序列同源的异源5'端和3'端。为此,第一步中的靶向bac是用稀有切割酶消化的,从而暴露与突变片段同源的所述两个末端。限制酶还可以保持靶向bac开放,从而无需添加选择标志物即可进行低背景反应。参见图3。例如,当需要将无法通过pcr获得的较大片段(例如,15kb或30kb)插入到构建体中时,此方法尤其有益。例如,此类大片段可以像bac一样从其来源切割(例如,使用crispr/cas9),并且然后使用gibson组装插入经修饰的携带此片段的5'端和3'端的同源物的bac,由此产生最终的靶向性构建体。
[0220]
在具体实例中,此方法用于将剪接突变引入到包括人源化靶基因2的大靶向性载
体中。初始靶向性构建体含有野生型靶基因2基因组序列,包含内含子,旨在置换小鼠靶基因2从起始密码子到最后一个外显子之前的对应的基因组序列,包含在内含子中添加自缺失新霉素抗性盒。此起始人源化载体然后如上文所描述的用潮霉素抗性盒进行修饰,所述潮霉素抗性盒侧接有asci限制性位点和期望的剪接突变下游和上游的四十个碱基对同源序列。将潮霉素盒用asci切除,并将构建体用包括剪接突变的dna片段通过分子间gibson组装重新密封,所述dna片段侧接有与邻近稀有切割位点的靶向靶向性构建体序列同源的异源5'端和3'端。最终测序证实了剪接突变的存在,并且原始靶向性载体没有另外的变化。将新的经修饰的载体电穿孔到小鼠胚胎干细胞中,并且通过taqman鉴定阳性克隆,然后进行桑格测序以确认剪切突变的掺入。
[0221]
在第三种方法中,使用crispr/cas9从细菌人工染色体(bac)中切下人dna片段。此人dna片段通过gibson组装与先前用选择盒靶向的小鼠bac融合。在要整合人片段的区域设计了稀有切割限制酶位点。在靶向小鼠bac中,此稀有切割限制位点的每一侧都有40bp的同源序列。同源序列与人dna片段的5'端和3'端同源。在与原始小鼠bac靶向相同的抗生素中选择最终构建体。即使在最终的gibson组装反应中没有结合新的选择,也观察到低背景。在gibson组装之后添加稀有限制酶可以将背景保持在低水平。
[0222]
在具体实例中,上述实验是将包括靶基因3的对靶蛋白3的胞外结构域进行编码的区域的等位基因整合到小鼠靶基因3中。初始靶向性构建体含有野生型小鼠靶基因3基因组序列,包含内含子。通过细菌同源重组添加自缺失新霉素抗性盒,从而使小鼠靶基因3胞外结构域编码区缺失。在新霉素抗性盒上游,存在将与人片段相互作用的人同源物的5'和3'40bp区域分开的sgrdi限制性位点。所有这些序列都通过先前描述的细菌同源重组并入。通过crispr/cas9从人bac上切下长度为32kb的人dna片段,使5'端和3'端暴露,以用于与通过sgrdi消化打开的小鼠靶向bac进行分子内gibson组装反应。将新的经修饰的载体电穿孔到小鼠胚胎干细胞中,并且通过taqman鉴定阳性克隆。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。