1.本发明属于生物化学制药技术领域,具体涉及从蝇蛆中提取高活性蛆激酶的方法。
背景技术:
2.正常情况下,身体内止血调节机制与抗凝机制相互拮抗,当机体调节机制发生病变时,过量的凝血酶生成,使纤维蛋白沉积,从而引发体内血栓形成。血栓作为常见的心脑血管病,会诱发心肌梗死、缺血性脑梗死、冠状动脉硬化性心脏病等症状,严重威胁人们身体健康,每年死于脑梗塞、脑溢血、心肌梗死的病人达数百万。
3.目前常用的抗血栓药物主要分为3类:一是抗血小板类药物;二是抗凝血药物如肝素、维生素k拮抗剂等;三是溶血栓药物。溶栓药物具有溶解血栓速度快,且副作用小的优势,成为血栓类疾病治疗的重要手段。溶栓酶可以通过以下途径发挥溶栓作用:1、降低纤维蛋白原含量,抑制纤维蛋白原生成纤维蛋白;2、直接水解纤维蛋白原和纤维蛋白(溶酶);3、激活纤溶系统,促进纤溶酶原转化为纤溶酶,促进血管内皮细胞产生组织纤溶酶原激活剂(t
‑
pa),抑制纤溶酶原激活物抑制剂(pai)生成,增强内源纤溶活力(激酶)。自然界资源是获取溶栓药物的天然宝库,目前溶栓酶的来源较为广泛,微生物、植物、动物中可分离得到具有溶血栓活性的物质。常见的纳豆激酶,是在纳豆发酵过程中由纳豆枯草杆菌产生的一种丝氨酸蛋白酶,具有降解血栓、软化血管的功能;从健康人尿中分离的尿激酶,不仅能降解纤维蛋白凝块,亦能降解血循环中的纤维蛋白原、凝血因子
ⅴ
和凝血因子
ⅷ
等;以及临床广泛使用的蚓激酶,也具有溶栓作用,可用于冠心病心绞痛、脑梗塞的治疗。研究报道水蛭、蝙蝠、蛇毒中也可作为溶栓酶提取的原料。
4.但利用纳豆生产的纳豆激酶由于野生型纳豆芽孢杆菌的纳豆激酶含量不高,由此得到的纳豆激酶的生产方法亦不够理想;尿激酶由于收集尿液、储运、消臭等程序,对环境卫生造成不良的后果,影响周边居民的生活;蚓激酶则需要从特殊种类的蚯蚓中提取。
5.因此,仍然需要寻找新的溶栓酶提取来源,以能够高产量地提取高活性的溶栓酶。
技术实现要素:
6.为解决现有技术中存在的问题,本发明提供以下技术方案:
7.一方面,本发明提供蛆激酶的制备方法,其特征在于包括以下步骤:
8.a.将原料洗净,加入匀浆剂后进行匀浆;
9.b.对匀浆液进行离心,收集上清液a;
10.c.在上清液a中加入硫酸铵饱和度达到25%
‑
35%,静置,析出蛋白沉淀,离心,收集上清液b;
11.d.在上清液b中补充硫酸铵至65%
‑
75%饱和度,静置,离心,弃上清,收集沉淀;
12.e.沉淀用溶剂溶解,得到溶液c;
13.f.对溶液c进行透析或超滤,除去溶液c中盐离子,至电导率低于200μs/cm,得到溶
液d;
14.g.调节溶液d为ph 4
‑
8,得到溶液e;
15.h.溶液e用滤膜过滤,进行层析,目标蛋白吸附在离子交换层析柱上;
16.i.用洗脱液洗脱层析柱,收集有活性的洗脱峰溶液f;
17.j.对溶液f进行透析或超滤,除去溶液f中盐离子,得到溶液g;
18.k.溶液g浓缩,冷冻干燥,得到蛆激酶粗品;
19.l.蛆激酶的精制:将步骤j获得的溶液g平衡至ph6.5
‑
8,利用含有丝氨酸蛋白酶吸附配体的填料对溶液g中蛆激酶进行亲和吸附,利用洗脱液洗脱,获得有活性的洗脱液h;
20.m:对溶液h进行透析或超滤,除去溶液h中盐离子,得到溶液i;
21.n:将溶液i浓缩,冷冻干燥,得到蛆激酶精制品。
22.在一些实施方案中,步骤a中所述原料为蝇蛆,优选家蝇科和丽蝇科幼虫,更优选家蝇和大头金蝇的幼虫。
23.在一些实施方案中,步骤a中所述匀浆剂选自蒸馏水和pbs缓冲液。
24.在一些实施方案中,步骤e中,所述溶剂选自蒸馏水和pbs缓冲液。
25.在一些实施方案中,步骤f、j、m中,进行透析的透析膜截留分子量小于3000,超滤膜截留分子量小于3000。
26.在一些实施方案中,步骤g中,采用柠檬酸缓冲液或pbs缓冲液调节ph。
27.在一些实施方案中,步骤h中,滤膜的大小为0.20μm或0.45μm。
28.在一些实施方案中,步骤h中,所述层析柱选自cm
‑
52、deae
‑
32、和deae
‑
52。
29.在一些实施方案中,步骤i中,所述洗脱液选自nacl、含nacl的甘氨酸盐缓冲液和kcl。
30.在一些实施方案中,步骤i中,所述洗脱液的浓度为0.5
‑
2m。
31.在一些实施方案中,步骤k、n中,溶液g的浓缩方法包括利用超滤装置截留2000
‑
50000分子量的物质,进行浓缩,或利用peg12000进行浓缩。
32.在一些实施方案中,步骤f、j、m中透析或超滤的透析膜或超滤膜相同或不同。
33.在一些实施方案中,步骤l的亲和层析填料接枝有选自以下任意一种的配体:苯甲脒、对氨基苯甲脒、对氨基苯脒盐酸盐、精氨酸、慈菇蛋白酶抑制剂、大豆胰蛋白酶抑制剂和卵黏蛋白。
34.在一些实施方案中,蛆激酶的精制方法包括:利用苯甲脒作为亲和层析柱,对样品进行精制、纯化;将溶液g平衡至ph=7.4,用0.45μm滤膜过滤溶液g,滤液用苯甲脒脂糖凝胶4ff进行亲和吸附,收集洗脱峰h,其中,平衡液为0.1m ph7.4 pbs,含0.05m nacl;洗脱液为50mm
‑
ph3甘氨酸盐酸缓冲液含0.5m nacl;
35.在一些实施方案中,蛆激酶的精制方法包括:用卵黏蛋白亲和层析柱纯化,将溶液g,用0.1m ph 8tris
‑
hcl缓冲液平衡,利用卵黏蛋白层析柱进行亲和吸附,用洗脱液(洗脱液为0.1m ph2.5甲酸溶液含0.5m kcl)洗脱亲和层析柱上吸附的蛋白,收集具有活性的洗脱峰h。
36.另一方面,本发明提供根据上述方法制备的蛆激酶。
37.另一方面,本发明提供根据上述方法制备的蛆激酶在制备溶栓药物中的用途。
38.另一方面,本发明提供根据上述方法制备的蛆激酶在制备预防或治疗血栓相关疾
病的药物中的用途。
39.在一些实施方案中,所述血栓相关疾病包括但不限于冠状动脉硬化性心脏病,血栓性静脉炎,血流淤滞,肠系膜动静脉血栓和脑血栓。
40.在一些实施方案中,所述血栓相关疾病选自冠状动脉硬化性心脏病,血栓性静脉炎,血流淤滞,肠系膜动静脉血栓和脑血栓。
41.另一方面,本发明提供药物组合物,其特征在于,所述药物组合物包括根据上述方法制备的溶栓酶和药学上可接受的载体。
42.在一些实施方案中,所述药物组合物的递送方式包括但不限于全身施用、非胃肠施用(包括血管内、肌内、动脉内施用)、口服施用、局部施用、口腔施用、直肠施用、阴道施用、皮下施用、腹膜内施用、手术植入和局部注射。
43.在一些实施方案中,所述药物组合物的递送方式选自全身施用、非胃肠施用(包括血管内、肌内、动脉内施用)、口服施用、局部施用、口腔施用、直肠施用、阴道施用、皮下施用、腹膜内施用、手术植入和局部注射。
44.另一方面,本发明提供治疗血栓的方法,所述方法包括向受试者施用有效量的根据上述方法制备的蛆激酶。
45.在一些实施方案中,所述受试者选自脊椎动物和无脊椎动物。
46.定义
47.蛆激酶:本发明从蝇蛆中提取具有溶栓能力的蛋白,命名为蛆激酶。依据国家药品标准ws1
‑
(x
‑
052)
‑
2001z评价标准,本发明中的蛆激酶具有将纤维蛋白及纤维蛋白原降解的高活力,属于溶栓酶。
48.有益效果
49.(1)首次从蝇蛆中分离得到高活性蛆激酶,为首创性工作,为新溶栓酶的开发提供了物质基础。
50.(2)通过系统实验发现该蛆激酶为丝氨酸蛋白酶,为该蛆激酶精制纯化提供了科学基础。
51.(3)建立了从蝇蛆中分离高活性蛆激酶的技术工艺,为从该昆虫中溶栓酶的生产提供了基础。
52.(4)蝇蛆容易养殖,生产出的蛆激酶活性高、成本低,可为后续高活性、低价格溶栓酶制备提供基础,具有重大社会价值。
附图说明
53.图1示出了离子交换层析洗脱图。提取液通过cm52层析柱吸附蛆激酶,利用nacl进行洗脱,横坐标为时间,纵坐标为洗脱液紫外吸收峰。
54.图2示出了亲和吸附洗脱图。酶液利用苯甲脒亲和层析柱进行亲和纯化,洗脱峰为高纯度蛆激酶,纵坐标为产物紫外吸收峰。
55.图3示出了酶活力评价。酶纤活力测定,参照国家食品药品监督管理局国家药典委员会审定国家药品标准ws1
‑
(x
‑
052)
‑
2001z。以蚓激酶标准品为阳性对照,以生理盐水为阴性对照;用游标卡尺测量溶圈的垂直两直径,测定酶活力。
①
实施例1制备的蛆激酶溶栓效果;
②
实施例2制备的蛆激酶溶栓效果;
③
实施例3制备的蛆激酶溶栓效果;
④
实施例4制备
的蛆激酶溶栓效果;
⑤
实施例5制备的蛆激酶溶栓效果;
⑥
实施例6制备的蛆激酶溶栓效果。
56.图4示出了蛋白sds电泳图。
①
、
④
泳道均为蛋白电泳marker样品,
②
泳道为实施例6中用苯甲脒精制蛆激酶,
③
泳道为实施例7中用卵黏蛋白精制蛆激酶。
57.图5示出了蛆激酶降解纤维蛋白原的sds电泳图。1
‑
6号泳道分别为实施例7蛆激酶与纤维蛋白原反应15min、30min、1h、1.5h、2h和24h后,被降解的纤维蛋白原的电泳图。
具体实施方式
58.为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
59.实施例1蛆激酶的制备
60.取新鲜冷冻家蝇幼虫100g,用水洗净,加入500ml蒸馏水,进行匀浆,8000r/min离心除去底部沉淀,收集上清液a,除去不溶的杂质沉淀,并将蛆激酶溶解在上清中。
61.加入硫酸铵使溶液a中硫酸铵饱和度达到30%。静置4h,待蛋白沉淀析出,进行离心8000r/min,收集上清液b。利用盐析的方法将杂蛋白分离出去,蛆激酶位于上清中。
62.往收集的上清液b再补充硫酸铵至75%饱和度,静置,离心7000r/min,弃上清,收集沉淀,沉淀用纯净水溶解,得到沉淀的水溶液c。利用盐析的方法将上清中的蛆激酶沉淀出来,并用水将沉淀(沉淀中含有蛆激酶)溶解,获得含蛆激酶的水溶液c。
63.将水溶液c进行透析或超滤,除去溶液c中盐离子,至电导率50μs/cm,得到溶液d,为后续离子交换层析做准备。
64.将溶液d置于ph=4,10mm柠檬酸缓冲液中进行平衡得到溶液e。
65.溶液e用0.45μm滤膜过滤,上cm52阳离子层析柱,进行层析分离,目标蛋白吸附在cm52上。
66.用含0.5m nacl的柠檬酸缓冲液(ph=4,10mm)进行洗脱,收集有活性的洗脱峰溶液f。
67.将收集的溶液f进行透析(截留分子量为2kd),除去溶液f中盐离子,得到溶液g。
68.溶液g用peg12000浓缩,冷冻干燥,得到粗酶0.381g(381mg)。酶的溶纤活力测定,参照国家食品药品监督管理局国家药典委员会审定国家药品标准ws1
‑
(x
‑
052)
‑
2001z,进行活力测定,测定酶比活为:15439u/mg。
69.溶纤活力测定:取纤维蛋白原溶液39ml(每1ml中含1.5mg的可凝蛋白溶液),置烧杯中,边搅拌边加入55℃琼脂糖溶液39ml、凝血酶溶液3.0ml(每1ml中含1bp单位的溶液),立即混匀,快速倒入直径14cm塑料培养皿中,室温水平放置1小时,打孔。精密量取不同浓度的蚓激酶标准品溶液及供试品溶液,分别点在同一平皿中,加盖,置37℃恒温箱中反应18小时。取出后用卡尺测量溶圈垂直两直径,以蚓激酶标准品单位数的对数为横坐标,垂直两直径乘积的对数为纵坐标,计算回归方程,将供试品垂直两直径乘积的对数代入回归方程,计算供试品效价单位数。
70.sds
‑
page电泳方法
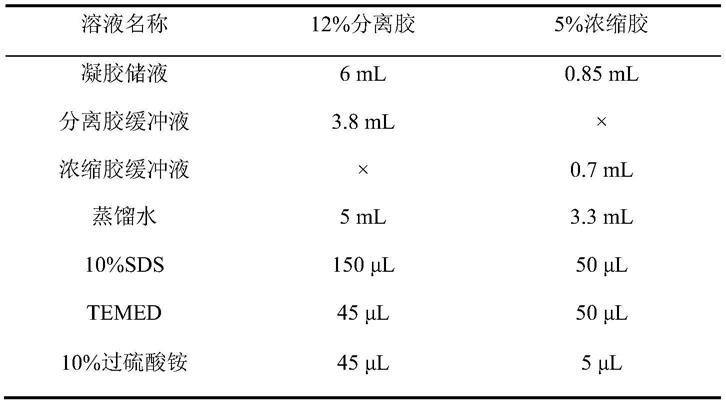
71.产物进行蛋白质电泳,分离胶、浓缩胶配方如下;电泳条件:电压调至约80v保持恒压。待溴酚蓝标记移动进浓缩胶胶内时,电压调至约120v保持恒压。
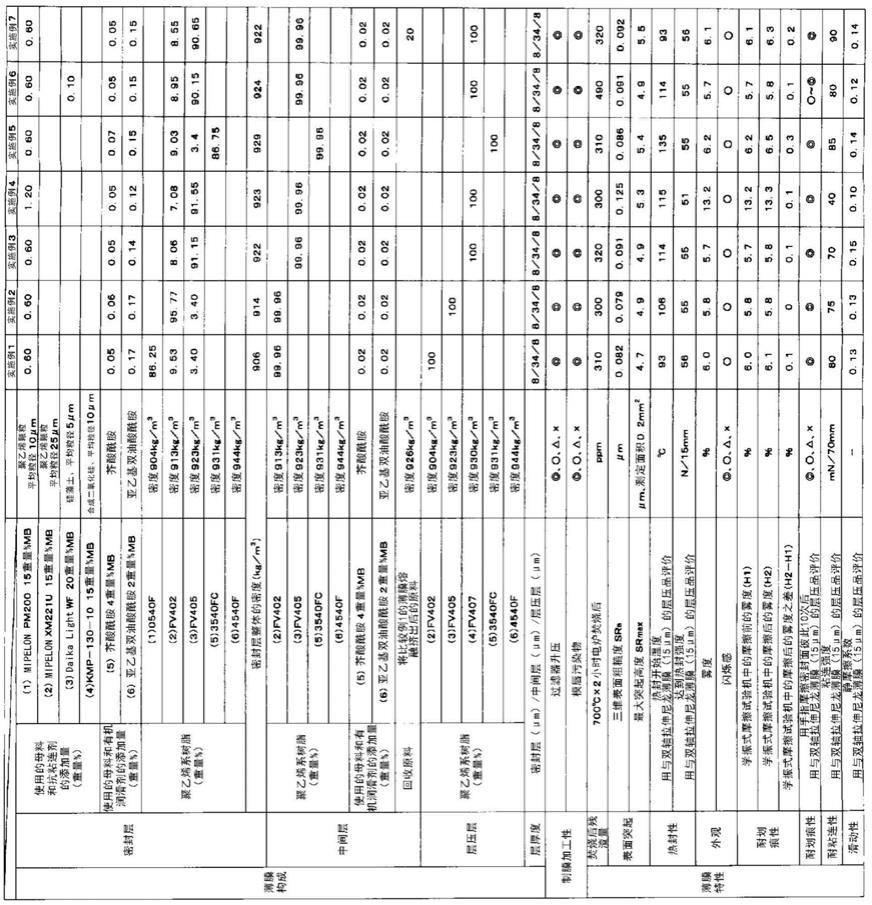
72.表1分离胶、浓缩胶配方
[0073][0074]
实施例2蛆激酶的制备
[0075]
取新鲜家蝇幼虫100g,用水洗净,加入800ml蒸馏水,进行匀浆,8000r/min离心除去底部沉淀,收集上清液a。
[0076]
加入硫酸铵使溶液a中硫酸铵饱和度达到25%。静置4h,待蛋白沉淀析出,进行离心8000r/min,收集上清液b。
[0077]
往收集的上清液b再补充硫酸铵至70%饱和度,静置,离心8000r/min,弃上清,收集沉淀,沉淀用纯净水溶解,得到沉淀的水溶液c。
[0078]
将水溶液c进行透析或超滤,除去溶液c中盐离子,至电导率90μs/cm,得到溶液d。
[0079]
将溶液d置于ph=5(调节ph=5,使溶液中蛆激酶带上正电荷,为下一步离子交换层析做准备),10mm柠檬酸缓冲液中进行平衡得到溶液e。
[0080]
溶液e用0.45μm滤膜过滤,上cm52阳离子层析柱,进行层析分离,目标蛋白吸附在cm52上。
[0081]
用含0.5m nacl的柠檬酸缓冲液(ph=5,10mm)进行洗脱,收集有活性的洗脱峰溶液f。
[0082]
将收集的溶液f进行透析或超滤,除去溶液f中盐离子,得到溶液g。
[0083]
溶液g用超滤装置进行浓缩(截留分子量为3000~50000),冷冻干燥,得到蛆激酶粗酶0.225g(225mg)。溶纤活力测定,参照国家食品药品监督管理局国家药典委员会审定国家药品标准ws1
‑
(x
‑
052)
‑
2001z,进行溶纤活力测定,测定酶比活为:28363u/mg(
‑
20℃保存)。
[0084]
实施例3蛆激酶的制备
[0085]
取新鲜冷冻家蝇幼虫100g,用水洗净,加入1600ml蒸馏水,进行匀浆,8000r/min离心除去底部沉淀,收集上清液a。
[0086]
加入硫酸铵使溶液a中硫酸铵饱和度达到35%。静置4h,待蛋白沉淀析出,进行离心8000r/min,收集上清液b。
[0087]
往收集的上清液b再补充硫酸铵至70%饱和度,静置,离心8000r/min,弃上清,收集沉淀,沉淀用纯净水溶解,得到沉淀的水溶液c。
[0088]
将水溶液c进行透析或超滤,除去溶液c中盐离子,至电导率70μs/cm,得到溶液d。
[0089]
将溶液d置于ph=6,10mm pbs缓冲液中进行平衡得到溶液e。
[0090]
溶液e用0.45μm滤膜过滤,上cm52阳离子层析柱,进行层析分离,目标蛋白吸附在cm52上。
[0091]
用含0.5m nacl的pbs缓冲液(ph=6,10mm)进行洗脱,收集有活性的洗脱峰溶液f。将收集的溶液f用3kd滤膜超滤,除去溶液f中盐离子,得到截留溶液g。
[0092]
溶液g用12000peg浓缩,冷冻干燥,得到蛆激酶粗酶0.148g(148mg)。溶纤活力测定,参照国家食品药品监督管理局国家药典委员会审定国家药品标准ws1
‑
(x
‑
052)
‑
2001z,进行活力测定,测定酶比活为:29885u/mg。
[0093]
实施例4蛆激酶的制备
[0094]
(1)取新鲜冷冻家蝇幼虫100g,用水洗净,加入1600ml蒸馏水,进行匀浆,滤膜过滤,收集滤液a。
[0095]
(2)加入硫酸铵使溶液a中硫酸铵饱和度达到30%。静置4h,待蛋白沉淀析出,进行离心8000r/min,收集上清液b。
[0096]
(3)往收集的上清液b再补充硫酸铵至70%饱和度,静置,离心8000r/min,弃上清,收集沉淀,沉淀用纯净水溶解,得到沉淀的水溶液c。
[0097]
(4)将水溶液c进行透析或超滤,除去溶液c中盐离子,至电导率70μs/cm,得到溶液d。
[0098]
(5)将溶液d置于ph=7,10mm pbs缓冲液中进行平衡得到溶液e。
[0099]
溶液e过滤,上cm52阳离子层析柱,进行层析分离,目标蛋白吸附在cm52上。
[0100]
(6)用含0.5m nacl的pbs缓冲液(ph=7,10mm)进行洗脱,收集有活性的洗脱峰溶液f。将收集的溶液f进行透析或3kd滤膜超滤,除去溶液f中盐离子,得到溶液g。
[0101]
(7)溶液g浓缩,冷冻干燥,得到蛆激酶粗酶0.0328g(32.8mg)。溶纤活力测定,参照国家食品药品监督管理局国家药典委员会审定国家药品标准ws1
‑
(x
‑
052)
‑
2001z,进行活力测定,测定酶比活为:41446u/mg。
[0102]
实施例5蛆激酶的制备
[0103]
(1)取新鲜冷冻家蝇幼虫100g,用水洗净,加入1600ml蒸馏水,进行匀浆,8000r/min离心除去底部沉淀,收集上清液a。
[0104]
(2)加入硫酸铵使溶液a中硫酸铵饱和度达到30%。静置4h,待蛋白沉淀析出,进行离心8000r/min,收集上清液b。
[0105]
(3)往收集的上清液b再补充硫酸铵至70%饱和度,静置,离心8000r/min,弃上清,收集沉淀,沉淀用纯净水溶解,得到沉淀的水溶液c。
[0106]
(4)将水溶液c进行透析或超滤,除去溶液c中盐离子,至电导率70μs/cm,得到溶液d。
[0107]
(5)将溶液d置于ph=8,10mm pbs缓冲液中进行平衡得到溶液e。
[0108]
溶液e过滤,上cm52阳离子层析柱,进行层析分离,目标蛋白吸附在cm52上。
[0109]
(6)用含0.5m nacl的pbs缓冲液(ph=8,10mm)进行洗脱,收集有活性的洗脱峰溶液f。
[0110]
将收集的溶液f进行透析或超滤(滤膜截留分子量2000道尔顿),除去溶液f中盐离子,至电导率50μs/cm,得到溶液g。
[0111]
(7)洗脱液g浓缩,冷冻干燥,得到蛆激酶0.0283g(28.3mg)。酶的溶纤活力测定,参
照国家食品药品监督管理局国家药典委员会审定国家药品标准ws1
‑
(x
‑
052)
‑
2001z,进行活力测定,测定酶比活为:71649u/mg。
[0112]
实施例1
‑
5说明,溶液d的ph值是影响产物活性的重要参数,调节溶液d的ph越接近8,获得的酶比活越高。
[0113]
实施例6蛆激酶的制备
[0114]
(1)取新鲜冷冻家蝇幼虫100g,用水洗净,加入1800ml蒸馏水,进行匀浆,8000r/min离心除去底部沉淀,收集上清液a。
[0115]
(2)加入硫酸铵使溶液a中硫酸铵饱和度达到35%。静置4h,待蛋白沉淀析出,进行离心8000r/min,收集上清液b。
[0116]
(3)往收集的上清b再补充硫酸铵至70%饱和度,静置,离心8000r/min,弃上清,收集沉淀,沉淀用纯净水溶解,得到沉淀的水溶液c。
[0117]
(4)将水溶液c进行透析或超滤,除去溶液c中盐离子,至电导率100μs/cm,得到溶液d。
[0118]
(5)将溶液d置于ph=8,10mm pbs缓冲液中进行平衡得到溶液e。
[0119]
溶液e过滤,上cm52阳离子层析柱,进行层析分离,蛆激酶吸附在cm52上。
[0120]
(6)用含0.5m nacl的pbs缓冲液(ph=8,10mm)进行洗脱,收集有活性的洗脱峰溶液f。将收集的溶液f进行透析或超滤(截留分子量2000道尔顿),除去溶液f中盐离子,得到溶液g。
[0121]
(7)溶液g置于ph7.5,10mm pbs溶液中平衡,进行亲和层析,优选用含有吸附丝氨酸蛋白酶配体的填料苯甲脒琼脂糖凝胶,进行亲和吸附,用含0.5m nacl的0.05m ph3甘氨酸盐酸缓冲液洗脱,收集活性洗脱峰h。
[0122]
(8)收集的溶液h进行透析(截留分子量为2kd),除去溶液h中盐离子,至电导率<10μs/cm,得到溶液i,将i用超滤装置浓缩(截留分子量2000
‑
50000)、冷冻干燥,获得高活性蛆激酶0.0031g(3.1mg)。
[0123]
蛆激酶的溶纤活力测定,参照国家食品药品监督管理局国家药典委员会审定国家药品标准ws1
‑
(x
‑
052)
‑
2001z,进行活力测定,测定酶比活为:402974u/mg。
[0124]
实施例7蛆激酶的精制
[0125]
(1)取新鲜冷冻家蝇幼虫100g,用水洗净,加入1800ml蒸馏水,进行匀浆,8000r/min离心除去底部沉淀,收集上清液a。
[0126]
(2)加入硫酸铵使溶液a中硫酸铵饱和度达到35%。静置4h,待蛋白沉淀析出,进行离心8000r/min,收集上清液b。
[0127]
(3)往收集的上清b再补充硫酸铵至70%饱和度,静置,离心7500r/min,弃上清,收集沉淀,沉淀用纯净水溶解,得到沉淀的水溶液c。
[0128]
(4)将水溶液c进行透析或超滤,除去溶液c中盐离子,至电导率100μs/cm,得到溶液d。
[0129]
(5)将溶液d置于ph=8,10mm pbs缓冲液中进行平衡得到溶液e。
[0130]
溶液e过滤,上cm52阳离子层析柱,进行层析分离,蛆激酶吸附在cm52上。
[0131]
(6)用含0.5m nacl的pbs缓冲液(ph=8,10mm)进行洗脱,收集有活性的洗脱峰溶液f。将收集的溶液f进行透析或超滤(截留分子量2000道尔顿),除去溶液f中盐离子,得到
溶液g。
[0132]
(7)酶的精制:溶液g用0.1m ph 8tris
‑
hcl缓冲液进行平衡(含0.5m kcl),用卵黏蛋白层析柱进行亲和层析(注:卵黏蛋白接枝在sepharose 4b上);洗脱液为0.1m ph2.5甲酸溶液含0.5m kcl。收集活性洗脱峰h。
[0133]
(8)收集的溶液h进行透析(截留分子量为2kd),除去溶液h中盐离子,至电导率<10μs/cm,得到溶液i,将i用peg12000浓缩、冷冻干燥,获得高活性蛆激酶0.0035g(3.5mg),蛆激酶的溶纤活力测定,参照国家食品药品监督管理局国家药典委员会审定国家药品标准ws1
‑
(x
‑
052)
‑
2001z,进行活力测定,溶纤活性为:391085u/mg。
[0134]
(9)将实施例6、实施例7精制的蛆激酶进行sds电泳分析。苯甲脒和卵黏蛋白亲和纯化的蛆激酶电泳条带一致,且苯甲脒、卵黏蛋白均为丝氨酸蛋白酶特异性吸附配体,说明产物为丝氨酸蛋白酶。
[0135]
(10)溶解纤维蛋白原实验:取6支1.5ml离心管,分别加入40μl 1.5mg/ml牛血血纤维蛋白原(纤维蛋白原来自中国食品药品检定研究院)和2μl 0.088mg/ml蛆激酶,置于37℃保温反应,水浴锅转速约为90r/min。分别于15min、30min、1h、1.5h、2h和24h后测定牛血血纤维蛋白原组分,进行sds电泳分析。如图5所示,随时间延长,纤维蛋白原逐步降解。
[0136]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。