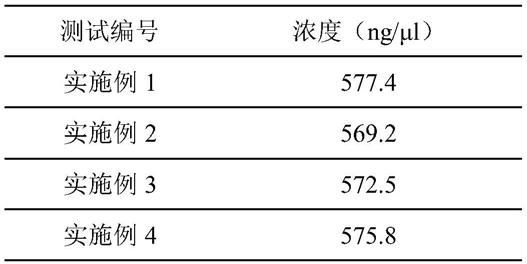
1.本发明涉及一种曲前列尼尔(treprostinil)中间体的制备方法,属于药物合成领域。
背景技术:
::2.肺动脉高压(pulmonaryarteryhypertension,pah)是一种慢性严重致命性疾病,被称为“心血管疾病中的恶性肿瘤”,临床上主要表现为肺血管阻力增加,肺动脉压升高,右心衰竭,呼吸困难,病情呈进行性呼吸困难和运动受阻,最终导致右心功能衰竭而死亡,其治疗目标主要包括改善患者临床症状、增强患者心功能储备等。3.目前尚无有效治愈pah的疗法,pah的治疗主要是通过药物缓解临床症状,以改善生活质量,提高存活率,在首个前列素类药物依前列醇问世之前,主要采用传统疗法治疗pah(包括吸氧、利尿、强心和抗凝)。而今,pah的治疗多采用钙离子拮抗剂、前列环素类似物、内皮素受体拮抗剂和5‑磷酸二酯酶抑制剂。其中,钙离子拮抗剂因具有导致血压降低、心功能衰竭加重以及诱发肺水肿等风险而使其临床应用受限。事实上,钙离子拮抗剂仅适用于急性肺血管扩张试验阳性的pah患者。依前列醇作为首个人工合成的前列环素药物,在临床已被证实能有效改善肺动脉高压患者的临床症状和生存时间,被认为是治疗肺动脉高压的“金标准”。但因其血浆半衰期很短,仅3~5分钟,且不能口服给药,必须通过中心静脉连续输注,而这种给药方法存在诸多弊病,这也促使了对其替代物的开发和研究。4.2014年12月20日,美国fda批准联合治疗公司(unitedtherapeutics)开发的曲前列尼尔口服剂型:曲前列尼尔二乙醇胺缓释片(treprostinilextended‑releasetablets),用于治疗肺动脉高压(pah)。曲前列尼尔作为首批鼓励仿制药目录药品,是一款人工合成前列环素药品,其物理性质稳定,药理作用与内源性pgi2相似,可通过促进血管内皮细胞中camp的表达,抑制血管平滑肌细胞生长及血小板聚集来扩张肺动脉,减少肺血管平滑肌细胞的过度增殖,防止肺小动脉内原位血栓形成,进而降低肺动脉压力和肺血管阻力,增加心输出量,提高血氧饱和度,使临床症状得到显著改善甚至几乎消失,作为一线治疗和抢救药物广泛应用。[0005][0006]曲前列尼尔是由美国联合制药公司(unitedtherapeutics)研发,其化合物专利us4306075a已经过期。美国专利us7417070、us7384978、us7544713以及us20070078095、us20050282901、us20080249167公布描述了曲前列尼尔和其他环前列腺素类似物的口服制剂及其治疗各种病症的用途。[0007]众所周知,由于曲前列尼尔分子具有稠环结构并且具有多个手性中心,其合成过程比较复杂。aristoff等人首次报道了曲前列尼尔的制备方法(tetrahedronlett.1982,23,2067‑2070),该路线是首先通过多步反应合成五元环,然后通过1,4‑加成反应引入芳香环,通过羰基的烯烃化,经不对称还原后,通过friedel‑crafts反应关环构建中间的六元环,从而获得曲前列尼尔的母核结构,再经多步反应最终合成曲前列尼尔。[0008]该手性合成路线共需要36步反应,步骤冗长,不利于大规模合成。[0009][0010]1999年,unitedtherapeutics公司专利申请wo9921830a1公开了一种制备曲前列尼尔的方法,包括以下步骤:[0011][0012]而期刊j.org.chem.2004,69,1890‑1902优化了wo9921830a1报道的制备工艺,并报道了侧链化合物6的制备方法:[0013][0014]该合成策略是以间甲氧基苯酚为原料,通过claisen重排、氧化及侧链的亲核加成等关键步骤,合成关键中间体8。其经不对称还原和pauson‑khand环化反应来构建曲前列尼尔的骨架结构,再通过氢化还原脱掉手性控制基团、硼氢化钠还原、脱保护等步骤合成曲前列尼尔。该手性合成路线较之前的报道路线,在合成效率和手性控制上都有了明显的提高。但仍存在一些缺陷:需要用过量的昂贵的手性cbs试剂、八羰基二钴和三甲基硅丙炔,合成成本较高;claisen重排反应为高温反应,生产的安全系数低,且易产生邻位异构体杂质,纯化难度较大;使用重金属氧化剂易造成产品重金属超标;接侧链的步骤是低温反应,条件苛刻,生产成本高,工业应用价值低。技术实现要素:[0015]为了解决现有技术存在的问题,本发明人开发了一种曲前列尼尔中间体(i)的制备方法,该方法不仅反应条件温和,成本相对低廉,而且获得产品纯度高达99%以上,适合工业化生产。[0016][0017]本发明的目的在于提供一种曲前列尼尔中间体(i)的制备方法,包括如下步骤:[0018]式(ii)化合物或其羧酸盐与式(iii)化合物反应得到式(i)化合物,反应式如下:[0019][0020]其中,r1,r2各自独立地分别为羟基保护基;优选r1、r2各自独立的为取代或非取代的c1‑6烷基,c3‑6环烷基、苄基、c1‑6烷氧基取代的苄基,四氢吡喃基,‑sir1r2r3,其中r1、r2和r3各自分别为c1‑6的烷基、c3‑6的环烷基、或取代或非取代的c6‑10芳基。[0021]作为更进一步优选的方案,r1为甲基,r2为2‑四氢吡喃基。[0022]作为更进一步优选的方案,所述式(ii)化合物羧酸盐选自钠盐。[0023]作为优选的方案,所述的碱是指有机碱或无机碱,所述的有机碱选自三乙胺、n,n‑二异丙基乙胺、吡啶、dbu、dabco、dmap或其混合物;无机碱选自碳酸钠、碳酸钾或其混合物。[0024]进一步,所述式(ii)化合物以通过如下制备方法制得:[0025][0026]其中r1如权利要求1所定义,r1选自取代或非取代的c1‑6烷基,c3‑6环烷基、苄基、c1‑6烷氧基取代的苄基,四氢吡喃基,‑sir1r2r3,其中r1、r2和r3各自分别为c1‑6的烷基、c3‑6的环烷基、或取代或非取代的c6‑10芳基;其中x为卤素,优选溴。[0027]进一步,所述式(v)化合物又可以通过如下制备方法制得:[0028][0029]其中r1如权利要求1所定义,所述的碱为四甲基哌啶锂。[0030]进一步,所述式(iv)化合物又可以通过如下制备方法制得:[0031][0032]其中r1如权利要求1所定义,所述的碱为有机碱或无机碱,所述有机碱选自三乙胺、吡啶、吗啉、哌啶、dmap或其混合物,所述无机碱选自氢氧化钠、氢氧化钾、氢氧化锂、碳酸铯、碳酸钾、碳酸钠或其混合物。[0033]进一步,所述式(iii)化合物可以通过如下制备方法制得:由式(viii)化合物式经羟基保护后制得的:[0034][0035]其中r2如权利要求1所定义,r2选自取代或非取代的c1‑6烷基,c3‑6环烷基、苄基、c1‑6烷氧基取代的苄基,四氢吡喃基,‑sir1r2r3,其中r1、r2和r3各自分别为c1‑6的烷基、c3‑6的环烷基、或取代或非取代的c6‑10芳基。[0036]进一步,所述式(viii)化合物又可以通过如下制备方法制得:由式(vii)化合物与正丁基卤化镁反应制得的:[0037][0038]其中x为卤素,优选氯。[0039]进一步,所述式(vii)化合物又可以通过如下制备方法制得:以(r)‑缩水甘油为原料制备式(vii)化合物,制备方法如下:[0040][0041]本发明另一方面提供一种以由间羟基苯甲酸为原料制备式(ii)化合物的方法,包括如下步骤:[0042][0043]其中,r1如式(i)化合物所定义。[0044]作为优先的方案,当r1选自甲基时,x选自溴时,其具体制备方法如下:[0045]本发明另一方面提供一种以(r)‑缩水甘油为原料制备式(iii)化合物的方法,包括如下步骤:[0046][0047]其中,r2如式(i)化合物所定义。[0048]作为优先的方案,当r2选自2‑四氢吡喃基时,x选自氯时,其具体制备方法如下:[0049][0050]相比于现有技术,本发明具有以下优点:本发明提供的曲前列尼尔中间体(i)的制备方法,经式(ii)化合物和式(iii)化合物在三聚氯氰和碱的作用下,室温反应即可得到,反应条件温和,中间体(i)纯度高达99%以上,避免了氧化和低温反应,从而避免了现有技术中使用重金属(pcc氧化剂)造成的环境污染,也简化了生产操。本发明以间羟基苯甲酸为原料,三步合成式(ii)化合物,反应条件温和,且无异构体副产物产生,避免了现有技术报道的claisen重排反应所需高温反应条件和复杂的纯化操作,生产成本和安全系数大大提高。本发明以(r)‑缩水甘油为原料,三步合成式(vii)化合物,避免使用了现有技术中昂贵的三甲基硅丙炔,并避免了丁基锂的低温反应,简化了合成操作,生产成本低,工业应用前景广阔。具体实施方式[0051]下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则所有的百分数、比率、比例、或份数按重量计。[0052]本发明中的重量体积百分比中的单位是本领域技术人员所熟知的,例如是指在100毫升的溶液中溶质的重量。[0053]本发明所使用的术语,除有相反的表述外,具有如下的含义:[0054]“烷基”指饱和的脂族烃基团,包括1至6个碳原子的直链和支链基团。非限制性实施例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1‑二甲基丙基、1,2‑二甲基丙基、2,2‑二甲基丙基、1‑乙基丙基、2‑甲基丁基、3‑甲基丁基、正己基、1‑乙基‑2‑甲基丙基、1,1,2‑三甲基丙基、1,1‑二甲基丁基、1,2‑二甲基丁基、2,2‑二甲基丁基、1,3‑二甲基丁基、2‑乙基丁基、2‑甲基戊基、3‑甲基戊基、4‑甲基戊基、2,3‑二甲基丁基等。烷基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选为一个或多个以下基团,独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、硫醇、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代。[0055]“环烷基”指饱和或部分不饱和单环或多环环状烃取代基,其包括3至6个碳原子,优选5元或6元环烷基。单环环烷基的非限制性实施例包含环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基等。多环环烷基包括螺环、稠环和桥环的环烷基。环烷基可以是取代的或未取代的,当被取代时,取代基优选为一个或多个以下基团,独立地选自烷基、烷氧基、卤素、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基。[0056]“芳基”指具有共轭的π电子体系的6至10元全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,优选苯基和萘基。芳基可以是取代的或未取代的,当被取代时,取代基优选为一个或多个以下基团,独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、硫醇、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基。[0057]除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。[0058]实施例1[0059][0060]将间羟基苯甲酸(96g,0.7mol)和碳酸钾(480g,3.5mol)置于无水丙酮(1.2l)中,室温下滴加硫酸二甲酯(441g,3.5mol),滴毕,升温至50℃反应2小时,停止反应,过滤,滤液减压浓缩,残留物加入20%naoh水溶液(1.2l),搅拌至全溶,冷至10℃,加入浓盐水调ph=2‑3,过滤,滤饼用水(300ml)洗涤后,用乙醇重结晶,得到间甲氧基苯甲酸(78g,产率73.3%)。[0061]实施例2[0062][0063]将2,2,6,6‑四甲基哌啶锂(294g,2.0mol)溶于四氢呋喃(200ml)中,降至0℃,滴加含有间甲氧基苯甲酸(80g,0.53mol)的四氢呋喃(400ml),滴毕,0℃反应2小时,分批加入碘(380g,1.5mol),加毕,升至室温继续搅拌反应12小时,停止反应,加入水(800ml)稀释,用1mhcl调ph=2‑3,加入乙酸乙酯(400ml)萃取,收集有机相,无水硫酸钠干燥,过滤,滤液减压浓缩所得残留物,经丙酮结晶得到2‑碘‑3‑甲氧基苯甲酸(90.2g,产率61.2%)。[0064]实施例3[0065][0066]将2‑碘‑3‑甲氧基苯甲酸(56g,0.2mol)置于四氢呋喃(500ml)中,降至‑20℃,滴加甲基溴化镁(1m的四氢呋喃溶液)(200ml,0.2mol),滴毕,继续滴加异丙基氯化镁(2m的四氢呋喃溶液)(120ml,0.24mol)滴毕,‑20℃反应2小时,再滴加3.3m氰化亚铜双(氯化锂)络合物的四氢呋喃溶液(3ml,0.01mol),滴毕,‑20℃反应1小时,加入烯丙基溴(72g,0.6mol),加毕,室温搅拌12h后,停止反应,加入乙酸乙酯(500ml)稀释,用1mhcl调ph=2‑3,静置分层,收集有机相,无水硫酸钠干燥,过滤,滤液减压浓缩所得残留物,用四氢呋喃100ml溶解,滴加10%naoh水溶液调ph=8‑9,过滤,滤饼真空干燥后得到2‑烯丙基‑3‑甲氧基苯甲酸钠(34.9g,产率81.5%)。[0067]实施例4[0068][0069]将2‑烯丙基‑3‑甲氧基苯甲酸钠(21g,0.1mol)加入到乙腈(120ml)中,搅拌下,加入三聚氯氰(6.1g,0.03mol),在室温下搅拌反应0.5小时后,加入(6s)‑6‑((四氢‑2h‑吡喃基‑2‑基)氧基)‑癸‑9‑炔(23.8g,0.1mol)、三乙胺(10.1g,0.1mol)和无水氯化镁(9.5g,0.1mol),加毕,继续室温反应3小时。将反应混合物过滤,溶液减压浓缩,残留物加入乙酸乙酯(300ml)溶解,用15%nacl水溶液洗涤,收集有机相,无水硫酸钠干燥,过滤,滤液减压浓缩所得残留物,通过短硅胶柱快速洗脱(正己烷:乙酸乙酯=20:1)得到黄色油状物(6s)‑1‑(2‑烯丙基‑3‑(甲氧基)苯基)‑6‑((四氢‑2h‑吡喃基‑2‑基)氧)‑十一烷基‑2‑炔‑1‑酮(33.2g,产率80.6%,hplc纯度99.3%)。[0070]1hnmr(400mhz,cdcl3):δ7.72(t,j=9.0hz,1h),7.28(m,1h),7.05(d,j=9.0hz,1h),6.05‑5.90(m,1h),5.01‑4.88(m,2h),4.56‑4.55(m,1h),3.91‑3.78(m,4h),3.66‑3.80(m,3h),3.51‑3.43(m,1h),2.56(dt,j=1.6,5.8hz,1h),2.49(t,j=5.9hz,1h),1.90‑1.22(m,16h),0.88(t,j=6.9hz,3h).[0071]实施例5[0072][0073]向无水乙醚(150ml)中加入的镁屑(15g,0.63mol)、氯化汞(0.6g,2.2mmol)和一粒碘单质的混合物,滴加炔丙基溴(5ml,0.06mol),引发反应,降温至0‑10℃,滴加炔丙基溴(15ml,0.18mol),滴毕,继续搅拌反应1小时,得炔丙基溴化镁的乙醚溶液。将(r)‑缩水甘油(5.9g,0.08mol)加入到乙醚(30ml)中,冷却至‑50℃,滴加上述的炔丙基溴化镁的乙醚溶液,滴毕,自然升至室温,继续搅拌反应15小时,降温至‑10℃,滴加饱和氯化铵水溶液(30ml)淬灭,过滤,滤液静置分层,水相用乙酸乙酯(30ml)萃取,合并有机相,依次用水(30ml)、饱和nacl水溶液(30ml)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩,得到黄色油状物,(s)‑十六烷‑5‑炔‑1,2‑二醇粗品(8.8g),不经进一步纯化,直接用于下一步反应[0074]将(s)‑十六烷‑5‑炔‑1,2‑二醇粗品(8.8g)溶于二氯甲烷(100ml)中,加入三乙胺(8.1g,0.08mol),降温至0℃,分批加入对甲苯磺酰氯(13.4g,0.07mol),加毕,室温反应8小时,滴加水(50ml)淬灭,滤液静置分层,水相用二氯甲烷(50ml)萃取,合并有机相,饱和nacl水溶液(30ml)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩所得残留物,通过短硅胶柱快速洗脱(正己烷:乙酸乙酯=100:1)得到黄色油状物(s)‑2‑羟基‑4‑乙炔基‑1‑丁基对甲苯磺酸酯(14.1g,产率65.8%)。[0075]实施例6[0076][0077]将(s)‑2‑羟基‑4‑乙炔基‑1‑丁基对甲苯磺酸酯(10.7g,0.04mol)和碘化亚铜(0.76g,4mmol)加入到无水四氢呋喃(120ml)中,降温至0℃,滴加2m正丁基溴化镁的四氢呋喃溶液(20ml,0.04mol),滴毕,继续0℃搅拌反应6小时,反应完全,滴加饱和氯化铵水溶液(30ml)淬灭,过滤,滤液静置分层,水相用乙酸乙酯(50ml*2)萃取,合并有机相,依次用水(30ml)、饱和nacl水溶液(30ml)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩,得到黄色油状物(s)‑辛‑1‑炔‑5‑醇(4.4g,产率71.4%)。[0078]实施例7[0079][0080]将(s)‑辛‑1‑炔‑5‑醇(4.0g,0.026mol)加入到二氯甲烷(50ml)中,加入吡啶对甲苯磺酸盐(ppts)(0.33g,1.3mmol)和3,4‑二氢吡喃(4.2g,0.05mol),室温搅拌15h。停止反应,依次用用水(20ml×2)洗,饱和nacl水溶液(20ml)洗涤,无水硫酸钠干燥,抽滤,减压浓缩得黄色油状物,即c‑2粗品94.7g,经硅胶柱层析分离纯化(正己烷:乙酸乙酯=200:1),得浅黄色油状物,即(6s)‑6‑((四氢‑2h‑吡喃基‑2‑基)氧)‑癸‑9‑炔(5.7g,产率91.9%,gc纯度:98.6%)。当前第1页12当前第1页12
背景技术:
::2.肺动脉高压(pulmonaryarteryhypertension,pah)是一种慢性严重致命性疾病,被称为“心血管疾病中的恶性肿瘤”,临床上主要表现为肺血管阻力增加,肺动脉压升高,右心衰竭,呼吸困难,病情呈进行性呼吸困难和运动受阻,最终导致右心功能衰竭而死亡,其治疗目标主要包括改善患者临床症状、增强患者心功能储备等。3.目前尚无有效治愈pah的疗法,pah的治疗主要是通过药物缓解临床症状,以改善生活质量,提高存活率,在首个前列素类药物依前列醇问世之前,主要采用传统疗法治疗pah(包括吸氧、利尿、强心和抗凝)。而今,pah的治疗多采用钙离子拮抗剂、前列环素类似物、内皮素受体拮抗剂和5‑磷酸二酯酶抑制剂。其中,钙离子拮抗剂因具有导致血压降低、心功能衰竭加重以及诱发肺水肿等风险而使其临床应用受限。事实上,钙离子拮抗剂仅适用于急性肺血管扩张试验阳性的pah患者。依前列醇作为首个人工合成的前列环素药物,在临床已被证实能有效改善肺动脉高压患者的临床症状和生存时间,被认为是治疗肺动脉高压的“金标准”。但因其血浆半衰期很短,仅3~5分钟,且不能口服给药,必须通过中心静脉连续输注,而这种给药方法存在诸多弊病,这也促使了对其替代物的开发和研究。4.2014年12月20日,美国fda批准联合治疗公司(unitedtherapeutics)开发的曲前列尼尔口服剂型:曲前列尼尔二乙醇胺缓释片(treprostinilextended‑releasetablets),用于治疗肺动脉高压(pah)。曲前列尼尔作为首批鼓励仿制药目录药品,是一款人工合成前列环素药品,其物理性质稳定,药理作用与内源性pgi2相似,可通过促进血管内皮细胞中camp的表达,抑制血管平滑肌细胞生长及血小板聚集来扩张肺动脉,减少肺血管平滑肌细胞的过度增殖,防止肺小动脉内原位血栓形成,进而降低肺动脉压力和肺血管阻力,增加心输出量,提高血氧饱和度,使临床症状得到显著改善甚至几乎消失,作为一线治疗和抢救药物广泛应用。[0005][0006]曲前列尼尔是由美国联合制药公司(unitedtherapeutics)研发,其化合物专利us4306075a已经过期。美国专利us7417070、us7384978、us7544713以及us20070078095、us20050282901、us20080249167公布描述了曲前列尼尔和其他环前列腺素类似物的口服制剂及其治疗各种病症的用途。[0007]众所周知,由于曲前列尼尔分子具有稠环结构并且具有多个手性中心,其合成过程比较复杂。aristoff等人首次报道了曲前列尼尔的制备方法(tetrahedronlett.1982,23,2067‑2070),该路线是首先通过多步反应合成五元环,然后通过1,4‑加成反应引入芳香环,通过羰基的烯烃化,经不对称还原后,通过friedel‑crafts反应关环构建中间的六元环,从而获得曲前列尼尔的母核结构,再经多步反应最终合成曲前列尼尔。[0008]该手性合成路线共需要36步反应,步骤冗长,不利于大规模合成。[0009][0010]1999年,unitedtherapeutics公司专利申请wo9921830a1公开了一种制备曲前列尼尔的方法,包括以下步骤:[0011][0012]而期刊j.org.chem.2004,69,1890‑1902优化了wo9921830a1报道的制备工艺,并报道了侧链化合物6的制备方法:[0013][0014]该合成策略是以间甲氧基苯酚为原料,通过claisen重排、氧化及侧链的亲核加成等关键步骤,合成关键中间体8。其经不对称还原和pauson‑khand环化反应来构建曲前列尼尔的骨架结构,再通过氢化还原脱掉手性控制基团、硼氢化钠还原、脱保护等步骤合成曲前列尼尔。该手性合成路线较之前的报道路线,在合成效率和手性控制上都有了明显的提高。但仍存在一些缺陷:需要用过量的昂贵的手性cbs试剂、八羰基二钴和三甲基硅丙炔,合成成本较高;claisen重排反应为高温反应,生产的安全系数低,且易产生邻位异构体杂质,纯化难度较大;使用重金属氧化剂易造成产品重金属超标;接侧链的步骤是低温反应,条件苛刻,生产成本高,工业应用价值低。技术实现要素:[0015]为了解决现有技术存在的问题,本发明人开发了一种曲前列尼尔中间体(i)的制备方法,该方法不仅反应条件温和,成本相对低廉,而且获得产品纯度高达99%以上,适合工业化生产。[0016][0017]本发明的目的在于提供一种曲前列尼尔中间体(i)的制备方法,包括如下步骤:[0018]式(ii)化合物或其羧酸盐与式(iii)化合物反应得到式(i)化合物,反应式如下:[0019][0020]其中,r1,r2各自独立地分别为羟基保护基;优选r1、r2各自独立的为取代或非取代的c1‑6烷基,c3‑6环烷基、苄基、c1‑6烷氧基取代的苄基,四氢吡喃基,‑sir1r2r3,其中r1、r2和r3各自分别为c1‑6的烷基、c3‑6的环烷基、或取代或非取代的c6‑10芳基。[0021]作为更进一步优选的方案,r1为甲基,r2为2‑四氢吡喃基。[0022]作为更进一步优选的方案,所述式(ii)化合物羧酸盐选自钠盐。[0023]作为优选的方案,所述的碱是指有机碱或无机碱,所述的有机碱选自三乙胺、n,n‑二异丙基乙胺、吡啶、dbu、dabco、dmap或其混合物;无机碱选自碳酸钠、碳酸钾或其混合物。[0024]进一步,所述式(ii)化合物以通过如下制备方法制得:[0025][0026]其中r1如权利要求1所定义,r1选自取代或非取代的c1‑6烷基,c3‑6环烷基、苄基、c1‑6烷氧基取代的苄基,四氢吡喃基,‑sir1r2r3,其中r1、r2和r3各自分别为c1‑6的烷基、c3‑6的环烷基、或取代或非取代的c6‑10芳基;其中x为卤素,优选溴。[0027]进一步,所述式(v)化合物又可以通过如下制备方法制得:[0028][0029]其中r1如权利要求1所定义,所述的碱为四甲基哌啶锂。[0030]进一步,所述式(iv)化合物又可以通过如下制备方法制得:[0031][0032]其中r1如权利要求1所定义,所述的碱为有机碱或无机碱,所述有机碱选自三乙胺、吡啶、吗啉、哌啶、dmap或其混合物,所述无机碱选自氢氧化钠、氢氧化钾、氢氧化锂、碳酸铯、碳酸钾、碳酸钠或其混合物。[0033]进一步,所述式(iii)化合物可以通过如下制备方法制得:由式(viii)化合物式经羟基保护后制得的:[0034][0035]其中r2如权利要求1所定义,r2选自取代或非取代的c1‑6烷基,c3‑6环烷基、苄基、c1‑6烷氧基取代的苄基,四氢吡喃基,‑sir1r2r3,其中r1、r2和r3各自分别为c1‑6的烷基、c3‑6的环烷基、或取代或非取代的c6‑10芳基。[0036]进一步,所述式(viii)化合物又可以通过如下制备方法制得:由式(vii)化合物与正丁基卤化镁反应制得的:[0037][0038]其中x为卤素,优选氯。[0039]进一步,所述式(vii)化合物又可以通过如下制备方法制得:以(r)‑缩水甘油为原料制备式(vii)化合物,制备方法如下:[0040][0041]本发明另一方面提供一种以由间羟基苯甲酸为原料制备式(ii)化合物的方法,包括如下步骤:[0042][0043]其中,r1如式(i)化合物所定义。[0044]作为优先的方案,当r1选自甲基时,x选自溴时,其具体制备方法如下:[0045]本发明另一方面提供一种以(r)‑缩水甘油为原料制备式(iii)化合物的方法,包括如下步骤:[0046][0047]其中,r2如式(i)化合物所定义。[0048]作为优先的方案,当r2选自2‑四氢吡喃基时,x选自氯时,其具体制备方法如下:[0049][0050]相比于现有技术,本发明具有以下优点:本发明提供的曲前列尼尔中间体(i)的制备方法,经式(ii)化合物和式(iii)化合物在三聚氯氰和碱的作用下,室温反应即可得到,反应条件温和,中间体(i)纯度高达99%以上,避免了氧化和低温反应,从而避免了现有技术中使用重金属(pcc氧化剂)造成的环境污染,也简化了生产操。本发明以间羟基苯甲酸为原料,三步合成式(ii)化合物,反应条件温和,且无异构体副产物产生,避免了现有技术报道的claisen重排反应所需高温反应条件和复杂的纯化操作,生产成本和安全系数大大提高。本发明以(r)‑缩水甘油为原料,三步合成式(vii)化合物,避免使用了现有技术中昂贵的三甲基硅丙炔,并避免了丁基锂的低温反应,简化了合成操作,生产成本低,工业应用前景广阔。具体实施方式[0051]下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则所有的百分数、比率、比例、或份数按重量计。[0052]本发明中的重量体积百分比中的单位是本领域技术人员所熟知的,例如是指在100毫升的溶液中溶质的重量。[0053]本发明所使用的术语,除有相反的表述外,具有如下的含义:[0054]“烷基”指饱和的脂族烃基团,包括1至6个碳原子的直链和支链基团。非限制性实施例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1‑二甲基丙基、1,2‑二甲基丙基、2,2‑二甲基丙基、1‑乙基丙基、2‑甲基丁基、3‑甲基丁基、正己基、1‑乙基‑2‑甲基丙基、1,1,2‑三甲基丙基、1,1‑二甲基丁基、1,2‑二甲基丁基、2,2‑二甲基丁基、1,3‑二甲基丁基、2‑乙基丁基、2‑甲基戊基、3‑甲基戊基、4‑甲基戊基、2,3‑二甲基丁基等。烷基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选为一个或多个以下基团,独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、硫醇、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代。[0055]“环烷基”指饱和或部分不饱和单环或多环环状烃取代基,其包括3至6个碳原子,优选5元或6元环烷基。单环环烷基的非限制性实施例包含环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基等。多环环烷基包括螺环、稠环和桥环的环烷基。环烷基可以是取代的或未取代的,当被取代时,取代基优选为一个或多个以下基团,独立地选自烷基、烷氧基、卤素、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基。[0056]“芳基”指具有共轭的π电子体系的6至10元全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,优选苯基和萘基。芳基可以是取代的或未取代的,当被取代时,取代基优选为一个或多个以下基团,独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、硫醇、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基。[0057]除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。[0058]实施例1[0059][0060]将间羟基苯甲酸(96g,0.7mol)和碳酸钾(480g,3.5mol)置于无水丙酮(1.2l)中,室温下滴加硫酸二甲酯(441g,3.5mol),滴毕,升温至50℃反应2小时,停止反应,过滤,滤液减压浓缩,残留物加入20%naoh水溶液(1.2l),搅拌至全溶,冷至10℃,加入浓盐水调ph=2‑3,过滤,滤饼用水(300ml)洗涤后,用乙醇重结晶,得到间甲氧基苯甲酸(78g,产率73.3%)。[0061]实施例2[0062][0063]将2,2,6,6‑四甲基哌啶锂(294g,2.0mol)溶于四氢呋喃(200ml)中,降至0℃,滴加含有间甲氧基苯甲酸(80g,0.53mol)的四氢呋喃(400ml),滴毕,0℃反应2小时,分批加入碘(380g,1.5mol),加毕,升至室温继续搅拌反应12小时,停止反应,加入水(800ml)稀释,用1mhcl调ph=2‑3,加入乙酸乙酯(400ml)萃取,收集有机相,无水硫酸钠干燥,过滤,滤液减压浓缩所得残留物,经丙酮结晶得到2‑碘‑3‑甲氧基苯甲酸(90.2g,产率61.2%)。[0064]实施例3[0065][0066]将2‑碘‑3‑甲氧基苯甲酸(56g,0.2mol)置于四氢呋喃(500ml)中,降至‑20℃,滴加甲基溴化镁(1m的四氢呋喃溶液)(200ml,0.2mol),滴毕,继续滴加异丙基氯化镁(2m的四氢呋喃溶液)(120ml,0.24mol)滴毕,‑20℃反应2小时,再滴加3.3m氰化亚铜双(氯化锂)络合物的四氢呋喃溶液(3ml,0.01mol),滴毕,‑20℃反应1小时,加入烯丙基溴(72g,0.6mol),加毕,室温搅拌12h后,停止反应,加入乙酸乙酯(500ml)稀释,用1mhcl调ph=2‑3,静置分层,收集有机相,无水硫酸钠干燥,过滤,滤液减压浓缩所得残留物,用四氢呋喃100ml溶解,滴加10%naoh水溶液调ph=8‑9,过滤,滤饼真空干燥后得到2‑烯丙基‑3‑甲氧基苯甲酸钠(34.9g,产率81.5%)。[0067]实施例4[0068][0069]将2‑烯丙基‑3‑甲氧基苯甲酸钠(21g,0.1mol)加入到乙腈(120ml)中,搅拌下,加入三聚氯氰(6.1g,0.03mol),在室温下搅拌反应0.5小时后,加入(6s)‑6‑((四氢‑2h‑吡喃基‑2‑基)氧基)‑癸‑9‑炔(23.8g,0.1mol)、三乙胺(10.1g,0.1mol)和无水氯化镁(9.5g,0.1mol),加毕,继续室温反应3小时。将反应混合物过滤,溶液减压浓缩,残留物加入乙酸乙酯(300ml)溶解,用15%nacl水溶液洗涤,收集有机相,无水硫酸钠干燥,过滤,滤液减压浓缩所得残留物,通过短硅胶柱快速洗脱(正己烷:乙酸乙酯=20:1)得到黄色油状物(6s)‑1‑(2‑烯丙基‑3‑(甲氧基)苯基)‑6‑((四氢‑2h‑吡喃基‑2‑基)氧)‑十一烷基‑2‑炔‑1‑酮(33.2g,产率80.6%,hplc纯度99.3%)。[0070]1hnmr(400mhz,cdcl3):δ7.72(t,j=9.0hz,1h),7.28(m,1h),7.05(d,j=9.0hz,1h),6.05‑5.90(m,1h),5.01‑4.88(m,2h),4.56‑4.55(m,1h),3.91‑3.78(m,4h),3.66‑3.80(m,3h),3.51‑3.43(m,1h),2.56(dt,j=1.6,5.8hz,1h),2.49(t,j=5.9hz,1h),1.90‑1.22(m,16h),0.88(t,j=6.9hz,3h).[0071]实施例5[0072][0073]向无水乙醚(150ml)中加入的镁屑(15g,0.63mol)、氯化汞(0.6g,2.2mmol)和一粒碘单质的混合物,滴加炔丙基溴(5ml,0.06mol),引发反应,降温至0‑10℃,滴加炔丙基溴(15ml,0.18mol),滴毕,继续搅拌反应1小时,得炔丙基溴化镁的乙醚溶液。将(r)‑缩水甘油(5.9g,0.08mol)加入到乙醚(30ml)中,冷却至‑50℃,滴加上述的炔丙基溴化镁的乙醚溶液,滴毕,自然升至室温,继续搅拌反应15小时,降温至‑10℃,滴加饱和氯化铵水溶液(30ml)淬灭,过滤,滤液静置分层,水相用乙酸乙酯(30ml)萃取,合并有机相,依次用水(30ml)、饱和nacl水溶液(30ml)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩,得到黄色油状物,(s)‑十六烷‑5‑炔‑1,2‑二醇粗品(8.8g),不经进一步纯化,直接用于下一步反应[0074]将(s)‑十六烷‑5‑炔‑1,2‑二醇粗品(8.8g)溶于二氯甲烷(100ml)中,加入三乙胺(8.1g,0.08mol),降温至0℃,分批加入对甲苯磺酰氯(13.4g,0.07mol),加毕,室温反应8小时,滴加水(50ml)淬灭,滤液静置分层,水相用二氯甲烷(50ml)萃取,合并有机相,饱和nacl水溶液(30ml)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩所得残留物,通过短硅胶柱快速洗脱(正己烷:乙酸乙酯=100:1)得到黄色油状物(s)‑2‑羟基‑4‑乙炔基‑1‑丁基对甲苯磺酸酯(14.1g,产率65.8%)。[0075]实施例6[0076][0077]将(s)‑2‑羟基‑4‑乙炔基‑1‑丁基对甲苯磺酸酯(10.7g,0.04mol)和碘化亚铜(0.76g,4mmol)加入到无水四氢呋喃(120ml)中,降温至0℃,滴加2m正丁基溴化镁的四氢呋喃溶液(20ml,0.04mol),滴毕,继续0℃搅拌反应6小时,反应完全,滴加饱和氯化铵水溶液(30ml)淬灭,过滤,滤液静置分层,水相用乙酸乙酯(50ml*2)萃取,合并有机相,依次用水(30ml)、饱和nacl水溶液(30ml)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩,得到黄色油状物(s)‑辛‑1‑炔‑5‑醇(4.4g,产率71.4%)。[0078]实施例7[0079][0080]将(s)‑辛‑1‑炔‑5‑醇(4.0g,0.026mol)加入到二氯甲烷(50ml)中,加入吡啶对甲苯磺酸盐(ppts)(0.33g,1.3mmol)和3,4‑二氢吡喃(4.2g,0.05mol),室温搅拌15h。停止反应,依次用用水(20ml×2)洗,饱和nacl水溶液(20ml)洗涤,无水硫酸钠干燥,抽滤,减压浓缩得黄色油状物,即c‑2粗品94.7g,经硅胶柱层析分离纯化(正己烷:乙酸乙酯=200:1),得浅黄色油状物,即(6s)‑6‑((四氢‑2h‑吡喃基‑2‑基)氧)‑癸‑9‑炔(5.7g,产率91.9%,gc纯度:98.6%)。当前第1页12当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。