一种由农杆菌介导的草莓
‘
甜查理’遗传转化体系的构建方法
技术领域
1.本发明涉及一种
‘
甜查理’草莓叶片再生方法和农杆菌介导的遗传转化体系建立,属于
‘
甜查理’草莓叶片组培再生和遗传转化基因工程技术领域。
背景技术:
2.草莓(fragaria
×
ananassa)为蔷薇科(rosaceae)草莓属(fragaria)宿根性多年生草本植物,是重要的鲜食水果作物之一,也是蔷薇科植物重要的功能基因研究的模式物种。由于草莓染色体的多倍性和高度杂合性,使传统育种受到了有益性状定向改良难、育种范围窄、耗时长等限制。上世纪80年代,国内外有很多学者开始研究草莓的转基因方法,1990年michael等利用草莓离体再生体系,通过农杆菌介导,将外源基因成功导入到草莓体内,开始逐步推动了草莓基因工程的发展。根据之前学者的研究进展发现,不同品种草莓再生方法和效率差距很大,具体表现为不同草莓品种特性不同,叶片再生的方法所用的激素,以及激素用量等方法也不同等。甜查理(sweetcharlie)是1986年美国佛罗里达大学用fl80
‑
456
×
派扎罗(paiaro)培育而成,果大且均匀,鲜果综合性状优良。增产效果和生长优势十分明显,目前在我国栽培面积位居首位。本发明通过建立草莓
‘
甜查理’叶片高效再生体系,进一步建立农杆菌介导的高效遗传转化体系,为今后针对草莓甜查理’的基因工程具有重要意义。
技术实现要素:
3.发明目的:针对草莓
‘
甜查理’茎尖快繁和遗传转化基因工程等技术问题,本发明的第一个目的是提供一种草莓
‘
甜查理’茎尖分生组织组培快繁技术。本发明第二个目的是提供一种由农杆菌介导的草莓
‘
甜查理’叶片诱导愈伤和不定芽的遗传转化体系,为草莓
‘
甜查理’品种的基因工程研究奠定基础。
4.为实现上述目的,本发明的技术方案如下:
5.一种由农杆菌介导的草莓
‘
甜查理’遗传转化体系的构建方法,包括如下步骤:
6.(1)采用茎尖组培快繁技术得到草莓
‘
甜查理’无菌苗;
7.(2)利用步骤(1)制备的无菌苗进行叶片再生愈伤诱导和不定芽诱导预培养;
8.(3)活化农杆菌,用农杆菌浸染草莓叶片和叶柄进行共培养,然后进行农杆菌控菌杀菌处理;
9.(4)用抗生素梯度筛选阳性愈伤和不定芽,然后在增值培养基中培养扩增,将扩增得到的三叶一心的单独苗转移到优选生根培养基中进行生根培养;
10.(5)采用转化jh19载体上的通用载体序列片段cas9基因pcr扩增检测或荧光蛋白egfp发光情况观察进行阳性转化株系检测。
11.步骤(1)中,首先对匍匐茎消毒处理,然后依次进行茎尖诱导培养、增殖培养和生根培养,其中,茎尖诱导的培养基为m1:ms ga 0.3
‑
0.5mg/l 6
‑
ba 0.3
‑
0.5mg/l;增殖培养基为m3:ms iba 0.01
‑
0.02mg/l 6
‑
ba 0.2
‑
0.4mg/l;生根培养基m5为 ms iba 0.03
‑
0.05mg/l。
12.具体地,所述匍匐茎消毒处理方法为:选取无病虫害且健壮的草莓
‘
甜查理’匍匐茎尖在流水下冲洗1小时,在超净台上用75%酒精消毒30s,再利用6%次氯酸钠消毒6min一次,最后用无菌水清洗5次,每次2min;在无菌滤纸上吸干水分后,在显微镜下利用解刨针剥取茎尖生长点0.3
‑
0.5cm,转接到茎尖诱导培养基上培养。
13.优选地,茎尖诱导培养基为m2:ms ga 0.5mg/l 6
‑
ba 0.5mg/l,温度(25
±ꢀ
2)℃,在避光暗处理24℃条件下启动茎尖诱导,避光暗处理一周之后弱光1000lx 光培养,光照时间16h/d。
14.优选的增殖培养的培养基为m4:ms iba 0.01mg/l 6
‑
ba 0.3mg/l。在温度(25
ꢀ±
2)℃,光照强度1500~2000lx,光照时间16h/d条件下培养,每月扩繁一次。
15.优选的生根培养基为m6:ms iba 0.05mg/l。温度(25
±
2)℃,在避光暗处理 24℃条件下启动茎尖诱导,避光暗处理一周之后弱光1000lx光培养,光照时间16h/d。
16.优选地,步骤(2)中,先将
‘
甜查理’无菌苗叶片用灭菌的手术刀将叶片边缘锯齿切开,然后将叶片沿着叶脉切成1立方厘米大小的叶块进行预培养愈伤和不定芽诱导,发现tdz比6
‑
ba更能诱导出健康的五级愈伤组织。诱导愈伤培养基为m7:ms iba 0.1mg/l tdz 1.8
‑
2.6mg/l。优选的诱导愈伤培养基为m8:ms iba 0.1 mg/l tdz 2.4mg/l,ph值为5.8,温度(25
±
2)℃,暗培养3天。
17.优选地,农杆菌首先在常规固体lb培养基上活化,然后在液体lb培养基上先后经过两次量摇后,检测od600=1
‑
2范围之间备用。
18.其中,所述农杆菌菌株为gv3101,遗传转化的载体是getway系统载体jh19,该载体的详细信息披露于zhou等的《efficient genome editing of wild strawberry genes, vector development and validation》(plant biotechnology journal(2018)16,pp.1868
–
1877) 中,载体上有潮霉素筛选标记和egfp荧光蛋白标签。
19.农杆菌在浸染液中浸染时间和农杆菌od
600
值有关。农杆菌与草莓叶片或者叶柄在m9:ms 乙酰丁香酮(as)20mg/l的浸染液中侵染15
‑
30min,然后转移到无菌滤纸上吸干多余菌液,得到染了农杆菌的预培养叶片,然后将其转接到培养基:m10: ms iba 0.1mg/l tdz 2.4mg/l as 20mg/l 上进行暗共培养2
‑
3天,温度(25
±ꢀ
2)℃,以肉眼可见培养基上叶片边缘有携带jh19双元表达载体的gv3101农杆菌菌斑长出为最佳停止培养时间。
20.具体地,杀菌处理的方法为,将农杆菌共培养后获得的叶片在杀菌液为m11:ms carb 300
‑
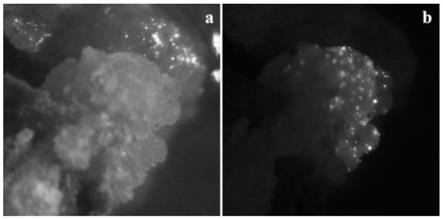
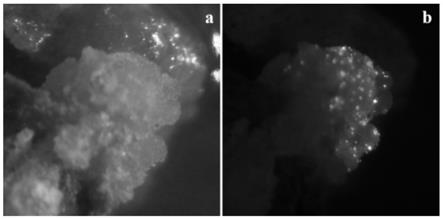
400mg/l tim 300
‑
400mg/l中杀菌处理,杀菌时间为30
‑
40分钟,优选地,杀菌液组成为:ms carb 400mg/l tim 400mg/l。如果浸染后叶片上农杆菌较多,可在高浓度杀菌液下较长时间浸泡;如果浸染后叶片上农杆菌较少,可在低浓度杀菌液下较短时间浸泡。然后转至杀菌培养基m12:ms iba 0.1mg/l tdz 2.4mg/l carb250 mg/l tim 250mg/l、ph为5.8上进行暗培养10天。
21.通过抗生素潮霉素对阳性不定芽的筛选,方法为:杀菌处理后的的叶片转接到筛选培养基:m13:ms iba 0.1mg/l tdz 2.4mg/l carb 250mg/l cef 50mg/l hyg 1 mg/l上进行筛选,每两周换一次培养基,每次将潮霉素(hyg)的浓度提高1mg/l,直至潮霉素的浓度上调到6mg/l为上线,且有不定芽长出为止,同时杀菌抗生素carb 和cerf的浓度逐步降低到30
‑
50mg/l,直至没有农杆菌再生长时不再使用,经过高浓度潮霉素筛选的不定芽,在增
殖培养基m4:ms iba 0.01mg/l 6
‑
ba 0.3mg/l上培养,在温度(25
±
2)℃,光照强度1500~2000lx,光照时间16h/d条件下培养,每月扩繁一次。然后将扩增三叶一心的单独苗转移至生根培养基m5:ms iba 0.03
‑
0.05 mg/l上进行培养。其中,carb:羧苄青霉素钠,cef:头孢氨苄;as:乙酰丁香酮; iba:吲哚丁酸;tdz:n
‑
苯基
‑
n
’‑
1,2,3,
‑
噻二唑
‑5‑
脲。
22.其中,上述ms培养基的基本成分包括murashige&skoog 4.74g/l、mes 0.525 g/l、vitamin b1 10mg/ml、vitamin b6 1mg/l、myo
‑
inositol100mg/l、sucrose2%,当为固体培养基时添加7g/l琼脂粉,ph值为5.8。
23.经过抗生素
‘
潮霉素’筛选以后,并且生根的转化株系可以进行一下两种方法的检测。
24.a.通用载体序列片段pcr扩增检测
25.以待检测植株叶片为模板提取dna,利用t1/t2为引物,进行常规pcr扩增cas9 基因,并通过琼脂糖凝胶电泳(age)方法显示检测结果。
26.b.荧光蛋白egfp发光验证。
27.以待检测转化愈伤组织或者植株为对象,在荧光显微镜下进行观察egfp是否可以发出绿色荧光蛋白,如果egfp可以发出绿色荧光,说明被检测愈伤或者株系中egfp 成功表达,遗传转化成功。
28.其中,jh19载体序列cas9基因检测片段pcr检测引物为t1:tggacaaaaaatacagcat 和t2:tgcgaagatggtagatcg。
29.有益效果:本发明是针对草莓
‘
甜查理’品种开展的茎尖无菌苗组培快繁技术和遗传转化技术,并且针对遗传转化中茎尖快繁、愈伤组织诱导、不定芽诱导和生根诱导等关键环节进行探索,并对各个关键步骤筛选激素浓度进行了探索,具体体现在以下几点:
30.(1)本发明是针对草莓
‘
甜查理’品种开展的茎尖无菌苗组培快繁技术,并对茎尖快繁的诱导、增殖和生根培养基进行了筛选优化,最终得到适合草莓
‘
甜查理’品种茎尖快繁的体系:
31.最优茎尖诱导培养基:m2:ms ga0.5 mg/l 6
‑
ba 0.5mg/l;
32.最优增殖培养基:m4:ms iba 0.01mg/l 6
‑
ba 0.3mg/l;
33.最优生根培养基:m6:ms iba 0.05mg/l;
34.(2)本发明研究的草莓
‘
甜查理’品种的遗传转化体系,通过茎尖快繁获得无菌苗,利用草莓
‘
甜查理’无菌苗叶片进行愈伤组织和不定芽诱导,该方法有效较少了遗传转化后期的污染问题,为高效转化奠定基础;
35.(3)本发明研究的草莓
‘
甜查理’品种的遗传转化体系,从无菌草莓叶片准备与预培养开始,依次经过农杆菌浸染叶片共培养,控菌处理,愈伤组织荧光观察,分化苗期抗生素标记
‘
潮霉素’筛选和标记分子鉴定与等关键环节,整个转化周期从愈伤阶段开始抗生素和荧光筛选,实现转化周期短,阳性转化效率高等特点;
36.(4)本发明优化了草莓
‘
甜查理’叶片诱导愈伤组织和不定芽的培养基条件,其中4级愈伤组织最大化诱导的优选培养基为:m8:ms iba 0.1mg/l tdz 2.4mg/l,温度(25
±
2)℃,暗培养3天;
37.(5)本发明采用农杆菌介导的叶盘转化方法,探索了适合农杆菌浸染叶片和共培养中乙酰丁香酮的浓度为20mg/l;
38.(6)本发明采用carb和cef两种抗生素进行杀菌处理,在杀菌液中carb和cef浓度为300
‑
400mg/l,在延迟筛选和杀菌固体培养基中采用carb 250mg/l tim 250mg/l 处理10天,可以有效控制农杆菌再生长;
39.(7)本发明针对农杆菌介导的草莓
‘
甜查理’叶片遗传转化,阳性株系筛选方法采用植物筛选标记
‘
潮霉素’梯度筛选阳性转化株系,采用叶片
‘
潮霉素’抗生素延迟7
‑
10天筛选,叶片抗生素
‘
潮霉素’低浓度筛选,愈伤组织绿色荧光gfp方法筛选,分化芽抗生素
‘
潮霉素’高浓度筛选等过程;
40.(8)本发明针对农杆菌介导的草莓
‘
甜查理’叶片遗传转化,检测方法采转化载体(图14)cas9基因序列pcr扩增检测,同时结合egfp绿色荧光蛋白发光观察检测相互验证,增加了阳性株系筛选的效率;
41.(9)本发明为了方面叶片愈伤诱导和不定芽的效率,根据叶片愈伤生长情况,将叶片四边发生的愈伤的情况分为四边无愈伤、1边愈伤发生、2边愈伤发生、3边愈伤发生、4边愈伤发生,并依次划分为0、1、2、3、4五种等级;为了分析叶片对
‘
潮霉素’敏感性,按照叶片死亡面积占叶片总面积的比例进行分级0%、25%、50%、75%、100%,将叶片死亡程度划分为0、1、2、3、4五种等级。
附图说明
42.图1为草莓
‘
甜查理’匍匐茎茎尖;
43.图2为茎尖离体快繁生根健壮的
‘
甜查理’苗;
44.图3为叶片诱导愈伤等级分类标准,其中,从a到e的情况分别为四边无愈伤、 1边愈伤发生、2边愈伤发生、3边愈伤发生、4边愈伤发生,并依次划分为0、1、2、 3、4五种等级;
45.图4为不同浓度梯度细胞分裂素6
‑
ba诱导
‘
甜查理’愈伤诱导率;
46.图5为不同浓度梯度细胞分裂素6
‑
ba诱导
‘
甜查理’愈伤和叶片不定芽;
47.图6为不同浓度梯度细胞分裂素tdz诱导
‘
甜查理’愈伤诱导率;
48.图7为不同浓度梯度细胞分裂素tdz诱导
‘
甜查理’愈伤和叶片不定芽;
49.图8为不同浓度梯度细胞分裂素tdz诱导
‘
甜查理’叶片不定芽诱导率;
50.图9为草莓叶片死亡程度五种等级标准,从a到e将叶片死亡程度划分为0、1、 2、3、4五种等级;
51.图10为不同浓度
‘
潮霉素’处理对
‘
甜查理’叶片坏死率影响;
52.图11为不同预培养时间对遗传转化愈伤及不定芽诱导的影响;
53.图12为以
‘
甜查理’为基因型材料转化株系中标记基因cas9基因pcr检测;
54.图13为以
‘
甜查理’为基因型材料转化愈伤系中标记荧光蛋白egfp发光表达分析;
55.图14为载体cas9的结构示意图。
具体实施方式
56.以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
57.若未特别指明,实施例中所用的化学试剂均为常规市售试剂,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
58.下述实施例中,愈伤分级、潮霉素敏感性分级和不定芽分化率分析标准如下:
59.愈伤分级:根据叶片愈伤生长情况,将叶片四边发生的愈伤的情况分为四边无愈伤、1边愈伤发生、2边愈伤发生、3边愈伤发生、4边愈伤发生,并依次划分为0、1、 2、3、4五种等级(如图3所示)。
60.潮霉素敏感性分级:按照叶片死亡面积占叶片总面积的比例进行分级0%、25%、 50%、75%、100%,将叶片死亡程度划分为0、1、2、3、4五种等级(图9)。
61.愈伤发生率(%)=愈伤发生外植体数/总接种外植体数
×
100%
62.敏感发生率(%)=坏死发生外植体数/总接种外植体数
×
100%
63.不定芽分化率(%)=出芽的外植体数/接种外植体总数
×
100%
64.不定芽再生率=再生不定芽的外植体数/接种外植体总数*100%
65.外植体平均再生芽数=外植体再生的不定芽总数/再生不定芽的外植体数。
66.实施例1草莓
‘
甜查理’茎尖快繁方法建立。
67.草莓
‘
甜查理’在中国的栽培面积位居首位,本发明系统建立了
‘
甜查理’的茎尖快繁技术,包括茎尖诱导培养、茎尖诱导分化培养、幼苗增殖培养和生根培养。
68.茎尖消毒处理:选取无病虫害且健壮的4厘米长度左右的匍匐茎尖在流水下冲洗1 h(图1),在超净台上利用75%酒精消毒30s,再利用6%次氯酸钠消毒6min,最后用无菌水清洗5次,每次2min;在无菌滤纸上吸干水分后,利用解刨针在超净台上显微镜下剥取茎尖生长点0.3~0.5cm。
69.茎尖诱导培养:将上一步骤剥取的茎尖生长点转接到优选茎尖诱导培养基m2: ms iba 0.5mg/l 6
‑
ba 0.5mg/l,温度(25
±
2)℃,先暗培养一周,再进行光照培养20
‑
30天左右。
70.增殖培养:将茎尖诱导成功的茎尖分生丛芽转接到增殖培养基m4:ms iba 0.01mg/l 6
‑
ba 0.3mg/l上培养,温度(25
±
2)℃,30天左右换一次培养基,一般继代培养2
‑
3次即可。
71.生根培养:将继代2
‑
3次的增殖苗,可以直接转接到生根培养基m6:ms iba 0.05 mg/l上进行生根处理进行生根壮苗处理。温度(25
±
2)℃、光照度2000~3000lx、光照16h(光)/8h(暗)。在遗传转化用叶片之前,将生根健壮的
‘
甜查理’苗(图2) 提前在无激素ms固体培养基上培养20
‑
30天处理,减少草莓苗体内的激素,有利于叶片诱导不定芽的生成。
72.实施例2不同浓度外源激素对草莓
‘
甜查理’叶片诱导再生的影响。
73.随着植物组织培养的快速发展,在草莓组织培养中常用的细胞分裂素有6
‑
ba(6
‑ꢀ
苄基嘌呤)与人工合成的tdz两种细胞分裂素,针对草莓品种
‘
甜查理’叶片愈伤诱导及不定芽分化影响。本发明选取生根壮苗后的
‘
甜查理’无菌苗叶片,先将
‘
甜查理’无菌苗叶片用灭菌的手术刀将叶片边缘锯齿切开,进行激素配比如表1所示,试验分别设置6
‑
ba和tdz两种细胞分裂素各5个浓度梯度,筛选适合
‘
甜查理’叶片诱导愈伤和不定芽的最优培养基。
74.表1不同激素浓度下
‘
甜查理’不定芽诱导分析
75.[0076][0077]
我们根据图3愈伤分级标准,将叶片四边无愈伤、有一边愈伤发生、有两边愈伤发生、有三边愈伤发生、有四边愈伤发生,将愈伤组织划分为0、1、2、3、4五种等级。不同浓度6
‑
ba 和tdz两种细胞分裂素分别处理后的叶片愈伤和不定芽观察分析,结果如图4
‑
5所示, 3.0
‑
3.8mg/l不同梯度浓度6
‑
ba诱导
‘
甜查理’叶片4级愈伤量均较少,在3.3mg/l浓度下叶片褐化比较严重,叶片趋近于褐化枯死。而且在不同浓度的6
‑
ba浓度梯度诱导下,
‘
甜查理’叶片均没有不定芽形成。进一步,本专利尝试用tdz诱导叶片不定芽形成,结果发现1.8
‑
2.6mg/l tdz均可以从
‘
甜查理’叶片中诱导出健康的4级愈伤组织(图 6
‑
7),同时在叶块数目相同的情况下,tdz浓度在2.4mg/l时,不定芽分化率最高(图 8)。综上所述,1.8
‑
2.6mg/l tdz均是
‘
甜查理’叶片诱导愈伤组织和不定芽的优选激素浓度。诱导培养基为m7:ms iba 0.1mg/l tdz 1.8
‑
2.6mg/l。
[0078]
实施例3浸染农杆菌前叶片不同预培养时间对转化不定芽诱导的影响分析。
[0079]
选取在生根壮苗培养基上培养20~30天的无菌苗叶片,将叶片沿着叶脉切成1立方厘米大小的叶块,近轴面朝下放置于培养基m7:ms iba 0.1mg/l tdz 1.8
ꢀ‑
2.6mg/l,ph值为5.8,试验设置0
‑
5天5组不同预培养天数进行预培养(表3),结果如图11所示,4级健康愈伤组织的诱导率随着预培养天数的增加而增加,预培养3 天时3级健康愈伤和4级健康愈伤诱导率达到最大值,之后随着预培养时间的延长,3 级健康愈伤和4级健康愈伤诱导率逐渐降低。由此可见,在m7:ms iba 0.1mg/l tdz 1.8
‑
2.6mg/l培养基上预培养3天时3级健康愈伤和4级健康愈伤的诱导率最高,本发明以此预培养时间为准,进行农杆菌浸染前的叶片预培养愈伤诱导处理。
[0080]
表3不同预培养天数
[0081][0082][0083]
实施例4农杆菌转化和潮霉素筛选
[0084]
在叶片预培养时间探索的基础上,本发明进一步将携带jh19双元表达载体的 gv3101农杆菌进行菌株活化,具体步骤如下:
[0085]
(1)在超净台上用200μl移液枪头挑取
‑
80℃保存的农杆菌,在常规lb kan 50 mg/l gen 50mg/l rif 50mg/l固体培养基上划线培养,28℃,12
‑
48h,长出单菌落。
[0086]
(2)无菌枪头挑取单菌落,划线保存,同时用该枪头挑取单菌落接种于5ml常规lb kan 50mg/l gen50 mg/l rif 50mg/l液体培养基中,28℃,200rpm培养20h,获得步骤(3)所需菌液。
[0087]
(3)取10μl(2)中培养的菌液于20ml相同液体lb培养基中,28℃,200rpm,培养 16
‑
18h,od
600
=1
‑
2。
[0088]
(4)25℃,5000rpm,离心5min收集活化的农杆菌菌体沉淀备用。
[0089]
活化后的菌株和预培养的草莓叶片在浸染培养基m9:ms 乙酰丁香酮(as)20mg/l 中浸染15
‑
30min,后在共培养基m9上暗共培养3
‑
5天,然后在m11培养基上进行暗培养10天延时筛选处理后,可以进行潮霉素1mg/l
‑
5mg/l梯度筛选。
[0090]
实施例5抗生素
‘
潮霉素’不同浓度对草莓品种
‘
甜查理’叶片的敏感性影响。
[0091]
草莓叶片对
‘
潮霉素’的坏死发生情况和敏感性标准如图9所示,按照叶片死亡面积占叶片总面积的比例进行分级0%、25%、50%、75%、100%,将叶片死亡程度划分为0、1、2、3、4五种等级。
[0092]
本发明为了摸索适合
‘
甜查理’叶片敏感性筛选的
‘
潮霉素’浓度,设计了5组不同
‘
潮霉素’浓度培养基(表2),选取壮苗进行生根后,在无激素ms培养基上培养20
‑
30 天左右的
‘
甜查理’无菌苗叶片,切掉叶缘及主叶叶脉,切成0.4
‑
0.5cm的叶盘,近轴面朝下置于2.2mg/ltdz不定芽诱导培养基上,同时在培养基中加入1
‑
5mg/l不同浓度梯度的潮霉素。结果发现,
[0093]
表2不同潮霉素(hyg)浓度
[0094][0095][0096]
当
‘
潮霉素’浓度为0时,叶片的坏死面积为0,随着
‘
潮霉素’浓度的升高,叶片的坏死面积不断扩大,当
‘
潮霉素’浓度为达到5mg/l时,叶片的4级死亡率占了60%以上,2级死亡率仅占了3%左右,由此可见,5
‑
6mg/l是
‘
甜查理’叶片对
‘
潮霉素’敏感度的上线,后期
‘
潮霉素’筛选应保持在该浓度范围以内才能确保叶片不完全死亡(图10)。
[0097]
实施例6转化株系中核心标记基因cas9 pcr检测和gfp荧光观察分析
[0098]
转化愈伤和不定芽在高浓度
‘
潮霉素’筛选之后,进一步我们检测了阳性愈伤分化而来株系苗中cas9基因情况。通过利用t1和t2引物扩增cas9基因,结果显示在第 10、18、19号愈伤诱导的不定芽中成功检测出了cas9基因(图11),并进一步作为备选阳性株系进行后续的检测分析。
[0099]
在cas9基因检测基础上,进一步通过荧光显微镜观察愈伤组织和不定芽gfp荧光蛋白标记发光情况,如图11所示,遗传转化成功的阳性草莓愈伤可以发出荧光,证明携带egfp标签的外源载体已经成功在草莓愈伤中遗传转化并表达,以上转化株系双重检测方法是阳性株系筛选鉴定的有效保障。
[0100]
综上,本发明提供一种草莓
‘
甜查理’茎尖快繁技术和农杆菌介导的草莓
‘
甜查理’无菌叶片遗传转化体系。其中茎尖诱导愈伤和不定芽效率高,遗传转化过程中由乙酰丁香酮诱导农杆菌浸染叶片,通过抗生素浓度梯度控菌,抗生素浓度梯度筛选和多样化筛选标记基因分子pcr检测,提供一种由农杆菌介导的高效的草莓
‘
甜查理’叶片遗传转化体系,为以草莓
‘
甜查理’为基因型材料的组培茎尖快繁和基因功能改良奠定基础。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。