抗dog
‑
1抗体、缀合物、药物组合物、药物制剂及其用途
技术领域
1.本发明涉及生物医药技术领域,尤其是涉及一种抗dog
‑
1抗体、缀合物、药物组合物、药物制剂及其用途。
背景技术:
2.dog1(discovered on gastrointestinal stromal tumor
‑
1),是一种钙离子激活的氯离子通道蛋白,又名ano1、taos2、oraov2和 tmem16a等,参与细胞膜电位、体液分泌、嗅觉形成、神经冲动传导与平滑肌收缩等生理过程。
3.在肿瘤中,dog1异常高表达。研究表明,dog1在胃肠道间质瘤(gastrointestinal stromal tumor,gist)中普遍高表达,阳性率高达99%。dog1还高表达于多种消化道肿瘤,包括食管鳞状细胞癌、胃腺癌、肺腺癌、平滑肌瘤等,而正常组织中表达量极低。此外,一项由1840名gist患者组成的大样本临床实验证实,dog1作为gist 的诊断分子靶标其准确率超过传统的c
‑
kit靶标,目前dog1已被广泛应用于gist的诊断此外。
4.抗体
‑
化疗药物缀合物(antibody
‑
drug conjugates,adc)是将抗肿瘤抗体和强效细胞毒性药物(弹头药物)通过连接子(linker)化学偶联得到的复合物,是肿瘤靶向药物的最新发展方向。截止目前,已有2个adc药物被美国fda批准上市,20余种adc药物处于临床2、3期研究。adc药物包括三个组成部分:针对肿瘤抗原的抗体、强效的弹头药物和连接抗体与弹头药物的linker。抗体的主要功能是药物载体,同时也赋予adc靶向性。弹头药物是adc肿瘤杀伤效应的执行者,其体外半数抑制浓度(half maximal inhibitoryconcentration,ic50)值在nm
‑
pm水平较为理想,一个抗体分子偶联 2
‑
4个分子就能发挥高效杀伤作用。此外,连接抗体和弹头药物的连接子也很重要,与adc的稳定性、体内代谢、药效和毒副作用密切相关。adc通过抗肿瘤抗体的靶向作用与肿瘤细胞表面抗原特异性结合形成抗原
‑
抗体复合物,再经受体介导内吞作用进入肿瘤细胞内,连接子被水解断裂释放出活性药物而发挥细胞毒性作用。
5.胃肠道间质瘤是最常见的胃肠道间质来源肿瘤。gist被认为起源于cajal间质细胞(interstitial cells of cajal,icc)或者干细胞前体。大多数患者存在kit突变,少部分患者存在pdgfra突变。上述突变导致非配体依赖的受体酪氨酸激酶(receptor tyrosine kinases, rtk)持续活化,导致肿瘤快速进展。也存在无上述突变的野生型肿瘤,发生与增殖机理不清。胃肠道间质瘤对化疗不敏感,手术切除是目前的首选治疗方案。近年来,随着靶向药物发展,对于体积较大难以手术患者,可使用靶向药物治疗。伊马替尼(imatinib mesylate, gleevec)是一种小分子抑制剂,能有效抑制kit酪氨酸激酶受体,具有对抗kit、pdfgfra的活性,是目前治疗手术不可切除gist 的一线临床靶向药物。其他小分子靶向药物如苏尼替尼(sunitinib, sutent)等,目前被用于经伊马替尼治疗失败后gist患者的替代治疗药物。但上述药物在临床应用中会很快产生耐药性。综上所述,在结肠癌与间质瘤的靶向治疗过程中,肿瘤存在快速耐药现象,因此继续开发新型靶向药物具有重大意义。
技术实现要素:
6.有鉴于此,本发明提供了一种抗dog
‑
1抗体、缀合物、药物组合物、药物制剂及其用途,以解决了现有技术在结肠癌与间质瘤的靶向治疗过程中的药物会很快产生耐药性的技术问题。
7.为了实现上述目的之一,本发明提供了一种抗dog
‑
1抗体或其抗原结合片段,所述抗dog
‑
1抗体或其抗原结合片段包含:
8.(a)下述3个重链可变区(vh)的互补决定区(cdr):
9.(i)vh cdr1,其具有如seq id no:1所示的vh中含有的cdr1 的序列,或者与所述vh中含有的cdr1的序列相比具有一个或几个氨基酸的置换、缺失或添加(例如1个,2个或3个氨基酸的置换、缺失或添加)的序列;
10.(ii)vh cdr2,其具有如seq id no:2所示的vh中含有的cdr2 的序列,或者与所述vh中含有的cdr2的序列相比具有一个或几个氨基酸的置换、缺失或添加(例如1个,2个或3个氨基酸的置换、缺失或添加)的序列;和
11.(iii)vh cdr3,其具有如seq id no:3所示的vh中含有的cdr3 的序列,或者与所述vh中含有的cdr3的序列相比具有一个或几个氨基酸的置换、缺失或添加(例如1个,2个或3个氨基酸的置换、缺失或添加)的序列;
12.和/或
13.(b)下述3个轻链可变区(vl)的互补决定区(cdr):
14.(iv)vl cdr1,其具有如seq id no:4所示的vl中含有的cdr1 的序列,或者与所述vl中含有的cdr1的序列相比具有一个或几个氨基酸的置换、缺失或添加(例如1个,2个或3个氨基酸的置换、缺失或添加)的序列;
15.(v)vl cdr2,其具有如seq id no:5所示的vl中含有的cdr2 的序列,或者与所述vl中含有的cdr2的序列相比具有一个或几个氨基酸的置换、缺失或添加(例如1个,2个或3个氨基酸的置换、缺失或添加)的序列;
16.(vi)vl cdr3,其具有如seq id no:6所示的vl中含有的cdr3 的序列,或者与所述vl中含有的cdr3的序列相比具有一个或几个氨基酸的置换、缺失或添加(例如1个,2个或3个氨基酸的置换、缺失或添加)的序列。
17.根据一种优选实施方式,(i)
‑
(vi)任一项中所述的置换为保守置换。
18.根据一种优选实施方式,所述重链可变区(vh)中含有的3个cdr 和/或所述轻链可变区(vl)中含有的3个cdr由kabat、chothia或 imgt编号系统定义。
19.根据一种优选实施方式,所述重链可变区(vh)中含有的3个cdr 和/或所述轻链可变区(vl)中含有的3个cdr由kabat编号系统定义。
20.本发明的抗dog
‑
1抗体或其抗原结合片段包含:
21.(a)重链可变区(vh),其包含选自下列的氨基酸序列:
22.(i)seq id no:7所示的序列;
23.(ii)与seq id no:7所示的序列相比具有一个或几个氨基酸的置换、缺失或添加(例如1个,2个,3个,4个或5个氨基酸的置换、缺失或添加)的序列;或
24.(iii)与seq id no:7所示的序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序
列同一性的序列;
25.和/或
26.(b)轻链可变区(vl),其包含选自下列的氨基酸序列:
27.(iv)seqidno:8所示的序列;
28.(v)与seqidno:8所示的序列相比具有一个或几个氨基酸的置换、缺失或添加(例如1个,2个,3个,4个或5个氨基酸的置换、缺失或添加)的序列;或
29.(vi)与seqidno:8所示的序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性的序列。
30.根据一种优选实施方式,(ii)或(v)中所述的置换是保守置换。
31.本发明的抗dog
‑
1抗体或其抗原结合片段包含重链和轻链,其中:
32.(i)所述重链至少包含三个cdr区,所述cdr区分别具有如seqidno:1、2和3所示的氨基酸序列;和
33.(ii)所述轻链至少包含三个cdr区,所述cdr区分别具有如seqidno:4、5和6所示的氨基酸序列。
34.本发明提供了一种分离的核酸分子,其包含编码本发明的抗dog
‑
1抗体或其抗原结合片段,或其重链可变区和/或轻链可变区的核苷酸序列。
35.根据一种优选实施方式,所述分离的核酸分子编码本发明的抗dog
‑
1抗体或其抗原结合片段,或其重链可变区和/或轻链可变区。
36.本发明提供了一种分离的核酸分子,其包含编码抗dog
‑
1抗体的重链可变区的核酸分子,和/或编码抗dog
‑
1抗体的轻链可变区的核酸分子,其中,所述编码重链可变区的核酸分子具有选自下列的序列:
37.(a)如seqidno:9的核苷酸序列,或(b)与(a)所述的核苷酸序列基本上相同的序列(例如,与(a)所述的核苷酸序列相比,具有至少大约85%、90%、95%、99%或更高序列同一性的序列,或具有一个或更多个核苷酸取代的序列);
38.所述编码抗dog
‑
1抗体的轻链可变区的核酸分子具有选自下列的序列:(a)如seqidno:10所示的核苷酸序列,或(b)与(a)所述的核苷酸序列基本上相同的序列(例如,与(a)所述的核苷酸序列相比,具有至少大约85%、90%、95%、99%或更高序列同一性的序列,或具有一个或更多个核苷酸取代的序列)。
39.根据一种优选实施方式,所述编码抗dog
‑
1抗体的重链可变区的核酸分子具有如seqidno:9所示的核苷酸序列,以及所述编码抗dog
‑
1抗体的轻链可变区的核酸分子具有如seqidno:10所示的核苷酸序列。
40.根据一种优选实施方式,本发明分离的核酸分子包含如seqidno:9所示的编码抗体重链可变区的核酸分子,和/或如seqidno:10所示的编码抗体轻链可变区的核酸分子。
41.根据一种优选实施方式,所述抗体是人源化抗体。
42.在另一些方面,本发明还提供了一种缀合物,分子式为ab
‑
(l
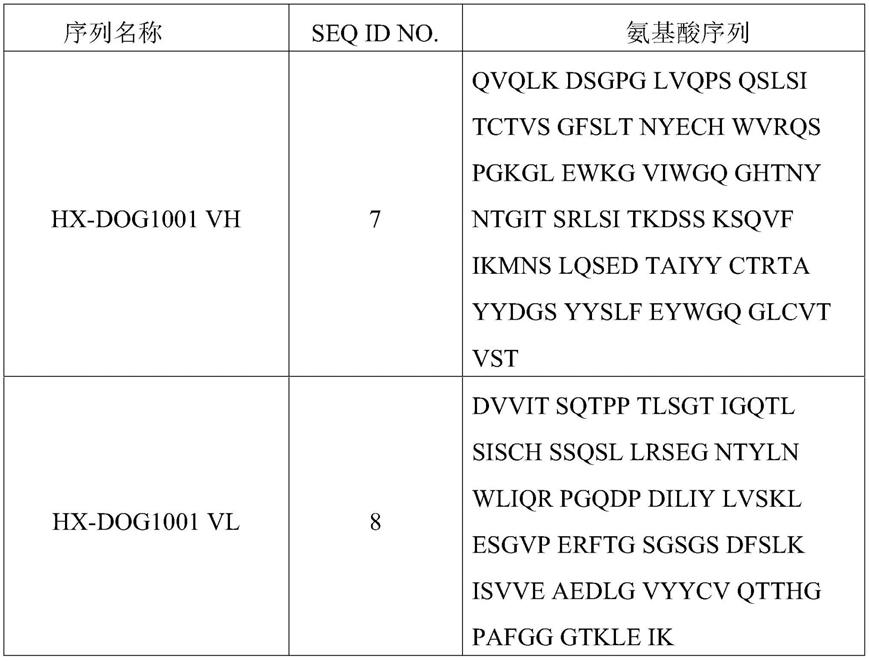
‑
d)n,其中:ab是抗dog
‑
1抗体或其抗原结合片段,所述抗dog
‑
1抗体或抗原结合片段包含重链可变区的互补决定区seqidno:1、seqidno:2和seqidno:3以及轻链可变区的互补决定区seqid
no:4、seqidno:5和seqidno:6;
43.l是接头;
44.d是药物部分;
45.n是从1至10的整数。
46.根据一种优选实施方式,所述缀合物是抗体药物缀合物(adc)。
47.根据一种优选实施方式,本发明的抗dog
‑
1抗体或其抗原结合片段任选地通过接头与药物部分缀合。
48.根据一种优选实施方式,本发明的抗dog
‑
1抗体或其抗原结合片段通过可裂解或不可裂解的接头与药物部分缀合。
49.根据一种优选实施方式,所述n是3或4。
50.根据一种优选实施方式,所述药物部分选自mmae、mmaf、dm1、dm4及它们的衍生物中的一种或者多种。
51.其中mmae(monomethylauristatine,单甲基耳抑素肽e)及其衍生物、mmaf(monomethylauristatinf,单甲基耳抑素肽f)及其衍生物、dm1(mertansinederivativem1)、dm4(mertansinederivativem4)、duocarmycine、calicheamicin、pbda、doxorubicin、vincaalkaloids、metrotrexate、vinblastine、daunorubicin;
52.抗体药物缀合物(adc)由抗dog
‑
1抗体和一种或多种药物部分缀合得到,所述药物部分包括但不限于小分子药物,诸如喜树碱衍生物、加利车霉素(calicheamicin)、美登素(maytansine)或其衍生物、美登木素生物碱(maytansinoids)、多拉司他汀(dolastatin)、澳瑞他汀、单端孢霉素(trichothecene)和cc1065及这些药物具有细胞毒活性的片段。
53.以及药物部分选自细胞毒素或放射性同位素,合适的药物部分的非限制性实例包括:抗代谢物、烷化剂、dna小沟结合剂、dna嵌入剂、dna交联剂、组蛋白去乙酰基酶抑制剂、核输出抑制剂、蛋白酶体抑制剂、拓扑异构酶i或ii抑制剂、热激蛋白抑制剂、酪氨酸激酶抑制剂、抗生素及抗有丝分裂剂。
54.根据一种优选实施方式,所述接头选自可切割接头或不可切割接头。
55.根据一种优选实施方式,所述可切割接头或所述不可切割接头选自n
‑
琥珀酰亚胺基
‑3‑
(2
‑
吡啶基二硫代)丙酸酯(spdp)、n
‑
琥珀酰亚胺基4
‑
(2
‑
吡啶基二硫代)戊酸酯(spp)、n
‑
琥珀酰亚胺基4
‑
(2
‑
吡啶基二硫代)丁酸酯(spdb)、n
‑
琥珀酰亚胺基
‑4‑
(2
‑
吡啶基二硫代)2
‑
磺基
‑
丁酸酯(磺基
‑
spdb)、n
‑
琥珀酰亚胺基碘乙酸酯(sia)、n
‑
琥珀酰亚胺基(4
‑
碘乙酰基)氨基苯甲酸酯(siab)、马来酰亚胺pegnhs、n
‑
琥珀酰亚胺基4
‑
(马来酰亚胺甲基)环己烷羧酸酯(smcc)、n
‑
磺基琥珀酰亚胺基4
‑
(马来酰亚胺甲基)环己烷羧酸酯(磺基
‑
smcc)或2,5
‑
二氧杂吡咯烷
‑1‑
基17
‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)
‑
5,8,11,14
‑
四氧代
‑
4,7,10,13
‑
四氮杂十七碳
‑1‑
酸酯(cx1
‑
1)。
56.根据一种优选实施方式,所述接头可以是二肽接头,诸如缬氨酸
‑
瓜氨酸(val
‑
cit)、苯丙氨酸
‑
赖氨酸(phe
‑
lys)接头或马来酰亚胺基己酰基
‑
缬氨酸
‑
瓜氨酸
‑
对氨基苄基氧基羰基(vc)接头。
57.根据一种优选实施方式,,所述接头为n
‑
琥珀酰亚胺基4
‑
(2
‑
吡啶基二硫代)丁酸酯(spdb)。
58.在另一些方面,本发明提供了一种药物组合物,其含有本发明的抗体或其抗原结
合片段或者本发明的缀合物,以及药学上可接受的载体和/或赋形剂。
59.根据一种优选实施方式,所述药物组合物还可以包含另外的药学活性剂。
60.所述另外的药学活性剂是具有抗肿瘤活性的药物,例如另外的免疫检查点抑制剂、溶瘤病毒、化学治疗剂、抗血管生成药物、抗代谢药物、靶向肿瘤药物、免疫刺激剂等。
61.所述另外的药学活性剂是用于治疗感染的药物,例如抗病毒剂、抗真菌剂、抗细菌剂、免疫刺激剂等。
62.在另一些方面,本发明提供了一种药物制剂,包括上述所述的缀合物,所述药物制剂为固体制剂、半固体制剂、液体制剂或气体制剂。
63.在另一些方面,本发明提供了如本发明公开的缀合物在制备用于治疗、预防或诊断肿瘤、感染性疾病和自身免疫性疾病的药物中的用途。
64.根据一种优选实施方式,所述肿瘤选自实体瘤。
65.根据一种优选实施方式,所述肿瘤选自消化道肿瘤。
66.根据一种优选实施方式,所述肿瘤为dog
‑
1阳性的肿瘤。
67.根据一种优选实施方式,所述肿瘤选自食管癌、胃肠癌、胰腺癌、甲状腺癌、结直肠癌、肾癌、肺癌、肝癌、胃癌、头颈癌、膀胱癌、乳腺癌、子宫癌、宫颈癌、卵巢癌、前列腺癌、睾丸癌、生殖细胞癌、骨癌、皮肤癌、胸腺癌、胆管癌、黑素瘤、间皮瘤、淋巴瘤、骨髓瘤、肉瘤、成胶质细胞瘤、神经胶质母细胞瘤、白血病或癌症的转移性、难治性或复发性病灶。
68.本发明具有以下技术效果:
69.本发明提供的抗dog
‑
1抗体,通过其独特的重链可变区的互补决定区和轻链可变区的互补决定区,克服了现有技术在结肠癌与间质瘤的靶向治疗过程中的药物会很快产生耐药性的缺陷。
附图说明
70.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
71.图1表面等离子共振检测hx
‑
dog1001与人源dog
‑
1的亲和力;
72.图2流式细胞术检测hx
‑
dog1001与多种肿瘤细胞系的结合力;
73.图3流式细胞术检测hx
‑
dog1001在gist
‑
882细胞系中内吞变化(从下至上分别为阴性对照组(control),0、1、3、6h实验组);
74.图4不同时间gist
‑
882细胞系中的hx
‑
dog1001内吞率;
75.图5共聚焦显微镜观察gist
‑
882细胞系对hx
‑
dog1001抗体的内吞过程(分别为0h、1h、3h、6h结果;蓝色为细胞核,绿色为细胞骨架,红色为hx
‑
dog1001抗体);
76.图6a
‑
b hx
‑
dog1001
‑
adc的结构示意图(a); hx
‑
dog1001
‑
adc的偶联率测定结果(b);
77.图7a
‑
b hx
‑
dog1001
‑
adc的体外毒性结果; hx
‑
dog1001
‑
adc作用于gist
‑
882、ht
‑
29和mgc
‑
803细胞系随时间变化的生长曲线(a);hx
‑
dog1001
‑
adc作用于gist
‑
882、 ht
‑
29和mgc
‑
803细胞系24、48、72h的细胞毒性(b);
78.图8hx
‑
dog1001
‑
adc治疗结肠癌细胞系ht
‑
29cdx模型的体内活性;
79.图9hx
‑
dog1001
‑
adc治疗胃肠道间质瘤gist pdx模型的体内活性。
具体实施方式
80.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
81.实施例1、抗dog
‑
1抗体的产生
82.1.1抗dog
‑
1抗体的筛选
83.(1)将人dog
‑
1胞外域抗原(genbank:np_060513.5所示序列第1
‑
301位多肽片段,由xxx公司制备)50μg以完全弗氏佐剂充分乳化后,利用多点免疫方式免疫雄性balb/c小鼠,免疫周期为2
‑
3周一次。
84.(2)在第三次免疫后第10天,取尾静脉血,用elisa法测试血浆抗dog
‑
1抗体滴度,然后融合前3天对产生抗dog
‑
1抗体滴度最高的小鼠加强免疫一次。
85.(3)3天后处死小鼠并取出该小鼠脾脏与小鼠骨髓瘤sp2/0细胞株融合。
86.(4)混合2
×
108个sp2/0细胞与2
×
108个脾细胞在50%聚乙二醇(分子量为1450)和5%二甲基亚砜(dmso)溶液中融合。
87.(5)用hat筛选培养基(dmem培养基,含有10%胎牛血清, 100u/ml青霉素,100μg/ml链霉素,0.1mm次黄嘌呤,0.4μm氨基蝶呤和16μg胸苷)调整脾脏细胞数至5
×
105/ml,加入96孔培养板孔内(每孔0.3ml),置于37℃,5%co2培养箱内进行培养。
88.(6)培养10天后,采用高通量elisa筛选法检测上清中抗体与dog
‑
1抗原高亲和结合的克隆。
89.(7)然后将上述单克隆抗体的孔内融合细胞进行亚克隆。
90.(8)再通过竞争elisa的方法,以此筛选出竞争结合dog
‑
1 的阳性孔,获得杂交瘤细胞株。继续培养产生特异性抗体的克隆。当细胞密度达到约5
×
105个细胞/ml时,用无血清培养基替换该培养基。
91.(9)培养三天后,将培养过的培养基离心,以收集培养物上清液进一步纯化抗体。最终获得待测试的纯化的杂交瘤细胞株对应的单克隆抗体。
92.1.2hx
‑
dog1001抗体的序列分析
93.按照上述方法制备得到了1株特异性结合dog
‑
1的抗体,命名为hx
‑
dog1001。抗体的vh和vl序列如表1所示。进一步使用 kabat等人描述的方法(kabat等,sequences of proteins ofimmunological interest,第五版,publichealth service,美国国立卫生研究院,贝塞斯达、马里兰州(1991),第647
‑
669页),确定了筛选得到的hx
‑
dog1001抗体的cdr序列,具体如表2所示。
94.表1 hx
‑
dog1001抗体轻重链可变区氨基酸序列
[0095][0096]
表2 hx
‑
dog1001抗体cdr的序列
[0097]
序列名称seq id no.氨基酸序列vh cdr11nyechvh cdr22viwgqghtnyntgitsvh cdr33sgyyydgsyyslfdyvl cdr14hssqsllrsegntylnvl cdr25lvsklesvl cdr36vqtthgpa
[0098] 实施例2、表面等离子共振法(spr)检测抗体的抗原亲和活性
[0099]
利用biacore t200仪器(ge healthcare公司)进行抗体的抗原亲和力测定。
[0100]
1.计算抗原偶联ru
[0101]
根据rmax=(mwanalyte/mwligand)
×
rl
×
sm,实际偶联量为 rl的1.5倍。算出适宜检测hx
‑
dog1001抗体的抗原偶联量为 1557ru;
[0102]
2.偶联操作
[0103]
偶联缓冲液缓为1
×
hbs
‑
ep buffer,50mm naoh作为清洗液。使用ph为4.5的醋酸钠溶液配制her2蛋白至10μg/ml。选择氨基偶联,在target level中输入1557ru,将抗原样品、naoh、乙醇胺、 edc、nsh、空试管根据提示放到样品盘中相应的位置,点击开始。
[0104]
3.样品检测
[0105]
用1
×
hbs
‑
ep buffer将样品稀释至32nm、16nm、8nm、4nm、 2nm、1nm、0.5nm、0.25nm。13,000rpm/min,离心3min;所有的样品均设置一个重复。
[0106]
kinetics/affinity选项中的flow pat选2
‑
1;regeneration选择2。
affinipuregoatanti
‑
humanigg(h l),sa00003
‑
12,proteintech),100μl/组,冰上孵育30min;
[0127]
(6)阴性对照组加入以1:100的比例稀释二抗(fluorescein(fitc)
–
conjugatedaffinipuregoatanti
‑
humanigg(h l),sa00003
‑
12,proteintech)100μl,冰上孵育30min;
[0128]
(7)重复步骤5;加入500μlpbs重悬细胞,上流式细胞仪检测,检测结果图3所示。
[0129]
记录阴性对照组(control),0、1、3、6h实验组的荧光强度(meanx,如表4)。利用阴性对照组的荧光强度作为基准,以(0h实验组的荧光强度
‑
th实验组的荧光强度)/(0h实验组的荧光强度
‑
阴性对照组的荧光强度)
×
100%为计算公式,计算内吞效率,结果如图4所示,hx
‑
dog1001在gist
‑
882细胞系中8h的内化率高达80%。
[0130]
表4gist
‑
882细胞膜表面结合的hx
‑
dog1001荧光强度(meanx)
[0131]
编号分组荧光强度(meanx)1gist882(6h)10,4382gist882(3h)13,9963gist882(1h)15,4624gist882(0h)16,5075gist882control8,981
[0132]
实施例5、激光共聚焦测定hx
‑
dog1001抗体的内化
[0133]
利用激光共聚焦显微镜可以实时动态检测抗体的内化过程。
[0134]
(1)收集对数生长期的gist
‑
882细胞,以约5
×
105/孔的密度铺入4个nunc玻底培养皿(thermoscientific);
[0135]
(2)细胞置于培养箱中贴壁培养24h后,用pbs清洗细胞;4组均加入含5μg/mlhx
‑
dog1001的pbs,分别置于0℃避光孵育30min,37℃避光孵育1h、3h、6h;孵育结束后,用1
×
pbs清洗细胞三次;
[0136]
(3)fitc标记鬼笔环肽(solarbio,ca1620)室温孵育20min;
[0137]
(4)1
×
pbs清洗三次,4%多聚甲醛固定,室温10min;
[0138]
(5)1
×
pbs清洗三次,hoechst(thermoscientific,hoechst33342)进行细胞核染色;置于共聚焦显微镜下检测。
[0139]
实验结果如图5所示,在dog1阳性细胞系gist882中,hx
‑
dog1001于0℃孵育30min时,抗体开始结合在细胞膜表面;hx
‑
dog1001于37℃孵育1h时,细胞膜表面结合抗体增加,出现少量内吞现象;hx
‑
dog1001于孵育3h时,细胞膜表面结合抗体开始减少,细胞质浅表出现较多抗体;hx
‑
dog1001于孵育6h时,抗体已经大量内吞进入细胞质深部,浅表剩余较少抗体分布于整个细胞。结果说明hx
‑
dog1001能在1h左右被gist882细胞系快速介导内吞,且抗原
‑
抗体复合物能在细胞表面停留3h左右,此性质有利于adc药物渗透进入实体瘤深部,证明hx
‑
dog1001具有开发为adc药物的潜质。
[0140]
实施例6、hx
‑
dog1001抗体药物缀合物的制备
[0141]
1.抗体hx
‑
dog1001的纯化
[0142]
经proteina从293f细胞培养液中捕获得到的单克隆抗体,sds
‑
page电泳及sec分析纯度达到95%以上。用30kd超滤浓缩管将所获抗体蛋白置换到pbs缓冲液中,浓缩,用
nanodrop (thermofisher公司)标定浓度,用于后续的偶联反应。
[0143]
2.抗体hx
‑
dog1001与药物分子的偶联
[0144]
本实施例中采用美登素类化合物dm4作为细胞毒性分子,spdb 作为接头,与hx
‑
dog1001进行偶联制备抗体药物缀合物(adcs),其结构示意图如图6a所示。值得注意的是,前述实施例已经证实了 hx
‑
dog1001作为内吞作用优异的抗dog
‑
1抗体,具有开发成为 adcs的潜力。因此,本实施例中选用的细胞毒性分子dm4和spdp 接头仅作为示例,以证明由hx
‑
dog1001制备的抗体药物缀合物效果。
[0145]
用30kd超滤浓缩管将抗体蛋白置换到偶联反应液(50mm磷酸钾,50mm氯化钠,2mm edta,ph 7.2),nanodrop检测并将浓度调整为5mg/ml。称取适量的dm4
‑
spdb,用dmf配置成10mg/ ml的母液。抗体:dm4
‑
spdb以1:10的摩尔比反应。dm4
‑
spdb 需按照10%体积比加入5mg/ml的抗体反应液中;充分混匀抗体和 dm4
‑
spdb,将反应体系置于恒温摇床中,25℃,200rpm/min,反应约18h。反应完成后,用30kd超滤浓缩管将所获adc置换到pbs 缓冲液中,置换3次,去除未偶联dm4
‑
spdb,浓度调整为1mg/ml 保存。
[0146]
使用液质联用仪(waters公司,quattropremierxe)测定偶联率,抗体
‑
药物的偶联率dar(drug
‑
antibodyratio)=3.55(图6b)。
[0147]
实施例7、hx
‑
dog1001抗体药物缀合物的体外细胞毒性测定
[0148]
在表达dog
‑
1的细胞系上评估抗体药物缀合物 hx
‑
dog1001
‑
adc的细胞毒性。
[0149]
用含10%胎牛血清的dmem培养基培养胃肠道间质瘤gist882 细胞系、结肠癌ht
‑
29、结肠癌hct
‑
116、肝癌hepg
‑
2细胞系,置于5%co2,37℃恒温细胞培养箱中培养;收集对数生长期的细胞,计数并调整细胞悬液的细胞密度;将含有1
×
104个肿瘤细胞的0.1ml 细胞悬液接种于rtca分析仪(agilent,xcelligencertcasp)的 e
‑
plate96板各孔中。培养24小时后各孔分别加入不同浓度的待测药物(抗体对照组:hx
‑
dog1001;药物对照组:伊马替尼imatinib)。通过rtca分析仪监测给药后0
‑
72小时的细胞生长曲线(cellindex 值),并采用graphpadprism(version8.0)软件计算ic50值,结果如图 7所示,hx
‑
dog1001
‑
adc对胃肠道间质瘤gist
‑
882、结肠癌ht
‑
29、 hct
‑
116和胃癌mgc
‑
803细胞系的增殖抑制作用的ic50分别为 8.374nm、9.913nm、17.92nm,且均具有浓度依赖性。
[0150]
同时,hx
‑
dog1001
‑
adc作用于gist
‑
882、ht
‑
29和mgc
‑
803 细胞系随时间变化的生长曲线见图8所示,对应的24、48、72h的细胞毒活性如图7b所示。结果表明hx
‑
dog1001
‑
adc对gist
‑
882、 ht
‑
29和mgc
‑
803细胞系的细胞毒性具有时间依赖性。
[0151]
实施例8、hx
‑
dog1001
‑
adc对裸鼠结肠癌细胞株移植瘤 (cdx)模型的肿瘤增殖抑制活性
[0152]
将hx
‑
dog1001
‑
adc单次尾静脉注射给皮下移植人结肠癌细胞系ht
‑
29的裸鼠后,测定肿瘤体积和动物体重变化,计算adc对荷瘤小鼠的药效(抑瘤疗效)。用pbs配制hx
‑
dog1001抗体和 hx
‑
dog1001
‑
adc溶液至适当浓度,并采用相同浓度的pbs作为溶剂对照。
[0153]
选择随机分组(根据样品数量决定分组数)的肿瘤体积在 100~200mm3的荷瘤鼠,5只/组。给药剂量为hx
‑
dog1001
‑
dm4高浓度组10mg/kg,hx
‑
dog1001
‑
dm4低浓度组5mg/kg, hx
‑
dog1001裸抗组10mg/kg,溶剂对照组1ml/kg。给药途径为尾静脉注射。每3天给药一次,给药三次。第一次给药后每周2次用游标卡尺测量肿瘤直径,并按如下计算公式计算肿瘤体积:v=0.52
×
length
×
width2,其中length和width分别表示肿瘤的长径和短径。每天观察
记录动物死亡情况。
[0154]
采用以下公式计算肿瘤生长抑制率tgi(%),tgi(%)=[1
‑
(vt末
‑
vt始)/(vc末
‑
vc始)]
×
100%。其中vt末:处理组实验结束时肿瘤体积均值;vt始:处理组给药开始时肿瘤体积均值;vc末:溶剂对照组实验结束时肿瘤体积均值;vc始:溶剂对照组给药开始时肿瘤体积均值。结果如表5和图8所示。
[0155]
表5结肠癌ht
‑
29细胞系cdx中的hx
‑
dog1001
‑
adc效力
[0156][0157][0158]
表5和图8显示,与对照相比,hx
‑
dog1001
‑
adc在结肠癌 ht
‑
29细胞系的cdx模型中有效。这表明在该模型中, hx
‑
dog1001
‑
adc在体内能够有效抑制肿瘤生长。
[0159]
实施例9、hx
‑
dog1001
‑
adc对胃肠道间质瘤(gist)人源肿瘤异种移植(pdx)模型的肿瘤增殖抑制活性
[0160]
将hx
‑
dog1001
‑
adc单次尾静脉注射给皮下移植人结肠癌细胞系ht
‑
29的裸鼠后,测定肿瘤体积和动物体重变化,计算抗体
‑
药物偶联物对荷瘤小鼠的药效(抑瘤疗效)。用pbs配制hx
‑
dog1001抗体和hx
‑
dog1001
‑
adc溶液至适当浓度,并采用相同浓度的pbs 作为溶剂对照。
[0161]
选择随机分组(根据样品数量决定分组数)的肿瘤体积在 100~200mm3的荷瘤鼠,5只/组。给药剂量为hx
‑
dog1001
‑
adc高浓度组10mg/kg,hx
‑
dog1001
‑
adc低浓度组5mg/kg, hx
‑
dog1001抗体组10mg/kg,溶剂对照组1ml/kg。给药途径为尾静脉注射。每3天给药一次,给药三次。第一次给药后每周2次用游标卡尺测量肿瘤直径,并按如下计算公式计算肿瘤体积:v=0.52
×
length
×
width2,其中length和width分别表示肿瘤的长径和短径。每天观察记录动物死亡情况。
[0162]
采用以下公式计算肿瘤生长抑制率tgi(%),tgi(%)=[1
‑
(vt末
ꢀ‑
vt始)/(vc末
‑
vc始)]
×
100%。其中vt末:处理组实验结束时肿瘤体积均值;vt始:处理组给药开始时肿瘤体积均值;vc末:溶剂对照组实验结束时肿瘤体积均值;vc始:溶剂对照组给药开始时肿瘤体积均值。结果如表6和图9所示。
[0163]
表6胃肠道间质瘤gist的pdx中hx
‑
dog1001
‑
adc效力
[0164][0165]
表6和图9显示,与对照相比,hx
‑
dog1001
‑
adc在胃肠道间质瘤gist的pdx模型中有效。这表明在该模型中, hx
‑
dog1001
‑
adc在体内能够有效抑制肿瘤生长。
[0166]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。