1.本技术属于化学领域,具体涉及芳烷基胺类化合物及其盐的制备方法。
背景技术:
2.目前的芳烷基胺类化合物及其盐的合成方法多采用例如金属催化氢化反应或多步反应过程,杂质种类复杂且不易去除。已有的芳烷基胺类化合物(例如下述化合物e)的合成方法包括例如将邻甲氧基苯基丙酮和甲胺醇溶液经贵金属高压催化氢化反应,上述反应常用钯碳,氧化铂等贵金属,价格昂贵,且需要专门的高压氢化设备,显著增加生产成本,且对生产场地有特殊要求。或者将邻甲氧基苯基丙酮和甲胺甲醇溶液先形成席夫碱,后经金属还原剂进行还原。该反应需低温反应,且易形成杂质,难以去除。且后处理过程中会生成大量氢气,对设备场地有较高要求。或者通过向邻甲氧基苯基丙酮通入一甲胺气体合成中间体邻甲氧基苯基肟,再加入硼氢化钠或硼氢化钾进行还原,该方法需要用到不易进行的通气操作且通气时间长达11
‑
13个小时,反应时间长且反应过程复杂,需分多步反应进行。
技术实现要素:
3.根据本技术的一个方面,提供了制备式i化合物的方法,
[0004][0005]
其中:
[0006]
各个r1独立地选自氢、烷基、环烷基、芳基、杂芳基和烷氧基;
[0007]
r2、r3各自独立地选自烷基和环烷基;
[0008]
r4选自氢、烷基、环烷基和烷氧基;以及
[0009]
x为选自1至4的整数;
[0010]
所述方法包括:
[0011]
将以下式a化合物与r2nh2的甲酸盐溶液反应得到所述式i化合物;
[0012][0013]
其中式a中的各个r1、r3、r4和x如上所定义,r2nh2中的r2如上所定义。
[0014]
另一方面,本技术提供了制备式i化合物的盐酸盐的方法,
[0015][0016]
其中:
[0017]
各个r1独立地选自氢、烷基、环烷基、芳基、杂芳基和烷氧基;
[0018]
r2、r3各自独立地选自烷基和环烷基;
[0019]
r4选自氢、烷基、环烷基和烷氧基;以及
[0020]
x为选自1至4的整数;
[0021]
所述制备式i化合物的盐酸盐的方法包括:
[0022]
通过上述制备式i化合物的方法制得式i化合物;以及
[0023]
在所得式i化合物中加入氯化氢溶液得到所述盐酸盐。
附图说明
[0024]
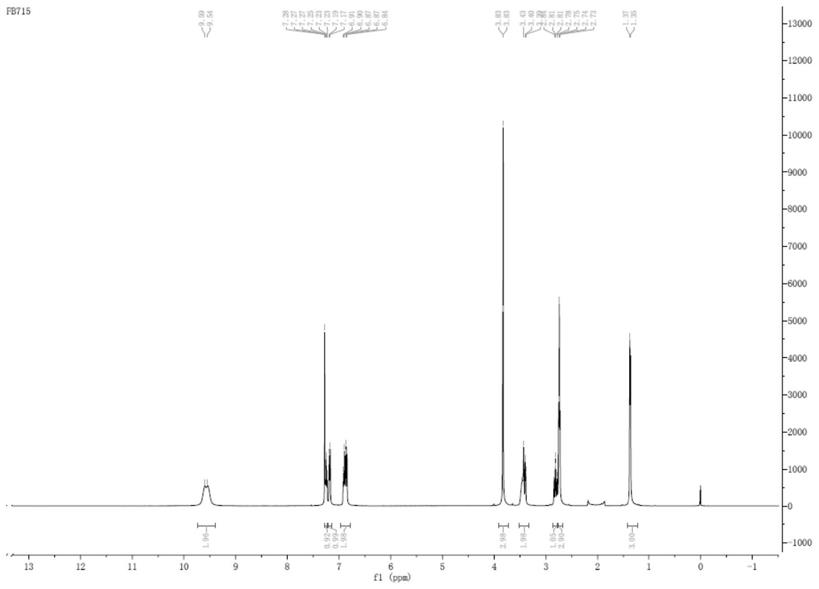
图1为实施例1中制得的白色固体产物的1h
‑
nmr图谱。
[0025]
图2为实施例1中制得的白色固体产物的ms图谱。
[0026]
图3为实施例1中制得的白色固体产物的hplc色谱图。
具体实施方式
[0027]
发明详述
[0028]
定义
[0029]
提供以下定义和方法用以更好地界定本技术以及在本技术实践中指导本领域普通技术人员。除非另作说明,否则术语按照相关领域普通技术人员的常规用法理解。本文所引用的所有专利文献、学术论文及其他公开出版物,其中的全部内容整体并入本文作为参考。
[0030]
术语“烷基”是指直链或支链的饱和烃基,例如c1‑8烷基、c1‑6烷基、c1‑4烷基。烷基的例子包括甲基(me),乙基(et),丙基(如,n
‑
丙基和异丙基),丁基(如,n
‑
丁基,异丁基,s
‑
丁基,t
‑
丁基),戊基(如,n
‑ꢀ
戊基,异戊基,新戊基)等;例如,术语“c1‑6烷基”指含有1至6(例如 1、2、3、4、5、6)个碳原子的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、1
‑
甲基丁基、2
‑
甲基丁基、 3
‑
甲基丁基、新戊基、己基、2
‑
甲基戊基等)。
[0031]
除非另有规定,术语“环烷基”包括任何稳定的单环状或多环状烃基,任何碳原子都是饱和的。环烷基的实例包括,但不限于,环丙基、环丁基、环戊基、环已基、降冰片烷基、[2.2.2]二环辛烷、[4.4.0]二环癸烷等。
[0032]
术语“烷氧基”代表通过氧桥连接的具有特定数目碳原子的上述烷基,除非另有规定,c1‑6烷氧基包括c1、c2、c3、c4、c5和c6的烷氧基。烷氧基的例子包括但不限于:甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基、正戊氧基和s
‑
戊氧基。
[0033]
术语“芳基”是指具有完全共轭的π电子体系的全碳单环或稠合环,其具有6
‑
18个碳原子,优选具有6
‑
12个碳原子,最优选具有6
‑
10个碳原子。芳基的非限制性实例包括但不限于苯基、萘基和蒽基。
[0034]
术语“杂芳基”是指5
‑
18个环原子的单环或稠合环,例如具有5、 6、7、8、9、10、11或12个环原子,其中含有1、2、3或4个选自 n、o、s的杂环原子,其余环原子为c,且具有完全共轭的π
‑
电子体系。非取代的杂芳基的非限制性实例包括但不限于吡咯基、呋喃基、噻吩基、咪唑基、噁唑基、吡唑基、吡啶基、嘧啶基、吡嗪基、喹啉基、异喹啉基、四唑基、三嗪基。
[0035]
本文所用术语“c
n”是指给定分子具有的碳原子数为n,其中n是正整数,例如c1‑6是指给定分子中碳原子数可以为1、2、3、4、5或 6。c1‑4是指给定分子中碳原子数可以为1、2、3或4。
[0036]
结构单元表示其中取代基r1可以在苯环上的5个取代位点中的任意一个或多个位置上进行取代。
[0037]
术语“强碱”是指在水溶液中电离出的阴离子全部是氢氧根离子的物质,其溶液在标准情况下(浓度为0.1mol/l)的ph>12,是与弱碱相对的。
[0038]
术语“强酸”是指在水溶液中接近完全电离的酸,或以酸度系数的概念理解,则指pk
a
值<
‑
1.74的酸。这个值可以理解为在标准状况下,氢离子的浓度等同于加入强酸后的溶液浓度。
[0039]
凡在本文中给出某一数值范围之处,所述范围包括其端点,以及位于所述范围内的所有单独整数和分数,并且还包括由其中那些端点和内部整数和分数的所有各种可能组合形成的每一个较窄范围,以在相同程度的所述范围内形成更大数值群的子群,如同每一个那些较窄范围被明确给出一样。例如,80℃
‑
150℃的反应温度是指所述反应温度可以为80℃、81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、 89℃、90℃、91℃、92℃、93℃、94℃、95℃、96℃、97℃、98℃、 99℃、100℃、101℃、102℃、103℃、104℃、105℃、106℃、107℃、 108℃、109℃、110℃、111℃、112℃、113℃、114℃、115℃、116℃、 117℃、118℃、119℃、120℃、121℃、122℃、123℃、124℃、125℃、 126℃、127℃、128℃、129℃、130℃、131℃、132℃、133℃、134℃、 135℃、136℃、137℃、138℃、139℃、140℃、141℃、142℃、143℃、 144℃、145℃、146℃、147℃、148℃、149℃或150℃等以及由它们所形成的范围等。
[0040]
实施方案的详细描述
[0041]
一方面,本技术提供了制备式i化合物的方法,
[0042][0043]
其中:
[0044]
各个r1独立地选自氢、烷基、环烷基、芳基、杂芳基和烷氧基;
[0045]
r2、r3各自独立地选自烷基和环烷基;
[0046]
r4选自氢、烷基、环烷基和烷氧基;以及
[0047]
x为选自1至4的整数;
[0048]
所述方法包括:
[0049]
将以下式a化合物与r2nh2的甲酸盐溶液反应得到所述式i化合物;
[0050][0051]
其中式a中的各个r1、r3、r4和x如上所定义,r2nh2中的r2如上所定义。
[0052]
在一些实施方案中,各个r1独立地选自氢、c1‑6烷基、3
‑
12元环烷基、c6‑
18
芳基、c2‑
18
杂芳基、c1‑6烷氧基。
[0053]
在一些实施方案中,各个r1独立地选自氢、c1‑4烷基、3
‑
10元环烷基、c6‑
12
芳基、c2‑
12
杂芳基、c1‑4烷氧基。
[0054]
在一些实施方案中,各个r1独立地选自氢、c1‑4烷基、3
‑
8元环烷基、c6‑
10
芳基、c2‑
10
杂芳基、c1‑4烷氧基。
[0055]
在一些实施方案中,各个r1独立地选自氢、c1‑4烷基、3
‑
8元环烷基、c6‑
10
芳基、c2‑
10
杂芳基、c1‑4烷氧基。
[0056]
在一些实施方案中,至少一个r1为烷氧基。
[0057]
在一些实施方案中,至少一个r1为甲氧基。
[0058]
在一些实施方案中,x为1。
[0059]
在一些实施方案中,r2、r3各自独立地选自c1‑6烷基、3
‑
12元环烷基。
[0060]
在一些实施方案中,r2、r3各自独立地选自c1‑4烷基、3
‑
10元环烷基。
[0061]
在一些实施方案中,r2、r3各自独立地选自c1‑4烷基、3
‑
8元环烷基。
[0062]
在一些实施方案中,r2和r3为甲基。
[0063]
在一些实施方案中,r4选自氢、c1‑6烷基、3
‑
12元环烷基、c1‑6烷氧基。
[0064]
在一些实施方案中,r4选自氢、c1‑4烷基、3
‑
10元环烷基、c1‑4烷氧基。
[0065]
在一些实施方案中,r4选自氢、c1‑4烷基、3
‑
8元环烷基、c1‑4烷氧基。
[0066]
在一些实施方案中,r4选自氢。
[0067]
在一些实施方案中,所述反应中式a化合物与r2nh2的摩尔比为 1:2.5
‑
6。
[0068]
在一些实施方案中,所述反应在80℃
‑
150℃(例如80℃、81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、89℃、90℃、91℃、 92℃、93℃、94℃、95℃、96℃、97℃、98℃、99℃、100℃、101℃、 102℃、103℃、104℃、105℃、106℃、107℃、108℃、109℃、110℃、 111℃、112℃、113℃、114℃、115℃、116℃、117℃、118℃、119℃、 120℃、121℃、122℃、123℃、124℃、125℃、126℃、127℃、128℃、 129℃、130℃、131℃、132℃、133℃、134℃、135℃、136℃、137℃、 138℃、139℃、140℃、141℃、142℃、143℃、144℃、145℃、146℃、 147℃、148℃、149℃或150
℃)的温度下进行。
[0069]
在一些实施方案中,所述反应的时间不超过8h(例如8h、7h、6h、 5h、4h、3h或2h等)、不超过6h或不超过4h。
[0070]
在一些实施方案中,所述r2nh2的甲酸盐溶液由向r2nh2的溶液中添加甲酸而形成。
[0071]
在一些实施方案中,所述r2nh2的甲酸盐溶液由向r2nh2的溶液中添加甲酸后去除溶剂而形成。
[0072]
在一些实施方案中,添加的所述甲酸为无水甲酸。
[0073]
在一些实施方案中,所述r2nh2的甲酸盐溶液中r2nh2与甲酸的摩尔比为0.8
‑
1.2:1。
[0074]
在一些实施方案中,所述r2nh2的溶液中所述r2nh2的浓度为 25wt%
‑
35wt%(例如25wt%、26wt%、27wt%、28wt%、29wt%、30wt%、 31wt%、32wt%、33wt%、34wt%或35wt%等)。
[0075]
在一些实施方案中,所述r2nh2的溶液中的溶剂为醇类。在一些实施方案中,所述溶剂选自甲醇、乙醇、乙二醇、或其组合。
[0076]
在一些实施方案中,所述方法进一步包括:
[0077]
在所述反应之后,将所得产物在溶剂以及碱或酸的存在下进行加热处理。
[0078]
在一些实施方案中,所述加热处理在80℃
‑
120℃(例如80℃、 81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、89℃、90℃、 91℃、92℃、93℃、94℃、95℃、96℃、97℃、98℃、99℃、100℃、101℃、102℃、103℃、104℃、105℃、106℃、107℃、108℃、109℃、 110℃、111℃、112℃、113℃、114℃、115℃、116℃、117℃、118℃、 119℃或120℃等)的温度下进行。
[0079]
在一些实施方案中,将所得产物在溶剂以及2倍及以上摩尔当量的碱或酸的存在下进行加热处理。
[0080]
在一些实施方案中,所述碱或酸为强碱或强酸。
[0081]
在一些实施方案中,所述强碱选自氢氧化钠、氢氧化钾、碳酸钾、氢氧化锂或其组合。
[0082]
在一些实施方案中,所述强酸选自硫酸、盐酸、硝酸、磷酸、或其组合。
[0083]
在一些实施方案中,所述溶剂选自乙醇、水、甲醇、乙二醇、异丙醇或其组合。在一些实施方案中,所述溶剂为乙醇和水的混合溶剂。
[0084]
在一些实施方案中,在所述加热处理之前,进一步去除溶剂。
[0085]
在一些实施方案中,在所述加热处理之前,在低于所述反应的温度下通过减压蒸除溶剂。
[0086]
在一些实施方案中,在所述反应之后和所述加热处理之前,将所得产物进行萃取和分离溶剂(例如通过蒸除溶剂)。优选在所述萃取前调节ph至碱性。
[0087]
在一些实施方案中,在所述加热处理之后,降至室温并进行纯化(例如通过过滤和/或萃取)。
[0088]
在一些实施方案中,在所述过滤后进行浓缩。
[0089]
在一些实施方案中,在所述浓缩后调节ph值至9
‑
11。在一些实施方案中,调节ph至10。
[0090]
在一些实施方案中,在所述调节之后进行纯化例如萃取。
[0091]
在一些实施方案中,使用乙酸乙酯进行所述萃取。
[0092]
在一些实施方案中,在所述萃取后去除溶剂,例如通过减压蒸除溶剂。
[0093]
另一方面,本技术提供了制备式i化合物的盐酸盐的方法,
[0094][0095]
其中:
[0096]
各个r1独立地选自氢、烷基、环烷基、芳基、杂芳基和烷氧基;
[0097]
r2、r3各自独立地选自烷基和环烷基;
[0098]
r4选自氢、烷基、环烷基和烷氧基;以及
[0099]
x为选自1至4的整数;
[0100]
所述制备式i化合物的盐酸盐的方法包括:
[0101]
通过上述制备式i化合物的方法制得式i化合物;以及
[0102]
在所得式i化合物中加入氯化氢溶液得到所述盐酸盐。
[0103]
在一些实施方案中,所述氯化氢溶液为氯化氢在乙酸乙酯、二氧六环、丙酮或乙醇中的溶液;
[0104]
在一些实施方案中,在加入所述氯化氢溶液之后,进行搅拌和过滤。
[0105]
在一些实施方案中,其中所述式i化合物为化合物e: [0106]
具体地,化合物e:的制备方法包括:将甲酸和甲胺溶液形成的甲酸甲胺盐溶液与邻甲氧基苯丙酮反应(优选在加热条件下)生成该反应生成了所需产物和少量n
‑
甲酰化产物,所述n
‑
甲酰化产物可以在
溶剂中采用碱或酸经加热又转化为所需产物
[0107]
本技术的各项发明提供下述优势:
[0108]
本技术的芳烷基胺类化合物的方法为一种新的一锅合成法,合成方法简单、成本低、设备要求低、并且收率和产率高(在较短的反应时间例如不超过4小时就能达到较高的收率),适于高效率高产率工业生产。
[0109]
根据本技术的方法制得的芳烷基胺类化合物及其盐纯度高(粗品 hplc纯度>99.5%)、所含杂质种类少且易于分离纯化,生成的少量n
‑ꢀ
甲酰化副产物在溶剂和碱或酸的存在下经加热处理又能转化为所需的所述芳烷基胺类产物,同时另一反应副产物co2为气体,可以直接排出而无需进一步分离纯化。
实施例
[0110]
以下实施例仅用于说明而非限制本技术范围的目的。
[0111]
实施例1
[0112]
称取33wt%的甲胺甲醇溶液(38.5g,0.41mol),常温下滴加无水甲酸 (18.4g,0.4mol),加毕,60℃下减压去除溶剂至无液体流出。向剩余甲胺甲酸溶液中加入邻甲氧基苯丙酮(16.4g,0.1mol),升温至120℃,反应4h后70℃减压蒸除溶剂,加入16ml乙醇,1.6g水,加入氢氧化钠10g,升温至90℃,搅拌反应6h,降至室温,过滤,60℃减压浓缩,加3mol/l 的盐酸调节ph至10,加入33ml的乙酸乙酯萃取,水层用33ml乙酸乙酯萃取,合并乙酸乙酯层,饱和食盐水洗涤后干燥,50℃减压蒸除溶剂得油状物。加入自制的1mol/l的氯化氢乙酸乙酯溶液100ml,搅拌,过滤,得白色固体15g,hplc纯度>99.5%,收率69.5%。1h—nmr(400 mhz,dmso)δ:1.36(d,3h,ch3);2.74(d,3h,n
‑
ch3);2.83(dd,1h,ch);3.40(m, lh,ch2);3.43(m,lh,ch2);3.83(s,3h,o
‑
ch3);6.87(m,1h,arh);6.90(m, 1h,arh);7.20(m,1h,arh);7.28(m,1h,arh);9.54(d,2h,nhhcl)。 m 1=180.10。
[0113]
实施例2:
[0114]
称取33wt%的甲胺甲醇溶液(29.1g,0.31mol),常温下滴加无水甲酸 (13.8g,0.3mol),加毕,60℃下减压去除溶剂至无液体流出。向剩余甲胺甲酸溶液中加入邻甲氧基苯丙酮(16.4g,0.1mol),升温至120℃,反应6h后70℃减压蒸除溶剂,加入16ml甲醇,1.6g水,加入氢氧化钾10g,升温至90℃,搅拌反应4h,降至室温,过滤,60℃减压浓缩,加3mol/l 的盐酸调节ph至10,加入33ml的乙酸乙酯萃取,水层用33ml乙酸乙酯萃取,合并乙酸乙酯层,饱和食盐水洗涤后干燥,50℃减压蒸除溶剂得油状物。加入自制的1mol/l的氯化氢乙酸乙酯溶液100ml,搅拌,过滤,得白色固体14.2g,hplc纯度>99.5%,收率65.8%。
[0115]
实施例3:
[0116]
称取33wt%的甲胺甲醇溶液(24.4g,0.26mol),常温下滴加无水甲酸 (11.5g,0.25mol),加毕,60℃下减压去除溶剂至无液体流出。向剩余甲胺甲酸溶液中加入邻甲氧基苯丙酮(16.4g,0.1mol),升温至120℃,反应8h后70℃减压蒸除溶剂,加入30%氢氧化钠水
溶液调节ph值至10,加入33ml乙酸乙酯萃取后水层再用33ml乙酸乙酯萃取,饱和食盐水洗涤后50℃蒸去溶剂,加入15ml乙醇,5ml水,缓慢加入浓硫酸10g,升温至90℃,搅拌反应10h,降至室温,用10%氢氧化钠调节ph至9,各用33ml乙酸乙酯萃取两次,无水硫酸钠干燥,加入自制的3mol/l的氯化氢乙酸乙酯溶液33ml,搅拌,过滤,得白色固体13.8g,hplc纯度> 99.5%,收率63.9%。
[0117]
上文中已经用一般性说明及具体实施方案对本技术作了详尽的描述,但在本技术基础上,可以对之作一些修改或改进,并根据需要进行任意组合,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本技术要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。