用于制备对映异构体纯的去甲肾上腺素的方法
1.本发明涉及一种在氢供体转移下使用催化氢化系统制备对映异构体纯的去甲肾上腺素(也称为降肾上腺素)或其加成盐的新的有效方法。本发明还公开了新的中间体及其制备方法。
2.发明背景
3.去甲肾上腺素,也称为降肾上腺素或动脉醇,是一种天然存在的化合物,属于儿茶酚胺类。在人体内,去甲肾上腺素是一种激素和神经递质,其主要功能是调动大脑和身体采取行动;药理学上它被用作拟交感神经药。作为交感神经激动剂,去甲肾上腺素刺激肾上腺素能受体,引起不同辐射肌和胃肠道括约肌的血管收缩。此外,去甲肾上腺素是心血管系统中交感神经的主要神经递质,它负责心血管张力的增强性和反射性变化。
4.去甲肾上腺素以左旋对映异构体的形式天然存在,化学上为4
‑
[(1r)
‑2‑
氨基
‑1‑
羟基乙基]苯
‑
1,2
‑
二醇,其结构如式i所示:
[0005][0006]
目前制造(r)
‑
去甲肾上腺素的工业方法包括通过不同的反应顺序制备3,4
‑
二羟基
‑
α
‑
氨基苯乙酮(也称为动脉酮(arterenone)),然后通过金属催化剂氢化还原后者,生成外消旋的去甲肾上腺素,然后其通过与l
‑
( )
‑
酒石酸形成非对映异构体盐来拆分。
[0007]
us 2,786,871公开了通过将3,4
‑
二羟基
‑
α
‑
氯苯乙酮与氨反应以50%的产率获得该动脉酮。然后,动脉酮可以氢化以获得外消旋去甲肾上腺素。该方法的缺点是产率低,且反应混合物颜色变深,生成不适合医药用途的有色产物。
[0008]
wo 2013/008247公开了通过将3,4
‑
二羟基
‑
α
‑
卤代苯乙酮与六胺反应制备动脉酮,然后水解并氢化得到外消旋去甲肾上腺素。无论如何,该工艺的缺点是需要使用氯化溶剂,优选氯仿,其有毒且具有致突变性,且其用途仅限于工业用途。此外,氢化产生外消旋物质,其必须经过进一步的拆分步骤,这大大降低了该方法的产率并增加了废物。
[0009]
由于动脉酮形成中的主要问题是存在与邻苯二酚部分共存的伯氨基,因此动脉酮自身可选地被其中邻苯二酚部分被保护(例如乙酰化)的或氨基被保护(例如苄基化)的衍生物替代。无论如何,关于这两种选择的文献很少。在邻苯二酚部分被保护的情况下,主要缺点是必须添加两个步骤,即保护和脱保护,这会导致更长且更繁琐的过程,并有形成难以纯化的杂质的风险;由于这些原因,保护/脱保护方法很少用于工业规模的工艺。在氨基部分被保护的情况下,可以使用苄胺代替氨进行缩合,然后通过相同的氢化步骤去除苄基。无论如何,根据文献,这种化合物是不稳定的。事实上,根据egorov等人(org.biomol.chem.,
2014,12,1518),苄胺与2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮的缩合导致式ii所示的不稳定氨基酮:
[0010][0011]
如同一篇参考文献中所述,该化合物非常不稳定,因此无法将其分离出来,而是必须将其与另一种化合物快速反应。
[0012]
另一篇参考文献报道制备2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮的单苄基氨基衍生物的尝试没有成功(simonoff和hartung,j.am.pharm.assoc.1946oct;35(10):306
‑
9)。在另一篇论文(dakin,proc.roy.soc.,76b,498(1905))中,其描述了苄胺和3,4
‑
二羟基苯酰氯未能按预期反应是由于酚羟基的存在。
[0013]
一般而言,所有依赖于动脉酮或其衍生物的氢化的已知的(r)
‑
去甲肾上腺素生产工艺的缺点是获得外消旋物质,需要进一步分离对映异构体,从而损失时间和增加废物。
[0014]
例如,us 2,774,789公开了使用酒石酸、苹果酸或n
‑
苯甲酰
‑
l
‑
苏氨酸拆分dl
‑
去甲肾上腺素。无论如何,这种方法的产率相当低,因为从169克外消旋物中可以得到60
‑
85克酒石酸盐一水合物,相当于约30
‑
40克(r)
‑
去甲肾上腺素。该量对应于理论摩尔量的47%产率,由此意味着相对于外消旋物起始量的23%产率,即,产物量的77%被浪费。母液随后可回收并外消旋化,以获得一些将再次拆分的物质,但这是一项繁琐且耗时的任务。从产率、废物产生和所需时间来看,这一方法显然非常低效。
[0015]
cn 108069863中报道了一种对映异构选择性方法,其描述了用手性硼烷试剂例如(
–
)
‑
二异丙基二异松蒎基氯硼烷进行动脉酮还原。报道的实施例表明,为了获得至少99.0%的对映异构体纯度(这将适用于医药用途),反应必须在非常低的温度下进行,例如
‑
30℃。在工厂中保持如此低的温度不是一项简单的任务,适合在如此低的温度下进行反应的设备的成本限制了该方法的工业适用性。
[0016]
此外,大量过量的还原剂是必需的,如所描述的2.5至3.0摩尔当量。事实上,如该专利的实施例中所报道,对于16.7g动脉酮,必须使用高达150g硼烷试剂的量,这几乎是其质量的十倍。然后,该试剂被消耗和作为废物丢弃,并且无法通过任何方式回收。该硼烷试剂无法在市场上直接获得,且制造成本较高;它必须采用繁琐的程序在内部生产,其使用有安全性担忧的试剂,由于其是一种不稳定的试剂,因此必须在惰性气体下在受控温度下储存,并且必须在短时间内使用。
[0017]
考虑到所有这些因素,这种制造方法显然不适合工业制造,因为它有许多缺点。
[0018]
kershaw nm等人“x
‑
ray crystallography and computational docking for the detection and development of protein
‑
ligand interactions.”,curr med chem.2013;20(4):569
‑
75,公开了通过将式iv化合物保护、还原并与苄胺反应来制备化合物。
[0019][0020]
令人惊讶的是,还没有其它已知的对映异构选择性方法用于制备去甲肾上腺素的单一对映异构体。这尤其令人惊讶,因为这种分子是在20世纪初被发现的,一个多世纪以来,它一直在药理学和患者护理中发挥着重要作用。更令人惊讶的是,对于几乎所有其他具有相同生物学和药理学作用的儿茶酚胺类分子,如肾上腺素或去氧肾上腺素,文献中都报道了一种或多种对映异构选择性的制造方法。
[0021]
因此,需要一种有效的方法来制备药理学上有用的(r)
‑
去甲肾上腺素,其适合于工业制备并且适合用作药物成分。鉴于上述缺点,这种新方法的主要目标是需要一种对映异构选择性方法(即产生手性纯度至少为99.0%或更高的单一对映异构体),该方法使用催化试剂并产生少量废物,使用适合于普通化工厂的条件,并遵循简单、省时和经济高效的程序。此外,新方法旨在使用易于制备且对于工业生产具有足够稳定性的中间体,其不需要有毒或致突变的试剂,并且以具有适合于制药生产的质量特性获得。
[0022]
发明描述
[0023]
本发明提供了一种新的、有效的对映异构选择性方法,用于通过对新中间体进行催化不对称氢化来制备去甲肾上腺素的单一对映异构体,并且克服了现有技术的所有上述缺点。在新方法条件下特别有用的是制备(r)
‑
去甲肾上腺素,其是药理学上感兴趣的对映异构体。
[0024]
本发明提供一种制备去甲肾上腺素的单一对映异构体或其加成盐的方法,该方法包括以下步骤:
[0025]
a)将式(iv)化合物
[0026][0027]
其中x是卤素(f、cl、br、i),与在适合溶剂中的苄胺,使用辅助性碱在惰性气体氛围下反应,并将所得缩合产物作为与羧酸的酸加成盐进行分离,得到式(iii)化合物
[0028][0029]
其中r是氢,或脂肪族、脂环族或芳香族一元羧酸或二元羧酸的残基;
[0030]
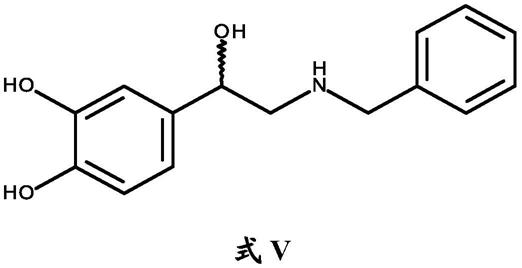
b)将式iii的苄基氨基酮酸加成盐进行对映异构选择性还原,得到式v的苄基氨基醇的单一对映异构体
[0031][0032]
其中带有波浪键的碳原子可以以(r)或(s)构型;
[0033]
c)式v化合物的单一对映异构体进行脱苄基化,得到去甲肾上腺素的单一对映异构体;
[0034]
d)分离作为游离碱或其酸加成盐的去甲肾上腺素的单一对映异构体。
[0035]
本发明的其它目的是式iii的新中间体。
[0036]
发明详述
[0037]
在一个实施方案中,本发明提供了一种新的中间体,其用于制备去甲肾上腺素的单一对映异构体。在一个实施方案中,所述去甲肾上腺素的单一对映异构体为式(i)的(r)
‑
去甲肾上腺素。
[0038]
令人惊讶的是,已经发现,上文所述不稳定的式ii的苄基氨基酮,当所获得的缩合产物作为上述通式iii的与羧酸形成的酸加成盐分离时,可以以可重复的且工业上方便的方式制备。
[0039]
在通式iii中,该羧酸可以是任何脂肪族(包括脂环族)的一元羧酸或二元羧酸以及芳香族一元羧酸和二元羧酸。如本文在上述通式iii中所用,r是氢、羧基、烷基(优选1至17个碳原子的烷基)或芳基(优选不超过12个碳原子的芳基),所述烷基、环烷基和芳基任选地被另外的羧基取代。羧酸的实例为甲酸、乙酸、丙酸、草酸、丙二酸、丁二酸、苯甲酸、甲苯甲酸、邻苯二甲酸、酒石酸等。
[0040]
因此,本发明提供了制备式iii化合物的方法,该方法通过将式iv化合物,
[0041][0042]
其中x是卤素(f、cl、br、i),与苄基胺在适合的溶剂中,使用辅助性碱在惰性气体(例如氮气)的氛围下反应,并将所得缩合产物作为与羧酸的酸加成盐进行分离。
[0043]
在优选的实施方案中,式iv化合物是2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮,即x=cl。事实上,在所有通式iv化合物中,这是最稳定的一个,且最适合于工业应用。
[0044]
该反应在惰性气体(通常为氮气)的氛围下进行,以避免氧气与反应混合物接触。事实上,当氧气存在时,可能会发生自由基氧化反应,降低产品纯度和方法收率。
[0045]
选择用于反应的辅助性碱具有等于或大于10的pk,因为其应当从至少一个邻苯二酚部分提取质子;该碱可以是有机的或无机的。适合的无机碱的实例包括金属氢化物或金属氢氧化物或醇盐,例如氢氧化钠、氢化钠、甲醇钠、叔丁醇钾和叔丁醇钠。适合的有机碱的实例包括胺类,例如三乙胺、1,8
‑
二氮杂二环[5.4.0]十一碳
‑7‑
烯或1,4
‑
二氮杂二环[2.2.2]辛烷或苄基胺。从工业角度来看,使用三乙胺(其通常可获得、安全且廉价)尤其有利。
[0046]
对于2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮,辅助性碱以1至10摩尔当量使用,优选以1至5摩尔当量使用,且最优选以1至2摩尔当量使用。
[0047]
苄基胺可与2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮以1:1至1:10的摩尔比使用。从工业角度来看,特别有用的是使用摩尔过量的苄基胺,其与2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮的因子为1.5:1至5:1。优选地,过量比率应为3:1至5:1,最优选4:1摩尔过量,这给出了产率和工业成本之间的最佳比率。
[0048]
适合的溶剂是在碱性条件下稳定的有机溶剂或水。适合的有机溶剂包括醚、环醚、烃、卤代烃、亚砜或其混合物。此类溶剂的实例包括但不限于乙醚、四氢呋喃、1,4
‑
二噁烷、甲苯、二甲苯、二氯甲烷或二甲基亚砜。在优选实施方案中,水用作溶剂,因为与任何有机溶剂相比时,水是安全的溶剂,并且在完整溶液中提供反应混合物,与非均相反应系统相比,水提供稳定的均相反应系统和更快的反应时间。
[0049]
反应温度保持在10℃和溶剂回流温度之间,优选在20℃和60℃之间。在优选实施方案中,当溶剂为水时,35℃和50℃之间的温度在产率、纯度和反应时间方面提供最佳结果。温度越高,反应时间越短,但杂质分布越高,产率越低,而温度越低,反应时间越长。
[0050]
反应完成后,用其中r如上文所定义的通式r
‑
cooh的一元羧酸或二元羧酸对混合物进行猝灭。在优选实施方案中,羧酸为甲酸(r=h,化合物a)或乙酸(r=ch3,化合物b)。
[0051][0052]
相对于缩合过程中使用的碱的总摩尔数,羧酸的方便的使用量为等量或略微过量,即,覆盖反应中使用的辅助性碱的摩尔数和苄基胺摩尔数。羧酸添加结束时的ph值应当在该羧酸在水中的稀释溶液范围内,因此,例如当使用乙酸时,ph值应在4左右。这确保了缩合产物的中和和稳定。一旦ph值在正确范围内,产物的酸加成盐直接从溶剂中沉淀,或者当使用水时,添加水溶性溶剂以从溶液中沉淀酸加成盐。所述水溶性溶剂是从式iii化合物在其中不溶的溶剂中选择;适合的溶剂为醇、环醚或酮;溶剂的选择与选择用于猝灭反应的羧酸直接相关,因为酸加成盐基于酸性部分本身而具有不同的溶解性。此类溶剂的实例包括但不限于甲醇、异丙醇、乙醇、四氢呋喃、1,4
‑
二噁烷、丙酮、甲乙酮等。在优选实施方案中,当使用水作为溶剂和乙酸或甲酸用于猝灭时,优选的水溶性溶剂为丙酮,因为其容易获得、廉价且在产率和纯度方面给出最佳结果。
[0053]
然后通过过滤或其他类似方法分离所得产物。所得产物可进一步纯化,例如通过结晶或用溶剂研磨,或可将其提交至方法的下一步骤以制备去甲肾上腺素的单一对映异构体。
[0054]
事实上,在本发明的第二方面中,令人惊讶地发现,式iii的苄基氨基酮酸加成盐可以对映异构选择性地还原为式v的新的苄基氨基醇。
[0055]
新的式v中间体可以脱苄基以获得去甲肾上腺素的单一对映异构体。
[0056]
在优选的实施方案中,去甲肾上腺素的单一对映异构体为(r)
‑
去甲肾上腺素,且制备(r)
‑
去甲肾上腺素的本发明方法的步骤b)和c)的顺序如流程1中描述,其中r如上文所定义:
[0057][0058]
流程1
[0059]
该方法可方便地与依次进行的步骤b)和c)的两次还原以一锅法进行,而无需分离中间产物,这是一种最适合工业化制备的方法。尽管如此,在不限制本发明范围的情况下,仍有可能在需要时分离出式v的中间体或其酸加成盐。
[0060]
根据上述流程的反应包括以下步骤:
[0061]
·
步骤1:将式iii化合物与氢或氢源在适当的催化剂存在下,在醇或水醇溶剂中反应,以对映异构选择性地获得式v化合物;
[0062]
·
任选地分离式v化合物,作为游离碱或其酸加成盐。
[0063]
·
步骤2:将式v化合物与氢或氢源在适当的催化剂存在下,在醇或水醇溶剂中反
应,以获得去甲肾上腺素的单一对映异构体。
[0064]
·
分离去甲肾上腺素的单一对映异构体,作为游离碱或其酸加成盐。
[0065]
如上所述,工业制备最有用的系统是一锅反应,其中步骤1用一种催化剂完成,并且所获得的式v化合物与第二种催化剂在原位反应,以去除保护性苄基。在此过程中,步骤1和2均使用相同的溶剂混合物和相同的氢源。
[0066]
用于该反应的溶剂为c1至c3醇,优选甲醇、乙醇、丙醇或异丙醇,最优选甲醇。该溶剂可任选地含有水。在优选实施方案中,使用9:1的甲醇/水混合物作为反应介质。
[0067]
氢源可以是分子氢或在转移氢化系统下的氢供体。转移氢化是众所周知的方法;氢供体的合适实例包括异丙醇与氢氧化钾、甲酸/三乙胺缓冲液、甲酸钠缓冲液、甲酸或它们的混合物。在优选实施方案中,使用甲酸,其在加热下分解为氢和二氧化碳。
[0068]
步骤1中用于对映异构选择性还原的合适催化剂是“系链(tethered)”型的钌(ii)与磺酰胺衍生的二苯乙二胺的复合物。此类催化剂已经在m.wills等人在j.am.chem.soc.2005,127,7318和r.hodgkinson等人在organometallics,2014,33(19),5517
‑
5524中公开并由通式vi描述
[0069][0070]
在上式中,n是整数1或2,且磺酰胺部分可以是烷基磺酰胺或芳基磺酰胺,分别对应于基团r'或ar。“系链”侧链是由3个(n=1)或4个(n=2)碳原子组成的亚烷基链。乙二胺部分的带有苯基的两个立体中心可以是(r,r)或(s,s)。当使用(r,r)对映异构体时,获得去甲肾上腺素的对映异构体其中一种,而当使用(s,s)对映异构体时,获得另一种对映异构体。具体而言,当使用(s,s)对映异构体时,获得具有药理活性的(r)
‑
去甲肾上腺素。
[0071]
具有三个或四个碳原子系链(teth)的式vi的市售催化剂实例包括c3
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl]、[(s,s)
‑
teth
‑
mtsdpen
‑
rucl]、c3
‑
[(s,s)
‑
teth
‑
mesdpen
‑
rucl]、c3
‑
[(s,s)
‑
teth
‑
trisdpen
‑
rucl]、c4
‑
[(r,r)
‑
teth
‑
trisdpen
‑
rucl]、c4
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl]和c4
‑
[(s,s)
‑
teth
‑
msdpen
‑
rucl]。在这些式中,r’或ar基团是对甲苯磺酰基(ts)、mesytilyl(mts)、甲磺酰基(mes)或三异丙基苯基(tris),前缀c3或c4分别表示存在具有三个或四个碳原子的系链(teth)。
[0072]
优选地,用于制备(r)
‑
去甲肾上腺素的催化剂选自c3
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl]、c3
‑
[(s,s)
‑
teth
‑
mtsdpen
‑
rucl]、c3
‑
[(s,s)
‑
teth
‑
mesdpen
‑
rucl]和c3
‑
[(s,s)
‑
teth
‑
trisdpen
‑
rucl]。更优选地,该催化剂是c3
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl],其在对映异
构体纯度、反应时间和催化剂载量方面提供了最佳结果。
[0073]
因此,以99%或更高的高对映异构体纯度获得(r)
‑
去甲肾上腺素,如通过hplc分析所测定。
[0074]
步骤2中使用的催化剂选自在脱苄基保护中使用的普通催化剂。优选地,该催化剂为钯,更优选钯/碳。
[0075]
然后,以游离碱或其酸加成盐的形式回收所获得的去甲肾上腺素的单一对映异构体。从工业角度来看,特别有用的是分离作为酒石酸盐的(r)
‑
去甲肾上腺素,以获得医药上有用的活性成分(r)
‑
去甲肾上腺素酒石酸氢盐一水合物。尽管如此,也可以将其分离为不同的酸加成盐,例如在需要时用于进一步纯化,并且在第二步骤中将该盐转化为酒石酸氢盐,而不限制本发明本身的范围。然后通过过滤或其他类似方法分离所得产物。
[0076]
在优选实施方案中,如果需要进一步纯化,则将(r)
‑
去甲肾上腺素作为草酸盐回收,或作为酒石酸盐回收,以直接获得市售的活性药物成分。
[0077]
因此,在优选实施方案中,(r)
‑
去甲肾上腺素通过以下方法制备为草酸或酒石酸加成盐,该方法包括:
[0078]
·
将2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮与苄胺在水中使用三乙胺作为辅助性碱进行反应。
[0079]
·
用甲酸或乙酸猝灭反应,并通过加入丙酮沉淀式iii化合物。
[0080]
·
将在甲醇和水的混合物中的式iii化合物与甲酸(作为氢源)反应,使用c3
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl]作为催化剂用于对映异构选择性还原。
[0081]
·
将钯/碳加入反应混合物中,以除去苄基保护基团。
[0082]
·
沉淀作为草酸或酒石酸加成盐的(r)
‑
去甲肾上腺素。
[0083]
因此,本发明公开了一种简单、经济、有效、稳定、生态友好和合适的用于制备去甲肾上腺素的单一异构体、特别是(r)
‑
去甲肾上腺素的方法,该方法具有高收率和高纯度,对映异构体纯度高于99%。
[0084]
以下实施例进一步说明了本发明。
[0085]
实施例1
[0086]
制备2
‑
苄基氨基
‑3′
,4
′‑
二羟基苯乙酮乙酸盐(化合物b)
[0087]
将水(1.3kg)和2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮(1kg)装入惰性化反应器中。在不超过30℃下将三乙胺(0.67kg)加入所得混悬液中,得到溶液。在不超过50℃下逐滴加入苄胺(2.4kg)。在添加结束时,将该物质在搅拌下于50℃保持约2小时,然后冷却至约10℃,并在氮气中在不超过25℃下加入丙酮(1.6kg)和乙酸(1.8kg)的混合物。将反应混合物冷却至约10℃,然后加入丙酮(2kg),并过滤产物,得到(干燥后)1kg的2
‑
苄基氨基
‑3′
,4
′‑
二羟基苯乙酮乙酸盐。
[0088]
实施例2
[0089]
制备2
‑
苄基氨基
‑3′
,4
′‑
二羟基苯乙酮乙酸盐(化合物b)
[0090]
在氮气中将水(30g)和2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮(10g)装入反应器中。在不超过35℃下逐滴加入苄胺(31g)。加完时,将该物质保持在45℃搅拌下约2小时,然后冷却至约10℃,并在氮气中在不超过25℃下加入丙酮(8g)和乙酸(18g)的混合物。将反应混合物冷却至约10℃,然后加入丙酮(72g),并过滤产物,随后悬浮于丙酮(27g)中,并在室温下搅拌约30
分钟,然后过滤,得到(干燥后)8g的2
‑
苄基氨基
‑3′
,4
′‑
二羟基苯乙酮乙酸盐。
[0091]
实施例3
[0092]
制备2
‑
苄基氨基
‑3′
,4
′‑
二羟基苯乙酮甲酸盐(化合物a)
[0093]
在氮气中将水(45g)和2
‑
氯
‑3′
,4
′‑
二羟基苯乙酮(30g)装入反应器中。在不超过30℃下将三乙胺(20g)加入所得混悬液中。在不超过45℃下逐滴加入苄胺(72g)。加完时,将该物质保持在45
‑
50℃搅拌下约2小时,然后冷却至约10℃,并在氮气中在不超过25℃下加入丙酮(24g)和甲酸(54g)的混合物。将反应混合物冷却至约10℃,加入丙酮(48g),然后过滤产物,得到(干燥后)39g的2
‑
苄基氨基
‑3′
,4
′‑
二羟基苯乙酮乙酸盐。
[0094]
实施例4
[0095]
制备2
‑
苄基氨基
‑1‑
(3
′
,4
′‑
二羟基苯基)
‑
乙醇(式v化合物)
[0096]
将异丙醇(90ml)、水(10ml)、甲酸(3ml)、化合物b(20g)和c3
‑
[(s,s)
‑
teth
‑
mesdpen
‑
rucl](30mg)装入烧瓶中。将该混合物加热至回流30分钟,并随后逐滴加入甲酸(6ml)。将该混合物加热至回流2小时,用异丙醇(100ml)稀释,并用氨中和至ph 8。将固体过滤,用异丙醇洗涤,并真空干燥,得到15g的2
‑
苄基氨基
‑1‑
(3
′
,4
′‑
二羟基苯基)
‑
乙醇。
[0097]
实施例5
[0098]
制备2
‑
苄基氨基
‑1‑
(3
′
,4
′‑
二羟基苯基)
‑
乙醇(式v化合物)
[0099]
将甲醇(180ml)、水(20ml)、甲酸(6ml)、化合物b(40g)和c3
‑
[(s,s)
‑
teth
‑
mtsdpen
‑
rucl](50mg)装入烧瓶中。将该混合物加热至回流30分钟,然后逐滴加入甲酸(12ml)。将该混合物加热至回流2小时,浓缩至干,用水(200ml)和异丙醚(200ml)稀释。将该两相混合物用三乙胺中和至ph 8。过滤固体,用异丙醇研磨,再次过滤,最后真空干燥,得到28g的2
‑
苄基氨基
‑1‑
(3
′
,4
′‑
二羟基苯基)
‑
乙醇。
[0100]
实施例6
[0101]
制备(r)
‑
去甲肾上腺素酒石酸氢盐
[0102]
将化合物b(300g)、甲醇(1.8l)、水(1.2l)、c3
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl](0.6g)和甲酸(50ml)装入反应器中。将该混合物加热至回流,并逐滴加入甲酸(38ml)。将该溶液加热至回流2小时,然后加入pd/c 10%(30g)。将该混合物加热至回流,并逐滴加入甲酸(88ml)。3小时回流后,将该混合物过滤以除去催化剂,并加入l
‑
( )
‑
酒石酸(261g)。将该溶液真空浓缩,并将残余物溶于乙醇(600ml)和纯水(200ml)中。向该溶液种晶并冷却,随后过滤并洗涤,得到168g去甲肾上腺素酒石酸氢盐一水合物。
[0103]
实施例7
[0104]
制备(r)
‑
去甲肾上腺素酒石酸氢盐
[0105]
将化合物b(100g)、乙醇(450ml)、水(50ml)、c3
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl](0.15g)和甲酸(15ml)装入反应器中。将该混合物加热至60℃持续1小时,并逐滴加入甲酸(15ml)。将该溶液加热至回流2小时,然后加入活性炭(10g)。过滤该混合物,并装回反应器中,随后加入pd/c 10%(11g)。将该混合物加热至回流,并逐滴加入甲酸(15ml)。回流3小时后,过滤该混合物以除去催化剂,并加入l
‑
( )
‑
酒石酸(87g)。将该溶液种晶并冷却,随后过滤并洗涤,得到93g去甲肾上腺素酒石酸氢盐一水合物。
[0106]
实施例8
[0107]
制备(r)
‑
去甲肾上腺素草酸盐
[0108]
将化合物a(35g)、甲醇(160ml)、水(18ml)、c3
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl](0.07g)和甲酸(5ml)装入反应器中。将该混合物加热至约50℃持续1小时,并逐滴加入甲酸(5ml)。将该溶液加热至回流3小时,然后加入活性炭(3g)。过滤该混合物,并装回反应器中,随后加入pd/c 10%(3.5g)。将该混合物加热至回流,并逐滴加入甲酸(5ml)。在约50℃下3小时后,逐滴加入甲酸(5ml)。在约50℃再过2小时后,过滤该混合物以除去催化剂,并加入草酸(8.6g)。向该溶液种晶并冷却,随后过滤并洗涤,得到11g去甲肾上腺素草酸盐。
[0109]
实施例9
[0110]
制备(r)
‑
去甲肾上腺素草酸盐
[0111]
将甲醇(9l)、水(1l)、甲酸(290ml)和c3
‑
[(s,s)
‑
teth
‑
tsdpen
‑
rucl](4g)装入反应器中。将化合物b(2kg)加入该溶液中。将该混合物在约60℃加热2小时,然后逐滴加入甲酸(290ml),并将该混合物在约60℃加热3小时。逐滴加入甲酸(290ml),并将该混合物在约60℃再加热2小时,随后将该溶液在活性炭柱上过滤,并装回反应器中。将pd/c 10%(200g)和甲酸(290ml)加入该溶液,并在约60℃继续加热2小时,随后逐滴加入甲酸(290ml),并再继续加热2小时。将该混合物过滤,并将草酸二水合物(490g)加入过滤后的溶液中。将该结晶的混合物冷却,过滤并干燥,得到1kg去甲肾上腺素草酸盐。
[0112]
实施例10
[0113]
制备(r)
‑
去甲肾上腺素酒石酸氢盐一水合物
[0114]
将去甲肾上腺素草酸盐(0.7kg)、偏亚硫酸氢钠(5g)、edta(5g)和水(4.6l)装入反应器中。在约60℃下,加入碳酸钾(0.6kg),然后将该混合物冷却,过滤并干燥,得到530g去甲肾上腺素碱。将该固体悬浮于水(500ml)和乙醇(900ml)中,并加入l
‑
( )
‑
酒石酸(470g);将该混合物在50℃加热,得到溶液,将其过滤以除去杂质,然后冷却以获得结晶。将固体过滤,洗涤并干燥,得到890g去甲肾上腺素酒石酸氢盐一水合物。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。