靶向小鼠atp7b基因的grna及构建wilson疾病小鼠模型的方法
技术领域
1.本发明属分子生物学领域,具体公开了一组靶向小鼠atp7b基因的grna及构建wilson疾病小鼠模型的方法。
背景技术:
2.威尔逊病(wilson’s disease,wd)又称肝豆状核变性,是罕见的常染色体隐形遗传铜代谢疾病,本病属于风湿性疾病当中的混合性结缔组织病,临床上以肝病、神经症状为主要特征。组织中铜的蓄积增加是引起肝病、神经学病变、角膜周围出现棕绿色环(凯
‑
弗环)、肾和其他器官发病的主要原因,且组织损伤可引起肝硬化脑基底节双侧软化、变性。据美国国家糖尿病、消化和肾病疾病研究所估计,全球约1/10000~1/30000的人患有该疾病,我国目前尚缺乏大样本多中心的威尔逊wd疾病发病率调查,但有文献分析该病在中国的发病率比西方国家高。
3.wd的发病机制在于atp7b基因变异,atp7b基因是位于细胞高尔基体膜上的铜转运atp酶,主要在肝细胞上表达,正常人体中约90%铜离子由atp7b介导经胆汁排出。正常情况下通过饮食摄入的铜经过肠道上皮细胞吸收后通过门静脉血转运到肝细胞的肝窦面,经过铜转运体1(ctr1)转运至肝细胞,在肝细胞内,铜离子与多个分子伴侣结合并转运到相应蛋白上发挥作用,铜离子可经抗氧化蛋白1(atox1)转运,将其转运到高尔基体上的atp7b分子,而后与铜蓝蛋白结合进而分泌道血液中发挥作用。当atp7b基因发生变异导致atp7b功能受到不同程度的损伤,铜蓝蛋白结合转运铜离子的能力也会不同程度的下降或完全消失。铜离子不能有效经过胆汁排泌导致其在肝细胞内蓄积,通过氧化应激损伤等方式损伤线粒体等细胞器,进而引起肝细胞脂肪变性、坏死与凋亡。肝细胞破坏后游离铜离子会释放到血液中引起机体其他损伤。为了研究该疾病的发病机制以及开发有效的治疗方法,构建该疾病的实验模型对于疾病的研究不可或缺,小鼠模型是目前公认到的制备人类疾病模型及研究基因组功能最有效的疾病模型,但是目前还缺乏高效的构建wilson疾病小鼠模型的方法。
技术实现要素:
4.针对现有技术不足,本发明利用crispr/cas9技术快速在小鼠体内将atp7b 基因敲除,构建wd疾病模型。crispr/cas9是一种由grna指导,利用cas9核酸酶对靶向基因进行编辑的技术,其工作原理是crrna(crispr
‑
derived rna) 通过碱基配对与tracrrna(trans
‑
activating rna)结合形成tracrrna/crrna 复合物,此复合物会引导cas9蛋白在与crrna配对的序列靶位点剪切双链dna,通过人工设计crrna和tracrrna两种rna,改造成具有引导作用的grna,从而引导cas9蛋白对dna的定点切割,并产生一个平末端的双链dna缺口,进而启动dna损伤修复机制,主要通过非同源末端连接(non
‑
homologous end joining, nhej)或同源重组(homologous recombination,hr)的方式将断裂上下游两端的
序列连接起来。cas9蛋白若要发挥作用需要靶位点下游的一个5
’‑
ngg
‑3’
基序,即pam序列,基因特异的grna模板序列为位于pam序列前,同时grna序列避免4个以上的t结尾,gc含量最佳为30%~70%。另外在选择grna时应考虑到其脱靶效应,全基因的脱靶效应需考虑脱靶位点的碱基错配数尽量不超过5个,基于多方面考虑,我们共设计了三条针对atp7b基因的grna,分别靶向exon2 的5’端和exon20的3’端。
5.本发明包括以下技术方案:
6.一组靶向小鼠atp7b基因的grna,包括三条grna,其核酸序列分别为:
7.grna1=seq id no 1=5
’‑
ggcacccaggccaaatgtagggg
‑3’
;
8.grna2=seq id no 2=5
’‑
gactcttaccactgctaagtggg
‑3’
;
9.grna3=seq id no 3=5
’‑
tctttgctaaggagtaaaactgg
‑3’
。
10.进一步,一种靶向小鼠atp7b基因的基因敲除试剂盒,所述试剂盒中包括上述一组靶向小鼠atp7b基因的grna。
11.进一步的,使用上述一组靶向小鼠atp7b基因的grna构建wilson疾病小鼠模型的方法,所述方法包括利用grna1、grna2、grna3将小鼠atp7b基因敲除。
12.进一步的,使用上述一组靶向小鼠atp7b基因的grna构建wilson疾病小鼠模型的方法,所述grna1靶向切割小鼠atp7b基因exon2的5’端,grna2 和grna3靶向切割exon20的3’端。
13.进一步的,使用上述一组靶向小鼠atp7b基因的grna构建wilson疾病小鼠模型的方法,所述grna1、grna2、grna3将atp7b基因第2~第20个外显子之间的33183bp的dna切除。
14.进一步的,使用上述一组靶向小鼠atp7b基因的grna构建wilson疾病小鼠模型的方法,包括以下步骤:
15.1)将cas9 mrna以及针对atp7b基因合成的3条grna混合后注射到培养于m2培养基中具有双核清晰的受精卵的细胞核中;
16.2)注射后的受精卵培养在特定的培养基中,培养至3.5天后每15
‑
20个囊胚移植到假孕母鼠体内,产出小鼠,即为f0小鼠;
17.3)仔鼠出生后5天即可剪鼠尾提取dna进行pcr扩增鉴定并送测序,若有检测结果为阳性则表示小鼠基因敲除成功。
18.进一步的,使用上述一组靶向小鼠atp7b基因的grna构建wilson疾病小鼠模型的方法,所述步骤3中的测序引物为:
19.pcr测序引物=seq id no 4=5
’‑
gtggaagagaggagatggtaaac
‑3’
。
20.进一步的,使用上述一组靶向小鼠atp7b基因的grna构建wilson疾病小鼠模型的方法,所述步骤3中pcr鉴定中的引物包括:
21.pcr primers1,其序列分别为:
22.f1=seq id no 5=5
’‑
gtggaagagaggagatggtaaac
‑3’
;
23.r1=seq id no 6=5
’‑
catggttcaagttcacatagtccag
‑3’
。
24.进一步的,使用上述一组靶向小鼠atp7b基因的grna构建wilson疾病小鼠模型的方法,所述步骤3中pcr鉴定中的引物包括:
25.pcr primers2,其序列分别为:
26.f2=seq id no 7=5
’‑
tcagctcaagtggtaagtcctgg
‑3’
;
27.r1=seq id no 6=5
’‑
catggttcaagttcacatagtccag
‑3’
。
28.进一步的,使用上述一组靶向小鼠atp7b基因的grna构建wilson疾病小鼠模型的方法获得的wilson疾病模型小鼠。
29.本发明具有以下有益效果:
30.本发明设计了特异性靶向atp7b基因的三条grna,利用cas9蛋白将 atp7b基因的exon2
‑
exon20敲除,所敲区域序列为非3倍数,造成移码突变,且敲除区域包含该基因编码区的91.91%,从而达到将该基因敲除的目的。使用 crispr/cas9系统构建atp7b基因敲除小鼠模型方法简单易行,周期短,拿到阳性小鼠的概率高,利用该小鼠模型可以充分研究该疾病的致病机理,并为进一步开发针对该疾病的治疗方式提供服务。
附图说明
31.附图1.atp7b基因敲除小鼠的构建方案示意图;图中,深色线段表示敲除区域,实心矩形数字代表bbs5基因的外显子,grna region代表grna的剪切区域;
32.附图2.atp7b基因敲除小鼠的鉴定策略;显示了用于鉴定小鼠的pcr引物的结合位点:f1、f2、r1;
33.附图3.atp7b基因敲除小鼠的鉴定结果;利用pcr引物pcr primers1进行 pcr筛选,基因敲除后的扩增产物:490bp;野生型的扩增产物:34335bp。左图为dna分子量标记,右图为pcr的鉴定产物图;
34.附图4.atp7b基因敲除小鼠的基因组测序结果,箭头指示处atp7b基因被删除33834bp以及11bp。
具体实施方式
35.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明中所述的适量,为本领域内普通技术人员根据国家技术规范和生产实际情况所决定的用量。本发明中所述的原料如无特殊说明,均为商业购得。
36.实施例
37.1.敲除方案设计
38.根据需求,查找atp7b基因详细信息,选择基因敲除的区域尽可能包括基因的功能域部分,根据实际情况选择敲除区域,我们选择atp7b基因敲除区域 exon2
‑
exon20共33183bp序列,包含atp7b基因整个编码区的91.91%,如附图 1所示。
39.2.grna序列设计
40.根据小鼠atp7b基因的序列,设计并合成了3条针对该基因的grna序列,序列信息如下:
41.grna1=seq id no 1=5
’‑
ggcacccaggccaaatgtagggg
‑3’
;
42.grna2=seq id no 2=5
’‑
gactcttaccactgctaagtggg
‑3’
;
43.grna3=seq id no 3=5
’‑
tctttgctaaggagtaaaactgg
‑3’
。
44.3.cas9/sgrna的显微注射
45.选取4~6周龄spf级雌性小鼠作为卵子供体,小鼠腹腔注射pmsg(孕马血清促性腺素),48h后注射hcg(人血绒膜促性腺素),随即与生殖能力正常的种公鼠进行交配,采集小鼠受精卵,消化洗涤之后置于37℃培养箱中待用。将 cas9 mrna与实验2中人工合成的grna混匀后通过显微注射至小鼠受精卵细胞核中,然后移植到代孕母鼠输卵管壶腹部中,代孕鼠每隔一周进行体重称量,初步判断是否怀孕,手术后19~21天仔鼠分娩,待仔鼠5天后剪尾编号并进行pcr 检测。
46.4.atp7b基因敲除小鼠的pcr鉴定
47.根据atp7b基因敲除区域,我们分别在exon2的5’端以及exon20的3’端设计一对引物f1和r1(f1=seq id no 5=5
’‑
gtggaagagaggagatggtaaac
‑3’ꢀ
r1=seq id no 6=5
’‑
catggttcaagttcacatagtccag
‑3’
),我们对出生的f0 小鼠进行pcr引物扩增并送测序,该引物在基因敲除小鼠中扩增的产物为490bp,在野生型小鼠中不能扩增出产物,鉴定结果及测序结果如附图3和4所示。将鉴定正确的阳性小鼠与野生型小鼠交配获得f1小鼠,小鼠出生14天后进行pcr 扩增鉴定小鼠纯杂合,鉴定引物如附图2所示,纯合小鼠扩增产物为490bp,杂合小鼠扩增产物为490bp/502bp,野生型小鼠扩增产物为502bp。pcr测序引物=seq id no 4=5
’‑
gtggaagagaggagatggtaaac
‑3’
。
48.小鼠pcr鉴定部位为鼠尾,对于鼠尾鉴定选择粗裂解的方法提取dna。
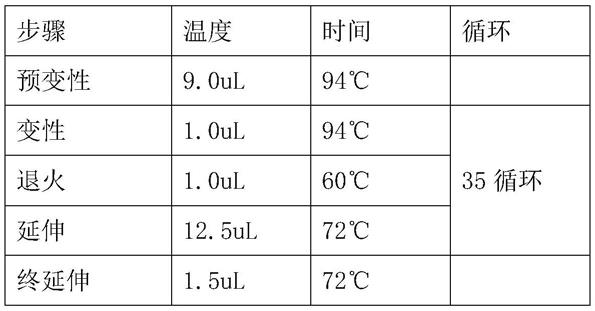
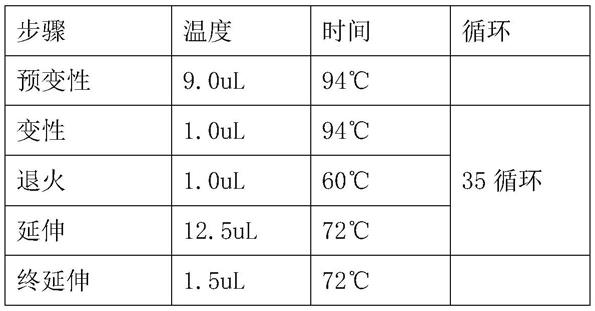
49.pcr反应体系如下:
50.组分体积ddh2o9.0ulf1(10um)1.0ulr1(10um)1.0ulpremix taq12.5uldna1.5ul总共25ul
51.pcr反应程序如下:
[0052][0053]
将pcr产物进行琼脂糖凝胶电泳,电泳结果如附图3所示。
[0054]
根据上述实验结果可知:本发明设计了特异性靶向atp7b基因的三条grna,利用cas9蛋白将atp7b基因的exon2
‑
exon20敲除,所敲区域序列为非3倍数,造成移码突变,且敲除区域包含该基因编码区的91.91%,从而达到将该基因敲除的目的。使用crispr/cas9系统构建atp7b基因敲除小鼠模型方法简单易行,周期短,拿到阳性小鼠的概率高,利用该小
鼠模型可以充分研究该疾病的致病机理,并为进一步开发针对该疾病的治疗方式提供服务。
[0055]
以上仅为本发明的较佳实施例而已,不能以此限定本发明的保护范围,即大凡依本发明权利要求书及发明内容所做的简单的等效变化与修改,皆仍属于本发明专利申请的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。