1.本发明涉及微生物发酵技术,具体而言,是一种将微生物菌体和发酵基质粘附于可以反复回收利用的惰性支撑体的表面上进行固态发酵的方法。
背景技术:
2.在工业发酵领域,固态发酵的历史悠久,其产品主要包括传统发酵食品与酒类、饲料、微生物菌体和酶制剂,以及部分微生物代谢物。与液态深层发酵相比,固态发酵具有节水、节能、成本低等优势,具有良好的发展前景。然而,传统的固态发酵通常使用麸皮、稻壳、蔗渣、高粱、豆饼等颗粒状物料作为培养基质,固体物料自身传热和传质效率低,且随固体基质自身被微生物大量降解和消耗以及水分的散失,料床易出现收缩和板结现象,从而造成温度和含水率的空间分布不均。此外,除部分便于蒸馏(例如白酒)或淋洗(例如食醋)的产品外,一般的固态发酵产品与固体基质的分离也较困难,并且提取产品后剩余的大量固体废弃物易造成环保压力。上述问题成为限制固态发酵发展的主要技术问题。
3.为解决传统固态发酵领域的上述问题,出现了吸附载体固态发酵技术。该技术使用天然或人工的多孔性颗粒状惰性或半惰性材料作为载体,利用其内部发达的孔隙吸附水和可溶性培养基成分,并容纳微生物在其内部孔隙及颗粒表面生长、代谢,所用的吸附载体一般为蔗渣、玉米芯颗粒、聚氨酯泡沫块以及蛭石等多孔性颗粒。与传统固态发酵相比,吸附载体固态发酵技术具有不易板结的优势,传热和传质的效率有所提高。然而,此类吸附载体依靠高孔隙率实现高持水性,其中的聚氨酯泡沫块等载体以其孔隙的内表面作为微生物生长和代谢的场所,因此存在以下问题:
4.(1)在产品洗脱分离的过程中,由于毛细现象,载体孔隙中吸附的菌体和代谢产物载体难以彻底分离,从而造成产品损失。
5.(2)多孔性载体的机械强度通常不高,在批次间清洗时易损坏,限制了载体颗粒的使用寿命。同时由于孔隙中残余菌体和代谢物的积累,使得多孔载体难以实现长期的反复利用,而废弃的载体仍会造成环保压力。
6.(3)多孔惰性载体虽然能缓解发酵料床板结的问题,但载体颗粒内部孔隙中的热量和质量传递阻力仍然较大。
技术实现要素:
7.针对现有技术的缺陷或不足,本发明提供了一种惰性支撑体粘附式发酵方法。
8.为此,本发明提供的方法包括:
9.将惰性支撑颗粒料和半固态培养基混合使得半固态培养基粘附于惰性支撑颗粒料表面;之后在灭菌后的混合料中接种进行发酵,发酵过程中惰性支撑颗粒料不发生降解;发酵完成后,分别回收发酵产物和惰性支撑颗粒料;
10.所述半固态培养基由粘附保水剂、发酵营养物和水配置而成;所述粘附保水剂使得半固态发酵剂粘附于所述惰性支撑体上,且确保发酵过程中半固态发酵剂不发生干结,
所述粘附保水剂不被发酵微生物降解或所述粘附保水剂中含有不被发酵微生物降解的组分;
11.所述惰性支撑颗粒料中的各惰性支撑颗粒包括颗粒体,该颗粒体上设有至少一个孔,且每个孔的径向尺寸和轴向尺寸均为毫米级(即能够精确到毫米为单位的尺寸);所述孔为通孔或盲孔。
12.可选的,所述惰性支撑颗粒的粒径2—10mm,优选3—8mm,所述孔的径向尺寸小于颗粒体粒径,为1—9mm。
13.可选的,所述惰性支撑颗粒由网状材料折叠或卷曲成中间有孔的筒形颗粒体。
14.可选的,所述惰性支撑颗粒的材质为金属、陶瓷或可制成刚体的高分子聚合物。
15.可选的,每立方厘米的惰性支撑颗粒料堆积料上粘附0.001—1g的半固态培养基。
16.可选的,以100%计,所述半固态培养基中水的质量占比为75%—95%,粘附保水剂的质量占比为0.5%
‑
6%,其余为发酵营养物。
17.可选的,所述半固态培养基的粘附度为1—100g
·
s。
18.可选的,所述半固态培养基的硬度为50—300g。
19.可选的,所述粘附保水剂选自海藻酸钠、羧甲基纤维素钠、聚丙烯酸钠、黄原胶、瓜尔胶、可得兰胶、果胶、结冷胶、魔芋胶和刺槐豆胶中的一种或多种的组合。
20.可选的,发酵完成后,通过水洗、过滤分离发酵产物和惰性支撑颗粒料,进行分别回收。
21.本发明的方法和用于制备丝状真菌、酵母菌或细菌。本发明的方法具有以下优点:
22.(1)本发明利用惰性支撑体在受挤压时不易变形的特点,使料床在发酵过程全程均可保持良好的通透性;利用惰性支撑体较大的表面积和空隙率,为微生物生长和发酵提供充足的空间;进而,利用惰性支撑体与其表面粘附的培养基和培养物容易通过水洗分离的特性,在发酵结束后加水清洗,从而回收全部惰性支撑体,实现惰性支撑体的反复循环利用,降低发酵过程的物料消耗量,减少固体废弃物的产生量,同时还降低了发酵产品的提取难度。
23.(2)本发明的惰性支撑体不依靠毛细现象保持水分和营养物质,而是通过支撑粘附在其表面的培养基层实现微生物的固态发酵过程,发酵结束后通过简单的洗涤即可将支撑体与微生物、代谢产物和残余的培养基分离,从而简化了固态发酵的分离提取流程。
24.(3)本发明的工艺发酵结束后,惰性支撑体易于通过洗涤和培养基层分离,从而可以实现惰性支撑体的长期反复回收利用,降低发酵的物料消耗量,同时大幅度降低固体废弃物的产生量。
25.(4)本发明的发酵料床的通透性好,料床不会随着发酵的进行和培养基的消耗而收缩、板结,从而缓解料床内部温度、水分宏观分布不均的问题。
附图说明
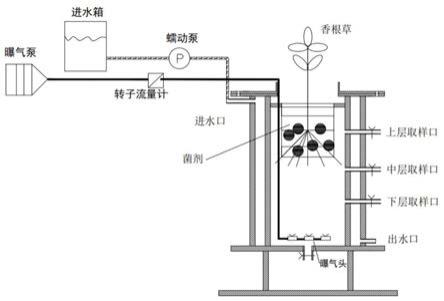
26.图1为实施例2粘附保水剂对固态发酵物料水分蒸散速率的影响;
27.图2为实施例3惰性支撑体粘附式固态发酵物料表观状态;
28.图3为实施例6三种不同的黑曲霉培养方法料床中心点温度趋势。
具体实施方式
29.除非另有说明,本文中的术语或方法根据相关领域普通技术人员的认识理解或采用已知方法实现。
30.本文所述“惰性”的含义可以理解为不与粘附保水剂、发酵营养物及其他添加剂发生化学反应,不影响微生物的生长和代谢,可在发酵工艺中反复循环使用。例如,022cr17ni12mo2不锈钢就属于一种惰性材料,已被广泛用于发酵罐、制药设备和手术器械的制造。本文所述“支撑体”的含义可以理解为可以支撑粘附在其表面的半固态附着物,以使半固态附着物也能保持稳定的外形,不至于聚集形成大的团块。
31.本发明发酵过程中所用支撑体颗粒料与现有固态发酵工艺中所用载体不同的是:一方面,现有的传统固态发酵工艺中,固体培养基颗粒除了发挥对发酵微生物的承载作用外,同时还作为发酵营养物,例如但不仅限于片状麸皮;而本发明的支撑体的材质为惰性。另一方面,现有的载体吸附固态发酵工艺中,液态培养基通过毛细管作用吸附在载体表面和内部,发酵机制是利用载体上的毛细孔道吸附液态培养基,同时也可以为微生物生长提供空间;与上述现有技术不同的是,本发明的发酵机制是通过支撑粘附在其表面的培养基层实现微生物的发酵过程,支撑体的尺寸及结构需满足半固态培养基粘附或挂载的需求,从另一角度来讲,本发明的“粘附或挂载”可以理解为“非毛细管作用”的附着。实施方案中,适用于本发明的支撑体颗粒料的单颗粒体的粒径为毫米级,且单颗粒体表面设有至少一个孔,该孔的径向尺寸与轴向尺寸均为毫米级,且孔的结构为通孔或/和盲孔。
32.本发明所用惰性支撑颗粒料材质为不锈钢、钛合金、陶瓷或可制成刚体的高分子聚合物(包括但不仅限于聚乙烯、聚丙烯、聚碳酸酯、聚四氟乙烯),表面可以直接裸露,也可以涂一层高分子材料涂层,起到保护支撑体的基体,同时提高半固态培养基挂载量的作用。惰性支撑体外形为颗粒状,由不锈钢网或不锈钢片制成,具备足够的刚性,使其不会在堆积成料床时被挤压变形,从而保持料床的通透性,有助于缓解温度和含水率在料床中分布的不均匀现象。
33.本发明的半固态培养基剂由粘附保水剂、发酵营养物和水配制而成;所用粘附保水剂可以是海藻酸钠、羧甲基纤维素钠、聚丙烯酸钠、黄原胶、瓜尔胶、可得兰胶、果胶、结冷胶、魔芋胶、刺槐豆胶、卡拉胶等成分中的一种或多种组合,粘附保水剂的作用是增加培养基在支撑体表面的挂载量和在培养过程中延缓培养基的干结,为了避免发酵过程中发生干结,所选用粘附保水剂的组分不参与发酵即不被发酵微生物降解或者粘附保水剂中含有不被发酵微生物降解的成分,以在发酵过程中持续发挥粘附和保水作用;所述发酵营养物根据具体发酵微生物确定。本发明的发酵方法适用于所有可采用固态发酵进行扩大培养或生成的微生物,如丝状真菌、酵母和细菌等。按100%计算,本发明的半固态培养基中水的质量占比约为75%—95%(现有技术中固体培养基的含水率为30—75%),粘附保水剂的质量占比为0.5%—6%,其余为发酵营养物。
34.本发明所述半固态培养基除了组分与一般的液态培养基不同外,两者在粘度(或粘附度)、或/和硬度方面的特性也不同。一般的液态培养基采用旋转粘度计检测,其粘度(或表观粘度)应为5—1000000mpa
·
s,常见100—1000mpa
·
s,而且液体培养基不存在硬度;本发明的半固态培养基采用食品物性分析仪(如英国ta公司生产,型号ta.xt.plus的食品物性分析仪)检测,其粘附度为1—100g
·
s,优选5—50g
·
s;硬度为50—300g,优选100—
200g;所述粘附度单位反映的是半固态培养基的粘着能力,硬度可以反映半固态培养基的抗压与抗变形能力。以下实施例中的粘附度、硬度采用英国ta公司生产的型号为ta.xt.plus的食品物性分析仪进行检测。
35.配制本发明的半固态培养基时,粘附保水剂、发酵营养成分及水混合形成具有较高粘性的半固态培养基,再与支撑体混合搅拌,使粘附保水剂和培养基营养成分的高粘性混合物挂载在支撑体内、外表面。本发明实施过程中,可以先进行粘附再灭菌或先灭菌再进行粘附。
36.本发明发酵工艺中可通过“挂载量”来控制与评价惰性支撑颗粒料和半固态培养基的混合效果,以确保发酵生产率,所述挂载量定义为单位堆积体积的惰性支撑体颗粒表面粘附的半固态培养基的总质量(湿重),单位是g
·
cm
‑3。示例,本发明所述挂载量的取值范围在0.001—1g
·
cm
‑3。以下实施例所用挂载量的检测方法是:将惰性支撑颗粒料和半固态培养基的混合料用20目不锈钢网过滤,称量滤过物的质量,即不能挂载的混合物质量,半固态培养基质量与滤过物质量差为挂载的半固态培养基质量,除以惰性支撑颗粒料堆积体积即为挂载量:
[0037][0038]
在本发明方案基础上,针对所要生产的微生物或菌,本领域技术人员采用常规实验方法选择合适的半固态培养基各组分及各组分添加量、合适的粘附度与硬度、以及合适的惰性支撑体材质及尺寸、挂载量、常规发酵工艺参数(温度、ph、营养物选择等)取得理想的产率。
[0039]
以下是本发明的具体实施例,以对本发明的特征、方案与效果做详细解释说明。
[0040]
实施例1:
[0041]
该实施例的发酵营养物是根据黑曲霉选择的,具体成分为麸皮、木薯淀粉和葡萄糖,粘附保水剂分别选用卡拉胶、聚丙烯酸钠和黄原胶,配置成多组半固态发酵剂,并测试各组半固态发酵剂的粘附度及其在西塔环填料上的挂载量,结果如表1所示。
[0042]
表1
[0043]
[0044][0045]
将表1所示各组配方量的粘附保水剂、发酵营养物和水的混合物与西塔环载体(该实施例所用西塔环填料颗粒直径5mm,高度5mm)充分混合,使半固态培养基粘附于支撑体颗粒的全部内、外表面,并充满金属网上的小孔;
[0046]
分别测各组混合料灭菌(高温蒸汽灭菌条件121℃,20min)与不灭菌混合料的挂载量;
[0047]
结果表明,无论是否经过高温蒸汽灭菌,添加粘附保水剂后可确保混合物挂载于惰性支撑体表面,不使用粘附保水剂则会造成混合物不同程度的流失。
[0048]
实施例2:
[0049]
该实施例设置两组半固态培养基,检测水分在培养过程中的蒸散速率。
[0050]
第一组:麸皮粉1.25g、一水合葡萄糖1.0g、水25.0g,西塔环5mm粒径23.0g;
[0051]
第二组:麸皮粉1.25g、一水合葡萄糖1.0g、水25.0g,粒径5mm西塔环23.0g,卡拉胶0.375g,聚丙烯酸钠0.25g,黄原胶0.167g。
[0052]
两组均装于三角瓶中,棉布封口,121℃灭菌35min,冷却后瓶口向上置于35.0℃培养箱中保温静置,定时称量剩余物料的总质量。
[0053][0054]
结果如图1所示,添加包括卡拉胶、聚丙烯酸钠和黄原胶三种成分的粘附保水剂时,水分蒸散速率明显低于不添加上述粘附保水剂的组别,可以说明粘附保水剂起到了保持水分、降低蒸散速率的作用。
[0055]
实施例3:
[0056]
该实施例是采用本发明的工艺生产黑曲霉(aspergillus niger m288,购自上海工微所科技有限公司),设置多组发酵实例,具体参见表2所示。
[0057]
具体发酵工艺为:
[0058]
将表2所示各发酵组配方量的粘附保水剂(其中卡拉胶和聚丙烯酸钠不被黑曲霉降解,发酵过程中持续发挥粘附和保水作用)、发酵营养物和水的混合物与西塔环载体(该实施例所用西塔环填料颗粒直径5mm,高度5mm)分别装于相应容器中充分混合,使半固态培养基粘附于支撑体颗粒的全部内、外表面,并充满金属网上的小孔;
[0059]
之后将各发酵组容器用四层纯棉布捆扎封口,121℃饱和蒸汽灭菌35min,冷却后接入菌悬液,充分混合后开始发酵;
[0060]
发酵温度35℃,在恒温培养箱中静置发酵,发酵过程第24h和48h分别对发酵物料震荡混合,持续培养7天后,黑曲霉菌体在西塔环载体粘附的培养基层上大量生长,如图2所示。检测并计算孢子产率,所述孢子产率的计算方法为(以下实施例同):
[0061]
(1)向培养物中加入含有2g
·
l
‑1吐温
‑
80和12g
·
l
‑1柠檬酸的水100ml,进行震荡洗涤;吸取5ml洗涤获得的孢子悬液,用含有2g
·
l
‑1吐温
‑
80和12g
·
l
‑1柠檬酸的水稀释至25ml,用血球计数板检测孢子浓度;
[0062]
(2)计算孢子总产量,孢子总产量=洗涤用水体积(100ml)
×
孢子浓度(ml
‑1);
[0063]
(3)孢子产率=孢子总产量/培养基中全部发酵营养物质的干重(粘附保水剂不计入),单位是g
‑1。
[0064]
表2
[0065]
[0066]
[0067]
[0068][0069]
相比于表2中第12组所示黑曲霉发酵工艺,表2中所示的1—11发酵组孢子产率较高;说明在使用粘附保水剂将培养基粘附在支撑体表面的同时,也可以通过使用自身具有一定粘附力的培养基成分提高挂载量,从而进一步提高孢子产率。
[0070]
实施例4:
[0071]
该实施例是采用本发明的工艺生产黑曲霉,设置表3所示多组发酵实例,各实例中该实施例中所用西塔环填料直径5mm,高度5mm。具体发酵工艺同实施例3。
[0072]
表3
[0073]
[0074]
[0075][0076]
相比于表3中第9组所示黑曲霉发酵工艺,表3所示的1—8发酵组孢子产率较高,说明粘附保水剂的存在有利于提高孢子产率。
[0077]
实施例5:
[0078]
该实施例是采用本发明的工艺生产黑曲霉,设置表4所示多组发酵实例,各组所用惰性支撑颗粒料不同。具体发酵条件同实施例3。
[0079]
所述水洗提取的孢子回收率和培养
‑
提取工艺全过程固废产生量是指:
[0080]
用300ml去离子水分2次清洗,第1次100ml,第2次200ml,每次清洗完毕,以20目滤布为过滤介质抽滤去除游离水;之后,将已被洗净的西塔环从滤布上移走,剩余的少许滤渣沉积在滤布表面,经103℃烘干至恒重,得干燥的固体残渣;
[0081]
第一次清洗后抽滤所得孢子总量,占检测出的该批培养所得的孢子总量的百分数,即为一次水洗提取的孢子回收率。
[0082]
水洗所得的孢子悬浮液,用20目滤布过滤所得固体残渣质量为固废产生量。
[0083]
所述发酵结束时料床堆积体积减小的比例是指发酵结束时料床体积减小的量占发酵开始时料床体积的百分数。
[0084]
参见表4所示,在粘附保水剂和培养基用量相同,颗粒状惰性支撑体堆积体积相同的前提下,支撑体的粒度大小对孢子产率有明显影响。此外,除西塔环外,陶瓷拉西环、陶瓷十字环、不锈钢压延环也可以作为孢子培养的惰性支撑体使用。
[0085]
由于玉米芯颗粒作为吸附载体,其原理是利用颗粒中的小孔吸附悬浊液状态的营养物质,因此不添加粘附保水剂即可保证悬浊液状态的营养物质附着于玉米芯颗粒的内部及表面。与现有技术中的玉米芯颗粒载体培养方法相比,惰性支撑体培养方法在水洗提取孢子的过程中基本上避免了固体废弃物的产生,其原因是西塔环惰性支撑体可以完全回收,反复利用,而玉米芯颗粒则难以回收和重复利用;并且,由于惰性支撑体粘附培养利用的是支撑体的表面,而玉米芯颗粒内部孔隙率相对较高,在水洗提取孢子时易吸附洗脱下的孢子,造成部分孢子难以和玉米芯颗粒载体分离。因此,惰性支撑体在培养完成后水洗提取孢子的效率也比玉米芯颗粒高。
[0086]
传统麸曲培养法的料床易结块,内部超温现象更严重,因此不适合补充葡萄糖、淀粉等高效的培养基,而本发明的惰性支撑体培养法由于料床通透性较好,更具有大规模应用的潜力。
[0087]
[0088]
[0089]
[0090]
[0091][0092]
实施例6:
[0093]
该实施例是采用本发明发酵黑曲霉与现有技术的黑曲霉孢子培养过程料床超温
幅度的对比,具体是比较传统麸曲培养、玉米芯颗粒载体培养和本发明惰性支撑体粘附培养三种方法的料床中心点温度变化趋势:
[0094]
均以500ml三角瓶为培养容器,发酵开始时培养物料厚度均为5cm;分别在发酵开始后的24h,48h,72h检测料床中心温度,检测点位于料床轴线上距离顶部1/2厚度处;
[0095]
各组培养物料配方(g):
[0096]
传统麸曲培养:片状小麦麸皮54,水70;
[0097]
玉米芯载体培养:玉米芯颗粒50,木薯淀粉1.6,麸皮粉6.0,水100;
[0098]
本发明惰性支撑体粘附培养:西塔环92,卡拉胶1.5,聚丙烯酸钠1.0,黄原胶1.6,木薯淀粉1.6,麸皮粉6.0,水100。
[0099]
参见图3所示结果,与传统的麸曲培养方式和现有技术中的玉米芯颗粒载体吸附培养方式相比,本发明惰性支撑体培养方式的料床内部温度过热现象得到了显著的缓解。其原因是,具有足够刚性的惰性支撑体颗粒易于在培养过程中维持料床的空隙率不随微生物的生长而下降,从而保持料床的通透性,确保了料床内部具有较高的对流传热强度;二是惰性支撑体为不锈钢材质,自身的导热系数也远高于浸湿的生物质颗粒(玉米芯颗粒、麸皮等),确保了料床内部具有较高的热传导强度。
[0100]
实施例7:采用本发明的工艺制备酵母菌
[0101]
该实施例是采用本发明发酵工艺生产酵母菌的实例,所用酵母菌菌株为saccharomyces cerevisiae cicc1049,具体工艺为:
[0102]
在250ml锥形瓶中加入卡拉胶0.375g,聚丙烯酸钠0.25g,酵母粉0.25g,一水合葡萄糖0.5g,蛋白胨0.5g,水25ml,搅拌均匀。再加入粒径5mm,总堆积体积为62.5cm3的西塔环填料;
[0103]
灭菌并冷却至室温后,接入酿酒酵母,混合均匀,30℃培养3d,酵母细胞的细胞产率为9.05
×
109g
‑1(细胞产率的检测与计算方法同上述实施例中的孢子产率)。
[0104]
实施例8:采用本发明的工艺制备细菌
[0105]
该实施例是采用本发明发酵工艺生产细菌的实例,所用大肠杆菌为escherichia coli cmcc44102,具体工艺为:
[0106]
在250ml锥形瓶中加入卡拉胶0.375g,聚丙烯酸钠0.25g,酵母粉0.125g,nacl 0.125g,蛋白胨0.25g,水25ml,搅拌均匀。再加入粒径5mm,总堆积体积为62.5cm3的西塔环填料。灭菌并冷却至室温后,接入枯草芽孢杆菌,混合均匀,35℃培养3d,枯草芽孢杆菌细胞的细胞产率为4.66
×
10
10
g
‑1(细胞产率的检测与计算方法同上述实施例中的孢子产率)。
[0107]
上述实例选用具体的黑曲霉、酵母菌及枯草芽孢杆菌进行发酵示例,但本发明并不限于生产这些微生物的菌体,本领域技术人员基于本发明的原理及构思,采用本发明的方案,可以对其他微生物进行发酵生产,也可结合相应微生物的生长特性对上述工艺参数进行优化,以得到理想效果,这些由本领域技术人员在本发明公开范围内采用常规实验所优化后的方案均属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。