仿生阵列装置及其使用方法
1.相关申请的交叉引用本技术请求享有于2018年12月20日提交的题为“simple microchamber array technology (smart) and method of use”的第62/782,523号美国临时专利申请和于2019年11月14日提交的题为“biomimetic array device and method of using same”的第16/684,287号美国非临时专利申请的优先权,两者的全部内容通过引用并入在本文中。
技术领域
2.本发明涉及一种阵列装置和使用该装置的方法,以用于将生物样本暴露到成阵列的流体。
背景技术:
3.在有效治疗方案的开发和施用中,了解治疗药剂(therapeutic agent,有时也被称作治疗剂)和生物靶点(biological target)之间的相互作用是重要的。然而,与疾病相关联的细胞和组织不仅在患者之间不同,而且在个别患者内部也不同。因此,治疗方案可能对于一些患者有效,但对其它患者较不有效或无效。类似地,由于疾病发展或其它动态生理现象,对患者起作用的治疗方案在医治期间可变得较不有效。例如,常规的肿瘤医治方法包括在患者上迭代地尝试治疗方案,直到建立有效的方案。这种方法既耗时又昂贵,经常延迟有效的医治并在此期间允许疾病发展。另外,医治对患者提出了挑战,患者可能在承受最终无效的疗法的同时遭受令人不快且繁重的副作用。
4.作为使用患者的身体进行体内医治评价的备选方案,动物模型、细胞体外模型和类器官已经被运用来鉴别潜在治疗如何影响生物样本。然而在评价多种潜在疗法药剂(therapy agent)时,成本和时间负担使这些方法难以应用。另外,在一些情况下,这些方法可能无法对患者身体中存在的生理状况准确地进行建模,并且因此产生不清楚或不确定的结果。本公开提供了一种以省时且低成本的方式来评价到生物样本的成阵列的流体的装置和方法,所述成阵列的流体包括治疗药剂。与典型地涉及原始组织(original tissue)的解离(dissociation)和/或扩增(expansion)的其它方法相比,生物样本可包括来自患者的肿瘤组织切片培养物,该肿瘤组织切片培养物保留了微结构并且不需要添加生长因子。因此,可通过将成阵列的治疗药剂应用于生物样本并观察治疗药剂暴露的每个区域中的生物样本的细胞活性和特性来同时评价若干医治选择。
技术实现要素:
5.本发明涉及仿生阵列装置及其使用方法。在本发明的一个方面中,提供了仿生阵列装置,该仿生阵列装置包括具有至少一个微室阵列,以及至少一个微通道或至少一组微通道的盒,其中每个微室阵列包括与至少一个微通道流体地连通的至少一个微室。每个微室具有对其外部环境开放的顶部接口,并构造成沿其顶部接口接纳生物样本,使得顶部接口处的生物样本定位成在微室包含流体时从微室吸取流体。该装置进一步包括注入区域,
该注入区域具有至少一个储器和至少一个注入通道,其中每个储器与一个注入通道的摄入区域流体地连通,并且每个注入通道的摄入区域与一个储器流体地连通。每个储器构造成通过顶部开口接纳流体,并通过位于储器的基部中的端口将流体引导到一个注入通道的摄入区域。每个注入通道具有用于接纳来自一个储器的流体的摄入区域和用于将流体从该摄入区域输送到在盒中的至少一个微通道的输送区域。仿生阵列装置构造成将大致相等体积的流体从每个储器输送到与每个储器流体地连通的每个微室,使得一个微室阵列内的每个微室构造成向每个微室的顶部接口处的生物样本提供大致相等体积的流体。
6.在一些实施例中,至少一个注入通道在输送区域内分支成多于一个注入子通道,并且每个注入子通道与至少一个微通道流体地连通。至少两个微室阵列的连接可为并联或串联的,并且装置是整体结构并且由亲水材料构成。在一些示例中,疏水涂层被放置在装置的一些区域上以基本上防止流体从装置溅出或意外地润湿相邻的壁的顶部。微通道在盒内具有不同的深度并且相邻的微通道不具有相同的深度,使得基本上防止了相邻的微通道之间的流体输送。类似地,微通道具有跨过盒的不同的长度并且相邻的微通道不具有相同的长度,使得基本上防止了相邻的微通道之间的流体输送。为了防止流体在装置被搅动的情况下从装置溅出,并且为了容纳生物样本,盒的侧壁沿微通道较高而沿微室较低。为了帮助混合流体,在一些示例中,至少一个微通道和/或至少一个注入通道包括从其内部表面延伸的用于混合流体组分的搅动结构。
7.在一些实施例中,至少一个储器在其内部包含减小平行于其基部的横截面面积的间隔结构,使得所述至少一个储器构造成与在没有间隔结构的情况下相同体积的流体将产生的高度相比,在其内部以更大的高度容纳一定体积的流体。间隔结构的大小由注入通道的长度确定,其中与较长的注入通道流体地连通的储器中有较大的间隔结构,使得装置被构造成将相等体积的贮存到每个储器中的流体输送到一个微室阵列内的每个微室,并向使流体同等地暴露到在每个微室的顶部接口处的生物样本。
8.在本发明的另一方面中,提供了一种使用仿生阵列装置的方法。该方法包括首先提供仿生阵列装置,其中该装置包括盒和注入区域。该盒包括至少一个微室阵列,以及至少一个微通道或至少一组微通道,每个微室阵列具有与至少一个微通道流体地连通的至少一个微室。每个微室具有对其外部环境开放的顶部接口,并构造成沿顶部接口接纳生物样本。注入区域包括至少一个储器和至少一个注入通道,每个储器与一个注入通道流体地连通,并且每个注入通道与一个储器流体地连通。每个储器构造成通过顶部开口接纳流体并通过位于储器的基部中的端口将流体引导到一个注入通道中,并且每个注入通道与盒中的至少一个微通道流体地连通。第二个步骤包括沿每个微室阵列中的至少一个微室的顶部接口定位生物样本。在定位生物样本之后,操作者将流体贮存在至少一个储器中,其中流体流动通过与包含所贮存的流体的每个储器流体地连通的每个注入通道和微通道,使得一个微室阵列内的每个微室向在每个微室的顶部接口处的生物样本提供大致相等体积的流体。在一些实施例中,在流体填充微室之后定位生物样本。在一些实施例中,生物样本经历利用相同或不同的流体依次填充和排空微室,以模拟多种治疗周期,或监测医治后的疾病发展,或用于在治疗发现(therapeutic discovery)期间评价临床前治疗制剂(preclinical therapeutic formulation)。在一些实施例中,附加的水凝胶基质与生物样本整合。在一些实施例中,水凝胶基质灌注有图案化纳米颗粒以用于电磁脉冲分析。在一些附加的实施例
中,水凝胶基质灌注有来自相同患者、细胞系、动物模型或以其它方式建立的来源的其它完整或分离的结缔组织或液体活检标本。
9.在每个储器中贮存相等体积的流体,并且贮存在至少一个储器中的任何储器中的流体选自包含培养介质、治疗药剂或药物化合物的集合。生物样本包括来自患者的肿瘤组织或与附加组分(包括水凝胶基质)整合的组织,如在以上所描述的那样。该方法可进一步包括以下步骤:表征暴露到流体之后的肿瘤组织内的细胞的表型、反应和活性,以便将得到靶细胞死亡模式和程度的流体识别为用于患者的治疗候选。
10.在本发明的又一方面中,提供了一种仿生阵列装置。该装置包括具有至少一个微室阵列,以及至少一个微通道或至少一组微通道的盒,每个微室阵列具有与至少一个微通道流体地连通的至少一个微室。每个微室和每个微通道包括对其外部环境开放的顶部接口。微通道具有交替变化的深度和交替变化的长度,其中较长的微通道较浅,而较短的微通道较深,使得微通道构造成容纳相等体积的流体,并且使得基本上防止了相邻的微通道之间的流体输送。该装置进一步包括具有至少一个储器和至少一个注入通道的注入区域,每个储器构造成通过顶部开口接纳流体并通过位于储器的基部中的端口将流体引导到一个注入通道中,其中每个注入通道构造成将流体输送到盒中的至少一个微通道。仿生阵列装置构造成将大致相等体积的流体从每个储器输送到与每个储器流体地连通的每个微室,使得一个微室阵列内的每个微室构造成向定位在每个微室的顶部接口处的生物样本提供大致相等体积的流体。
11.在一些实施例中,储器具有大致相同的形状和大小,并且定位成至少一行储器,每行内的储器具有大致均匀的间隔。在一些实施例中,至少一个储器在其内部包含减小平行于其基部的横截面面积的间隔结构,使得所述至少一个储器构造成与在没有间隔结构的情况下相同体积的流体将产生的高度相比,在其内部以更大的高度容纳一定体积的流体。间隔结构的大小由注入通道的长度确定,其中与较长的注入通道流体地连通的储器中有较大的间隔结构,使得装置被构造成将相等体积的贮存到每个储器中的流体输送到一个微室阵列内的每个微室,并使流体同等地暴露到定位在每个微室的顶部接口处的生物样本。
12.通过参考说明书的其余部分和附图将进一步认识到对于本发明的本质和优点的进一步了解。
附图说明
13.参考以下附图,同样可更好地仅通过示例的方式来理解本公开。附图的元素不必相对于彼此成比例,而是将重点放置在清楚地说明本公开的原理上。此外,贯穿若干视图,相似的附图标记标明对应的部分。
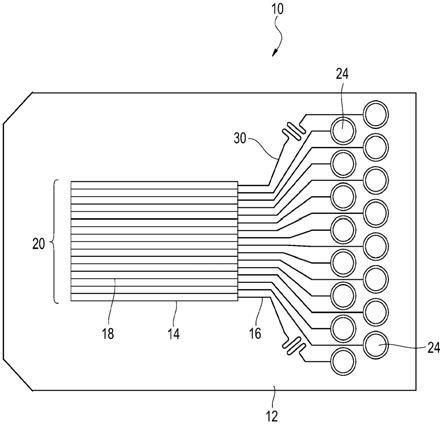
14.图1是描绘具有微通道的仿生阵列装置的示意图的俯视图,所述微通道构造成将流体通过微通道输送到微室。
15.图2是图1的仿生阵列装置的顶部立面图,其示出了具有端口的储器,所述端口用于将流体输送到仿生阵列装置的注入区域中的注入通道中。
16.图3是图1的仿生阵列装置的底部立面图,其示出了通过储器、注入通道、微通道和微室的流体路径。
17.图4是图1的仿生阵列装置的侧透视图,其示出了盒的形状,该盒具有沿微室的较
低侧壁和沿微通道的较长侧壁。
18.图5是图1的仿生阵列装置的储器的透视增强图,其示出了间隔结构在储器内改变流体高度的实施例。
19.图6是图1的仿生阵列装置的实施例的微通道和微室的终点的俯视图,其中相邻的微通道或微室不终止在相同的长度处。
20.图7是图1的仿生阵列装置的盒内的微通道和微室的截面图,在一些实施例中,该盒所具有的相邻的微通道或微室不在该盒内延伸到相同的深度。
21.图8是微室和放置在图1的仿生阵列装置上的生物样本的截面图,其中流体在每个微室的顶部接口处与生物样本相互作用。
22.图9是微室和放置在图1的仿生阵列装置上的生物样本的截面图,其中与生物样本相互作用的不同流体导致生物样本内的不同细胞反应和活性。
具体实施方式
23.本发明大体上涉及仿生阵列装置10及其使用方法。仿生阵列装置具有注入区域12和盒14,该注入区域12用于接纳流体,该盒14用于将流体通过微通道16输送到在微室阵列20内的微室18。因此,生物样本22在被放置在微室阵列20上方时,被暴露到组成微室阵列20的微室18中存在的多种流体。当生物样本22是来自患者的肿瘤组织样本时,通过观察肿瘤组织样本的暴露区域内的细胞活性来评估暴露到多种流体的结果。在这些示例中,流体可为治疗药品的候选。因此,可在仿生体外环境中同时评估针对个别患者的多种治疗医治,这与常规的体内治疗方案评估不同,在所述常规的体内治疗方案评估中,对患者迭代地进行医治,直到识别合适的方案。
24.如在本文中所使用的那样,单数形式“一个”、“一种”和“该”包括复数对象,除非上下文清楚地另外指示。
25.如在本文中所使用的那样,可将范围表示为从“大约”一个特定值和/或到“大约”另一特定值。在表示这样的范围时,实施例包括从一个特定值和/或到另一特定值。类似地,当通过使用“大约”来将值表示为近似值时,将理解的是,特定值形成另一个实施例。将理解的是,相对于另一个端点并且独立于另一个端点,每个范围的端点均为重要的。还应当理解的是,在本文中公开了多个值,而除了该值本身之外,每个值在本文中还被公开为“大约”该特定值。例如,如果公开了值“50”,则也公开了“大约50”。
26.如在本文中所使用的那样,用语“生物样本”指在本领域中已知的生物样本,包括但不限于组织、细胞、蛋白质和脂质。生物样本可为天然改性的或经工程改造的,并且包括非哺乳动物和哺乳动物样本,包括人类样本。
27.如在本文中所使用的那样,用语“患者”或“受试者”包括任何哺乳动物,包括人类。
28.如在本文中所使用的那样,用语“药物”指意图用于疾病或生物紊乱的诊断、治愈、医治、缓解或预防的制品。
29.参考图1,在这里描绘了仿生阵列装置10及其用于流体应用的注入区域12和用于样本评价的盒14。在所描绘的示例中,仿生阵列装置10具有整体构造,尽管在未示出的实施例中,部件或特征可潜在地分开地制造并且附接。用于制造仿生阵列装置10的材料是亲水的,包括诸如聚乳酸、丙烯腈丁二烯苯乙烯、聚对苯二甲酸乙二醇酯、聚碳酸酯和尼龙的材
料,但考虑了使用其它材料。在一些示例中,该材料是聚丙烯。为了制造在图2中所描绘的仿生阵列装置10,使用了增材制造技术或注射成型。然而,在本领域中已知的多种制造技术和制造技术的组合适合用于仿生阵列装置10的制造。类似地,在仿生阵列装置10的制造中所使用的材料基于制造技术的选择而不同。通常,首先产生所意图的仿生阵列装置10的3d模型,并且使用其来引导仿生阵列装置10的准确制造,包括期望的尺寸和特征。在一些示例中,仿生阵列装置10在一些区域中涂覆有疏水材料。涂层区域包括仿生阵列装置10的盒14的上边缘,使得盒14内的流体在仿生阵列装置10的正常操作或搅动下不会不经意地溅出或不经意地以其它方式润湿相邻的壁的顶部。
30.仿生阵列装置10的尺寸基于将被引入注入区域12中的流体的数量和包括在盒14中的微室阵列20的数量而变化。盒14的深度可基于应用而不同,并且允许微室18中的流体与定位在盒14上的任何生物样本22相互作用。在一些示例中,盒14的深度的范围为毫米到若干厘米。在一些示例中,注入区域12的深度与盒14的深度大约相同,而在其它示例中更浅或更深。盒14的厚度使得每个微室18容纳有将相邻的微通道16和微室18分开的足够厚的壁,使得生物样本22的大小被最大限度地减小。例如,具有微室18和在微室18之间的壁的盒14将容纳在盒14的厚度上的这些尺寸,所述微室18为大约300μm厚,所述壁为大约300μm厚。在一些示例中,注入区域12的宽度大于盒14的宽度,而在其它示例中小于或大约等于盒14的宽度。盒14的长度使得期望数量的微室阵列20以及用于流体输送的微通道16得到容纳。在一些示例中,盒14的长度的范围为若干厘米到若干分米,但其它长度也是可能的。在一些示例中,注入区域12的长度小于盒14的长度,而在其它示例中大于或大约等于盒14的长度。
31.如在图2中所示出的那样,仿生阵列装置10的注入区域12包括至少一个储器24以收集所贮存的流体并将该流体引导至仿生阵列装置10内的其它区域。仿生阵列装置10在包括多个储器24时被构造成向生物样本22施用多种流体。在包括多个储器24的其它示例中,仿生阵列装置10构造成以至少一式两份的方式向生物样本22施用至少一种流体,从而允许样本
‑
流体的相互作用的统计分析。储器24被构建到仿生阵列装置10中并且以列、行或其它构造定位。在一些实施例中,储器24在每行中间隔成使得商用多通道移液器能够将流体一次分配到一行中的每个储器24中。储器24的数量和形状是可变化的,但当仿生阵列装置10被构造成与商用多通道移液器一起使用时,使用大致相同形状的储器24。在使用商用多通道移液器的示例中,在任何行中的储器24的数量也取决于商用多通道移液器的通道的数量。例如,如在图2中所描绘的那样,八个储器24在一行中,但是考虑了其它数量的储器24或其它数量的行的储器24。进一步,在一些实施例中,在一个仿生阵列装置10内,行和/或列具有不同的数量的储器。如在图1和图2中所描绘的那样,储器24的形状被示出为大致的圆形,但是考虑了其它形状,例如椭圆形、四边形或圆化四边形。进一步,虽然图2中的储器24的高度和周长大致相等,但在未示出的其它实施例中,一个注入区域12内的储器24具有不同的尺寸。
32.参考图2,每个储器24具有基部26,该基部26具有端口28,该端口28跨越基部26以允许储器24与注入通道30流体地连通。如在图2中所示出的那样,每个基部26具有与每个储器的顶部开口32相同的横截面面积,但在未被描绘的实施例中,每个基部26和每个顶部开口32的横截面面积不同。通过储器24的顶部开口32将流体施用到储器24,并将流体收集在由储器侧壁和基部26限定的储器24的内部。由于在制造每个储器24中所使用的亲水材料和
重力,流体在被施用到储器24中之后朝向基部26流动。端口28在图2中的横截面中被描绘为圆形,但其它形状也是可能的,诸如四边形、椭圆形或圆化四边形。端口28具有最大尺寸,该最大尺寸的范围为若干微米到若干毫米。由于亲水材料特性、毛细管力、重力和仿生阵列装置10的几何形状,储器24内的流体在没有诸如泵的外部压力源的帮助的情况下进入端口28。
33.现在参考图3,从仰视图示出了在注入区域12和盒14内的流体路径。在注入区域12中,每个储器24与一个注入通道30的摄入区域34流体地连通。类似地,一个注入通道30的每个摄入区域34与一个储器24流体地连通。因此,进入储器24的顶部开口32的流体被通过端口28输送到注入通道30的摄入区域34。在所描绘的实施例中,注入通道30在仿生阵列装置10的注入区域12内输送流体,并且注入通道30的任何部分都不对外部环境开放。然而,在未被描绘的实施例中,注入通道30可能在注入通道30的至少一部分中对外部环境开放。在所描绘的实施例中,注入通道30的横截面基本上等于端口28的横截面,但在其它实施例中,注入通道30的横截面与端口28的横截面不同。在所描绘的实施例中,注入通道30的横截面尺寸在注入通道30的整个长度上保持基本一致,但在未示出的其它实施例中,注入通道30的横截面尺寸沿注入通道30的长度增加、减小或以其它方式变化。另外,在一些示例中,所有注入通道30的横截面尺寸是相同的(诸如所描绘的那样),或在其它示例中与个别的注入通道30不同。流体在进入摄入区域34中的注入通道30之后,流动通过注入通道30的输送区域36。在一些未示出的实施例中,注入通道30在它们的输送区域36内形成分支,使得来自一个储器24的流体均匀地分开到每个分支。在图2
‑
3所示出的实施例中,注入区域12比盒14更宽,并且注入通道30将流体从每个储器24输送到注入通道30与微通道16相遇的区域。因此,基于仿生阵列装置10的几何形状,一些注入通道30比其它注入通道30更长。在以下论述对仿生阵列装置10的调整,所述调整允许输送相等体积的流体并且将生物样本22同等地暴露到流体。
34.流体从注入通道30的输送区域36进入盒14的微通道16。在注入通道30进行分支的情况下,每个分支与一个微通道16相遇。在未进行分支的注入区域中,每个注入通道30将流体输送到一个微通道16,并且每个微通道16与一个注入通道30流体地连通。
35.参考图4,盒14具有微通道16,所述微通道16构造成将流体输送到微室阵列20内的微室18。虽然在图4中描绘了一个微室阵列20,但是两个或更多个微室阵列20是可能的,并且所述两个或更多个微室阵列20处于并联、串联,或处于并联以及串联两者。当如在图4中那样从侧部观看盒14时,微室阵列20被示出成具有比仅包括微通道16的部位更短的侧壁。因此,盒14在外观上具有u形或阶梯形形状,其中每个u形的谷或较低的阶梯指示一个微室阵列20的位置。该较低的侧壁区域允许将生物样本22放置在一个微室阵列20内的微室18的顶部接口38处。另外,u形或阶梯形减少或基本上防止流体在正常操作期间或在仿生阵列装置10的搅动期间从盒14溅出。
36.在未被描绘的示例中,微通道16在到达微室18之前进行分支,或如图1
‑
2中所示出的那样不进行分支。在存在一个如所描绘的那样的微室阵列20或微室阵列20被串联布置的示例中,微通道16基本上是线性的。在其它示例中,诸如当微室阵列20并联布置时,微通道16不是线性的。如在图4中所示出的那样,微通道16与微室18流体地连通,并且一个微通道16与一个微室18流体地连通。在诸如那些所描绘的实施例中,微通道16从微室18的下游端
延伸,但在未示出的实施例中,微通道16在最终微室阵列20之后终止。微室18和微通道16的组合长度在一些示例中是相等的,或在其它示例中不同,这在以下论述。在盒14内,微通道16和微室18具有基本上相等的宽度,例如可为300μm。在图4中所描绘的示例中,微通道16和微室18的横截面与注入通道30的横截面不同,但这些横截面在其它示例中基本相同。微通道16和微室18的横截面是例如u形的横截面或其顶侧被去除的四边形的横截面。在以下更详细地论述微通道16和微室18的深度,尽管在一些示例中所有深度是相等的,而在其它示例中不同。微通道16和微室18在它们的顶部接口38处向与它们的基部相对的外部环境开放。将相邻的微通道16和微室18分开的侧壁具有与图3中的每个微通道16或微室18相同的厚度,但侧壁厚度可能大于或小于微通道16和微室18的厚度。在所描绘的实施例中,微通道16和微室18在盒14内相等地间隔,但在其它实施例中间隔可不同。
37.返回参考图4,微室18包括顶部接口38,该顶部接口38提供用于流体与放置在顶部接口38处的任何生物样本22相互作用的区域。顶部接口38被描绘为对外部环境开放,但在未被描绘的实施例中,顶部接口38包括在微室18和生物样本22之间的渗透性或半渗透性接口。在一些示例中,当流体填充微室18时,立即产生生物样本22到流体的暴露以及生物样本22与所述流体的相互作用,而在其它情况下,顶部接口38提供流体或流体的组分从微室18到生物样本22的延迟释放。
38.在一些实施例中,微通道16、注入通道30和/或微室18包括搅动结构42,以帮助流体组分在它们行进穿过微通道16、注入通道30和/或微室18时混合。搅动结构42是半圆形、棒状、经分支的棒、球形或从微通道16、注入通道30和/或微室18的内部表面延伸并在流体移动通过其时混合流体的任何其它结构。搅动结构42附接或构建在微通道16、注入通道30和/或微室18的内部壁和/或基部中,并且从这些内部表面延伸到在微通道16、注入通道30和/或微室18内的流体路径中,使得流体的通过搅动结构42的移动引起至少一定程度的湍流流动,从而混合该流体。在一些示例中,通过仿生阵列装置10的移动或搅动来在搅动结构42的混合功能上帮助所述搅动结构42。例如,仿生搅动装置10被放置在商用振荡器(rocker)、摇荡器(shaker)或用以提供搅动或运动的其它振动或搅动设备上。
39.参考图5,一些实施例包括具有间隔结构40的储器24。间隔结构40被包括在储器24内以改变流体从基部26起的高度。因此,在包含具有多种大小的间隔结构40的多个储器24中贮存的相等体积的流体导致多种流体高度。因而,在一些实施例中,仿生阵列装置10构造成使得与较长注入通道30流体地连通的储器24具有比与较短注入通道30流体地连通的储器24更大的间隔结构40。在根据注入通道30的长度设定间隔结构40的大小上,应用到储器24的相等体积的流体导致相等体积的流体到达生物样本22,以及使来自微室18的流体同等地暴露到生物样本22。间隔结构40定位成使得端口28不受阻塞或阻碍,并且使得所贮存的流体到达端口28并通过端口28输送。间隔结构40的平行于基部26的横截面形状是圆形、半圆形、四边形、椭圆形、圆化四边形或适合在储器24内而不阻塞或阻碍流体接近端口28的任何其它横截面形状。间隔结构40在图5中被示出为共形于储器24的侧壁的至少一些区域,但在未示出的实施例中,间隔结构24不共形于储器24的任何侧壁。在从基部26延伸的情况下,间隔结构40在储器24内达到的高度小于或等于储器24的侧壁的高度。通过改变间隔结构40的尺寸(诸如高度和平行于基部26的横截面面积)而使间隔结构40的大小变化。在一些情况下,一些储器24具有间隔结构40而其它储器不具有。在其它情况下,所有储器24具有间隔结
构40,或没有储器24具有间隔结构40。在一些实施例中,储器24内间隔结构40的存在、不存在和大小由仿生阵列装置10的几何形状确定,使得最靠近盒14的储器24(该储器24具有较短的到达盒14的注入通道30)不具有间隔结构40、最小间隔结构40。类似地,最远离盒14的储器24(该储器24具有较长的到达盒14的注入通道30)具有最大的间隔结构。在储器24相对于盒14的位置不与注入通道30的长度相互关联的实施例中,注入通道30的长度确定了间隔结构40的大小以及存在或不存在,其中与较长注入通道30流体地连通的储器24具有较大的间隔结构40。较大的间隔结构40比较小的间隔结构40包围储器24的内部的更大容积,使得相比于在没有间隔结构或具有较小间隔结构40的储器中,在具有较大的间隔结构40的储器中应用到储器24的相同体积的流体将具有更高的从基部26起的高度。在一些未被描绘的实施例中,在至少一个储器24中存在多于一个间隔结构40,从而允许端口28不阻塞或阻碍流体输送。间隔结构40的大小和形状设定成使得它们不阻碍移液管或其它流体贮存装置向储器24提供流体。如在图5中的一个实施例中所描绘的那样,间隔结构40被构建到储器24中并且具有与储器24的整体构造,而在未被描绘的其它实施例中,间隔结构被与储器24分开地形成并且通过本领域中已知的附接手段附接。在这些实施例中,间隔结构40由与构成储器24的材料相同的材料制成,或由不同的材料制成。间隔结构40是中空的、部分中空的或实心的,但对于流体基本上是不可渗透的。虽然间隔结构40的使用允许将相等的体积分配并且输送到生物样本22,其中生物样本22大致同等地暴露到每种流体,但一些不具有间隔结构40的实施例改为基于注入通道30与盒14的距离而使用不相等的体积的流体到储器24的分配以实现此相同的结果。这些不相等的体积是在分配之前经计算的,但间隔结构40的使用通过消除这些计算为用户简化了该过程。
40.现在参考图6,在一些实施例中,微通道16和微室18被制造成使得它们终止于跨过盒14长度的不同点处。图6描绘了在较长和较短的微通道16之间交替变化的微通道16。然而,在未被描绘的其它实施例中,微室18也在较长和较短的微室18之间交替变化。产生不同的长度以防止源于微米级孔洞的泄漏,所述微米级孔洞可在制造期间在微通道16和微室18的基部和侧壁的交叉处形成。通过确保没有相邻的微通道16或微室18共用公共终点侧壁,基本上防止了相邻的微通道16或微室18之间的裂缝。图6描绘了两个交替变化的微通道长度,但在未示出的其它实施例中存在多于两种长度的微通道16或微室18。
41.在图7中,盒14的横截面被示出成具有微通道16,所述微通道16在盒14内具有不同的深度。在与图7的横截面类似的未示出的横截面中,微室18在盒14内也具有不同的深度。与以上所描述的类似,在制造期间,可在微通道16和微室18的基部和侧壁的交叉处形成微米级孔洞。因此,在一些实施例中,相邻的微通道16或微室18不具有相同的深度,以基本上防止在微通道16和微室18之间的源于任何微米大小的孔洞的泄漏。虽然描绘了两种深度的微通道16和微室18,但在未示出的实施例中,多于两种深度的微通道16和微室18是可能的。
42.在微通道和微室的长度不同的一些实施例中,微通道和微室的深度也不同,其中微通道和微室的宽度保持相等。在这些实施例中,通过具有较长的微通道16和相对地较浅的微室18以及通过具有较短的微通道16和相对地较深的微室18,在每个微通道16和微室18中保持相等的流体体积容量。因此,相等体积的流体到达微室18和微室18的顶部接口38处的任何生物样本22。在微通道或微室的长度和深度不同的其它实施例中,每个微通道16或微室18内的流体体积容量不相等。
43.图8和9描绘了盒14的顶部区域的横截面,其中流体在每个微室18的顶部接口38处与生物样本22相互作用。在图8中描绘了不同的流体,并且生物样本22内的细胞被暴露到这些流体。流体的示例包括培养介质、洗涤溶液、标记溶液、药物化合物、治疗药剂、分析物或用于与生物样本22相互作用的其它溶液。当运用成阵列的药物药剂时,能够使用患者的生物样本22来进行疗法方案(therapy regimen)的效率的多重测试,从而允许快速且低成本地识别有希望的疗法。当运用成阵列的药剂时,有可能同时测试若干种候选化合物或分子的有效性,进而帮助选择最有效的化合物。当一式两份或更多地应用特定流体时,结果的统计分析是可能的。类似地,当阵列中的流体的部分是健康的培养介质而阵列中的流体的另一部分是分析物(诸如治疗药剂或药物化合物)时,健康的培养介质用作与分析物进行比较的正常细胞形态、表型和活性的对照。
44.在图9中,已经在生物样本22的区域上培育了来自微室18的流体,并且可就细胞活性、表型、响应和形态来分析这些区域以确定流体的影响。例如,健康的介质培育导致标准的、预期的细胞形态和增殖外观,其具有可用作其它分析物的基线或对照的细胞计数。因此,相对于对照,导致较低细胞计数或异常细胞形态的分析物、凋亡指数或坏死指数,或染色模式得到识别。对于坏死细胞死亡来说,死亡或不健康细胞的细胞形态是膨胀或经爆破的,或者对于凋亡细胞死亡来说,死亡或不健康细胞的细胞形态具有气泡。当分析物由提供分析物的微室18的顶部接口38处的生物样本22的区域吸收并且观察到细胞凋亡时,确定细胞已由分析物诱导而计划或开始它们自己的死亡。在一些示例中,坏死指示的是,细胞没有吸收分析物或细胞缺乏必需的营养或生长条件。在一些示例中,染色技术(诸如那些使用荧光分子的染色技术)被用于指示活细胞或死细胞。例如,碘化丙啶和/或膜联蛋白v提供有关细胞活性的可见信息。
45.为了观察生物样本22的区域和生物样本22内的细胞,使用了成像技术。通常,使用显微术来在细胞水平上观察生物样本22,其中共焦显微术在一个或多个z平面上提供生物组织22的图像。因此,共焦显微术允许分析在生物样本22内的细胞,不仅允许分析在生物样本22的表面上的细胞,而且允许分析在生物样本22内的细胞。使用显微镜来观看荧光通道以观察染色模式,其中不同的通道可用来观看不同的荧光团。
46.在一些示例中,在流体已经与生物样本22接触之后,分析来自微室阵列20中的每个微室18的流体。使用诸如酶联免疫吸附测定(elisa)、酶联免疫斑点法(elispot)和西方印迹法(western blotting)的方法进行流体分析,以识别和/或量化流体组分(诸如抗体或蛋白质),这些组分可基于流体本性和生物样本暴露而不同。在其它示例中,在流体已经与生物样本22接触之后,在微室18中的流体中检测dna或rna。可使用诸如凝胶电泳(gel electrophoresis)、北方印迹法(northern blotting)、南方印迹法(southern blotting)或聚合酶链反应(polymerase chain reaction)和测序的技术来检测和识别核酸。对于本公开,考虑了未在以上被具体地描述的用于核酸、蛋白质、抗体或其它细胞组分的检测、识别和/或定量的其它技术和方法。
47.生物样本22包括任何组织、细胞、蛋白质、脂质或其它生物材料。在一些示例中,生物样本22由患者或受试者新鲜地提供,或是由患者或受试者原始地提供的冷冻样本。进一步,生物样本22是天然的、改性的,或至少部分地经工程改造的材料。在一些情况下,生物样本22包括未扩增的细胞或由未扩增的细胞构成,而在其它情况下,生物样本22的一些或所
有细胞得到扩增。在一些情况下,在生物样本22的制备和储存中使用样本洗涤和保存技术,而在其它情况下,生物样本22不被暴露到保存材料、生长因子或其它所添加的溶液组分。在一些实施例中,生物样本22是来自患者的肿瘤活检的组织切片培养物。新鲜或快速冷冻(flash
‑
frozen)的肿瘤活检标本与本发明相容。在其它实施例中,生物样本22包括根据在本领域中已知的方法吸附、结合或生长在支架上的生物组分,该支架包括弹性体纺丝支架(elastomer spun scaffold)。生物样本22的厚度典型地大约小于500μm,但范围为大约100μm到大约1mm的厚度被考虑为与本公开相容。生物样本22被放置成横向跨过一个微室阵列20,使得微室阵列20内的每个微室18定位在生物样本22下方。生物样本22的定位允许通过毛细作用带走流体,并且背离顶部接口38的生物样本22的顶部表面经常比与顶部接口38接触的生物样本22的表面更不饱和,从而形成浓度梯度,使得可能通过毛细作用从微通道中带走流体。
48.在一个示例中,生物样本22是使用14号针通过核芯针活检收集的新鲜肿瘤组织样本。从核芯标本制备大约300
µ
m厚的组织切片培养物,并且将其放置在多孔聚合物膜培养插入物上。然后利用经预热的介质来使生物样本22适应环境,并且将其转移到经消毒的仿生阵列装置10上、到在一个微室阵列20内的微室28的顶部接口38处。使用在本领域中已知的方法进行仿生阵列装置10的消毒,包括但不限于uv辐射和乙醇溶液的应用。生物样本22的位置使得生物样本22的基底表面与微室18的顶部接口38处于直接或大致直接的共形接触,而顶端表面朝上面向外部环境。将流体通过微通道16提供给微室18,并且将仿生阵列装置10放置在处于大致37℃,具有5%co2的组织培养培育器(tissue culture incubator)中。培育发生在范围为若干分钟到若干天的时间段内,或如在本例中的那样,发生在范围为3天到14天的时间段内。备选地,在一些示例下,改为在不同的温度和培养条件下应用和培育流体。回到本示例,研究了生物样本22的区域内的细胞活性和形态。使用染色技术来检查活性和增殖,诸如利用碘化丙啶和膜联蛋白v来将生物样本22染色,随后使用显微镜(诸如共焦显微镜)来对生物样本22内的细胞成像。诸如通过可视化染色模式、通过细胞计数确定细胞数量或观察细胞形态来评估生物样本22内的若干z平面,使得可评估活性和增殖。在另一个示例中,使用从较大的大块标本而不是从核芯针活检来制备的组织切片培养物,之后进行上述程序。
49.在又一个示例中,肿瘤活检在被分析之前首先被快速冷冻(flash frozen)。在此情况下,核芯针活检或较大的标本样本被放置在无菌冷冻管或适合冷冻储存的其它无菌容器中。储存容器还包括95%的组织培养介质或具有5%二甲基亚砜的胎牛血清。每个样本都根据已建立的生物银行协议(bio
‑
banking protocol)进行处理,并将样本储存容器放置在具有异丙醇的间接冷冻容器(secondary freezing container)中,并且然后转移到
‑
80℃冷冻箱大致24小时。在此之后,样本被转移到液氮储存装置,持续时间的范围为若干天到若干年,或更具体地说,对于本示例是大约一到四个星期。在该储存持续时间之后,根据已建立的生物银行协议解冻样本。在解冻且洗涤样本以去除储存剂之后,将样本制备为如以上所描述的那样的新鲜生物样本22。
50.在一些实施例中,在分析生物样本22以及与多种分析物和流体接触的区域之后,获得关于每种流体的有效性的信息。当流体是潜在的治疗药剂时,那些有效导致肿瘤细胞死亡的治疗药剂被识别为对提供肿瘤活检的患者施用的候选。因此,代替向患者施用治疗
方案、评价有效性以及如果原始方案不成功则切换到不同治疗方案的耗时、昂贵且低效的典型方法,本公开提供了一种方法,通过该方法,以低成本、快速且有效的方式测试治疗药剂的杀死患者的肿瘤中的肿瘤细胞的有效性。患者能够避免不必要且无效的疗法而开始那些最有可能有效的疗法,从而通常比使用常规迭代方法将发生的那样更早地开始有效治疗。
51.仿生阵列装置10构造成在没有例如由泵提供的外部机械力的帮助的情况下输送流体。而装置的几何形状、毛细管力、重力和材料特性提供了流体在仿生阵列装置10内流动的能力。然而,在未示出的实施例中,除了装置特性之外,还使用了外部机械装置。
52.本发明能够支持多种构造的微通道16、微室18、微室阵列20和储器24,包括a
‑
k
‑
d
‑
n构造,其中(a)是任何数量的微室阵列20,(k)是任何数量的储器24,(d)是通过(n)数量的微通道16连接到每个储器24的微室18的任何数量。具有a
‑
k
‑
d
‑
n构造的这些构件能够并联连接、串联连接或以其任何组合连接。例如,1
‑1‑1‑
1构造包括一个微室阵列20,其中一个储器24通过单个微通道16连接到一个微室18。在示例性的3
‑
16
‑1‑
1瀑布式构造中,三个微室阵列20由16个储器24提供流体,每个储器24通过一个微通道16连接到每个微室阵列20内的一个微室18。因此,在该示例性瀑布式构造中,每个微室阵列20内存在16个微室18。当微室阵列20处于串联形式时,一个微通道16将一个微室阵列20内的一个微室18连接到另一个微室阵列20内的一个微室18。
53.如将由熟悉本领域的技术人员所理解的那样,在不脱离本发明的精神或基本特征的情况下,可能以其它具体形式实施本发明。本公开可利用未在本文中具体地描述的应用来应用到其它领域,例如用于药品发现、化学能量存储探索、生物制造(biofabrication)和诊断成像。因此,在本文中的公开和描述意图说明而非限制本发明的范围,本发明的范围在所附权利要求书中阐述。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。