1.本发明涉及肠道调节用茶发酵组合物及其制造方法,更详细而言,涉及用于调节肠道菌群、用于缩短消化道通过时间等用于调节肠道的茶发酵组合物及其制造方法。
背景技术:
2.便秘是因饮食习惯失调、运动不足、应激之类的各种因素而发病且许多人经历的症状,因此有容易被忽视的倾向。然而,据报道,便秘不仅使qol 降低而且提高了冠状动脉疾病、缺血性中风等的发生风险和死亡风险,近些年保持正常的通便被认为是重要的。另一方面,也报道了:便秘与肠道菌群密切相关,肠道菌群的变化有助于改善便秘。例如,xiaolong ge等人在 2017,scientific reports 7:441(非专利文献1)中报道了:便秘患者的粪便中的细菌的shannon
‑
winner的多样性指数(h’)的值显著高于健康的人,木村修武等人在1971,小麦胚芽对便秘症的成人的肠道菌群产生的影响,日本细菌学杂志 26:5
·
6,p.222~227(非专利文献2)中报道了:便秘改善的同时观察到粪便中的乳杆菌属、双歧杆菌属的菌数的增加、链条杆菌属等细菌数的减少。另外,可认为肠道菌群还具有消化辅助、免疫反应调节、抗炎症等各种作用。
3.另外,乳杆菌属等乳酸菌被认为是栖息在人的肠道中并发挥防御感染、防止肠道腐败和促进肠道运动这样的各种生理活性的肠道有用细菌,例如,日本特开2018
‑
85953号公报(专利文献1)中,作为以通过经口摄取固定于肠道中为目的的乳酸菌,记载了特定的植物乳杆菌。
4.另一方面,已知可以使用乳酸菌由各种底物制备发酵物,例如,日本特开2016
‑
167984号公报(专利文献2)中记载了一种发酵产物,所述发酵产物是通过将由底物产生邻苯三酚的戊糖乳杆菌接种于食品材料中并使其发酵而产生的;日本特开2011
‑
72217号公报(专利文献3)中记载了一种茶乳酸菌发酵物,所述茶乳酸菌发酵物是通过用特定的短乳杆菌对茶叶或茶叶提取物的加水物进行发酵处理而得到的。
5.另外,作为前述乳酸菌的发酵物的用途,例如,专利文献2中记载了所产生的邻苯三酚具有抗变态反应作用;另外,国际公开第2006/090729号(专利文献4)中记载了含有乳杆菌属中所包含的特定的乳酸菌的茶发酵液的茶
‑ꢀ
发酵饮料可以发挥iga产生亢进作用和粘膜免疫激活作用。然而,为了预防、改善上述的便秘,对于能够实现肠道菌群的调节、消化道通过时间的缩短这样的调节肠道的乳酸菌的茶发酵物,研究/开发尚不充分。
6.现有技术文献
7.专利文献
8.专利文献1:日本特开2018
‑
85953号公报
9.专利文献2:日本特开2016
‑
167984号公报
10.专利文献3:日本特开2011
‑
72217号公报
11.专利文献4:国际公开第2006/090729号
12.非专利文献
13.非专利文献1:xiaolong ge等,2017,scientific reports 7:441
14.非专利文献2:木村修武等,1971,小麦胚芽对便秘症的成人的肠道菌群产生的影响(小麦胚芽
の
便秘症
の
成人
の
腸内菌叢
に
及
ぼす
影響),日本细菌学杂志26:5
·
6,p.222~227
技术实现要素:
15.发明要解决的问题
16.本发明是鉴于上述现有技术所具有的课题而完成的,其目的在于提供:具有调节肠道菌群、缩短消化道通过时间等肠道调节作用的、新型的肠道调节用茶发酵组合物及其制造方法。
17.用于解决问题的方案
18.本发明人等为了实现上述目的而进行了深入研究,首先,研究了含有用戊糖乳杆菌(l.pentosus oll203984、保藏编号:nite bp
‑
01988)使茶提取物发酵而制备的茶发酵物的茶发酵组合物对ncx/hox11l.1基因敲除小鼠 (ncxko小鼠、由国立大学法人千叶大学导入)的便秘改善效果。ncx/hox11l.1 基因是控制肠神经细胞的分化、细胞死的转录因子,ncxko小鼠中过量地存在肠神经细胞。因此,ncxko小鼠中肠的运动功能降低,与野生型小鼠(wt 小鼠)相比消化道内容物的消化道通过时间变长,确认患有慢性便秘。将上述茶发酵组合物向前述ncxko小鼠给予后,结果确认了:与给予了水的情况相比,给予了前述茶发酵组合物的ncxko小鼠中消化道通过时间显著缩短;显示出inos基因的表达量减少的倾向;以及与给予前相比,肠道菌群向改善便秘的方向发生变化。根据这些结果,本发明人等发现:前述茶发酵物具有前述戊糖乳杆菌的茶发酵物中以前未知的缩短消化道通过时间、调节肠道菌群这样的肠道调节作用。
19.另外,本发明人等发现:前述戊糖乳杆菌是产生邻苯三酚的乳酸菌,前述茶发酵组合物中包含未发酵茶中不含有的作为特征性成分的邻苯三酚,利用具有邻苯三酚产生活性的乳酸菌的茶发酵物,与前述戊糖乳杆菌同样地具有肠道调节作用,以至完成了本发明。
20.根据上述见解而得到的本发明的方式如下所述。提供:
21.1.22.一种肠道调节用茶发酵组合物,其含有乳酸菌的茶发酵物作为有效成分,所述乳酸菌为选自由戊糖乳杆菌、牛痘乳杆菌、棒状乳杆菌、发酵乳杆菌、嗜酸乳杆菌、格氏乳杆菌和布氏乳杆菌组成的组中的至少一种。
23.2.24.根据[1]所述的肠道调节用茶发酵组合物,其中,前述乳酸菌为产生邻苯三酚的乳酸菌。
[0025]
[3]
[0026]
根据[1]或[2]所述的肠道调节用茶发酵组合物,其中,前述茶发酵物含有邻苯三酚。
[0027]
[4]
[0028]
根据[1]~[3]中任一项所述的肠道调节用茶发酵组合物,其中,前述茶发酵物含有选自由前述乳酸菌及其处理物组成的组中的至少一种。
[0029]
[5]
[0030]
根据[1]~[4]中任一项所述的肠道调节用茶发酵组合物,其为用于调节肠道菌群的组合物。
[0031]
[6]
[0032]
根据[1]~[5]中任一项所述的肠道调节用茶发酵组合物,其为用于缩短消化道通过时间的组合物。
[0033]
[7]
[0034]
根据[1]~[6]中任一项所述的肠道调节用茶发酵组合物,其为用于减少 inos基因在肠中的表达量的组合物。
[0035]
[8]
[0036]
根据[1]~[7]中任一项所述的肠道调节用茶发酵组合物,其为用于预防或改善便秘的组合物。
[0037]
[9]
[0038]
根据[1]~[8]中任一项所述的肠道调节用茶发酵组合物,其为饮食品组合物。
[0039]
[10]
[0040]
一种肠道调节用茶发酵组合物的制造方法,所述方法包括如下工序:
[0041]
制备发酵混合物的工序,所述发酵混合物含有:茶提取物,以及选自由戊糖乳杆菌、牛痘乳杆菌、棒状乳杆菌、发酵乳杆菌、嗜酸乳杆菌、格氏乳杆菌和布氏乳杆菌组成的组中的至少一种乳酸菌;以及,
[0042]
得到茶发酵物的工序,在前述发酵混合物中使前述茶提取物通过前述乳酸菌发酵而得到茶发酵物。
[0043]
[11]
[0044]
根据[10]所述的肠道调节用茶发酵组合物的制造方法,其中,前述乳酸菌为产生邻苯三酚的乳酸菌。
[0045]
[12]
[0046]
根据[10]或[11]所述的肠道调节用茶发酵组合物的制造方法,其中,前述茶发酵物含有邻苯三酚。
[0047]
[13]
[0048]
根据[10]~[12]中任一项所述的肠道调节用茶发酵组合物的制造方法,其中,前述茶发酵物含有选自由前述乳酸菌及其处理物组成的组中的至少一种。
[0049]
[14]
[0050]
根据[10]~[13]中任一项所述的肠道调节用茶发酵组合物的制造方法,其中,前述肠道调节用茶发酵组合物为用于调节肠道菌群的组合物。
[0051]
[15]
[0052]
根据[10]~[14]中任一项所述的肠道调节用茶发酵组合物的制造方法,其中,前述肠道调节用茶发酵组合物为用于缩短消化道通过时间的组合物。
[0053]
[16]
[0054]
根据[10]~[15]中任一项所述的肠道调节用茶发酵组合物的制造方法,其中,前述肠道调节用茶发酵组合物为用于减少inos基因在肠中的表达量的组合物。
[0055]
[17]
[0056]
根据[10]~[16]中任一项所述的肠道调节用茶发酵组合物的制造方法,其中,前述肠道调节用茶发酵组合物为用于预防或改善便秘的组合物。
[0057]
[18]
[0058]
根据[10]~[17]中任一项所述的肠道调节用茶发酵组合物的制造方法,其中,前述肠道调节用茶发酵组合物为饮食品组合物。
[0059]
[19]
[0060]
一种乳酸菌的茶发酵物在用于制造肠道调节用茶发酵组合物中的应用,其中,所述乳酸菌为选自由戊糖乳杆菌、牛痘乳杆菌、棒状乳杆菌、发酵乳杆菌、嗜酸乳杆菌、格氏乳杆菌和布氏乳杆菌组成的组中的至少一种。
[0061]
[20]
[0062]
根据[19]所述的应用,其中,前述乳酸菌为产生邻苯三酚的乳酸菌。
[0063]
[21]
[0064]
根据[19]或[20]所述的应用,其中,前述茶发酵物含有邻苯三酚。
[0065]
[22]
[0066]
根据[19]~[21]中任一项所述的应用,其中,前述茶发酵物含有选自由前述乳酸菌及其处理物组成的组中的至少一种。
[0067]
[23]
[0068]
根据[19]~[22]中任一项所述的应用,其中,前述肠道调节用茶发酵组合物为用于调节肠道菌群的组合物。
[0069]
[24]
[0070]
根据[19]~[23]中任一项所述的应用,其中,前述肠道调节用茶发酵组合物为用于缩短消化道通过时间的组合物。
[0071]
[25]
[0072]
根据[19]~[24]中任一项所述的应用,其中,前述肠道调节用茶发酵组合物为用于减少inos基因在肠中的表达量的组合物。
[0073]
[26]
[0074]
根据[19]~[25]中任一项所述的应用,其中,前述肠道调节用茶发酵组合物为用于预防或改善便秘的组合物。
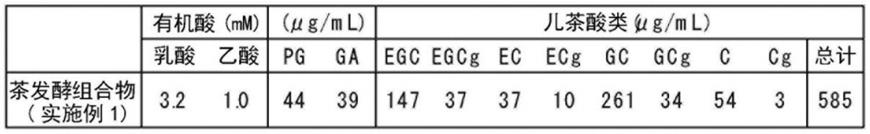
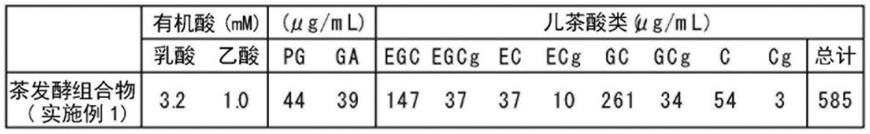
[0075]
[27]
[0076]
根据[19]~[26]中任一项所述的应用,其中,前述肠道调节用茶发酵组合物为饮食品组合物。
[0077]
[28]
[0078]
一种含有乳酸菌的茶发酵物的组合物在调节肠道中的应用,其中,所述乳酸菌为选自由戊糖乳杆菌、牛痘乳杆菌、棒状乳杆菌、发酵乳杆菌、嗜酸乳杆菌、格氏乳杆菌和布氏乳杆菌组成的组中的至少一种。
[0079]
[29]
[0080]
一种在对象中的肠道调节方法,其包括向对象给予含有乳酸菌的茶发酵物的组合物,所述乳酸菌为选自由戊糖乳杆菌、牛痘乳杆菌、棒状乳杆菌、发酵乳杆菌、嗜酸乳杆菌、
格氏乳杆菌和布氏乳杆菌组成的组中的至少一种。
[0081]
发明的效果
[0082]
根据本发明,能够提供具有调节肠道菌群、缩短消化道通过时间等肠道调节作用的、新型的肠道调节用茶发酵组合物及其制造方法。另外,本发明的肠道调节用茶发酵组合物能够以饮食品组合物的形式制成茶饮料,因此容易摄取(饮用),而且容易养成饮用的习惯。
附图说明
[0083]
图1是示出水或实施例1中得到的茶发酵组合物在给予前至给予开始后第4周为止的各组中的小鼠的平均体重的图。
[0084]
图2是示出水或实施例1中得到的茶发酵组合物从给予开始至4周后的各组中的小鼠的平均消化道通过时间的图。
[0085]
图3是示出水或实施例1中得到的茶发酵组合物给予前和给予后的各粪便中的细菌的种类数量的差值(δ种类数量)的图。
[0086]
图4是示出水或实施例1中得到的茶发酵组合物给予前和给予后的各粪便中的细菌的shannon
‑
winner的多样性指数的差值(δ香农多样性指数 (shannon diversity index))的图。
[0087]
图5是示出水或实施例1中得到的茶发酵组合物从给予开始至4周后的每 1g各盲肠内容物(干燥重量)的对甲酚量的图。
[0088]
图6是示出水或实施例1中得到的茶发酵组合物从给予开始至4周后的每 1g各盲肠内容物(干燥重量)的甲基吲哚量的图。
[0089]
图7是示出水或实施例1中得到的茶发酵组合物从给予开始至4周后的各结肠中的inos基因的表达量(相对的inos mrna水平)的图。
[0090]
图8是示出水、未发酵茶、或实施例1中得到的茶发酵组合物在给予前至给予开始后第4周为止的各组中的小鼠的平均体重的图。
[0091]
图9是示出水、未发酵茶、或实施例1中得到的茶发酵组合物从给予开始至4周后的每1g各盲肠内容物(干燥重量)的甲基吲哚量的图。
具体实施方式
[0092]
以下,根据其适合的实施方式对本发明进行详细地说明。
[0093]
本发明的肠道调节用茶发酵组合物含有选自由戊糖乳杆菌、牛痘乳杆菌、棒状乳杆菌、发酵乳杆菌、嗜酸乳杆菌、格氏乳杆菌和布氏乳杆菌组成的组中的至少一种乳酸菌的茶发酵物作为有效成分。另外,本发明的肠道调节用茶发酵组合物的制造方法包括如下工序:
[0094]
制备发酵混合物的工序,所述发酵混合物含有:茶提取物,以及选自由戊糖乳杆菌、牛痘乳杆菌、棒状乳杆菌、发酵乳杆菌、嗜酸乳杆菌、格氏乳杆菌和布氏乳杆菌组成的组中的至少一种乳酸菌;以及,
[0095]
得到茶发酵物的工序,在前述发酵混合物中使前述茶提取物通过前述乳酸菌发酵而得到茶发酵物。
[0096]
(茶发酵物)
[0097]
本发明的肠道调节用茶发酵组合物含有下述的特定的乳酸菌的茶发酵物作为有效成分。本发明中,乳酸菌的茶发酵物是指以茶提取物作为底物用乳酸菌发酵而得到的物质(发酵产物)。
[0098]
〔乳酸菌〕
[0099]
本发明的茶发酵物为选自由戊糖乳杆菌(lactobacillus pentosus:也称为戊糖乳杆菌(lactiplantibacillus pentosus))、牛痘乳杆菌(lactobacillusvaccinostercus:也称为牛痘乳杆菌(paucilactobacillus vaccinostercus))、棒状乳杆菌(lactobacillus coryniformis:也称为棒状乳杆菌(loigolactobacilluscoryniformis))、发酵乳杆菌(lactobacillus fermentum:也称为发酵乳杆菌 (limosilactobacillus fermentum))、嗜酸乳杆菌(lactobacillus acidophilus)、格氏乳杆菌(lactobacillus gasseri)和布氏乳杆菌(lactobacillus buchneri:也称为布氏乳杆菌(lentilactobacillus buchneri))组成的组中的至少一种乳酸菌的茶发酵物。
[0100]
作为本发明的乳酸菌,在上述的乳酸菌中也优选为具有邻苯三酚产生活性的产生邻苯三酚的乳酸菌。本发明人等认为:具有肠道调节作用的本发明的茶发酵物中,特异性产生了未发酵的茶提取物中不含有的邻苯三酚,因此其主要有助于前述肠道调节作用。邻苯三酚也称为1,2,3
‑
三羟基苯 (1,2,3
‑
trihydroxybenzene)。
[0101]
本发明中,对于前述乳酸菌具有前述邻苯三酚产生活性而言,例如可以通过由下述的茶提取物(底物)产生邻苯三酚来确认,作为此时的邻苯三酚的产生量,例如,将前述茶提取物制成阿波晚茶的茶叶(5片量)的热水提取物 (100℃、3分钟)的总量4ml与前述热水提取后的茶叶片(5片量)的粉碎物的混合物,相对于该总量将乳酸菌(活菌)数设为1
×
106~
×1×
10
10
cfu/ml,30℃下在厌氧条件下使其发酵时的邻苯三酚的产生量优选为0.01μg/ml以上,更优选为0.01~200μg/ml,进一步优选为0.01~100μg/ml,进而更优选为 0.01~50μg/ml。
[0102]
作为这样的具有邻苯三酚产生活性的乳酸菌,例如可列举出日本特开 2016
‑
167984号公报(专利文献2)中记载的表1中邻苯三酚的产生量为1μg/ml 以上的乳酸菌。作为前述具有邻苯三酚产生活性的乳酸菌,更具体而言,例如,作为戊糖乳杆菌,可列举出oll203969株(保藏编号:nite bp
‑
01986)、 oll203982株(保藏编号:nite bp
‑
01987)、oll203984株(保藏编号:nitebp
‑
01988)。另外,这些各菌株只要具有邻苯三酚产生活性,就也包括前述各菌株的传代菌株、育种菌株、人工突变菌株、自然突变菌株和基因重组菌株。
[0103]
作为本发明的乳酸菌,可以单独使用1种或组合使用2种以上,但从使茶发酵物和茶发酵组合物的风味趋于变得更良好的观点出发,更优选为戊糖乳杆菌,更优选为选自由oll203969株、oll203982株和oll203984株组成的组中的至少一种,进一步优选为oll203984株。
[0104]
作为本发明的乳酸菌的培养方法,没有特别限制,可以根据前述乳酸菌的种类,利用适宜公知的方法或利用依据其的方法进行培养而调整至期望的菌数。
[0105]
〔茶提取物〕
[0106]
本发明中,茶提取物是指由茶提取出的混合物,更具体而言,是指用提取溶剂从茶
(例如,山茶(camellia siensis var.sinensis)、普洱茶(camellia siensisvar.assamica)、薮北(yabukita)种等山茶属(camellia))的叶子和/或茎等中提取而得到的混合物,也可以混合了前述茶的叶子和/或茎等。前述茶的叶子和茎中除了生叶和茎之外,包括:煎茶、粗绿茶、玉露、碾茶等绿茶;被称为乌龙茶的半发酵茶;被称为红茶的发酵茶等制茶,作为前述茶的叶子和茎,也可以是这些当中的单独1种或2种以上的组合。另外,作为前述提取溶剂,可列举出水(包括温水和热水)、有机溶剂(例如,乙醇等水性有机溶剂)等,也可以是这些当中的单独1种或2种以上的组合。前述提取的方法和条件可以根据所使用的茶的种类、前述提取溶剂的种类等进行适宜确定。
[0107]
作为本发明的茶提取物,可以是利用适宜公知的方法或依据其的方法将前述混合物干燥、浓缩/纯化而成者,另外,作为茶提取物或茶饮料,也可以适宜使用市售的商品。
[0108]
作为本发明的茶提取物,优选含有儿茶素类,更优选含有没食子酸酯型儿茶素。本发明中,儿茶素类是指:表没食子儿茶素(egc)、表儿茶素(ec)、儿茶素(c)、没食子酰儿茶素(gc)、表没食子儿茶素没食子酸酯(egcg)、表儿茶素没食子酸酯(ecg)、儿茶素没食子酸酯(cg)、和没食子酰儿茶素没食子酸酯(gcg),也可以是这些当中的单独1种或2种以上的混合物。另外,本发明中,没食子酸酯型儿茶素是具有没食子酰基的儿茶素类,可列举出表没食子儿茶素没食子酸酯(egcg)、表儿茶素没食子酸酯(ecg)、儿茶素没食子酸酯(cg)、和没食子酰儿茶素没食子酸酯(gcg),也可以是这些当中的单独1种或2种以上的组合。
[0109]
作为本发明的茶提取物中的前述儿茶素类的含量,没有特别限制,以相对于茶提取物总量的体积的儿茶素类的含量(前述儿茶素类为2种以上的混合物时它们的总计、以下相同)计优选为0.01~1.0w/v%,更优选为 0.02~0.2w/v%。另外,作为本发明的茶提取物中的前述没食子酸酯型儿茶素的含量,以相对于茶提取物总量的体积的没食子酸酯型儿茶素的含量(前述没食子酸酯型儿茶素为2种以上的混合物时它们的总计、以下相同)计优选为 0.005~0.5w/v%,更优选为0.01~0.1w/v%。需要说明的是,本发明中,“w/v%”是指相对于总体积100ml的质量(g)的比例。
[0110]
作为本发明的茶提取物,在不损害本发明的效果的范围内,除了前述儿茶素类之外还可以进一步含有茶来源的其它成分,作为前述其它成分,例如可列举出糖类、糖醇类、矿物质类、维生素类、蛋白质、肽、氨基酸类、有机酸,可以含有这些当中的单独1种或组合2种以上而含有。
[0111]
(茶发酵物的制造方法)
[0112]
本发明的茶发酵物可以通过使前述乳酸菌与前述茶提取物接触并发酵而得到,更具体而言,可以通过包含如下工序的方法得到:制备含有前述茶提取物和前述乳酸菌的发酵混合物的工序(制备工序);以及,在前述发酵混合物中使前述茶提取物通过前述乳酸菌发酵而得到茶发酵物的工序(发酵工序)。
[0113]
作为前述发酵混合物,优选为水溶液。作为前述水溶液的溶剂,可列举出水、磷酸缓冲液、生理盐水、液体培养基、通常提取的茶等,也可以是这些当中的单独1种或2种以上的组合。这些当中,从能够将发酵后的发酵混合物(茶发酵物)直接制成本发明的茶发酵组合物的观点出发,优选为水或通常提取的茶。
[0114]
作为前述发酵混合物中含有的前述茶提取物的方式,可以是干燥粉末等固体;浓缩物、稀释物等的水溶液(包括通常提取的茶);浆料状中任意的形态。
[0115]
作为前述发酵混合物中的茶提取物的浓度,没有特别限制,例如,相对于发酵混合物总量的体积,前述儿茶素类的含量优选成为0.01~1.0w/v%的浓度,更优选成为0.02~0.4w/v%的浓度,进一步优选成为0.02~0.2w/v%的浓度。进而更优选地,相对于发酵混合物总量的体积,前述没食子酸酯型儿茶素的含量优选成为0.005~0.5w/v%的浓度,更优选成为0.01~0.2w/v%的浓度,进一步优选成为0.01~0.1w/v%的浓度。前述茶提取物的浓度低于前述下限时,底物量变少,有变得无法充分获得本发明的茶发酵物的倾向,另一方面,超过前述上限时,邻苯三酚产生活性降低而变得难以有效地得到邻苯三酚,有由得到的茶发酵物带来的肠道调节效果降低的倾向。需要说明的是,本发明中,前述发酵混合物的溶剂中包含上述的通常提取的茶时,前述茶提取物的浓度(儿茶素类的含量)中也包括源自上述茶的儿茶素类的含量。
[0116]
作为前述发酵混合物中含有的前述乳酸菌,也可以是含有该乳酸菌的乳酸菌组合物的形态。本发明中,前述乳酸菌组合物中含有:包含乳酸菌的培养结束后的培养基成分的培养物;前述培养物的浓缩物、稀释物、干燥物、冷冻物等,也可以是这些当中的单独1种或2种以上的组合。这些当中,作为前述乳酸菌,优选前述乳酸菌组合物的形态、更优选以培养物或培养物的浓缩物的形态含有在前述发酵混合物中。另外,作为在前述发酵混合物中所含有的前述乳酸菌,也可以使用利用适宜公知的方法进行了活化培养的乳酸菌或乳酸菌组合物。
[0117]
作为前述发酵混合物中的前述乳酸菌的浓度,没有特别限制,相对于发酵混合物总量的体积,以乳酸菌(活菌)数换算计优选为1
×
106~1
×
10
10
cfu/ml,更优选为1
×
107~1
×
109cfu/ml。前述乳酸菌的浓度低于前述下限时,发酵无法充分地进行,有变得无法充分获得本发明的茶发酵物的倾向,另一方面,超过前述上限时,邻苯三酚产生活性降低而变得难以有效地得到邻苯三酚,有由得到的茶发酵物带来的肠道调节效果降低的倾向。
[0118]
另外,作为前述发酵混合物的ph,可以根据前述乳酸菌的生长条件、前述发酵混合物的量等进行适宜选择,例如,优选为ph4.8~8.3,更优选为 ph5.3~7.8。前述ph的范围不在前述范围内时,发酵无法充分地进行,有变得无法充分获得本发明的茶发酵物的倾向。
[0119]
作为前述发酵混合物,在不损害本发明的效果的范围内,除了前述茶提取物、前述乳酸菌和前述溶剂之外,可以进一步含有其它成分,作为前述其它成分,例如可列举出前述乳酸菌组合物中含有的成分、碳酸盐、糖类、糖醇类、矿物质类、维生素类、蛋白质、肽、氨基酸类、有机酸、ph调节剂,可以含有这些当中的单独1种或组合2种以上。
[0120]
前述发酵工序中,作为发酵的方法,可以根据前述乳酸菌的生长条件、前述发酵混合物的量等进行适宜选择,没有特别限制,例如,温度25~40℃、更优选为30~37℃下、优选在好氧条件下将前述发酵混合物静置或搅拌(优选为静置)12~72小时、更优选为18~48小时。另外,也可以代替好氧条件而采用在氮气通气条件下的发酵。
[0121]
作为前述发酵后的发酵混合物,可以得到作为本发明的茶发酵组合物的有效成分的茶发酵物。另外,也可以对前述发酵后的发酵混合物进一步实施乳酸菌的破碎和/或加热处理。因此,作为本发明的茶发酵物,优选含有前述乳酸菌(活菌和/或死菌)、及含有选自由该处理物(前述乳酸菌的破碎处理物和 /或加热处理物)组成的组中的至少一种。本发明的茶发酵物中,作为前述乳酸菌和/或其处理物的含量,以活菌数换算计优选为1
×
106~1
×
10
10
cfu/ml,更优选为1
×
107~1
×
109cfu/ml,进一步优选为1
×
108~1
×
109cfu/ml。前述乳
酸菌和/或其处理物的含量低于前述下限时,有由茶发酵物带来的肠道调节效果降低的倾向,另一方面,超过前述上限时,有风味降低的倾向。
[0122]
作为本发明的茶发酵物,从肠道调节效果更优异的观点出发,优选含有邻苯三酚。本发明的茶发酵物中,作为前述邻苯三酚的含量,优选为 0.01~200μg/ml,更优选为0.01~100μg/ml,进一步优选为0.01~55μg/ml,进而更优选为0.01~50μg/ml。前述邻苯三酚的含量低于前述下限时,有由茶发酵物带来的肠道调节效果降低的倾向。
[0123]
另外,本发明的茶发酵物中,作为前述邻苯三酚的含量,从同样的观点出发,相对于茶发酵物中根据需要含有的邻苯三酚、没食子酸、和儿茶素类的总计含量,优选为0.001~15质量%,更优选为0.001~10质量%。
[0124]
作为本发明的茶发酵物,从肠道调节效果更优异的观点出发,优选含有没食子酸。本发明的茶发酵物中,作为前述没食子酸的含量,优选为 5~60μg/ml,更优选为10~50μg/ml,进一步优选为15~45μg/ml。前述没食子酸的含量低于前述下限时,有由茶发酵物带来的肠道调节效果降低的倾向。
[0125]
另外,本发明的茶发酵物中,作为前述没食子酸的含量,从同样的观点出发,相对于茶发酵物中根据需要含有的邻苯三酚、没食子酸、和儿茶素类的总计含量,优选为1~10质量%,更优选为3~8质量%。
[0126]
作为本发明的茶发酵物,从肠道调节效果更优异的观点出发,优选含有前述儿茶素类中的至少一种。本发明的茶发酵物中,作为前述儿茶素类的含量,优选为100~10000μg/ml,更优选为200~2000μg/ml。前述儿茶素类的含量低于前述下限时,有由茶发酵物带来的肠道调节效果降低的倾向,另一方面,超过前述上限时,有产生苦味而影响茶发酵组合物的风味的担心。
[0127]
另外,本发明的茶发酵物中,作为前述儿茶素类的含量,从同样的观点出发,相对于茶发酵物中根据需要含有的邻苯三酚、没食子酸、和儿茶素类的总计含量,优选为70~98质量%(更优选为75~98质量%),更优选为80~96质量%(更优选为82~96质量%)。
[0128]
进而,作为本发明的茶发酵物,从肠道调节效果更优异的观点出发,优选前述儿茶素类中的前述没食子酸酯型儿茶素与除此以外的儿茶素获得了平衡,全部儿茶素类中的前述没食子酸酯型儿茶素的含量优选为5~35质量%,更优选为10~30质量%。前述没食子酸酯型儿茶素的含量在前述范围内时,有通过茶发酵物发挥更优异的肠道调节效果的倾向。
[0129]
作为本发明的茶发酵物,除了上述以外,也可以进一步含有前述发酵混合物、和源自其的其它成分。作为前述其它成分,例如可列举出糖类、糖醇类、矿物质类、维生素类、蛋白质、肽、氨基酸类、有机酸,可以含有这些当中的单独1种或组合2种以上而含有。
[0130]
(茶发酵组合物)
[0131]
本发明的茶发酵组合物含有前述茶发酵物,可以使用前述茶发酵物而得到。该茶发酵组合物可以仅由前述茶发酵物构成,也可以将前述茶发酵物进行浓缩、干燥或冷冻等而得到。另外,作为本发明的茶发酵组合物,在不损害本发明的效果的范围内,也可以进一步含有除前述茶发酵物以外的成分。此时的茶发酵物的含量没有特别限定,可根据下述的组合物的形态、给予组合物的目的、对象、方法、用量等进行适宜调整。
[0132]
本发明的茶发酵组合物通过含有上述的本发明的茶发酵物作为有效成分而能够用于肠道调节。更具体而言,优选用作:用于调节肠道菌群的组合物(用于调节肠道菌群的
组合物)、用于缩短消化道通过时间的组合物(用于缩短消化道通过时间的组合物)、用于减少inos基因在肠中的表达量的组合物 (用于减少inos基因表达量的组合物),另外,可以用作发挥调节肠道菌群、缩短消化道通过时间、和减少inos基因表达量中的至少一种作用的用于预防或改善便秘的组合物。因此,本发明也提供前述茶发酵物在用于制造这些组合物(肠道调节用茶发酵组合物、用于调节肠道菌群的组合物、用于缩短消化道通过时间的组合物、用于减少inos基因表达量的组合物、用于预防或改善便秘的组合物)中的应用。
[0133]
进而,本发明的茶发酵组合物可以用于如下方法:人或非人动物的肠道调节方法;肠道菌群调节方法;缩短消化道通过时间的方法;减少inos基因在肠中的表达量的方法;便秘的预防方法或改善方法,本发明也提供这些方法。这些方法包括向对象(人或非人动物、优选为哺乳动物)给予本发明的茶发酵组合物的有效量的工序,更优选包括向作为便秘的对象给予本发明的茶发酵组合物的有效量的工序。
[0134]
本发明中,前述调节肠道菌群是指改变肠道的菌群,优选指改变为能改善便秘的菌群。作为这样的变化,更具体而言,例如可列举出:以茶发酵组合物给予前作为基准,选自由肠道中的乳杆菌目(lactobacillales)和双歧杆菌目(bifidobacteriales)组成的组中的至少一种、更优选乳杆菌目的占有率的增加;选自由肠道中的梭菌目(clostridiales)和拟杆菌目(bacteroidales)组成的组中的至少一种菌数的减少;肠道中的细菌的种类数量的减少;肠道中的细菌的shannon
‑
winner的多样性指数(h’)的减少;肠道中的对甲酚浓度和/或甲基吲哚浓度的减少等。
[0135]
另外,本发明中,消化道通过时间是指消化道内容物通过消化道(口~肛门)的时间,前述消化道通过时间的缩短可以通过如下方式确认,例如,以代替组合物而给予了水的情况(水组)作为基准,能够确认消化道通过时间变短。另外,也可以通过以前述水组作为基准、inos基因在肠中的表达量减少来确认。
[0136]
本发明的茶发酵组合物可以以经口或经肠方式向人或非人动物(优选为哺乳动物)给予。需要说明的是,本发明中,经口给予包括饮食品组合物、饲料组合物的摄取。根据给予组合物的目的、对象、方法、用量等,可以将本发明的茶发酵组合物制成例如药物组合物、准药物组合物、饮食品组合物、饲料组合物等。
[0137]
作为本发明的药物组合物和准药物组合物,例如可以制成制剂,其形态没有特别限定,例如可列举出片剂、丸剂、颗粒剂、散剂、粉末剂、胶囊剂等固体制剂;普通液体制剂、悬浮剂、乳剂、糖浆剂等液体制剂;啫喱剂;经肠给予剂;栓剂。对于前述制剂,例如可以在上述的本发明的茶发酵物或其浓缩物、干燥物、或冷冻物中加入溶剂、分散剂、乳化剂、增稠剂、凝胶化剂、表面活性剂、缓冲剂、稳定剂、防腐剂、赋形剂、结合剂、崩解剂、助溶剂、润滑剂、着色剂、矫味剂、甜味剂、涂层剂、香料这样的辅助制剂中的1种或2种以上,根据公知的方法或依据其的方法进行制造。
[0138]
另外,作为前述药物组合物和准药物组合物,在不损害本发明的效果的范围内,分别进一步含有适当量的水、脂质、糖质、蛋白质、糖醇类、矿物质类(钙、镁、钠、钾、铁、铜、锌等)、维生素类(维生素a、b1、b2、b6、 b12、c、d、e、k等)、肽、氨基酸类、有机酸、ph调节剂这样的添加剂中的单独1种或组合2种以上。
[0139]
作为本发明的饮食品组合物的方式,没有特别限定,例如可列举出如条形那样的固体形状、饮料、流质食品那样的液态、糊剂状、半液体状、凝胶状(啫喱状)、凝胶状油脂(半
固体形状油脂)、粉末状的形态。另外,作为前述饮食品组合物,也可以以流质食品、粉末流质食品、营养糊剂、经口/经管营养剂、饮料、凝胶状食品等的形态,用于经口/经肠营养患者、高龄者、婴幼儿等营养管理。
[0140]
作为本发明的饮食品组合物的例子,没有特别限制,例如可列举出饮料 (茶类、碳酸饮料、可可、咖啡、乳酸菌饮料、豆乳饮料、果汁/蔬菜汁饮料、清凉饮料、营养饮料、酒精饮料等)、加工食品(巧克力、口香糖、软糖、果冻、烘焙食品(面包、蛋糕、点心、饼干等)、糖果等)、乳制品(配方奶粉(粉末状奶)、配方奶、乳饮料、发酵乳、酸奶、冰激凌、奶酪、奶油、黄油、人造黄油、炼乳等)、调味剂(沙司、汤、沙拉酱、蛋黄酱、蛋黄酱类型调味剂、奶油等)、营养强化剂、食用油、功能性食用油脂等。这样的饮食品组合物例如可以通过在现有的饮食品或其制造过程中配混上述的本发明的茶发酵物;其浓缩物、干燥物、或冷冻物;或前述制剂的方法等而制造。
[0141]
作为本发明的饮食品组合物,在不损害本发明的效果的范围内,此外还可以进一步含有能够在饮食品中含有的各种成分。作为这样的成分,没有特别限制,例如可以含有适当量的前述药物组合物和准药物组合物中列举的辅助制剂和添加剂、食物纤维(难消化性糊精等)、果实/蔬菜及其加工品、动物和植物生药提取物、天然来源高分子(胶原蛋白、透明质酸、软骨素等)中的单独1种或组合2种以上。
[0142]
另外,作为本发明的饮食品组合物,例如可以制成普通食品、健康食品、功能性食品、保健功能食品(例如,特定保健用食品、营养功能食品、营养辅助食品、功能性标示食品等)、特别用途食品(例如,幼儿用食品、孕产妇用食品、患者用食品等)、医药食品(美国食品药品监督管理局(fda)和根据罕见病药物法所定义的在医生的管理中被处方的食品)、治疗食品(为发挥治疗目的的食品,基于医生开的膳食营养士等制作的菜单而烹调出的食品)、饮食疗法食品,前述饮食品组合物中,在其制品中可以标示通过本发明的茶发酵物而带来的进一步的作用/功效(例如,调节肠道、缩短消化道通过时间、调节肠道菌群、减少inos基因表达量、预防或改善便秘等)。
[0143]
作为本发明的饲料组合物,可列举出根据施予饲料组合物的目的、对象、方法、用量等将上述饮食品组合物适宜改变而成者。
[0144]
另外,考虑到对象的种类、年龄、体重、性别、疾病的差异、症状的程度等,本发明的茶发酵组合物给予量可以根据各自的情况进行适宜确定。例如,作为对于人(成人)的给予量,以没食子酸量计优选为1~100mg,更优选为2~50mg,进一步优选为2~10mg。
[0145]
对于本发明的茶发酵组合物,优选在制造后直至给予前的期间被包装 (优选为封入)到包装容器内。作为前述包装容器,没有特别限制,例如可列举出包装纸、包装袋、软袋、管、铝箔包装、纸容器、罐、瓶、胶囊等。
[0146]
实施例
[0147]
以下,基于实施例和比较例对本发明进行更具体地说明,但本发明不限定于以下的实施例。需要说明的是,以下,“%”的表示只要没有特别声明则表示质量/体积(w/v)百分比(g/100ml)。
[0148]
<乳酸菌>
[0149]
以下的各制备例中,作为乳酸菌1,使用下述的乳酸菌株:
[0150]
乳酸菌1:戊糖乳杆菌(l.pentosus)oll203984株(保藏编号:nitebp
‑
01988)。
[0151]
乳酸菌1是本发明的申请人分离出的菌株,具有上述的邻苯三酚产生活性。
[0152]
(实施例1)
[0153]
<茶发酵组合物的制备>
[0154]
在mrs培养基中,以37℃、厌氧条件、18小时将乳酸菌1活化培养2次,然后以前述活化培养液为1%(体积%)的方式接种在mrs培养基中,在37℃、厌氧条件下培养18小时。将培养液以5000rpm、4℃进行15分钟离心,用生理盐水清洗1次后,将培养液以5000rpm、4℃再次进行15分钟离心分离,悬浮在与沉淀物(培养物)等量的茶提取物中,将其用作乳酸菌组合物 1(1.9
×
10
11
cfu/ml)。作为茶提取物,使用株式会社明治制的“明治深蒸静冈茶”。以成为10%(体积%、以乳酸菌数换算计2
×
108cfu/ml)的方式将乳酸菌组合物1接种在前述茶提取物中,在30℃、好氧条件下培养48小时。培养48小时后的培养液的ph为4.7。将该培养后的培养液以122℃加热10分钟进行杀菌,得到茶发酵组合物(乳酸菌发酵茶)。
[0155]
<邻苯三酚、没食子酸、和儿茶素类的浓度测定>
[0156]
将得到的茶发酵组合物以13000rpm、4℃进行3分钟离心,用超纯水将上清液稀释2倍。将稀释后的上清液放入过滤瓶(thomson公司制)中,通过hplc,测定了邻苯三酚(pg)、没食子酸(ga)、表没食子儿茶素(egc)、表没食子儿茶素没食子酸酯(egcg)、表儿茶素(ec)、表儿茶素没食子酸酯(ecg)、没食子酰儿茶素(gc)、没食子酰儿茶素没食子酸酯(gcg)、儿茶素(c)、和儿茶素没食子酸酯(cg)的各浓度。以下示出hplc的分析条件。另外,将结果示于下述的表1。表1所述的各值用小数点以下的位数0位表示。茶发酵组合物(实施例1)中,表示乳酸、乙酸、pg、ga、egc、egcg、ec、ecg、gc、gcg、 c、cg和总计的小数点以下位数4位的各值分别依次为3.1925、0.9990、44.2850、 39.0000、147.3700、37.4500、37.0475、10.4550、261.3925、34.4150、54.2025、 2.8775和585.2100(下述的表5中相同)。
[0157]
〔hplc的分析条件〕
[0158]
·
柱:cosmosil cholester
[0159]
·
柱尺寸:4.6mm i.d.
×
150mm
[0160]
·
流动相:
[0161]
a)乙腈/20mm磷酸缓冲液(ph2.5)=10/90
[0162]
b)乙腈/20mm磷酸缓冲液(ph2.5)=30/70
[0163]
b:0%(0分钟)
→
100%(20分钟)
→
0%(21分钟)
[0164]
·
流速:1ml/分钟
[0165]
·
温度:30℃
[0166]
·
检测器:uv
‑
vis检测器spd
‑
20av(株式会社岛津制作所制)
[0167]
·
检测波长:200nm(除ga以外)、280nm(ga)
[0168]
·
注入量:10μl。
[0169]
<乳酸、乙酸的浓度测定>
[0170]
将得到的茶发酵组合物以13000rpm、4℃进行10分钟离心,将上清液放入过滤瓶(thomson公司制)中,通过hplc测定了乳酸、乙酸的各浓度。以下示出hplc的分析条件。另外,将结果示于下述的表1。
[0171]
〔hplc的分析条件〕
[0172]
·
柱:icsep ice orh
‑
801(transgenomic公司制)
[0173]
·
柱尺寸:6.5mm i.d.
×
300mm
[0174]
·
流动相:7.5mm对甲苯磺酸
[0175]
·
反应液:7.5mm对甲苯磺酸 150μm edta(2na) 30mm bis tris
[0176]
·
流速:0.5ml/分钟
[0177]
·
温度:55℃
[0178]
·
检测器:cdd
‑
10a(株式会社岛津制作所制)
[0179]
·
注入量:10μl。
[0180]
[表1]
[0181][0182]
<肠道调节效果的确认>
[0183]
喂养/繁殖ncxko小鼠(ncx/hox11l.1基因敲除小鼠、从国立大学法人千叶大学获得),确保了周龄相近的雄性14只ncxko小鼠。作为饲料使用clea rodent diet ce
‑
2(固体、clea japan,inc.制)。在各小鼠达到9~10周龄的时间点,以体重没有偏差的方式每7只分成以下的2组:
[0184]
1组:水组(对照)
[0185]
2组:茶发酵组合物组。
[0186]
需要说明的是,喂养方式是单只饲养。在分组后(给予前)采集各小鼠的粪便,然后,对1组的小鼠给予水,对2组的小鼠给予上述中得到的茶发酵组合物,分别以自由饮水给予4周。另外,在各笼子中设置饲料,采取自由摄取。每周进行3次更换为新的饲料和各给予物(水或茶发酵组合物),从给予开始每周测定一次体重,采集了从给予开始至喂养4周后的粪便。
[0187]
1.消化道通过时间测定
[0188]
从开始给予各给予物至喂养4周后,将各小鼠移至钢丝网笼子中,经口给予悬浮于1%阿拉伯胶溶液中的50%硫酸钡300μl。然后,在钢丝网笼子中设置对各组的小鼠的给予物和饲料,均采用自由摄取。给予硫酸钡后,采集 /观察所排出的粪便,确认了是否被硫酸钡着色。测定给予硫酸钡后直至观察到最初着色的粪便所需的时间,将该值作为消化道通过时间。另外,在给予硫酸钡的第二天采集了各小鼠的结肠和盲肠内容物。
[0189]
将从给予水或茶发酵组合物开始至4周的各组中的小鼠的平均体重、和4 周后的各组中的平均消化道通过时间分别示于图1和图2。如图1所示,在实验期间,小鼠的体重未观察到组间差异,但如图2所示,消化道通过时间与水组相比,茶发酵组合物组显著缩短(水组中的时间与茶发酵组合物组中的时间之间的基于student t检验的p值:p<0.05),确认了本发明的茶发酵组合物对于缩短消化道通过时间是有效的。
[0190]
2.肠道菌群解析
‑
1(基于实时pcr的解析)
[0191]
从在给予水或茶发酵组合物前和给予4周后所采集的各粪便20mg中,使用qiaamp dna stool mini kit(qiagen公司制)和qiacube(qiagen公司制) 提取dna,溶解于200μl的水中。将提取的dna作为模板dna,通过以细菌群的16s rrna基因为靶向的q
‑
pcr对粪便中的
菌群进行了解析。作为解析对象的细菌群是构成肠道菌群的主要细菌群(1)拟球梭菌亚群(clostridiumcoccoides group)、(2)柔嫩梭菌亚群(clostridium leptum subgroup)、和(3)脆弱拟杆菌亚群(bacteroides fragilis group)。以下示出各细菌群的pcr反应条件。
[0192]
〔pcr条件〕
[0193]
(1)拟球梭菌亚群
[0194]
·
引物f(g
‑
ccoc
‑
f):5
’‑
aaatgacggtacctgactaa
‑3’
(序列号:1)
[0195]
·
引物r(g
‑
ccoc
‑
r):5
’‑
ctttgagtttcattcttgcgaa
‑3’
(序列号:2)
[0196]
·
dna定量标准:ob7133(梭状梭菌(clostridium clostridiiforme) jcm1291)
[0197]
·
模板dna浓度:100倍稀释
[0198]
·
pcr装置:quantstudio 3实时pcr系统(applied biosystems公司制)
[0199]
·
pcr反应液组成:
[0200]
powerup sybr green mater mix(abi公司制):100μl
[0201]
引物f(100pmol/μl):0.18μl
[0202]
引物r(100pmol/μl):0.18μl
[0203]
模板dna:4μl
[0204]
h2o:5.64μl
[0205]
总计:20μl
[0206]
·
pcr反应条件:
[0207]
50℃
‑
2分钟
[0208]
95℃
‑
2分钟
[0209]
95℃
‑
15秒/60℃
‑
1分钟:45次循环
[0210]
熔解曲线分析(解离阶段(dissociation stage))
[0211]
(2)柔嫩梭菌亚群
[0212]
·
引物f(sg
‑
clept
‑
f):5
’‑
gcacaagcagtggagt
‑3’
(序列号:3)
[0213]
·
引物r(sg
‑
clept
‑
r):5
’‑
cttcctccgttttgtcaa
‑3’
(序列号:4)
[0214]
·
dna定量标准:ob7163(球孢梭菌(clostridium sporosphaeroides) ncimb 10672)
[0215]
·
模板dna浓度:100倍稀释
[0216]
·
pcr装置、pcr反应液组成和反应条件:与(1)相同
[0217]
(3)脆弱拟杆菌亚群
[0218]
·
引物f(g
‑
bact
‑
f):5
’‑
atagcctttcgaaagaagat
‑3’
(序列号:5)
[0219]
·
引物r(g
‑
bact
‑
r):5
’‑
ccagtatcaactgcaatttta
‑3’
(序列号:6)
[0220]
·
dna定量标准:olb7086(普通拟杆菌(bacteroides vulgatus)jcm 5826)
[0221]
·
模板dna浓度:100倍稀释
[0222]
·
pcr装置:abi prism 7000sequence detection system
[0223]
·
pcr反应液组成:
[0224]2×
sybr green pcr master mix(qiagen公司制):12.5μl
[0225]
引物f(100pmol/λ):0.225μl
[0226]
引物r(100pmol/λ):0.225μl
[0227]
50mm mgcl2:0.75μl
[0228]
h2o:6.3μl
[0229]
模板dna:5μl
[0230]
总计:25μl
[0231]
·
pcr反应条件:
[0232]
95℃
‑
15分钟
[0233]
94℃
‑
15秒/50℃
‑
30秒/72℃
‑
30秒:45次循环
[0234]
熔解曲线分析(解离阶段(dissociation stage))。
[0235]
基于水或茶发酵组合物给予前和给予后(给予4周后)的每1g各粪便中的向拷贝数的换算,求出每1g各粪便中的各细菌群的菌数(log
10
细胞数/g粪便)。另外,各组中,通过用检测了各细菌群的个体数量除以总体数,从而求出各细菌群的检测率(%)。将得到的结果示于下述的表2。表2中,各菌数的值用各组的小鼠中的平均值(m)及其标准误差(se)(m
±
se)表示,基于各给予前的值和给予后的值之间的wilcoxon的符号秩检验(wilcoxon signed rank test)的p 值低于0.05(p<0.05),即在确认到给予前与给予后之间的显著差异时标注星号 (*)(下述的表6中相同)。
[0236]
[表2]
[0237][0238]
结果表示为七只小鼠的平均值
±
标准误差。
[0239]
*:给予前与给予后,p<0.05(wilcoxon符号秩检验)
[0240]
如表2所示,水组中,在给予前与给予后之间各细菌群的菌数没有显著的变化。相对于此,确认了:茶发酵组合物组中,拟球梭菌亚群、柔嫩梭菌亚群、和脆弱拟杆菌亚群的菌数均显著减少。
[0241]
3.肠道菌群解析
‑
2(基于下一代测序的解析)
[0242]
(1)16s rdna v4区域的扩增
[0243]
首先,使用上述2(基于实时pcr的解析)中从各粪便中提取的dna,将其作为模板dna,扩增了16s rdna v4区域。以下示出pcr反应条件。对于引物,制作caporaso jg等,2012,isme j.,6(8),p.1621
‑
1624中记载的515f(正向引物、序列号:7)pcr引物和806rcbc1~806rcbc28(反向引物、序列号: 8~35)pcr引物而使用。
[0244]
〔pcr条件〕
[0245]
·
引物f(515f):序列号:7中记载的序列
[0246]
·
引物r(806rcbc1~806rcbc28):分别为序列号:8~35中记载的序列
[0247]
·
pcr装置:veriti thermal cycler(applied biosystems公司制)
[0248]
·
pcr反应液组成:
[0249]
takara ex taq(rr001、takara bio inc.制):0.125μl
[0250]
10
×
extaq缓冲液:2.5μl
[0251]
引物f(10μm):0.5μl
[0252]
引物r(5μm):1μl
[0253]
dntp:2μl
[0254]
dh2o:17.825μl
[0255]
模板dna:1μl
[0256]
总计:25μl
[0257]
·
pcr反应条件:
[0258]
94℃
‑
3分钟
[0259]
94℃
‑
45秒/50℃
‑
60秒/72℃
‑
90秒:25次循环
[0260]
72℃
‑
10分钟
[0261]
4℃
‑
∞。
[0262]
(2)pcr产物的纯化
[0263]
接着,使用qiaquick pcr purification kit(qiagen公司制)将上述(1)中得到的各pcr产物纯化。纯化的步骤依据qiagen的方案。
[0264]
(3)pcr产物的定量和浓度调整
[0265]
用0.1%tween20将上述(2)中得到的纯化后的各pcr产物稀释10000倍,将其作为模板dna,在下述所示的条件下进行实时pcr。作为dna定量标准,使用illumina library quantification dna standards 1
‑
6(kapa biosystems公司制)。接着,以基于实时pcr的定量结果为基础,用qiaamp dna stool minikit(qiagen公司制)随附的eb缓冲液将各实时pcr产物稀释至1000ng/ml。
[0266]
〔pcr条件〕
[0267]
·
引物1.1:5
’‑
aatgatacggcgaccaccgagat
‑3’
(序列号:36)
[0268]
·
引物2.1:5
’‑
caagcagaagacggcatacga
‑3’
(序列号:37)
[0269]
·
pcr装置:quantstudio 3实时pcr系统(applied biosystems公司制)
[0270]
·
pcr反应液组成:
[0271]2×
sybr green pcr master mix(qiagen公司制):12.5μl
[0272]
引物1.1:0.3μl
[0273]
引物2.1:0.3μl
[0274]
dh2o:7μl
[0275]
模板dna:5μl
[0276]
总计:25.1μl
[0277]
·
pcr反应条件:
[0278]
95℃
‑
15分钟
[0279]
94℃
‑
15秒/60℃
‑
40秒/72℃
‑
40秒:45次循环72℃
‑
10分钟
[0280]
4℃
‑
∞。
[0281]
(4)pcr产物的尺寸的确认
[0282]
使用dna/rna分析用微芯片电泳装置(multina、株式会社岛津制作所制),将在上述(3)中稀释至1000ng/ml的各实时pcr产物电泳,确认具有目标条带。步骤依据株式会社岛
津制作所的方案。
[0283]
(5)dna测序解析
[0284]
将上述(3)中稀释至1000ng/ml(4nm)的各实时pcr产物各混合5μl,制成 4nm文库。将4nm文库5μl与0.2n naoh 5μl混合,在室温下静置5分钟而使文库改性。在其中加入冰冷的ht1缓冲液(illumina公司制)990μl,制成20pm 的改性文库。另外,将10nm phix sequencing control v3(phix;illumina公司制)2μl与eb缓冲液3μl混合,制成4nm phix。将4nm phix 5μl与0.2n naoh5μl混合,在室温下静置5分钟而使phix改性。加入冰冷的ht1缓冲液(illumina 公司制)990μl,制成20pm的改性phix。
[0285]
接着,将前述改性文库200μl、前述改性phix 150μl和冰冷的ht1缓冲液(illumina公司制)250μl混合,制成最终文库。使用最终文库实施了用 miseq(illumina公司制)进行的dna测序解析。用miseq进行的dna测序解析所需的样品表的制作方法、装置的使用方法依据miseq随附的手册。
[0286]
(6)数据解析
[0287]
用解析软件“bits(bits株式会社制)”对上述(5)中得到的数据进行解析,计算出各粪便中的各细菌群相对于全部细菌群的占有率。数据解析的方法依据bits随附的手册。需要说明的是,检测出的各细菌群中,排除全部粪便中的读取数的最大值相对于细菌域的总读取数低于1%(读取数%)时的菌群。将水或茶发酵组合物给予前和给予后(给予4周后)的各粪便中的乳杆菌目 (lactobacillales)的读取数相对于总读取数的比例(占有率、读取数%)示于下述的表3。表3中,各值用各组的小鼠中的平均值(m)及其标准误差(se)(m
±ꢀ
se)表示,各给予前的值与给予后的值之间的基于wilcoxon的符号秩检验的p 值低于0.05(p<0.05),即在确认到给予前与给予后之间具有显著差异时标注星号(*)(下述的表7中相同)。
[0288]
[表3]
[0289][0290]
结果表示为七只小鼠的平均值
±
标准误差。
[0291]
*:给予前与给予后,p<0.05(wilcoxon符号秩检验)
[0292]
如表3所示,水组中,在给予前与给予后之间乳杆菌目的占有率没有显著变化。相对于此,确认了:茶发酵组合物组中,在给予前与给予后之间乳杆菌目的占有率显著增加。需要说明的是,与上述不同地,使用了含有2倍量的乳酸菌1的茶发酵组合物,除此以外进行同样的试验,结果:在与给予含有1倍量的乳酸菌1的茶发酵组合物之间未观察到乳杆菌目的占有率存在显著差异,由此启示出:上述的乳杆菌目的占有率的增加不是检测出本发明的茶发酵组合物中含有的乳酸菌的dna本身的结果,而是通过给予本发明的茶发酵组合物使肠道菌群朝着改善便秘的方向发生变化的结果。
[0293]
另外,用解析软件“bits(bits株式会社制)”对上述(5)中得到的数据进行解析,解析了水或茶发酵组合物给予前和给予后(给予4周后)的各粪便中的细菌群的α多样性。数据
解析的方法依据bits随附的手册。将各粪便中的细菌的种类数量和shannon
‑
winner的多样性指数(h’,shannon diversity index) 示于下述的表4。另外,将由水或茶发酵组合物给予前的粪便中的种类数量减去给予后的粪便中的种类数量后的差值(δ种类数量)和同h’的差值 (δshannon diversity index)分别示于图3和图4。表4中,各值用各组的小鼠中的平均值(m)及其标准误差(se)(m
±
se)表示,各给予前的值和给予后的值之间的基于wilcoxon的符号秩检验的p值低于0.05(p<0.05)时,即在确认到给予前与给予后之间具有显著差异时标注星号(*)。
[0294]
[表4]
[0295][0296]
结果表示为七只小鼠的平均值
±
标准误差。
[0297]
*:给予前与给予后,p<0.05(wilcoxon符号秩检验)
[0298]
如表4和图3~4所示,确认了:茶发酵组合物组与水组相比,给予后的种类数量和h’的值较给予前降低。如表4所示,特别是水组中,在给予前与给予后之间h’的值没有显著变化,而茶发酵组合物组中,在给予前与给予后之间h’的值显著减少。另外,如图4所示,对于h’的差值,与水组的给予后与给予前的差值相比,茶发酵组合物组的相同差值显著减少。以往报道了:与健康的人相比,便秘患者的h’的值显著增大(例如,非专利文献1),通过给予本发明的茶发酵组合物,可以说肠道菌群朝着改善便秘的方向发生变化。另外,可认为上述肠道菌群的变化也有助于缩短上述的消化道时间。
[0299]
4.盲肠内容物中的腐败产物浓度的测定
[0300]
首先,将在上述1中给予硫酸钡的第二天采集的各盲肠内容物100mg冷冻干燥,测定了冷冻干燥后的重量。接着,在其中加入甲醇1.5ml并将混合后的悬浮液添加至lysing matrix f(mp biomedicals公司制)中,使用fastprep 24(mp biomedicals公司制)在5.0m/秒、30秒、2次的条件下进行破碎。将破碎物在
‑
20℃下冷冻1小时。需要说明的是,在冷却后经过30分钟的时间点进行倒置混合。冷却后,以20000g、4℃进行20分钟离心,将上清液1ml用0.45μm 过滤器进行过滤。对于各滤液,通过lc/ms/ms测定了对甲酚量和甲基吲哚量。以下示出lc/ms/ms的分析条件。另外,将每1g各盲肠内容物(干燥重量) 的对甲酚量和甲基吲哚量(浓度、ng/g干燥重量)分别示于图5和图6。
[0301]
〔lc/ms/ms的分析条件(qtrap4500 lc
‑
ms/ms系统)〕
[0302]
[lc条件]
[0303]
·
柱:waters beh c18 1.7μm
×
10cm
[0304]
·
流动相:a)水、b)甲醇、
[0305]
b:30%(0分钟)
→
30%(5分钟)
→
99%(10分钟)
→
99%(12分钟)
→ꢀ
30%(12.01分钟)
[0306]
·
流速:0.3ml/分钟
[0307]
·
温度:40℃
[0308]
·
注入量:5μl
[0309]
[ms条件(apci探针)]
[0310]
·
对甲酚:q1)107、q3)91.9、ce)
‑
31
[0311]
·
甲基吲哚:q1)132.2、q3)117、dp)70、ce)27。
[0312]
如图5~6所示,确认了:与水组相比,茶发酵组合物组中作为盲肠内容物中的腐败产物已知的对甲酚浓度和甲基吲哚浓度均为低值。对甲酚和甲基吲哚是由肠道细菌生成的,可以说它们的减少是由肠道菌群的变化所引起的。
[0313]
5.结肠中的inos基因表达量解析
[0314]
将在上述1中给予硫酸钡的第二天采集的结肠浸渍于rnalater(ambion 公司制)中,直至使用保存在
‑
20℃。用tissuelyserii将该结肠破碎,用 nucleospin rna plus(macherey
‑
nagel公司制)提取了rna。接着,将用 primescript rt master mix(takara bio inc.制)对其进行了逆转录的cdna作为模板dna,进行以inos基因和作为内源性对照的gapdh基因为靶向的 q
‑
pcr,对各基因的表达量进行解析。以下示出pcr反应条件。对于引物,制作boyer l等,2011,lab invest 91,p.353
‑
362中记载的引物(inos基因)和eissan等,2016,plos one 11,e0156289中记载的引物(gapdh基因)而使用。
[0315]
〔pcr条件〕
[0316]
·
引物f(inos正向引物):5
’‑
cgggcaaacatcacattcagatcccg
‑3’
(序列号:38)
[0317]
·
引物r(inos反向引物):5
’‑
tatattgctgtggctcccatgtt
‑3’
(序列号:39)
[0318]
·
标准引物f(gapdh正向标准引物):5
’‑
aggtcggtgtgaacggatttg
‑3’
(序列号:40)
[0319]
·
标准引物r(gapdh反向标准引物):5
’‑
ggggtcgttgatggcaaca
‑3’
(序列号: 41)
[0320]
·
模板dna(cdna)浓度:12.5ng/μl
[0321]
·
pcr装置:quantstudio 3实时pcr系统(applied biosystems公司制)
[0322]
·
pcr反应液组成:
[0323]
tb green premix ex taq(takara bio inc.制):10μl
[0324]
引物f(或标准引物f):0.4μl
[0325]
引物r(或标准引物r):0.4μl
[0326]
模板dna:1μl
[0327]
rox reference dyeii:0.4μl
[0328]
h2o:7.8μl
[0329]
总计:20μl
[0330]
·
pcr反应条件:
[0331]
95℃
‑
30秒
[0332]
95℃
‑
5秒/60℃
‑
30秒:40次循环
[0333]
熔解曲线分析(dissociation stage)。
[0334]
将给予水或茶发酵组合物4周后的各结肠中的inos基因的表达量(inos 基因的mrna量/gapdh基因的mrna量、相对的inos mrna水平)示于图7。如图7所示,对于结肠中的inos基因的表达量,确认了:与水组相比茶发酵组合物组显示出趋于减少(水组中的inos基因的表达量与茶发酵组合物组中的inos基因的表达量之间的基于welch’s t检验的p值:p<
0.1)。以往报道了:通过给予no合成酶抑制剂(l
‑
name)而缩短ncxko小鼠的消化道通过时间;结肠的no改善了便秘患者的肠的运动障碍;结肠的inos基因表达量有助于肠道运动;等,可认为结肠的inos基因表达量的减少有助于缩短上述的消化道通过时间。
[0335]
(实施例2)
[0336]
<茶发酵组合物与未发酵茶的成分对比>
[0337]
作为茶发酵组合物,使用实施例1中得到的茶发酵组合物(乳酸菌发酵茶)。作为对照,作为未发酵茶使用前述茶提取物(以122℃经10分钟加热、ph6.2、乳酸菌1的菌数:0)。对于前述茶提取物,也与实施例1同样地测定了各成分的浓度。将结果示于下述的表5。需要说明的是,表5中一并示出实施例1的结果。
[0338]
[表5]
[0339][0340]
如表5所示,本发明的茶发酵组合物中,因发酵而生成乳酸和乙酸,ph 降低。另外,确认了:本发明的茶发酵组合物中,尤其特异性生成了邻苯三酚(pg)。进而,确认了:本发明的茶发酵组合物与未发酵茶相比,观察到egcg、 ecg、gcg、cg浓度的降低、egc、ec、gc、c浓度的增加、及总儿茶素浓度的降低。
[0341]
<肠道调节效果的确认>
[0342]
喂养/繁殖ncxko小鼠和wt小鼠,分别确保周龄相近的雄性24只 ncxko小鼠、8只wt小鼠。饲料使用clea rodent diet ce
‑
2(固体、clea japan,inc.制)。在各小鼠达到9~10周龄的时间点,以体重没有偏差的方式每8 只分成以下的4组:
[0343]
1组:wt小鼠、水组(对照)
[0344]
2组:ncxko小鼠、水组(对照1)
[0345]
3组:ncxko小鼠、未发酵茶组(对照2)
[0346]
4组:ncxko小鼠、茶发酵组合物组。
[0347]
需要说明的是,喂养方式为每4只进行组喂养。在分组后(给予前)采集各小鼠的粪便,然后,1~2组的小鼠给予水,3组的小鼠给予未发酵茶(上述的茶提取物、“明治深蒸静冈茶”、株式会社明治制、以122℃加热10分钟),4 组的小鼠给予上述的茶发酵组合物,分别以自由饮水给予4周。另外,在各笼子中设置饲料,采取自由摄取。每周进行3次更换为新的饲料和各给予物 (水、未发酵茶或茶发酵组合物),从给予开始每周测定一次体重。从开始给予各给予物至喂养4周后,采集各小鼠的粪便,另外,从各小鼠中采集了盲肠内容物。
[0348]
将从给予水(1组、2组)、未发酵茶(3组)、或茶发酵组合物(4组)开始至4 周之间的各组中的小鼠的平均体重示于图8。如图8所示,在实验期间,小鼠的体重未观察到组间差异。
[0349]
1.肠道菌群解析
‑
1(基于实时pcr的解析)
[0350]
使用在上述中水、未发酵茶、或茶发酵组合物给予前和给予4周后采集的各粪便,除此以外与实施例1的2同样地通过q
‑
pcr对粪便中的菌群进行解析。将水(1组、2组)、未发
酵茶(3组)、或茶发酵组合物(4组)的给予前和给予后(给予4周后)的每1g各粪便中的各细菌群的菌数(log
10
细胞数/g粪便)和检测率(%)示于下述的表6。
[0351]
[表6]
[0352][0353]
结果表示为七只小鼠的平均值
±
标准误差。
[0354]
*:给予前与给予后,p<0.05(wilcoxon符号秩检验)
[0355]
如表6所示,wt小鼠(1组)、ncxko小鼠的水组(2组)和未发酵茶组(3组) 中,在给予前与给予后之间各菌群的菌数没有显著变化。相对于此,确认了:ncxko小鼠的茶发酵组合物组(4组)中,拟球梭菌亚群、柔嫩梭菌亚群、和脆弱拟杆菌亚群的菌数显著减少。
[0356]
2.肠道菌群解析
‑
2(基于下一代测序的解析)
[0357]
使用在上述中水、未发酵茶、或茶发酵组合物给予前和给予4周后采集的各粪便,除此以外与实施例1的3同样地计算出各粪便中的各菌群的占有率。将水(1组、2组)、未发酵茶(3组)、或茶发酵组合物(4组)的给予前和给予后(给予4周后)的各粪便中的乳杆菌目(lactobacillales)的读取数相对于总读取数的比例(占有率、读取数%)示于下述的表7。
[0358]
[表7]
[0359][0360]
结果表示为七只小鼠的平均值
±
标准误差。
[0361]
*:给予前与给予后,p<0.05(wilcoxon符号秩检验)
[0362]
如表7所示,wt小鼠(1组)、ncxko小鼠的水组(2组)和未发酵茶组(3组) 中,在给予前与给予后之间乳杆菌目的占有率没有显著变化。相对于此,确认了:ncxko小鼠的茶发酵组合物组(4组)中,在给予前与给予后之间乳杆菌目的占有率显著增加。
[0363]
3.盲肠内容物中的腐败产物浓度的测定
[0364]
使用在上述中水、未发酵茶、或茶发酵组合物的给予4周后采集的各盲肠内容物,除此以外与实施例1的4同样地测定了甲基吲哚量。将每1g各盲肠内容物(干燥重量)的甲基吲哚量(浓度、ng/g干燥重量)示于图9。
[0365]
如图9所示,确认了:与ncxko小鼠的水组(2组)和未发酵茶组(3组)相比, ncxko小
鼠的茶发酵组合物组(4组)中盲肠内容物中的甲基吲哚的浓度为低值。
[0366]
产业上的可利用性
[0367]
如以上说明所述,根据本发明,能够提供具有调节肠道菌群、缩短消化道通过时间等肠道调节作用的、新型的肠道调节用茶发酵组合物及其制造方法。本发明的肠道调节用茶发酵组合物例如作为用于调节肠道菌群组合物、用于缩短消化道通过时间组合物、减少inos基因在肠中的表达量用组合物、用于预防或改善便秘的组合物、或者饮食品组合物是特别有用的。
[0368]
[保藏编号]
[0369]
1.
[0370]
(1)微生物分类命名:戊糖乳杆菌oll203969(lactobacillus pentosus oll203969)
[0371]
(2)保藏编号:nite bp
‑
01986
[0372]
(3)原保藏日:2015年1月5日
[0373]
(4)保藏机构:国家技术评估学会,专利微生物保藏中心(npmd)
[0374]
(5)保藏机构地址:邮编292
‑
0818,日本国千叶县木更津市上总镰足2
‑5‑
8 122室
[0375]
2.
[0376]
(1)微生物分类命名:戊糖乳杆菌oll203982(lactobacillus pentosus oll203982)
[0377]
(2)保藏编号:nite bp
‑
01987
[0378]
(3)原保藏日:2015年1月5日
[0379]
(4)保藏机构:国家技术评估学会,专利微生物保藏中心(npmd)
[0380]
(5)保藏机构地址:邮编292
‑
0818,日本国千叶县木更津市上总镰足2
‑5‑
8 122室
[0381]
3.
[0382]
(1)微生物分类命名:戊糖乳杆菌oll203984(lactobacillus pentosus oll203984)
[0383]
(2)保藏编号:nite bp
‑
01988
[0384]
(3)原保藏日:2015年1月5日
[0385]
(4)保藏机构:国家技术评估学会,专利微生物保藏中心(npmd)
[0386]
(5)保藏机构地址:邮编292
‑
0818,日本国千叶县木更津市上总镰足2
‑5‑
8 122室
[0387]
[序列表自由文本]
[0388]
序列号:1
[0389]
<223>g
‑
ccoc
‑
f
[0390]
序列号:2
[0391]
<223>g
‑
ccoc
‑
r
[0392]
序列号:3
[0393]
<223>sg
‑
clept
‑
f
[0394]
序列号:4
[0395]
<223>sg
‑
clept
‑
r
[0396]
序列号:5
[0397]
<223>g
‑
bact
‑
f
[0398]
序列号:6
[0399]
<223>g
‑
bact
‑
r
[0400]
序列号:7
[0401]
<223>515f
[0402]
序列号:8
[0403]
<223>806rcbc1
[0404]
序列号:9
[0405]
<223>806rcbc2
[0406]
序列号:10
[0407]
<223>806rcbc3
[0408]
序列号:11
[0409]
<223>806rcbc4
[0410]
序列号:12
[0411]
<223>806rcbc5
[0412]
序列号:13
[0413]
<223>806rcbc6
[0414]
序列号:14
[0415]
<223>806rcbc7
[0416]
序列号:15
[0417]
<223>806rcbc8
[0418]
序列号:16
[0419]
<223>806rcbc9
[0420]
序列号:17
[0421]
<223>806rcbc10
[0422]
序列号:18
[0423]
<223>806rcbc11
[0424]
序列号:19
[0425]
<223>806rcbc12
[0426]
序列号:20
[0427]
<223>806rcbc13
[0428]
序列号:21
[0429]
<223>806rcbc14
[0430]
序列号:22
[0431]
<223>806rcbc15
[0432]
序列号:23
[0433]
<223>806rcbc16
[0434]
序列号:24
[0435]
<223>806rcbc17
[0436]
序列号:25
[0437]
<223>806rcbc18
[0438]
序列号:26
[0439]
<223>806rcbc19
[0440]
序列号:27
[0441]
<223>806rcbc20
[0442]
序列号:28
[0443]
<223>806rcbc21
[0444]
序列号:29
[0445]
<223>806rcbc22
[0446]
序列号:30
[0447]
<223>806rcbc23
[0448]
序列号:31
[0449]
<223>806rcbc24
[0450]
序列号:32
[0451]
<223>806rcbc25
[0452]
序列号:33
[0453]
<223>806rcbc26
[0454]
序列号:34
[0455]
<223>806rcbc27
[0456]
序列号:35
[0457]
<223>806rcbc28
[0458]
序列号:36
[0459]
<223>引物1.1
[0460]
序列号:37
[0461]
<223>引物2.1
[0462]
序列号:38
[0463]
<223>inos正向引物
[0464]
序列号:39
[0465]
<223>inos反向引物
[0466]
序列号:40
[0467]
<223>gapdh正向标准引物
[0468]
序列号:41
[0469]
<223>gapdh反向标准引物
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。