一种胞外转运维生素d3前体角鲨烯的酿酒酵母菌株构建及其应用
技术领域
1.本发明涉及一种胞外转运维生素d3前体角鲨烯的酿酒酵母菌株构建及其应用,属于发酵工程技术领域。
背景技术:
2.酿酒酵母(s.cerevisiae)是发酵工业最广泛使用的模式微生物之一,具有遗传背景清晰、基因操作方便等诸多优点。酿酒酵母(s.cerevisiae)胞内天然存在的甲羟戊酸途径(mva pathway)和后角鲨烯途径(post
‑
squalene pathway)使其可以合成角鲨烯、羊毛甾醇、麦角甾醇等具有高附加值的脂类物质,还可通过引入外源基因实现对维生素d3前体(7
‑
dhc)的合成。
3.角鲨烯是s.cerevisiae胞内的一种重要平台化合物,与脂类物质合成密切相关,也是维生素d3合成的关键前体和限制性因素。已报道的研究主要通过启动子工程、过表达途径酶、增强辅因子供给等传统代谢工程手段来实现角鲨烯在s.cerevisiae细胞中的高效生产,过量合成的角鲨烯储存在脂滴和过氧化物酶体等细胞器中。但s.cerevisiae胞内复杂的反馈调节机制和存储空间的有限性给角鲨烯产量的进一步提高带来了不小的难度。因此,如何促进角鲨烯向胞外的高效转运,并且进一步提高角鲨烯产量成为研究的难点。
技术实现要素:
4.为了解决现有技术当中s.cerevisiae胞内的反馈调节机制和有限的胞内储存空间限制了内源性三萜类化合物角鲨烯产量的进一步提高,以及现有技术当中的胞外分泌生产角鲨烯的产量较低的技术问题,本发明提供了一种重组酿酒酵母菌株,所述重组酿酒酵母强化表达了3
‑
羟基
‑3‑
甲基戊二酰辅酶a还原酶thmg1、异戊烯基焦磷酸异构酶idi、法尼基焦磷酸合酶erg20、内质网大小调节因子的相关基因ino2、pdr5蛋白和osh3蛋白;并且敲除了rox1基因。
5.在本发明的一种实施方式中,所述重组酿酒酵母通过p
gpd
启动子强化表达thmg1,通过p
pgk1
启动子强化表达ino2,通过p
tef1
启动子强化表达erg20和idi,通过p
tdh3
启动子强化表达pdr5,通过p
tef2
启动子强化表达osh3。
6.在本发明的一种实施方式中,所述强化表达,是指在酿酒酵母by 4741基因组上强化表达了2个拷贝数的thmg1、1个拷贝数的idi、1个拷贝数的erg20,并且强化表达了1个拷贝数的ino2、1个拷贝数的osh3和1个拷贝数的pdr5。
7.在本发明的一种实施方式中,以酿酒酵母by 4741为出发菌株。
8.在本发明的一种实施方式中,所述thmg1的gene id为42650、所述idi的gene id为855986、所述erg20的gene id为853272、所述ino2的gene id为851701、所述rox1的gene id为856178、所述pdr5蛋白的gene id为854324、所述osh3蛋白的gene id为856472。
9.本发明还提供了上述重组酿酒酵母的构建方法,所述方法包括以下步骤:
10.(1)敲除by4741基因组上的编码rox1酶的基因,并将p
gpd
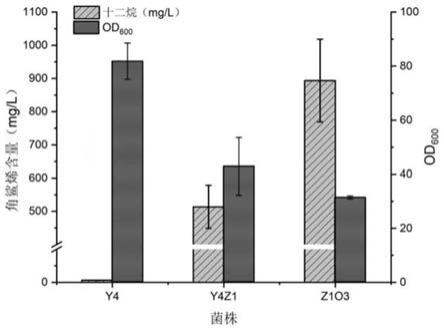
‑
thmg1
‑
t
adh1
片段整合到by4741基因组上,构建得到by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
,命名为酿酒酵母y1;
11.(2)将p
tef1
‑
idi
‑
t
cyc1
片段整合至y1菌株基因组上,构建得到酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
,命名为酿酒酵母y2;
12.(3)将p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
片段整合至y2菌株基因组上,构建得到酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
,命名为酿酒酵母y3;
13.(4)将p
pgk1
‑
ino2
‑
t
ino2
片段整合至y3菌株基因组上,构建得到酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
‑
p
pgk1
‑
ino2
‑
t
ino2
,命名为酿酒酵母y4;
14.(5)将p
tdh3
‑
pdr5
‑
t
tdh3
片段整合至y4菌株基因组上,构建得到酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
‑
p
pgk1
‑
ino2
‑
t
ino2
‑
208a
‑
p
tdh3
‑
pdr5
‑
t
tdh3
,命名为酿酒酵母y4z1;
15.(6)将p
tef2
‑
osh3
‑
t
tdh3
片段整合至y4z1菌株基因组上,构建得到酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
‑
p
pgk1
‑
ino2
‑
t
ino2
‑
208a
‑
p
tdh3
‑
pdr5
‑
t
tdh3
‑
1622b
‑
p
tef2
‑
osh3
‑
t
tdh3
,命名为酿酒酵母z1o3,即得到本发明的菌株酿酒酵母z1o3。
16.本发明还提供了一种制备角鲨烯的方法,采用上述重组酿酒酵母发酵制备得到。
17.在本发明的一种实施方式中,所述方法为,将重组酿酒酵母接种至种子培养基,制备得到种子液,将制备得到的种子液以2%~4%(v/v)的接种量接入发酵培养基中,发酵培养,制备得到角鲨烯。
18.在本发明的一种实施方式中,将所述的重组酿酒酵母接种至sd
‑
trp
‑
leu培养基中,于30℃,220rpm条件下,培养16
‑
24h,得到种子液。
19.在本发明的一种实施方式中,所述sd
‑
trp
‑
leu培养基每升组分包括:尿嘧啶50mg,组氨酸50mg、无氨基酵母氮源(ynb)6.7g,无水葡萄糖20g。
20.在本发明的一种实施方式中,将制备得到的种子液以2%~4%(v/v)的接种量接入发酵培养基中,在30℃,220rpm条件下培养84~96h。
21.在本发明的一种实施方式中,所述发酵培养基每升组分包括:大豆蛋白胨50g,无水葡萄糖25g,蔗糖25g,甘油25g,k2hpo
4 0.6g。
22.本发明还提供了一种提高酿酒酵母胞外分泌角鲨烯的方法,所述方法为:在酿酒酵母中强化表达3
‑
羟基
‑3‑
甲基戊二酰辅酶a还原酶thmg1、异戊烯基焦磷酸异构酶idi、法尼基焦磷酸合酶erg20、内质网大小调节因子的相关基因ino2、pdr5蛋白和osh3蛋白;并且敲除酿酒酵母中的rox1基因。
23.在本发明的一种实施方式中,通过p
gpd
启动子强化表达thmg1,通过p
pgk1
启动子强化表达ino2,通过p
tef1
启动子强化表达erg20、idi和osh3,通过p tdh3
启动子强化pdr5。
24.在本发明的一种实施方式中,所述thmg1的gene id为42650、所述idi的gene id为855986、所述erg20的gene id为853272、所述ino2的gene id为851701、所述rox1的gene id为856178、所述pdr5蛋白的gene id为854324、所述osh3蛋白的gene id为856472。
25.本发明还提供了上述重组酿酒酵母,或上述方法在制备含有角鲨烯产品中的应
用。
26.本发明还提供了一种应用上述重组酿酒酵母在5l生物反应器中进行发酵的方法。
27.在本发明的一种实施方式中,将上述重组酿酒酵母接种至sd
‑
trp
‑
leu培养基中,在30℃,220rpm条件下,培养16~24h,制备得到种子液;
28.将制备得到的种子液按2%(v/v)的接种量接种于两瓶装有135ml ypd培养基并添加抗生素的500ml锥形瓶中,在30℃,220rpm条件下,培养16
‑
24h后,制备得到培养液,将制备得到的培养液按体积比为(1:10)的接种量接种于装有2.7l发酵培养基、270ml十二烷和3ml卡那霉素(50mg/ml)的5l生物反应器中;通过流加50%氨水将ph控制在5.10~5.20,发酵温度控制为30℃,通气量为1vvm,通过关联搅拌转速(200~700rpm)控制溶氧(do)维持在30%。发酵10h后流加葡萄糖(500g/l)使罐中葡萄糖浓度维持在5g/l左右。
29.在本发明的一种实施方式中,所述发酵培养基每升组分包括:大豆蛋白胨50g,无水葡萄糖25g,蔗糖25g,甘油25g,k2hpo
4 0.6g。
30.在本发明的一种实施方式中,ypd培养基为本领域常规培养基,每升组分包括:胰蛋白胨20g,无水葡萄糖20g,酵母提取物10g。
31.有益效果
32.本发明构建了一株可向胞外高效转运角鲨烯的高产重组s.cerevisiae菌株z1o3,利用其进行5l生物反应器发酵时,角鲨烯产量达到1726.03mg/l(70.75mg/g dcw),胞外角鲨烯含量也达到6995.81mg/l。在该菌株中,通过过表达pdr5转运蛋白,从无到有的实现了角鲨烯向胞外的高效转运,减少了过量合成的角鲨烯带来的胞内储存负担和对合成途径的反馈抑制;通过过表达osh3蛋白进一步增强了角鲨烯向胞外转运的效果。由本发明构建的重组菌株具有角鲨烯胞外转运能力,且具有更强的角鲨烯生产性能,具有广阔的应用前景。
附图说明
33.图1:不同重组酿酒酵母胞外分泌角鲨烯的产量及反应结束后的od
600
。
34.图2:不同重组酿酒酵母胞内角鲨烯的产量。
35.图3:重组菌株z1o3在5l生物反应器中的发酵验证。
具体实施方式
36.下述实施例中所涉及的by4741菌株购自北京华越洋生物。
37.下述实施例中所涉及的培养基如下:
38.lb液体培养基:每升含10g胰蛋白胨、10g nacl和5g酵母提取物。
39.sd
‑
trp
‑
leu培养基:每升含尿嘧啶50mg,组氨酸50mg、无氨基酵母氮源6.7g,无水葡萄糖20g。
40.发酵培养基:每升含大豆蛋白胨50g,无水葡萄糖25g,蔗糖25g,甘油25g,k2hpo
4 0.6g。
41.sd trp平板:ynb培养基6.7g/l,葡萄糖20g/l,l
‑
亮氨酸50mg/l,l
‑
组氨酸50mg/l,尿嘧啶50mg/l,琼脂粉20g/l。
42.sd leu平板:ynb培养基6.7g/l,葡萄糖20g/l,l
‑
色氨酸50mg/l,l
‑
组氨酸50mg/l,尿嘧啶50mg/l,琼脂粉20g/l。
43.sd trp leu平板:ynb培养基6.7g/l,葡萄糖20g/l,l
‑
组氨酸50mg/l,尿嘧啶50mg/l,琼脂粉20g/l。
44.ypd固体平板:1%酵母粉,2%蛋白胨,2%葡萄糖,1.5%琼脂粉。
45.下述实施例中所涉及的检测方法如下:
46.角鲨烯含量的检测:
47.将发酵后的菌液离心,把位于上层的十二烷吸出,用滤膜过滤进入液相瓶;将剩余菌体和培养基摇匀后加入破碎管中,并加入等体积的乙酸乙酯作为萃取相,使用玻璃珠研磨破碎细胞,离心后将上层的乙酸乙酯吸出,适当比例稀释后用滤膜过滤进入液相瓶;使用安捷伦1200液相色谱仪和赛默飞c18 ods色谱柱在195nm波长处对角鲨烯产量进行检测,流动相成分为hplc级乙腈,检测柱温40℃,流速为1.6ml
·
min
‑1;其中高效液相色谱(hplc)条件为:使用agilent 1260进行高效液相色谱检测,色谱柱为c18ods(5μm,250
×
4.6mm,thermo fisher scientific,waltham,ma,usa)。流动相:纯乙腈,流速0.6ml/min,柱温40℃,波长为195nm,进样体积为10μl。
48.重组酿酒酵母od
600
的检测方法:
49.将培养16
‑
24h的酵母种子液按1%的接种量接种于装有25ml发酵培养基和2.5ml十二烷的250ml摇瓶中,置于30℃,220rpm培养。间隔一定时间从摇瓶中取样,按适当比例稀释后使用紫外分光光度计测量od
600
。
50.下述实施例中所涉及的质粒的构建在e.coli jm109中进行,质粒构建完成后作为模板扩增表达框,同时扩增整合位点上下游同源臂和两端含有loxp位点的营养缺陷型标记,转化到角鲨烯高产菌株中进行pdr5和osh3的过表达。
51.下述实施例中所涉及的引物序列如表1所示:
52.表1:引物序列
53.[0054][0055]
实施例1:构建酿酒酵母菌株y1
[0056]
具体步骤如下:
[0057]
(1)人工合成基因片段p
gpd
‑
thmg1
‑
t
adh1
(核苷酸序列如seq id no.1所示);
[0058]
以酿酒酵母by4741基因组为模板,采用表1所述的引物序列,用引物rox1
‑
up
‑
f、rox1
‑
up
‑
r扩增得到基因片段rox1
‑
up;
[0059]
用引物rox1
‑
down
‑
f、rox1
‑
down
‑
r扩增得到基因片段rox1
‑
down;
[0060]
以质粒pmhylp
‑
his(核苷酸序列如seq id no.2所示)为模板,采用引物rox1
‑
loxh
‑
f、rox1
‑
loxh
‑
r扩增得到rox1
‑
his片段。
[0061]
(2)将步骤(1)中的四个片段p
gpd
‑
thmg1
‑
t
adh1
、rox1
‑
up、rox1
‑
down、rox1
‑
his采用pcr进行融合pcr,跑胶得到的正确条带进行切胶回收后得到融合基因片段δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
。
[0062]
(3)将步骤(2)中的融合基因片段转化入酿酒酵母by4741菌株感受态中,在sd his平板上于30℃培养2
‑
3天,使用表1所述的引物yz
‑
thmg1
‑
f、yz
‑
thmg1
‑
r进行单菌落pcr验证。挑选条带正确的单菌落,得到菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
his。
[0063]
(4)将步骤(3)得到的菌株制备成感受态,转化入py26
‑
cre(核苷酸序列如seq id no.3所示)质粒,在sd ura平板上于30℃培养2
‑
3天,取单菌落接入ypd培养基内培养15
‑
24h,划线于含有5
‑
foa的ypd平板上,于30℃培养2
‑
3天。将长出的单菌落分别在sd ura、sd his、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
,命名为酿酒酵母y1。
[0064]
实施例2:构建酿酒酵母菌株y2
[0065]
(1)人工合成基因片段p
tef1
‑
idi
‑
t
cyc1
(核苷酸序列如seq id no.4所示);
[0066]
以酿酒酵母by4741基因组为模板,采用如表1所示的引物序列,用引物911b
‑
up
‑
f、911b
‑
up
‑
r扩增得到基因片段911b
‑
up;
[0067]
用引物911b
‑
down
‑
f、911b
‑
down
‑
r扩增得到基因片段911b
‑
down;
[0068]
以质粒pmhylp
‑
his为模板,采用引物idi
‑
loxh
‑
f、idi
‑
loxh
‑
r扩增得到ino2
‑
his片段。
[0069]
(2)将步骤(1)中的四个片段p
tef1
‑
idi
‑
t
cyc1
、911b
‑
up、911b
‑
down、idi
‑
his采用pcr进行融合pcr,跑胶得到的正确条带进行切胶回收后得到融合基因片段911b
‑
p
tef1
‑
idi
‑
t
cyc1
。
[0070]
(3)将步骤(2)中的基因片段转化入实施例1制备得到的y1菌株感受态中,在sd his平板上于30℃培养2
‑
3天,使用引物yz
‑
idi
‑
f、yz
‑
idi
‑
r进行单菌落pcr验证。挑选条带正确的单菌落,得到菌株y1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
his。
[0071]
(4)将步骤(3)得到的菌株制备成感受态,转化入py26
‑
cre质粒,在sd ura平板上于30℃培养2
‑
3天,取单菌落接入ypd培养基内培养15
‑
24h,划线于含有5
‑
foa的ypd平板上,于30℃培养2
‑
3天。将长出的单菌落分别在sd ura、sd his、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
,命名为酿酒酵母y2。
[0072]
实施例3:构建酿酒酵母菌株y3
[0073]
具体步骤如下:
[0074]
(1)人工合成基因片段p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
(核苷酸序列如seq id no.5所示);
[0075]
以酿酒酵母by4741基因组为模板,采用表1所述的引物序列,用引物erg20
‑
up
‑
f、erg20
‑
up
‑
r扩增得到基因片段erg20
‑
up;
[0076]
用引物erg20
‑
down
‑
f、erg20
‑
down
‑
r扩增得到基因片段erg20
‑
down;
[0077]
以质粒pmhylp
‑
his为模板,采用引物erg20
‑
loxh
‑
f、erg20
‑
loxh
‑
r扩增得到erg20
‑
his片段。
[0078]
(2)将步骤(1)中的四个片段p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
‑
p
pgk
、erg20
‑
up、erg20
‑
down、erg20
‑
his采用pcr进行融合pcr,跑胶得到的正确条带进行切胶回收后得到融合基因片段p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
;
[0079]
(3)将步骤(2)中得到的融合基因片段转化入实施例2制备得到的y2菌株的感受态中,在sd his平板上于30℃培养2
‑
3天,使用引物yz
‑
erg20
‑
f、yz
‑
erg20
‑
r进行单菌落pcr验证;挑选条带正确的单菌落,得到菌株y2
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
‑
his。
[0080]
(4)将步骤(3)得到的菌株制备成感受态,转化入py26
‑
cre质粒,在sd ura平板上于30℃培养2
‑
3天,取单菌落接入ypd培养基内培养15
‑
24h,划线于含有5
‑
氟乳清酸的ypd平板上,于30℃培养2
‑
3天。将长出的单菌落分别在sd ura、sd his、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
,命名为酿酒酵母y3。
[0081]
实施例4:构建酿酒酵母菌株y4
[0082]
具体步骤如下:
[0083]
(1)人工合成基因片段p
pgk1
‑
ino2
‑
t
ino2
(核苷酸序列如seq id no.6所示);
[0084]
以酿酒酵母by4741基因组为模板,采用表1所述的引物序列,用引物ino2
‑
up
‑
f、ino2
‑
up
‑
r扩增得到基因片段ino2
‑
up;
[0085]
用引物ino2
‑
down
‑
f、ino2
‑
down
‑
r扩增得到基因片段ino2
‑
down;
[0086]
以质粒pmhylp
‑
his为模板,采用引物ino2
‑
loxh
‑
f、ino2
‑
loxh
‑
r扩增得到ino2
‑
his片段。
[0087]
(2)将步骤(1)中的四个片段p
pgk1
‑
ino2
‑
t
ino2
、ino2
‑
up、ino2
‑
down、ino2
‑
his采用pcr进行融合pcr,跑胶得到的正确条带进行切胶回收后得到融合基因片段up
‑
p
pgk1
‑
ino2
‑
t
ino2
‑
down;
[0088]
(3)将步骤(2)中得到的融合基因片段转化入实施例3制备得到的y3菌株的感受态中,在sd his平板上于30℃培养2
‑
3天,使用引物yz
‑
ino2
‑
f、yz
‑
ino2
‑
r进行单菌落pcr验证;挑选条带正确的单菌落,得到菌株y3
‑
p
pgk1
‑
ino2
‑
t
ino2
‑
his。
[0089]
(4)将步骤(3)得到的菌株制备成感受态,转化入py26
‑
cre质粒,在sd ura平板上于30℃培养2
‑
3天,取单菌落接入ypd培养基内培养15
‑
24h,划线于含有5
‑
氟乳清酸的ypd平板上,于30℃培养2
‑
3天。将长出的单菌落分别在sd ura、sd his、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
‑
p
pgk1
‑
ino2
‑
t
ino2
,命名为酿酒酵母y4。
[0090]
实施例5:构建酿酒酵母菌株y4z1
[0091]
具体步骤如下:
[0092]
(1)人工合成基因片段p
tdh3
‑
pdr5
‑
t
tdh3
(核苷酸序列如seq id no.7所示);
[0093]
以酿酒酵母by4741基因组为模板,采用表1所述的引物序列,用引物208a
‑
up
‑
f、208a
‑
up
‑
r扩增得到基因片段208a
‑
up;
[0094]
用引物208a
‑
down
‑
f、208a
‑
down
‑
r扩增得到基因片段208a
‑
down;
[0095]
以质粒pmhylp
‑
trp(核苷酸序列如seq id no.8所示)为模板,采用引物pdr5
‑
loxt
‑
f、pdr5
‑
loxt
‑
r扩增得到pdr5
‑
trp片段。
[0096]
(2)将步骤(1)中的四个片段p
tdh3
‑
pdr5
‑
t
tdh3
、208a
‑
up、208a
‑
down、pdr5
‑
trp采用pcr进行融合pcr,跑胶得到的正确条带进行切胶回收后得到融合基因片段up
‑
p
tdh3
‑
pdr5
‑
t
tdh3
‑
down;
[0097]
(3)将步骤(2)中得到的融合基因片段转化入实施例4制备得到的y4菌株的感受态中,在sd trp平板上于30℃培养2
‑
3天,使用引物yz
‑
pdr5
‑
f、yz
‑
pdr5
‑
r进行单菌落pcr验证;挑选条带正确的单菌落,得到菌株y4
‑
p
tdh3
‑
pdr5
‑
t
tdh3
‑
trp。
[0098]
(4)将步骤(3)得到的菌株制备成感受态,转化入py26
‑
cre质粒,在sd ura平板上于30℃培养2
‑
3天,取单菌落接入ypd培养基内培养15
‑
24h,划线于含有5
‑
氟乳清酸的ypd平板上,于30℃培养2
‑
3天。将长出的单菌落分别在sd ura、sd trp、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
‑
p
pgk1
‑
ino2
‑
t
ino2
‑
208a
‑
p
tdh3
‑
pdr5
‑
t
tdh3
,命名为酿酒酵母y4z1。
[0099]
实施例6:构建酿酒酵母菌株z1o3
[0100]
具体步骤如下:
[0101]
(1)人工合成基因片段p
tef2
‑
osh3
‑
t
tdh3
(核苷酸序列如seq id no.9所示);
[0102]
以酿酒酵母by4741基因组为模板,采用表1所述的引物序列,用引物1622b
‑
up
‑
f、1622b
‑
up
‑
r扩增得到基因片段1622b
‑
up;
[0103]
用引物1622b
‑
down
‑
f、1622b
‑
down
‑
r扩增得到基因片段1622b
‑
down;
[0104]
以质粒pmhylp
‑
leu(核苷酸序列如seq id no.10所示)为模板,采用引物osh3
‑
loxl
‑
f、osh3
‑
loxl
‑
r扩增得到osh3
‑
leu片段。
[0105]
(2)将步骤(1)中的四个片段p
tef2
‑
osh3
‑
t
tdh3
、1622b
‑
up、1622b
‑
down、osh3
‑
leu采用pcr进行融合pcr,跑胶得到的正确条带进行切胶回收后得到融合基因片段up
‑
p
tef2
‑
osh3
‑
t
tdh3
‑
down;
[0106]
(3)将步骤(2)中得到的融合基因片段转化入实施例5制备得到的y4z1菌株的感受态中,在sd leu平板上于30℃培养2
‑
3天,使用引物yz
‑
osh3
‑
f、yz
‑
osh3
‑
r进行单菌落pcr验证;挑选条带正确的单菌落,得到菌株y4z1
‑
p
tef2
‑
osh3
‑
t
tdh3
‑
leu。
[0107]
(4)将步骤(3)得到的菌株制备成感受态,转化入py26
‑
cre质粒,在sd ura平板上于30℃培养2
‑
3天,取单菌落接入ypd培养基内培养15
‑
24h,划线于含有5
‑
氟乳清酸的ypd平板上,于30℃培养2
‑
3天。将长出的单菌落分别在sd ura、sd leu、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株by4741δrox1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
911b
‑
p
tef1
‑
idi
‑
t
cyc1
‑
p
gpd
‑
thmg1
‑
t
adh1
‑
p
tef1
‑
erg20
‑
t
cyc1
‑
p
pgk1
‑
ino2
‑
t
ino2
‑
208a
‑
p
tdh3
‑
pdr5
‑
t
tdh3
‑
1622b
‑
p
tef2
‑
osh3
‑
t
tdh3
,命名为酿酒酵母z1o3。
[0108]
实施例7:摇瓶发酵条件下重组菌株的角鲨烯产量
[0109]
具体步骤如下:
[0110]
(1)分别将上述重组酿酒酵母菌株在30℃,220rpm条件下培养16~24h,制备得到种子液,将制备得到的种子液按2%(v/v)的接种量接种于装有25ml发酵培养基和2.5ml十二烷的250ml锥形瓶,在30℃,220rpm条件下培养96h,制备得到发酵液。
[0111]
(2)计算胞外角鲨烯的产量:
[0112]
将发酵液离心后吸净上层十二烷,经滤膜过滤于液相进样瓶,进行高效液相色谱
检测,通过与角鲨烯标品峰面积进行换算得出工程菌株发酵产量。将吸净十二烷的发酵液重悬,吸取发酵液稀释100倍后使用紫外分光光度计测量od
600
。
[0113]
结果如表2及图1所示,过表达pdr5和osh3蛋白的z1o3菌株胞外十二烷中角鲨烯含量达到893.58mg/l,od
600
达到31.36。
[0114]
表2:不同重组酿酒酵母胞外分泌角鲨烯的产量及反应结束后的od
600
[0115]
菌株产量(mg/l)od
600
y45.9881.79y4z1513.8642.80z1o3893.5831.36
[0116]
(3)计算胞内角鲨烯的产量:
[0117]
吸取600μl重悬发酵液,使用等量去离子水洗涤并重悬后,与600μl乙酸乙酯和适量0.5mm玻璃珠放入破碎管,使用全细胞研磨仪破碎细胞。离心后吸取乙酸乙酯,适当稀释后经滤膜过滤于液相进样瓶,进行高效液相色谱检测,通过与角鲨烯标品峰面积进行换算得出工程菌株发酵产量。
[0118]
结果如表3及图2所示,z1o3菌株胞内角鲨烯含量达到1390.87mg/l(99.86mg/g dcw)。
[0119]
表3:不同重组酿酒酵母胞内角鲨烯的产量
[0120]
菌株胞内产量(mg/l)胞内产量(mg/g dcw)y41157.3131.96y4z11416.4276.04z1o31390.8799.86
[0121]
实施例8:重组菌株在5l生物反应器中的发酵验证
[0122]
本实施例仅以y4
‑
pdr5
‑
osh3(即:z1o3)重组酿酒酵母作为研究对象,在5l发酵罐中进行发酵验证。
[0123]
具体步骤如下:
[0124]
将实施例6制备得到的种子液按照2%(v/v)的接种量接种于装有150ml发酵培养基的500ml锥形瓶,培养16
‑
24h后,制备得到培养液,将制备得到的培养液按体积比为(1:10)的比例接种于装有2.7l发酵培养基、270ml十二烷、3ml卡那霉素(50mg/ml)的5l生物反应器中。通过向生物反应器中流加50%氨水将ph控制在5.10~5.20,发酵温度控制为30℃,通气量为1vvm,通过关联搅拌转速(200~700rpm)控制溶氧(do)维持在30%。发酵10h后流加葡萄糖(500g/l)使罐中葡萄糖浓度维持在5g/l。发酵过程中间隔一定时间取样处理进行液相检测并测量残糖和od
600
。
[0125]
结果如图3所示,发酵93h时,z1o3菌株胞外十二烷中角鲨烯含量可达到6995.81mg/l,胞内角鲨烯含量可达到70.75mg/g dcw。
[0126]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。