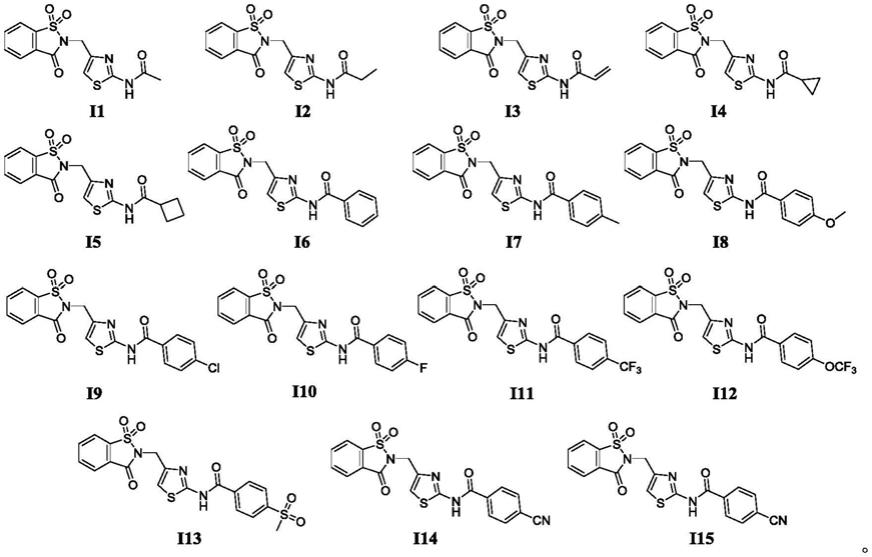
具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物、制备方法和应用
技术领域
1.本发明涉及有机合成与农用化学品技术领域,尤其涉及具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物、制备方法和应用。
背景技术:
2.真菌感染是农作物的主要病害之一,从而影响到农作物的产量与品质。目前,合理使用杀菌剂是防治真菌病害最有效的手段之一。但是,现有商品化杀菌剂的不合理使用,使得大多数病菌已经或多或少对这些商品药产生抗性。此外,人们对环境保护意识不断增强,药物使用寿命、药物经济性等问题也不可忽略,因此,开发出新型、高效、安全及经济的杀菌剂具有重要意义。
[0003]2‑
氨基噻唑骨架具多个取代位点,使得这类化合物在衍生化的过程中易于产生结构多样性,加之其在生物学上的重要性,因此在药物设计中常被作为活性片段引入到结构优化当中。而在农用化学品领域,2
‑
氨基噻唑骨架为活性片段也衍生出不少优秀的杀菌剂,如拌种灵、噻唑菌胺、噻唑锌等。而二酰亚胺类化合物也在杀菌剂中扮演重要角色,如灭菌丹、克菌丹和敌菌丹等。然而,在农用化学品领域,目前合成的化合物杀菌效果仍有待提高,使用剂量高容易残留在作物表面。
技术实现要素:
[0004]
本发明所要解决的技术问题是目前农作物用杀菌化合物的杀菌效果差,使用剂量高及病菌对已有商品化杀菌剂产生抗药性。
[0005]
为了解决上述问题,本发明提出以下技术方案:
[0006]
第一方面,本发明提供具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物,其具有如下结构通式:
[0007][0008]
其中,r选自甲基、乙基、乙烯基、环丙基、环丁基、未取代或4
‑
位取代的芳香基团中的至少一种;所述芳香基团上的取代基团选自甲基、叔丁基、甲氧基、卤素、三氟甲基、三氟甲氧基苯、氰基、甲磺酰基中的至少一种。
[0009]
第二方面,本发明提供所述的具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物的制备方法,包括以下步骤:
[0010]
s1,将1,3
‑
二氯丙酮和硫脲按1:1反应当量在第一溶剂中进行反应,得到2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐;
[0011]
s2,将2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐加入第二溶剂中形成混悬液,加入碱催化剂、酰氯,于0
‑
25℃下反应8~12小时得到中间体,其中2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐与酰氯的反应用量为1:1.1反应当量;碱催化剂与2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐的摩尔比为(2~4):1;
[0012]
s3,在第三溶剂中,于室温至体系回流温度下,将所述中间体与糖精钠按1:1.2反应当量进行反应,得到所述的具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物;
[0013]
所述酰氯具有如下式iii结构:
[0014][0015]
其中,r选自甲基、乙基、乙烯基、环丙基、环丁基、未取代或4
‑
位取代的芳香基团中的至少一种;所述芳香基团上的取代基团选自甲基、叔丁基、甲氧基、卤素、三氟甲基、三氟甲氧基苯、氰基、甲磺酰基中的至少一种。
[0016]
在本发明的具体实施方式中,步骤s1中还包括,反应完毕后,将反应后的物料减压蒸馏除去溶剂,所得固体用丙酮洗涤,不进一步纯化用于下步反应。
[0017]
步骤s2中还包括,反应完毕后,减压蒸馏除去溶剂,采用乙酸乙酯萃取所述浓缩后的物料,然后采用饱和食盐水洗涤,合并收集有机相,无水硫酸钠干燥后减压除去溶剂,再进行柱层析分离纯化。
[0018]
步骤s3中还包括,反应完毕后,将反应液倒入冰水,析出固体产物,过滤收集固体产物,重结晶纯化样品。
[0019]
步骤s1
‑
s3的反应时间可通过薄层色谱监测反应进程,反应时间根据起始原料的反应程度进行调整。
[0020]
其进一步地技术方案为,所述碱催化剂为碳酸氢盐或磷酸一氢盐。
[0021]
其进一步地技术方案为,步骤s2中,所述碱催化剂为碳酸氢钠、碳酸氢钾、磷酸氢二钠或磷酸氢二钾中的任意一种。
[0022]
其进一步地技术方案为,步骤s2中,加入所述酰氯的方式为,于
‑
10℃下缓慢加入反应体系中。
[0023]
其进一步地技术方案为,所述第一溶剂选自甲醇、乙醇、四氢呋喃、乙腈、二氧六环中的至少一种。
[0024]
其进一步地技术方案为,所述第二溶剂选自二氯甲烷、四氢呋喃、n,n
‑
二甲基甲酰胺、甲苯、二氧六环中的至少一种。
[0025]
其进一步地技术方案为,所述第三溶剂选自丙酮、乙腈、n,n
‑
二甲基甲酰胺、四氢呋喃中的至少一种。
[0026]
本发明还提供如第一方面所述的具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物,或者,如第二方面所述的具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物的制备方法得到的所述具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物,在制备杀菌农药中的应用。
[0027]
其进一步地技术方案为,所述杀菌农药为抑制植物病原菌真菌的杀菌农药;所述植物病原菌真菌包括灰葡萄孢引起黄瓜灰霉病菌、玉米弯孢菌叶斑病菌、水稻纹枯病菌中的至少一种。
[0028]
与现有技术相比,本发明所能达到的技术效果包括:
[0029]
本发明采用分子杂合手段,将2
‑
氨基噻唑及二酰亚胺结构片段进行拼接,设计出具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物,实验证明,此类化合物对灰葡萄孢引起黄瓜灰霉病菌、玉米弯孢菌叶斑病菌、水稻纹枯病菌均具有一定抑制作用,在很低的剂量下就可以获得很好的杀菌效果。本发明提供的化合物可制备成杀菌农药,较恶霉灵和拌种灵具有更高的杀菌活性。
具体实施方式
[0030]
下面将对实施例中的技术方案进行清楚、完整地描述。显然,以下将描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0031]
以下实施例中所有化学药品及试剂均为从市场供应商购置,未经过进一步纯化直接使用;所指温度为摄氏温度;柱层析均采用200~300目硅胶。
[0032]
本发明实施例提供具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物,其具有如下结构通式:
[0033][0034]
其中,r选自甲基、乙基、乙烯基、环丙基、环丁基、未取代或4
‑
位取代的芳香基团中的至少一种;所述芳香基团上的取代基团选自甲基、叔丁基、甲氧基、卤素、三氟甲基、三氟甲氧基苯、氰基、甲磺酰基中的至少一种。
[0035]
具体实施中,符合上述通式结构且具有良好杀菌效果的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物,优选以下15种化合物:
[0036][0037]
上述15种化合物的理化数据如下所示:
[0038]
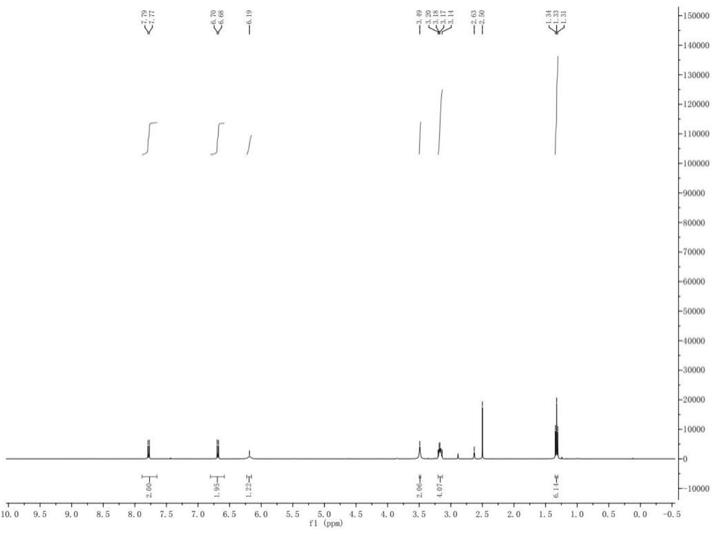
i1:棕色固体;熔点:225
‑
226℃;1h nmr(600mhz,acetone
‑
d6)δ10.93(brs,1h),8.11(d,j=7.7hz,1h),8.07(d,j=7.6hz,1h),8.05
–
8.00(m,1h),7.97(t,j=7.6hz,1h),7.00(s,1h),4.84(s,2h),2.17(s,3h).
13
c nmr(151mhz,acetone)δ168.1,158.4,158.2,144.8,137.9,135.6,134.9,127.0,125.1,121.1,110.5,38.1,21.9.hrms m/z calcd for c
13
h
11
n3o4s2(m na)
360.0083;found 360.0089.
[0039]
i2:黄色固体;熔点:150℃;1h nmr(600mhz,chloroform
‑
d)δ9.40(brs,1h),8.08(d,j=7.5hz,1h),7.94(d,j=7.5hz,1h),7.88(t,j=7.4hz,1h),7.84(t,j=7.4hz,1h),6.99(s,1h),4.94(s,2h),2.47(q,j=7.5hz,2h),1.24(t,j=7.5hz,3h).
13
c nmr(151mhz,cdcl3)δ171.5,158.8,158.2,144.0,137.7,135.0,134.4,127.2,125.4,121.1,112.2,38.4,29.5,9.0.hrms m/z calcd for c
14
h
13
n3o4s2(m na)
374.0240;found 374.0231.
[0040]
i3:白色固体;熔点:152
‑
154℃;1h nmr(500mhz,acetone
‑
d6)δ11.34(brs,1h),8.17(dd,j=15.7,7.6hz,2h),8.10(d,j=7.6hz,1h),8.05(d,j=7.1hz,1h),6.64(dd,j=17.0,10.2hz,1h),6.50(dd,j=17.0,1.5hz,1h),5.90(dd,j=10.2,1.5hz,1h),4.95(s,2h).
13
c nmr(126mhz,acetone)δ163.0,158.5,158.1,145.2,137.9,135.6,134.9,129.5,128.8,127.0,125.1,121.1,111.3,38.1.hrms m/z calcd for c
14
h
11
n3o4s2(m na)
372.0083;found 372.0074.
[0041]
i4:白色固体;熔点:196
‑
197℃;1h nmr(500mhz,chloroform
‑
d)δ10.07(brs,1h),8.07(d,j=6.3hz,1h),7.93(s,1h),7.91
–
7.81(m,2h),6.97(s,1h),4.94(s,2h),1.62(brs,1h),1.15(brs,2h),0.95(brs,2h).
13
c nmr(126mhz,cdcl3)δ171.8,158.8,158.7,143.8,137.7,135.0,134.5,127.2,125.4,121.1,112.0,38.5,14.9,9.1.hrms m/z calcd for c
15
h
13
n3o4s2(m na)
86.0240;found 386.0224
[0042]
i5:白色固体;熔点:175
‑
157℃;1h nmr(600mhz,acetone
‑
d6)δ10.84(brs,1h),8.19(d,j=7.7hz,1h),8.16(d,j=7.6hz,1h),8.12(t,j=7.6hz,1h),8.06(t,j=7.6hz,
1h),7.10(s,1h),4.92(s,2h),3.58
–
3.44(m,1h),2.46
–
2.33(m,2h),2.26
–
2.21(m,2h),2.07
–
2.01(m,1h),1.99
‑
1.89(m,1h).
13
c nmr(126mhz,cdcl3)δ172.4,158.7,158.0,144.0,137.8,134.9,134.4,127.2,125.4,121.1,112.3,39.6,38.4,25.1,18.2.hrms m/z calcd for c
16
h
15
n3o4s2(m h)
400.0396;found 400.0409
[0043]
i6:棕色固体;熔点:117
‑
119℃;1h nmr(500mhz,chloroform
‑
d)δ8.07(d,j=7.4hz,1h),7.92(d,j=7.4hz,4h),7.89
–
7.78(m,3h),7.58(d,j=7.4hz,1h),7.50(t,j=7.7hz,3h),7.06(s,1h),4.88(s,2h).
13
c nmr(126mhz,cdcl3)δ164.6,158.7,158.6,144.3,137.7,134.9,134.4,133.0,131.9,129.0,127.4,127.2,125.4,121.1,112.7,38.3.hrms m/z calcd for c
18
h
13
n3o4s2(m na)
422.020;found 422.0231
[0044]
i7:黄色固体;熔点:222
‑
223℃;1h nmr(600mhz,chloroform
‑
d)δ10.26(brs,1h),8.07(d,j=7.5hz,1h),7.93(d,j=7.6hz,1h),7.90
–
7.82(m,2h),7.84(d,j=8.3hz,2h),7.29(d,j=8.0hz,2h),7.05(s,1h),4.92(s,2h),2.42(s,3h).
13
c nmr(151mhz,cdcl3)δ164.5,159.0,158.8,144.0,143.8,137.7,134.9,134.42,129.7,128.9,127.5,127.2,125.4,121.1,112.6,38.4,21.6.hrms m/z calcd for c
19
h
15
n3o4s2(m na)
436.0396;found 436.0389
[0045]
i8:黄色固体;熔点:214
‑
216℃;1h nmr(500mhz,chloroform
‑
d)δ8.07(d,j=7.2hz,1h),7.89(d,j=8.7hz,2h),7.87
–
7.93(m,3h),7.04(s,1h),6.97(d,j=8.9hz,2h),4.91(s,2h),3.87(s,3h).
13
c nmr(126mhz,cdcl3)δ164.0,163.4,158.9,144.2,137.8,134.9,134.4,129.4,127.2,125.4,123.9,121.1,114.3,112.5,55.5,38.4.hrms m/z calcd for c
19
h
15
n3o5s2(m na)
452.0345;found 452.0345
[0046]
i9:白色固体;熔点:185
‑
186℃;1h nmr(600mhz,chloroform
‑
d)δ10.39(brs,1h),8.05(d,j=7.4hz,1h),7.92(d,j=7.6hz,1h),7.91
–
7.80(m,4h),7.45(d,j=8.5hz,2h),7.08(s,1h),4.90(s,2h).
13
c nmr(151mhz,cdcl3)δ163.6,158.8,158.7,144.2,139.4,137.7,135.0,134.4,130.2,129.3,128.9,127.1,125.4,121.1,112.9,38.3.hrms m/z calcd for c
18
h
12
cln3o4s2(m na)
455.9850;found 455.9839
[0047]
i10:白色固体;熔点:187℃;1h nmr(500mhz,chloroform
‑
d)δ9.90(brs,1h),8.08(d,j=7.1hz,1h),7.99
–
7.92(m,4h),7.91
–
7.81(m,2h),7.18(t,j=8.6hz,1h),7.08(s,1h),4.93(s,2h).
13
c nmr(151mhz,acetone)δ165.32(d,j=251.3hz),163.9,158.6,158.5,145.2,137.9,135.6,134.9,130.8,130.7,128.8,127.0,125.1,121.1,115.61(d,j=22.2hz),111.5,38.1.hrms m/z calcd for c
18
h
12
fn3o4s2(m na)
440.0145;found 440.0144
[0048]
i11:白色固体;熔点:249
‑
251℃;1h nmr(500mhz,dmso
‑
d6)δ12.97(brs,1h),8.33(d,j=7.6hz,1h),8.26(d,j=8.1hz,2h),8.17(d,j=7.4hz,1h),8.06(dt,j=25.6,7.4hz,2h),7.91(d,j=8.2hz,2h),7.29(s,1h),4.98(s,2h).
13
c nmr(151mhz,acetone)δ163.9,158.5,158.3,145.3,137.9,136.2,135.6,134.9,133.20(q,j=32.7hz),128.8,127.0,125.63(q,j=3.7hz),125.1,123.98(d,j=271.9hz),121.1,111.8,38.1.hrms m/z calcd for c
19
h
12
f3n3o4s2(m na)
490.0114;found 490.0107
[0049]
i12:黄色固体;熔点:242
‑
243℃;1h nmr(500mhz,acetone
‑
d6)δ11.69(brs,1h),8.35(d,j=8.5hz,2h),8.19(dd,j=14.3,7.6hz,2h),8.15
–
8.10(m,1h),8.08(dd,j=7.5,
1.0hz,1h),8.01(d,j=8.5hz,2h),7.25(s,1h),5.23
–
4.72(m,2h).
13
c nmr(126mhz,acetone)δ163.7,158.5,158.2,145.3,137.9,136.3,135.6,134.9,132.5,128.8,127.0,125.1,121.1,117.7,115.7,111.8,38.1.hrms m/z calcd for c
19
h
12
n4o4s2(m h)
447.0192;found 447.0221
[0050]
i13:白色固体;熔点:208
‑
210℃;1h nmr(600mhz,acetone
‑
d6)δ8.34(d,j=8.7hz,2h),8.21(d,j=7.6hz,1h),8.18(d,j=7.6hz,1h),8.12(t,j=7.4hz,1h),8.07(t,j=7.5hz,1h),7.54(d,j=8.5hz,2h),7.23(s,1h),4.98(s,2h).
13
c nmr(151mhz,acetone)δ163.7,158.48(d,j=7.1hz),151.9,145.2,137.9,135.6,134.9,131.3,130.4,127.0,125.1,122.9,120.11(q,j=257.0hz),117.8,111.6,38.1.hrms m/z calcd for c
19
h
12
f3n3o5s2(m na)
506.0063;found 506.0090
[0051]
i14:黄色固体;熔点:242
‑
244℃;1h nmr(500mhz,dmso
‑
d6)δ13.00(brs,1h),8.33(d,j=7.6hz,1h),8.29(d,j=8.6hz,2h),8.16(d,j=7.2hz,1h),8.09
–
8.06(m,1h),8.07(d,j=8.3hz,2h),8.03(td,j=7.6,1.0hz,1h),7.30(s,1h),4.98(s,2h),3.30(s,3h).
13
c nmr(151mhz,dmso)δ164.5,158.9,158.8,145.1,144.4,137.3,136.9,136.4,135.8,129.7,127.6,126.7,125.7,122.1,112.5,43.6,38.4.hrms m/z calcd for c
19
h
15
n3o6s3(m h)
500.0015;found 500.0038
[0052]
i15:白色固体;熔点:173℃;1h nmr(500mhz,chloroform
‑
d)δ9.95(brs,1h),8.07(d,j=7.2hz,1h),7.93(d,j=7.3hz,1h),7.89
–
7.81(m,2h)7.86(d,j=8.0hz,2h),7.51(d,j=8.5hz,2h),7.05(s,1h),4.91(s,2h),1.34(s,9h).
13
c nmr(126mhz,cdcl3)δ164.4,158.7,158.7,156.8,144.3,137.7,134.9,134.4,128.9,127.3,127.2,126.0,125.4,121.1,112.5,38.4,35.2,31.1.hrms m/z calcd for c
22
h
21
n3o4s2(m na)
478.0866;found 478.0881
[0053]
本发明实施例还提供一种如上所述的具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物的制备方法,包括以下步骤:
[0054]
s1,将1,3
‑
二氯丙酮和硫脲按1:1反应当量在第一溶剂中进行反应,得到2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐;
[0055]
s2,将2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐加入第二溶剂中形成混悬液,加入碱催化剂、于
‑
10℃下将酰氯缓慢加入反应体系中,滴加完毕后于0
‑
25℃下反应8~12小时得到中间体,其中2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐与酰氯的反应用量为1:1.1反应当量;碱催化剂与2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐的摩尔比为(2~4):1;
[0056]
s3,在第三溶剂中,于室温至体系回流温度下,将所述中间体与糖精钠按1:1.2反应当量进行反应,得到所述的具有杀菌活性的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物;
[0057]
所述酰氯具有如下式iii结构:
[0058][0059]
其中,r选自甲基、乙基、乙烯基、环丙基、环丁基、未取代或4
‑
位取代的芳香基团中
的至少一种;所述芳香基团上的取代基团选自甲基、叔丁基、甲氧基、卤素、三氟甲基、三氟甲氧基苯、氰基、甲磺酰基中的至少一种。
[0060]
具体实施例中,所述碱催化剂为碳酸氢盐或磷酸一氢盐。
[0061]
优选的实施例中,所述碱催化剂为碳酸氢钠、碳酸氢钾、磷酸氢二钠或磷酸氢二钾中的任意一种。
[0062]
具体实施例中,所述第一溶剂选自甲醇、乙醇、四氢呋喃、乙腈、二氧六环中的至少一种。
[0063]
具体实施例中,所述第二溶剂选自二氯甲烷、四氢呋喃、n,n
‑
二甲基甲酰胺、甲苯、二氧六环中的至少一种。
[0064]
具体实施例中,所述第三溶剂选自丙酮、乙腈、n,n
‑
二甲基甲酰胺、四氢呋喃中的至少一种。
[0065]
具体实施例中,合成路线具体介绍如下:
[0066][0067]
其中,式iii为所述酰氯,式
ⅴ
的糖精钠结构如下:
[0068][0069]
具体实施例中,对步骤s1的2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐的合成介绍如下:
[0070][0071]
将2.3g硫脲溶于50ml乙醇中并剧烈搅拌,在0℃下缓慢滴加至含有3.8g 1,3
‑
二氯丙酮的乙醇溶液,保持冰浴反应6小时以上,待薄层色谱检测原料消失,减压蒸馏除去溶剂,得淡黄色固体(化合物ii,2
‑
氨基
‑4‑
氯甲基噻唑盐酸盐),用50ml丙酮洗涤固体2次,干燥,得3.2g白色固体。1h nmr(500mhz,dmso
‑
d6)δ9.39(d,j=33.9hz,1h),6.98(s,1h),4.68(s,2h).
13
c nmr(126mhz,dmso)δ170.3,136.5,107.9,37.6.
[0072]
具体实施例中:以合成化合物i1为例,介绍步骤s2、s3的合成:
[0073][0074]
将61.8mg化合物ii和51.6mg碳酸氢钠加入到10ml二氯甲烷中,剧烈搅拌形成混悬
液,冰浴下缓慢滴加24μl乙酰氯,反应6小时以上,待薄层色谱检测原料消失,将反应液倒入冰水中,用二氯甲烷萃取两次,有机相用饱和氯化铵溶液洗涤两次,合并有机相,无水硫酸钠干燥后减压蒸馏除去溶剂,所得固体经柱层析纯化,得43.7mg白色固体,即iva(中间体)。1h nmr(500mhz,cdcl3)δ6.93(s,1h),4.56(s,2h),2.27(s,3h).
[0075]
将38mg iva溶于乙腈中,加入102mg糖精钠和3mg碘化钾,搅拌均匀,回流反应4小时以上,待薄层色谱检测原料消失,冷却至室温,将反应液倒入水中,析出固体,过滤,固体用乙醇重结晶,得60.7mg棕色固体,即i1。熔点:225
‑
226℃;1h nmr(600mhz,acetone
‑
d6)δ10.93(brs,1h),8.11(d,j=7.7hz,1h),8.07(d,j=7.6hz,1h),8.05
–
8.00(m,1h),7.97(t,j=7.6hz,1h),7.00(s,1h),4.84(s,2h),2.17(s,3h).
13
c nmr(151mhz,acetone)δ168.1,158.4,158.2,144.8,137.9,135.6,134.9,127.0,125.1,121.1,110.5,38.1,21.9.hrms m/z calcd for c
13
h
11
n3o4s2(m na)
360.0083;found 360.0089.
[0076]
具体实施例2:以合成化合物i3为例,介绍步骤s2、s3的合成:
[0077][0078]
将61.8mg化合物ii和127.8mg磷酸氢二钠加入到10ml四氢呋喃中,剧烈搅拌形成混悬液,冰浴下缓慢滴加含有29.7mg丙烯酰氯的四氢呋喃溶液,反应6小时以上,待薄层色谱检测原料消失,减压蒸馏除去溶剂,所得残余物用乙酸乙酯和饱和氯化铵溶液萃取两次,有机相用饱和氯化铵溶液洗涤两次,合并有机相,无水硫酸钠干燥后减压蒸馏除去溶剂,所得固体经柱层析纯化,得54.3mg白色固体,即ivc。1h nmr(500mhz,chloroform
‑
d)δ9.68(brs,1h),6.98(s,1h),6.55(d,j=16.9hz,1h),6.30(dd,j=17.0,10.4hz,1h),5.92(d,j=10.8hz,1h),4.58(s,2h).
[0079]
将40.2mg ivc溶于n,n
‑
二甲基甲酰胺中,加入102mg糖精钠,搅拌均匀,常温反应12个小时以上,待薄层色谱检测原料消失,将反应液倒入水中,析出固体,过滤,固体用乙醇重结晶,得63.5mg白棕色固体,即i3。熔点:152
‑
154℃;1h nmr(500mhz,acetone
‑
d6)δ11.34(brs,1h),8.17(dd,j=15.7,7.6hz,2h),8.10(d,j=7.6hz,1h),8.05(d,j=7.1hz,1h),6.64(dd,j=17.0,10.2hz,1h),6.50(dd,j=17.0,1.5hz,1h),5.90(dd,j=10.2,1.5hz,1h),4.95(s,2h).
13
c nmr(126mhz,acetone)δ163.0,158.5,158.1,145.2,137.9,135.6,134.9,129.5,128.8,127.0,125.1,121.1,111.3,38.1.hrms m/z calcd for c
14
h
11
n3o4s2(m na)
372.0083;found 372.0074.
[0080]
具体实施例3:以合成化合物i8为例,介绍步骤s2、s3的合成:
[0081][0082]
将61.8mg化合物ii和60mg碳酸氢钾加入到15ml二氧六环中,剧烈搅拌形成混悬液。再将61.2mg对甲氧基苯甲酰氯溶于10ml n,n
‑
二甲基甲酰胺中,冰浴下缓慢滴加至上述
混悬液中,待薄层色谱检测原料消失,将反应液倒入水中,用乙酸乙酯萃取2次,有机相用饱和食盐水洗涤两次,合并有机相,无水硫酸钠干燥后减压蒸馏除去溶剂,所得固体经柱层析纯化,得73.6mg白色固体,即ivh。1h nmr(500mhz,chloroform
‑
d)δ8.02(d,j=8.9hz,2h),7.01(d,j=8.9hz,2h),6.95(s,1h),4.58(s,2h),3.89(d,j=1.6hz,3h).
[0083]
将56.4mg ivh溶于丙酮中,加入102mg糖精钠,搅拌均匀,回流反应4个小时以上,待薄层色谱检测原料消失,减压脱去溶剂,残余物用二氯甲烷萃取,有机相用饱和食盐水洗涤两次,减压脱去溶剂,得淡黄色固体,乙醇重结晶,得78.6mg淡黄色,固体即i8。熔点:214
‑
216℃;1h nmr(500mhz,chloroform
‑
d)δ8.07(d,j=7.2hz,1h),7.89(d,j=8.7hz,2h),7.87
–
7.93(m,3h),7.04(s,1h),6.97(d,j=8.9hz,2h),4.91(s,2h),3.87(s,3h).
13
c nmr(126mhz,cdcl3)δ164.0,163.4,158.9,144.2,137.8,134.9,134.4,129.4,127.2,125.4,123.9,121.1,114.3,112.5,55.5,38.4.hrms m/z calcd for c
19
h
15
n3o5s2(m na)
452.0345;found 452.0345
[0084]
具有通式(i)所示的其中15种化合物的杀菌活性测试实验:
[0085]
实验方法:将供试药剂(15种化合物)在无菌条件下溶解于二甲亚砜中,配制成所需浓度的溶液。然后各吸取1ml药液注入培养皿内,再分别加入9ml培养基,摇匀后制成所需实验浓度(mg/l)的含药平板,以添加1ml二甲亚砜的平板做空白对照。用直径4mm的打孔器沿菌丝外缘切取菌盘,将培养皿放在25℃恒温培养箱内培养。48小时后记录各处理菌盘扩展直径,求取平均值,与空白试验对照比较,计算相对抑菌率。每个样品在同一实验浓度下重复三次,求平均值。
[0086]
抑菌率(%)=(1
‑
处理组菌盘扩展平均直径/对照组菌盘扩展平均直径)
×
100%。
[0087]
以商品化的杀菌剂恶霉灵和拌种灵为对照,杀菌结果见下表1:
[0088]
表1
[0089][0090]
从表1的杀菌实验结果中可知,在50mg/l浓度下,本发明提供的n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物对黄瓜灰霉病菌均具有一定抑制作用。优选的,在20mg/l和50m g/l质量浓度下,化合物i8对黄瓜灰霉病菌的生长抑制率高于75%。
[0091]
在50mg/l质量浓度下,部分n
‑
取代
‑2‑
氨基
‑4‑
糖精取代甲基噻唑类化合物对玉米弯孢菌叶斑病菌和水稻纹枯病菌具有一定抑制作用。优选的,在20mg/l和50mg/l质量浓度下,化合物i3对玉米弯孢菌叶斑病菌和水稻纹枯病菌的生长抑制率高于50%。
[0092]
化合物i3及化合物i8对不同菌株半数抑制浓度(ic
50
)的计算:
[0093]
采用上述杀菌活性测试实验方法进一步测定化合物i3及化合物i8在0.5mg/l、1mg/l、2.5mg/l、5mg/l、10mg/l、20mg/l及50mg/l条件下对黄瓜灰霉病菌、玉米弯孢菌叶斑病菌和水稻纹枯病菌的抑制率,并根据实验浓度下相应的抑制率计算出ic
50
(mg/l),结果见下表2:
[0094]
表2
[0095][0096]
本发明选取具有高杀菌活性化合物i3和化合物i8进一步测定其对黄瓜灰霉病菌、玉米弯孢菌叶斑病菌和水稻纹枯病菌的ic
50
。从上表2的结果可以看出,i8对黄瓜灰霉病菌的ic
50
为1.1mg/l,低于商品化杀菌剂恶霉灵及拌种灵。i3对玉米弯孢菌叶斑病菌和水稻纹枯病菌的ic
50
分别为15.0mg/l和12.9mg/l,均低于商品化杀菌剂恶霉灵。
[0097]
以上数据说明,本发明提供的含有n
‑
取代
‑2‑
氨基
‑4‑
糖精类化合物具有很好的杀菌活性,在很低的剂量下就可以获得很好的杀菌效果,在农用化学品领域具有非常大的潜在应用价值。
[0098]
在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详细描述的部分,可以参见其他实施例的相关描述。
[0099]
以上所述,为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。