2
β
‑
叠氮甲基青霉烷酸二苯甲酯、他唑巴坦中间体及他唑巴坦三者的制备方法
技术领域
1.本发明涉及药物的制备技术领域,具体而言,涉及一种2β
‑
叠氮甲基青霉烷酸二苯甲酯、他唑巴坦中间体及他唑巴坦三者的制备方法。
背景技术:
2.他唑巴坦(tazobactam),化学名:3
‑
甲基
‑7‑
氧代
‑3‑
(1h
‑
1,2,3,
‑
三唑
‑1‑
亚甲基)
‑4‑
硫杂
‑1‑
氮杂双环[3.2.0]庚烷
‑2‑
羧酸
‑
4,4
‑
二氧化物,是日本大鹏制药公司开发的新型青霉烷砜类β
‑
内酰胺酶抑制剂。他唑巴坦是目前公认的抗菌谱最广、抗性最好、临床应用效果最好、最具有前途的β
‑
内酰胺酶抑制剂。他唑巴坦对于腹腔、呼吸道、尿路以及皮肤组织等感染有很强的疗效,在儿科、烧伤、血液病等方面也有明显的治疗效果。它的结构是在舒巴坦的基础上增加一个三氮唑环,以提高抑酶效果,它是目前临床效果最佳的β
‑
内酰胺酶抑制剂,具有稳定性高、活性低、毒性低、抑酶活性强等特点。1992年,他唑巴坦的复方药物他唑巴坦/哌拉西林(1:8)首次在法国上市,用于治疗多种细菌感染。
[0003]
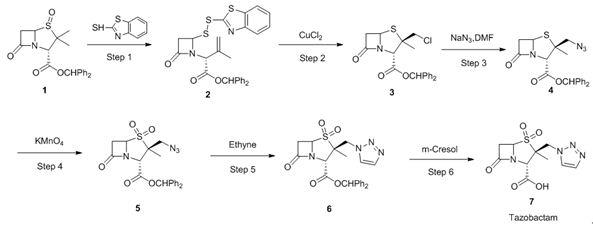
目前,他唑巴坦的合成根据所采用原材料不同,主要有三条合成工艺,分别以舒巴坦、青霉素g钾盐和6
‑
氨基青霉烷酸(6
‑
apa)为起始原材料。其中,尤其以6
‑
氨基青霉烷酸(6
‑
apa)为起始原料合成他唑巴坦的研究最为活跃。这条工艺路线主要包括青霉烷酸二苯甲酯经历开环形成二硫键、氯甲基化、上三氮唑、硫醚氧化合成砜、以及脱保护得到最终产物他唑巴坦。但是,由于氯甲基化后的氯代物稳定性差,所以在上三氮唑的反应中需要大大过量的三氮唑,且此步收率不高,造成原料成本明显提高,经济效益差。因此,在目前工业放大合成他唑巴坦的策略上,普遍采用原位合成三氮唑,主要改变是在氯甲基化后,以叠氮化钠为反应物实现叠氮化,随后通过click反应实现三氮唑的构建。具体路线如下:
在以上合成路线中,化合物2β
‑
叠氮甲基青霉烷酸二苯甲酯4是最关键的中间体之一,其分子式为c
21
h
20
n4o3s,分子量为408.48,结构式如下所示:在专利申请公布号为cn103254214a的中国专利申请中报道过以双硫开环物2作为原料,经历一步环化氯代得到2β
‑
氯甲基青霉烷酸二苯甲酯中间体3,随后和叠氮化钠反应得到五元环的2β
‑
叠氮甲基青霉烷酸二苯甲酯4。根据文献报道和实验验证,step
‑
3叠氮化过程根据反应机理会生成六元环异构体,且目标产物五元环和其异构体六元环的比例高达3:2,选择性非常差,因此步理论反应收率也只有60%,从而导致整条路线的总收率很低,生产成本明显增加。进一步地,产品和异构体进行分离比较困难,普通的析晶、重结晶以及柱层析等分离方法都不能得到纯的产品,只能在step
‑
5氧化后才能根据二者溶解性的差别将异构体除去,这样一来,就大大增加了step
‑
5氧化剂高锰酸钾等其它物料的用量,导致三废以及生产成本的进一步增加。
[0004]
其中,step
‑
3的反应机理如下:。
技术实现要素:
[0005]
本发明的主要目的在于提供一种2β
‑
叠氮甲基青霉烷酸二苯甲酯、他唑巴坦中间体及他唑巴坦三者的制备方法,以解决现有技术中合成他唑巴坦的方法存在收率低、成本高的问题。
[0006]
为了实现上述目的,根据本发明的一个方面,提供了一种2β
‑
叠氮甲基青霉烷酸二苯甲酯的制备方法,该制备方法包括:将包括双硫开环化合物、叠氮源、氧化剂的反应原料在溶剂中进行自由基反应,得到包括2β
‑
叠氮甲基青霉烷酸二苯甲酯的产物体系,其中,双
硫开环化合物的结构式为,氧化剂使得叠氮源产生叠氮自由基。
[0007]
进一步地,上述氧化剂选自醋酸碘苯、硝酸铈铵、过硫酸铵、5%~50%的双氧水、叔丁基过氧化氢、过硫酸钾、过氧单硫酸钾、过氧化脲中的任意一种或多种。
[0008]
进一步地,上述叠氮源选自叠氮基三甲基硅烷、叠氮化钠、叠氮化钾、叠氮磷酸二苯酯中的任意一种或多种。
[0009]
进一步地,上述叠氮源与所双硫开环化合物的摩尔比为1~3:1。
[0010]
进一步地,上述氧化剂与叠氮源的摩尔比为1~2:1。
[0011]
进一步地,上述自由基反应的温度为
‑
20~20℃,自由基反应的时间为1~24h。
[0012]
进一步地,上述溶剂为极性溶剂和/或非极性溶剂,极性溶剂选自四氢呋喃、2
‑
甲基四氢呋喃、1,4
‑
二氧六环、乙二醇二甲醚、二乙二醇二甲醚、丙酮、乙腈、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、n,n
‑
二乙基甲酰胺、n
‑
甲基吡咯烷酮、二甲基亚砜、甲醇、乙醇、异丙醇、二氯甲烷、乙二醇、六甲基磷酸三胺、吡啶、环己醇、邻甲酚、碳酸二乙酯、草酸二乙酯吗啉、丙二酸二乙酯、二乙二醇二乙醚以及氯仿中的任意一种或多种,非极性溶剂选自苯、甲苯、二甲苯、联苯、苯酚、间二甲苯、邻二甲苯、二苯醚、环己酮、环己醇、邻甲酚、正十八烷烃、正二十烷以及硅油中的任意一种或多种;溶剂的体积与双硫开环物的质量比为1~50ml:1g。
[0013]
进一步地,上述反应原料还包括能够促进自由基反应进行的添加剂,添加剂与所双硫开环化合物的摩尔比为0.2~2.0:1。
[0014]
进一步地,上述添加剂包括无机盐和/或有机盐,无机盐包括卤化盐和/或硫酸盐,卤化盐选自氯化锌、氯化铁、氯化亚铁、氯化锰、氯化锂、溴化锌、溴化铁、溴化亚铜、溴化镍、溴化铁、溴化亚铁、碘化亚酮、碘化锂中的任意一种或多种,硫酸盐选自硫酸镍、硫酸铜、硫酸镍、硫酸钴、硫酸铁、硫酸亚铁中的任意一种或多种,有机盐选自三乙酰丙酮铁、三乙酰丙酮亚铁、三氟甲基磺酸铁、三氟甲基磺酸亚铁、三氟甲基磺酸钯、三氟甲基磺酸铝、三氟甲基磺酸锰、三氟甲基磺酸钪中的任意一种或多种。
[0015]
根据本发明的另一个方面,提供了一种他唑巴坦中间体的制备方法,该他唑巴坦中间体的结构式为:该制备方法包括制备2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程,以及以2β
‑
叠氮甲基青霉烷酸二苯甲酯为中间体经过硫醚氧化得到他唑巴坦中间体的过程,制备2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程包括上述的制备方法。
[0016]
根据本发明的又一个方面,提供了一种他唑巴坦的制备方法,该制备方法包括制备2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程,以2β
‑
叠氮甲基青霉烷酸二苯甲酯为中间体经过
硫醚氧化合成砜以及脱保护得到他唑巴坦的过程,制备2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程包括上述的制备方法。
[0017]
应用本发明的技术方案,氧化剂使得叠氮源产生叠氮自由基,通过叠氮自由基对双硫开环化合物的碳碳双键进行自由基加成,随后分子内自由基取代成功实现了由双硫开环化合物直接到2β
‑
叠氮甲基青霉烷酸二苯甲酯的高效、高选择性的合成。由于自由基加成的位点在双硫开环化合物碳碳双键的端位上,从而可以很好地避免六元环异构体的产生,明显提高五元环2β
‑
叠氮甲基青霉烷酸二苯甲酯的转化率,与目前工业生产使用的路线相比,该策略不但缩短了反应步骤,而且大大提高了目标产物2β
‑
叠氮甲基青霉烷酸二苯甲酯的选择性,从而明显提高了2β
‑
叠氮甲基青霉烷酸二苯甲酯的反应收率,降低了生产成本。进一步地,2β
‑
叠氮甲基青霉烷酸二苯甲酯作为合成他唑巴坦的关键中间体,提高了他唑巴坦的收率,降低了成本。
具体实施方式
[0018]
需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
[0019]
如背景技术所分析的,现有技术中合成他唑巴坦的方法存在收率低、成本高的问题,为解决该问题,本发明提供了一种2β
‑
叠氮甲基青霉烷酸二苯甲酯、他唑巴坦中间体及他唑巴坦三者的制备方法。
[0020]
在本技术的一种典型的实施方式中,提供了一种2β
‑
叠氮甲基青霉烷酸二苯甲酯的制备方法,该制备方法包括:将包括双硫开环化合物、叠氮源、氧化剂的反应原料在溶剂中进行自由基反应,得到包括2β
‑
叠氮甲基青霉烷酸二苯甲酯的产物体系,其中,双硫开环化合物的结构式为,氧化剂使得叠氮源产生叠氮自由基。
[0021]
氧化剂使得叠氮源产生叠氮自由基,通过叠氮自由基对双硫开环化合物的碳碳双键进行自由基加成,随后分子内自由基取代成功实现了由双硫开环化合物直接到2β
‑
叠氮甲基青霉烷酸二苯甲酯的高效、高选择性的合成。由于自由基加成的位点在双硫开环化合物碳碳双键的端位上,从而可以很好地避免六元环异构体的产生,明显提高五元环2β
‑
叠氮甲基青霉烷酸二苯甲酯的转化率,与目前工业生产使用的路线相比,该策略不但缩短了反应步骤,而且大大提高了目标产物2β
‑
叠氮甲基青霉烷酸二苯甲酯的选择性,从而明显提高了2β
‑
叠氮甲基青霉烷酸二苯甲酯的反应收率,降低了生产成本。进一步地,2β
‑
叠氮甲基青霉烷酸二苯甲酯作为合成他唑巴坦的关键中间体,提高了他唑巴坦的收率,降低了成本。
[0022]
在本技术的一些实施例中,上述氧化剂选自醋酸碘苯、硝酸铈铵、过硫酸铵、5%~50%的双氧水、叔丁基过氧化氢、过硫酸钾、过氧单硫酸钾、过氧化脲中的任意一种或多种。
[0023]
氧化剂的作用是将叠氮源氧化为叠氮自由基,以通过叠氮自由基对双硫开环化合物碳碳双键的端位上进行自由基加成反应,这一步决定了叠氮自由基加成到双硫开环化合物的位置,从而提高了2β
‑
叠氮甲基青霉烷酸二苯甲酯的高选择性,优选上述种类的氧化剂
以尽可能快速地促进叠氮源释放叠氮自由基的速度,从而提高了2β
‑
叠氮甲基青霉烷酸二苯甲酯的生成速度。
[0024]
用于本技术的叠氮源用于在氧化剂作用下形成叠氮自由基,因此在氧化作用下可以形成叠氮自由基的叠氮化合物均可考虑应用至本技术。为了便于叠氮源在形成叠氮自由基的同时,形成的生成物的分离,在本技术的一些实施例中,上述叠氮源选自叠氮基三甲基硅烷、叠氮化钠、叠氮化钾、叠氮磷酸二苯酯中的任意一种或多种。一方面,上述种类的叠氮源更有利于在以上氧化剂的作用下,将叠氮自由基快速的释放出来;另一方面,叠氮源产生叠氮自由基后,所形成的生成物占比较小且分离较为容易。
[0025]
为了提高加成转化率,在本技术的一些实施例中,上述叠氮源与双硫开环化合物的摩尔比为1~3:1,优选为1~2:1。其中,当硝酸铈铵与叠氮钠或叠氮钾组合使用时,优选叠氮源与双硫开环化合物的摩尔比为2:1,醋酸碘苯与叠氮基三甲基硅烷组合使用时,优选叠氮源与双硫开环化合物的摩尔比为1.1:1。从而尽可能地使不同的叠氮源在不同的氧化剂作用下能够产生足够与双硫开环化合物反应的叠氮自由基。
[0026]
当采用硝酸铈铵作为氧化剂时,叠氮钠和叠氮钾形成叠氮自由基的效率均较高,但叠氮钠和叠氮钾均为剧毒物质,因此应用时应做好安全防护措施;叠氮基三甲基硅烷相对于叠氮钠和叠氮钾的安全性更高,且当采用醋酸碘苯作为氧化剂与叠氮基三甲基硅烷组合使用更容易将叠氮基三甲基硅烷中的叠氮自由基释放出来。优选上述氧化剂与叠氮源的摩尔比为1~2:1。一方面尽可能减少物料的浪费以及分离困难,另一方面有利于提高叠氮源与氧化剂的协统同配合作用,从而快速高效的生成相应的叠氮自由基。
[0027]
优选上述自由基反应的温度为
‑
20~20℃,自由基反应的时间为1~24h,优选自由基反应的温度为0~5℃,自由基反应的时间为6~20h。从而有利于减少副反应产物的生成,提高上述自由基反应的效率。
[0028]
在本技术的一种实施例中,上述溶剂为极性溶剂和/或非极性溶剂,优选极性溶剂选自四氢呋喃、2
‑
甲基四氢呋喃、1,4
‑
二氧六环、乙二醇二甲醚、二乙二醇二甲醚、丙酮、乙腈、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、n,n
‑
二乙基甲酰胺、n
‑
甲基吡咯烷酮、二甲基亚砜、甲醇、乙醇、异丙醇、二氯甲烷、乙二醇、六甲基磷酸三胺、吡啶、环己醇、邻甲酚、碳酸二乙酯、草酸二乙酯吗啉、丙二酸二乙酯、二乙二醇二乙醚以及氯仿中的任意一种或多种,优选非极性溶剂选自苯、甲苯、二甲苯、联苯、苯酚、间二甲苯、邻二甲苯、二苯醚、环己酮、环己醇、邻甲酚、正十八烷烃、正二十烷以及硅油中的任意一种或多种;优选溶剂的体积与双硫开环物的质量比为1~50ml:1g,优选为10~20 ml:1g。
[0029]
溶剂作为反应的一种介质,有利于使反应原料分子溶解于其中,从而使反应原料分子之间接触、碰撞的几率提高,进而促进反应的进行,提高反应效率。优选上述种类的溶剂并将溶剂的用量控制在上述范围内,有利于进一步地提高叠氮自由基与双硫开环化合物之间的自由基加成反应的效率。
[0030]
上述反应原料还包括能够促进自由基反应进行的添加剂,添加剂与所双硫开环化合物的摩尔比为0.2~2.0:1,优选为0.8~1.5:1。
[0031]
上述叠氮自由基与双硫开环化合物的碳碳双键之间进行自由基加成反应的过程是关键的一步,其反应的速率和选择性决定了该步骤生成2β
‑
叠氮甲基青霉烷酸二苯甲酯的收率和速率,优选加入一些添加剂并控制添加剂的量在上述范围内有利于尽可能地提高
上述自由基加成反应的转化率,并同时抑制一些副产物的生成。
[0032]
添加剂通常是通过添加剂的酸碱性以及添加剂分子上的基团或离子特性来促进反应的进行,为进一步地提高添加剂对本技术叠氮自由基与双硫开环化合物的碳碳双键之间进行自由基加成反应的效率和效果,优选上述添加剂包括无机盐和/或有机盐,优选上述无机盐包括卤化盐和/或硫酸盐,进一步地,优选卤化盐选自氯化锌、氯化铁、氯化亚铁、氯化锰、氯化锂、溴化锌、溴化铁、溴化亚铜、溴化镍、溴化铁、溴化亚铁、碘化亚酮、碘化锂中的任意一种或多种,优选硫酸盐选自硫酸镍、硫酸铜、硫酸镍、硫酸钴、硫酸铁、硫酸亚铁中的任意一种或多种,优选有机盐选自三乙酰丙酮铁、三乙酰丙酮亚铁、三氟甲基磺酸铁、三氟甲基磺酸亚铁、三氟甲基磺酸钯、三氟甲基磺酸铝、三氟甲基磺酸锰、三氟甲基磺酸钪中的任意一种或多种。
[0033]
在本技术的另一种典型的实施方式中,提供了一种他唑巴坦中间体的制备方法,该他唑巴坦中间体的结构式为:该制备方法包括制备2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程,以及以2β
‑
叠氮甲基青霉烷酸二苯甲酯为中间体经过硫醚氧化得到他唑巴坦中间体的过程,制备2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程包括上述的制备方法。
[0034]
在上述的制备方法制备得到2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程中,由于氧化剂使得叠氮源产生叠氮自由基,叠氮自由基对双硫开环化合物的自由基加成位点在双硫开环化合物碳碳双键的端位上,从而可以很好地避免六元环异构体的产生,明显提高五元环2β
‑
叠氮甲基青霉烷酸二苯甲酯的转化率,与目前工业生产使用的路线相比,该策略不但缩短了反应步骤,而且大大提高了目标产物2β
‑
叠氮甲基青霉烷酸二苯甲酯的选择性,从而明显提高了2β
‑
叠氮甲基青霉烷酸二苯甲酯的反应收率,降低了生产成本。进一步地,提高了以该2β
‑
叠氮甲基青霉烷酸二苯甲酯经过硫醚氧化得到他唑巴坦中间体的收率,降低了成本。
[0035]
在本技术的又一种典型的实施方式中,提供了一种他唑巴坦的制备方法,该制备方法包括制备2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程,以2β
‑
叠氮甲基青霉烷酸二苯甲酯为中间体经过硫醚氧化合成砜、以及脱保护得到他唑巴坦的过程,该制备2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程包括上述的制备方法。
[0036]
在上述的制备方法制备得到2β
‑
叠氮甲基青霉烷酸二苯甲酯的过程中,由于氧化剂使得叠氮源产生叠氮自由基,叠氮自由基对双硫开环化合物的自由基加成位点在双硫开环化合物碳碳双键的端位上,从而可以很好地避免六元环异构体的产生,明显提高五元环2β
‑
叠氮甲基青霉烷酸二苯甲酯的转化率,与目前工业生产使用的路线相比,该策略不但缩短了反应步骤,而且大大提高了目标产物2β
‑
叠氮甲基青霉烷酸二苯甲酯的选择性,从而明显提高了2β
‑
叠氮甲基青霉烷酸二苯甲酯的反应收率,降低了生产成本。进一步地,该2β
‑
叠氮甲基青霉烷酸二苯甲酯中间体经过硫醚氧化合成砜以及脱保护得到他唑巴坦的过程提
高了他唑巴坦的收率,降低了成本。
[0037]
以下将结合具体实施例和对比例,对本技术的有益效果进行说明。
[0038]
以下实施例中,所用的双硫开化合物均采用以下方法制备:室温下,向装有分水器的四口瓶中加入甲苯(975 ml),然后向体系中依次加入2
‑
巯基苯并噻唑(28.92 g,172.90 mmol,1.02 eq)和青霉烷亚砜酸二苯甲酯1(65 g,169.51 mmol,1.0 eq),然后体系升温至120 ℃回流分水2h,原料反应完毕,体系快速降温至室温,产品hplc纯度为96%,体系外标收率为95%,然后控温30~40 ℃进行减压浓缩至无馏分后直接用于下一步反应。
[0039]
实施例1室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(30 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌6h原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,滤液用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,有机相检测hplc外标,体系外标收率85%,中间体4(2β
‑
叠氮甲基青霉烷酸二苯甲酯)产品hplc纯度为95%,控温30~40 ℃进行减压浓缩至无馏分后直接用于下一步反应。中间体4的核磁氢谱数据为1h
‑
nmr (400 mhz, cdcl3): δ= 1.23 (s, 3h,), 3.11 (dd, 1h), 347 (s, 2h), 3.59 (dd, 1h), 4.68 (s, 1h), 5.37 (dd, 1h ), 6.93 (s,1h), 7.28
‑
7.48 (m, 10h)。
[0040]
制备中间体5:
4.79 (s, 1h), 3.31
ꢀ–ꢀ
3.72 (m, 2h), 1.34 (s, 3h)。
[0045]
实施例2室温下,将双硫开环化合物2(10 g,18.77 mmol) 溶解于乙腈(150 ml)中搅拌澄清,然后加入10ml叠氮钠水溶液(2.24 g,37.54 mmol,2 eq)和10ml氯化锌水溶液(512 mg,3.75 mmol,0.2 eq),体系降温至0 ℃,搅拌30min后向体系中缓慢滴加硝酸铈铵(20.58 g,37.54 mmol,2 eq)与水(30 ml)的混合溶液,过程控制体系温度在0 ℃,反应过程中有放气和放热现象出现。滴毕,体系在此温度下保温搅拌60min原料反应完毕,体系为红色浑浊,过滤除去双噻唑副产物后,滤液用10%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,有机相检测hplc外标,体系外标收率86%,中间体4产品hplc纯度为95%,直接用于后续的反应。
[0046]
中间体4的核磁氢谱数据为1h
‑
nmr (400 mhz, cdcl3): δ= 1.23 (s, 3h,), 3.11 (dd, 1h), 347 (s, 2h), 3.59 (dd, 1h), 4.68 (s, 1h), 5.37 (dd, 1h ), 6.93 (s,1h), 7.28
‑
7.48 (m, 10h)。
[0047]
制备中间体5:在冰水浴条件下,将中间体4 ( 7 g,17.13mol)溶剂于冰醋酸(70 ml)和纯化水(7 ml)中,缓慢加入高锰酸钾(4.06g,25.71mmol),加入完成后撤去冰浴,在常温条件中反应4h后,原料反应完毕,体系为红褐色,将反应体系倒入冰水(210 ml)后,用二氯甲烷溶剂并且萃取两次,合并有机相用碳酸氢钠溶液和饱和食盐水洗涤一次,有机相检测hplc外标,体系外标为90%,中间体5产品hplc纯度为95%,控温30~40 ℃进行减压浓缩至无馏分后直接用于下一步反应。中间体5的核磁氢谱数据为1h
‑
nmr (400 mhz, dmso
‑
d): δ= 1.15 (s, 3h), 3.33(dd, 1h), 3.77 (dd, 1h), 4.94 (dd, 1h), 5.29 (dd, 1h), 5.25 (s, 1h), 5.26 (s, 1h), 6.99 (s, 1h), 7.29
‑
7.52 (m, 10h), 7.77(s, 2h), 7.95 (s, 2h)。
[0048]
制备中间体6:在室温条件下,将中间体5(5g,11.37mmol)溶解于乙腈(50 ml)中,反应体系中加入氯化亚铜(0.22g,2.27mmol)通入乙炔气体在50度条件下搅拌1h,原料反应完毕,将体系通过硅胶层过滤,有机相检测hplc外标,体系外标为90%,产品hplc纯度为95%,控温30~40 ℃进行减压浓缩至无馏分后直接用于下一步反应。
[0049]
他唑巴坦二苯甲酯6的核磁氢谱数据:1h nmr (400 mhz, dmso
‑
d6) δ 7.95 (d, j = 1.1 hz, 1h), 7.77 (d, j = 1.1 hz, 1h), 7.56
ꢀ–ꢀ
7.27 (m, 10h), 6.99 (s, 1h), 5.33
ꢀ–ꢀ
5.23 (m, 3h), 4.96 (d, j = 15.4 hz, 1h), 3.37
ꢀ–ꢀ
3.29 (m, 2h), 1.13 (s, 3h)。
[0050]
制备他唑巴坦7:在室温条件下,将中间体6(5g,10.71mmol)加入到间甲酚(20 ml)中,加热至45℃后,搅拌底物完全溶解后,继续反应1h至原料反应完毕,体系为红色。体系快速降低至15℃以下,加入7~8%的碳酸氢钠水溶液(15 ml,3v),继续搅拌30~45min;然后向体系中加入乙酸乙酯(50 ml,10v)搅拌5~15min。体系在0~10 ℃静置,分液,保持温度在0~10 ℃,有机相再用7~8%的碳酸氢钠水溶液(0.3v)萃取一次,合并水相,水相降温至0~5℃,缓慢滴加6m 盐酸调节ph=1~2,有白色固体析出,0 ℃搅拌1小时后过滤,水洗滤饼,滤饼室温下氮气吹干,他唑巴坦7固体hplc纯度为98%,分离收率为80%。
[0051]
他唑巴坦7的核磁氢谱数据:1h nmr (400 mhz, dmso
‑
d6) δ 8.09 (d, j = 1.1 hz, 1h), 7.79 (d, j = 1.1 hz, 1h), 5.21 (m, 1h), 4.96 (d, j = 15.5 hz, 2h), 4.79 (s, 1h), 3.31
ꢀ–ꢀ
3.72 (m, 2h), 1.34 (s, 3h)。
[0052]
实施例3实施例3与实施例1的区别在于,phi(oac)2固体的加入量为1.5 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0053]
实施例4实施例4与实施例1的区别在于,phi(oac)2固体的加入量为2 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0054]
实施例5实施例5与实施例1的区别在于,phi(oac)2固体的加入量为0.5 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0055]
实施例6实施例6与实施例1的区别在于,phi(oac)2固体的加入量为4 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0056]
实施例7实施例7与实施例1的区别在于,phi(oac)2固体的加入量为0.4 eq,最终得到包含
中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0057]
实施例8实施例8与实施例1的区别在于,phi(oac)2固体的加入量为1.1 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0058]
实施例9实施例9与实施例1的区别在于,phi(oac)2固体的加入量为2.2 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0059]
实施例10实施例10与实施例1的区别在于,phi(oac)2固体的加入量为0.9 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0060]
实施例11实施例11与实施例1的区别在于,phi(oac)2固体的加入量为2.5 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0061]
实施例12实施例12与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至0 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(30 ml)的混合溶液,过程控制体系温度在0 ℃。滴毕,体系在此温度下保温搅拌6h原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0062]
实施例13实施例13与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至20 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(30 ml)的混合溶液,过程控制体系温度在20 ℃。滴毕,体系在此温度下保温搅拌6h原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0063]
实施例14实施例14与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至
‑
20 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(30 ml)的混合溶液,过程控制体系温度在
‑
20 ℃。滴毕,体系在此温度下保温搅拌
6h原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0064]
实施例15实施例15与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(30 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌20h原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0065]
实施例16实施例16与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(30 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌24h原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0066]
实施例17实施例17与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(30 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌1h原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0067]
实施例18实施例18与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于1,4
‑
二氧六环(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(30 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌30min原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0068]
实施例19实施例19与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于环己酮(70 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢
呋喃(30 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌30min原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0069]
实施例20实施例20与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(140 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(60 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌30min原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0070]
实施例21实施例21与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(7 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(3 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌30min原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0071]
实施例22实施例22与实施例1的区别在于,室温下,将双硫开化合物2(10 g,18.77 mmol) 溶解于四氢呋喃(350 ml)中搅拌澄清,然后加入phi(oac)2固体(4.84 g,15.02 mmol,0.8 eq),体系降温至5 ℃,然后向体系中缓慢滴加tms
‑
n3(2.38 g,20.65 mmol,1.1 eq)与四氢呋喃(150 ml)的混合溶液,过程控制体系温度在5 ℃。滴毕,体系在此温度下保温搅拌30min原料反应完毕,体系为红褐色浑浊,过滤除去双噻唑副产物后,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0072]
实施例23实施例23与实施例2的区别在于,氯化锌水溶液的加入量为0.8 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0073]
实施例24实施例24与实施例2的区别在于,氯化锌水溶液的加入量为1.2 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0074]
实施例25实施例25与实施例2的区别在于,氯化锌水溶液的加入量为1.5 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接
用于后续的反应,最后得到他唑巴坦。
[0075]
实施例26实施例26与实施例2的区别在于,氯化锌水溶液的加入量为2 eq,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0076]
实施例27实施例27与实施例2的区别在于,添加剂为0.2 eq氯化铁水溶液,最终得到包含中间体4的滤液,用10wt%硫代硫酸钠水溶液淬灭后,加入二氯甲烷(50 ml)进行分液,直接用于后续的反应,最后得到他唑巴坦。
[0077]
第二步的放大化反应实施例1:双硫开化合物2扩大为1kg,其余原料的用量也以相应的比例放大,并在实施例1的反应条件下进行反应,最终得到包含中间体4的滤液,滤液用硫代硫酸钠水溶液淬灭后,加入二氯甲烷进行分液,有机相检测hplc外标,体系外标收率84.8%,产品hplc纯度为95.1%,可直接用于下一步氧化反应。
[0078]
第二步的放大化反应实施例2:双硫开化合物2扩大为1kg,其余原料的用量也以相应的比例放大,并在实施例2的反应条件下进行反应,最终得到包含中间体4的滤液,滤液用硫代硫酸钠水溶液淬灭后,加入二氯甲烷进行分液,有机相检测hplc外标,体系外标收率91.5%,产品hplc纯度为96.1%,可直接用于下一步氧化反应。
[0079]
由此说明利用本技术的方法以双硫开化合物2制备中间体4的反应可以放大化生产,具有重大的工业应用价值。
[0080]
对比例1对比例1与实施例1的区别在于,采用双硫开化合物2与氯化铜制备2β
‑
氯代甲基青霉烷酸二苯甲酯中间体后,通过加入叠氮钠反应后得到中间体4,其路线为室温下,向双硫开化合物2(20g,37.51mmol)中加入溶剂dcm(200 ml,10v),搅拌溶解,体系澄清;然后加入无水氯化铜(5.51 g,41.29mmol,1.1eq),体系呈黑色浑浊;体系控温25 ℃继续搅拌5~6h,反应完毕,体系逐渐变为墨绿色浑浊;将体系过滤,滤饼用dcm(3v
×
2)充分浸泡15min后抽滤,合并有机相,依次用5%的碳酸氢钠水溶液和饱和食盐水各洗涤一次,有机相在25℃下减压浓缩得到红褐色浑浊油状物;然后向油状物中加入dmf(180 ml,9v),搅拌溶解,体系澄清;体系中叠氮钠(3.6g,56.31mmol,1.5eq),然后体系升温至30 ℃搅拌2h~4h反应完毕。反应完毕后,将体系在30 ℃下浓缩,水相分别用8v和5v二氯甲烷萃取两次,合并有机相;有机相用纯化水(2v*5)洗涤后于30℃浓缩得到酒红色油状液体,使用甲基叔丁基醚进行析晶,得到目标产物中间体4,两步分离的收率为60%,最终得到他唑巴坦7。
[0081]
通过产品hplc纯度测定和体系外标收率测定实施例1至27、对比例1得到的中间体4和他唑巴坦,并将测试结果列于表1。
[0082]
表1从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:氧化剂使得叠氮源产生叠氮自由基,通过叠氮自由基对双硫开环化合物的碳碳双键进行自由基加成,随后分子内自由基取代成功实现了由双硫开环化合物直接到2β
‑
叠氮甲基青霉烷酸二苯甲酯的高效、高选择性的合成。由于自由基加成的位点在双硫开环化合物碳碳双键的端位上,从而可以很好地避免六元环异构体的产生,明显提高五元环2β
‑
叠氮
甲基青霉烷酸二苯甲酯的转化率,与目前工业生产使用的路线相比,该策略不但缩短了反应步骤,而且大大提高了目标产物2β
‑
叠氮甲基青霉烷酸二苯甲酯的选择性,从而明显提高了2β
‑
叠氮甲基青霉烷酸二苯甲酯的反应收率,降低了生产成本。进一步地,2β
‑
叠氮甲基青霉烷酸二苯甲酯作为合成他唑巴坦的关键中间体,提高了他唑巴坦的收率,降低了成本。
[0083]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。