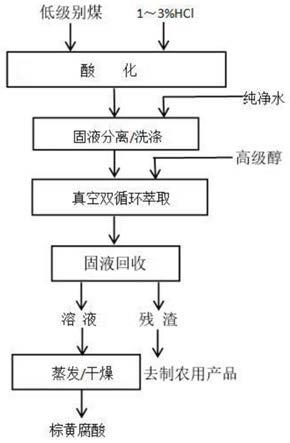
mir
‑
29c
‑
3p抑制物在制备神经干细胞分化的促进药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及mir
‑
29c
‑
3p抑制物在制备神经干细胞向神经元分化的促进药物中的应用。
背景技术:
2.中枢神经系统各种退行性病变的主要病理特征就是功能神经元的丢失,如何能够恢复这部分丢失的神经元一直是中枢神经系统再生的难点和热点。目前的策略主要集中在两个方面:一方面就是采用各种保护方法延缓或减多少功能神经元的丢失,另一个方面就是细胞替代策略。前者在研究疾病发病机制的基础上,通过药物或基因干预手段来保护神经元的丢失,后者则是期望通过促进体内神经元再生或通过移植的方法从而达到替代缺失神经元的目的。但是在细胞替代治疗策略中,如何促进神经干细胞(neural stem cells,nscs)向神经元分化一直是亟待解决的难题,这也是限制这一治疗策略应用的主要原因。
3.微小rna(micro rnas, mirnas)是包含约1825个核普酸的非编码单链小分子rna,调节基因转录后的表达。它们分布广泛,在组织和所有体液中均有分布,包括血浆、血清、尿液、唾液以及脑脊液等。其稳定性高,在血液中和脑脊液中通过脂质体或脂蛋白运输,很少被降解。几乎参与全身所有的生理过程,包括神经元的发生、学习、记忆过程,从而与中枢神经系统退行性疾病有着密切的关联。
4.因此,若能找到影响神经干细胞向神经元分化的关键microrna,则可能成为神经元替代疗法的新靶点,为中枢神经系统各种退行性病变的治疗带来突破。
技术实现要素:
5.本发明的目的是提供mir
‑
29c
‑
3p抑制物在制备神经干细胞向神经元分化的促进药物中的应用。
6.dcx是一种微管相关蛋白,在迁移的有丝分裂后的神经元前体中广泛表达,参与神经元分化的关键蛋白,是神经元前体细胞的主要标志物。本发明通过应用在线软件targetscan(http://www.targetscan.org)分析和预测调控dcx mrna上游mirnas,筛选得到mir
‑
29c
‑
3p(5’uagcaccauuugaaaucgguua3’,seq id no.1)。从而推测mir
‑
29c
‑
3p参与了神经干细胞向神经元分化过程。
7.本发明采用mirna抑制物对mir
‑
29c
‑
3p的表达进行下调,以mir
‑
nc作为对照,将携带有mir
‑
29c
‑
3p抑制物和对照mir
‑
nc的慢病毒分别感染神经干细胞后进行筛选,得到稳定低表达和正常表达mir
‑
29c
‑
3p的神经干细胞系,体外分化培养,观察两种情况下神经元分化情况。结果显示,mir
‑
29c
‑
3p在体外能抑制神经干细胞向神经元分化(p<0.05),低表达mir
‑
29c
‑
3p能明显促进神经干细胞向神经元分化(p<0.05)。
附图说明
8.图1为分化培养后dcx免疫荧光检测结果。其中:a为神经干细胞转染mir
‑
nc或mir
‑
29c
‑
3p抑制物分化培养72小时的dcx免疫荧光实验结果,hoechst染核,标尺=100微米; b为dcx阳性神经元前体细胞比例的统计(均值
±
标准差,* vs. control group,p<0.001;# vs.mir
‑
nc group,p<0.001)。
具体实施方式
9.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
10.实施例1本实施例的体外神经干细胞向神经元分化实验使用大鼠胚胎神经干细胞。
11.本实施例采用mirna抑制物对mir
‑
29c
‑
3p的表达进行下调,以mir
‑
nc作为对照,将携带有mir
‑
29c
‑
3p抑制物和对照mir
‑
nc的慢病毒分别感染神经干细胞后进行筛选,得到稳定低表达和正常表达mir
‑
29c
‑
3p的神经干细胞系,体外分化培养,观察两种情况下神经元分化情况。
12.具体过程如下:1. 神经干细胞培养和mirna抑制物转染1) 神经干细胞系来自赛默飞世尔科技有限公司的gibco rat fetal neural stem cells,培养在5% co2的37℃培养箱中,培养液为加入egf和bfgf(终浓度均为20 ng/ml)和1%青霉素/链霉素的dmem(gibco公司)。
13.2) mir
‑
29c
‑
3p抑制物来自赛默飞世尔科技有限公司,细胞转染利用invitrogen的lipofectamine rnaimax转染试剂,转染步骤按照说明书操作,mirna抑制物浓度为5 纳摩。
14.2. 分化培养及dcx免疫荧光检测:1) 分化培养实验:将神经干细胞及转染mirna抑制物的神经干细胞以1
×
105个/ml的密度接种于预先置入涂有多聚赖氨酸盖玻片的24孔培养板各孔中,加入含10�s的dmem/f12完全培养液2 ml。将24孔培养板置于饱和湿度的37℃、5% co2培养箱中培养,3 d后进行免疫荧光检测。
15.2) dcx免疫荧光检测:在培养3 d后,取上述各组6孔细胞,吸去培养孔中的培养液,加入含4%多聚甲醛的0.01 mol/l pb (ph7.2) 1 ml,室温下固定15 min。吸去多聚甲醛,用0.01 mol/l pbs (ph7.2)清洗3遍,每孔加入200
ꢀµ
l含10%山羊血清的0.01 mol/l pbs (ph7.2),室温下轻轻振摇30 min。吸去上述封闭液,加入1:1000稀释的豚鼠抗dcx 200
ꢀµ
l(abcam公司),室温下轻轻振摇1 h后放入4℃冰箱中过夜。次日晨吸去一抗,用pbs清洗3遍后,加入1:800稀释的alexa fluor
®ꢀ
488山羊抗豚鼠二抗(abcam公司),避光、室温下轻轻振摇2 h,用pbs清洗3遍后,加入1:2000稀释的hoechst(abcam公司)室温避光孵育30 min,pbs充分清洗后甘油磷酸缓冲液封片,荧光显微镜下观察dcx免疫荧光情况。
16.3.统计学处理
应用spss 21.0数据统计软件对数据进行分析。所得计量资料用均值
±
标准差表示,三组间两两比较采用单因素方差分析。以p<0.05认为差异有统计学意义。
17.结果如图1所示,与空白对照组和mir
‑
nc组比较,神经干细胞转染mir
‑
29c
‑
3p抑制物后,向dcx阳性神经元前体细胞分化数量明显增多,单因素方差分析结果显示,组间差异有统计学意义(p<0.05)。* vs.control group,p<0.001;# vs. mir
‑
nc group,p<0.001。
‑
29c
‑
3p抑制物在制备神经干细胞分化的促进药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及mir
‑
29c
‑
3p抑制物在制备神经干细胞向神经元分化的促进药物中的应用。
背景技术:
2.中枢神经系统各种退行性病变的主要病理特征就是功能神经元的丢失,如何能够恢复这部分丢失的神经元一直是中枢神经系统再生的难点和热点。目前的策略主要集中在两个方面:一方面就是采用各种保护方法延缓或减多少功能神经元的丢失,另一个方面就是细胞替代策略。前者在研究疾病发病机制的基础上,通过药物或基因干预手段来保护神经元的丢失,后者则是期望通过促进体内神经元再生或通过移植的方法从而达到替代缺失神经元的目的。但是在细胞替代治疗策略中,如何促进神经干细胞(neural stem cells,nscs)向神经元分化一直是亟待解决的难题,这也是限制这一治疗策略应用的主要原因。
3.微小rna(micro rnas, mirnas)是包含约1825个核普酸的非编码单链小分子rna,调节基因转录后的表达。它们分布广泛,在组织和所有体液中均有分布,包括血浆、血清、尿液、唾液以及脑脊液等。其稳定性高,在血液中和脑脊液中通过脂质体或脂蛋白运输,很少被降解。几乎参与全身所有的生理过程,包括神经元的发生、学习、记忆过程,从而与中枢神经系统退行性疾病有着密切的关联。
4.因此,若能找到影响神经干细胞向神经元分化的关键microrna,则可能成为神经元替代疗法的新靶点,为中枢神经系统各种退行性病变的治疗带来突破。
技术实现要素:
5.本发明的目的是提供mir
‑
29c
‑
3p抑制物在制备神经干细胞向神经元分化的促进药物中的应用。
6.dcx是一种微管相关蛋白,在迁移的有丝分裂后的神经元前体中广泛表达,参与神经元分化的关键蛋白,是神经元前体细胞的主要标志物。本发明通过应用在线软件targetscan(http://www.targetscan.org)分析和预测调控dcx mrna上游mirnas,筛选得到mir
‑
29c
‑
3p(5’uagcaccauuugaaaucgguua3’,seq id no.1)。从而推测mir
‑
29c
‑
3p参与了神经干细胞向神经元分化过程。
7.本发明采用mirna抑制物对mir
‑
29c
‑
3p的表达进行下调,以mir
‑
nc作为对照,将携带有mir
‑
29c
‑
3p抑制物和对照mir
‑
nc的慢病毒分别感染神经干细胞后进行筛选,得到稳定低表达和正常表达mir
‑
29c
‑
3p的神经干细胞系,体外分化培养,观察两种情况下神经元分化情况。结果显示,mir
‑
29c
‑
3p在体外能抑制神经干细胞向神经元分化(p<0.05),低表达mir
‑
29c
‑
3p能明显促进神经干细胞向神经元分化(p<0.05)。
附图说明
8.图1为分化培养后dcx免疫荧光检测结果。其中:a为神经干细胞转染mir
‑
nc或mir
‑
29c
‑
3p抑制物分化培养72小时的dcx免疫荧光实验结果,hoechst染核,标尺=100微米; b为dcx阳性神经元前体细胞比例的统计(均值
±
标准差,* vs. control group,p<0.001;# vs.mir
‑
nc group,p<0.001)。
具体实施方式
9.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
10.实施例1本实施例的体外神经干细胞向神经元分化实验使用大鼠胚胎神经干细胞。
11.本实施例采用mirna抑制物对mir
‑
29c
‑
3p的表达进行下调,以mir
‑
nc作为对照,将携带有mir
‑
29c
‑
3p抑制物和对照mir
‑
nc的慢病毒分别感染神经干细胞后进行筛选,得到稳定低表达和正常表达mir
‑
29c
‑
3p的神经干细胞系,体外分化培养,观察两种情况下神经元分化情况。
12.具体过程如下:1. 神经干细胞培养和mirna抑制物转染1) 神经干细胞系来自赛默飞世尔科技有限公司的gibco rat fetal neural stem cells,培养在5% co2的37℃培养箱中,培养液为加入egf和bfgf(终浓度均为20 ng/ml)和1%青霉素/链霉素的dmem(gibco公司)。
13.2) mir
‑
29c
‑
3p抑制物来自赛默飞世尔科技有限公司,细胞转染利用invitrogen的lipofectamine rnaimax转染试剂,转染步骤按照说明书操作,mirna抑制物浓度为5 纳摩。
14.2. 分化培养及dcx免疫荧光检测:1) 分化培养实验:将神经干细胞及转染mirna抑制物的神经干细胞以1
×
105个/ml的密度接种于预先置入涂有多聚赖氨酸盖玻片的24孔培养板各孔中,加入含10�s的dmem/f12完全培养液2 ml。将24孔培养板置于饱和湿度的37℃、5% co2培养箱中培养,3 d后进行免疫荧光检测。
15.2) dcx免疫荧光检测:在培养3 d后,取上述各组6孔细胞,吸去培养孔中的培养液,加入含4%多聚甲醛的0.01 mol/l pb (ph7.2) 1 ml,室温下固定15 min。吸去多聚甲醛,用0.01 mol/l pbs (ph7.2)清洗3遍,每孔加入200
ꢀµ
l含10%山羊血清的0.01 mol/l pbs (ph7.2),室温下轻轻振摇30 min。吸去上述封闭液,加入1:1000稀释的豚鼠抗dcx 200
ꢀµ
l(abcam公司),室温下轻轻振摇1 h后放入4℃冰箱中过夜。次日晨吸去一抗,用pbs清洗3遍后,加入1:800稀释的alexa fluor
®ꢀ
488山羊抗豚鼠二抗(abcam公司),避光、室温下轻轻振摇2 h,用pbs清洗3遍后,加入1:2000稀释的hoechst(abcam公司)室温避光孵育30 min,pbs充分清洗后甘油磷酸缓冲液封片,荧光显微镜下观察dcx免疫荧光情况。
16.3.统计学处理
应用spss 21.0数据统计软件对数据进行分析。所得计量资料用均值
±
标准差表示,三组间两两比较采用单因素方差分析。以p<0.05认为差异有统计学意义。
17.结果如图1所示,与空白对照组和mir
‑
nc组比较,神经干细胞转染mir
‑
29c
‑
3p抑制物后,向dcx阳性神经元前体细胞分化数量明显增多,单因素方差分析结果显示,组间差异有统计学意义(p<0.05)。* vs.control group,p<0.001;# vs. mir
‑
nc group,p<0.001。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。