用于检测猪胸膜肺炎放线杆菌的lamp引物组及试剂盒和lamp微流控芯片
技术领域
1.本发明属于疾病检测技术领域,特别是涉及用于检测猪胸膜肺炎放线杆菌的lamp引物组及试剂盒和lamp微流控芯片。
背景技术:
2.猪胸膜肺炎放线杆菌,是一种革兰氏阴性菌,细小杆状或呈小球状等多型性。自1957年第一次被发现以来,呈现世界流行趋势。
3.目前针对于猪胸膜肺炎放线杆菌检测方法有血清学、分子生物学等,但都存在着一定的局限性,如检测方法繁琐不易操作或者是灵敏度和特异性较差的缺陷。
技术实现要素:
4.为了解决上述问题,本发明提供了用于检测猪胸膜肺炎放线杆菌的lamp引物组及试剂盒和lamp微流控芯片。本发明提供的lamp引物组具有灵敏度高、特异性强的优势,结合微流控芯片及lamp技术能够有效提高猪胸膜肺炎放线杆菌的检测效率。
5.为了实现上述目的,本发明提供了如下技术方案:
6.用于检测猪胸膜肺炎放线杆菌的lamp引物组,所述lamp引物组包括外引物对和内引物对;
7.所述外引物对包括引物f3和引物b3,所述引物f3的核苷酸序列如seq id no:1所示,所述引物b3的核苷酸序列如seq id no:2所示;
8.所述内引物对包括引物fip和引物bip,所述引物fip的核苷酸序列如seq id no:3所示,所述引物bip的核苷酸序列如seq id no:4所示。
9.本发明还提供了一种检测猪胸膜肺炎放线杆菌的试剂盒,所述试剂盒包括上lamp引物组和反应液。
10.优选的,所述反应液包括10
×
thermopol反应缓冲液、dntp mix、mgso4、bsa
‑
a、bst dna聚合酶和荧光染料。
11.本发明还提供了一种检测猪胸膜肺炎放线杆菌的lamp微流控芯片,所述lamp微流控芯片包括上述lamp引物组、反应液和微流控芯片。
12.优选的,所述lamp引物组中,外引物对和内引物对的摩尔比为1:8。
13.优选的,所述反应液包括10
×
thermopol反应缓冲液、dntp mix、mgso4、bsa
‑
a、bst dna聚合酶和荧光染料。
14.本发明提供了用于检测猪胸膜肺炎放线杆菌的lamp引物组,所述lamp引物组包括外引物对(引物f3和引物b3)和内引物对(引物fip和引物bip)。本发明选取具有较高特异性的apxⅳ基因序列(af021919)做为本技术检测的靶基因,设计出一组用于微流控芯片技术的具有高特异性、高灵敏度的引物组。本发明提供的lamp引物组特异性较好,不会与猪的其他病原菌发生交叉反应,且最低检测限度为1.17pg/μl具有良好的灵敏性。将lamp引物组利
用微流控芯片技术应用于临床样本检测中,能够实现对于猪胸膜肺炎放线杆菌的即时检测,从而解决猪胸膜肺炎放线杆菌以往的耗时、费力的缺陷,提高了检测的特异性和灵敏度,缩短了检测周期,本检测方法提供的技术支持可以应用于猪胸膜肺炎放线杆菌的病菌检测、诊断和监测工作,对于基层的检测技术及应用更具意义。
附图说明
15.图1为本发明实施例所采用的微流控芯片的结构示意图;
16.图2为本发明实施例提供的lamp微流控芯片用于检测猪胸膜肺炎放线杆菌的特异性时的试验结果图;
17.图3为本发明实施例提供的lamp微流控芯片用于检测猪胸膜肺炎放线杆菌的灵敏度时的试验结果图;
18.图4为本发明实施例提供的lamp微流控芯片用于检测临床病料样本时的结果。
具体实施方式
19.本发明提供了用于检测猪胸膜肺炎放线杆菌的lamp引物组,所述lamp引物组包括外引物对和内引物对;
20.所述外引物对包括引物f3和引物b3,所述引物f3的核苷酸序列如seq id no:1所示,所述引物b3的核苷酸序列如seq id no:2所示;
21.所述内引物对包括引物fip和引物bip,所述引物fip的核苷酸序列如seq id no:3所示,所述引物bip的核苷酸序列如seq id no:4所示。在本发明中,所述seq id no:1如cccttagccccttacacta所示;seq id no:2如cgcttaggatccgcctta所示;seq id no:3如caccaccgagaaacaaatcctcggcgtggtttatgtcacc所示;seq id no:4如aggcgatacaattgaagacgccggtacccctttttctctcac所示。本发明提供的lamp引物组具有高特异性、高灵敏度。
22.本发明还提供了一种检测猪胸膜肺炎放线杆菌的试剂盒,所述试剂盒包括上述lamp引物组和反应液。在本发明中,所述反应液优选包括10
×
thermopol反应缓冲液、dntp mix、mgso4、bsa
‑
a、bstdna聚合酶和荧光染料。
23.本发明还提供了一种检测猪胸膜肺炎放线杆菌的lamp微流控芯片,所述lamp微流控芯片包括上述lamp引物组、反应液和微流控芯片。本发明所用的微流控芯片优选为cd盘状的微流控芯片,进一步优选为图1所示的微流控芯片。在本发明的实验中所用的微流控芯片由上海速创诊断产品有限公司生产,型号为4
×
8的微流控芯片;所述微流控芯片中优选包括4个反应检测区;所述反应检测区中优选包括加样孔、排气孔、反应池、球阀和废液缸;所述反应检测区优选包括8个反应池。本发明提供了一种结合微流控芯片与lamp扩增技术的即时检测技术,能够建立高效、快速、灵敏、特异的即时检测技术,在猪胸膜肺炎放线杆菌的检测方面提供更具意义的检测价值,为推进病原菌快速检测提供基础。
24.在本发明中,所述lamp微流控芯片的lamp引物组中,外引物对和内引物对的摩尔比优选为1:8;所述反应液优选包括10
×
thermopol反应缓冲液、dntp mix、mgso4、bsa
‑
a、bst dna聚合酶和荧光染料。本发明提供的lamp微流控芯片选用特定的反应液能够有效提高lamp微流控芯片的检测效率。
25.本发明获得lamp引物组后,优选将lamp引物组包被至微流控芯片的反应池中,得
到包被有lamp引物组的微流控芯片。在本发明中,所述lamp引物组中外引物对和内引物对优选以1:8的摩尔比混合后再添加至微流控芯片的反应池中;所述lamp引物组添加至反应池后,优选进行真空加热干燥、压片封膜和压模处理,使lamp引物组包被至反应池中;
26.得到包被有lamp引物组的微流控芯片后,优选将待测样品包被至微流控芯片的进样区中进行扩增检测。在本发明中,所述包被待测样品前优选对检测反应所需试剂进行混样处理得到混合物,将混合物与待测样品的核酸混合均匀后加样至包被有lamp引物组的微流控芯片的进样区中,封膜包被后将微流控芯片放置于检测装置中进行即时扩增检测。
27.扩增检测结束后,本发明优选根据各反应池中的扩增趋势,通过荧光值得变化,绘制出荧光强度
‑
时间的曲线表,从而判断各个扩增反应孔样本阴阳性,即待检样品对线的曲线呈“s”型,且空白对照无扩增曲线,则判断出待检样品为猪胸膜肺炎放线杆菌阳性样本。
28.为了进一步说明本发明,下面结合附图和实施例对本发明提供的用于检测猪胸膜肺炎放线杆菌的lamp引物组及试剂盒和lamp微流控芯片进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
29.实施例1
30.采用微流控芯片技术检测猪胸膜肺炎放线杆菌的lamp引物组的制备
31.lamp引物组的设计和合成步骤如下:
32.选取猪胸膜肺炎放线杆菌较为特异性的毒素apxⅳ基因序列(af021919)为检测的靶基因,设计出lamp引物组,所述引物组合由外引物f3/b3和内引物fip/bip组成,其中f3具有如seq id no:1所示的核苷酸序列,b3具有如seq id no:2所示的核苷酸序列,fip具有如seq id no:3所示的核苷酸序列,bip具有如seq id no:4所示的核苷酸序列。
33.f3:cccttagccccttacacta,seq id no:1;
34.b3:cgcttaggatccgcctta,seq id no:2;
35.fip:caccaccgagaaacaaatcctcggcgtggtttatgtcacc,seq id no:3;
36.bip:aggcgatacaattgaagacgccggtacccctttttctctcac,seq id no:4。
37.实施例2
38.离心式微流控芯片结构
39.本发明采用如图1所示的微流控芯片,该类型微流控芯片为cd盘状的微流控芯片,由上海速创诊断产品有限公司生产,型号为4
×
8,即每个微流控芯片中包括4个反应检测区,每个反应监测区包括8个反应池。每个反应检测区包括依次连通的加样孔(1)、球阀(2)、反应池(3)、排气孔(4)和废液池(5)。样本通过一条弧形通道与加样孔(1)加入反应区,通过一条弧形通道与排气孔(4)和废液池(5)连通。每个反应区均设有8个扩增反应池(3)。其中,加样孔(1)的主要功能为加入扩增反应液,通过反应池(3)均匀分配反应液,进行lamp反应。球阀(2)对反应液具有阻滞作用,从而控制反应液在微流控芯片中的流动。
40.实施例3
41.采用微流控芯片技术制备检测猪胸膜肺炎放线杆菌的lamp微流控芯片。
42.在实施例1提供的用于检测猪胸膜肺炎放线杆菌的lamp引物组中,用于制备外引物f3/b3、内引物fip/bip之间的摩尔比为1:8,引物初始浓度10μm,经过配置,使内引物终浓度为1.6μm,外引物终浓度为0.2μm。
43.反应液(恒温扩增预混液)包括10
×
thermopol反应缓冲液、dntp mix、mgso4、bsa
‑
a、bst dna聚合酶和荧光染料(syto
tm
9)。
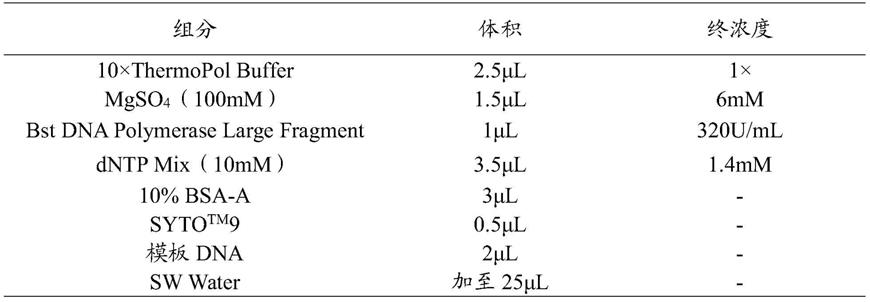
44.lamp微流控芯片的反应体系如表1所示。
45.表1 lamp微流控芯片的反应体系
[0046][0047]
实施例4
[0048]
猪胸膜肺炎放线杆菌lamp检测方法的样本制备及使用方法
[0049]
(1)待检样本提取:对猪胸膜肺炎放线杆菌纯培养物按照tiangen公司生产的提取试剂盒,进行目的细菌基因组及非目的菌基因组的提取,获得待测样品。
[0050]
(2)lamp引物组的包被:将实施例1中提供的用于检测猪胸膜肺炎放线杆菌的lamp引物组按照实施例3提供的摩尔比进行混样获得lamp引物组的组合物,将lamp引物组的组合物与海藻糖混合均匀,配制得到的包被混合液中内引物终浓度为1.6μm,外引物终浓度为0.2μm,海藻糖的质量百分含量为0.5%。
[0051]
每个反应检测区设有1个猪胸膜肺炎放线杆菌的反应池,将包被混合液加样至微流控芯片的反应池中,将含有包被混合液的微流控芯片置于25℃真空干燥箱进行干燥,压片封膜,冲压压实后,lamp引物组被包被至反应池内。
[0052]
(3)lamp反应:将反应液进行混样后,与步骤(1)获得的待检样品混合均匀,加样至步骤(2)获得的lamp微流控芯片的加样孔中,封膜处理后放置于荧光采集离心机(上海速创诊断有限公司,型号igene technotm sc
‑
ma2000)。先1500rpm/min瞬时离心15s以混匀样品和试剂,再4500rpm/min离心30s使样品和试剂液体在离心力作用下流入反应池内,最后将温度设置为63℃,反应时间设定为60min进行lamp扩增;
[0053]
(4)扩增结果判定:扩增结束后,根据仪器显示器上的各个反应池对应的荧光扩增曲线的情况来判断样品的阴阳性,若待检样品对应的荧光扩增曲线在显示屏上呈现“s”型,则判断待检样品为猪胸膜肺炎放线杆菌阳性的样品,否则待检样品中为阴性的样品。
[0054]
实施例5
[0055]
微流控芯片结合lamp检测猪胸膜肺炎放线杆菌(app)的特异性试验
[0056]
采用实施例4所述的方法进行检测,待检样本包括副猪嗜血杆菌(hps)、猪霍乱沙门氏菌(sal)、支气管败血波氏杆菌(bb)、多杀性巴氏杆菌(pm)、猪链球菌(ss)、猪丹毒杆菌(er)、猪肠外致病性大肠杆菌(expec)、金黄色葡萄球菌(金葡菌)的基因组dna(上述病菌均为本领域技术人员能够购买获得的常规菌株),以上述病菌的基因组dna作为阴性对照,无任何基因组的超纯水作为空白对照,进行lamp检测方法特异性扩增反应,检测结果如图2所示(图2中由上至下依次为app、hps、sal、bb、pm、ss、er、expec、金葡菌和空白对照)。
[0057]
根据图2可以看出,本发明建立的微流控芯片技术结合lamp技术检测猪胸膜肺炎
放线杆菌的方法,与其他猪源病原菌均不发生交叉反应,表明具有良好的检测特异性。
[0058]
实施例6
[0059]
微流控芯片结合lamp检测猪胸膜肺炎放线杆菌的灵敏度试验
[0060]
采用实施例4所述的方法进行检测,将猪胸膜肺炎放线杆菌阳性样本dna基因组以10倍梯度稀释后作为模板进行微流控芯片技术结合lamp检测。共设置8个梯度(1.17
×
102ng/μl~1.17
×
10
‑5ng/μl)及1组空白对照。检测结果如图3所示(图3中由上至下依次为1.17
×
102ng/μl、1.17
×
101ng/μl、1.17
×
100ng/μl、1.17
×
10
‑1ng/μl、1.17
×
10
‑2ng/μl、1.17
×
10
‑3ng/μl、1.17
×
10
‑4ng/μl、1.17
×
10
‑5ng/μl和空白对照组)。
[0061]
根据图3可知,采用微流控芯片技术结合lamp技术的检测方法的最低检测限度为1.17pg/μl(即1.17
×
10
‑3ng/μl)。
[0062]
实施例7
[0063]
微流控芯片结合lamp检测猪胸膜肺炎放线杆菌临床样本检测
[0064]
采用实施例4所述的方法和常规pcr技术进行检测,将120份临床样本分离得到的细菌样本进行增菌后提取基因组,再进行扩增检测。微流控芯片结合lamp技术和pcr技术的检测结果如表2所示。
[0065]
表2微流控芯片结合lamp技术和pcr技术对临床样品检测的结果比较
[0066][0067]
由表2可知,本实验检测的120份临床样本中,检测出胸膜肺炎放线杆菌的阳性样本为4份,检出率为3.3%。与pcr的检测结果比对可知,本发明提供的检测方法准确率高达100%。
[0068]
微流控芯片结合lamp技术设计得到的不同病菌的检测引物(包括本发明提供的lamp引物组)对猪胸膜肺炎放线杆菌进行检测,检测结果如图4所示,图4中由上至下依次为app、hps、sal、bb、pm、ss和er。
[0069]
由图4可知,本发明提供的猪胸膜肺炎放线杆菌lamp引物组能够准确的检测到猪胸膜肺炎放线杆菌。
[0070]
以上实施例表明,本发明所述的应用于检测猪胸膜肺炎放线杆菌的微流控芯片lamp技术的引物组合,可即时检测出猪胸膜肺炎放线杆菌,从而弥补了现有检测猪胸膜肺炎放线杆菌技术所存在的费时、基层不适用性等缺点,提高检测灵敏性和特异性,缩短病原菌检测周期。同时通过扩增曲线来判定检测结果的方式可以满足可视化的要求,使本发明在科学探究和生产实践中具有简便快捷的操作特点,同时兼备现场的即时检测的优势。还能够确定本发明建立的微流控芯片技术结合lamp技术检测猪胸膜肺炎放线杆菌的检测方法在临床的实用性。
[0071]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。