用于预防胃肠道损伤和/或促进胃肠道愈合的人乳寡糖
1.本技术是申请日为2012年08月13日,申请号为201280051863.0,发明名称为“用于预防胃肠道损伤和/或促进胃肠道愈合的人乳寡糖”的发明专利申请的分案申请。
技术领域
2.本公开涉及人乳寡糖用于在个体中预防胃肠道损伤和/或增强受伤的胃肠道愈合的用途。更具体地说,本公开涉及人乳强化剂、早产儿和足月儿配方、小儿配方、后续配方以及成人营养品,其包含可以增强多种黏蛋白结合蛋白质表达,由此改善个体胃肠道预防和修复功能的人乳寡糖。
背景技术:
3.经历多种疗法或患有多种疾病和/或病况的个体一般比健康个体对肠粘膜(胃肠)损伤或缺乏免疫力的胃肠道更易感。黏蛋白结合蛋白质或分泌蛋白质的表达是个体预防和/或修复肠损伤的天然能力的整体部分。尤其是,这些黏蛋白结合蛋白质的表达通过保护粘膜免于创伤、稳定粘液层、减少粘液层的炎症,和促进上皮组织的愈合来帮助肠粘膜损伤的愈合,并帮助预防进一步的损伤。
4.然而并不是所有个体具有充分的黏蛋白结合蛋白质的表达,以实现预防和所需的肠修复,其可能导致易位、脓毒症和可能死亡的风险增加。此外,目前不存在含有黏蛋白结合蛋白质(如三叶草因子3 (tff3))的市售营养组合物,或不存在通过施用额外组分增加黏蛋白结合蛋白质表达以帮助天然肠修复功能不足的个体的已知方法。
5.由此,期望提供这样的营养组合物,其可以产生营养益处,如通过增强黏蛋白结合蛋白质的表达帮助预防和愈合肠粘膜损伤。如果所述营养组合物还可以改善屏障功能、增强上皮细胞的愈合,并减少受伤的胃肠道的炎症,那么它会额外地有益。
技术实现要素:
6.本公开涉及营养组合物,包括人乳强化剂、早产儿和足月儿配方、小儿配方、后续配方以及成人配方(其包括单独的人乳寡糖或与其他组分如其他益生元寡糖和/或益生菌的组合)用于预防婴儿、幼儿、儿童或成人的胃肠道损伤和/或增强胃肠道愈合的用途。更具体地说,营养组合物可以通过增强多种黏蛋白结合蛋白质的表达改善胃肠道愈合,所述黏蛋白结合蛋白质可以稳定粘液层、减少炎症并促进上皮组织愈合。
7.一个实施方案涉及增强个体胃肠道愈合的方法。所述方法包括鉴定具有受伤的胃肠道的个体并向所述个体施用包含人乳寡糖的营养组合物。
8.另一实施方案涉及降低肠粘膜损伤发生率的方法。所述方法包括鉴定对肠粘膜损伤易感的个体并向所述个体施用包含人乳寡糖的营养组合物。
9.另一实施方案涉及改善个体胃肠道中的屏障功能的方法。所述方法包括鉴定需要增加的胃肠道屏障功能的个体并向所述个体施用包含人乳寡糖的营养组合物。
10.另一实施方案涉及降低个体胃肠道炎症发生率的方法。所述方法包括鉴定对胃肠
道炎症易感的个体并向所述个体施用包含人乳寡糖的营养组合物。
11.现在已经发现,人乳寡糖可以增强多种黏蛋白结合蛋白质,如tff3、muc2和relmβ的表达,其为肠修复系统的整体部分。尤其已经发现,通过施用含有人乳寡糖的组合物增强这些黏蛋白结合蛋白质的表达帮助细胞愈合、消退炎症,和促进屏障功能。已经进一步发现,所述人乳寡糖可以通过增强结肠中异丁酸的产生来增强胃肠道的愈合。尤其已经发现,尽管相对于其他短链脂肪酸,健康个体的结肠中的结肠细胞优选利用丁酸作为能量来源,但是经历饥饿延长期(诸如会发生在早产儿中喂养开始之前或胃肠外科手术之后)的个体的结肠中结肠细胞氧化丁酸的能力受损,但是保留利用异丁酸用于能量和回补(anapleurosis)的能力。
附图说明
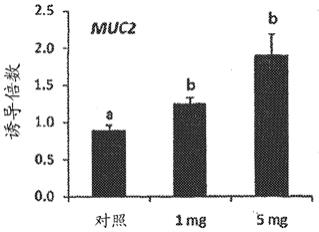
12.图1a
‑
1e是描绘人乳寡糖及其剂量依赖性对参与如实施例77中测定的胃肠道愈合应答的若干基因表达的影响的图。
13.图2是阐明用于实施例78的体外实验的微生物学培养基的表格。
14.图3是描绘如实施例78中所检测的多种寡糖底物引起的异丁酸产生随时间变化的图。
15.图4a
‑
4d是描绘hmos、嗜酸乳杆菌(lactobacillusacidophilus)、发酵乳杆菌(lactobacillus fermentum)或鼠李糖乳杆菌(lactobacillus rhamnosus)的组合对参与如实施例79中测定的胃肠道愈合应答的若干基因表达的影响的图。
16.图5a
‑
5d是描绘hmos和婴儿双歧杆菌(bifidobacterium infantis)和乳双歧杆菌(bifidobacterium lactis)的组合对参与如实施例79中测定的胃肠道愈合应答的若干基因表达的影响的图。
具体实施方案
17.本文所述的营养组合物和方法利用单独的人乳寡糖(hmos)或与一种或多种额外的组分组合的人乳寡糖(hmos),用于预防胃肠道的损伤和/或增强胃肠道的愈合。营养组合物和方法的这些及其他基本特征,以及许多种任选变化和添加中的一些均详细描述于下文中。
18.术语“蒸煮包装(retort packaging)”与“蒸煮灭菌(retort sterilizing)”在本文中互换使用,并且除非另有规定,指用营养液填充容器,最通常为金属罐或其他类似包装,然后使所述液体填充的包装经受必要的热力灭菌步骤,以形成灭菌的、蒸煮包装的营养液产品的普通实践。
19.除非另有规定,如本文所用,术语“无菌包装”是指包装产品不依赖于上述蒸煮包装步骤的制造,其中营养液和包装在填充之前分别灭菌,然后在灭菌的或无菌操作条件下进行组合,以形成灭菌的、无菌包装的营养液产品。
20.除非另有规定,如本文所用,术语“脂肪”和“油”互换使用,以指来自或加工自植物或动物的脂质材料。这些术语还包括合成的脂质材料,只要此类合成材料适合向人口服施用。
21.除非另有规定,术语“人乳寡糖”或“hmo”一般指在人母乳中发现的可以是酸性或
中性形式的许多复合碳水化合物,及其前体。示例性非限制性人乳寡糖包括3
’‑
唾液酸乳糖、6
’‑
唾液酸乳糖、3
’‑
岩藻糖基乳糖、2
’‑
岩藻糖基乳糖、乳糖
‑
n
‑
新四糖,和二唾液酸乳糖
‑
n
‑
四糖。示例性人乳寡糖前体包括唾液酸。
22.除非另有规定,如本文所用,术语“贮存稳定”是指营养产品,其经包装然后在18
‑
24℃下储存至少3个月(包括约6个月至约24个月,并且也包括约12个月至约18个月)后保持商业上稳定。
23.如本文所用,术语“营养制剂”或“营养组合物”可互换使用,并且除非另有规定,是指合成配方,包括营养液、营养粉、营养补充剂和如本领域中已知的任何其他营养食品。营养粉可重构形成营养液,其均包含脂肪、蛋白质和碳水化合物中的一种或多种且适于人类口服食用。
24.除非另有规定,如本文所用,术语“营养液”是指呈即饮型液体形式、浓缩形式的营养组合物,和通过在使用之前重构本文所述的营养粉所制得的营养液。
25.除非另有规定,如本文所用,术语“营养粉”是指呈可流动或可舀取(scoopable)形式的营养组合物(其可在食用之前用水或另一含水液体重构)且包括喷雾干燥和干混/干掺的粉末。
26.除非另有规定,如本文所用,术语“婴儿”是指12个月或更小的人。如本文所用,术语“早产儿”是指在妊娠36周前出生的人。
27.除非另有规定,如本文所用,术语“幼儿”是指大于一岁至高至三岁的人。
28.除非另有规定,如本文所用,术语“儿童”是指大于三岁至高至十二岁的人。
29.除非另有规定,如本文所用,术语“新生儿”是指自出生至高至四周龄的人。
30.除非另有规定,如本文所用,术语“婴儿配方”或“合成婴儿配方”可互换使用且是指适于婴儿食用的液体和固体人乳替代物或代用品。合成配方包括具有半纯化或纯化来源的组分。除非另有规定,如本文所用,术语“半纯化”或“纯化”是指已通过纯化天然材料或通过合成制备的物质。术语“婴儿配方”或“合成婴儿配方”不包括人母乳。
31.除非另有规定,如本文所用,术语“早产儿配方”是指适于早产儿食用的液体和固体营养产品。
32.除非另有规定,如本文所用,术语“人乳强化剂”是指适于与母乳或早产儿配方或婴儿配方混合以供早产儿或足月儿食用的液体和固体营养产品。
33.除非另有规定,如本文所用,术语“易感”和“处于风险中”意指对某种病况或疾病具有极小抗性,包括具有该病况或疾病的遗传倾向、具有其家族史和/或具有其症状。
34.除非另有规定,如本文所用,所有百分数、份数和比例均以总组合物的重量计。除非另有规定,所有此类重量在其关于所列成分时是基于活性水平且因此不包括可包括于市售品中的溶剂或副产物。
35.如本文所用,数值范围旨在包括该范围内的每一数目和数目的子集,无论是否具体公开。此外,这些数值范围应解释为对针对该范围内的任何数目或数目的子集的权利要求提供支持。例如,1至10的公开应解释为支持2至8、3至7、5至6、1至9、3.6至4.6、3.5至9.9等范围。
36.除非另有规定或所提及的上下文清楚暗示为相反,所有对本公开的单数特征或限制的提及均应包括相应复数特征或限制,反之亦然。
kcal/升至约2000 kcal/升,包括约150 kcal/升至约500 kcal/升的热量密度。在一些具体实施方案中,乳液可具有25或50或75或100 kcal/升的热量密度。
47.营养乳液可具有在约3.5至约8的范围内,但最有利地在约4.5至约7.5的范围内,包括约5.5至约7.3,包括约6.2至约7.2的ph值。
48.尽管营养乳液的食用份量(serving size)可视许多变量而变化,但典型食用份量一般为至少约 1 ml,或甚至至少约2 ml,或甚至至少约5 ml,或甚至至少约10 ml,或甚至至少约25 ml,包括在约2 ml至约500 ml的范围内,包括约4 ml至约340 ml,且包括约10 ml至约240 ml。
49.营养固体营养固体可呈任何固体形式,但通常呈可流动或实质上可流动微粒组合物或至少微粒组合物形式。尤其适合的营养固体产品形式包括喷雾干燥、聚结(agglomerated)和/或干掺的粉末组合物。所述组合物可容易地用勺或类似其他装置舀取和测量,且可由欲使用者用适合的含水液体(通常为水)容易地重构,以形成供立即口服或肠道使用的营养组合物。在此情形下,“立即”使用一般意指在约48小时内,最通常在约24小时内,优选在重构后立刻。
50.营养粉可在使用之前用水重构至为最终使用者的营养需求定制的热量密度,尽管在大多数情况下所述粉末用水重构形成包含至少19 kcal/fl oz (660 kcal/升),更通常为约20 kcal/fl oz (675
‑
680 kcal/升)至约25 kcal/fl oz (820 kcal/升),甚至更通常为约20 kcal/fl oz (675
‑
680 kcal/升)至约24 kcal/fl oz (800
‑
810 kcal/升)的组合物。一般,22
‑
24 kcal/fl oz配方更常用于早产儿或低出生体重婴儿,且 20
‑
21 kcal/fl oz (675
‑
680至700 kcal/升)配方更常用于足月儿。在一些实施方案中,重构粉末可具有约50
‑
100 kcal/升至约2000 kcal/升,包括约150 kcal/升至约500 kcal/升的热量密度。在一些具体实施方案中,乳液可具有25或50或75或100 kcal/升的热量密度。
51.人乳寡糖(hmos)本公开的营养组合物包括至少一种hmo,且在许多实施方案中包括两种或更多种hmos的组合。寡糖为人母乳主要组分之一,平均而言,所述人母乳含有10克/升中性寡糖和1克/升酸性寡糖。人乳寡糖的组成很复杂且多于200种不同寡糖样结构是已知的。
52.hmos可单独或在一些实施方案中与如本文所述的其他免疫增强因子(例如,lcpufas、抗氧化剂、核苷酸等)组合包括在营养组合物中。
53.用于营养组合物中的适合的hmos可包括酸性寡糖、中性寡糖、n
‑
乙酰葡萄糖化寡糖和hmo前体。可单独地或组合包括于本公开组合物中的hmos的具体非限制性实例包括:唾液酸(即,游离唾液酸,结合脂质的唾液酸、结合蛋白质的唾液酸);d
‑
葡萄糖(glc);d
‑
半乳糖(gal);n
‑
乙酰葡糖胺(glcnac);l
‑
岩藻糖(fuc);岩藻糖基寡糖(即,乳糖
‑
n
‑
岩藻五糖i;乳糖
‑
n
‑
岩藻五糖ii;2'
‑
岩藻糖基乳糖;3'
‑
岩藻糖基乳糖;乳糖
‑
n
‑
岩藻五糖iii;乳糖
‑
n
‑
二岩藻六糖i;和乳糖二岩藻四糖);非岩藻糖基化、非唾液酸化寡糖(即,乳糖
‑
n
‑
四糖和乳糖
‑
n
‑
新四糖);唾液酸寡糖 (即,3'
‑
唾液酸
‑3‑
岩藻糖基乳糖;二唾液酸单岩藻糖基乳糖
‑
n
‑
新六糖;单岩藻糖基单唾液酸乳糖
‑
n
‑
八糖(唾液酸);唾液酸乳糖
‑
n
‑
岩藻六糖ii;二唾液酸乳糖
‑
n
‑
岩藻五糖ii;单岩藻糖基二唾液酸乳糖
‑
n
‑
四糖);和唾液酸岩藻糖基寡糖(即,2'
‑
唾液酸乳糖;2
‑
唾液酸乳糖胺;3'
‑
唾液酸乳糖;3'
‑
唾液酸乳糖胺;6'
‑
唾液酸乳糖;6'
‑
唾液酸乳糖胺;唾液酸乳糖
‑
n
‑
新四糖c;单唾液酸乳糖
‑
n
‑
六糖;二唾液酸乳糖
‑
n
‑
六糖i;单唾液酸乳糖
‑
n
‑
新六糖i;单唾液酸乳糖
‑
n
‑
新六糖ii;二唾液酸乳糖
‑
n
‑
新六糖;二唾液酸乳糖
‑
n
‑
四糖;二唾液酸乳糖
‑
n
‑
六糖ii;唾液酸乳糖
‑
n
‑
四糖a;二唾液酸乳糖
‑
n
‑
六糖 i;和唾液酸乳糖
‑
n
‑
四糖b)。其中还原端的葡萄糖(glc经n
‑
乙酰葡糖胺置换的变体(例如,2'
‑
岩藻糖基
‑
n
‑
乙酰葡糖胺(2'
‑
flnag)为2'
‑
岩藻糖基乳糖的此类变体)也有用。这些hmos更全面地描述于美国专利申请号2009/0098240中,以其整体通过参考并入本文中。可包括于本公开组合物中的hmos的其他适合实例包括乳糖
‑
n
‑
岩藻五糖v、乳糖
‑
n
‑
六糖、对
‑
乳糖
‑
n
‑
六糖、乳糖
‑
n
‑
新六糖、对
‑
乳糖
‑
n
‑
新六糖、单岩藻糖基乳糖
‑
n
‑
六糖ii、异构岩藻糖基化乳糖
‑
n
‑
六糖(1)、异构岩藻糖基化乳糖
‑
n
‑
六糖(3)、异构岩藻糖基化乳糖
‑
n
‑
六糖(2)、二岩藻糖基
‑
对
‑
乳糖
‑
n
‑
新六糖、二岩藻糖基
‑
对
‑
乳糖
‑
n
‑
六糖、二岩藻糖基乳糖
‑
n
‑
六糖、乳糖
‑
n
‑
新八糖、对
‑
乳糖
‑
n
‑
八糖、异
‑
乳糖
‑
n
‑
八糖、乳糖
‑
n
‑
八糖、单岩藻糖基乳糖
‑
新八糖、单岩藻糖基乳糖
‑
n
‑
八糖、二岩藻糖基乳糖
‑
n
‑
八糖i、二岩藻糖基乳糖
‑
n
‑
八糖ii、二岩藻糖基乳糖
‑
n
‑
新八糖ii、二岩藻糖基乳糖
‑
n
‑
新八糖i、乳糖
‑
n
‑
十糖、三岩藻糖基乳糖
‑
n
‑
新八糖、三岩藻糖基乳糖
‑
n
‑
八糖、三岩藻糖基
‑
异
‑
乳糖
‑
n
‑
八糖、乳糖
‑
n
‑
二岩藻糖
‑
六糖ii、唾液酸
‑
乳糖
‑
n
‑
四糖a、唾液酸
‑
乳糖
‑
n
‑
四糖b、唾液酸
‑
乳糖
‑
n
‑
四糖c、唾液酸
‑
岩藻糖基
‑
乳糖
‑
n
‑
四糖i、唾液酸
‑
岩藻糖基
‑
乳糖
‑
n
‑
四糖ii和二唾液酸
‑
乳糖
‑
n
‑
四糖及其组合。特别适合的营养组合物包括以下hmos或hmo前体中的至少一种:唾液酸(sa);3'
‑
唾液酸乳糖(3'sl);6'
‑
唾液酸乳糖(6'sl);2'
‑
岩藻糖基乳糖(2'fl);3'
‑
岩藻糖基乳糖(3'fl);乳糖
‑
n
‑
新四糖(lnnt);和二唾液酸乳糖
‑
n
‑
四糖 (dslnt)。特别优选的营养组合物包括至少2'fl。
54.hmos以组合物中的如下hmo总量(mg hmo/ml组合物)存在于营养组合物中:至少约0.01 mg hmo/ml组合物,包括0.01 mg至20 mg hmo/ml组合物,且包括0.01 mg至2 mg hmo/ml组合物。通常,营养组合物中hmo的量将取决于营养组合物中存在的具体一种hmo或多种hmos和其他组分的量。
55.在一个具体实施方案中,当营养产品为营养粉时,营养粉中hmos的总浓度为约0.008%至约15%,包括约0.008%至约1.5%(以营养粉的重量计)。
56.在另一具体实施方案中,当营养产品为即食型营养液时,即食型营养液中hmos的总浓度为约0.001%至约2%,包括约0.001%至约1%,包括约0.001%至约0.5%,且进一步包括约0.001%至约0.1%(以即食型营养液的重量计)。
57.在另一具体实施方案中,当营养产品为浓缩营养液时,浓缩营养液中hmos的总浓度为约0.002%至约4%,包括约0.002%至约2%,包括约0.002%至约1%,且进一步包括约0.02%至约0.2%(以浓缩营养液的重量计)。
58.额外的益生元寡糖除上述hmos外,本公开的营养组合物可包含一种或多种益生元寡糖的额外来源。用于营养组合物中的益生元寡糖的适合的额外来源包括适合用于营养组合物中且与此类组合物的基本要素和特点相容的任何益生元寡糖。在一些实施方案中,营养组合物包括hmos与一种或多种额外的益生元寡糖的组合,以使得该组合物向最终使用者提供协同益处,例如改善胃肠道屏障功能的协同益处。
59.一种此类额外益生元寡糖包括含有半乳糖的寡糖,通常称为半乳糖寡糖(gos)。gos是含有通过β(1,4)和/或β(1,6)糖苷键连接的一个或多个半乳糖分子和一分子葡萄糖
的不消化寡糖。用于本公开的组合物中的gos可以选自β
‑
半乳糖寡糖、α
‑
半乳糖寡糖,及其组合。在一些实施方案中,gos可以是反式
‑
半乳糖寡糖(t
‑
gos),其是由d
‑
葡萄糖和d
‑
半乳糖单独组成的,或与gos的一种或多种其他形式组合组成的寡糖的混合物。t
‑
gos经由从米曲霉(aspergillus oryzae)获得的酶β
‑
半乳糖苷酶的作用从d
‑
乳糖产生。t
‑
gos对上胃肠道的消化具有抵抗力并且刺激大肠中双歧杆菌的生长。
60.gos一般由以下式代表:[半乳糖]n
‑
葡萄糖,其中n是1
‑
20之间的整数,并优选选自2、3、4、5、6、7、8、9或10。术语“半乳糖寡糖”或“gos”还可以指具有不同链长的半乳糖寡糖的混合物;即,长链长度和/或短链长度。半乳糖寡糖例如可以作为vivinal
®ꢀ
gos(75%总固体,60%总固体gos;friesland)和gos(clasado)通过商业途径获得。
[0061]
用于本文所述的营养组合物中的合适的额外益生元寡糖的其他非限制性实例包括聚合度(dp)为至少2个单糖单元的益生元寡糖,其在肠中并不通过存在于人类上消化道(小肠和胃)中的酸或消化酶的作用而消化或仅部分消化,但其可由人类肠内菌群发酵。术语“单糖单元”是指具有闭环结构的单元,优选为己糖,例如吡喃糖或呋喃糖形式。用于在本公开的营养组合物中与hmos组合的特别优选的寡糖包括gos、果寡糖(fos)、短链果寡糖、菊糖、聚右旋糖(pdx)、果胶水解物、胶纤维及其组合。
[0062]
在一个实施方案中,营养组合物包括以每1000 kg营养组合物约5 kg至约160 kg、包括每1000 kg营养组合物约8 kg至约160 kg、包括每1000 kg约8 kg至约80 kg、包括每1000 kg约8 kg至约64 kg、和包括每18,000磅营养组合物约164 kg至约818 kg的总量的gos。在一个实施方案中,所述营养组合物是人乳强化剂,其向1 kg早产儿提供每天约 0.11 g至约0.55 g gos量的gos。
[0063]
在一些具体实施方案中,hmos与fos组合使用。在其他具体实施方案中,hmos与gos组合使用。在这些具体实施方案中,hmos与gos的重量比是约1:1000至约2:1,包括约1:1,包括约1:10,包括约1:40,并还包括约1:99。
[0064]
益生菌除hmos外,本公开的营养组合物可以进一步包含一种或多种益生菌。
[0065]
用于包括本文的hmos的营养组合物中的合适的益生菌菌株的非限制性实例包括乳杆菌属(genus lactobacillus),包括嗜酸乳杆菌(l. acidophilus)、噬淀粉乳杆菌(l. amylovorus)、短乳杆菌(l. brevis)、保加利亚乳杆菌(l. bulgaricus)、干酪乳杆菌干酪亚种(l. casei spp. casei)、干酪乳杆菌鼠李糖亚种(l. casei spp. rhamnosus)、蜷曲乳杆菌(l. crispatus)、德氏乳杆菌乳酸亚种(l. delbrueckii ssp. lactis)、发酵乳杆菌(l. fermentum)、瑞士乳杆菌(l. helveticus)、约氏乳杆菌(l. johnsonii)、副干酪乳杆菌(l. paracasei)、戊糖乳杆菌(l. pentosus)、植物乳杆菌(l. plantarum)、路氏乳杆菌(l. reuteri)和米酒乳杆菌(l. sake);双歧杆菌属(genus bifidobacterium)包括:动物双歧杆菌(b. animalis)、双歧双歧杆菌(b. bifidum)、短双歧杆菌(b. breve)、婴儿双歧杆菌(b. infantis)、乳双歧杆菌(b. lactis)和长双歧杆菌(b. longum);片球菌属(genus pediococcus)包括:乳酸片球菌(p. acidilactici);丙酸杆菌属(genus propionibacterium)包括:产酸丙酸杆菌(p. acidipropionici)、费氏丙酸杆菌(p. freudenreichii)、詹氏丙酸杆菌(p. jensenii)和特氏丙酸杆菌(p. theonii);以及链球菌属(genus streptococcus)包括:乳酪链球菌(s. cremoris)、乳链球菌(s. lactis)和嗜
热链球菌(s. thermophilus)。特别优选的益生菌包括乳双歧杆菌和嗜酸乳杆菌。
[0066]
益生菌以至少约10
4 cfu/g组合物,包括约10
4 cfu/g组合物至约10
11 cfu/g组合物,且包括约10
5 cfu/g组合物至约10
10 cfu/g组合物的总量存在于营养组合物中。此外,所述益生菌可以作为活的(有活力的)和/或死的(无活力的)细胞包括在所述营养组合物中。
[0067]
大量营养物包括hmos的营养组合物可配制成包括蛋白质、脂肪和碳水化合物中的至少一种。在许多实施方案中,营养组合物将包括hmos及蛋白质、碳水化合物和脂肪的组合。
[0068]
尽管脂肪、蛋白质和碳水化合物的总浓度或量可视产品类型(即,人乳强化剂、早产儿配方、婴儿配方、幼儿配方、小儿配方、后续配方、成人营养物等)、产品形式(即,营养固体、粉末、即食型液体或浓缩液体)和欲使用者的目标膳食需求而变化,但这些浓度或量最通常在以下实施范围之一内,包括如本文所述的任何其他基本脂肪、蛋白质和/或碳水化合物成分。
[0069]
对于液体早产儿和足月儿配方,以早产儿或足月儿配方的重量计,碳水化合物浓度(包括hmos与任何其他碳水化合物/寡糖来源)最通常在约5%至约40%的范围内,包括约7%至约30%,包括约10%至约25%;以早产儿或足月儿配方的重量计,脂肪浓度最通常在约1%至约30%的范围内,包括约2%至约15%,且也包括约3%至约10%;以及以早产儿或足月儿配方的重量计,蛋白质浓度最通常在约0.5%至约30%的范围内,包括约1%至约15%,且也包括约2%至约10%。
[0070]
对于液体人乳强化剂,以人乳强化剂的重量计,碳水化合物浓度(包括hmos与任何其他碳水化合物/寡糖来源)最通常在约10%至约75%的范围内,包括约10%至约50%,包括约20%至约40%;以人乳强化剂的重量计,脂肪浓度最通常在约10%至约40%的范围内,包括约15%至约37%,且也包括约18%至约30%;以及以人乳强化剂的重量计,蛋白质浓度最通常在约5%至约40%的范围内,包括约10%至约30%,且也包括约15%至约25%。
[0071]
对于成人营养液,以成人营养液的重量计,碳水化合物浓度(包括hmos与任何其他碳水化合物/寡糖来源)最通常在约5%至约40%的范围内,包括约7%至约30%,包括约10%至约25%;以成人营养液的重量计,脂肪浓度最通常在约2%至约30%的范围内,包括约3%至约15%,且也包括约5%至约10%;以及以成人营养液的重量计,蛋白质浓度最通常在约0.5%至约30%的范围内,包括约1%至约15%,且也包括约2%至约10%。
[0072]
本文所述的任何液体营养组合物中碳水化合物、脂肪和/或蛋白质的量也可以如下表中所示以除占液体营养组合物总卡路里的百分数外的方式或其替代方式来表征。用于本公开液体营养组合物的这些大量营养物最通常以下表中所述的任何热量范围(实施方案a
‑
f)配制(在每一数值前加上术语“约”)。营养物占总卡路里的%实施方案a实施方案b实施方案c碳水化合物0
‑
982
‑
9610
‑
75蛋白质0
‑
982
‑
965
‑
70脂肪0
‑
982
‑
9620
‑
85 实施方案d实施方案e实施方案f碳水化合物30
‑
5025
‑
5025
‑
50蛋白质15
‑
3510
‑
305
‑
30
脂肪35
‑
551
‑
202
‑
20
[0073]
在一个具体实施方案中,液体婴儿配方(即食型和浓缩液体二者)包括如下那些实施方案,其中蛋白质组分可包含配方热量含量的约7.5%至约25%;碳水化合物组分(包括hmos与任何其他碳水化合物/寡糖来源)可包含婴儿配方总热量含量的约35%至约50%;且脂肪组分可包含婴儿配方总热量含量的约30%至约60%。这些范围仅作为实例提供,且不旨在限制。额外适合的范围如下表中所示(在每一数值前加上术语“约”)。营养物占总卡路里的%实施方案g实施方案h实施方案i碳水化合物:20
‑
8530
‑
6035
‑
55脂肪:5
‑
7020
‑
6025
‑
50蛋白质:2
‑
755
‑
507
‑
40
[0074]
当营养组合物为粉状早产儿或足月儿配方时,以早产儿或足月儿配方的重量计,蛋白质组分存在的量为约5%至约35%,包括约8%至约12%,且包括约10%至约12%;以早产儿或足月儿配方的重量计,脂肪组分存在的量为约10%至约35%,包括约25%至约30%,且包括约26%至约28%;以及以早产儿或足月儿配方的重量计,碳水化合物组分(包括hmos与任何其他碳水化合物/寡糖来源)存在的量为约30%至约85%,包括约45%至约60%,包括约50%至约55%。
[0075]
对于粉状人乳强化剂,以人乳强化剂的重量计,蛋白质组分存在的量为约1%至约55%,包括约10%至约50%,且包括约10%至约30%;以人乳强化剂的重量计,脂肪组分存在的量为约1%至约30%,包括约1%至约25%,且包括约1%至约20%;以及以人乳强化剂的重量计,碳水化合物组分(包括hmos与任何其他碳水化合物/寡糖来源)存在的量为约15%至约75%,包括约15%至约60%,包括约20%至约50%。
[0076]
对于粉状成人营养物,以成人营养物的重量计,蛋白质组分存在的量为约10%至约90%,包括约30%至约80%,且包括约40%至约75%;以成人营养物的重量计,脂肪组分存在的量为约0.5%至约20%,包括约1%至约10%,且包括约2%至约5%;以及以成人营养物的重量计,碳水化合物组分(包括hmos与任何其他碳水化合物/寡糖来源)存在的量为约5%至约40%,包括约7%至约30%,包括约10%至约25%。
[0077]
本公开的粉状营养组合物中脂肪、碳水化合物和蛋白质的总量或浓度可视所选组合物和欲使用者的膳食或医学需求而显著变化。下文显示大量营养物浓度的额外适合实例。在此情形下,总量或浓度是指粉状组合物中的所有脂肪、碳水化合物和蛋白质来源。对于粉状营养组合物,此类总量或浓度最通常且优选以下表中所述的任何实施范围来配制(在每一数值前加上术语“约”)。营养物占总卡路里的%实施方案j实施方案k实施方案l碳水化合物1
‑
8530
‑
6035
‑
55脂肪5
‑
7020
‑
6025
‑
50蛋白质2
‑
755
‑
507
‑
40
[0078]
脂肪本公开的营养组合物可任选包含脂肪的任何一种或多种来源。用于本文中的脂肪适合来源包括适合用于口服营养组合物中且与该组合物的基本要素和特点相容的任何脂肪或脂肪来源。例如,在一个具体实施方案中,脂肪来源于长链多不饱和脂肪酸(lcpufas)。
[0079]
用于营养组合物中的示例性lcpufas包括,例如,ω
‑
3 lcpufas和ω
‑
6 lcpufas。
具体的lcpufas包括来源于油来源诸如植物油、海洋浮游生物、真菌油和鱼油的二十二碳六烯酸(dha)、二十碳五烯酸(epa)、花生四烯酸(ara)、亚油酸、亚麻酸(α亚麻酸)和γ亚麻酸。在一个具体的实施方案中,lcpufas来源于鱼油诸如油鲱油、鲑鱼油、凤尾鱼油、鳕鱼油、大比目鱼油、金枪鱼油或鲱鱼油。与hmos一起用于营养组合物中的特别优选的lcpufas包括dha、ara、epa及其组合。
[0080]
为了减少营养组合物中高剂量lcpufas的潜在副作用,lcpufas的含量优选不超过营养组合物中总脂肪含量的3重量%,包括低于总脂肪含量的2重量%,且包括低于总脂肪含量的1重量%。
[0081]
lcpufa可以游离脂肪酸形式、甘油三酯形式、甘油二酯形式、甘油单酯形式、磷脂形式或以上述中一种或多种的混合物形式提供,优选以甘油三酯形式提供。在另一具体实施方案中,脂肪来源于短链脂肪酸。
[0082]
用于本文所述的营养组合物中的适合脂肪或其来源的另外非限制性实例包括椰子油、分馏椰子油、大豆油、玉米油、橄榄油、红花油、高油酸红花油、油酸(emersol 6313 oleic acid,cognis oleochemicals,malaysia)、mct油(中链甘油三酯)、向日葵油、高油酸向日葵油、棕榈和棕榈仁油、棕榈液油(palm olein)、芥花油、海洋油(marine oils)、鱼油、真菌油、藻类油、棉籽油及其组合。
[0083]
蛋白质本公开的营养组合物可任选进一步包含蛋白质。适合用于口服营养组合物且与此类组合物的基本要素和特点相容的任何蛋白质来源适合用于营养组合物中。
[0084]
用于营养组合物中的适合蛋白质或其来源的非限制性实例包括水解、部分水解或非水解蛋白质或蛋白质来源,其可来源于任何已知或另外适合的来源,诸如乳(例如,酪蛋白、乳清)、动物(例如,肉、鱼)、谷类(例如,稻、玉米)、植物(例如,大豆)或其组合。此类蛋白质的非限制性实例包括乳蛋白分离物、如本文所述的乳蛋白浓缩物、酪蛋白分离物、高度水解酪蛋白、乳清蛋白、酪蛋白钠或酪蛋白钙、全牛乳、部分或完全脱脂乳、大豆蛋白分离物、大豆蛋白浓缩物等。在一个具体的实施方案中,营养组合物包括来源于人和/或牛来源的乳蛋白的蛋白质来源。
[0085]
在一个实施方案中,蛋白质来源为水解的蛋白质水解物。在此情形下,术语“水解蛋白质”或“蛋白质水解物”在本文中可互换使用且包括高度水解蛋白质,其中水解程度最通常为至少约20%,包括约20%至约80%,且也包括约30%至约80%,甚至更优选为约40%至约60%。该水解程度为通过水解方法破坏肽键的程度。出于表征这些实施方案的高度水解蛋白质组分的目的,蛋白质水解程度由本领域技术人员通过定量所选液体制剂的蛋白质组分的氨基氮与总氮的比例(an/tn)来容易地测定。氨基氮组分通过测定氨基氮含量的usp滴定法来定量,而总氮组分通过tecator kjeldahl方法来测定,其均是分析化学领域的技术人员熟知的方法。
[0086]
适合的水解蛋白质可包括大豆蛋白水解物、酪蛋白蛋白质水解物、乳清蛋白水解物、稻蛋白水解物、马铃薯蛋白水解物、鱼蛋白水解物、卵白蛋白水解物、明胶蛋白水解物、动物和植物蛋白水解物的组合,及其组合。特别优选的蛋白质水解物包括乳清蛋白水解物和水解酪蛋白钠。
[0087]
当用于营养组合物中时,蛋白质来源可包括至少约20%(以总蛋白质的重量计)蛋
白质水解物,包括约30%至100%(以总蛋白质的重量计)蛋白质水解物,且包括约40%至约80%(以总蛋白质的重量计)蛋白质水解物,且包括约50%(以总蛋白质的重量计)蛋白质水解物。在一个具体实施方案中,营养组合物包括100%(以总蛋白质的重量计)蛋白质水解物。
[0088]
碳水化合物除hmos外,本公开的营养组合物可进一步任选包含适合用于口服营养组合物中且与此类组合物的基本要素和特点相容的任何其他碳水化合物。
[0089]
用于本文所述的营养组合物中的适合碳水化合物或其来源的非限制性实例可包括麦芽糊精、水解或改质淀粉或玉米淀粉、葡萄糖聚合物、玉米糖浆、玉米糖浆固体、稻来源的碳水化合物、豌豆来源的碳水化合物、马铃薯来源的碳水化合物、木薯、蔗糖、葡萄糖、果糖、乳糖、高果糖玉米糖浆、蜂蜜、糖醇(例如,麦芽糖醇、赤藻糖醇、山梨糖醇)、人造甜味剂(例如,蔗糖素、乙酰磺胺酸钾、甜菊(stevia))及其组合。特别期望的碳水化合物为低右旋糖当量(de)麦芽糊精。
[0090]
其他任选成分本公开的营养组合物可进一步包含其他任选组分,其可改变组合物的物理、化学、美观或加工特征或当用于目标群体时充当药物或额外的营养组分。许多这些任选的成分为已知的或另外适合用于医疗食物或其他营养产品或药物剂型中且也可用于本文的组合物中,条件是此类任选的成分对于口服施用为安全的且与所选产品形式中的基本和其他成分相容。
[0091]
此类任选的成分的非限制性实例包括防腐剂、乳化剂、缓冲剂、药物活性剂、抗炎剂、如本文所述的额外的营养物、着色剂、调味剂、增稠剂和稳定剂、乳化剂、润滑剂等。
[0092]
营养组合物可进一步包含甜味剂,优选包括至少一种糖醇,诸如麦芽糖醇、赤藻糖醇、山梨糖醇、木糖醇、甘露糖醇、异麦芽酮糖醇(isolmalt)和乳糖醇,且也优选包括至少一种人造或高效力甜味剂,诸如乙酰磺胺酸钾、阿斯巴甜、蔗糖素、糖精、甜菊和塔格糖。这些甜味剂,尤其是糖醇与人造甜味剂的组合,尤其用于配制具有期望的有利概况(favor profile)的本公开液体饮料实施方案。这些甜味剂组合尤其有效掩蔽有时与液体饮料中添加植物蛋白质相关的讨厌味道。以营养组合物的重量计,营养组合物中任选的糖醇浓度的范围可为至少0.01%,包括0.1%至约10%,且也包括约1%至约6%。以营养组合物的重量计,任选的人造甜味剂浓度的范围可为约0.01%,包括约0.05%至约5%,也包括约0.1%至约1.0%。
[0093]
流动剂或防结块剂可包括于如本文所述的营养组合物中以延缓粉末随时间凝块或结块并使得粉末实施方案容易自其容器流出。已知或另外适合用于营养粉或产品形式中的任何已知流动剂或防结块剂适用于本文,其非限制性实例包括磷酸三钙、硅酸盐及其组合。营养组合物中流动剂或防结块剂的浓度视产品形式、其他所选成分、期望的流动性质等而变化,但以营养组合物的重量计,最通常在约0.1%至约4%的范围内,包括约0.5%至约2%。
[0094]
稳定剂也可包括于营养组合物中。已知或另外适合用于营养组合物中的任何稳定剂也适用于本文,其一些非限制性实例包括胶,如黄原胶(xanthan gum)。以营养组合物的重量计,稳定剂可占约0.1%至约5.0%,包括约0.5%至约3%,包括约0.7%至约1.5%。
[0095]
另外,营养组合物可包含一种或多种抗氧化剂以提供营养支持,以及减少氧化应激。可包括适合于口服施用的任何抗氧化剂以用于本公开的营养组合物中,包括例如维生素a、维生素e、维生素c、视黄醇、生育酚和类胡萝卜素。
[0096]
在一个具体实施方案中,用于营养组合物中的抗氧化剂包括类胡萝卜素,诸如叶黄素、玉米黄素、番茄红素、β
‑
胡萝卜素及其组合,且特别为类胡萝卜素叶黄素、番茄红素和β
‑
胡萝卜素的组合。如本文所选和所定义的含有这些组合的营养组合物可用于调节早产儿和足月儿的炎症和/或c反应性蛋白的水平。
[0097]
营养组合物可进一步包含多种其他维生素或相关营养物中的任一种,其非限制性实例包括维生素d、维生素k、硫胺素、核黄素、吡哆醇、维生素b
12
、烟酸、叶酸、泛酸、生物素、胆碱、肌醇、其盐和衍生物,及其组合。
[0098]
营养组合物可进一步包含多种其他的额外矿物质中的任一种,其非限制性实例包括钙、磷、镁、铁、锌、锰、铜、钠、钾、钼、铬、氯化物及其组合。
[0099]
本公开的营养组合物可额外包含选自核苷、嘌呤碱基、嘧啶碱基、核糖和脱氧核糖的核苷酸和/或核苷酸前体以进一步改善肠道屏障完整性和/或成熟度。该核苷酸可呈单磷酸盐、二磷酸盐或三磷酸盐形式。核苷酸可为核糖核苷酸或脱氧核糖核苷酸。核苷酸可为单体的、二聚的或多聚的(包括 rna和dna)。核苷酸可以作为游离酸或以盐(优选为单钠盐)形式存在于营养组合物中。
[0100]
用于营养组合物中的适合核苷酸和/或核苷包括以下一种或多种:5'
‑
单磷酸胞苷、5'
‑
单磷酸尿苷、5'
‑
单磷酸腺苷、5'
‑1‑
单磷酸鸟苷和/或5'
‑
单磷酸肌苷,更优选为5'
‑
单磷酸胞苷、5'
‑
单磷酸尿苷、5'
‑
单磷酸腺苷、5'
‑
单磷酸鸟苷和5'
‑
单磷酸肌苷。
[0101]
制造方法本公开的营养组合物可通过用于制备所选产品固体或液体形式的任何已知或另外有效制造技术来制备。用于任何给定产品形式(诸如营养液或营养粉)的许多此类技术是已知的且可由本领域技术人员容易地应用于本文所述的营养组合物。
[0102]
因此,本公开的营养组合物可通过多种已知或另外有效配制或制造方法中的任一种来制备。在一种适合的制造方法中,例如制备至少三种单独的浆料,包括脂肪包蛋白质(protein
‑
in
‑
fat,pif)浆料、碳水化合物
‑
矿物质(cho
‑
min)浆料、水包蛋白质(protein
‑
in
‑
water,piw)浆料。pif浆料通过加热和混合油(例如,芥花油、玉米油等),然后在持续加热和搅拌下添加乳化剂(例如,卵磷脂)、脂溶性维生素和一部分总蛋白质(例如,乳蛋白浓缩物等)来形成。cho
‑
min浆料通过在加热搅拌下将以下添加至水中来形成:矿物质(例如,柠檬酸钾、磷酸氢二钾、柠檬酸钠等)、微量和超微量矿物质(tm/utm预混物)、增稠剂或悬浮剂(例如微晶纤维素(avicel)、结冷胶(gellan)、角叉菜胶)。所得的cho
‑
min浆料在持续加热和搅拌下保持 10分钟,然后添加另外的矿物质(例如,氯化钾、碳酸镁、碘化钾等)和/或碳水化合物(例如,gos、hmos、果寡糖、蔗糖、玉米糖浆等)。然后piw浆料通过在加热和搅拌下与剩余蛋白质(若存在)混合来形成。
[0103]
然后将得到的浆料在加热搅拌下掺合在一起并将ph调至6.6
‑
7.0,随后对组合物进行高温短时(htst)处理,在此期间将组合物热处理、乳化和均质化,然后使其冷却。添加水溶性维生素和抗坏血酸,必要时将ph调至期望的范围,添加调味剂,并添加水以达到期望的总固体水平。接着无菌包装组合物以形成无菌包装的营养乳液。然后可进一步稀释、热处理和包装该乳液以形成即食型或浓缩液体,或可将其热处理并随后加工和包装成可重构粉末,例如喷雾干燥的、干混的、聚结的粉末。
[0104]
营养固体诸如喷雾干燥的营养粉或干混的营养粉可通过适于制备和配制营养粉
的已知或另外有效技术的任何集合来制备。
[0105]
例如,当营养粉为喷雾干燥的营养粉时,喷雾干燥步骤可同样包括已知或另外适合用于产生营养粉的任何喷雾干燥技术。已知许多不同喷雾干燥方法和技术用于营养领域,其全部均适合用于制造本文的喷雾干燥的营养粉。
[0106]
一种制备喷雾干燥的营养粉的方法包括形成和均质化包含预先消化的脂肪和任选蛋白质、碳水化合物和其他脂肪来源的含水浆料或液体,然后喷雾干燥该浆料或液体以产生喷雾干燥的营养粉。该方法可进一步包括喷雾干燥、干混或另外向喷雾干燥的营养粉中添加额外营养成分(包括本文所述的任一种或多种成分)的步骤。
[0107]
用于制备营养组合物的其他适合方法例如描述于美国专利号6,365,218 (borschel等)、美国专利号6,589,576 (borschel等)、美国专利号6,306,908 (carlson等)、美国专利申请号20030118703 a1 (nguyen等)中,其说明书由此以其一致的程度通过引用并入本文中。
[0108]
使用方法如本文所述并含有hmos的营养组合物可以用于预防对早产儿、婴儿、幼儿、儿童和成人胃肠道的损伤和/或增强其受伤的胃肠道的愈合。该组中的任何人可能实际上具有受伤的胃肠道并因此受益于含有hmo的营养组合物的愈合作用,或可能处于胃肠道持续损伤的风险中或对此易感,并因此受益于含有hmo的营养组合物的预防作用。
[0109]
如本文所述的营养组合物包含单独的hmos或与一种或多种额外组分(诸如上文所示的益生菌)组合的hmos,以为改善个体的至少肠修复/愈合功能提供营养来源。尤其是,所述营养组合物可以增强黏蛋白结合蛋白质,诸如三叶草因子3 (tff3)、黏蛋白2(muc2)和relm
‑
β(relmβ)的表达,以稳定粘液层;促进上皮细胞的愈合;改善屏障功能;并减少炎症,其每一项增强胃、小肠和大肠的上皮组织和粘液层的整体愈合。
[0110]
此外,营养组合物可以通过增强结肠中异丁酸的产生,并由此增强结肠中结肠细胞的愈合来为改善个体的至少肠修复/愈合功能提供营养来源。尤其是,尽管相对于其他短链脂肪酸,健康个体的结肠中的结肠细胞优选利用丁酸作为能量来源,但是经历饥饿延长期(诸如会发生在早产儿中喂养开始之前或胃肠外科手术之后)的个体的结肠中的结肠细胞氧化丁酸的能力受损。然而,这些结肠细胞保留利用异丁酸用于能量和回补的能力。由此,通过增加通过施用含有hmo的组合物产生的异丁酸的量,可以改善胃肠愈合。
[0111]
在一些实施方案中,可以向由于经历多种疗法(其可以包括例如,抗生素疗法、放射疗法、化学疗法,或外科手术)或由于患有多种疾病或病症(其可以包括例如,肠道感染、炎性肠病、结肠炎、肠梗阻和慢性应激)而胃肠道具有持续损伤或对胃肠道损伤更易感或处于其风险中的个体施用所述营养组合物。
[0112]
所述个体期望每天消耗至少一份含有hmo的营养组合物,并且在一些实施方案中,可以每天消耗两份、三份或甚至更多份。期望将每一份作为单次连续剂量施用,尽管还可以将每一份分成两份或多份或分成一天内两次或多次取用的份数。本公开的方法包括连续的日复一日的施用以及周期性的或限制性的施用,尽管一般期望连续的日复一日的施用。
[0113]
所述营养组合物可以口服或通过管饲向个体施用。本公开的营养组合物还可以在肠内喂养开始之前和/或喂养的同时给予早产儿或足月儿。此外,所述营养组合物可以在部分或完全胃肠外营养之后重新喂养之前或与此同时给予婴儿、儿童或成人。
实施例
[0114]
下列实施例举例说明了本公开的营养组合物和方法的具体实施方案和/或特征。提供这些实施例仅仅为了举例说明的目的,不应该将其理解为对本公开的限制,在不背离本公开的精神和范围的条件下,可以对其进行许多改变。所有举例说明的量是基于组合物的总重量的重量百分数,除非另有规定。
[0115]
举例说明的组合物是按照本文所述的制造方法制备的贮存稳定的营养型组合物,因此,除非另有规定,否则,每个举例说明的组合物包括无菌加工的实施方案和蒸煮包装的实施方案。
[0116]
营养液实施方案是水包油型含水乳液,包装在240 ml塑料容器中,或可选包装大小,并在组合/包装之后,在1
‑
25℃的储存温度下,可保持12
‑
18个月的物理稳定性。
[0117]
实施例1
‑
5实施例1
‑
20举例说明了本公开的喷雾干燥的营养粉,其成分列于下表中。除非另有规定,否则所有成分的量均以千克/每1000千克批量的产品列出。
[0118]
实施例21
‑
40实施例21
‑
40举例说明了本公开的喷雾干燥的营养粉,其成分列于下表中。除非另有规定,否则所有成分的量均以千克/每1000千克批量的产品列出。
[0119]
实施例41
‑
60实施例41
‑
60举例说明了本公开的液体乳液,其成分列于下表中。除非另有规定,否则所有成分的量均以千克/每1000千克批量的产品列出。
[0120]
实施例61
‑
76实施例61
‑
76举例说明了本公开的浓缩液体人乳强化剂,其成分列于下表中。除非另有规定,否则所有成分的量均以千克或磅/每18,000磅批量的产品列出。
[0121]
实施例77
在该实施例中,分析了hmos对增加tff3和其他杯状细胞基因(其通过hmos促进胃肠愈合)表达的影响,及其剂量依赖性。
[0122]
测试合并的hmos其在杯状细胞的人ls174t细胞培养模型中诱导muc2、tff3、relmβ、chst5和gal3st2表达方面的能力。从美国典型培养物保藏中心(atcc)获得人ls174t结肠直肠癌细胞系。在37℃,5% co2中,在补充有10% fetalplex (gemini biosciences), 1.5 g/l na2co3, 10 ml/l 青霉素g
‑
链霉素溶液(gemini bio
‑
products)的最低必需培养基(mem)中维持ls174t细胞。从lars bode(university of california,san diego)获得合并的hmos,并溶于细胞培养等级的水中至所需浓度。随后将该溶液过滤灭菌,并用于细胞培养研究。用含有0、1或5 mg hmo/ml的上述培养基处理ls174t细胞。
[0123]
收集ls174t细胞,并悬浮于trizol试剂中,使用rneasy plus试剂盒(qiagen),按照生产商的说明书分离总rna。通过nanodrop (thermo fisher scientific)确定rna分离物的质量和数量。使用高容量cdna逆转录试剂盒(applied biosystems),将rna分离物逆转录,形成cdna,将其用于通过定量pcr评价基因表达。
[0124]
对于定量rt
‑
pcr,从applied biosystems获得特异性taqman基因表达测定法,其包括muc2 (hs00159374_m1)、tff3 (hs00173625_m1)、relmβ(hs00395669_m1)、chst5 (hs00375495_m1)、gal3st2 (hs00223271_m1)和gusb (hs99999908_m1)的表达测定法。使用taqman pcr master mix (applied biosystems),进行定量实时pcr。使用applied biosystems 7900ht快速实时pcr系统,在384孔板中一式两份进行反应。使用sds 2.3软件分析结果,并利用δδct方法进行计算。将所有样品对gus
‑
β表达归一化,并相对于未经处理的对照来计算诱导倍数。基因表达表示为相比于不含hmo的对照细胞的倍数增加。将该实验重复三次。数据表示平均值 sem(每个实验n=3个板)。用不同字母表示统计学差异(p < 0.05)。
[0125]
图1a
‑
1e表示三个重复实验的合并结果。尤其是,图1a、1b和1c举例说明,相比于对照培养物,用至少1 mg/ml水平的hmos处理,增加了muc2、tff3和relmβ基因的表达。杯状细胞基因的表达增加是特异性的且非普遍性的,如同通过用1 mg/ml或5 mg/ml的hmos处理的chst5和gal3st2各自的最低诱导或缺乏诱导所证明的。
[0126]
此外,图1a和1b表明了muc2和tff3表达的剂量依赖性增加,在1 mg/ml处理水平下出现适度的诱导(~1.5倍),而在5 mg/ml水平下出现更明显的增加(~2倍)。此外,在1 mg/ml处理水平和5 mg/ml处理水平的每个处理水平下,relmβ的表达水平(图1c)增加(~1.5倍)。与此相反,在任何剂量下,没有显著地影响chst5(图1d)和gal3st2(图1e)的基因表达。由此,可以断定,hmos对参与胃肠道愈合应答的若干基因表达的影响是剂量依赖性的。
[0127]
这些结果表明,hmos促进参与胃肠(gi)道愈合应答的若干基因的表达。首先,tff3的表达(显示hmos对其增强)已经与对哺乳动物肠中上皮细胞的胃肠损伤的预防和恢复正相关。在动物模型中,口服tff3处理减少与不同形式结肠炎相关的损伤。此外,hmos诱导muc2的表达,其提供保护胃肠道免于感染及其它损伤源的屏障。此外,hmos诱导relmβ的表达,其是与炎症消除相关的蛋白质。因为当出现大量炎症时,组织损伤难以愈合,hmos诱导的relmβ的炎症消除效果也支持愈合。hmos对tff3、muc2和relmβ表达的组合影响,通过其对细胞愈合、消除炎症和促进屏障功能的协同效应,使得产品能够支持创伤愈合。
[0128]
实施例78
在该实施例中,在体外模型中使用婴儿粪便接种物测定若干寡糖底物的发酵速率。
[0129]
基于以下标准选择8名婴儿参与者用于粪便提供:所述婴儿是否是:(1)以38至42周的胎龄足月出生;(2)等于或高于出生时体重5%;(3)无糖尿病、结核病或经证明对胎儿具有不良影响的围产期感染的母亲医疗史;(4)经阴道分娩;(5)研究登记时为至少2月龄,而不大于4月龄;(6)无已知心脏、呼吸、胃肠或其他全身疾病,诸如尿路感染或中耳炎;(7)无足够严重至导致血液问题的血型不合病史;和(8)未接受任何药物(除补充维生素外)和未曾接受抗生素。允许8名婴儿食用其母乳或婴儿配方的正常膳食。4名婴儿仅母乳喂养和4名婴儿仅配方喂养4种市售婴儿配方之一。
[0130]
体外实验当天,在尿布中收集粪便样品并在排便15分钟内准备。为进行准备,将该样品置于含温水的容器中并进行分析。在通过在co2气流下在掺合器中掺合溶液15秒制备的厌氧稀释溶液中以1:10 (wt/vol)稀释粪便样品。通过4层粗棉布(cheesecloth)过滤经掺合、稀释的粪便并在co2下密封于125
‑
ml血清瓶中。将接种物储存于37℃下直至接种体外试管。
[0131]
为细菌发酵和生长评估的寡糖测试底物包括(1)半乳糖寡糖95 (gos; inalco group, italy);(2)α
‑
(2
‑6’
)
‑
n
‑
乙酰神经氨酰
‑
乳糖钠盐(6’sl; inalco group, italy);(3) 2'
‑
α
‑
l
‑
吡喃岩藻糖基
‑
d
‑
乳糖(2’fl; inalco group, italy);(4) 乳糖
‑
n
‑
新四糖(lnnt; boehringer mannheim, germany);(5) orafti
®
hp菊糖(hp菊糖;beneo
‑
orafti, belgium);和(6)阿拉伯胶。
[0132]
体外底物发酵模型将约80 mg的每一种测试底物(1)
‑
(6)一式三份称重于模拟大肠发酵的常规模型中所用的16 ml balch管中。将培养基(表1;图2)的一份等分试样(7.2 ml)无菌转移至balch管中,加盖丁基橡胶塞子,并用铝帽密封。在4℃下将含有hp菊糖和阿拉伯胶的试管储存约12小时以能够在起始发酵前实现底物的水合。在接种前将这些试管置于37℃水浴中约30分钟。在获得粪便样品后使含有gos、6'sl、2'fl和lnnt的试管进行水合并将其置于37℃水浴中直至接种。
[0133]
给样品和空白试管无菌接种0.8 ml经稀释的粪便。在37℃下孵育试管,每2 h进行定期混合,持续至多12小时。接种后0、3、6和12小时,自37℃孵育箱移出试管并立即处理以进行分析。收集3
‑
ml流体小例样并用于支链脂肪酸分析,特别是异丁酸分析,其为发酵的指示剂并如下文进一步所述改善胃肠愈合。
[0134]
支链脂肪酸(bcfa)分析bcfa分析:提供蛋白质或氨基酸发酵程度的指示。细菌培养物中累积的bcfa的量还表明有多少可发酵的碳水化合物可用于细菌生长;即,如果存在足够的可发酵碳水化合物,那么所述细菌能够产生atp,其继而允许它们将所述氨基酸和氨氮掺入到细菌蛋白质中。如果存在不充足的可发酵碳水化合物,那么细菌将发酵蛋白质和氨基酸,以获得能量。
[0135]
将从样品试管取出用于bcfa分析的3
‑
ml流体等分试样立即添加至0.75 ml 25%偏磷酸中。使用hewlett
‑
packard 5890a系列ii气相色谱仪(palo alto, ca)和填充有10% sp
‑
1200/1% h3po4的玻璃柱(180 cm x 4 mm内径),在80/100 目chromosorb waw (supelco inc.,bellefonte,pa)上确定异丁酸的浓度。炉温、探测器温度和注射器温度分
别为125、175和180℃。利用空白试管产生的bcfa和每一底物的0小时浓度校正bcfa浓度值。将总bcfa计算为戊酸、异戊酸和异丁酸的总量。
[0136]
结果和讨论除2
’‑
fl外,异丁酸产生在每一种底物内随时间是相似的。尤其是,与2
’‑
fl孵育的培养物在6小时和12小时时分别比任何其他底物产生约5倍和10倍更高浓度的异丁酸(p<0.05) (图3)。
[0137]
来自发酵分析的结论如上文讨论的数据和图中所示,相比于其他底物,2’fl由婴儿粪便细菌容易地发酵并增强异丁酸的产生,这改善胃肠愈合。尤其是,不希望受任何特定理论的束缚,在正常喂养条件下,相比于其他短链脂肪酸,结肠细胞优选利用丁酸作为能量来源。然而,在饥饿延长期内(诸如会发生在早产儿中开始喂养之前在胃肠外科手术后),结肠细胞氧化丁酸的能力受损,但保留利用异丁酸用于能量和回补的例外能力。由此,通过施用2
’‑
fl来增加产生的异丁酸的量,可以改善胃肠愈合。
[0138]
实施例79在该实施例中,分析hmos促进益生菌诱导tff3和其他杯状细胞表达的能力的能力。
[0139]
测试hmos其对益生菌诱导杯状细胞的人ls174t细胞培养模型中muc
‑
2、tff3、relmβ和chst5表达的能力方面的影响。从美国典型培养物保藏中心(atcc)获得人ls174t结肠直肠癌细胞系。在37℃,5% co2中,在补充有10% fetalplex (gemini biosciences), 1.5 g/l na2co3, 10 ml/l 青霉素g
‑
链霉素溶液(gemini bio
‑
products)的最低必需培养基(mem)中维持ls174t细胞。从lars bode (university of california, san diego)获得合并的hmos。随后将该溶液过滤灭菌,并用于细胞培养研究。
[0140]
益生菌乳双歧杆菌(b.l.)和婴儿双歧杆菌(b.i.)培养物在存在1%葡萄糖或1% hmo的补充有0.5 g/l 半胱氨酸的smrs中生长,而益生菌嗜酸乳杆菌(l.a.)、发酵乳杆菌(l.f.)和鼠李糖乳杆菌(l.r.)培养物在存在1%葡萄糖或1% hmo的smrs中生长。在600nm处测定培养物的o.d.且在稳定期,在4000 rpm下离心5分钟后收集培养物上清液。随后过滤灭菌所述培养物上清液并低压冻干。低压冻干的产品在本文中命名为“生物处理后(postbiotic)”级分。将含有1% hmo或1%葡萄糖但不接种益生菌的细菌培养基过滤、低压冻干并用作生物处理后级分的对照。然后将生物处理后级分和对照级分添加到mem中,以分别表示“生物处理后”和对照培养基。用生物处理后和对照培养基处理ls174t细胞72小时。
[0141]
在孵育期结束时,收集ls174t细胞并将其悬浮于trizol试剂中。使用rneasy plus试剂盒(qiagen),按照生产商的说明书分离总rna。通过nanodrop (thermo fisher scientific)确定rna分离物的质量和数量。使用高容量cdna逆转录试剂盒(applied biosystems),将rna分离物逆转录,形成cdna,将其用于通过定量实时pcr评价基因表达。从applied biosystems获得特异性taqman基因表达测定法,其包括muc
‑
2 (hs00159374_m1)、tff3 (hs00173625_m1)、relmb (hs00395669_m1)、chst5 (hs00375495_m1)、gal3st2 (hs00223271_m1)和gusb (hs99999908_m1)的表达测定法。使用taqman pcr master mix(applied biosystems)进行定量实时pcr。使用applied biosystems 7900ht快速实时pcr系统,在384孔板中一式两份进行反应。使用sds 2.3软件分析结果,并利用δδct方法进行
计算。将所有样品对gus
‑
β表达归一化,并相对于未经处理的对照来计算诱导倍数。基因表达表示为相比于不含hmo的对照细胞的倍数增加。数据表示平均值 sem(n=3)。用不同字母表示统计学差异(p < 0.05)。
[0142]
图4a
‑
4d报道了在ls174t细胞培养物中,利用嗜酸乳杆菌、发酵乳杆菌和鼠李糖乳杆菌生物处理后级分相对于对照级分的处理对促进胃肠愈合的杯状细胞产物的表达的影响,且图5a
‑
5d报道了在ls174t细胞培养物中,利用婴儿双歧杆菌和乳双歧杆菌生物处理后级分相对于对照级分的处理对促进胃肠愈合的杯状细胞产物的表达的影响。利用婴儿双歧杆菌生物处理后级分处理那些细胞显著地增加了relmβ和chst5的表达(分别是3.5倍和3倍)。嗜酸乳杆菌、发酵乳杆菌和鼠李糖乳杆菌生物处理后级分不增加muc2、tff3、relmβ或chst5的表达。利用任一双歧杆菌生物处理后级分处理均没有显著增加muc
‑
2和tff3的表达。
[0143]
这些结果表明,益生菌婴儿双歧杆菌与hmos的孵育导致产生“生物处理后”上清液,其诱导可以促进胃肠愈合的基因的表达。该生物处理后级分是当在婴儿胃肠道腔中暴露于hmos时,益生菌,诸如婴儿双歧杆菌会产生的产物的模型。因此,这些数据表明,提供包括hmos和婴儿双歧杆菌的婴儿喂养配方,其比单独具有婴儿双歧杆菌或hmos的那些给定配方具有更强的胃肠保护。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。