1.本发明属于作物遗传领域,涉及油菜基因的乙酰化修饰,特别是指调控脂肪酸代谢的乙酰化修饰相关蛋白对应基因及其突变体基因和应用。
背景技术:
2.油菜是我国第一大自产油料作物,是食用油和饲用蛋白的重要来源,种植规模与产业价值仅次于粮食作物,对农业经济发展具有重要影响。随着经济的不断发展,科学技术向前推进、国民生活水平提高,消费者对食用油的品质提出了新的要求,菜籽油品质的优劣主要取决于脂肪酸碳氢链饱和程度,油菜品质改良已成为当前油菜育种领域的热点。
3.早期筛选高油酸油菜育种材料的研究中,如王敬乔等通过观察置于含有次氯酸钠和吐温的混合溶液中叶片氧化变白的快慢在早期阶段鉴别高油酸突变体。高建芹等发现除花期外,各生育期营养器官与生殖器官中的油酸相对含量呈极显著正相关。noelle a等通过利用实时荧光定量pcr方法检测高油酸花生及其野生型种子和叶片中fad2基因表达量快速检测高油酸花生基因型。本课题组前期对油菜的研究中也发现不少与油酸合成相关的基因/蛋白;利用itar方法对一组高油酸油菜近等基因系材料脂肪酸合成期种子进行分析,得到4个脂肪酸代谢相关的蛋白,其中3个为乙酰化蛋白,因而推测油菜脂肪酸代谢可能与乙酰化修饰相关。
[0004]“乙酰化”是改变蛋白质功能最主要的修饰方式之一。蛋白质在执行生命复杂的调控和信息传递功能过程中,需要在蛋白质分子链上接上某种分子或分子团,以改变蛋白质的功能,称之为“蛋白质的修饰”。如果蛋白质的分子链上嫁接上一个乙酰基分子,则称为“乙酰化”修饰。修饰后的蛋白质可以对细胞内的各类通路进行精确的调节与控制。
[0005]
从生长发育、疾病发生发展、植物抗逆到免疫调控等,均与代谢过程密不可分。例如,diabetes上已发表的文章发现糖尿病病理过程存在显著的乙酰化修饰改变;代谢是目前肿瘤领域最热点研究方向;而植物抗逆的过程,实际上就是植物通过各种策略和机制,来维持代谢稳态,以平衡防御、生长与存活之前关系的过程。在免疫方面,研究证实免疫细胞在促炎和抗炎过程中,具有完全不同的代谢策略,并且乙酰化修饰可能在其中扮演重要作用。甚至,代谢研究的顶级期刊《cell metabolism》发表的研究还曾发现,在有些代谢状态下,乙酰化修饰对代谢的调控,比蛋白表达调控、磷酸化调控更为重要。
[0006]
为进一步探索组蛋白乙酰化修饰与油菜脂肪酸代谢的关系,本课题组选用相同材料进行乙酰化蛋白质组学定量分析,并对筛选得到的脂肪酸代谢相关差异蛋白对应基因进行功能验证,从新的角度对油菜脂肪酸代谢分子机理开展研究,促进油菜分子育种研究进展。
技术实现要素:
[0007]
为解决上述技术问题,本发明提出一种调控脂肪酸代谢的乙酰化修饰相关蛋白对
应基因及其突变体基因和应用,提供了一种减缓油酸向亚油酸的转化的新思路。
[0008]
本发明的技术方案是这样实现的:调控脂肪酸代谢的乙酰化修饰相关蛋白对应的基因,所述基因为bnaacp3
63k
,其核苷酸序列如seq id no.1所示。
[0009]
上述基因编码的蛋白质,其氨基酸序列如seq id no.2所示。
[0010]
调控脂肪酸代谢的乙酰化修饰相关蛋白,对权利要求2的蛋白质的氨基酸序列的第63号位氨基酸进行突变所得到。
[0011]
所述蛋白质的氨基酸序列如seq id no.3或seq id no.4所示。
[0012]
编码上述的蛋白的基因,所述基因为bnaacp3
63r
基因序列如seq id no.5所示或bnaacp3
63q
基因序列如seq id no.6所示。
[0013]
所述的基因的克隆方法,步骤如下:(1)以甘蓝型油菜hocr苗期叶片cdna为模板,以所需引入突变碱基的序列分别设计bnaacp3
63k
引物对、bnaacp3
63r
‑1引物对、bnaacp3
63r
‑2引物对、bnaacp3
63r
引物对、bnaacp3
63q
‑1引物对、bnaacp3
63q
‑ꢀ2引物对以及bnaacp3
63q
引物对;(2)以步骤(1)中的模板及相对应的引物对,进行重叠引物pcr扩增;(3)回收目的片段,经连接、转化、验证分别克隆获得bnaacp3
63k
基因、bnaacp3
63r
基因和bnaacp3
63q
基因。
[0014]
所述bnaacp3
63k
引物对为f1和r2,其中f1序列为:gaattctcctctctttgcctttctccgc、r2序列为:gctttttgaccacttcacacact;bnaacp3
63r
‑1引物对为f1和r(r)1,其中r(r)1序列为agttgctttctgaccacttcacaca;bnaacp3
63r
‑2引物对为f(r)2与r2,其中f(r)2序列为tgtgtgaagtggtcagaaagcaact、r2序列为gtcgacgtgggtttgggtttagtggggtt;bnaacp3
63r
引物对为f1和r2; bnaacp3
63q
‑1引物对为f1与r(q)1,其中r(q)1序列为agttgcttttggaccacttcacaca;bnaacp3
63q
‑ꢀ2引物对为f(q)2与r2,其中f(q)2序列为tgtgtgaagtggtccaaaagcaact。
[0015]
所述bnaacp363k基因、bnaacp363r基因和bnaacp363q基因的核苷酸长度均为560bp。
[0016]
含有上述的基因的表达载体。
[0017]
所述的表达载体在制备高油酸植株中的应用。
[0018]
本发明具有以下有益效果:1、bnaacp3的乙酰化修饰对油酸和亚油酸可能具有选择作用,能够减缓油酸向亚油酸的转化,之后将在这些t1代拟南芥叶片中进行基因阳性鉴定。可利用外源的乙酰化修饰剂在油菜脂肪酸形成期进行喷施,调控bnaacp3基因的表达,从而实现改善油菜籽脂肪酸成分的目的,减轻油菜品质育种的工作难度,以低廉的成本及简易的操作来实现菜油品质改良。
[0019]
2、当前研究多认为油酸的累积与fad2基因相关,抑制其表达即可达到提高菜籽中油酸含量的目的,本研究以新角度开展研究,发现乙酰化修饰会对油酸累积产生影响,为油菜脂肪酸改良分子育种提供了新的思路。
附图说明
[0020]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0021]
图1为质谱数据的质控检测结果,其中(a)鉴定肽段的质量偏移分布(b)鉴定肽段的长度分布。
[0022]
图2为乙酰修饰肽段分析图,其中字母的大小对应于氨基酸残基出现的频率。
[0023]
图3为发生乙酰化修饰蛋白的go和结构域富集分析,(a)差异表达蛋白go富集分析;(b)差异表达蛋白结构域富集分析。
[0024]
图4为蛋白质相互作用网络分析。
[0025]
图5为h3k27ac抗体的蛋白质印迹。
[0026]
图6为7个差异基因的表达量,以hocr与locr相对表达量的比值表示。
[0027]
图7为重叠引物pcr法原理。
[0028]
图8为pcr电泳图,其中(a)分段基因克隆电泳;(b)bnaacp3
63k
、bnaacp3
63r
与bnaacp3
63q
基因克隆。
[0029]
图9为单菌落pcr检测电泳图。
[0030]
图10为序列比对及进化树分析,(a)碱基序列分析;(b)氨基酸序列分析。
[0031]
图11为植物表达载体构建图谱。
[0032]
图12为双酶切克隆载体质粒电泳图,其中泳道1:k1,泳道2:r2,泳道3:r4,泳道4:q8。
[0033]
图13为重组质粒检测电泳图,其中泳道1~3:k,泳道4~5:r:泳道6~7,q(b)重组质粒双酶切检测,泳道1~2:k,泳道3~4:r,泳道5~6:q,泳道7:未切。
[0034]
图14为菌液pcr检测电泳图,其中泳道1~3:bnaacp3
63k
;泳道4~6:bnaacp3
63r
;泳道7~9:bnaacp3
63q
。
[0035]
图15为转基因拟南芥种子脂肪酸组分分析图。
具体实施方式
[0036]
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例
[0037]
1试验方法1.1乙酰化修饰组学分析1.1.1供试材料一组油酸含量不同的甘蓝型油菜近等基因系(hocr,油酸含量81.4%;locr,油酸含量56.2%),由湖南农业大学农学院提供;两个材料的苗期、5~6叶期和蕾薹期的第一片伸展
叶;取盛开的花;角果期取自花授粉后20~35 d混合自交种;每次取5株样品,液氮速冻后,置于-80℃低温保存备用1.1.2 乙酰化修饰定量组学分析分别取两个甘蓝型油菜自花授粉后20~35 d混合种子(每隔5 d取样,每次取3个不同单株的角果),以locr作为对照,保存于超低温冰箱(-80℃)备用,之后送杭州景杰生物科技有限公司进行相关分析。
[0038]
1.1.3 数据库搜索使用maxquant搜索引擎(v.1.5.2.8)处理生成的ms/ms数据。串联质谱搜索了甘蓝型油菜数据库与反向诱饵数据库。用胰蛋白酶为裂解酶,允许多达4个缺失的裂解。对前体离子的质量耐受性,第一次搜索为20 ppm,主搜索为5 ppm,片段离子的质量耐受性为0.02 da。将半胱氨酸烷基化设置为固定修饰,可变修饰为甲硫氨酸的氧化,蛋白n端的乙酰化,赖氨酸的乙酰化。
[0039]
图1表示质谱数据的质控检测结果,图a是对所有鉴定到的肽段的质量偏移(mass error)检测,质量误差以0为中轴并且集中在低于10 ppm的范围内,说明质量误差符合要求;其次,图b绝大部分的肽段长度分布在8~20个氨基酸残基之间,符合胰酶消化肽段的规律,说明样品制备达到标准。
[0040]
1.1.4 分析数据与软件油菜基因组数据库(http://www.genoscope.cns.fr/brassicanapus/),芸薹属数据库(http://brassicadb.org/brad/),修饰位点基序分析软件motif
‑
x,gene ontology(go)基因功能注释分析(http://geneontology.org/),interpro结构域数据库(http://www.ebi.ac.uk/interpro/)。
[0041]
本研究一共鉴定到位于1,610个蛋白上的2,903个乙酰化位点,其中1,409个蛋白的2,473个位点包含定量信息。以1.3倍为变化阈值,t检验p值< 0.05为标准,那在定量到的乙酰化位点中,有80个位点的修饰水平发生上调,21个位点的修饰水平发生下调。
[0042]
为了检测甘蓝型油菜中的保守基序,用motif
‑
x搜索所有已鉴定的乙酰化蛋白中的保守氨基酸序列。如图2所示,为乙酰修饰肽段分析,大多数保守残基位于kac位点的
±
1或
±
2位置,在发生修饰位点的侧翼序列中发现了两种类型:一种是位于下游的赖氨酸(k),组氨酸(h),丝氨酸(s),精氨酸(r),谷氨酸(e),苯丙氨酸(f),苏氨酸(t),天冬酰胺(n)和天冬氨酸(d);另一种是位于修饰位点上游的h,e,f和甘氨酸(g)(图2)。在修饰位点的上,下游均检测到h,e和f。结果表明这些氨基酸基序对于植物,细菌和动物中的赖氨酸乙酰化而言可能是保守且重要的。
[0043]
蛋白质go及结构域富集分析:为了了解发生乙酰化修饰蛋白的功能,我们分别对分子功能,细胞组成和生物学过程进行了功能富集分析(图3a),以负对数(
‑
log10)进行转换。在细胞组成中,dna包装复合体、核小体、染色质、染色体部分、蛋白质
‑
dna复合物、染色体、细胞核和细胞器部分显著富集;在分子功能中,富集到蛋白质异二聚化、蛋白质二聚化、dna结合蛋白、蛋白质结合蛋白和核酸结合蛋白,其中程度最高的是蛋白质异二聚化,最低的是核酸结合蛋白;在生物过程中,有调控细胞过程、调控细胞代谢、调控生物过程、调控代谢过程、生物调控、rna聚合酶ii启动子转录的调控、单一生物碳水化合物的代谢过程、adp生成atp、adp代谢过程、糖酵解过程、核糖核苷二磷酸代谢过程、嘌呤核苷二磷酸代谢过程、
rna生物合成过程的调控以及嘌呤核糖核苷二磷酸代谢过程被富集到。
[0044]
此外,还对测序中结果中的差异蛋白进行结构域富集分析(图3b)。在鉴定出的蛋白质中,有包括组蛋白折叠,氧化还原酶fad/nad(p)结合、铁氧还原型蛋白fad结合域和酰基辅酶a n
‑
酰基转移酶在内的14个结构域显著富集。
[0045]
关键差异蛋白筛选:综合测序结果,筛选出3个与脂肪酸代谢相关:酰基
‑
[酰基载体蛋白]去饱和酶5(gsbrna2t00153661001)、3
‑
氧代酰基
‑
[酰基载体蛋白]合酶i(gsbrna2t00054708001)和酰基载体蛋白3(gsbrna2t00100854001);4个与三羧酸循环(tricarboxylic acid cycle,tca cycle)相关:磷酸甘油酸激酶1(gsbrna2t00076479001)、果糖二磷酸醛缩酶(gsbrna2t00069603001)、磷酸丙糖异构酶(gsbrna2t00108116001)、丙酮酸激酶(gsbrna2t00009340001)。
[0046]
1.1.5 蛋白质相互作用分析使用string数据库(v.0.5)对检测出的蛋白质进行相互作用分析预测,并在cytoscape中可视化string的互动网络。
[0047]
在string数据库(v.0.5)中搜索所有已识别出蛋白质,以检测蛋白质
‑
蛋白质相互作用分析。string定义了一个“可信度得分”指标来定义相互作用的可信度,以置信度得分≥0.7(高置信度)获取所有交互并在cytoscape中可视化。使用一种新颖的图论聚类算法和分子复合物检测(mcode)来分析密集连接的区域(图4),而mcode是cytoscape插件工具套件的一部分,用于网络分析和可视化。
[0048]
1.2乙酰化修饰结果验证根据测序结果,从蛋白质表达与基因表达量两个角度来验证测序结果是否可靠。
[0049]
1.2.1供试材料验证测序结果所用材料为送测序的同时期自花授粉种子,同1.1.1。
[0050]
1.2.2蛋白提取及免疫印迹1.2.2.1蛋白提取及浓度测定取适量组织样品(送测序同批材料)加液氮研磨至粉末。分别加入粉末4倍体积酚抽提缓冲液(含10 mm二硫苏糖醇,1%蛋白酶抑制剂,3 μm tsa,50 mm nam),超声裂解。加入等体积的tris平衡酚,4℃,5500 g离心10 min,取上清并加入5倍体积的0.1 m乙酸铵/甲醇沉淀过夜,用甲醇和丙酮洗涤蛋白沉淀后,用8 m尿素复溶,利用bca试剂盒进行蛋白浓度测定。
[0051]
选择发生乙酰化修饰的组蛋白h3k27ac(gsbrna2t00135897001)用于免疫印迹分析以验证测序结果,以组蛋白h3作为内部参考(图5)。
[0052]
由图5可看出组蛋白h3k27ac在第1,2和3泳道,比第4,5和6的泳道颜色深度,表明该组蛋白在hocl中的表达量要高,与附表1结果结果一致。
[0053]
附表1乙酰化修饰差异表达数据
1.2.2.2电泳取20 μg蛋白质样品,加入4
×
sample buffer,调至1
×
,配制浓度控制在2 mg/ml,95℃加热10 min。电泳条件:先80 v恒压30 min,再120 v恒压电泳至溴酚兰刚跑出分离胶。
[0054]
1.2.2.3转膜电转缓冲液放4℃冰箱预冷1 h后,将nc膜浸在电转缓冲液中平衡30 min左右。将胶平铺于膜上,放于4℃环境,80 v恒压电转2 h。用5%脱脂奶粉(1
×
tbst配制)进行封闭,室温封闭1 h。
[0055]
1.2.2.4一抗、二抗孵育封闭结束,使用tbst漂洗三次,每次10 min。使用含5%脱脂奶粉的tbst稀释抗体,加入抗体后于4℃冰箱,温和摇晃孵育过夜。一抗孵育结束后,使用tbst漂洗三次,每次10 min。加入二抗孵育,室温1 h。二抗孵育结束,用tbst漂洗三次,每次10 min。
[0056]
1.2.2.5曝光加入荧光底物孵育5 min,用自封袋覆盖在膜上,放入暗盒曝光。
[0057]
1.2.3总rna提取及荧光定量验证1.2.3.1rna提取及cdna合成所有样品从
‑
80 ℃取出,称取适量组织样品至液氮预冷的研钵中,加液氮充分研磨至粉末,其余步骤按说明书进行,电泳检测rna完整性,nd 2000测定浓度后备用。
[0058]
以总rna为模板,去除总rna中的残留基因组dna后,合成第一链cdna,用20 μl反应体系:反应程序:42℃孵育2 min,随后60℃孵育5 min,短暂离心后50℃孵育15 min,85℃继续孵育5 min后,置于-20℃保存备用。
[0059]
1.2.3.2荧光定量pcr验证相关差异蛋白对应基因及表达规律用premier 5.0设计引物,对引物进行检测,以油菜bnaactin基因(fj529167.1)为内参基因(f:5
′‑
ggttgggatggaccagaagg
‑3′
;r:5
′‑
tcaggagcaatacggagc
‑3′
),进行荧光定量分析,用20 μl反应体系:
反应程序:采用pfaffl等的方法进行基因表达情况评价,实验重复三次,取平均值。
[0060]
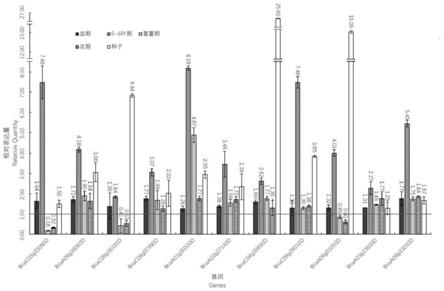
表1相关差异蛋白对应基因qpcr引物以两个甘蓝型油菜(locr,hocr)的苗期、5~6叶期、蕾薹期的叶、花期时盛开的花和成熟期自花授粉20~35 d混合种子为材料进行表达量研究,以hocr与locr相对表达量的比值表示(图6)。
[0061]
研究发现hocr材料在这5个时期,bnac03g33080d和bnac09g16320d具有相同的表达情况,均在5~6叶期升高后下降,再持续升高的表达,且在蕾薹期和花期要低于对照locr的表达量。bnaa06g36060d、bnac09g07990d、bnaa01g30320d和bnac04g33690d具有相同的表达规律,均在5~6叶期先升高,在蕾薹期和花期再持续下降,到成熟种子中再升高。在整个生育期均高于对照locr,且在5~6叶期具有较高的表达量。bnaa02g27140d和bnac09g29010d这5个时期,均呈现先上升后下降,再持续上升,与bnac03g33080d和bnac09g16320d不同,在蕾薹期和花期的表达量均要高于对照locr。bnaa06g01050d在5~6叶期先升高,在蕾薹期和花
期时持续下降,在成熟种子中的表达量再升高,而在蕾薹期和花期中间的表达量均低于locr材料。其中与脂肪酸代谢相关的三个基因为:bnac03g33080d、bnaa06g36060d和bnac09g16320d,其中在作为产油部分的种子中油酸表达量最高的基因为bnac09g16320d(酰基载体蛋白3),将其命名为bnacp3,进行乙酰化修饰功能验证。
[0062]
1.3乙酰化修饰功能验证1.3.1 bnacp3基因定点突变及克隆1.3.1.1甘蓝型油菜总rna提取检测及cdna合成总rna提取同1.2.3。
[0063]
反转录合成cdna第一链,根据试剂盒说明书,用20 μl体系:反应程序:25℃孵育10 min,42℃孵育30 min,85℃加热5 s后失活transscript
®ꢀ
rt/ri与gdna remover。置于-20℃保存。
[0064]
1.3.1.2甘蓝型油菜bnaacp3的克隆及突变碱基引入(1)引物设计根据乙酰化修饰差异表达数据结果(附表1),利用pcr法对bnapc3进行克隆。在甘蓝型油菜数据库(http://www.genoscope.cns.fr/brassicanapus/)中,下载其cdna序列如seq id no.7和cds序列seq id no.1。
[0065]
在生理条件下,赖氨酸(lys,k)残基侧链可通过质子化而带上正电荷,如果发生乙酰化修饰,则可以阻止其残基发生质子化因而不带正电荷。因此,受到乙酰化修饰的k表现为中性,可通过将k分别突变成带正电荷的精氨酸(arg,r)来模拟该位点未发生乙酰化修饰,以及不带电荷的谷氨酰胺(glu,q)来模拟位点发生了乙酰化修饰。如果发现k突变成q后的蛋白功能发生更显著的活性变化时,则说明该位点的乙酰化修饰对蛋白功能有重要的调控作用。
[0066]
根据测序结果,在其第63号位氨基酸(赖氨酸)位置,用重叠引物法(图7)定向引入一个突变碱基,使其由赖氨酸(k,aaa)突变为精氨酸(r,aga)以及谷氨酰胺(q,caa)。以甘蓝型油菜hocr苗期叶片cdna为模板,根据序列及所需引入突变碱基设计引物(表2)。
[0067]
表2bnaacp3克隆及定点突变碱基所需引物序列
注:下划线表示酶切位点,底纹表示定点突变位置引物f1与r2用于克隆bnaacp3
63k
(约560 bp);引物f1与r(r)1用于克隆bnaacp3
63r
‑1(约280 bp),f(r)2与r2用于克隆bnaacp3
63r
‑2(约280 bp),经胶回收纯化后,以这两段产物为模板,用引物f1与f2克隆获得bnaacp3
63r
(约560 bp);引物f1与r(q)1用于克隆bnaacp3
63q
‑1(约280 bp),f(q)2与r2用于克隆bnaacp3
63q
‑2(约280 bp),经胶回收后,以这两段产物为模板,用引物f1与r2克隆获得bnaacp3
63q
(约560 bp)。
[0068]
(2)目的片段pcr扩增50μl反应体系:反应程序:退火温度:65℃(bnaacp3
63k
)、64℃(bnaacp3
63r
‑1)、64℃(bnaacp3
63r
‑2)、65℃(bnaacp3
63r
)、64℃(bnaacp3
63q
‑1)、64℃(bnaacp3
63q
‑2)、65℃(bnaacp3
63q
);反应结束后以20 μl体系,1.5%琼脂糖凝胶电泳检测扩增产物并胶回收。
[0069]
1.3.1.3 目的片段胶回收参照axyprep dna凝胶回收试剂盒说明书进行pcr产物回收,nanodrop 2000分光光度计检测回收产物浓度后,将目的片段溶液置于
‑
20℃保存。
[0070]
1.3.1.4 连接t载体及转化感受态细胞
参照zero background ptopo
‑
ta simple cloning kit试剂盒说明书,对目的片段与t载体进行连接反应。连接体系及反应条件(10 μl反应体系):将目的片段、peasy
®‑
t1 cloning vector于冰上溶解,吸取1 μl目的片段、1 μl ptopo
‑
t simple vector、1 μl 10
ꢀ×ꢀ
enhancer、7 μl灭菌水于200 μl pcr管中,在室温(20℃~30℃)下用移液器轻轻吹打混匀,低速瞬时离心收集所有液体在离心管底,室温(20℃~30℃)连接5 min。用热激法转化trans1
‑
t1大肠杆菌感受态细胞。
[0071]
1.3.1.5 菌落检测菌种保存及测序:挑取阳性单菌落于5 ml amp(50mg/ml) lb液体培养基(附录二)中,200 rpm,37℃,摇菌,过夜培养。分成两份各1 ml,一份送至上海生工生物科技有限公司进行测序,另一份加入300 μl菌液 300 μl 40% lb甘油保存液,
‑
20℃保存菌种。
[0072]
克隆的bnaacp3
63r
‑
1、bnaacp3
63r
‑
2、bnaacp3
63q
‑
1、bnaacp3
63q
‑
2长度约为280 bp(图8a),经胶回收后,再以bnaacp3
63r
‑
1和bnaacp3
63r
‑
2为模板合成bnaacp3
63r
(约560 bp),以bnaacp3
63q
‑
1、bnaacp3
63q
‑
2为模板合成bnaacp3
63q
(约560 bp)(图8b),目的条带符合预期。
[0073]
回收目的基因片段t载体连接并转化大肠杆菌感受态细胞,经单菌落筛选和菌落pcr验证后(约700 bp)(图9),送生物公司测序。
[0074]
1.3.2三个基因的分析鉴定用snapgene 3.2.1将克隆到的靶基因序列翻译成氨基酸,进行序列比对,结果见图10。
[0075]
测序结果得到3条cds序列,长度均为396 bp,编码131个氨基酸,分别命名为bnaacp3
63k
、bnaacp3
63r
与bnaacp3
63q
。根据芸薹属数据库及甘蓝型油菜数据库的序列(bnac09g16320d),用dnaman 7.0比对其cds序列以及氨基酸序列,并构建进化树(图10),结果显示,克隆到的bnaacp3
63k
、bnaacp3
63r
和bnaacp3
63q
与bnac09g16320d比对结果中,有99.12%的同源性,bnaacp3
63k
、bnaacp3
63r
与编码序列有99%的同源性,与bnaacp3
63q
有98%的同源性;在编码氨基酸的序列比对中,bnaacp3
63k
与数据库中编码序列同源性达到100%,与bnaacp3
63r
和bnaacp3
63q
达到99%,表明成功通过重叠引物pcr的方法,将第63号位氨基酸分别定向突变为精氨酸和谷氨酰胺,达到预期结果。
[0076]
1.3.3过表达载体构建及转化拟南芥分析1.3.3.1过表达载体构建(1)引物设计根据克隆结果,设计引物m13,用于检测阳性克隆载体。根据bnaacp3基因序列信息,选择植物双元表达载体pcambia1300多克隆位点附近eco ri(gaattc)、sal i(gtcgac)作为酶切位点,图谱如图11所示。选择35s启动子内一段序列作为上游引物,bnaacp3内一段保守序列为下游引物,作为检测阳性表达载体及转基因阳性苗引物,此为检测引物1,另根据表达载体pcambia1300上hyg抗性标签序列,设计检测引物2,以上引物均利用primer premier 6.0设计,由擎科生物科技有限公司合成(表3)。
[0077]
表3植物表达载体构建及检测引物
(2)提取大肠杆菌质粒取10 μl经琼脂糖凝胶电泳及测序鉴定的阳性大肠杆菌于10 ml amp(50mg/ml) lb液体培养基中,另挑取大肠杆菌(含pcambia1300质粒)单菌落于10 ml kan(50 mg/ml) lb液体培养基中,37℃,摇菌,过夜培养。参照质粒抽提试剂盒说明书提取质粒,用bnaacp3和m13引物检测克隆载体质粒。
[0078]
(3)酶切使用eco ri、sal i限制性内切酶对阳性质粒(含目的片段)及pcambia1300植物表达载体进行双酶切反应。反应体系(30 μl体系):6 μl质粒(<1 μg),2 μl 10
ⅹ
o buffer,1μl eco ri、1 μl sal i,20 μl ddh2o。反应条件:混匀酶切液后,置于pcr仪37℃,孵化1 h。反应结束后以1.5%琼脂糖凝胶电泳检测及回收目的片段。
[0079]
(4)连接重组质粒连接反应体系(10 μl体系):5 μl目的片段、2 μl线性化的pcambia1300植物表达载体片段、1 μl 10
ⅹ
ligase buffer、1 μl t
4 dna ligase,1 μl ddh2o。
[0080]
连接反应条件:将连接液混匀后,置于pcr仪,16℃,连接过夜。
[0081]
(5)重组质粒转化大肠杆菌dh5α(e.coli)感受态细胞(6)提取重组质粒(7)参照陶芬芳的实验方法,制备农杆菌感受态、重组质粒转化及阳性鉴定。
[0082]
挑选阳性克隆载体质粒,利用限制性内切酶eco ri、sal i,分别对其以及植物表达载体pcambia1300进行双酶切(图12),胶回收目的片段,用连接酶连接回收的目的片段与线性化后的pcambia1300,转化大肠杆菌感受态细胞dh5α,加大培养并提取质粒。用检测引物1对其做pcr检测,目的片段约1153 bp,目的条带符合预期。利用限制性内切酶eco ri、sal i对其进行双酶切检测,结果如图13所示。经过质粒pcr检测及酶切检测等双重检测,其电泳片段与目的片段大小一致,表明pcambia1300
‑
bnaacp3载体构建成功。用snapgene 3.2.1构建重组质粒图谱(图11)。
[0083]
1.3.3.2过表达载体转化拟南芥野生型(wt)拟南芥种植与侵染参照邢蔓的实验方法并加以改进。
[0084]
邢蔓. 甘蓝型油菜bngpat9基因的克隆与表达分析[d]. 长沙: 湖南农业大学, 2018.将构建成功的pcambia1300
‑
bnaacp3植物表达载体,用热激法转化农杆菌gv3101感受态细胞,经rif(50 mg/ml) kan(50 mg/ml) yeb固体培养基筛选后,挑取单菌落于10 ml rif(50 mg/ml) kan(50 mg/ml) yeb液体培养基摇菌,用检测引物1(1153 bp)进行菌液pcr检测,结果表明pcambia1300
‑
bnaacp3植物表达载体转化农杆菌成功(图14),并将其
转入拟南芥。
[0085]
1.3.3.3转基因拟南芥脂肪酸组成分析采用sp
‑
6890型气相色谱仪、fid检测器、n3000色谱工作站、毛细管色谱柱db
‑
23进行对收获的t1代拟南芥种子进脂肪酸组成测定。
[0086]
分别收集野生型拟南芥种子(wt),bnaacp3
63q
、bnaacp3
63r
转基因t1代种子,烘干后进行气相色谱分析种子脂肪酸组成。结果显示如图15,与野生型拟南芥(wt)相比较,甘蓝型油菜bnaacp3
63q
、bnaacp3
63r
基因在拟南芥中异源表达,模拟发生乙酰化修饰的bnaacp3
63q
中的油酸(c18:1)含量比野生型约增加了1.75%,变化幅度12.9%,而亚油酸(c18:2)含量减少了1.27%,幅度为4.95%;模拟未发生乙酰化修饰的bnaacp3
63r
中的油酸含量比wt约增加了0.91%,幅度为6.67%,而亚油酸含量减少了0.68%,幅度为2.64%,表明bnaacp3的乙酰化修饰对油酸和亚油酸可能具有选择作用,能够减缓油酸向亚油酸的转化,之后将在这些t1代拟南芥叶片中进行基因阳性鉴定。脂肪酸合成路径乙酰辅酶a及其他乙酰化激酶的作用,可改变脂肪酸合成及油酸积累。
[0087]“乙酰化”是改变蛋白质功能最主要的修饰方式之一。蛋白质在执行生命复杂的调控和信息传递功能过程中,需要在蛋白质分子链上接上某种分子或分子团,以改变蛋白质的功能,称之为“蛋白质的修饰”。如果蛋白质的分子链上嫁接上一个乙酰基分子,则称为“乙酰化”修饰。修饰后的蛋白质可以对细胞内的各类通路进行精确的调节与控制。
[0088]
从生长发育、疾病发生发展、植物抗逆到免疫调控等,均与代谢过程密不可分。例如,diabetes上已发表的文章发现糖尿病病理过程存在显著的乙酰化修饰改变;代谢是目前肿瘤领域最热点研究方向;而植物抗逆的过程,实际上就是植物通过各种策略和机制,来维持代谢稳态,以平衡防御、生长与存活之前关系的过程。在免疫方面,研究证实免疫细胞在促炎和抗炎过程中,具有完全不同的代谢策略,并且乙酰化修饰可能在其中扮演重要作用。甚至,代谢研究的顶级期刊《cell metabolism》发表的研究还曾发现,在有些代谢状态下,乙酰化修饰对代谢的调控,比蛋白表达调控、磷酸化调控更为重要。
[0089]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。