
1.本发明涉及一种高透过率的界面组装核-壳型全液态器件及其制备方法与力学性能调控方法,属于微液滴制备技术领域。
背景技术:
2.液滴等全液态器件具有彼此独立的微小体积,并且能够方便地大量制备,因此对于微纳尺度下的生物技术具有重要意义,如微型生化反应、高通量筛选等。
3.常规的液滴制备可以通过乳化不相容的双水相实现,例如利用乳化聚乙二醇(peg)与葡聚糖(dex)的二元双水相溶液可以得到分散的液滴,实现三维环境下的细胞培养(例如us20140120573a1,wo2016044681a1公开的方法)。但是该方法仅仅利用双水相自身的不相容性提供液滴的稳定机制,无法解决分散后液滴的动态聚并问题,而且物质的渗透交换需要穿过整个分散溶液层才能够到达液滴,严重影响高效的交换速率。
4.改进的策略包括在液滴表面利用界面活性物质稳定液滴形貌(l.tea,t.nicolai,f.renou,stabilization of water-in-water emulsions by linear homo-polyelectrolytes,langmuir 35(27)(2019)9029-9036),或者包覆一层凝胶壳层(例如wo2015085898a1公开的方法),从而改进液滴的结构稳定性以及渗透性。其中以水凝胶包覆效果最佳,例如在液滴的分散过程中通过微流控技术增加一层额外的海藻酸钠水凝胶壳层从而提升液滴的稳定性(k.x.zhu,y.r.yu,y.cheng,c.h.tian,g.zhao,y.j.zhao,all-aqueous-phase microfluidics for cell encapsulation,acs appl.mater.inter.11(5)(2019)4826-4832)。尽管水凝胶包覆的液滴解决了液滴的聚并问题,但是水凝胶包覆层的渗透交换性能依旧较差,其存在增加了额外的渗透阻力,使得液滴的透过性不理想,不利于液滴与周围环境的物质渗透交换;离子交联的水凝胶的耐溶胀性能在无机盐溶液中较差,不利于液滴结构稳定性的长期保持。
技术实现要素:
5.为解决上述技术问题,本发明的目的在于提供一种高透过率的界面组装核-壳型全液态器件及其制备方法;该核-壳型全液态器件具有良好的渗透性能,为基于渗透反应的全液态器件性能调控提供了更大的灵活性。
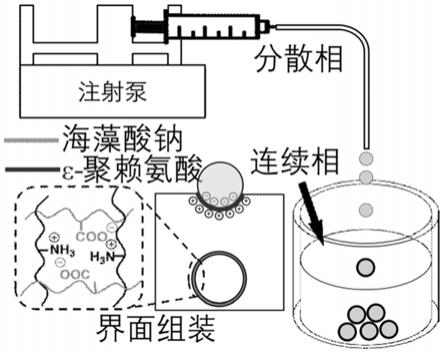
6.为达到上述目的,本发明提供了一种高透过率的界面组装核-壳型全液态器件的制备方法,其包括如下步骤:
7.以海藻酸钠(alg)溶液为分散相,以ε-聚赖氨酸(ε-pl)溶液为连续相;
8.将所述分散相加入所述连续相中,通过海藻酸钠与ε-聚赖氨酸的界面组装(或称超分子界面聚合)得到核-壳型全液态器件,记为alg@ε-pl。
9.根据本发明的具体实施方案,海藻酸钠溶液的质量浓度可以为0.5%-5%。该海藻酸钠溶液可以是海藻酸钠的水溶液。
10.根据本发明的具体实施方案,ε-聚赖氨酸溶液的质量浓度为0.5%-5%。该ε-聚赖氨酸溶液可以是ε-聚赖氨酸的水溶液。
11.海藻酸钠与ε-聚赖氨酸可以通过静电相互作用发生超分子聚合,并且由于两种物质均为聚电解质,相互之间的分子链缠结阻碍了超分子聚合的扩散延伸,使得超分子聚合仅限于接触的界面,从而实现界面组装,如图1所示。由于海藻酸钠与ε-聚赖氨酸之间的强相互静电相互作用,使得得到的超分子聚合界面拥有比金属离子交联的海藻酸钠水凝胶具有更好的力学性能以及耐溶胀性;同时,调控界面组装的动力学,能够实现界面组装层的高透明性以及高透过性,为基于渗透反应的全液态器件性能调控提供了更大的灵活性;除此之外,由于ε-聚赖氨酸对于脂溶性药物的亲和性,核-壳型全液态器件能够显著提升其渗透交换效率。
12.根据本发明的具体实施方案,界面组装的温度可以控制为10℃-30℃,界面组装的时间可以控制为10s-60s。
13.根据本发明的具体实施方案,分散相优选是以液滴的形式以恒定速率加入所述连续相中,加入过程可以通过注射泵进行。
14.根据本发明的具体实施方案,本发明所提供的高透过率的界面组装核-壳型全液态器件的制备方法可以按照以下具体步骤进行:
15.将海藻酸钠按照不同的浓度溶解在水中,作为分散相;
16.将ε-聚赖氨酸按照不同的浓度溶解在水中,作为连续相;
17.通过注射泵将分散相按照恒定速率加入到连续相中,通过海藻酸钠与ε-聚赖氨酸的界面组装得到核-壳型全液态器件,记为alg@ε-pl;
18.将alg@ε-pl取出,用蒸馏水清洗,得到核-壳型全液态器件。
19.本发明所提供的制备方法通过双水相界面组装获得核-壳型全液态器件,制备过程简单,可以实现连续化操作,利于大规模生产,能够应用于生物医学领域并满足全液态器件力学性质的按需调节。并且界面组装过程的动态可控性好,得到的核-壳型全液态器件具有相比水凝胶更好的透明性以及耐溶胀性。
20.本发明提供的界面组装核-壳型全液态器件的制备方法利用具有生物相容性的聚电解质溶液制备出高透明性、耐溶胀性以及透过率的核-壳型全液态器件,克服了传统方法对于双水相必须不混溶的限制,拓宽了可选用的材料范围,并且适用于包括液滴在内的各种形状的全液态器件制备,如纤维状、环状、螺旋状等。
21.本发明还提供了一种高透过率的界面组装核-壳型全液态器件,其是由上述方法制备的。该高透过率的界面组装核-壳型全液态器件的可见光区透过率>85%。该全液态器件的形状可以为液滴状、纤维状、环状和螺旋状中的一种或两种以上的组合。
22.本发明制备的高透过率的界面组装核-壳型全液态器件能够应用于生物医学领域,并具有丰富的功能化前景,例如满足全液态器件力学性质的按需调节以及亲脂性药物的渗透交换。
23.本发明还提供了上述高透过率的界面组装核-壳型全液态器件的力学性能调控方法,该方法是利用界面组装核-壳型全液态器件的渗透性来实现对其力学性能的调控,其包括以下步骤:
24.将所述高透过率的界面组装核-壳型全液态器件浸泡在含钙离子的水溶液中,通
过ca
2
将高透过率的界面组装核-壳型全液态器件固化;
25.对固化的高透过率的界面组装核-壳型全液态器件进行冲洗,然后浸泡在能够与ca
2
竞争配位的物质的水溶液中,通过调节该水溶液的浓度,实现固化高透过率的界面组装核-壳型全液态器件内部交联的可逆打开,得到不同力学性能的高透过率的界面组装核-壳型全液态器件。
26.根据本发明的具体实施方案,所述含钙离子的水溶液优选为cacl2水溶液;在所述cacl2水溶液中,cacl2的质量浓度可以为0.5%-5%。
27.根据本发明的具体实施方案,在所述能够与ca
2
竞争配位的物质的水溶液中,溶质的质量浓度可以为0.5%-5%。
28.根据本发明的具体实施方案,所述能够与ca
2
竞争配位的物质优选包括nacl,三乙醇胺,青霉胺,柠檬酸钠和乙二胺四乙酸二钠中的一种两种以上的组合。
29.根据本发明的具体实施方案,本发明提供的高透过率的界面组装核-壳型全液态器件的力学性能调控方法可以包括以下步骤:
30.将alg@ε-pl浸泡在cacl2水溶液中,通过离子交联将alg@ε-pl固化;
31.将固化alg@ε-pl取出,用蒸馏水进行冲洗,然后浸泡在能够与ca
2
竞争配位物质的水溶液中,通过调节溶液浓度的不同,可以实现固化alg@ε-pl内部交联的可逆打开,从而呈梯度地软化经ca
2
配位交联的alg@ε-pl。
32.本发明提供的制备方法一方面利用界面组装技术制备了具有高渗透性的核-壳结构的全液态器件,另外一方面突破了现有技术对于聚乙二醇与葡聚糖的二元溶液的依赖,赋予全液态器件更多的功能化潜力,如本发明提供的力学性质按需调节以及对于亲脂性药物渗透交换的促进作用。
33.本发明制备的高透过率的界面组装核-壳型全液态器件面向生物医学领域对于微纳尺度下生化反应以及高通量药物筛选的实际需求,具有非常巨大的市场应用前景。同时,本发明提供的全液态器件功能化的按需定制也提供了更加灵活的适用场景。
附图说明
34.图1为通过界面组装实现核-壳型液滴制备的示意图。
35.图2为核-壳型液滴的光学以及包覆层的荧光染色照片。
36.图3为核-壳型液滴的包覆层厚度随聚合时间变化对比图。
37.图4为核-壳型液滴的可见光透过性示意图。
38.图5为核-壳型液滴在不同alg浓度时,可见光透光率随时间的变化图。
39.图6为alg,ε-pl,核-壳型液滴中界面聚合包覆层的红外光谱图。
40.图7为不同聚合时间制备的核-壳型液滴在承压状态下最大形变率的变化柱状图。
41.图8为核-壳型液滴与ca
2
交联的alg的水凝胶在不同浓度的nacl溶液中的溶胀对比图。
42.图9为核-壳型液滴在ca
2
交联后固化以及在不同配位竞争溶液中软化后的力学性质对比图。
43.图10为核-壳型液滴在ca
2
交联后固化及在梯度nacl溶液中软化的力学性质对比图。
44.图11为脂溶性药物gefitnib在核-壳型液滴表面富集以及向内扩散的图像。
具体实施方式
45.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
46.实施例1
47.本实施例提供了高透过率的界面组装核-壳型液滴的制备方法,该方法按照以下具体步骤进行:
48.将海藻酸钠溶解在水中,得到浓度为1.5%的海藻酸钠水溶液,作为分散相;
49.将ε-聚赖氨酸溶解在水中,得到浓度为1.0%的ε-聚赖氨酸水溶液,作为连续相;
50.通过注射泵将分散相按照恒定速率以液滴形式加入到连续相中,通过海藻酸钠与ε-聚赖氨酸的界面组装得到核-壳型液滴,记为alg@ε-pl,界面组装的温度为25℃,时间为10-50s;
51.将alg@ε-pl取出,用蒸馏水清洗,得到核-壳型液滴。
52.图2为核-壳型液滴的光学以及包覆层的荧光染色照片,制备该液滴时的界面组装时间为20s。图2的左图为光学照片,该图体现了液滴的透明性,图2的右图为荧光照片,发荧光的部分是海藻酸钠和ε-聚赖氨酸通过界面组装形成的外壳,而里面没有荧光的部分为液体。
53.图3为不同界面组装时间制备的alg@ε-pl的包覆层厚度随聚合时间变化对比图。通过图2展示的荧光染色可以获得核-壳结构的液滴的外壳包覆层厚度,而图3是改变界面组装的时间(从10s到50s)统计得到的包覆层厚度,即包覆层在不同时间点的厚度。
54.图7为不同界面组装时间制备的核-壳型液滴(未经过固化时)在承压状态下最大形变率的变化柱状图。图7的数据是通过压缩试验获得了液滴在承压状态下的最大形变率。由图7可以看出:界面组装时间达到20秒就可以获得较好的耐压缩稳定性。
55.实施例2
56.本实施例提供了高透过率的界面组装核-壳型液滴的制备方法,按照以下具体步骤进行:
57.将海藻酸钠溶解在水中,得到浓度为2%的海藻酸钠水溶液,作为分散相;
58.将ε-聚赖氨酸溶解在水中,得到浓度为1.0%的ε-聚赖氨酸水溶液,作为连续相;
59.通过注射泵将分散相按照恒定速率以液滴形式加入到连续相中,通过海藻酸钠与ε-聚赖氨酸的界面组装得到核-壳型液滴,记为alg@ε-pl,界面组装的温度为25℃,时间分别为20s、30s和40s;
60.将alg@ε-pl取出,用蒸馏水清洗,得到核-壳型液滴。
61.图4为实施例2通过不同界面组装时间制备的核-壳型液滴的可见光透过性示意图。由图4可以看出:界面组装时间超过20s之后,延长界面组装时间会显著降低液滴的可见光透过性。
62.实施例3
63.本实施例提供了高透过率的界面组装核-壳型液滴的制备方法,按照以下具体步骤进行:
64.将海藻酸钠溶解在水中,分别得到浓度为2%、3%的海藻酸钠水溶液,作为分散相;
65.将ε-聚赖氨酸溶解在水中,得到浓度为1.0%的ε-聚赖氨酸水溶液,作为连续相;
66.通过注射泵将分散相分别按照恒定速率以液滴形式加入到连续相中,通过海藻酸钠与ε-聚赖氨酸的界面组装得到核-壳型液滴,记为alg@ε-pl,界面组装的温度为25℃,时间分别为10s-50s;
67.将alg@ε-pl取出,用蒸馏水清洗,得到核-壳型液滴。
68.图5为实施例3制备的核-壳型液滴在不同alg浓度时,可见光透光率随时间的变化图。图5对比了两种浓度的海藻酸钠溶液制备核-壳型液滴的可见光透过性能。由图5可以看出:相对于3%的浓度,浓度2%的海藻酸钠溶液能够获得更高可见光透过性的液滴。
69.图6为实施例3通过浓度为2%的海藻酸钠水溶液、20s的界面组装时间制备的核-壳型液滴的界面聚合包覆层的红外光谱图。图6出现了海藻酸钠(用alg标识)中的羧基振动峰从1600厘米-1
移动至1581厘米-1
的现象,这说明在由海藻酸钠与ε-聚赖氨酸形成的包覆层中,海藻酸钠(用alg标识)与ε-聚赖氨酸(用ε-pl标识)具有强的分子间相互作用。该图6为包覆层的形成提供了分子作用层面的机理证据。
70.实施例4
71.对实施例1制备的核-壳型液滴就进行力学性能调控,按照以下步骤进行:
72.将不同界面组装时间制备的alg@ε-pl分别浸泡在浓度为1%的cacl2水溶液中,通过离子交联将alg@ε-pl固化;
73.将固化alg@ε-pl取出,用蒸馏水进行冲洗,然后浸泡在浓度为0.1m的nacl溶液中,实现固化alg@ε-pl内部交联的可逆打开,从而呈梯度地软化经ca
2
配位交联的alg@ε-pl。
74.实施例5
75.对实施例3通过浓度为2%的海藻酸钠水溶液、界面组装时间20s制备的核-壳型液滴就进行力学性能调控,按照以下步骤进行:
76.将不同界面组装时间制备的alg@ε-pl分别浸泡在浓度为1%的cacl2水溶液中,通过离子交联将alg@ε-pl固化;
77.将固化alg@ε-pl取出,用蒸馏水进行冲洗,然后浸泡在不同浓度的nacl溶液中,实现固化alg@ε-pl内部交联的可逆打开,从而呈梯度地软化经ca
2
配位交联的alg@ε-pl。
78.图8是核-壳型液滴与ca
2
交联的alg的水凝胶在不同nacl溶液中的溶胀对比图。由图8可以看出:核-壳型液滴在不同浓度的nacl溶液中均具有良好的耐溶胀性能,甚至要优于传统的海藻酸钠-钙水凝胶(alg-ca
2
水凝胶)。
79.alg-ca
2
水凝胶的制备方法是:将浓度为2wt%的海藻酸钠溶液滴加在浓度1wt%的cacl2水溶液中,然后静置十五分钟取出。这个制备方法在文献(x.du,h.cui,q.zhao,j.wang,h.chen,y.wang,inside-out 3d reversible ion-triggered shape-morphing hydrogels.research 2019,2019,6398296)以及(bajpai,s.k.;sharma,s.investigation of swelling/degradation behaviour of alginate beads crosslinked with ca
2
and ba
2
ions.react.funct.polym.2004,59,129-140)中都有报道。
80.图10为核-壳型液滴在ca
2
交联后固化及在梯度nacl溶液中软化的力学性质对比图。由图10可以看出:经过钙离子交联后的液滴,通过浸泡在不同浓度的nacl溶液中,可以
实现不同程度的软化,获得理学性质的可控变化。
81.实施例6
82.对实施例3通过浓度为2%的海藻酸钠水溶液、界面组装时间20s制备的核-壳型液滴就进行力学性能调控,按照以下步骤进行:
83.将不同界面组装时间制备的alg@ε-pl分别浸泡在浓度为1%的cacl2水溶液中,通过离子交联将alg@ε-pl固化;
84.将固化alg@ε-pl取出,用蒸馏水进行冲洗,然后浸泡在浓度为1%的不同配位竞争溶液中,实现固化alg@ε-pl内部交联的可逆打开,从而呈梯度地软化经ca
2
配位交联的alg@ε-pl。
85.图9为核-壳型液滴在ca
2
交联后固化以及在不同配位竞争溶液中软化后的力学性质对比图。由图9可以看出:核-壳型液滴在经过钙离子交联后,还可以通过与配位竞争溶液经过离子交换的形式回复原始的液滴状态。
86.实施例7
87.对实施例3通过浓度为2%的海藻酸钠水溶液、界面组装时间20s制备的核-壳型液滴进行脂溶性药物gefitnib的扩散实验,按照以下步骤进行:
88.1)将gefitnib溶解在少量dmso中,然后按照最终30μm摩尔浓度的剂量分散在水中(由于gefitnib不溶于水,所以需要dmso溶解,并使用涡旋分散)。
89.2)将液滴浸泡在gefitnib的水分散液中,浸泡半小时,取出,用清水润洗。
90.3)利用显微镜以及488nm的激光进行观察,获得gefitnib在液滴中的分布,分别观察不同浸泡时间时的分布。
91.图11为脂溶性药物gefitnib在核-壳型液滴表面富集以及向内扩散的图像。图11体现了gefitnib从水分散液中被富集到包覆层(左图为浸泡5分钟时的分布),进而扩散至液滴内部的过程(右图为浸泡30分钟时的分布)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
![用于合成二氮杂二环[6.2.0]癸烷相关化合物的方法与流程](http://img.xjishu.com/img/zl/2021/11/16/pk9nyu86y.jpg)