基于线粒体基因组序列开发的老芒麦mtssr标记引物及其应用
技术领域
1.本发明涉及植物生物技术领域,具体涉及一种基于线粒体基因组序列开发的老芒麦 mtssr标记引物及其应用。
背景技术:
2.老芒麦(elymus sibiricus)和垂穗披碱草(elymus nutans)是小麦族披碱草属多年生疏丛型草本植物,由于其营养丰富,且对高寒地区的生态适应性良好,现已成为青藏高原等地的优势草种,具有广泛的利用前景。目前栽培利用的老芒麦和垂穗披碱草品种都是在收集优良野生种质的基础上,经过选育而来。准确鉴定和收集野生种质是选育老芒麦和垂穗披碱草优良品种的前提。
3.老芒麦和垂穗披碱草均为花序下垂类禾草,通过一些形态学特征可将二者进行初步区分。一般而言,垂穗披碱草的花序更为紧密,小穗排列偏于穗轴的一侧,颖先端具芒尖;而老芒麦的花序疏松,小穗均匀排列在穗轴两侧,颖先端具有短芒。但是,复杂的野外环境如土壤肥力、海拔等会使老芒麦和垂穗披碱草的形态特征存在交叉,难以对二者进行准确的区分。虽然细胞遗传学表明老芒麦为异源四倍体(2n=4x=28,sshh),垂穗披碱草为异源六倍体 (2n=6x=42,sshhyy)。然而,对野外采集的大量种质资源进行倍性鉴定费时费力,亟需更为有效的分子标记对其进行鉴定。
4.ssr(simple sequence repeats)分子标记由于具有基因组广布性、高多态性和高物种转移性而被广泛用于遗传多样性研究、物种区分和品种鉴定等。目前已开发出了一些基因组ssr (g
‑
ssr)和转录组ssr(est
‑
ssr)用于老芒麦和垂穗披碱草的区分,但未见线粒体ssr (mtssr)用于区分二者的报道。
技术实现要素:
5.本发明所要解决的技术问题是提供一种用于区分野生老芒麦和垂穗披碱草的基于线粒体基因组序列开发的老芒麦mtssr标记引物。
6.本发明解决其技术问题所采用的技术方案为:该基于线粒体基因组序列开发的老芒麦 mtssr标记引物,包括4对多态性引物,其核苷酸序列如序列表sequence id no.1~8所示。
7.进一步的是,所述老芒麦mtssr标记引物采用如下方法得到:
8.1)、提取老芒麦植物的线粒体dna,并对提取的线粒体dna进行纯度、浓度和完整性检测,剔除纯度、浓度、完整性不合格的dna片段得到合格dna片段;
9.2)、使用bluepippin全自动核酸回收仪回收步骤1)得到的合格dna片段;
10.3)、利用磁珠对回收的合格dna片段进行初次纯化处理;
11.4)、对初次纯化处理的dna片段进行损伤及末端修复;
12.5)、再次利用磁珠对修复后的dna片段进行纯化处理得到目的dna;
13.6)、使用sqk
‑
lsk109试剂盒中测序接头将经过步骤5)处理得到的目的dna片段进行连接得到dna文库;
14.7)、使用qubit对步骤6)得到的dna文库进行精确定量;
15.8)、将一定浓度和体积的dna文库加入到flowcell中,并将flowcell转移到oxfordnanoporepromethion测序仪进行实时单分子测序获得线粒体基因组全长,并通过高通量illumina测序结果对其进行校正,然后使用三代组装软件canu对校正后的三代数据进行拼接,设置基因组大小为5m,correctederrorrate=0.03,得到contig序列,使用blastv2.6将contig序列比对植物线粒体基因数据库,将比对上线粒体基因的contig做为种子序列,使用原始数据对其进行延伸和环化,得到环状主宰结构,然后使用nextpolish1.3.1用三代数据对组装结果进行校正,再使用pilon软件用二代数据对其进行校正,得到环状的老芒麦线粒体基因组;
16.9)、利用misaperl脚本软件搜索老芒麦线粒体基因组中分布的ssr位点,参数设定分别为:单核苷酸重复序列,重复单元≥8;二核苷酸重复序列,重复单元≥5;三核苷酸重复序列,重复单元≥3;四、五、六核苷酸重复序列,重复单元≥3;
17.10)、利用primerpremier5软件按照如下引物设计原则进行mtssr引物设计并筛选得到所述4对老芒麦mtssr标记引物,所述引物设计原则如下所示:引物长度范围18
‑
26个碱基;退火温度范围50
‑
60℃;产物长度100
‑
300bp。
18.本发明还提供了上述基于线粒体基因组序列开发的老芒麦mtssr标记引物在老芒麦和近缘物种垂穗披碱草野生种质资源群体结构和物种鉴定上的应用。
19.本发明还提供了一种上述基于线粒体基因组序列开发的老芒麦mtssr标记引物进行老芒麦和近缘物种垂穗披碱草野生种质资源群体结构和物种鉴定的方法,包括如下步骤:
20.a、基因组dna的提取;首先,收集一定数量的老芒麦和一定数量的垂穗披碱草的幼嫩叶片,放入硅胶进行干燥,并采用ctab法对植物总dna进行提取,1%琼脂糖凝胶电泳检测dna完整性,并使用nanodrop2000对提取的dna进行纯度检测以及浓度的定量,最终将每个样品的dna浓度稀释到20ng/μl;
21.b、mtssr
‑
pcr反应;以步骤a提取的待测样品dna为模板,利用序列表sequenceidno.1~8所示引物进行pcr扩增,得到pcr扩增产物;pcr扩增体系共15μl,包含3μl模板dna,0.8μl上下游引物(5pmolμl
‑1),7.5μlmix(包含10
×
pcrbuffer,mg
2
,dntps),0.4μltaq酶(2.5uμl
‑1),2.5μlddh2o;
22.c、电泳检测;将步骤b得到的扩增产物进行多态性检测;并对清晰的条带进行统计,采用有带记为“1”,无带记为“0”的原则;
23.d、利用structure软件构建种质群体结构图。
24.进一步的是,在步骤b中,pcr扩增体系共15μl,包含3μl模板dna,0.8μl上下游引物(5pmolμl
‑1),7.5μlmix(包含10
×
pcrbuffer,mg
2
,dntps),0.4μltaq酶(2.5uμl
‑1),2.5μlddh2o。
25.进一步的是,在步骤b中,pcr扩增程序如下:94℃预变性4min;然后94℃变性30s,51
‑
66℃退火30s,72℃延伸1min,共330个循环;最后72℃延伸10min,于4℃保存。
26.进一步的是,在步骤c中,将扩增产物进行多态性检测的过程如下所述:将扩增产
物于 8%聚丙烯酰胺凝胶电泳进行多态性检测,电泳缓冲液为0.5
×
tbe,200v稳压20min,400v 稳压1.5h。
27.本发明的有益效果在于:本发明所述的4对老芒麦mtssr标记引物能够在老芒麦和近缘物种垂穗披碱草野生种质资源群体结构和物种鉴定上应用,利用开发的mtssr标记引物分析了老芒麦和垂穗披碱草野生种质资源间的群体结构,为老芒麦和垂穗披碱草的区分鉴定提供便利,同时本发明所述的4对老芒麦mtssr标记引物不但具有细胞核基因组ssr标记的共显性和高多态性等特点,还具有线粒体基因组dna的单亲遗传模式,不易发生重组,克服了传统分子标记开发效率低、周期长的特点,同时填补了老芒麦mtssr开发的空白,为老芒麦的遗传多样性评价、种质鉴定及分子标记辅助育种等研究奠定了基础。
附图说明
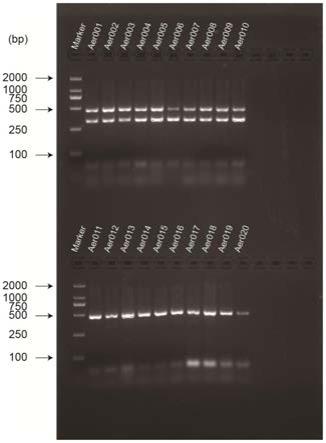
28.图1为引物mtssr1对60份野生老芒麦和32份野生垂穗披碱草进行pcr扩增后的电泳检测图;
29.图2为引物mtssr2对60份野生老芒麦和32份野生垂穗披碱草进行pcr扩增后的电泳检测图;
30.图3为引物mtssr3对60份野生老芒麦和32份野生垂穗披碱草进行pcr扩增后的电泳检测图;
31.图4为引物mtssr4对60份野生老芒麦和32份野生垂穗披碱草进行pcr扩增后的电泳检测图
32.图5是利用4对老芒麦mtssr标记引物构建的老芒麦和垂穗披碱草群体结构 structure图。
具体实施方式
33.下面结合实施例对本发明作进一步的说明。
34.本发明所述的基于线粒体基因组序列开发的老芒麦mtssr标记引物,包括4对多态性引物,其核苷酸序列如序列表sequence id no.1~8所示。
35.上述老芒麦mtssr标记引物采用如下方法得到:
36.1)、提取老芒麦植物的线粒体dna,并对提取的线粒体dna进行纯度、浓度和完整性检测,剔除纯度、浓度、完整性不合格的dna片段得到合格dna片段;dna片段的纯度、浓度、完整性是否合格从以下几点判断:观察样品的外观是否含有异物;琼脂糖电泳检测是否样品有降解以及dna片段大小;nanodrop/onedrop检测dna纯度;qubit对dna进行精确定量;样品外观无异物,琼脂糖电泳检测无降解、dna片段较大、dna纯度达标等作为合格的依据;
37.提取老芒麦植物的线粒体dna的具体过程如下所述:
38.(1)线粒体粗提操作流程:
①
选用黄化苗,按每克材料20ml缓冲液的比例准备缓冲液 a(使用前加入0.2%bsa、0.2%半胱氨酸、0.5%β
‑
巯基乙醇,然后轻柔颠倒混匀或搅拌溶解后放冰上预冷待用)。注意:试剂现用现加,每次实验用多少配多少,不能长期保存。处理样品量太大的话线粒体产率会急剧降低,所以如果同一样品太多可分成多组平行处理,得到线粒体粗提物后再汇集。
②
使用液氮研磨法,将1
‑
2g的绿色植物组织(去叶脉后的嫩叶子、愈伤组织)或干净的非绿色植物组织(如发芽组织、根、块茎等)转移到研钵中,加入液氮
研磨至粉末状态,注意及时补充液氮以防粉末潮解,然后迅速转移至预冷的装有10
‑
20ml缓冲液a的50ml离心管中,上下颠倒混匀。
③
用一层300目尼龙网过滤缓冲液,穿透液通过预冷的漏斗收集到预冷的50ml离心管中。
④
在冷冻离心机上4℃1000rpm离心5min,小心转移上清到新的预冷的50ml离心管中,冰上暂存,向沉淀中加入5ml预冷的缓冲液a,移液枪吹打混匀或上下颠倒混匀,1000rpm离心5min,收集两次离心所得上清,4000rpm离心10min,取上清转移到新的预冷的50ml离心管中。
⑤
在冷冻离心机上4℃12000g离心20min,弃上清液,所得沉淀即为线粒体粗提物。
⑥
加入10ml预冷的缓冲液b(使用前加入0.2%bsa,然后轻柔颠倒混匀或搅拌溶解后放冰上预冷待用),用枪头轻轻吹打或软毛笔轻柔重悬线粒体沉淀,不能剧烈震荡,否则线粒体容易破裂。
⑦
在冷冻离心机上4℃12000g离心20min,沉淀为线粒体,小心弃上清。
⑧
在沉淀中加入2ml预冷的缓冲液b(已加0.2%bsa、0.2%半胱氨酸),用枪头轻轻吹打重悬线粒体沉淀,不能剧烈震荡,否则线粒体容易破裂。
⑨
在显微镜下检测上一步得到的重悬液中线粒体的完整性。具体做法是先滴50ul左右的线粒体重悬液到载玻片上,再滴入50ul詹纳斯染液绿b染色液20min,光学显微镜下观察,蓝绿色颗粒状物即为线粒体。
⑩
向离心管中加入80uldnasei工作液:每个反应取10uldnasei(15u/ul)加入70ul的dnasebuffer,轻柔混匀,冰上放置1h,然后加入80ul0.5medta,混匀后静置10min以终止反应。将上述溶液小心铺于缓冲液c上(每管已事先准备好预冷的4ml缓冲液c),4℃12000g离心20min,沉淀为去除细胞核dna的线粒体。如果需要长期保存,则直接放
‑
80℃保存;
39.(2)线粒体dna的提取(具体参照天根dp305);
①
在线粒体沉淀中加入700ul65℃预热的裂解液,立即用移液枪充分吹打混匀,将离心管放在65℃水浴30min,期间颠倒离心管混匀数次。
②
加入10ulrnasea(25mg/ml)溶液,混匀后室温静置10min。
③
加入700ul氯仿,充分混匀,12000rpm离心5min。
④
小心转移上层水相(约650ul左右)到一个新的离心管中,避免触及中间层的白膜,然后加入700ul结合液或者0.5倍体积的无水乙醇/异丙醇,充分混匀。
⑤
将混匀的液体转入吸附柱,12000rpm离心30s,弃废液(吸附柱容积为700ul,可分次加入离心)。
⑥
向吸附柱中加入500ul洗涤液,12000rpm离心30s,弃废液。
⑦
向吸附柱中加入600ul漂洗液,12000rpm离心30s,弃废液。
⑧
重复上步操作。
⑨
12000rpm离心2min,将吸附柱转移至新的离心管,开盖室温静置数分钟,以彻底晾干吸附材料中残余的漂洗液。然后向吸附膜中间部位悬空滴加50ul左右洗脱液te,室温放置2
‑
5min,12000rpm离心2min,将溶液收集到离心管中。
⑩
为增加dna得率,可将离心得到的溶液再加入吸附柱,室温静置2min,12000rpm离心2min。浓度测定,琼脂糖凝胶电泳检测;
40.(3)高通量illumina联合纳米孔测序(nanoporesequencing)得到老芒麦植物的线粒体dna;
41.2)、使用bluepippin全自动核酸回收仪回收步骤1)得到的合格dna片段;
42.3)、利用磁珠对回收的合格dna片段进行初次纯化处理;
43.4)、对初次纯化处理的dna片段进行损伤及末端修复;
44.5)、再次利用磁珠对修复后的dna片段进行纯化处理得到目的dna;
45.6)、使用sqk
‑
lsk109试剂盒中测序接头将经过步骤5)处理得到的目的dna片段进行连接得到dna文库;
46.7)、使用qubit对步骤6)得到的dna文库进行精确定量;
47.8)、将一定浓度和体积的dna文库加入到flowcell中,并将flowcell转移到oxfordnanoporepromethion测序仪进行实时单分子测序获得线粒体基因组全长,并通过高通量illumina测序结果对其进行校正,然后使用三代组装软件canu对校正后的三代数据进行拼接,设置基因组大小为5m,correctederrorrate=0.03,得到contig序列,使用blastv2.6将contig序列比对植物线粒体基因数据库,将比对上线粒体基因的contig做为种子序列,使用原始数据对其进行延伸和环化,得到环状主宰结构,然后使用nextpolish1.3.1用三代数据对组装结果进行校正,再使用pilon软件用二代数据对其进行校正,得到环状的老芒麦线粒体基因组;利用高通量illumina测序联合纳米孔测序(nanoporesequencing)技术,获得了老芒麦线粒体全基因组序列,为老芒麦mtssr标记的开发提供了原始数据;
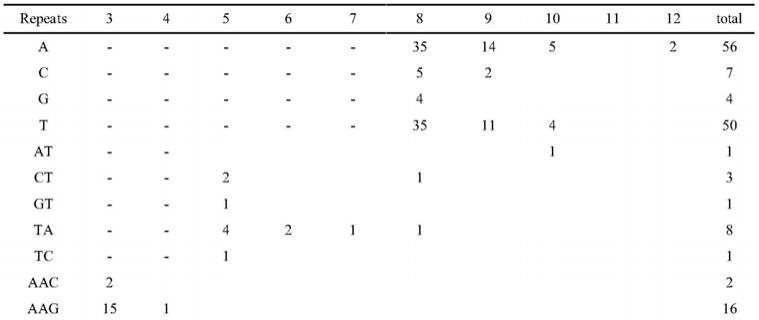
48.9)、利用misaperl脚本软件搜索老芒麦线粒体基因组中分布的ssr位点,参数设定分别为:单核苷酸重复序列,重复单元≥8;二核苷酸重复序列,重复单元≥5;三核苷酸重复序列,重复单元≥3;四、五、六核苷酸重复序列,重复单元≥3;搜索得到的老芒麦mtssr位点信息统计如下表1所示:
49.表1老芒麦mtssr位点信息统计
50.51.[0052][0053]
10)、利用primer premier 5软件按照如下引物设计原则进行mtssr引物设计,所述引物设计原则如下所示:引物长度范围18
‑
26个碱基;退火温度范围50
‑
60℃;产物长度100
‑
300bp,根据mtssr位点,共设计出281对mtssr引物,引物序列由有康生物科技有限公司(杭州) 合成,通过对15对mtssr引物筛选,可在老芒麦和垂穗披碱草中扩增出清晰且多态性高的电泳条带的mtssr共4对,即为本发明所述的4对老芒麦mtssr标记引物,老芒麦mtssr 标记引物信息如下表2所示:
[0054]
表2老芒麦mtssr标记引物信息
[0055][0056]
本发明还公开了上述基于线粒体基因组序列开发的老芒麦mtssr标记引物在老芒麦和近缘物种垂穗披碱草野生种质资源群体结构和物种鉴定上的应用。
[0057]
为了评价本发明所述的4对老芒麦mtssr标记引物在老芒麦野生种质和近缘物种垂穗披碱草区分上的适用性,本研究利用开发的多态性mtssr引物对60个野生老芒麦和32
个野生垂穗披碱草进行群体结构分析,具体步骤如下所述:
[0058]
a、基因组dna的提取;首先,收集60份老芒麦和32份垂穗披碱草的幼嫩叶片,分别放入硅胶进行干燥,并采用ctab法对植物总dna进行提取,1%琼脂糖凝胶电泳检测dna 完整性,并使用nanodrop 2000对提取的dna进行纯度检测以及浓度的定量,最终将每个样品的dna浓度稀释到20ng/μl;
[0059]
60份老芒麦和32份垂穗披碱草的幼嫩叶片信息如下表3所示:
[0060]
表3 60个野生老芒麦和32个野生垂穗披碱草样本采集地点信息
[0061]
[0062]
[0063][0064]
注:es,即老芒麦;en,即垂穗披碱草
[0065]
b、mtssr
‑
pcr反应;以步骤a提取的待测样品dna为模板,利用序列表sequenceidno.1~8所示引物进行pcr扩增,得到pcr扩增产物;pcr扩增体系共15μl,包含3μl模板dna,0.8μl上下游引物(5pmolμl
‑1),7.5μlmix(包含10
×
pcrbuffer,mg
2
,dntps),0.4μltaq酶(2.5uμl
‑1),2.5μlddh2o;pcr扩增体系共15μl,包含3μl模板dna,0.8μl上下游引物(5pmolμl
‑1),7.5μlmix(包含10
×
pcrbuffer,mg
2
,dntps),0.4μltaq酶(2.5uμl
‑1),2.5μlddh2o;pcr扩增程序如下:94℃预变性4min;然后94℃变性30s,51
‑
66℃退火30s,72℃延伸1min,共330个循环;最后72℃延伸10min,于4℃保存;
[0066]
c、电泳检测;将步骤b得到的扩增产物于8%聚丙烯酰胺凝胶电泳进行多态性检测,电泳缓冲液为0.5
×
tbe,200v稳压20min,400v稳压1.5h;并对清晰的条带进行统计,采用有带记为“1”,无带记为“0”的原则;每对老芒麦mtssr标记引物扩增电泳条带数为2(mtssr3、mtssr4)
‑
5条(mtssr2),4对老芒麦mtssr标记引物遗传多样性统计结果如表4所示:
[0067]
表4老芒麦mtssr标记遗传多样性统计
[0068]
引物名称位点数多态性位点多态性比例%mtssr13266.67%mtssr255100%mtssr322100%mtssr42150%
[0069]
由上表可知,平均每对引物扩增条带3条,实际扩增产物长度在100
‑
300bp之间,4对mtssr引物共扩增出12条带,其中多态性位点数量为10个,多态性位点所占比例为83.33%。平均每对引物多态性位点2.5个,每对mtssr多态性比例在50%
‑
100%之间。图1为引物 mtssr1对60份野生老芒麦和32份野生垂穗披碱草进行pcr扩增后的电泳检测图,泳道
1 和泳道94为50bp dna ladder标准分子量;泳道2
‑
61:老芒麦野生种质;泳道62
‑
93:垂穗披碱草野生种质;图2为引物mtssr2对60份野生老芒麦和32份野生垂穗披碱草进行pcr 扩增后的电泳检测图,泳道1和泳道94为50bp dna ladder标准分子量;泳道2
‑
61:老芒麦野生种质;泳道62
‑
93:垂穗披碱草野生种质;泳道96
‑
97为泳道69和72缺失补样;图3为引物mtssr3对60份野生老芒麦和32份野生垂穗披碱草进行pcr扩增后的电泳检测图,泳道1和94为50bp dna ladder标准分子量;泳道2
‑
61:老芒麦野生种质;泳道62
‑
93:垂穗披碱草野生种质;图4为mtssr4对60份野生老芒麦和32份野生垂穗披碱草进行pcr扩增后的电泳检测图,泳道93为50bp dna ladder标准分子量;泳道1
‑
60:老芒麦野生种质;泳道61
‑
92:垂穗披碱草野生种质。mtssr在老芒麦种内或者种间存在较高程度的遗传变异,其结构简单、开发较易,且具有细胞核基因组ssr分子标记共显性、高度变异和高多态性等特点。具有细胞质特有的单亲遗传模式,不易发生重组。因此,本发明提供的老芒麦mtssr 多态性引物可用于老芒麦及其近缘物种的种质遗传多样性分析。
[0070]
d、利用structure软件构建种质群体结构图,如图5所示,图5是利用4对老芒麦 mtssr标记引物构建的老芒麦和垂穗披碱草群体结构structure图,structure结果表明,供试材料最佳k值为2,即有2个遗传背景;对于3个老芒麦群体而言,青藏高原材料 (青藏高原
‑
es)的遗传构成与另外两个群体(新疆
‑
es和华北
‑
es)有所不同;垂穗披碱草(青藏高原
‑
en)的遗传构成明显区别于其他三个老芒麦群体,证明所采用的4对mtssr不仅能将老芒麦和垂穗披碱草区分开,亦能对不同来源地的老芒麦种质进行区分,适用于老芒麦及其近缘物种的遗传多样性分析以及分子标记辅助育种等研究。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。