样品制备、处理和分析系统
本技术是申请日为2012年10月20日,申请号为201710265086.4, 发明名称为“样品制备、处理和分析系统”的申请的分案申请。申请日为2012年10月20日,申请号为201710265086.4,发明 名称为“样品制备、处理和分析系统”的申请是2012年10月20日提 交的发明名称为“样品制备、处理和分析系统”的第201280063969.2 号中国专利申请(国际申请号pct/us2012/061223)的分案申请。交叉引用
1.本技术要求以下专利申请的权益和优先权:2011年10月21日 提交的序列号为61/550,364的美国临时专利申请;2012年2月29日 提交的序列号为61/605,169的美国临时专利申请;2012年3月14日 提交的序列号为61/610,977的美国临时专利申请;2012年5月1日提 交的序列号为61/641,120的美国临时专利申请;2012年6月1日提交 的序列号为61/654,749的美国临时专利申请;2012年6月26日提交 的序列号为61/664,726的美国临时专利申请;2012年7月13日提交 的序列号为61/671,592的美国临时专利申请;2012年7月20日提交 的序列号为61/674,295的美国临时专利申请;2012年8月20日提交 的序列号为61/691,242的美国临时专利申请;2012年9月5日提交的 序列号为61/696,809的美国临时专利申请;2012年9月19日提交的 序列号为61/703,194的美国临时专利申请;2012年8月31日提交的 序列号为61/696,132的美国临时专利申请;以及2012年9月6日提 交的序列号为61/697,803的美国临时专利申请,每一上述专利申请均 通过引用整体并入本文。
2.
背景技术:
3.dna谱型分析(又称dna检测、dna分型或遗传指纹分析) 是一种被法医科学家用来通过个人各自的dna谱来协助个人识别的 技术。dna谱可以是反映个人dna组成的加密数字集合,其还可用 作该人的身份标识。
4.dna谱型分析或遗传谱型分析可用于识别犯罪嫌疑人或验证受 试者的身份,如验证犯罪受害者的身份。这可以使执法人员能够准确 地从犯罪嫌疑人的名单中识别出犯罪行为人,并减少错误识别的情况。 在战地场景中,仅举几例而言,dna谱型分析可以识别非对称战争 中的对手,识别袭击嫌疑人,识别嫌疑恐怖分子,将简易爆炸装置(ied) 与炸弹制造者相联系,寻找被俘士兵(举例而言,诸如通过识别来自 载具上的组织样品的他们的dna并跟踪该载具),以及解开作战网 络。
5.dna谱型分析通常涉及样品制备、处理和分析。这一般是在实 验室环境中完成。样品制备是生物分析系统中普遍存在的问题。从多 样的原始样品类型提供充分纯化的靶标(target)以便可靠地进行下游 分析试验的问题十分普遍,并且涵盖细胞生物学、基因组学、蛋白质 组学、代谢组学、食品生物学、分子诊断以及许多其他生物试验和医 学试验。
6.目前可用于dna谱型分析的方法和系统具有各种局限性。例如, 用于dna谱型分析的样品制备和分析系统通常笨重庞大,难以在不 付出大量努力的情况下运输。这使得此类系统在现场(诸如在战场上) 的使用变得困难和不切实际。此外,当前的系统和方法的使用
和维护 费用昂贵,且遗传谱(genetic profile)的制备花费大量时间。在一些 情况下,要一到两天来提供受试者的遗传谱。这在时间至关重要的情 况下(诸如在执法人员追踪嫌疑人或者只能将嫌疑人扣留有限的一段 时间的情况下)缺乏吸引力。
技术实现要素:
7.本文认识到对用于遗传谱型分析的改进的系统和方法的需求。特 别是,认识到对具有相比于其他系统更小的占用空间及更快的时间的 系统的需求。此外,需要能够由较低技能的操作者以较低的成本进行 遗传谱型分析的系统和方法。
8.本公开提供一种集成的和自动化的样品到结果 (sample
‑
to
‑
answer)系统,该系统从包含生物材料的样品开始,在不 到两小时内生成遗传谱。在某些实施方式中,生物材料为dna,并 且遗传谱涉及确定位于受试者的一个或多个基因座(例如,遗传基因 座)处的一个或多个等位基因,例如,str(短串联重复)谱,举例 而言,诸如用于codis系统中的str谱。该系统可执行若干操作, 包括(a)核酸的提取和分离;(b)选定基因座(例如,遗传基因座) 处的核苷酸序列的扩增;以及(c)扩增产物的检测和分析。这些操 作可在包含若干集成模块的系统中进行,所述模块包括分析物制备模 块、检测与分析模块以及控制模块。这些模块在图48和图49中示出。 (一个或多个计算机系统可与图48中的分析物制备模块的各个组件 (例如,流体歧管和气动歧管)通信并控制所述各个组件的操作;这 样的一个或多个计算机系统未在图48中示出。)
9.本文所提供的系统可完全集成。样品处理可在单一系统中实现, 而无需移除样品和将样品转移至另一系统。本文所提供的系统可完全 自动化,从而使得使用者能够在无需来自该使用者的大量输入的情况 下处理样品。本文所提供的系统的尺寸可设定成使占用空间最小化, 从而实现便携性。这可以有利地使系统能够用于携行情况,诸如偏远 地区,不易获得运输或者期望使用者机动性的情况,诸如战地场景。
10.分析物制备模块包括盒模块组装件,该盒模块组装件配置用于接 合和操作一个或不止一个样品盒(sample cartridge)。样品盒配置用 于接收一个或多个样品,以及在该盒与系统中的盒模块组装件相接合 时进行核酸提取与分离以及dna扩增。其还可包括用于辅助分析的 对照和标准。
11.该样品盒包括:用于接收样品的样品贮器;用于dna提取与分 离的隔室;用于核酸提取、纯化和扩增的流体隔离的隔室中的板载试 剂(on
‑
board reagent)(例如,工艺微珠,用以浓缩样品);用于热 循环的组装件;流体通道(例如,微流体通道),用于将流体导引至 盒内不同的功能隔室和端口以接合盒模块组装件中的子组装件,所述 子组装件操作盒上的阀、泵和导引器,提供用于移动液体的压力,以 及提供未储存于盒上的耗材。在一些示例中,隔膜阀、泵和导引器—— 例如,move泵、阀和导引器——输送、处理样品,并实现样品的分 析。当盒与盒模块组装件中的盒贮器相接合时,致使流体隔离的腔室 与盒中的流体通道流体相连,从而允许流体和试剂向盒中的功能隔室, 以及随后向检测与分析模块的移动和导引。
12.分析物制备模块可包括:用于接收一个或多个盒的贮器,用以接 合所述盒的接合组装件;流体歧管,配置用于接合盒中的端口以通过 所述端口向盒传送压力和/或流体;传送组装件,配置用于从样品盒中 的隔室向扩增隔室传送试剂,诸如扩增预混物;气动歧管,
配置用于 接合盒中的端口以及通过所述端口向盒传送正压或负压以供移动流 体和操作盒中的阀、泵和导引器;泵,配置用于向流体歧管和气动歧 管传送压力。耗材试剂可携载于能够可拆卸地与盒模块接合的模块 (例如,缓冲液模块)中。试剂可在水溶液中提供(例如,储存), 或者能够以固体或干燥(例如冻干)的形式提供(例如,储存)并继 而通过添加适当的液体(例如,水溶液)而被置于溶液中。或者,如 在美国临时专利申请号61/709,417(通过引用以其整体并入本文)中 所描述,试剂可在基本上无水的非离子有机溶剂(例如,醇溶剂)中 或在基本上无水的离子有机溶剂(例如,深共晶溶剂)中提供(例如, 储存)并可通过添加适当的水溶液而被再水合。
13.分析与检测模块配置用于:接收来自分析物制备模块的分析物; 对分析物进行毛细管电泳;检测通过电泳分离的分析物,以及分析经 检测的分析物。其可包括毛细管电泳组装件、检测组装件和分析组装 件。
14.毛细管电泳组装件可包括:注射组装件,该注射组装件可包括变 性加热器组装件、用于定位分析物以供毛细管注射的定位组装件;阴 极组装件;毛细管组装件;阳极组装件;毛细管填充组装件,用于以 分离介质来填充毛细管;以及功率源,用于在阳极与阴极之间施加电 压。变性组装件可包括加热器,该加热器配置用于使双链dna分子 变性。阴极组装件可包括阴极。该阴极可为叉形阴极,用于堆积分析 物以供毛细管注射。毛细管组装件可包括配置用于接收分离介质的毛 细管和用于调控毛细管内温度的温度控制单元。例如,温度控制单元 可具有线路板材料,该线路板材料包括加热迹线,该加热迹线连接至 电流源并且连接至温度传感器以调控毛细管内的温度。阳极组装件可 包括阳极。该阳极可被包含在能够可拆卸地插入分析与检测模块的阳 极盒中。阳极盒可包括分离介质和任选的缓冲液供给,以及电极。毛 细管填充组装件可包括分离介质源(例如,包含在阳极盒中的分离胶), 以及用于向毛细管中传送分离介质的泵。
15.检测组装件可包含配置用于照射毛细管的激光器以及检测器。所 述激光器可配置用于激发分析物中的荧光染料。所述检测器可包括 ccd阵列,用于检测由被激发的染料所产生的光以及用于产生输出信 号。
16.分析组装件可包括计算机,该计算机包含存储器和用于执行代码 (例如,有形介质上的代码)的处理器,所述代码用于分析输出信号 和产生含有对该信号的分析的计算机文件。这样的分析可例如包括对 来自各str基因座的等位基因的识别。计算机文件可为能够与公共 数据库相兼容的格式。例如,文件可为与美国联邦调查局(fbi)所 运营的国家dna索引系统(ndis)相兼容的codis格式。分析组 装件可进一步包含对被测试样品和参比样品进行血缘关系分析的代 码。分析组装件可以查询可为该系统的一部分或作为远程数据库的数 据库,以确定样品是否完全或部分地匹配于数据库中的谱。数据库查 询的结果可显示给使用者。
17.该系统可由控制模块来操作。控制模块可包括用户接口,该用户 接口配置用于从使用者接收指令和向使用者传送信息。其可包括软件, 该软件被编程用于执行例程,所述例程用于进行上述操作以及例如通 过因特网传输和从远程位置接收诸如计算机文件等信息。控制模块还 可包括传感器,所述传感器定位在仪器的各部分中以检测和测量操作, 以及将此类参数传输到计算机,以供由配置用于监控仪器操作以及在 测量值不处于选定参数内时改变仪器操作的软件来进行分析。本发明 的系统和方法是完全集成和自动化的,这
有利地减少了用于样品处理 的处理时间,同时提供了在各个地点(包括可能不易到达的远程地点) 处理和分析样品的灵活性。
18.例如,从样品开始,可以应用本发明来浓缩和分离用于进一步处 理的组分,以利用通过elisa、pcr或其他核酸扩增技术、单分子检 测、蛋白质阵列、质谱法和本领域技术人员所熟知的其他分析方法进 行的分析,在包括气溶胶样品、水、液体、血液、粪便、鼻拭子、颊 拭子及其他拭子、体液、环境样品的基质中检测和分类人类和其他生 物体。援引并入
19.本说明书中提及的所有出版物、专利和专利申请均通过引用以其 整体并入本文之中,程度如同具体地和个别地指明要通过引用而将每 个单独的出版物、专利或专利申请整体并入本文之中。
附图说明
20.本发明的新颖特征在所附权利要求书中具体阐述。通过参考以下 阐述其中利用到本发明原理的示例说明性实施方式的详细描述和附图, 将会对本发明的特征和优点获得更好的理解;在附图中:
21.图1示出了根据本发明的实施方式的用于处理样品的系统。
22.图2示出了根据本发明的实施方式的图1的系统。
23.图3示出了根据本发明的实施方式的样品盒接口模块。
24.图4示出了根据本发明的实施方式的盒。
25.图5示出了根据本发明的实施方式的用于电泳的毛细管。
26.图6示出了根据本发明的实施方式的阳极接口模块和阳极盒。
27.图7示出了根据本发明的实施方式的缓冲液接口模块和缓冲液 盒。
28.图8示出了根据本发明的实施方式,用于随本文所提供的系统一 同使用的匣。
29.图9示出了根据本发明的实施方式的穿刺元件。
30.图10示出了根据本发明的实施方式的集成盒。
31.图11示出了根据本发明的实施方式的具有用于样品处理的腔室 的容器。
32.图12为根据本发明的实施方式的盒的示意性侧视图。
33.图13a和图13b示出了根据本发明的实施方式的样品贮器。
34.图14示出了根据本发明的实施方式的具有微流体装置和容器的 盒。
35.图15为根据本发明的实施方式的图14的微流体装置和容器的底 视图。
36.图16为根据本发明的实施方式的图14和图15的微流体装置和 容器的示意性顶视图,图中示出容器安装在微流体装置上。
37.图17示出了根据本发明的实施方式的图14
‑
图16的微流体装置 和容器的各种特征。
38.图18a
‑
图18d示出了根据本发明的实施方式的热循环器组装件, 其包含4个试剂(预混物)腔室和配置用于利用热循环来进行扩增(例 如,通过pcr)的4个反应腔室。
39.图19示出了根据本发明的实施方式的用于样品处理的系统。
40.图20
‑
图30示出了根据本发明的各实施方式,用于与处理样品 的系统一起使用的图形用户界面。
41.图31示出了根据本发明的实施方式的集成盒。
42.图32为根据本发明的实施方式的图31的盒的分解图。
43.图33a
‑
图33f示出了根据本发明的各实施方式的包含4个试剂 (预混物)腔室和配置用于利用热循环来进行扩增(例如,通过pcr) 的4个反应腔室的热循环器组装件的各种视图和特征。
44.图34a
‑
图34d示出了根据本发明的实施方式的盒的各个组件。
45.图35a和图35b示意性地图示了根据本发明的实施方式的接合 微流体装置的容器。
46.图36a和图36b为根据本发明的实施方式的盒模块的示意性侧 面透视图。
47.图37示出了本发明的样品盒的示图。
48.图38a示出了拭子传感器(swab sensor)的实施方式;图38b 示出了包含嵌入式eeprom芯片和用于拭子感测的光阑和滑动阻挡 器(sliding blocker)的盒的实施方式。
49.图39描绘了盒模块和具有用于容纳两个样品盒或者容纳一个样 品盒和一个对照盒的两个盒模块的样品/对照盒接口模块的实施方式。
50.图40示出了盒模块的流体歧管的实施方式,图中指示出管道与 样品盒中的端口的配合。
51.图41示出了气动歧管和样品盒的具有用于与气动管道相配合的 端口的气动侧的实施方式。
52.图42示出了热循环器组装件的实施方式,其包括位于样品盒或 对照盒中的4个反应腔室、安设在反应腔室上的热导体(或导热体) 以及热循环加热与冷却装置(例如,包括珀尔帖(peltier)加热与冷 却装置)。
53.图43为处于常开配置下的隔膜阀的示意图示。
54.图44示出了根据本发明的实施方式的具有包含4个反应腔室和 热导体的热循环器组装件的盒的一部分,其中热导体已被剥离以示出 配置用于利用热循环来进行扩增(例如,通过pcr)的4个反应腔室。
55.图45示出了根据本发明的实施方式的具有4个反应腔室的热循 环器组装件的底视图,其中每个反应腔室具有磁体。
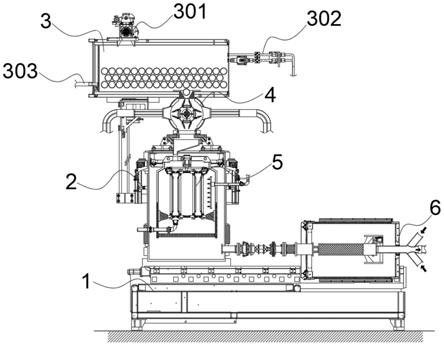
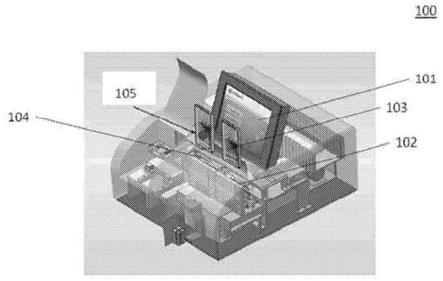
56.图46示出了盒模块3600的实施方式,其中第一组装件3602的 第一压力歧管3607包含管道3610、管道3614和管道3616,每个所 述管道接合盒的微流体装置的流体侧上的端口,并且第二组装件3603 的第二压力歧管3608包含多个管道3620,每个所述管道接合微流体 装置的气动侧上的端口。
57.图47示出了具有毛细管板和变性加热器的毛细管电泳阵列的实 施方式。
58.图48示出了在本发明的系统中有用的分析物制备模块的示意图。
59.图49示出了在本发明的系统中有用的分析模块的示意图。
60.图50示出了用于将来自电泳图的数据变换成可由str等位基因 判定软件所使用的格式的过程。
61.图51a示出了可从收集到的数据生成的典型电泳图。
62.图51b示出了从收集到的数据生成的核酸谱的典型图形。
63.图52a示出了可在本发明的盒中使用的微流体芯片的流体侧的 布局。
64.图52b示出了可在本发明的盒中使用的微流体芯片的气动侧的 布局。
65.图53示出了本发明的变性加热器。
66.图54a
‑
54b示出了用于将样品注射到电泳毛细管中的注射系统。 图54a示出了与管道的内腔之中的毛细管相对的三个电极;第三电极 并不电气相连,而是独立地通电。图54b示出了与管道的内腔之中的 毛细管相对的三个电极;所有的电极均电气相连。
67.图55图示了配置用于致动扩增试剂从预混物容器或腔室向反应 腔室的传送的装置的实施方式。
68.图56的a和图56的b示出了包含两个模块的便携式仪器或系 统的实施方式。
具体实施方式
69.本公开的每个实施方式可任选地与本文中描述的与该实施方式 相容的任何一个或多个其他实施方式相结合。
70.每当术语“约”或“近似”位于两个或更多个数值的序列中或者两 个或更多个数值范围的序列中的第一数值之前时,术语“约”或“近似
”ꢀ
适用于所述数值的序列或所述数值范围的序列中的每个数值。在某些 实施方式中,术语“约”或“近似”指在规定值的10%或5%以内。
71.每当术语“至少”或“大于”位于两个或更多个数值的序列中的第 一数值之前时,术语“至少”或“大于”适用于所述数值的序列中的每个 数值。
72.每当术语“不大于”或“小于”位于两个或更多个数值的序列中的 第一数值之前时,术语“不大于”或“小于”适用于所述数值的序列中的 每个数值。
73.本文所使用术语“样品”意指含有生物材料的样品。样品例如可以 是流体样品(例如,血液样品)或组织样品(例如,颊拭子)。样品 可以是较大样品的一部分。样品可以是具有诸如脱氧核糖核酸(dna) 或核糖核酸(rna)等核酸或蛋白质的生物样品。样品可以是法医样 品或环境样品。样品可在其被引入至系统之前得到预处理;预处理可 包括:从不适于装进系统的材料中进行的提取;细胞、dna或其他 生物聚合物或分子的量的量化;样品的浓缩;细胞类型的分离,诸如 从上皮细胞分离精子;使用极光系统(aurora system)(boreal genomic) 或微珠处理或其他浓缩方法对dna的浓缩或者其他样品操作。样品 可携载于载体中,该载体诸如为:拭子;擦拭物;海绵;刮刀;冲压 出材料的试片;在其上喷溅目标分析物的材料;食品样品;其中溶解 分析物的液体,诸如水、苏打水。样品可为直接的生物样品,诸如液 体,如血液、精液、唾液;或者为固体,诸如固体组织样品、肌肉或 骨骼。
74.本发明还可应用于处理和分析先前已预处理过的样品,例如,通 过在将已预处理的样品放入样品盒之前,从诸如床单或椅子等大的物 体提取dna以及其他处理(可包括dna浓度、细胞浓度的量化或其 他操作)来进行。
75.本文所使用的术语“模块”是指作为更大的装置、仪器或系统的一 部分的装置或组件。
76.术语“匣(cassette)”和“盒”除非另有明确指出,否则在本文中可 互换使用。
77.现将参考附图,其中相同的数字始终表示相同的部件。应当理解, 附图并不一定是按比例绘制。
78.i.介绍
79.图1示出了用于样品处理和分析的系统100。该系统包含显示器 101,该显示器101具有图形用户界面(gui),该gui例如用于使 得使用者能够开始样品处理以及查看样品处理和分析的进度或分析 结果。系统100包括用于容纳和固定样品盒103的第一端口102和用 于容纳和固定第二盒的第二端口104,该第二盒可为对照盒105。第 一端口102和第二端口104配置用于在样品处理之后释放样品盒103 和样品盒104。第一端口102和第二端口104为用于与样品盒和/或对 照盒相配合的盒托架(cartridge bay)。如将在下文更详细地讨论,用 于样品处理的各种试剂被包含在盒103和盒105中。系统100用于样 品制备、处理和分析。
80.图2进一步详细地示出了图1的系统100。系统100包括用于保 持盒103和盒105的样品盒接口模块。缓冲液盒接口模块使得使用者 能够提供由系统100使用的缓冲液。系统100包括用于结构支撑的机 架,该机架可由诸如铝或钢等金属材料或者聚合物材料所形成。机架 可被构造用以使系统100的重量最小化。气动模块提供空气(或其他 气体)来操作盒103和盒105中所包括的阀(例如,move)阀。功 率源向系统提供功率,该系统包括系统的控制器(例如,中央处理器, cpu)、系统存储器、高速缓存、硬盘以及系统100的其他电子组件。 高电压模块可向电泳系统提供升高的电压用于分析物的分离。该系统 还包括毛细管板、光学模块和阳极盒接口模块。
81.系统100可包括用于使系统100的各个模块能够与系统100的控 制器通信的通信总线。该通信总线可与高电压模块电连通,从而能够 向该系统的各个模块提供功率。
82.图1和图2的系统可用于法医分析以确定生物体的遗传谱。在一 些情况下,系统100在20个或更少个步骤、15个或更少个步骤、或 者10个或更少个步骤中处理来自受试者的生物样品。在某些实施方 式中,所述步骤选自:细胞裂解、dna捕获、dna纯化;dna扩增; 扩增子/分析物稀释;扩增子/分析物注射;扩增子/分析物分离;扩增 子/分析物检测;以及经检测产物的分析。在一些实施方式中,系统 100可在3小时、2小时、1.5小时、1小时或更少的时间内确定受试 者的遗传谱。法医分析可包括短串联重复(str)分析或限制性片段 长度多态性(rflp)分析。在这种情况下,str分析可在3小时、2 小时、1.5小时、1小时或更少的时间段内进行。
83.在一些实施方式中,图1和图2的系统100用于自动化法医学分 析。系统100可用于通过使用体积不超过20ft3、16ft3、15ft3、10ft3、 5ft3中任何一个的完全集成样品处理系统,在不多于20个步骤、15 个步骤、10个步骤中的任何一项的情况下确定受试者的遗传谱。
84.在一些实施方式中,该系统为完全的样品到结果系统 (sample
‑
to
‑
answer system),在一些情况下,需要将步骤耦合在一起 来匹配体积和浓度。集成系统可配置用于接收包含核酸的样品(例如, 生物样品),并以计算机文件(例如,codis兼容文件)的形式来产 生核酸的遗传谱,例如,等位基因分析或str分析。其还可将该谱 用于进行血缘关系分析。血缘关系分析涉及比较两个或更多个人的遗 传谱(例如,str谱)以及估算人们之间亲属关系的可能性,例如, 两个人是否为父母与子女、兄弟姐妹、堂表亲、次堂表亲、祖孙、叔 叔/姑妈与侄女/侄子等。
85.本发明提供用于包括样品制备在内的样品处理和/或分析的系统 和方法。此类系统可处理样品以供由所述系统或另一装置来进行分析。 一些实施方式提供了借助于可拆卸式匣来帮助样品处理的系统,该匣 具有用于样品处理和/或分析的试剂,举例而言,诸如
微珠和核酸扩增 试剂。在一些实施方式中,该系统为接收含有分析物的样品并报告分 析物的度量值(metric)或特性的样品到结果系统。分析物例如可以 是生物分子,诸如核酸(例如,dna或rna)、蛋白质或多糖。报 告的度量值可为样品中的分析物的量(包括存在或不存在分析物)。 报告的特性例如可以是分析物的身份、分析物的化学组成、分析物的 形式或组成(例如,在基因座(例如,遗传基因座)处的等位基因的 存在、形式、大小或同一性)。
86.本发明的一个方面提供用于样品处理和/或分析的系统。该系统 可配置用于扩增,诸如聚合酶链反应(pcr)扩增或蛋白质组学,这 可用于法医分析、动物(例如,人类)识别或血缘关系分析。在一些 情况下,该系统是集成的和完全自动化的。在一些情况下,该系统可 处理用于法医分析的样品而不需或只需很少的使用者参与。在一些实 施方式中,该系统包含子系统,所述子系统配置用于执行以下功能: 从样品(例如,含有生物分子混合物的样品)分离核酸(例如,dna); 可选地对核酸进行纯化;扩增经分离的核酸内的选定核苷酸序列(例 如,来自一个或多个遗传基因座的序列,在一个物种中每个基因座含 有一个或多个等位基因形式)以产生扩增产物;可选地对选定的经扩 增核苷酸序列进行纯化;与片段大小标准一起稀释或再悬浮;分离和 检测扩增产物(例如,产生电泳图)以及分析所检测的扩增产物电泳 图(例如,识别每个基因座(例如,遗传基因座)处的等位基因)。
87.在一些实施方式中,用于样品处理的系统实现在样品处理期间对 样品体积的宏观到微观缩减。在一些情况下,这样的系统实现样品体 积的宏观到微观以及随后的微观到宏观改变。本文所提供的系统可在 处理期间减少污染,例如,即使不消除污染也使其最小化,从而提供 改善的可靠性、性能和变异系数。这有利地实现了样品处理和分析在 系统与系统之间的可靠性。
88.ii.分析物制备模块
89.图48示出了本发明的分析物制备模块的实施方式。分析物制备 模块可包含样品盒模块,该样品盒模块接收样品盒并且配置用于移动 盒内的流体。样品盒包含用以接收样品的样品贮器,以及用以执行诸 如细胞裂解、dna捕获和洗涤、dna扩增以及dna稀释等功能的 区域。连接至压力源的流体歧管可向盒中传送压力(例如,气压), 以便移动样品盒内的液体。连接至压力源的试剂盒可将诸如缓冲液和 /或水等试剂移入样品盒。样品和缓冲液可通过流体导管移出盒并移至 分析组装件。在一个实施方式中,样品盒包含流体芯片,该流体芯片 包含含有流体通道的流体层、含有致动通道的致动层,以及夹在它们 之间的弹性体层。该芯片可包括由致动层来致动的阀和泵。在这样的 实施方式中,样品盒模块可包括连接至压力源的气动歧管,该压力源 在所述歧管接合盒时向盒的气动器件传递压力。该气动压力可操作盒 中的泵和阀,以便使流体在盒周围移动和使流体移出盒。
90.a.样品盒
91.本发明提供可预先装载用于进行一个或一系列化学反应或生化 反应的试剂的匣。该匣包括具有封闭隔室的容器(例如,见图8), 所述封闭隔室可含有试剂并且最初彼此流体分离。相应地,匣配置用 于防止试剂从匣中泄漏,或者防止试剂的混合直至期望如此。这样的 配置对于隔离地运送或以其他方式运输试剂是有用的。容器中的隔室 可具有易碎密封,所述易碎密封可被刺穿以提供对隔室及其内容物的 可及性。匣还包括具有流体通路或通道的流体装置。该流体装置可为 含有微流体通路或通道的微流体装置。流体装置还可具有适于刺穿容 器的易碎密封的穿刺元件。该穿刺元件本身可具有与流体装置中的流 体
通道流体连通的开口。匣配置成使得流体装置可与容器相接合。接 合例如可通过将容器压在流体装置上来实现。当接合时,穿刺元件刺 穿易碎密封并使被刺穿的隔室与流体装置中的流体通路流体连通。
92.在某些布置中,通过公共流体通道来使两个先前隔离的隔室彼此 流体连通。在其他布置中,例如通过在两个不同的位置刺穿单一隔室 的密封来使两个流体通道与单一隔室流体连通。例如,可以将装置配 置成使得接合(1)创造出两个隔室之间经过流体装置上的流体通道 (例如,通道的一个节段)的流动路径;以及/或者(2)创造出流体 装置上的两个流体通道(例如,通道节段)之间经过单一隔室的流动 路径。在某些实施方式中,两个隔室之间经过通道的流动路径或两个 通道之间经过隔室的流动路径在该流动路径中不包括分支。在其他布 置中,使与流体通道处于流体连通的引出流体装置的端口通过该流体 通道而与隔室流体连通。通道可以包括可控阀。此类阀可用于导引流 体在通道中,例如,在第一通路与第二通路之间的通过。流体可通过 装置上的泵(诸如隔膜泵)而移动经过装置。或者,可将端口处的流 体通道开口连接至外部的压力(例如,气动压力)源,所述压力源用 于将流体——特别是大量流体体积——移动经过装置。当需要时,可 将端口处的流体通道开口连接至外部的试剂源。相应地,在某些布置 中,流体装置与容器的接合创造出通过流体装置中的流体通路将容器 中的隔室彼此相连以及使之与引出匣的端口相连的流体路径。所述匣 还可包含腔室,所述腔室在匣通过接收控制仪器的元件而接合时变得 与热控制元件热接触。例如,热控制元件可利用加热和冷却来进行热 循环。可以使用压力传感器来指示端口(例如,流体端口或气动端口) 是否堵塞或有泄漏,以及标识堵塞的或泄露的端口的位置。
93.在一些情况下,多个封闭的且流体隔离的腔室可为微流体腔室。 此类腔室配置用于容纳从几微升到几纳升或更少的流体体积。在其他 情况下,多个封闭的且流体隔离的腔室为微流体腔室,其配置用于容 纳至少约1微升或更多的流体体积。
94.本发明的一个方面提供用于包括样品制备在内的样品处理的盒 (或匣)。本发明的盒可与样品处理和/或分析系统(诸如图1的系统 100)一起使用。在一些实施方式中,用于处理样品的盒包含容器(例 如,试剂包),该容器包含多个封闭的且流体隔离的腔室。该盒可与 图4的盒相似或相同。所述多个腔室中的每个腔室包含易碎密封。在 一些情况下,盒还包括微流体装置,该微流体装置包含多个穿刺元件 以及与一个或多个端口流体连通的微流体通道。多个穿刺元件与所述 多个腔室中的每个腔室相对地安设。通过将微流体装置与容器接合来 将所述多个腔室中的每个腔室的易碎密封刺穿,并创造出每个所述流 体隔离的腔室与微流体通道之间的流体流动路径。在一些实施方式中, 通过将微流体装置与容器相接合来流体连接两个隔离的腔室。在一些 情况下,这允许流体从一个腔室向另一腔室流动。
95.在一些实施方式中,在与容器的所述多个腔室中的每个腔室相邻 之处安设2个、或3个、或4个、或5个、或6个、或7个、或8个、 或9个、或10个或者更多个穿刺元件。所述多个腔室中的至少一些 腔室可预先填充有试剂,诸如洗涤溶液或缓冲液(见下文)。在一个 示例中,邻近于一个腔室安设两个穿刺元件。在另一示例中,邻近于 一个腔室安设3个穿刺元件。在又一示例中,邻近于第一腔室安设两 个穿刺元件,并且邻近于第二腔室安设3个穿刺元件。
96.所述多个穿刺元件可包括与微流体通道流体连通的开口(或端 口)。或者,所述开口可安设在邻近穿刺元件之处。开口可具有各种 几何形状和尺寸。在一些情况下,开口为圆形、三角形、正方形、矩 形、五边形、六边形,或者具有其他多边形横截面或部分横截面(例 如,半圆形)。
97.在处理期间,具有样品的流体从样品腔室向微流体通道的流动可 实现流体体积的宏观到微观缩减,而该流体从微流体通道向预先装载 有液体的容器的腔室的流动可实现流体体积的微观到宏观扩大。
98.在一些实施方式中,用于处理生物样品的匣包含微流体装置,该 微流体装置包含与一个或多个端口流体连通的微流体通道。该微流体 装置包括多个穿刺元件。所述匣还包含安设在微流体装置上或邻近微 流体装置之处的容器。该容器具有多个密封腔室。所述多个密封腔室 中的每个密封腔室包含易碎密封。容器可借助于可变形材料层或粘合 材料(例如,在全部两侧均有粘性的材料)层而附接至微流体装置。 通过将微流体装置与容器相接合来将所述多个密封腔室中的每个密 封腔室的易碎密封刺穿,并创造出每个所述密封腔室与微流体通道之 间的流体流动路径。在某些实施方式中,易碎密封的刺穿创造出从微 流体装置中的第一通道节段进入腔室,离开腔室并进入微流体装置中 的第二通道节段的流动路径。在另一实施方式中,易碎密封的刺穿创 造出从微流体装置中的端口经过第一通道节段并进入腔室的流动路 径。在又一实施方式中,易碎密封的刺穿创造出从微流体装置中的第 一端口经过第一通道节段,进入腔室,离开腔室,进入第二通道节段 并离开微流体装置中的第二端口的流动路径。
99.在一些情况下,易碎密封由诸如铝等金属材料形成。在其他情况 下,易碎密封由聚合物材料形成。
100.图4示出用于与系统100一起使用的盒。在一些实施方式中, 该盒配置用于进行所有的或基本上所有的样品处理,包括流体样品制 备操作。该盒包括拭子与样品输入端口、试剂容器、具有多个微流体 通道、阀和端口的芯片组装件,以及反应腔室。该盒配置用于相对于 具有系统100的水平面垂直地或成角度地插入到样品盒接口模块之中。 例如,系统100可接收相对于水平面成约10
°
、20
°
、30
°
、40
°
、50
°
、 60
°
、70
°
、80
°
或小于90
°
的角度的盒。
101.在例如图31和图32中所示的实施方式中,样品盒包含:a)流 体装置,其包含基本上布置于第一平面中的一个或多个流体通道(例 如,微流体通道);b)样品容器,其包含一个或多个样品贮器,每 个贮器具有细长形状,该细长形状由形状的长维度上的轴线(例如, 可沿其插入拭子的轴线)所限定,其中每个细长轴线基本上布置于第 二平面中;以及可选地c)试剂容器,其包含一个或多个试剂腔室, 每个试剂腔室具有细长形状,该细长形状由形状的长维度上的轴线 (例如,腔室3104)所限定,其中每个细长轴线基本上布置于第三平 面中;以及d)反应容器,其包含一个或多个反应腔室,每个反应腔 室具有细长形状,该细长形状由形状的长维度上的轴线所限定,其中 每个细长轴线基本上布置于第四平面中(例如,3106)。流体通道、 样品贮器、试剂腔室和反应腔室彼此流体相连;并且所述第一平面、 第二平面、第三平面和第四平面基本上彼此平行。在一个实施方式中, 样品盒包含:a)流体装置,其包含基本上布置于第一平面中的一个 或多个流体通道;以及b)样品容器,其包含一个或多个样品贮器, 其中流体通道与样品贮器彼此流体相连。样品盒被配置成当样品盒与 配置用于接收样品盒的盒模块相接合时,将样品装载到样品贮器中并 且将来自样品的
分析物移入流体通道之中,并且第一平面定向成偏离 水平面至少10
°
、至少20
°
、至少30
°
、至少40
°
、至少50
°
、至少60
°
、 至少70
°
、至少80
°
或者至少90
°
。(例如,见图1或图39。)
102.图8为根据本发明的实施方式,用于随样品制备和处理一起使 用的盒的分解图。该盒包括具有用于保存一种或多种试剂的多个腔室 的容器,以及具有微流体通道的微流体装置。所述腔室还用于在样品 制备和处理期间使用。每个所述腔室借助于易碎密封而得到密封,所 述易碎密封可由聚合物材料或金属材料形成。盒包括具有孔(或开口) 的可变形层(例如,可变形材料层),所述孔与各穿刺元件(见图9) 和配置成安设在邻近容器之处的微流体装置的对准构件相对准。在一 些情况下,所述多个穿刺元件中的两个或更多个穿刺元件与所述多个 封闭的且流体隔离的腔室中的每个腔室相对地安设。样品腔室配置成 以图中所示的大体定向安装在邻近微流体装置和容器之处。
103.盒可包括邻近每个腔室的单一易碎密封,或者多个易碎密封。 例如,容器的每一单个腔室可由单独的易碎密封来加以密封。
104.如下文所述,样品盒接口模块(盒模块)包括夹紧系统,举例 而言,诸如用于将盒的微流体装置(或层)与容器相接合的凸轮驱动 式夹紧系统。在一些情况下,凸轮对盒施加预定压力,该压力将盒的 容器压在盒的微流体装置上。在一些情况下,所施加的压力可以是恒 定的或者逐渐增大。
105.微流体通道可包括一个或多个可选择性地关闭的通道。所述可 选择性地关闭的通道可借助于诸如隔膜阀(或泵)之类的阀来打开和 关闭。微流体通道可与一个或多个隔膜阀——诸如1个、2个、3个、 4个、5个、6个、7个、8个、9个、10个或更多个阀流体连通。隔 膜阀可以包括可受压变形材料(例如,弹性材料)层,该层配置成抵 靠在阀座上,从而调控流体流动。所述一个或多个阀可为气动致动阀, 诸如借助于正压或负压(真空)来致动的阀。在一些情况下,所述一 个或多个阀为压电阀,其配置用于在向压电材料施加电势时打开或关 闭。
106.在一个实施方式中,盒包含框架,该框架附接在具有通向样品 腔室(例如,样品贮器)的端口的微流体芯片的一侧上。样品腔室各 自适于容纳来自样品托架的样品(例如,棉签、穿孔器或液体)。盒 还包括孔(例如,插槽、插座、接收元件、隔室),该孔适于容纳具 有预先装载有用于样品处理的试剂的多个腔室的容器。盒包括这样的 插槽或接收元件:其容纳部分的或整个的热循环器组装件,例如,配 置用于利用热循环来进行扩增(例如,通过pcr)的多个反应腔室(热 循环腔室)和用于向反应腔室提供扩增试剂(例如,扩增预混物)的 多个试剂(预混物)腔室。热循环腔室与微流体芯片中的微流体通道 流体连通,该微流体通道与容器的腔室流体连通。在一些情况下,热 循环腔室相对于微流体装置升高并且具有开口,所述开口与散热器 (或者可散布/分布热量和进行冷却的热导体)相接触或相邻,所述散 热器转而与配置用于进行热循环的温度控制元件(例如,加热元件和 /或冷却元件,诸如珀尔帖加热与冷却装置)相接触或相邻。在某些实 施方式中,温度控制元件(例如,加热与冷却元件,诸如珀尔帖加热 与冷却装置)配置用于移动以接触散热器或反应腔室或者变得与之相 邻。图42图示了热循环加热与冷却装置的实施方式,该装置在盒与 盒模块相接合时接触安设于反应腔室上的热导体。
107.在一些实施方式中,盒还包含样品贮器,该样品贮器具有适于 接收样品的样品腔室。该样品腔室具有开口,所述开口平行于安设在 微流体装置与容器之间的微流体装置的
表面。这样的配置可有利地允 许使用者使用诸如各种形状和尺寸的q
‑
tip或棉球等各种用于收集组 织样品的工具和装置来插入组织样品(例如,棉签)。开口的对准允 许将盒以相对于具有系统的平面垂直或成角度的配置插入到所述系 统(例如,图1的系统100)之中。
108.样品盒可包含一个或多个泳道,每个泳道配置用于处理样品或 对照。泳道可包含流体回路,该流体回路包含通道、隔室和诸如阀或 泵等流体控制元件。样品盒中的泳道可彼此流体隔离,例如,来自一 个泳道的流体无法跨入另一泳道。
109.在一些情况下,样品贮器与微流体装置成为一体(或者成为单 件)。这样的构造可帮助使加工成本最小化,这是因为样品贮器和微 流体装置可在一个或多个重叠的加工步骤中形成。
110.微流体通道可包含与样品腔室流体连通的样品通道。当容器已 接合微流体装置时,容器覆盖整个样品通道或其绝大部分。
111.微流体装置可包含与所述多个封闭的且流体隔离的腔室的试剂 腔室流体连通的试剂通道。当容器已接合微流体装置时,容器覆盖整 个试剂通道或其绝大部分。
112.在一些实施方式中,所述多个封闭的且流体隔离的腔室包括保 存稀释剂的第一腔室、保存一种或多种裂解试剂的第二腔室、具有捕 获颗粒的第三腔室,以及具有洗涤溶液的第四腔室和/或第五腔室。第 二腔室与样品腔室流体连通。在一些情况下,第二腔室为配置用于容 纳废料的废液腔室。
113.在一些实施方式中,盒包含处于容器与微流体装置之间的可变 形材料层。在一些情况下,所述可变形材料层由诸如乙烯丙烯二烯单 体(epdm)等闭孔泡沫、诸如乙烯醋酸乙烯酯(eva)等开孔泡沫 或者诸如聚硅氧烷等其他聚合物材料所形成。可变形材料层可以具有 约0.5mm与20mm之间,或者1mm与5mm之间的厚度。在一个 实现方案中,可变形材料层具有约3mm的厚度。可变形材料层可以 压缩成约10微米(“百万分之一米”)与1000微米之间,或者100微 米与800微米之间,或者300微米与600微米之间的厚度。容器借助 于可变形材料层而附接至微流体装置。在一些情况下,可变形材料层 具有第一粘贴面和与该第一粘贴面相对的第二粘贴面。所述第一粘贴 面邻近于微流体装置,而所述第二粘贴面邻近于容器。在一些情况下, 可变形材料层由可压缩材料形成。在其他情况下,可变形材料层由可 热柔化材料形成。在一个示例中,可变形材料层包含被配置成在向可 变形材料层施加压力时压缩的弹簧或聚合物材料。
114.微流体装置包括气动致动阀。在一些情况下,多个阀限定一个 泵。一个泵可包括串联配置下的至少2个、3个、4个、5个、6个、 7个、8个、9个、10个或更多个阀。
115.参考图8,盒包括用于在聚合酶链反应(pcr)中使用的热循 环器组装件。在图示的示例中,盒中的热循环器组装件包括被配置用 于利用热循环来进行通过pcr的核酸扩增的4个反应腔室(热循环 腔室),每个热循环腔室与微流体装置的一个通道流体连通。热循环 器组装件还包括多个试剂(预混物)腔室,用于向热循环腔室传送扩 增试剂的预混物。图55图示了配置用于致动扩增试剂从预混物腔室 向pcr反应腔室的传送的装置的实施方式。这样的装置发挥预混物 施加构件的功能,并且可例如包含用于在样品处理期间传送正压以传 送预混物的柱塞和/或气动致动装置。热循环组装件可任选地包括光学 元件,以允许对热循环腔室的探询,以便进行诸如实时或定量pcr 等试验;所述光学元件可包括诸如激光器或led等光源的光纤传送, 以及荧光的收集以供传送到检测器,诸如ccd、cmos、光检测
器、 光电二极管或光电倍增检测器。光学检测可用于量化样品中dna的 量,这可例如进一步用于将样品稀释成已知的dna浓度,或者用于 调整热循环数目或注射参数。
116.在一些实施方式中,容器的每个腔室由密封构件从顶面密封, 该密封构件可以是透明的或不透明的。容器的底面配置用于搁在与微 流体装置相邻之处,其借助于易碎密封而得到密封。该易碎密封可在 容器与外部环境之间形成气密(或密闭)密封。
117.图9示出根据本发明的实施方式,形成于微流体装置中的穿刺 元件。所述穿刺元件配置用于当容器被压在微流体装置上时在盒的易 碎密封中形成孔。穿刺元件包括配置用于使容器的腔室与微流体装置 中的微流体通道流体连通的孔,以及各种端口,包括样品腔室。这允 许了来自容器的腔室和样品腔室的流体经过微流体装置的微流体通 道的流动。穿刺元件还包括突出物或凸脊,用于帮助在易碎密封中形 成孔。
118.图10示意性地图示了根据本发明的实施方式,当容器与微流体 装置(包括中间层)已彼此接合时的盒。图10的盒包括多个分离的 或可分离的组件,但在一些实施方式中,盒的一个或多个组件可为单 件。例如,样品腔室可形成于微流体装置之中。
119.参考图10,盒1000包括多个样品腔室1001和与具有微流体通 道的微流体装置1010相邻的容器1011。容器1011包括4个裂解试剂 储存与废液腔室1002、4个微珠悬浮与捕获腔室1003、4对第一洗涤 溶液/缓冲液腔室1004和第二洗涤溶液/缓冲液腔室1005、具有4对 预混物腔室1007和反应腔室1008的热循环器组装件1006,以及4 个稀释剂(或稀释)腔室1009。盒1000包括并行的4对预混物腔室 1007和反应腔室1008(示出4对)。容器1011的每个腔室与盒1000 的微流体装置1010(见图15)的通道流体连通。在一些实施方式中, 所有的样品腔室、洗涤腔室、微珠悬浮/捕获腔室、裂解试剂/废液腔 室、稀释剂腔室以及反应腔室都基本上共面。
120.容器1011可预先填充有第一洗涤溶液或缓冲液、第二洗涤溶液 或缓冲液、预混物和微珠。这有利地提供了在最少的使用者干预或者 无使用者干预的情况下的自动化样品制备、处理和分析。试剂可以是 进行str分析所必需的那些试剂。例如,试剂可包括dna和/或试剂。
121.盒1000包括4个处理通道用于并行处理,诸如并行(即,同时) 处理样品,或者并行处理样品和对照。样品腔室1001、微流体装置 1010中的微流体通道以及热循环腔室被包含在盒的单一处理通道或 泳道中。
122.在一些实施方式中,第一和第二洗涤溶液或缓冲液包括水和盐, 诸如氯化钠。在其他实施方式中,第一洗涤溶液和第二洗涤溶液为含 醇(例如,乙醇)的水溶液。第一洗涤溶液和第二洗涤溶液可含有适 合于纯化被捕获到基底(例如,磁响应颗粒)的核酸(例如,dna) 的任何浓度的醇类水溶液(例如,约60%至约95%,或约70%至约 90%)。在一个实施方式中,第一洗涤溶液含有约90%的乙醇水溶液, 而第二洗涤溶液含有约70%的乙醇水溶液。在另一实施方式中,第一 洗涤溶液和第二洗涤溶液全都含有约70%的乙醇水溶液。
123.在一些实施方式中,裂解试剂或缓冲液包含化学或生化裂解试 剂和去污剂/表面活性剂。可用于从细胞中提取核酸的化学裂解试剂的 非限制性示例包括胍盐(例如,硫氰酸胍和盐酸胍)和尿素。在某些 实施方式中,去污剂/表面活性剂包含兼性离子去污剂/表面活性剂和/ 或非离子型去污剂/表面活性剂。兼性离子去污剂/表面活性剂的示例 包括但不限于3
‑
[(3
‑
胆酰胺丙基)二甲基铵基]
‑1‑
丙磺酸酯(chaps)、 椰油酰胺丙基羟基磺基
甜菜碱和椰油酰胺丙基甜菜碱。非离子型去污 剂/表面活性剂的非限制性示例包括聚乙二醇烷基醚类(例如,八聚乙 二醇单十二醚和五聚乙二醇单十二醚)、聚丙二醇烷基醚类、聚乙二 醇与聚丙二醇的嵌段共聚物(例如,泊洛沙姆)、聚 乙二醇辛基酚醚类(例如,如x
‑
100和 x
‑
114)、聚乙二醇烷基酚醚类(例如,np
‑
40和壬苯醇醚
‑
9)、聚乙 二醇失水山梨醇烷基酯类(例如,聚山梨醇酯类/如聚山梨醇 酯/20)、失水山梨醇烷基酯类(例如,失水山梨醇单月桂酸酯)、 甘油烷基酯类(例如,甘油基月桂酸酯)和葡糖苷烷基醚类(例如, 癸基葡糖苷、十二烷基葡糖苷和辛基葡糖苷。在某些实施方式中,裂 解试剂或缓冲液包含胍盐(例如,硫氰酸胍或盐酸胍)、去污 剂/表面活性剂(例如,x
‑
100或x
‑
114)和chaps。 在一个实施方式中,裂解试剂或缓冲液包括约50
‑
70%的硫氰酸胍、 低于约2%的聚乙二醇叔辛基苯基醚(x
‑
114)、低于约2% 的3
‑
[(3
‑
胆酰胺丙基)二甲基铵基]丙磺酸(chaps)和约44.2%的水。
[0124]
在进一步的实施方式中,裂解试剂或缓冲液包含化学或生化裂 解试剂、去污剂/表面活性剂和缓冲剂。在一些实施方式中,该缓冲剂 提供在碱性ph范围(例如,约ph 8
‑
11、约ph 8
‑
10、约ph 10
‑
11、 约ph 9
‑
10或约ph 8
‑
9)内的缓冲。提供在碱性ph范围内的缓冲的 缓冲剂的非限制性示例包括硼酸盐、n,n
‑
双(2
‑
羟乙基)甘氨酸(bicine)、 n
‑
三(羟甲基)甲基甘氨酸(tricine)、三(羟甲基)甲胺(tris)、3
‑
氨 基
‑1‑
丙磺酸、4
‑
(环己基氨基)
‑1‑
丁磺酸(cabs)、3
‑
(环己基氨基)
‑1‑ꢀ
丙磺酸(caps)、3
‑
(环己基氨基)
‑2‑
羟基
‑1‑
丙磺酸(capso)、2
‑
(环 己基氨基)乙磺酸(ches)、n
‑
(2
‑
羟乙基)哌嗪
‑
n
’‑
(3
‑
丙磺酸)(epps) 和3
‑
{[三(羟甲基)甲基]氨基}
‑
丙磺酸(taps)。
[0125]
在附加的实施方式中,裂解试剂或缓冲液包含:1)化学或生化 裂解试剂、去污剂/表面活性剂和消泡剂(也称为去泡剂);或2)化 学或生化裂解试剂、去污剂/表面活性剂、缓冲剂和消泡剂。消泡剂(去 泡剂)的非限制性示例包括基于水的消泡剂、基于硅氧烷的消泡剂(例 如,含有硅酸盐或聚硅氧烷(例如,聚二甲基硅氧烷)的消泡剂)和 含有聚乙二醇和聚丙二醇的共聚物的基于eo/po的消泡剂。
[0126]
如果样品储存在诸如纸张(例如纸)的纤维素基底上, 则可以使用适合从储存在纸张上的细胞中提取核酸(例如,dna)的 裂解试剂或缓冲液。合适的裂解试剂或缓冲液包括但不限于 (可从integenx inc.获得),其可以任选地含有一种或多 种用于本文所述的系统或仪器中的另外的试剂(例如消泡剂)。
[0127]
在处理过程中使用的其他试剂可以包括洗脱缓冲液,例如,该 缓冲液含有10mm tris(ph 8.0)、0.1mm edta。期望时,在微珠上 捕获的dna可以从微珠上洗脱下来或者可以不洗脱。
[0128]
稀释腔室中的稀释剂可以是水溶液。在一些实施方式中,稀释 剂的液体是水。稀释剂还可包含对照—例如,1)在运行样品的泳道 中的大小标准,2)在运行阳性对照的泳道中的大小标准,3)在运行 阴性对照的泳道中的大小标准,和4)在既不运行样品也不运行阳性 对照或阴性对照的泳道中的等位基因标准物和大小标准两者。
[0129]
图11为根据本发明的实施方式的容器的示意性顶视图,图中示 出各个腔室。该容
器包括洗涤溶液/缓冲液腔室、微珠悬浮与捕获腔室、 裂解试剂储存腔室,以及稀释剂腔室。裂解试剂储存腔室在处理期间 用作废液腔室。腔室限定盒的单一通道;如图所示的盒具有4个通道, 用于样品或不同样品的并行处理。当容器被压在微流体装置上时,穿 刺元件形成腔室中的开口。如图所示,在每个腔室中形成2个开口。 所述开口允许流体流向和流出微流体装置的通道。
[0130]
图12为根据本发明的实施方式的盒的示意性侧视图。穿刺元件 已穿透盒的易碎层(或密封),从而使穿刺元件的开口和微流体装置 的微流体通道与容器的腔室流体连通。
[0131]
图13a和图13b示出根据本发明的实施方式的样品贮器。该样 品贮器包括多个样品腔室——盒的每一通道有一个腔室。样品腔室配 置用于容纳样品,例如棉签,诸如借助于q
‑
tip或棉球,或者另一材 料中所含的分析物。样品贮器可包括封盖,用于在处理期间密封样品 腔室。
[0132]
图14示出根据本发明的实施方式的容器和微流体装置。一对穿 刺元件配置用于使微流体装置中的通道与容器的腔室流体连通。在图 15中示出了盒的底视图。微流体装置具有针对盒的每一通道的微流体 通道网络。图15的微流体装置包括4个反应通道,用于并行处理。 样品入口端口配置用于使容器的各个腔室与样品腔室流体连通。反应 腔室入口端口配置用于使微流体装置的微流体通道与配置用于利用 热循环来进行核酸扩增(例如,通过pcr)的反应腔室(本文有时亦 称为“热循环腔室”)流体连通。反应腔室出口端口使反应腔室与分离 系统(诸如电泳毛细管)直接或间接地流体连通。反应腔室可与稀释 剂腔室流体连通,该稀释剂腔室可以利用稀释剂(例如,水)来稀释 扩增产物,反应腔室可以包含对照(例如,大小标准),并且可以转 而与分离系统流体连通。图16为根据本发明的实施方式的盒的示意 性侧视图,图中示出与微流体装置相接合的容器,以及包含4个反应 腔室并附接至微流体装置的热循环器组装件。
[0133]
参考图17,微流体装置的穿刺元件与容器的腔室流体连通。穿 刺元件的开口使腔室与微流体装置的微流体通道流体连通。
[0134]
盒可以是一次性的、单次使用的盒。在一些实施方式中,盒具 有使得在使用后的环境废物以及甚至在构建期间的环境废物(例如, co2和nox排放)减到最少的尺寸和形状。盒可具有提供与其他样 品处理和/或分析系统相比更小的占用空间的厚度。在一些情况下,盒 的尺寸和厚度实现系统100的尺寸的最小化,这转而实现系统100的 便利运输,并且甚至实现在系统100的构建期间的制造成本和费用的 减少。
[0135]
在一些实施方式中,通过将容器与微流体装置相接合而创造出 经过容器的腔室从第一通道到第二通道的流体流动路径。图35a示出 盒3500,其具有带有腔室3501的容器以及与该容器相邻的微流体装 置。该微流体装置包含第一通道3502和第二通道3503。所述第一通 道与穿刺元件3504流体连通,而所述第二通道3503与第二穿刺元件 3505流体连通。容器3501通过可变形材料层3506附接至具有第一通 道3502和第二通道3503的微流体装置。腔室3501借助于易碎(可 刺穿)密封而在与可变形材料层3506相邻的一侧密封。第一通道3502 可与第一端口流体连通以允许流体进入或离开第一通道3502,并且第 二通道3503可与第二端口流体连通以允许流体进入或离开第二通道 3503。可变形材料层3506支撑容器,但在没有足够的力的情况下阻 止穿刺元件3504和穿刺元件3505穿透易碎密封。参考图35b,通过 将容器接合在微流体装置上而使可变形材料层3506变形,并使穿刺 元件
3504和穿刺元件3505与容器的易碎密封相接触。穿刺元件穿透 易碎材料层,并使腔室与第一通道3502和第二通道3503流体连通。
[0136]
本文所提供的匣可由多个组件所形成,并组装形成整体单元。 在一些实施方式中,在由最终使用者使用之前进行组装。
[0137]
图31示出用于随本文所提供的系统一起使用的集成匣3100。 匣3100的单个处理通道具有样品与裂解腔室3101、洗涤溶液/缓冲液 腔室3102、微珠悬浮与捕获腔室3103、裂解试剂储存与废液腔室3104 以及稀释剂腔室3105。匣3100具有包含4个反应腔室3106的热循环 器组装件,所述反应腔室3106配置用于利用热循环来进行核酸扩增 (例如,通过pcr)。匣3100具有4个处理通道或泳道。
[0138]
参考图32,匣3100包括托架3107,该托架3107包括裂解腔室 3101、具有多个微流体通道3109和气动致动阀(例如,move阀) 的微流体装置3108,以及具有腔室3102
‑
3105的容器3110。流体构 件3111使腔室3102
‑
3105与通道3109流体连通。流体构件3111实 现流体体积的宏观到微观转换。流体构件3111包括穿刺元件3111a 和导销3111b,该导销3111b用于将流体构件3111耦合至托架3107。
[0139]
微流体装置3108包括阀,所述阀具有气动层、流体层和安设于 气动层与流体层之间的弹性体层。阀与用于致动阀的正压源或负压源 流体连通(例如,见图36a和图36b)。在使用期间,微流体装置 3108的阀将流体移入和移出腔室3102
‑
3105。在通过与微流体装置 3108相对的一侧上相邻于腔室3102
‑
3105中的每个腔室的空间向腔室 3102
‑
3105中的每个腔室施加正压或负压时,可帮助流体流入和流出 腔室。
[0140]
腔室3102
‑
3105借助于层3112和层3113而密封。层3113由易 碎材料形成,该易碎材料诸如为聚合物材料(例如,弹性体材料)或 本文所提供的其他材料。匣3100包括可变形材料层3114,该可变形 材料层3114配置用于使流体构件3111中的穿刺元件与层3113相接 触。层3112和层3113在腔室3102
‑
3105中的每个腔室内形成气密密 封。
[0141]
匣3100包括夹持构件3115,用于使得使用者能够利用使用者 的一只手或双手来夹持匣3100。夹持构件3115为匣的侧壁中的有角 凹坑。在其他情况下,夹持构件可为所述侧壁的表面上的凸脊。
[0142]
样品腔室3101配置用于容纳样品,例如借助于拭子(例如,棉 签或毛刷拭子)或纤维素基底(例如,纸,诸如纸)。腔室3101 借助于门栓3116来密封,该门栓3116配置成手动关闭,或者备选地 借助于马达机构或致动机构来关闭。洗涤溶液/缓冲液腔室3102可预 先装载有洗涤溶液或洗涤缓冲液。微珠悬浮与捕获腔室3103可预先 装载有用于处理的微珠,诸如磁性(磁响应)微珠或颗粒。在一些实 施方式中,微珠悬浮/捕获腔室包含(例如,预先装载有)二氧化硅包 覆的磁珠(例如,来自promega的微珠)。裂解储存腔室 3104可预先装载有裂解试剂。稀释剂腔室3105可预先装载有可包含 对照(例如,大小标准)的稀释剂(例如,水)。
[0143]
图8、图10、图11、图14、图16、图31和图32示出向每个 试剂储存/废液腔室的左侧(从反应腔室向样品腔室观看)的两个孔, 以及向每个微珠悬浮/捕获腔室的右侧的两个孔。在另一实施方式中, 盒包含向每个试剂储存/废液腔室的左侧的两个孔,以及向每个微珠悬 浮/捕获腔室的右侧的一个孔。在附加的实施方式中,从反应腔室向样 品腔室观看,盒包含:(1)向每个试剂储存/废液腔室的左侧的两个 或更多个孔,以及向每个微珠悬浮/
structures in microfluidic devices”)和属于 jovanovich等人的美国专利公开no.2011/0005932(“universalsample preparation system and use in an integratedanalysis system”)(“jovanovich”)、美国专利公开2010/0303687、 美国专利公开2011/0005932、美国专利公开2011/0126911中进一步 详细地描述了move阀,这些文献通过引用而整体并入于此。
[0150]
move阀、泵和导引器可具有常开配置或常闭配置。在常闭配 置中,若无致动,move阀、泵或导引器是关闭的,从而阻断流体流 动。常闭move阀可在致动时打开,诸如借助于用以将move阀的 弹性体层从阀的阀座移开的正压或真空来打开。在常开配置中,若无 致动,move阀、泵或导引器是打开的,从而允许流体流动。常开 move阀可在致动时关闭,诸如借助于用以移动move阀的弹性体层 并使之与阀的阀座相接触的正压或真空来关闭。
[0151]
move阀和泵可将两个玻璃和/或塑料微流体层与打开和关闭 阀的弹性体层(例如,聚二甲基硅氧烷(pdms))以及气动层结合 起来,以使膜变形并对阀加以致动。蚀刻在顶部玻璃流体片中的微流 体通道是间断的,并且通向常闭的阀座。当通过常规尺度真空源和压 力源向气动排量室施加真空时,常闭pdms膜从阀座抬起以将阀打开。 通过给塑料涂覆一层氧化物(例如,金属氧化物),并继而可选地利 用热和压力使pdms接触塑料,可将pdms联结至塑料。
[0152]
在一些实施方式中,将微流体装置提供于盒中。该盒可包括样 品捕获与纯化系统、微分离系统、微阀、微泵和微导引器系统、纳流 体控制系统和纳米尺度生化系统。move泵、阀和导引器输送、处理 样品,并实现样品分析。这些外部致动、气动驱动的片上阀、泵和导 引器能够以从20nl至10μl的操纵体积来控制流体流动。
[0153]
可以使用3个阀来构成微芯片上的泵,以移动流体经过微流体 通道。所述阀可为微米级阀或纳米级阀,相应地配置用于移动微升或 纳升流体体积。流体可由3个或更多个阀来移动。所述阀可为创造出 的可变形结构的致动。在一些实现方案中,创造出阀座,而在其他实 施方式中可无需阀座。在一个实施方式中,隔膜泵可包含入口(例如, 阀,诸如常开阀)、泵头(例如,1个或2个或更多个泵室,可选地 串联操作)以及出口(例如,阀,诸如常开阀)。(例如,见图52a
‑
52b)。
[0154]
move阀、泵和导引器的阵列可容易地制造在微芯片上。值得 注意的是,微芯片上的所有的move阀、泵和导引器全都使用单片 pdms膜在简单的制造工艺中同时被创造出来。在一些情况下,5个 move微泵在微芯片上的制造可与500个微泵的制造相同。
[0155]
在本发明中有用的装置和系统例如在以下文献中有述:美国专 利7,445,926、美国专利公开2004/0209354、2005/0161669、 2006/0073484、2007/0248958、2008/0014576、2009/0253181、 2010/0165784、2010/0303687、2011/0005932、2011/0126911、 2011/0240127、2012/0181460、2012/0240127和2012/0290648;以及 pct公开wo 2008/115626、wo 2011/011172和wo 2012/024657。
[0156]
在一些实施方式中,阀处于常开配置。或者,阀可处于常闭配 置。在常开配置下,若无致动,可变形膜层不接触座,并且阀允许流 体流经阀的穹顶(或腔室)。致动可变形膜层致使可变形膜层接触座, 从而将阀关闭。在常闭配置下,若无致动,可变形膜层接触阀座,这 阻挡了流体经过阀的穹顶的流动。致动可变形膜层致使可变形膜层从 阀座移开,从而将阀打开。可变形膜层的致动是利用通过气动管路施 加正压或负压以增大或减小气动
腔室中相对于微流体通道的压力(这 可以使可变形膜层变形)而实现的。
[0157]
在一个示例中,图43示出了可随本发明的微流体装置一起使用 的、本发明的常开隔膜阀的实施方式的掀开视图。流体层4301包含 流体导管,该流体导管包含流体通道4302,该流体通道4302通向发 挥阀座的作用的凹陷穹顶4315。当不在弹性层4305上施加压力或负 压时,弹性层4305位于远离阀座之处,从而允许打开的阀,其中进 入阀的通道之间的流体路径处于流体接触,从而创造出流体路径。当 在弹性层4305上施加正压时,弹性层4305朝向阀座变形以将阀关闭。
[0158]
在常开阀的一个实施方式中,不将阀座配置成流体导管中的障 碍物。相反,其采取相对于正常情况下接触弹性层的流体层的表面的 凹陷的形式,从而使得在不对弹性层施加压力(例如,通过致动腔室) 的情况下,弹性层不靠在凹陷的表面上。在这种情况下,阀可不具有 与阀座分离的流体层中的分立阀室。阀座可采取相对于流体层的表面 为凹面的弯曲形状,弹性层可符合于该形状。例如,阀的形状可为倒 凹坑或穹顶。当由压力所变形时,其形状可基本上符合于弹性层的形 状。其可采取基本上为抛物面或球面的一部分的形状。这样的配置例 如通过不包括在阀关闭时含有液体的阀室而减小了阀的死体积。该阀 还包含可让弹性层很容易地与之符合以将阀关闭的表面。另外,该配 置不需要创造出被图案化成使得阀不包含表面羟基以便例如与诸如 pdms等聚硅氧烷弹性体相结合的表面,这是因为凹陷表面不与它们 在构建期间所倚靠的弹性层相联结。在另一实施方式中,该凹形表面 可在其内包含具有凸形表面的子区段,例如,在其内包含外倾凹坑的 倒凹坑,从而例如形成鞍形。凸形区域在压力下上升以与弹性层相遇, 从而为阀创造出更好的密封。
[0159]
在常开阀的一些实施方式中,凹部的凹陷小于其所连接到的通 道。例如,凹部的最深部分可为通道的深度的约三分之一至二分之一 (例如,凹部为30微米至50微米,对比于通道为100微米)。例如, 弹性层可为约250微米,通道为约100微米深,并且阀座为约30微 米深。弹性层越薄,凹部可以越深,这是因为弹性层可在不过度变形 的情况下符合于凹部。在某些实施方式中,通道可部分地进入到凹部 之中,从而例如形成拱顶。在某些实施方式中,通道和凹部通过微加 工来形成。在其他实施方式中,它们可通过热压成型或注射模塑或者 其他方法来形成。致动层可包含阀释放部——隔膜向其中偏转以将阀 打开。
[0160]
在一些实施方式中,由包含致动层中的腔室(例如,阀释放部) 和流体层中的腔室(例如,泵室)但不包含障碍物的主体来形成隔膜 阀。在该实施方式中,通过使隔膜向致动腔室中变形而创造出用以容 纳流体的容积,并且通过使隔膜向流体腔室中变形而将液体泵出该腔 室。在该配置下,隔膜的位置改变流体导管的有效横截面,并且因此 可调控经过阀的流动速度。在这样的配置下,阀可不完全地阻断流体 在导管中的流动。
[0161]
具有凹形阀座的阀在关闭时排开限定的液体体积。因此,当期 望泵送一致的体积时,这样的阀和泵是有用的。通常,泵送阀具有比 截止阀更大的容积。例如,泵送阀可具有介于50μl至150μl之间 (例如,约100μl)的工作容积。泵送阀可串联放置——例如,无介 于中间的特征——以便提供可变容积泵。这样的泵送阀通常放置在发 挥泵入口和泵出口功能的两个截止阀之间。泵头可配置成使得弹性体 膜当在该泵头中被致动时不完全阻止流体穿过泵头。这与可闭阀形成 对比。
[0162]
在一些实施方式中,微流体装置由弹性体聚合物来制成,该弹 性体聚合物例如是ge rtv 615(配方),一种乙烯基硅烷交联的(类 型)硅氧烷弹性体(家族)。然而,微流体装
置并不限于这一种配方、 类型或者甚至该族聚合物家族;相反,几乎任何弹性体聚合物都是合 适的。考虑到聚合物化学、前体、合成方法、反应条件和潜在的添加 剂的巨大的多样性,存在大量可用于制作单片式弹性体微阀和泵的有 可能的弹性体体系。材料的选择通常取决于开展的应用所需的特定材 料性质(例如,耐溶剂性、刚度、透气性和/或温度稳定性)。关于可 在本文所公开的微流体装置的组件的制造中使用的弹性体材料类型 的更多详情在unger等人(2000)science 288:113
‑
116,以及pct公开wo 02/43615(unger等人)和wo 01/01025(unger等人)中有述,上述 文献通过引用而整体并入于此。
[0163]
c.热循环器组装件
[0164]
分析物制备模块可包括热循环器组装件。该热循环器组装件可 被包含在样品盒与盒模块的组合之中。热循环器组装件可配置用于将 分析物(例如,多核苷酸,诸如dna)和试剂传送到反应腔室(或 热循环腔室)以及循环热循环腔室中的液体的温度(例如,加热和冷 却)。在一个实施方式中,热循环腔室附接至样品盒,并与流体装置 流体连通。扩增试剂容器可与热循环腔室流体隔离,并且可配置用于 在致动时向该腔室传送试剂。在盒模块中可包含被配置用于致动试剂 传送的装置(例如,见图55)。热控制器,诸如珀尔帖装置,可配置 用于加热和冷却以便进行热循环,并且可被包含在盒模块中(例如, 见图42),该盒模块可配置用于例如通过安设在如图42的实施方式 中所示的每个反应腔室上的散热器(或者可散布/分布热量和进行冷却 的热导体)来移动热控制器使之与热循环腔室热接触。
[0165]
在一些实施方式中,盒包含具有一个或多个(例如,4个、8 个、10个、16个、24个、32个、40个、48个或更多个)热循环腔 室的热循环器组装件,每个热循环腔室与一微流体通道流体连通。所 述一个或多个热循环腔室可配置用于核酸扩增,诸如通过聚合酶链反 应(pcr)进行核酸扩增。在一些情况下,盒包括与热循环腔室流体 连通的预混物容器或腔室。该预混物容器或腔室包括预混物,该预混 物可包含用于扩增一个或多个选定的核苷酸序列的一种或多种引物、 缓冲液、金属盐(例如,氯化镁)和用于诸如通过pcr、滚环扩增或 其他扩增方法进行的核酸扩增的酶(例如,dna聚合酶,诸如taq 聚合酶)。
[0166]
热循环器组装件的所述一个或多个反应腔室中的每个反应腔室 可配置用于进行标准pcr及其变化形式,诸如等位基因特异性pcr、 装配pcr、不对称pcr、热启动pcr、序列间特异性pcr、反向pcr、 等温pcr(例如,依赖于解旋酶的扩增和pan
‑
ac)、连接介导的 pcr、小引物pcr、多重pcr、巢式pcr、皮滴定(picotiter)pcr、 定量pcr、实时pcr、限制性片段长度多态性pcr、逆转录pcr、 单细胞pcr、固相pcr(例如,桥式pcr)、热不对称交错pcr、 降落(步降)pcr和通用快速步移pcr。在pcr扩增前,可以进行 全基因组扩增以改善低拷贝数dna或降解的dna的扩增。dna还 可以使用其他方法来扩增,这些方法可以是等温的,或者可以涉及热 循环,诸如连接酶链反应和链置换试验。
[0167]
尿嘧啶
‑
dna
‑
糖基化酶(亦称为尿嘧啶
‑
n
‑
糖基化酶、ung或 udg)与脱氧尿苷三磷酸(dutp)组合可用于防止基因座(例如, str基因座)的pcr扩增中的留传dna污染。在代替脱氧胸苷三磷 酸(dttp)的dutp的存在下进行的扩增产生含有尿嘧啶的str扩 增子。在扩增前,pcr反应混合物可以用ung预处理,ung特异性 地降解任何从先前pcr扩增留传的含有尿嘧啶的pcr产物,从而防 止其不期望的扩增。ung在后续pcr扩增过程中被热灭活,而仅有 来自特定目标样品的dna得到扩增。可能期望生成掺入尿嘧啶碱基 而不是胸苷碱基的等位基因标准物,这是因为含有尿嘧啶的str片 段的电泳迁移可能不同于其含有胸苷的对应物
的电泳迁移。
[0168]
通过适当波长(例如,254nm)的uv照射也可以使先前pcr 扩增产物的留传污染最小化。例如,可能含有dna污染物的溶液可 以在适当的仪器(例如,uv crosslinker 2400装置 (stratagene,cedar creek,usa)或spectrolinker xl 1500uv交联装 置(spectronics corp.,westbury,new york))中,在适当的波长(例 如,254nm)和距uv灯泡的适当距离(例如,1cm)下uv照射适 当的一段时间(例如,10分钟)。
[0169]
在一些实施方式中,匣还包含与热循环器组装件相邻的磁场施 加构件。该磁场施加构件可配置用于使用永磁体或电磁体来施加磁场, 在该情况下,磁场施加构件包括永磁体或电磁体。在样品盒中可包含 永磁体。或者,磁场施加构件可以是可移动磁体(例如,永磁体或电 磁体),其可移动以变得邻近于热循环腔室。
[0170]
在一些实施方式中,热循环器组装件包括一对或多对(例如,4 对、8对、10对、16对、24对、32对、40对、48对或更多对)预混 物容器/腔室和用于核酸扩增(例如,通过pcr)的反应腔室。热循 环器组装件在一些情况下包含聚合物材料(例如,塑料),该聚合物 材料附接至盒的微流体装置的外表面。在一个示例中,热循环器组装 件的至少一部分(例如,反应腔室)机械地附接至微流体装置,例如, 用螺栓固定或卡扣至微流体装置上。或者,热循环器组装件的至少一 部分通过粘合(例如,通过胶或胶带)附接至微流体装置。
[0171]
热循环器组装件可包括多个用于核酸扩增的反应腔室。每个反 应腔室可具有细长形状。在一些情况下,每个腔室为开放容器,诸如 槽,该槽具有(从槽的开口到槽的底板测量的)约1微米至10,000 微米、或10微米至800微米、或50微米至600微米的深度。槽可具 有介于约100纳升与1微升、1微升与100微升、或5微升与50微升、 或10微升与30微升之间的容积。在一个示例中,槽具有约510微米 的深度和约20微升的容积。在一些情况下,腔室为圆柱形或矩形形 状的封闭容器。
[0172]
在一些实施方式中,热循环器组装件的反应腔室与热导体(例 如,散热器)热接触,该热导体用于在样品处理期间对每个反应腔室 和反应腔室中的样品传导热量和冷却。热导体可置于热循环器组装件 的每个反应腔室之上,并远离微流体装置(例如,见图34a的层3406、 图42和图44)。热导体可由石墨、石墨烯、铝、铜或含铜合金形成, 但亦可使用其他具有合适的热导率的金属或材料。在一些情况下,热 导体由多个层形成,诸如适于与温度控制元件(例如,加热元件和/ 或冷却元件)热连通的导热材料(例如,石墨)层,以及适于与热循 环器组装件的每个反应腔室或每个反应腔室中的样品相接触的相邻 于导热材料层的聚合物材料(例如,聚丙烯)层。作为替代,热导体 可相邻于盒的微流体装置,诸如位于热循环器组装件与微流体装置之 间,或者集成到热循环器组装件中并安设在邻近于盒之处。
[0173]
在处理期间,温度控制元件(例如,加热元件和/或冷却元件, 其可为加热与冷却元件)安设在与热循环器组装件的一个或多个反应 腔室相邻之处,诸如邻近于盒或者位于反应腔室上并远离盒安设。热 循环器组装件的温度控制元件可集成在微流体装置或盒模块中,或者 位于靠近热循环器组装件腔室之处。温度控制元件可为珀尔帖温度控 制元件(例如,珀尔帖加热与冷却元件),其配置用于在跨珀尔帖温 度控制元件的电极施加电势时生成热量。温度控制元件可与热导体热 连通,这样可以帮助在样品处理期间将热量导向样品。珀尔帖可帮助 在每个腔室中保持恒定温度,或者相应地以期望的或除此之外预定的 加热或冷却速率来增高温度或降低温度。诸如不同温度的循环空气、 水或其他气体或液
体、ir加热以及本领域技术人员所熟知的其他方法 等替代的加热与冷却元件亦有可能,其中空气温度控制和ir加热提 供无接触的优势。
[0174]
图42图示了可进行加热和冷却的热循环装置4200的实施方式。 热循环装置(或热循环器)4200可用于进行热循环,以供例如通过 pcr的核酸扩增。热循环装置4200包含散热器4230、由合适的金属 (例如,铜)所构成的金属块4210,以及由合适的金属(例如,铝) 所构成的冷板4220。珀尔帖加热与冷却元件(未示出)夹在金属块 4210与冷板4220之间。在图42的实施方式中,热循环装置4200被 包括在盒模块中。热循环装置4200浮于盒模块之中,并且通过压在 盒上而与样品/对照盒相接合,这导致冷板4220接触安设于盒的反应 腔室上的热导体。一旦热循环装置4200与盒相接合,则装置被固定 就位。珀尔帖加热与冷却元件既进行加热又进行冷却(例如,通过热 电加热和热电冷却),并且位于盒上的热导体可散布/分布涉及加热和 冷却的热变化。由于热循环装置4200的冷板4220接触热导体,因此 珀尔帖元件的加热和冷却造成热导体的(例如,传导)加热和冷却, 这转而将热量和冷却分布到盒中的4个反应腔室中的每个反应腔室。
[0175]
图18a
‑
图18d示意性地图示了根据本发明的实施方式的热循 环器组装件。图中示出4个热循环腔室,针对上述的盒的每一通道或 泳道有一个热循环腔室。该热循环器组装件包括如图18a中所示的预 混物储存腔室,用于储存和向每个热循环腔室提供预混物。该预混物 可包括用于反应的引物、缓冲液和酶。热循环器组装件包括4个反应 腔室,用于在反应(例如,pcr)期间保存样品和试剂。在一些实施 方式中,如图18b和图45中所示,从样品获得的核酸(例如,dna) 被捕获在磁珠上,并且磁珠借助于磁场(如可由磁场源(例如,磁体、 感应线圈)供应的磁场)而固定就位。如图18c中所示,例如借助于 柱塞从预混物储存腔室向反应腔室提供预混物。图18d示出一个示例 性的预混物(或试剂)流动路径。
[0176]
图18a
‑
图18d的热循环器组装件可用螺栓固定或以其他方式 固定到微流体装置的主体上。(例如,见3106。)在一个示例中,图 16示出附接至微流体装置的4个热循环腔室。热循环器组装件包括用 于样品处理(例如,pcr)的反应腔室。参考图34a,在样品处理期 间,温度控制元件(例如,加热元件和/或冷却元件,诸如珀尔帖加热 与冷却元件)被配置成借助于安设在腔室之上的热导体层3406而与 每个腔室热连通。仅举几例而言,热导体3406可包括石墨、石墨烯、 铜、钽或铝。在一个示例中,温度控制元件(例如,加热元件和/或冷 却元件)在样品处理期间倚靠热导体3406。或者,盒可以包括可例如 安设在微流体装置与热循环器组装件之间的集成式温度控制元件。相 应地,在某些实施方式中,诸如在包括包含通道和涉及聚硅氧烷膜(诸 如pdms)的隔膜阀的微流体芯片的匣中,反应腔室不必被包括在微 流体芯片内。在其他实施方式中,可以通过选择合适的材料(例如, 聚丙烯)制作反应腔室或者通过例如由接枝聚乙二醇(peg)基团、 硅烷化、等离子体处理、化学气相沉积或其他方法对材料进行表面改 性,来将反应腔室的表面配置成不抑制酶的活性。
[0177]
在一些情况下,在核酸扩增(例如,pcr)之前向样品提供扩 增预混物,并于随后对含有预混物的样品进行热退火以启动核酸扩增。 预混物包括用于促进核酸扩增的试剂(例如,引物、酶)。预混物可 为pcr预混物,其可包括短串联重复(str)预混试剂。
[0178]
存在各种用于在扩增之前向经处理的或经部分处理的样品传送 核酸扩增预混物的方式。在预混物的传送之后,在与耦合至盒的通道 流体连通的热循环腔室中升高并且在一些情况下循环样品的温度。
[0179]
在一些实施方式中,借助于柱塞将预混物传送至样品。在其他 实施方式中,借助于再水合传送装置将预混物传送至样品。
[0180]
图33a
‑
图33e图示了可随本文所提供的系统和方法一起使用的 热循环器组装件3300。热循环器组装件3300可为图31和图32的热 循环器组装件3106。图33a为热循环器组装件3300的示意性顶视图。 热循环器组装件3300包括4个试剂传送构件3301(或者试剂(或预 混物)容器/腔室),用于向热循环器组装件3300的4个热循环(或 反应)腔室3302传送预混物或其他试剂。在一些情况下,热循环腔 室3302为槽,该槽具有沿着热循环腔室3302的长度的开口。试剂或 预混物通过与试剂腔室及热循环腔室3302流体连通的通道3303从试 剂传送构件3301传送至热循环腔室3302。在一些实施方式中,通道 3303不包含阀。试剂或预混物可借助于柱塞或致动装置(诸如图55 中所示的致动装置)传送至热循环腔室。图33b为热循环器组装件 3300的示意性底视图。入口端口3304和出口端口3305配置用于相应 地与邻近于热循环器组装件3300安设的微流体装置(诸如图32的微 流体装置3108)的入口端口和出口端口流体连通。
[0181]
例如,将所要处理的样品从微流体装置的入口端口引向入口端 口3304并引向热循环腔室3302。试剂传送构件(或试剂容器/腔室) 3301向热循环腔室3302传送试剂(例如,预混物)。对样品进行处 理(例如,str处理)。继而将经处理的样品引向出口端口3305和 微流体装置的出口端口以供分析,诸如借助于毛细管阵列电泳来进行 分析。在一些实施方式中,电泳系统包括存储器装置,该存储器装置 记录毛细管已被使用的次数。
[0182]
图33c为热循环器组装件3300的分解图,图中示出试剂传送 构件(或试剂容器/腔室)3301。在一些实施方式中,试剂传送构件为 双柱塞密封腔室,其具有第一阻挡器3306和第二阻挡器3307——在 本例中被配置成球。阻挡器3306和3307密封具有试剂(例如,预混 物、主混合物,诸如str主混合物)的贮器(例如,柱或管)3308。 通过向第一阻挡器球3306施加力(举例而言,诸如借助于柱塞或注 射器施加力)而致动第二阻挡器球3307向更大的腔室、空腔或通道 中的移动,所述移动创造出用于让主混合物穿过通道3303进入到热 循环腔室3302的流动路径。热循环器组装件3300包括热导体,该热 导体由层压到聚合物材料(诸如聚丙烯)层3316的诸如石墨等导热 材料层3315所形成。
[0183]
在一些实施方式中,系统100包括双热循环器(本文亦称“热循 环仪”)单元,用于在样品处理过程中使用(见下文)。所述双热循 环器单元在处理期间向每个对照盒和样品盒施加热量和冷却。热循环 器能够以至少约10瓦特(w)、20w、30w、40w、50w、100w、 200w、300w、400w、500w或更高的功率输出来施加热量。图42 图示了热循环器的一个实施方式,该热循环器可以用作被包括在样品 盒接口模块中的两个热循环器中的每一个。如上文所述,由于当样品 /对照盒与盒模块相接触时冷板4220接触安设于反应腔室上的热导体, 因此夹在金属块4210与冷板4220之间的珀尔帖加热与冷却元件(未 在图42中示出)可以传导性地加热和冷却热导体,并从而加热和冷 却反应腔室。在其他实施方式中,热循环器可通过电阻或辐射加热和 冷却来操作,但在一些情况下亦可采用对流加热和冷却。在一些情况 下,在处理期间使用安设在邻近于样品盒接口模块之处的系统100的 自动化捕获磁体来将磁吸颗粒固定就位。
[0184]
通过向阻挡器球施加力,诸如借助于向第一阻挡器球3306施加 正压或者向第二阻挡器球3307施加负压(或真空),来激活试剂从 试剂传送构件(或试剂容器/腔室)3301的
流动。力可借助于机械装 置、气动装置或者其他传力机构或装置(诸如图55中所示的装置) 来施加。在一些情况下,借助于与阻挡器球3306和3307以及贮器(例 如,柱或管)3308流体连通的柱塞来传送力。该柱塞可为金属柱塞或 注射器式装置。
[0185]
在一些实施方式中,第一阻挡器球3306具有比第二阻挡器球 3307更大的直径。在一些情况下,第一阻挡器球3306具有与第二阻 挡器球3307不同的形状。
[0186]
贮器(例如,柱或管)3308可包括一种或多种试剂。阻挡器球 3306和阻挡器球3307可用于将试剂分隔在流体隔离的容器中。在一 些情况下,当向第一阻挡器球3306施加力时,或者备选地,当向第 二阻挡器球3307施加真空时,流体可以混合。
[0187]
阻挡器球3306和阻挡器球3307可为球形或其他几何形状—— 即,阻挡器球3306和阻挡器球3307可具有并不一定为球形的形状。 在一些实施方式中,阻挡器球3306和阻挡器球3307可具有圆形、三 角形、正方形、矩形、五边形、六边形、七边形、八边形或者诸如半 圆形等部分形状的横截面。
[0188]
在其他实施方式中,试剂施加构件包含第二阻挡器球3307和柱 塞而不是第一阻挡器球3306。用于这样的试剂施加构件的传力机构或 装置可与用于包含第一阻挡器球3306和第二阻挡器球3307的试剂施 加构件的传力机构或装置相同或基本上相似。
[0189]
参考图33c和图33d,试剂传送构件(或试剂容器/腔室)3301 具有法兰或衬圈3309,所述法兰或衬圈3309配置用于与具有两个围 壁3311的贮器3310相配合,所述围壁3311具有用于与衬圈3309相 配合的突出物3312。在一个示例中,试剂传送构件3301被配置成卡 扣就位。
[0190]
参考图33d,第一阻挡器球3306通过贮器(例如,柱或管)3308 (其包括用于保存试剂的腔室)而与第二阻挡器球3307流体连通。 在图示的示例中,阻挡器球3306和阻挡器球3307与试剂传送构件 3301的壁相接触,这种配置可以不允许流体流动。图33e中示出了 在这样的情况下阻挡器球3306和阻挡器球3307的配置。
[0191]
当向第一阻挡器球3306施加正压或者向第二阻挡器球3307施 加负压时,流体将会从贮器(例如,柱或管)3308流入通道3303, 并于随后流入热循环腔室3302。在一些实施方式中,如图33f中所示, 当向第一阻挡器球3306施加正压时,第一阻挡器球沿着贮器柱(例 如,柱或管)3308横向地朝向第二阻挡器球3307移动。流体压力将 第二阻挡器球3307逐出具有第二阻挡器球3307的保持腔室3313,从 而在第二阻挡器球3307周围提供流体流动路径3314。流体随后将会 流向通道3303。
[0192]
在一些实施方式中,试剂传送构件(或试剂容器/腔室)3301 可产生流体混合的作用。例如,第二阻挡器球3307可由柱塞来移动 (例如,附接至柱塞),该柱塞可使第二阻挡器球3307能够缩回到 保持腔室3313中。在使用期间,可在向第二阻挡器球3307施加压力 时将第二球3307从保持腔室3313逐出,并于随后将其缩回到保持腔 室3313中。因此,可将流体逐出保持腔室3313和收回到保持腔室(例 如,从通道3303),这产生流体混合的作用。
[0193]
可以将核酸扩增预混物传送至液体形式的样品。例如,图33a
‑ꢀ
图33f的试剂传送(或施加)构件3301配置用于传送液体预混物。 在一些实施方式中,液体形式的pcr试剂储存在经由传送通道连接 至扩增反应腔室的小瓶中。该小瓶由橡胶球在底部密封并由第二橡胶 球或柱塞在顶部密封。如下所述将液体pcr试剂传送到反应腔室: 在顶部球或柱塞上推压以打破由底部球所形成的密封,从而将液体 pcr试剂从小瓶通过传送通道传送到扩增
反应腔室。
[0194]
液体形式的pcr试剂在环境温度下的长期储存可能潜在地造 成pcr引物的降解,这可导致非特异性的扩增和降低扩增效率。为 使试剂的降解减至最小,在一些实施方式中将液体形式的pcr试剂 (或者用于其他生化反应的试剂)储存在约4℃或更冷的温度下。在 其他实施方式中,pcr试剂或用于其他生化反应的试剂以固体(例如, 冻干)形式、干燥形式或其他稳定的形式来储存,这些形式可再水合 以供在合适的生化反应中使用。
[0195]
pcr小瓶、顶部柱塞和底部密封可使用任何合适的技术(例如, 注射模塑),独立地由任何合适的材料(例如,一种或多种聚合物) 制成。例如,pcr小瓶、顶部柱塞和底部密封可独立地由选自环烯烃 聚合物和共聚物、合成橡胶、乙烯丙烯二烯单体(epdm)、聚丙烯、 聚甲醛和液体硅橡胶之中的一种或多种聚合物制成。材料的选择可取 决于诸如易于制造(例如,注射模塑)、pcr相容性等因素。在一些 实施方式中,pcr小瓶由聚丙烯或者环烯烃聚合物或共聚物制成。在 某些实施方式中,顶部柱塞和底部密封由聚丙烯制成。
[0196]
d.盒模块组装件
[0197]
参考图3和图39,样品盒接口模块包括两个盒模块,用于容纳 样品盒,诸如一个对照盒和一个样品盒或者两个样品盒。样品盒用于 提供要制备、处理和分析的一个或多个样品(例如,带有遗传物质的 流体fta卡片穿孔器、固体材料或组织样品)。对照盒可针对对照 样品而提供,例如,该对照样品具有已知的遗传谱和/或阴性对照(例 如,不含可通过分析物制备过程来扩增的dna序列)。对照可包括 等位基因标准物、例如具有已知遗传谱的阳性对照,以及不具有任何 目标dna(例如,无人类dna)的阴性对照。对照盒还可根据配置 而处理一个或多个样品。
[0198]
在图3和图39中所示的实施方式中,样品盒接口模块包含两个 盒模块。在其他实施方式中,样品盒接口模块包含用于接收单一样品 盒的单一盒模块。配置用于接收单一样品盒的样品盒接口模块将不需 要提供通向多个(例如,两个)样品盒的气动连接和流体连接,这可 减少系统或仪器的重量和复杂度。不论样品盒接口模块包含单一盒模 块还是多个(例如,两个)盒模块,样品盒均可配置成具有4组、8 组、10组、16组、24组、32组、40组、48组或更多组样品腔室、 试剂腔室(例如,一个或多个洗涤腔室、dna捕获腔室、裂解试剂/ 废液腔室以及稀释剂腔室)、反应腔室以及反应试剂(例如,预混物) 腔室,用于接收和处理4个、8个、10个、16个、24个、32个、40 个、48个或更多个样品,其中可以运行一个或多个对照(例如,等位 基因标准物、阳性对照和/或阴性对照)来代替一个或多个样品。
[0199]
在一些实施方式中,夹紧系统与盒接合,并使盒的宏观尺度腔 室彼此流体连通。在一个示例中,夹紧系统与盒接合,并使裂解腔室 通过盒的微流体通道而与缓冲液腔室流体连通。因此借助于盒,系统 100被配置用于实现流体体积的宏观到微观缩减,并且还实现流体体 积的微观到宏观扩大。
[0200]
在一些实施方式中,该系统包含用于接收匣的贮器,该匣具有 包含多个封闭的且流体隔离的腔室的容器以及包含多个穿刺元件和 与一个或多个端口流体连通的微流体通道的微流体装置。所述多个封 闭的且流体隔离的腔室中的每个腔室包含易碎密封。该系统还包括压 力施加构件,用于使微流体装置与容器相接合。通过使微流体装置与 容器相接合而刺穿所述多个封闭的且流体隔离的腔室中的每个腔室 的易碎密封,并且在所述多个封闭的且流体隔离的腔室中的每个腔室 与微流体通道之间创造出流体流动路径。
[0201]
在一些实施方式中,系统包含盒模块,该盒模块具有用于容纳 盒的贮器以及具有第一压力歧管的第一组装件,所述第一压力歧管接 合盒的第一面并使所述一个或多个腔室与压力源流体连通。第二组装 件具有第二压力歧管,该第二压力歧管接合盒的第二面并使所述一个 或多个阀与用于致动(例如,气动致动或液压致动)的压力源流体连 通。伸长或移动构件将第一组装件和第二组装件中之一或全部两者朝 向盒模块移动并使之靠近盒。
[0202]
伸长或移动构件可通过线缆(诸如波顿线缆(bowden cable)) 耦合至第一组装件和第二组装件中之一或全部两者。伸长或移动构件 可将第一压力歧管和第二压力歧管中之一或全部两者移离盒模块。在 一些情况下,伸长或移动构件包含空气驱动活塞,该活塞的移动将第 一组装件和第二组装件中之一或全部两者移向盒模块。气动活塞可具 有一个或多个传感器,用于监控活塞的运动。例如,气动活塞可具有 两个传感器,用于指示活塞是否完全撤回或完全接合。
[0203]
1.流体歧管和气动歧管
[0204]
图36a示出根据本发明的实施方式的、配置用于容纳盒的盒模 块3600。盒模块3600包括盒贮器3601、第一组装件3602和第二组 装件3603。第一组装件3602包括第一气缸3604并且第二组装件3603 包括第二气缸3605。所述气缸各自与正压源或负压源流体连通。在一 个示例中,第一气缸3604与正压源流体连通,并且第二气缸3605与 正压源流体连通。
[0205]
当第一组装件已与盒接合时,第一气缸3604向盒的腔室(例如, 图31中的废液腔室3104)提供正压或负压(真空)。第二气缸3605 如本文其他部分所述致动盒的微流体装置中的阀。
[0206]
继续参考图36a,第一组装件3602包含流体推动器组装件3606。 该流体推动器组装件包括歧管3607,该歧管3607配置成位于邻近已 被插入到盒贮器3601中的盒之处,并将正压或负压引向盒的一个或 多个腔室。在一些情况下,歧管3607将正压引向盒的腔室以促进流 体流动。第一组装件可包括str柱塞组装件,用于致动盒的str柱 塞。
[0207]
在盒被插入到盒贮器3601中的情况下,借助于伸长或移动构件 (未示出)而对着盒的腔室移动歧管3607。伸长或移动构件可通过线 缆(诸如波顿线缆)耦合至歧管3607。
[0208]
图36b示出盒模块3600的透视图,其中盒模块相对于图36a 中所示的盒模块旋转180度。参考图36b,第二气缸3605安设在邻 近气动推动器组装件(或压力歧管)3608之处。第二气缸3605向与 盒的微流体装置的单个阀流体连通的气动推动器组装件3608提供空 气。第二气缸3605和气动推动器组装件3608配置用于致动微流体装 置的阀。
[0209]
在一些实施方式中,本公开的仪器或系统包含由合适的材料(例 如,金属或金属合金,诸如不锈钢)制成的管道,所述管道通过接合 端口来促进本文所述的流体连通。这样的管道可具有相对于其他此类 管道相同或不同的尺寸,并且可沿着管道的长度具有相同或不同的尺 寸。管道可包含刚性材料。每个管道可独立地对其所对准的端口偏置。 例如,每个管道可由不同的压力源(例如,不同的弹簧)来驱动。独 立偏置可确保每个管道与每个端口的正确密封,特别是在其中盒具有 有限的顺应性的情况下尤为如此。
[0210]
在一些实施方式中,仪器或系统包含10个或更多个管道(例如, 图46中的管道3620),所述管道可逆地接触微流体装置的气动侧上 的垫片,接合气动端口,并通过施加压力或真空而经由阀的促动来促 进流体连通。在一些实施方式中,仪器或系统包含15个或更
多个、20个或更多个、25个或更多个或者30个或更多个这样的管道。在其 他实施方式中,仪器或系统包含从20个到30个这样的管道。在某些 实施方式中,仪器或系统包含23个、24个或25个这样的管道。在一 些实施方式中,本文所述系统的第二组装件的第二压力歧管包含这样 的管道。
[0211]
配置用于接合匣的系统可包括气动歧管和流体歧管,所述气动 歧管与流体芯片的气动层上的气动端口相配合,而所述流体歧管与流 体层上的端口相配合。包含气动歧管的气动组装件可由电磁阀来控制, 以便传送压力和真空。流体组装件可包含流体歧管,该流体歧管接合 匣上的端口并且包括将匣中的通路与分析组装件(例如,毛细管电泳) 连接起来的通道。
[0212]
当完全接合时,气动歧管接合气动端口。在一些情况下,压力 歧管与盒的一个或多个腔室流体连通。该压力歧管向所述一个或多个 腔室提供正压或负压。在另一侧,匣具有与芯片上的端口连通的端口, 所述芯片上的端口与微流体通道连通。在一些情况下,这些第一端口 与压力源相接合,以便不通过隔膜泵而是通过外部压力来泵送液体。
[0213]
气动模块可包括压缩器和/或泵,用于向诸如盒103和盒105的 阀等各个气动致动阀提供加压气体(例如,压强大于1atm)和/或真 空。系统100可包括致动导管,所述致动导管与气动模块流体连通, 用于提供阀与气动模块之间的(正或负)压力连通。每个致动导管与 相比于环境的正压源(例如,空气压缩器)或者相比于环境的负压源 (例如,真空泵)或者全部两者流体连通——亦即,系统100可配置 成同时借助于正压和负压来对阀加以致动,举例而言,诸如使用正压 来关闭常开阀,以及使用负压来打开常开阀。气动模块还可向样品盒 的流体器件中的端口以及向缓冲液模块提供压力,以将缓冲液从缓冲 液模块移至样品盒的流体系统。
[0214]
在其他实施方式中,仪器或系统包含4个或更多个管道(例如 图46中的管道3610),所述管道穿过通往每个微珠悬浮/捕获腔室的 右侧(或通往其左侧)的一个或多个孔,可逆地接触微流体装置的流 体侧的垫片,接合流体通道的端口,并通过施加压力(例如,空气或 液体压力)来促进各处之间(例如,腔室之间)的流体移动。在一个 实施方式中,仪器或系统包含4个这样的管道,每个管道单独地穿过 通往4个微珠悬浮/捕获腔室中的每个腔室的右侧(或通往其左侧)的 一个孔,针对每个这样的孔有一个这样的管道。在另一实施方式中, 仪器或系统包含8个这样的管道,每个管道单独地穿过通往4个微珠 悬浮/捕获腔室中的每个腔室的右侧(或通往其左侧)的两个孔之中的 一个孔,针对每个这样的孔有一个这样的管道。应当理解,这样的管 道的数目可基于通往每个微珠悬浮/捕获腔室的右侧(或通往其左侧) 的孔的数目以及微珠悬浮/捕获腔室的数目,或者要由这样的管道接合 的流体端口的数目。在一些实施方式中,本文所述系统的第一组装件 的第一压力歧管包含这样的管道。
[0215]
在附加实施方式中,仪器或系统包含8个或更多个管道(例如, 图46中的管道3614和管道3616),所述管道穿过通往每个试剂储存 /废液腔室的左侧(或通往其右侧)的两个或更多个孔,可逆地接触微 流体装置的流体侧上的垫片,接合流体端口,并成为流体的导管。在 一个实施方式中,仪器或系统包含8个这样的管道,每个管道单独地 穿过通往4个试剂储存/废液腔室中的每个腔室的左侧(或通往其右侧) 的两个孔之一,针对每个这样的孔有一个这样的管道。在某些实施方 式中,穿过通往每个试剂储存/废液腔室的左侧(或通往
其右侧)的上 部孔的管道(例如,图46中的管道3614)通过施加压力(例如,弹 簧驱动的压力)而将样品盒(含有样品腔室的盒)连接至毛细管电泳 系统,并且穿过通往每个试剂储存/废液腔室的左侧(或通往其右侧) 的下部孔的管道(例如,图46中的管道3616)通过施加压力(例如, 弹簧驱动的压力)而将样品盒连接至缓冲液盒。所述管道可连接至将 样品从盒输送到电泳毛细管的导管,诸如柔性管道。应当理解,这样 的管道的数目可基于通往每个试剂储存/废液腔室的左侧(或通往其右 侧)的孔的数目以及试剂储存/废液腔室的数目,或者要由这样的管道 接合的流体端口的数目。在一些实施方式中,本文所述系统的第一组 装件的第一压力歧管包含这样的管道。
[0216]
在一些实施方式中,用于接合样品盒的歧管结构(例如,本文 所述系统的第一组装件的第一压力歧管或第二组装件的第二压力歧 管)包含底座压力板、多个管弹簧组装件以及压力致动器。在某些实 施方式中,管弹簧组装件包含这样的管道:其具有两个止动环槽、两 个止动环、带有由凸起的密封边缘所包围的孔口的尖端、与该尖端相 对的软管钩结构,以及盘簧。所述盘簧被容纳在两个止动环与止推板 之间。所述止推板包含多个管弹簧组装件,所述多个管弹簧组装件处 于被配置用于接合盒的端口的布置之中。所述多个管道配置用于同时 成组地或单个地流体接合盒(例如,如果使用不止一个止推板)。管 道被配置用于单个地施加足以针对盒上的管道产生与对应端口(或者 中间垫片)的可靠密封的力。为了让所有的管道产生可靠密封,管道 阵列无需为高精度平面结构,并且盒无需为高精度结构。每个管道可 独立于其他管道而移动和接合,以便优化每个密封。相比之下,单片 固封“块”可能在密封盒的端口方面效果较差,这是因为密封块和盒的 两个平面可能需要高准确度(例如,约0.001英寸内)并且考虑到整 体系统精度,密封上的力分布可能并非合适地是均匀的。
[0217]
图46示出盒模块3600的一个实施方式。在图46的实施方式中, 第一组装件3602的第一压力歧管3607包含如下的4个管道3610:每 个所述管道单独地穿过通往每个微珠悬浮/捕获腔室的右侧(或通往其 左侧)的一个孔(针对每个这样的孔有一个这样的管道),并且接合 盒的微流体装置的流体侧上的端口。第一组装件的第一压力歧管还包 含如下的4个管道3614和4个管道3616:每个所述管道分别单独穿 过通往每个试剂储存/废液腔室的左侧(或通往其右侧)的上部孔和下 部孔(针对每个这样的孔有一个这样的管道),并且接合微流体装置 的流体侧上的端口。在图46的实施方式中,第二组装件3603的第二 压力歧管3608包含如下的23个或24个管道3602:每个所述管道接 合微流体装置的气动侧上的端口。
[0218]
在一些实施方式中,为了避免由污染物(例如,dna污染物, 诸如潜在可扩增的等位基因标准物或大小标准)所造成的潜在污染 (例如,批次间污染或跨泳道污染),在流体端口与穿过通往每个微 珠悬浮/捕获腔室的右侧(或通往其左侧)的一个或多个孔并接合此类 端口的管道(例如,图46中的管道3610)的末端之间放置包含疏水 材料的膜。在一个实施方式中,在接触这样的管道的垫片之下放置疏 水膜。所述疏水膜被设计用于允许气体从其穿过但不允许亲水液体 (例如,水溶液)穿过。构成疏水膜的材料的非限制性示例包括氟化 和全氟化聚合物{例如,全氟烷氧基(pfa)聚合物、聚四氟乙烯(ptfe, )、氟化乙烯
‑
丙烯(fep)聚合物、聚乙烯四氟乙烯(petfe)、 聚氟乙烯(pvf)、聚偏二氟乙烯(pvdf)、聚乙烯氯三氟乙烯(pectfe) 和聚氯三氟乙烯(pctfe)}、烃聚合物(例如,聚乙烯和
聚丙烯) 和含硅材料(例如,含硅聚合物和二氧化硅)。
[0219]
在其他实施方式中,为了排除由污染物(例如,dna污染物, 诸如潜在可扩增的等位基因标准物或大小标准)所造成的潜在污染 (例如,批次间污染或跨泳道污染),在样品到结果流程完成时用除 污剂(例如漂白剂)来洗涤穿过通往每个微珠悬浮/捕获腔室的右侧(或 通往其左侧)的一个或多个孔并接合流体端口的管道(例如,其内部) (例如,图46中的管道3610)。例如,可以使用含有除污剂(例如, 漂白剂)水溶液并且可选地含有一种或多种其他溶液(例如,水和/ 或乙醇)的除污盒来在样品到结果流程完成时用一种或多种此类溶液 来洗涤这样的管道的内部。
[0220]
在附加实施方式中,为了避免由污染物(例如,dna污染物, 诸如潜在可扩增的等位基因标准物或大小标准)所造成的潜在污染 (例如,批次间污染或跨泳道污染),在图8的容器之下放置浸有清 洗液的适形或海绵状材料。该适形或海绵状材料可为图8的可变形材 料、用来代替可变形材料的材料,或者与可变形材料相邻(例如,位 于其上方)的材料。污染物(例如,dna污染物)与浸有清洗液的 适形或海绵状材料的接触可使污染物降解。清洗液可含有除污剂(例 如,漂白剂)。
[0221]
2.缓冲液盒模块
[0222]
图7中示出了系统100的缓冲液盒与接口模块。该缓冲液盒与 接口模块包括缓冲液接口模块和缓冲液盒。图中左侧示出了缓冲液盒 的分解图。缓冲液盒接口模块包括用于容纳缓冲液盒的自动化接合机 构,该缓冲液盒可包含(例如,预先填充有)一种或多种缓冲液和/ 或水。一种或多种缓冲液可用于电泳(例如,毛细管电泳)。
[0223]
在一些实施方式中,缓冲液盒包含(例如,预先装载有)用于 电泳的水性缓冲液,该水性缓冲液含有一种或多种缓冲剂,该缓冲剂 选自n,n
‑
双(2
‑
羟乙基)甘氨酸(bicine)、n
‑
三(羟甲基)甲基甘氨酸 (tricine)、三(羟甲基)甲胺(tris)、3
‑
氨基
‑1‑
丙磺酸、4
‑
(环己基氨 基)
‑1‑
丁磺酸(cabs)、3
‑
(环己基氨基)
‑1‑
丙磺酸(caps)、3
‑
(环 己基氨基)
‑2‑
羟基
‑1‑
丙磺酸(capso)、2
‑
(环己基氨基)乙磺酸(ches)、 n
‑
(2
‑
羟乙基)哌嗪
‑
n
’‑
(3
‑
丙磺酸)(epps)和3
‑
{[三(羟甲基)甲基]氨基}
‑ꢀ
丙磺酸(taps)。在一个实施方式中,缓冲液盒包含含有tris和taps 的水性缓冲液。在另外的实施方式中,缓冲液盒还包含(例如,还预 先装载有)例如可用于阴极准备和清洁的水。在某些实施方式中,该 水性缓冲液和/或水进一步含有金属螯合剂。金属螯合剂的非限制性示 例包括金精三羧酸(ata)、硼酸、柠檬酸、水杨酸、1,2
‑
双(邻氨基 苯氧基)乙烷
‑
n,n,n',n'
‑
四乙酸(bapta)、二亚乙基三胺五乙酸(dtpa)、乙二胺四乙酸(edta)、乙二醇四乙酸(egta)、二 醇醚二胺四乙酸(gedta)、n
‑
(2
‑
羟乙基)乙二胺
‑
n,n',n'
‑
三乙酸 (hedta)、次氮基三乙酸(nta)、2,2'
‑
联吡啶、邻菲咯啉、三乙 醇胺,以及它们的盐。在一个实施方式中,金属螯合剂包含edta。 在另外的实施方式中,缓冲液盒进一步配置用于收集废料。
[0224]
借助于压力(例如,正压或负压)从缓冲液盒提供缓冲液和/ 或水。压力/泄放管路可将缓冲液盒连接至压力电磁阀。为了捕获任何 可能从缓冲液盒出来(例如,由于盒内超压)并进入压力/泄放管路的 液体,可在缓冲液盒与压力电磁阀之间的压力/泄放管路中放置集液器。 该集液器阻止液体迁移至压力电磁阀。还可在将压力源(例如,10psi 泵)连接至压力电磁阀的管路中放置止回阀。该止回阀被设计用于例 如通过创造出静态空气体积并且不产生流动而保护压力电磁阀。集液 器和/或止回阀还可在本文所述仪器或系统的其
他位置上使用,在这些 位置上,不期望让液体进入将液体源连接至阀或其他结构的管路。缓 冲液接口模块包括用于读取缓冲液盒的板载eeprom的eeprom读 取器,该eeprom读取器可以可拆卸地安装在缓冲液接口模块上。 缓冲液接口模块可具有相对较小的占用空间。在一些情况下,缓冲液 接口模块具有约4.5英寸或更小的长度、约2.5英寸或更小的宽度, 以及约5英寸或更小的高度。系统100的缓冲液接口模块有利地允许 使用者为系统100装载不同类型的缓冲液。缓冲液盒接口模块还可包 括用于接收来自将液体从样品盒移至阴极组装件的流体导管的液体 (例如,废液)的腔室。
[0225]
e.处理样品的方法
[0226]
在本发明的另一方面,提供用于处理样品的方法。本文所提供 的方法可与本文所提供的系统诸如图1的系统100和图8
‑
图18d的盒 一起使用。
[0227]
在一些实施方式中,用于处理生物样品的方法包括(a)提供如 上文所述的匣,(b)在样品腔室中提供生物样品,(c)将微流体装 置与容器相接合以在多个封闭的且流体隔离的腔室与微流体通道之 间形成流体流动路径,以及(d)处理所述生物样品。在一些情况下, 所述多个封闭的且流体隔离的腔室包含容纳稀释剂的第一腔室、容纳 一种或多种裂解试剂的第二腔室、具有捕获颗粒的第三腔室,以及具 有洗涤溶液的第四腔室。第二腔室与样品腔室流体连通。在一些情况 下,将微流体装置与容器相接合包括在微流体装置的方向上对容器施 加压力。
[0228]
在一些实施方式中,通过以下步骤处理样品:将来自第二腔室 的所述一种或多种裂解试剂引向样品腔室,使所述一种或多种裂解试 剂接触样品腔室中的生物样品,从而从该生物样品提取核酸样品,将 所述核酸样品从样品腔室引向第三腔室,从而将至少一部分所述核酸 样品附着至捕获颗粒,以及将捕获颗粒引向通过微流体通道而与第三 腔室流体连通的反应腔室(或热循环腔室)。
[0229]
在一些情况下,借助于负压或正压,诸如由安设在微流体装置 中的一个或多个泵所提供的负压,将裂解试剂从第二腔室引向样品腔 室。
[0230]
在一些情况下,样品包括核酸。在处理期间,在匣的反应腔室 (例如,配置用于利用热循环来进行pcr的反应腔室)中扩增核酸。 可以使核酸附着至捕获颗粒(例如,微珠)。在一些情况下,核酸样 品通过以下步骤进行扩增:将捕获颗粒引向热循环器组装件的反应腔 室,向该反应腔室提供含有引物、可含金属盐(例如,氯化镁)的缓 冲液和酶(例如,dna聚合酶,诸如taq聚合酶)的预混物,加热 核酸以扩增核酸,以及随后将经扩增的核酸引向分离系统。
[0231]
在一个示例中,在样品制备、处理和分析系统,诸如图1的系 统100中提供盒,诸如图10的具有微流体装置1010的盒1000。在将 盒1000提供于系统中之前或之后,将样品(诸如含核酸的棉签或者 含细胞的样品)提供到样品腔室1001之中。继而将盒1000的腔室与 微流体装置1010相接合,从而使腔室与微流体装置1010的微流体通 道流体连通。通过将腔室与微流体装置1010相接合还使腔室通过微 流体装置1010的微流体通道而彼此流体连通。继而,使流体推动器 组装件的歧管(例如,见图36a和图36b)与盒1000的试剂腔室和 处理腔室流体连通。将裂解试剂储存腔室1002中所含的裂解缓冲液 经过微流体装置1010(具有微流体通道)泵送至样品腔室1001之中, 在该处,裂解缓冲液(例如,naoh和去污剂,诸如sds;或者胍盐 (例如,硫氰酸胍)、兼性离子去污剂/表面活性剂(例如,chaps) 和/或非离
使用等位基因标准物(位于一个或多个基因座中的每个基因座处的多 个等位基因)。在优选实施方式中,在不含样品的泳道中提供等位基 因标准物。在某些实施方式中,等位基因标准物包含位于一个或多个 str基因座(诸如在法医数据库(例如,codis)中所使用的那些 str基因座)中的每个基因座处的多个等位基因。在一些实施方式中, 等位基因标准物包含位于或者可选地邻近于在codis中所使用的一 个或多个或者所有的str基因座处的多个等位基因,以及可选地包 含牙釉蛋白(amel)和被指定为penta d和penta e的str基因座 的多个等位基因。codis目前使用被指定为csf1po、d3s1358、 d5s818、d7s820、d8s1179、d13s317、d16s539、d18s51、d21s11、 fga、th01、tpox和vwa的str基因座用于人类识别,以及牙釉 蛋白用于性别确定。在一个实施方式中,等位基因标准物包含位于以 及可选地邻近于所有的codis str基因座外加牙釉蛋白、penta d和 penta e的多个等位基因。在另一实施方式中,同时使用大小标准和 等位基因标准物。在优选实施方式中,在含有样品的每个泳道中提供 大小标准,在不含样品的泳道中提供等位基因标准物,并且含有等位 基因标准物的泳道还含有大小标准。
[0234]
大小标准和/或等位基因标准物可在任何适当腔室中提供(例如, 预先装载)。在一个实施方式中,在预混物腔室中提供(例如,预先 装载)大小标准和/或等位基因标准物。为了避免由潜在可扩增的大小 标准和/或由潜在可扩增的等位基因标准物所造成的潜在污染(例如, 批次间污染或跨泳道污染),可以将大小标准和/或等位基因标准物提 供(例如,预先装载)在扩增后腔室中或者临引入到毛细管电泳系统 之前的腔室中。在优选实施方式中,可将大小标准和/或等位基因标准 物提供(例如,预先装载)在稀释剂(稀释)腔室中。
[0235]
如果同时采用大小标准和等位基因标准物,则可将大小标准和 等位基因标准物提供(例如,预先装载)在任何一个或多个合适的腔 室中。在一个实施方式中,将大小标准和等位基因标准物提供(例如, 预先装载)在同一泳道或单独的泳道的预混物腔室中。在另一实施方 式中,将大小标准提供(例如,预先装载)在一个泳道的预混物腔室 中,并且将等位基因标准物提供(例如,预先装载)在同一泳道或单 独的泳道的稀释剂腔室中。在其他实施方式中,将大小标准提供(例 如,预先装载)在一个泳道的稀释剂腔室中,并且将等位基因标准物 提供(例如,预先装载)在同一泳道或单独的泳道的预混物腔室中。 在附加实施方式中,将大小标准和等位基因标准物提供(例如,预先 装载)在同一泳道或单独的泳道的稀释剂腔室中。在优选实施方式中, 将大小标准提供(例如,预先装载)在含有样品的每个泳道的稀释剂 腔室中,将等位基因标准物提供(例如,预先装载)在不含样品的泳 道的稀释剂腔室中,并且含有等位基因标准物的稀释剂腔室还含有 (例如,还预先装载有)大小标准。
[0236]
在其他实施方式中,使用阳性对照。在一些实施方式中,阳性 对照包含已知的或未知的受试者(例如,已知的或未知的人)的纯化 基因组dna。在其他实施方式中,阳性对照可为结合到拭子或处于 液体中的对照核酸。在某些实施方式中,阳性对照的dna在与来自 规则样品的dna相同的基因座(例如,所有的codis str基因座, 可选地外加penta d、penta e和牙釉蛋白)处经受pcr扩增。在优选 实施方式中,含有阳性对照的泳道还含有大小标准。阳性对照和大小 标准可提供(例如,预先装载)在任何一个或多个适当的腔室中。例 如,可将阳性对照的dna提供(例如,预先装载)在样品腔室或预 混物腔室中,并且可将大小标准
提供(例如,预先装载)在预混物腔 室或稀释剂腔室中。在优选实施方式中,将阳性对照的dna提供(例 如,预先装载)在预混物腔室中,并且将大小标准提供(例如,预先 装载)在稀释剂腔室中。
[0237]
在其他实施方式中,可以通过使用未见于目标str组中的序列 来提供阳性内对照dna,或者可以使用包括人造dna在内的非人类 dna。阳性内对照dna可根据需要而提供(例如,预先装载)在任 何或每个泳道中。引物和荧光染料将被设计成具有由阳性内对照所生 成的、不与目标str组的任何等位基因(例如,在荧光色或片段大 小方面)重叠的扩增产物。这种方法的一个优点在于,每个样品均可 具有阳性内对照而无需针对阳性对照使用完整的泳道,因此允许每次 运行分析再多一个样品,从而降低成本并且潜在地提高阳性对照的质 量。
[0238]
在附加实施方式中,使用阴性对照。在一些实施方式中,阴性 对照不含所要扩增的dna,而是含有相同的预混试剂,包括相同的 染料标记的引物寡核苷酸,用于通过pcr来扩增样品的dna的选定 基因座(例如,选定的str基因座,诸如所有的codis str基因座, 可选地外加penta d、penta e和牙釉蛋白)。在优选实施方式中,含 有阴性对照的泳道还含有大小标准。阴性对照和大小标准可提供(例 如,预先装载)在一个或多个适当的腔室中。例如,可将阴性对照提 供(例如,预先装载)在预混物腔室中,并且可将大小标准提供(例 如,预先装载)在预混物腔室或稀释剂腔室中。在优选实施方式中, 将阴性对照提供(例如,预先装载)在预混物腔室中,并且将大小标 准提供(例如,预先装载)在稀释剂腔室中。
[0239]
在某些实施方式中,可将等位基因标准物、阳性对照和阴性对 照提供(例如,预先装载)在对照盒中,该对照盒可选地还可收取样 品。
[0240]
iii.检测与分析模块
[0241]
分析与检测模块可包括毛细管电泳组装件、检测组装件和分析 组装件。
[0242]
图49示出在本发明的系统中有用的分析模块的示意图。样品 (例如,经扩增的dna或对照)和缓冲液(例如,电泳缓冲液)在 可包括变性加热器、用于向毛细管中注射分析物的阴极组装件的路径 中从分析物制备模块流过流体导管(例如管)并流出至废物。变性加 热器加热含dna的流体,并将双链dna中的链变性成单链。阴极组 装件可包括连接至电压源的电极,诸如叉形电极。当所要分析的样品 被定位用于注射时,该电极可提供电压以将分析物注射到毛细管中。 毛细管填充有分离介质,诸如线性聚丙烯酰胺(例如,可从美国加利 福尼亚州pleasanton的integenx inc.购得的lpa v2e)。毛细管末端 电连接至电压源,例如,阳极和阴极。经分离的分析物用检测模块来 检测。该检测模块例如可采用激光器和检测器,诸如ccd相机、cmos、 光电倍增器或光电二极管。阳极组装件(例如,阳极盒接口)可包括 与毛细管和电压源电连接的阳极。阳极组装件还可包括分离介质源和 用于将分离介质引入毛细管的压力源。阳极组装件可包括电泳缓冲液。 分离介质和/或电泳缓冲液可被包括在阳极盒中。该阳极盒可配置用于 可拆卸地插入到阳极组装件中。其可含有足以用于一次或不止一次运 行的分离介质和/或电泳缓冲液。
[0243]
a.毛细管电泳组装件
[0244]
毛细管电泳组装件可包括:注射组装件,其可包括变性组装件、 阴极组装件;毛细管组装件;阳极组装件;毛细管填充组装件,用于 用分离介质来填充毛细管;定位组装件,用于定位分析物(或样品) 以供毛细管注射;以及功率源,用于在阳极与阴极之间施加电
压。
[0245]
毛细管电泳系统可包括一个或多个用于促进样品或产物分离的 毛细管,该毛细管可帮助进行分析。在一些实施方式中,流体流动路 径将样品或产物从盒引向该流体流动路径与分离通道之间的交点。 (例如,见图49和图54a
‑
54b。)借助于可在跨系统的阳极和阴极 施加电势(见下文)时生成的电场来将样品从流体流动路径引向分离 通道,并且将其导引穿过分离通道。全文并入于此的美国专利公开 no.2011/0005932(“universal sample preparation systemand use in an integrated analysis system”)提供了可随 本文的系统一起使用的、用于在分析中使用的电泳毛细管的示例。该 毛细管可插入到流体导管中以供流体连通和电连通。
[0246]
1.阴极组装件
[0247]
阴极还可通过与流体导管中的流体的电连通而与毛细管电连通。 该阴极可安设在流体导管中靠近与毛细管的连接之处。例如,阴极可 定位在与毛细管连接流体导管的点相对之处(例如,既不在该连接的 上游也不在其下游)。这可有助于样品向毛细管中的注射以及/或者提 供运行电泳的电压。在某些实施方式中,阴极可包含叉形电极,在其 中一个叉定位在毛细管与流体导管的连接点的上游,并且一个叉定位 在其下游。在其他实施方式中,阴极同时包含叉形电极和第三电极, 该第三电极定位在流体导管与毛细管之间的连接附近。
[0248]
可以通过任何合适的方法来制备电泳样品(例如,扩增产物) 以供向分离通道(例如,毛细管)中注射。作为示例,可以通过在电 泳样品通道中在包含较高盐浓度或较高离子强度的电泳缓冲液的区 域之间定位包含较低盐浓度或较低离子强度的样品的稀释混合物来 进行场放大堆积(fas)。作为另一示例,如下文所述,可将材料(例 如,空气)团块定位在样品通道中的样品的下游,其中该材料具有与 电泳缓冲液或样品的电导率不同的电导率。当跨分离通道定位样品时, 能够在适当的时间长度(例如,约10秒至约20秒,或者约15秒) 中,以适当的电压(例如,约3kv至约5kv,或者约4kv)将样品 电动地注射到分离通道中。
[0249]
2.毛细管组装件
[0250]
系统100配置用于样品(或样品产物)分析,诸如借助于毛细 管板进行分析。图5中示出了系统100的毛细管板(或盘)。毛细管 板包括单个的毛细管和集成的毛细管以及变性加热器。毛细管盘包括 要在对至少一个样品的毛细管电泳中使用的单个的毛细管。在一些情 况下,毛细管板用于对多个样品,诸如1个、2个、3个、4个、5个、 6个、7个、8个、9个、10个或不止10个样品进行毛细管电泳。为 了收集任何可能例如从电泳系统的毛细管或阴极泄漏的液体,可在毛 细管板下放置具有足够的收集容量(例如,高达约50ml、75ml、 100ml、125ml或150ml)的贮漏盘。该贮漏盘可以可选地具有用 于检测任何泄漏的泄漏传感器。还可以在本文所述的仪器或系统的可 潜在地泄漏液体的其他组件下,例如在缓冲液盒或针对其的接口下、 在样品盒或针对其的接口下以及/或者在阳极盒或针对其的接口下放 置具有足够的收集容量(例如,高达约50ml、75ml、100ml、125 ml或150ml)的贮漏盘,其中贮漏盘可选地具有泄漏传感器。
[0251]
系统100包括用于调控每个电泳毛细管的温度的装置。毛细管 可保持在电绝缘线路板上,该线路板具有大体上弯曲的路径或基本上 笔直的路径用于放置毛细管。在一些实施方式中,将毛细管提供在一 个或多个曲线路径上,举例而言,诸如在大体上为s形的路径
上或多 个s形路径上。所述路径可分成多个区段。每个所述区段单独地调控 与该区段热连通的毛细管的一个部分中的温度。温度借助于电阻加热 而得到调控,但亦可使用其他温度控制元件(例如,加热元件和/或冷 却元件)或装置。可借助于温度感测装置,诸如每个区段中的热电偶、 热敏电阻或电阻温度检测器(rtd)来测量温度。每个不同的区段包 括穿过每个区段的毛细管的电路径。在一些情况下,该电路径来回穿 过(例如,在该区段中以蛇形来回穿过)。电路径包括一个或多个温 度控制元件(例如,加热元件和/或冷却元件)(例如,电阻加热器), 用于向毛细管提供热量。图5的插图中示出了电路径的一部分。
[0252]
在线路板上,诸如在图5中所示的线路板上,电泳毛细管例如 借助于粘合剂而附接至路径(例如,s形路径)。在图示的实施方式 中,提供了一束8个毛细管。在其他实施方式中,根据用于并行处理 分析物的特定电泳的需求,路径可包括任何数目的毛细管,范围从1 个至更多的数目。
[0253]
在一些情况下,毛细管的进口具有成扇形散开的末端,以促进 分析物向不同毛细管中的注射。根据是一起填充所有的毛细管还是将 会单独地填充每个毛细管,毛细管的一端可以扎成束或者毛细管可以 是独立的。
[0254]
热传感器与所述路径的每个单独热调控区域或区段相接触。温 度传感器的示例为热敏电阻或其他温变电阻,或者热电偶或其他温变 电压源。在一些情况下,单独热调控区段的温度数据不通过分立的温 度传感器来采集,而是通过电路径本身,诸如通过电路径的电阻来采 集。还可使用外部温度传感器。
[0255]
毛细管的每个区段的特点可以是包含一个或多个电阻加热元件 的加热器。加热器可分布在毛细管的整个路径上,以提供温度控制。
[0256]
参考图5,电泳分离通道(例如,毛细管)可电连接至阴极和 阳极。所述阴极和阳极可电连接至高电压模块。阴极为毛细管阵列的 一部分,并由电泳系统硬件固定就位。阳极为阳极盒接口模块的一部 分,并且连接至电泳系统硬件(图5)。高电压供应到阳极电极,而 阴极电极(例如,16个阴极电极,每一通道有两个)保持接地。电流 监控可在阴极与地面之间进行,并且可针对高电压板上的单个通道进 行监控。阴极电极为毛细管阵列的一部分,并且在阵列安装期间建立 通往高电压系统的连接。
[0257]
电泳可在适合于实现分析物(例如,扩增产物)的良好分离的 任何电压下以及在任何时间段中进行。在一些实施方式中,在约10 分钟至约30分钟、或约15分钟至约25分钟、或约20分钟的时段内, 以约6kv至约12kv、或约8kv至约10kv、或约9kv的电压来分 离扩增产物。还可以选择分离通道(例如,毛细管)的长度来实现分 析物的良好分离。在某些实施方式中,分离通道至检测窗口的长度为 约10cm至约40cm、或约15cm至约35cm、或约20cm至约30cm, 或者约25cm。
[0258]
电泳通道可以填充有来自阳极盒的分离基质(例如,分离聚合 物或凝胶)。可用于通过电泳分离核酸片段的分离聚合物和凝胶的示 例包括聚丙烯酰胺(例如,lpa系列(包括lpa
‑
1)的分离凝胶 (beckman coulter)、pop
tm
系列(包括pop
‑4tm
、pop
‑6tm
和pop
‑7tm
) 的分离聚合物(life technologies)和用自包被聚合物(例如,lpa v2e (integenx inc.))、琼脂糖、羟乙基纤维素和其他生物聚合物改性 的lpa。为了分离单链核酸片段,可以使用包含化学变性剂(例如尿 素、甲酰胺或n
‑
甲基吡咯烷酮)的分离聚合物或凝胶或者在使双链核 酸片段变性的温度(例如,约65℃、75℃、85℃或90℃或更高) 下进行变性凝胶电泳。在核酸
片段注射到分离通道中之前可以使用如 下所述的变性加热器,和/或在分离过程中使用如本文所述的热控制的 固相加热系统(例如,包含一条或多条与分离通道相邻(例如,在包 含毛细管电泳阵列的板下)的金属丝(例如铜丝)的加热系统),向 该核酸片段施加热。
[0259]
3.阳极组装件
[0260]
图6示出系统100的阳极组装件(例如,阳极盒接口模块)。 阳极盒接口模块包括阳极接口模块(顶部)和阳极盒(底部)。阳极 盒在一些情况下为一次性的、有限使用(例如,单次使用)的盒。阳 极盒可通过注射模塑聚合物材料或者通过其他方法来形成。在一个实 施方式中,阳极盒可包含两个腔室。一个腔室可含有分离基质,而另 一腔室可含有电泳缓冲液。在另一实施方式中,全部两个腔室均含有 分离基质。在又一实施方式中,阳极盒可包含单一腔室,该单一腔室 含有经缓冲的分离基质。包含电泳缓冲液的腔室可与阳极电连通。其 还可例如通过一个或多个流体通道而与毛细管并与包含分离基质的 腔室电连通。每个腔室可包含柱塞,该柱塞可操作地与压力源相连, 并且适于将分离基质和/或缓冲液移出腔室。每个柱塞可以是可独立操 作的。阳极盒可预先填充有分离基质和缓冲液。在一些实施方式中, 阳极盒具有板载存储器,诸如电可擦可编程只读存储器(eeprom), 该板载存储器可包含校准详情和/或装置配置。
[0261]
阳极盒配置用于插入到阳极接口模块的端口中。阳极接口模块 包括自动化接合机构,用于与阳极盒相接合。在一些情况下,阳极接 口模块中的集成高电压电极向阳极盒提供功率。阳极接口模块包含存 储器读取器,用于通信地耦合至阳极盒的板载存储器。在一些情况下, 存储器读取器为eeprom读取器,配置用于与阳极盒的eeprom通 信(以及从其读取)。
[0262]
4.填充组装件
[0263]
阳极盒包括(例如,预先装载有)在电泳中使用的分离基质(例 如,聚合物或凝胶)。在一些实施方式中,阳极盒还包含(例如,还 预先装载有)用于电泳的水性缓冲液,该水性缓冲液含有选自bicine、 tricine、tris、3
‑
氨基
‑1‑
丙磺酸、cabs、caps、capso、ches、epps 和taps的一种或多种缓冲剂。在一个实施方式中,阳极盒包含含有 tris和taps的水性缓冲液。在某些实施方式中,该水性缓冲液还含 有金属螯合剂,诸如本文所述的金属螯合剂。在一个实施方式中,金 属螯合剂包含edta。阳极盒还可包含可读和/或可写存储器装置(例 如,eeprom芯片),所述可读和/或可写存储器装置配置用于存储、 接收和/或传输与盒有关的信息(例如,盒的批号、盒的建议使用期限、 水性缓冲液的组成和剩余量、分离基质的组成和剩余量,以及阳极电 极的状态)。
[0264]
在一个实施方式中,在电泳期间,向阳极电极供应高电压,同 时将阴极电极(例如,每个通道有两个阴极电极)保持接地。在阴极 与地面之间进行电流监控,并且针对系统板上的单个通道进行监控。 分离基质可为分离聚合物或凝胶。分离聚合物可通过在连接至用于阳 极高电压供应和控制的电泳系统硬件的阳极处的接口而提供至分离 通道(例如,毛细管)(例如,见图5)。阳极盒附接至阳极接口模 块,并且为每次运行供应压力和试剂。所述系统是压力驱动的,并且 可通过由电子器件管理的螺线管来控制。压力可通过由系统100的电 子安全所监控的电子换能器来监控。当任何入口门在运行期间被打开 时,可通过被动卸压路径和主动卸压路径以及通过电流切断来提供安 全性。
[0265]
在分离通道中分离运行完成之后,同一分离基质(例如,聚合 物或凝胶)可在一个
或多个后续的分离运行中重复使用,或者可以抛 弃该分离基质并且可以用来自同一阳极盒的新的分离基质来重新填 充分离通道。可以用对于期望的分离运行数而言足够量的分离基质和 足够量的电泳缓冲液来填充阳极盒。
[0266]
5.定位组装件
[0267]
在一个实施方式中,本发明提供用于定位样品以供向毛细管中 注射的方法。根据一个实施方式,该方法包括:提供与含样品的容器 和毛细管流体连通的流体导管,其中毛细管与流体导管的流体路径相 交,并且其中毛细管与阳极和阴极电连通,并且其中阴极插入到流体 导管中;在流体导管中样品的下游定位具有与电泳缓冲液或样品的电 导率不同的电导率的材料(例如,该材料包含空气)团块;在毛细管 的方向上移动材料团块和样品,同时监控跨阳极和阴极的电流;检测 与团块向阴极与阳极之间的导管中的电路径中的移动相对应的不同 电流(例如,电流变化);基于检测,将样品移入阴极与阳极之间的 导管中的电路径。或者,还可使用光学传感器来检测和控制团块的位 置。该方法还可包括施加注射电压和/或运行电压,以将样品注射到毛 细管中以及在毛细管中运行样品。例如,团块可通过使用泵来将材料 团块泵入导管中而得到定位,所述泵诸如为含有样品的盒中的片上泵, 例如,隔膜泵;或者为不处在盒上的泵送机构,诸如蠕动泵、注射泵 等。相应地,在另一实施方式中,样品传送子系统被配置成:(a) 样品通道,具有通道入口和通道出口;(b)电泳毛细管,具有毛细 管入口和毛细管出口,其中该毛细管包含导电介质并且与样品通道在 连接点处连通;(c)阳极和阴极,配置用于跨毛细管入口与毛细管 出口施加电压,其中阳极或阴极中之一包含叉形电极,其中叉与样品 通道在连接点的不同侧电连通;以及(d)第二电极,其与样品通道 在基本上与连接点相对之处电连通。在装置的一个实施方式中,第二 电极构成为叉形电极中的第三叉。
[0268]
6.变性加热器
[0269]
在某些实施方式中,变性加热器被配置成与加热元件热接触的 套管(或多个套管)。该套管可在一端流体连接至稀释腔室(例如, 见图10的腔室1009),并在另一端流体连接至毛细管样品注射器。 包含套管和加热元件的组装件可配置用于将套管内部的流体加热到 使双链核酸如dna变性的温度。在某些实施方式中,套管可包含导 热材料,诸如金属管道。加热元件可包括电阻加热器或其他类型的加 热机构。例如,加热元件可包含连接至电压源的电阻材料。套管可在 电阻加热器的元件(诸如板)之间夹紧。变性加热器可配置用于将加 热器中的多个套管中的每个套管彼此电隔离以及使之与加热元件电 隔离。例如,套管可由耐电材料彼此分开并与加热元件分开。例如, 套管可嵌入在环氧树脂中。变性加热器还可包含绝缘体,该绝缘体配 置用于将靠近变性加热器的元件与由其所生成的热量相隔绝。图53 示出了本发明的变性加热器。其包括套管5301、加热元件5302,该 加热元件5302包含电阻加热器5303,该电阻加热器5303连接至通向 电压源的导线5304。
[0270]
b.检测组装件
[0271]
可以使用检测器来观测或监控电泳毛细管(或通道)中的材料。 该检测器可例如为基于电荷耦合器件(ccd)相机的系统,或者为基 于互补金属氧化物半导体(cmos)相机的系统。
[0272]
系统可包括多个(例如,4个、8个、10个、16个、24个、32 个、40个、48个或更多个)电泳分离通道(例如,毛细管)、光源 (例如,激光器或发光二级管)、光检测器以及光选择器。
激光器装 置被定位成用于从该激光器装置向至少一个电泳毛细管传送光束。光 检测器光学地耦合以接收来自至少一个电泳毛细管的光信号。激光器 装置、光检测器和光选择器处于允许光检测器选择性地检测来自多个 电泳毛细管中的任何一个或多个电泳毛细管的布置之中。
[0273]
激光器装置可部分地基于适合于辨别经分离的分析物(例如, 核酸片段)的输出波长来选择。核酸片段可使用一定数目的(例如, 2个、3个、4个、5个或更多个)可光谱分辨的荧光染料来标记(例 如,通过在扩增中使用由这些染料标记的引物),使得具有不同序列 但又具有相同大小和相同电泳迁移率的片段仍能凭借被具有可光谱 分辨的发射光谱的染料进行标记而得以彼此分辨。可以选择激光器装 置使其具有高效地激发用以标记核酸片段的荧光染料的一个或两个 输出波长。激光器装置可具有单输出波长(例如,约488nm)或双输 出波长(例如,约488nm和约514nm)。激光器装置能够以适当速 率(例如,约1hz至约5hz,或者约2或3hz)跨每个分离通道的 内部扫描。由激光器装置所激发的每种染料的荧光发射可穿过滤光器 和棱镜,并且可例如成像到ccd相机或cmos相机上。
[0274]
在一个实施方式中,毛细管布置成阵列。在一个实施方式中, 光选择器光学地定位在激光器装置与多个电泳毛细管之间。来自激光 器装置的光束传送至单一电泳毛细管,而不传送到其他电泳毛细管。 在一个实施方式中,光选择器为扫描物镜,其将来自激光器装置的光 束引向单一电泳毛细管,而不引向其他电泳毛细管。在一个实施方式 中,扫描物镜适于相对于进入该扫描物镜的来自激光器装置的光束做 横向运动。在另一实施方式中,光选择器为光阑,其将来自激光器装 置的光束传到单一电泳毛细管,而不传到其他电泳毛细管。一个实施 方式还包括毛细管对准检测器,该检测器光学地耦合以接收光束从单 一电泳毛细管的反射。所述反射指示出光束与单一电泳毛细管的对准。
[0275]
在一个实施方式中,光选择器光学地定位在多个电泳毛细管与 光检测器之间。从多个电泳毛细管到光检测器的光信号仅限于单一电 泳毛细管。
[0276]
各实施方式还包括光学耦合于激光器装置与光检测器之间的波 长依赖型光束组合器,或者光学耦合于激光器装置与光检测器之间的 空间光束组合器。
[0277]
c.分析组装件
[0278]
分析组装件可包含计算机,该计算机包含存储器和处理器,该 处理器用于执行计算机中的代码以便接收检测组装件的数据输出、处 理数据和产生报告所分析的分析物的度量值或特性(例如,结果)的 文件。
[0279]
在优选实施方式中,分析模块可包含存储器和执行代码的处理 器,该处理器执行分析以便按长度和按连接的染料的光谱特性来对 str片段进行分类,并继而使用该信息连同诸如等位基因标准物的分 离等辅助信息一起来确定在检测到的扩增产物中存在哪些str等位 基因;该过程通常称为str等位基因。在str分析的情况中,分析 组装件可接收原始电泳图数据,将其转换成例如可由等位基因判定软 件所识别的格式,以及使用该等位基因判定软件来识别等位基因,并 以可被用户理解的或者由数据库所识别的格式报告这些等位基因。例 如,分析组装件可收取电泳图并产生例如由fbi的国家dna索引系 统(ndis)所识别的codis文件。
[0280]
由经扩增的str片段的分离所生成的电泳图可按以下方式分析。 系统的检测模式(例如,光学检测)将会产生数据流,该数据流为来 自连接至str片段的荧光染料的信号以
及许多光学和电子背景效应 的综合。该数据流可被处理成由可被str判定软件(例如,专家系 统)所利用的形式。
[0281]
由大多数商用str
‑
判定专家系统所预期的输入数据通常含有 维数为n x m的数字阵列,其中n为由系统检测到的染料的数目, 而m为在分离中所取的点的时序。一些专家系统对n和m有上限, 而这可能会因产品而异。存在商用专家系统关于这些数据流所作出的 若干辅助假设:(1)来自检测模式的大部分电子噪声和光学噪声已被移除。(2)n个通道中的每个通道名义上参考被定义为“零”的同一暗信 号。(3)已对每个片段进行足够的测量,以确保针对str套组中最 小大小报告模式的足够的碱基对分辨率。名义上,这意味着足以在片 段迁移穿过检测器所花费的时间内获得5
‑
10个测量的采样频率。(4)n个维度中的每个单独的通道代表对于该检测模式而言尽可 能地来自单一染料的光子信号。就该条件未得到满足的程度而言,其 被称为“渗滤”。
[0282]
str判定软件可提供的功能性包括:(1)相对于泳道内大小标准进行的片段大小确定。(2)使用(潜在地可选的)等位基因标准物进行的等位基因位 元(bin)校准。(3)利用形态斥拒过滤器进行的等位基因判定(对于普通pcr 效果,诸如打滑(stutter))。(4)基于诸如信噪比等数学度量进行的质量旗标分配。(5)作为文本的判定总结输出生成。
[0283]
从业者可适当地调谐str判定软件的性能以使假阳性测量组最 小化。针对于此的流程是本领域已知的,并且对于市售软件而言可被 包含在产品文档中。
[0284]
如上文所述,专家系统将会提供鉴别见于数据流中的片段的碱 基对大小以及如果存在初步等位基因分配则将其附属至每个片段的 服务。此外,可向报告给分析者的等位基因判定分配质量旗标。从业 者继而可基于来自旗标的信息来判定str谱实际上是什么。该过程 可通过付诸实施规则引擎来将判定和质量旗标处理成最终谱而得到 进一步的自动化。该规则引擎可在系统的数据上进行训练,以基于来 自系统的质量旗标的具体内容而知晓何时保留以及何时拒绝某一等 位基因。
[0285]
图50中示出了整个过程:图中左侧的前5个框示出如何以反映 出上述输入假设1
‑
4的方式来一般性地处理数据。这些步骤中的一些 步骤根据分离的质量和所使用的检测器的类型而可以是可选的。这些 步骤以生成标准格式(通常为*.fsa)的电泳图而告终。这些电泳图被 馈送至str判定包,该str判定包使用实现器提供的参数调谐来处 理电泳图。最后,通过规则引擎来过滤这些判定,以创建最终的、可 靠的str谱。
[0286]
用于进行str和血缘关系分析的软件可例如商购自hid str human identity software和genemarker kinshipanalysis software(softgenetics,state college,pa,usa)); dna
‑
view
tm
v29.11(charles brenner);lisa(future technologiesinc.,fairfax,va,usa);kincalcv3.1(california department ofjustice);genemapper(life technologies,carlsbad,ca))。
[0287]
在此描述更多种用于转换电泳图的方法:
[0288]
1.分段基线化(segmentation base
‑
lining)
[0289]
在一些具体实施方式中,如本文所述的系统可以包括用于改进 电泳数据的基线化的可拆分逻辑模块或方法,或者与之协同工作。信 号处理中的“基线”或“零水平”通常是指某一水平,低于该水平时,信 号和信号变化被认为是由于噪声引起的或者没有意义。信号处理中的 基线化通常描述用于针对整个信号或针对特定样品或信号位置来确 定哪个信号水平是由于噪声引起的并且从信号中去除或减去该水平 的方法。当信号快速变化和/或在基线噪声可能改变的一段时间内收集 时,正确确定毛细管电泳信号和类似信号的基线水平具有挑战性。在 具有可变信号噪声的快速变化的信号中,可能非常难以准确地确定基 线校正。
[0290]
在一个实施方式中,新的分段基线化逻辑模块或方法首先确定 收集的数据中确定不存在目标信号的区段或周期(有时被称为“平”段) 以及包含目标信号的高变区域(有时被称为“信号区段”或“可变区段”)。 通常,平区域和信号区域交替,使得每个信号区域被两个平区域所限 制。可以针对每个平区域确定基线校正曲线。在一个优选的实施方式 中,这种确定针对每个区域分别进行,并且通常是多项式拟合曲线, 该曲线可以是线性的,或者有些是更高阶的。然后利用两个不同平 区域的基线校正的终点来确定针对信号区域的基线校正。针对信号区 域的基线校正也是多项式的,并且可以是线性的或齿形的,并且通常 拟合,以便延续到任一侧的平区域,至少到达第一导数或前向差分, 并且任选地也到达第二导数或前向差分。
[0291]
通过鉴定平区域和变化区域,各种曲线拟合技术用于不同的区 域以构建代表基线校正的逐段连续总体曲线。然后从数据流(例如, 来自于诸如本文所述的色谱图痕迹或位元色谱图痕迹的检测器的数 据)中有效地减去该曲线,以提供“基线化的”或“归零的”数据集。已 经发现在一些实施方式或情况中,以及在如本文所述的一些系统中, 分段基线化方法提供更精确的结果。
[0292]
2.动态光谱校正
[0293]
在一些特定实施方式中,本文所描述的系统可包括用于动态光 谱校正的可拆分逻辑模块或方法或者与之协同工作。毛细管电泳系统 通常使用荧光标记的引物来帮助辨别特定dna片段与哪个基因座相 关。由于一些来自不同基因座的等位基因可能在其bp长度方面重叠, 因此使用每种染料的不同光谱曲线或颜色来辨别所检测的特定等位 基因与哪些基因座相关。然而,标记染料具有略宽而重叠的光谱响应。 因此,在多光谱通道检测器中的单一染料导致多光谱通道中的信号。 染料的特征频率响应是被称为染料的光谱曲线的次数。因此,在特定 时间段于多通道中的检测可涉及来自不同染料的信号的复杂混合物。 许多电泳系统采用在其中创建出矩阵的一些类型的光谱校准。该矩阵 用于确定对来自多通道数据的特定染料的检测。因此,在许多系统中, 使用荧光“矩阵”标准来自动计算光谱曲线的重叠并将其减去。
[0294]
然而,检测到的不同染料的光谱曲线在不同的电泳运行中可能 不同。在优选实施方式中,动态光谱校正模块检查收集到的数据并确 定所检测到的光谱能量仅来自一种染料的时段。使用机器学习和/或聚 类算法(例如,主成分分析)来识别纯多光谱峰。继而可以使用来自 这些峰的三个最高强度值来确定纠正相移,据此能够在软件中重新采 样一个或多个染料的光谱曲线和依据每一色谱图或每一痕迹来重新 计算光谱校正矩阵。
[0295]
3.差分迁移率校正
[0296]
如上所述,毛细管电泳数据一般在相对较长的时段(例如,10
‑
45 分钟)内收集。这在确定毛细管电泳数据针对特定系统和运行条件的 各种校准方面产生了许多问题。一种这样的校准一般针对用来判定样 品中的特定受检等位基因的参比等位基因(或等位基因)标准物来进 行。以一种形式,等位基因标准物是一组参比的序列长度,它们在特 定碱基对(bp)长度处产生参比信号峰,该参比信号峰与样品峰进行 比较,以便鉴定(或判定)样品中的特定峰的等位基因。
[0297]
当等位基因标准物混合物被置于电泳毛细管中用于(通常沿样 品毛细管)读取时,标准物和样品两者也可以包括一组已知长度的 dna片段,被称为“大小标准”和“内部大小标准”或“大小阶梯”。在运 行等位基因标准物电泳后,通常情况是,由大小标准峰所标示的产生 的峰并非处于由预期等位基因值所指示的位置(或在位元内)。这可 导致等位基因判定中的假阳性和假阴性。许多系统采用自动化方法来 提供对等位基因标准物的一定的调节,以便对应于预期的等位基因值。 当迁移特征缓慢变化时,这些方法能够工作。然而,存在迁移的强烈 非线性(通常发生在约10
‑
45分钟的一段时间内)导致标准物峰位置 相对于大小峰显著位移的情况。
[0298]
如上所述的差分迁移率校正模块采用三相调节,其中计算代表 适合预期位元的等位基因标准物组的质量的度量值。(1)首先针对 作为一个整体的等位基因标准物组计算该度量值,(2)然后依次针 对等位基因标准物组中的每个基因座计算该度量值,并且(3)然后 单独地针对等位基因标准物的每个等位基因位元计算该度量值。在基 因座校准过程中,使用特别优化的度量研究,该研究包括间距的单调 伸缩来阻止基因座与峰对准中的相移。
[0299]
iv.控制模块
[0300]
a.计算机
[0301]
本文所提供的系统包括各种硬件和软件。在一些实施方式中, 用于样品制备、处理和分析的系统——诸如图1的系统100(或本文 所提供的任何其他系统)——包括控制器,该控制器具有中央处理器、 存储器(随机存取存储器和/或只读存储器)、通信接口、数据存储单 元和显示器。通信接口包括网络接口,用于使系统能够与包括其他系 统和子系统在内的内联网以及包含万维网在内的因特网进行交互。数 据存储单元包括用于数据传输和存储的一个或多个硬盘和/或高速缓 存。数据存储单元可包括一个或多个数据库,诸如关系型数据库。在 一些情况下,该系统还包括用于存储诸如用户信息(例如,简档)和 结果等信息的数据仓库。在一些情况下,数据仓库驻留在远离所述系 统的计算机系统上。在一些实施方式中,该系统可包括关系型数据库 以及一个或多个服务器,举例而言,诸如数据服务器。系统100可包 括一个或多个通信端口(com port)、一个或多个输入/输出(i/o) 模块,诸如i/o接口。处理器可为一个中央处理器(cpu)或者用于 并行处理的多个cpu。
[0302]
系统100可配置用于数据挖掘以及提取、转换和加载(etl) 操作,这可允许系统将来自原始数据源(或挖掘的数据)的信息加载 到数据仓库之中。数据仓库可配置用于与商务智能系统(例如, business)一起使用。其还可配置用于与法 医数据库一起使用,所述法医数据库诸如为美国的国家dna索引系 统(ndis)或英国的ndad、州级dna索引系统(sdis)、或地方 dna索引系统(ldis),或者含有来自已知或未知
受试者、法医样 品或诸如生物体标识等其他样品类型的谱的其他数据库。
[0303]
本文所提供的系统和方法的各个方面可通过编程来体现。技术 的各个方面可被认为是“产品”或“制品”,其形式通常为携载或体现在 某种类型的机器可读介质中的可执行代码和/或关联的数据。“存储
”ꢀ
型介质可包括计算机、处理器等或其关联模块的任何或所有的有形存 储器,诸如可在任何时间为软件编程提供非暂时性存储的各种半导体 存储器、磁带驱动器、磁盘驱动器等。软件的全部或部分可不时通过 因特网或各种其他电信网络通信。这样的通信可例如实现软件从一个 计算机或处理器向另一计算机或处理器中的加载,举例而言,从管理 服务器或主计算机向应用服务器的计算机平台中的加载。因此,可承 载软件元素的另一类介质包括光波、电波和电磁波,诸如跨本地设备 之间的物理接口、通过有线网络和陆线光网络以及通过各种空中链路 使用的光波、电波和电磁波。携载此类波的物理元素——诸如有线链 路或无线链路、光链路等——亦可被认为是承载软件的介质。如本文 中所使用,除非限于非暂时性、有形“存储”介质,否则诸如计算机或 机器“可读介质”等术语意指参与向处理器提供用于执行的指令的任 何介质。
[0304]
因此,机器可读介质——诸如计算机可执行代码——可采取许 多形式,包括但不限于:有形存储介质、载波介质或物理传输介质。 非易失性存储介质例如包括光盘或磁盘,诸如任何一个或多个计算机 中的任何存储装置,诸如附图中所示的可用于实现数据库等的介质。 易失性存储介质包括动态存储器,诸如这样的计算机平台的主存储器。 有形传输介质包括:同轴电线缆;铜线或光纤,包括构成计算机系统 内的总线的导线。载波传输介质可采取电信号或电磁信号或者声波或 光波的形式,诸如在射频(rf)和红外(ir)数据通信期间生成的那 些信号。计算机可读介质的常见形式因此例如包括:软盘、柔性盘、 硬盘、磁带、任何其他磁介质、cd
‑
rom、dvd或dvd
‑
rom、任 何其他光介质、打孔卡片纸带、任何其他具有打孔图案的物理存储介 质、ram、rom、prom和eprom、flash
‑
eprom、任何其他存 储器芯片或盒式存储器、传送数据或指令的载波、传送此类载波的线 缆或链路,或者可由计算机从中读取编程代码和/或数据的任何其他介 质。这些形式的计算机可读介质中的许多介质可涉及将一个或多个序 列的一个或多个指令携载至处理器以供执行。
[0305]
在一些实施方式中,系统100配置用于与一个或多个远程装置 通信,诸如与远程电子装置(见图19)通信。通过使用通信接口来帮 助这样的远程连接。在一些情况下,系统100通过用户的电子装置上 的用户界面的方式(见下文)向用户呈现信息(或者从用户请求行动 信息)。用户界面可为图形用户界面(gui)。在一些情况下,gui 在用户的电子装置上,诸如便携式电子装置(例如,移动电话、智能 电话)上操作。电子装置可包括用于执行该电子装置的软件和图形用 户界面的操作系统。
[0306]
在一些实施方式中,系统100通过操作于该系统或用户的电子 装置上的图形用户界面(gui)的方式向用户提供提醒、更新、通知、 警告和/或其他通信。gui可允许用户访问系统以例如创建或更新谱、 查看状态更新、设置系统100以供样品制备和处理,或者查看样品制 备、处理和/或分析的结果。系统可配置成仅当用户提供诸如密钥卡和 /或密码等许可标记时才进行操作。系统可记录和提供有关样品保管链、 污染或篡改的信息。用以记录和提供此类信息的系统可包括:有关对 系统进行操作的访问权的控件(例如,操作员许可要求);样品控件 (例如,用以指示样品从盒的引入或移除的传感器)(例如,见图38a 和图38b);围闭控件(例如,指示开门和关门的传感器)以及盒控 件(例如,用于指示盒的插入、
正确就位和移除的传感器)。
[0307]
在一些实施方式中,系统包括一个或多个用于样品处理和/或分 析的模块,以及用于帮助样品处理和/或分析的控制器。该控制器可包 括一个或多个处理器,诸如一个中央处理器(cpu)、多个cpu或 多核cpu,以执行用于实现样品处理和/或分析的机器可读代码。该 系统在一些情况下循序地将样品从一个模块导引至另一模块,诸如从 样品制备模块导引至电泳模块。
[0308]
b.用户界面
[0309]
在本发明的另一方面,提供用户界面用于使得用户能够与本文 所提供的系统进行交互。在一些实施方式中,用户界面为图形用户界 面(gui),其包括各种图形对象(例如,图标等),并且在一些情 况下包括听觉元素,用于允许用户与样品制备、处理和分析系统(“系 统”)(诸如图1的系统100)进行交互。gui可配置用于识别通过触 摸或划过触摸屏或者通过使用
‘
鼠标’或其他标准输入设备而做出的手 势或者其他视觉或听觉用户命令,以实现预定任务。在一些情况下, 特定手势关联于特定任务。gui配置成在系统的显示器或远程电子装 置(见图19及相关文字)上显示。在一个示例中,gui配置成在图1 的系统100的显示器101上显示。
[0310]
在一些实施方式中,提供包括各种用于使得用户能够执行具有 gui的系统的各种命令的视觉元素的图形用户界面。图20示出了根 据本发明的实施方式的的gui 2000,其具有“运行(run)”、“冲洗 (flush)”、“校准(calibrate)”和“移除(remove)”按钮2001用于 实现各种命令。“运行”按钮开始样品制备和处理。“冲洗”按钮用缓冲 液或其他溶液来冲洗毛细管。“校准”按钮用于校准系统和验证由系统 生成的数据。“移除”按钮启动用于移除毛细管的过程。
[0311]
这个背景下的术语“按钮”意指二维或伪三维图形元素,其可类 似于按钮,但可借助于用户触摸或诸如鼠标等电子指点设备而被激活 (或按下)。gui 2000包括状态指示器,用于提供系统的状态。在图 示的示例中,系统(例如,图1的系统100)已准备好进行样品制备、 处理和分析(“就绪”)。gui 2000还包括按钮2003,用于提供关于 系统的帮助和信息(右侧按钮),提供菜单和运行状态信息(中间按 钮),以及使得用户能够访问系统设置(左侧按钮)。电源按钮2004 使得用户能够开关系统。
[0312]
在一些情况下,系统配置成在预定的非活动时段之后进入“关闭
”ꢀ
状态。用户可继而通过按下按钮2004来“开启”系统。在一些情况下, gui 2000可要求用户输入密码或提供其他识别信息作为安全措施的 一部分,以帮助防止未经授权使用系统。
[0313]
gui 2000配置用于以预定时间间隔或者实时地呈现系统更新 和其他状态信息。参考图21,状态菜单已响应于系统状态的变化而从
ꢀ“
就绪”改变成“无法连接”。gui 2000为用户呈现“测试”按钮以运行各 种诊断测试来确定系统是否存在任何问题。
[0314]
gui 2000配置用于引导用户经过样品制备、处理和分析的各个 阶段,以及用于在需要时请求用户输入。gui向用户通信各种指令或 系统要求,诸如输入盒。gui 2000为用户呈现进度指示器(即,相对 于达到完成所需的步骤数目的当前进度),其可位于gui的底部面板 或处于其他位置。
[0315]
参考图22,gui 2000要求用户将聚合物盒输入到系统的阳极接 口模块中(见图6)。进度指示器示出用户处于第一步骤(“步骤: (1
‑
10)”)。系统等待用户输入,或者使得用
户能够通过按下“中止”按 钮来中止。如图23中所示,gui继而指示出聚合物盒准备好可供使 用。参考图24,gui指示出系统已请求用户输入缓冲液盒(见图7)。 如图25中所示,当用户插入缓冲液盒时,系统指示出缓冲液盒就绪。 在图26中,gui指令用户输入对照盒。当成功插入对照盒时(图27), gui如图28中所示指令用户输入样品盒。gui继而如图29中所示指 示出样品盒准备好可供使用。
[0316]
参考图30,在系统设置期间的任何时点,用户均可通过按下“中 止”按钮来中止设置过程。所述用户或另一用户可继而在样品制备、 处理和分析之前开始新的过程。在一些情况下,系统在前一用户中止 设置过程之处开始设置过程。例如,如果前一用户在输入缓冲液盒之 后中止了设置过程而新用户期望使用系统,则系统可以不要求新用户 输入缓冲液盒。然而在一些情况下,当某种处理需要特定类型的缓冲 液时,系统可识别出(例如,借助于板载eeprom)当前在系统中的 缓冲液盒不适合使用,并请求用户输入所需的缓冲液盒。
[0317]
gui 2000可实现于系统的显示器(例如,图1的系统100的显 示器101)上,或者远程系统(例如,图19的便携式电子装置1902 和电子装置1905)的显示器上。在一些情况下,远程访问可使得用户 能够远程地与系统交互以及设置和运行样品处理。样品处理和/或分析 的结果,诸如样品的或相关于样品的遗传信息等,可以远程获得。
[0318]
c.集成及自动化系统中的定时控制
[0319]
在一些实施方式中,本文所描述的仪器或系统在不超过2小时 内——例如,在不超过约90分钟内执行样品到结果处理和分析(例 如,“开始过程”到结果显示)。所执行的功能包括:dna分离;dna 扩增;扩增子分离与数据收集;以及系统收工(例如,从耗材盒断开 仪器、管线清洗)与数据分析。在历时不超过约2小时内执行样品到 结果处理的系统中,可在约20%的时间中执行dna分离;可在约33% 的时间中执行dna扩增;可在约33%的时间中执行扩增子分离与数 据收集;并且可在约10%的时间中执行系统收工与数据分析。例如, 在90分钟运行中用于这些功能之中的每个功能的时间如下:dna分 离:~20分钟;dna扩增:~30分钟;扩增子分离与数据收集:~30 分钟;系统收工与数据分析:~10分钟。
[0320]
在一些实施方式中,本文所描述的仪器或系统在不超过约4小 时(hr)、3.5hr、3hr、2.5hr、2hr、1.5hr、1hr或0.5hr内执行样 品到结果处理和分析。在其他实施方式中,所述仪器或系统在约0.5hr 至约3hr、或约0.5hr至约2hr、或约0.5hr至约1.5hr、或约0.5hr 至约1hr、或约1hr至约2hr、或约1hr至约1.5hr、或约1.5hr至 约2hr中执行样品到结果处理和分析。在一些实施方式中,样品到结 果处理和分析时间包括从开始样品处理(例如,按下仪器或系统的开 始或运行按钮,或者启动样品到结果流程)到在所述仪器或系统的计 算机系统或计算机可读介质中或者在其屏幕上生成核酸谱(例如, dna谱,诸如法医数据库(例如,codis)中所使用的一个或多个 或者所有的str基因座以及可选地在人类身份识别或性别确定中有 用的其他基因座(例如,penta d、penta e和牙釉蛋白)的谱)的时 间。在其他实施方式中,样品到结果处理和分析时间包括从按下仪器 或系统的开始或运行按钮或者启动样品到结果流程到将核酸谱发布 在内部数据库或外部数据库上的时间。
[0321]
在一些实施方式中,样品到结果处理和分析包括核酸(例如, dna和/或rna)提取、核酸扩增(例如,通过pcr)、核酸分离(例 如,通过毛细管电泳)和关于经分离的分析物的数据的收集,以及对 收集到的数据的分析。在一些实施方式中,核酸提取包括裂解含核酸 的
细胞、将核酸结合到捕获颗粒(例如,磁性颗粒或顺磁性颗粒(例 如,微珠)),以及洗涤结合核酸的颗粒。在某些实施方式中,本文 所描述的仪器或系统在不超过约2hr、1.5hr、1hr、45分钟(min)、 30min、20min、15min、10min或5min内执行核酸提取。在其他 实施方式中,所述仪器或系统在约0.5hr至约2hr、或约0.5hr至约 1.5hr、或约0.5hr至约1hr、或约1hr至约2hr、或约1hr至约1.5hr、 或约5min至约30min、或约10至约20min、或约10min至约15min 内执行核酸提取。在某些实施方式中,核酸提取在按下仪器或系统的 开始或运行按钮时开始,或者在启动样品到结果流程时开始。核酸提 取的持续时间可例如取决于含核酸的介质的性质。例如,从包含于纤 维素介质(例如,纸)中的细胞提取核酸可能比从包含于拭子 中的细胞提取核酸花费更长的时间。
[0322]
在某些实施方式中,仪器或系统在不超过约2hr、1.5hr、1hr、 45min、40min、30min、20min、15min、10min或5min内执行核 酸(例如,法医数据库(例如,codis)中所使用的一个或多个或者 所有的str基因座以及可选地在人类身份识别或性别确定中有用的 其他基因座(例如,penta d、penta e和牙釉蛋白)处或者可选地与 之相邻之处的核酸)的扩增(例如,通过pcr)。进一步地,仪器或 系统在约5或10min至约2hr、或约20min至约1hr、或约20min 至约40min、或约20min至约30min、或约30min至约40min内执 行核酸(例如,法医数据库(例如,codis)中所使用的一个或多个 或者所有的str基因座以及可选地在人类身份识别或性别确定中有 用的其他基因座(例如,penta d、penta e和牙釉蛋白)处或者可选 地与之相邻之处的核酸)的扩增(例如,通过pcr)。核酸扩增的持 续时间可例如取决于所扩增的基因座的数目、升温速率、在特定温度 下的保持时间,或者扩增循环的数目。
[0323]
在一些实施方式中,核酸分离包括对核酸片段(例如,由在一 个或多个或者所有的codis str基因座以及可选地在其他基因座处 的pcr扩增所产生的核酸片段)的分离(例如,通过毛细管电泳) 以及数据收集(例如,由ccd相机来收集激光诱导的荧光)。在某 些实施方式中,仪器或系统在不超过约1hr、45min、40min、30min、 20min、15min、10min或5min内执行核酸分离。在其他实施方式 中,仪器或系统在约5或10min至约1hr、或约15min至约45min、 或约20min至约40min、或约20min至约30min、或约30min至约 40min内执行核酸分离。核酸分离的持续时间可例如取决于所使用的 凝胶、电泳毛细管的长度、电压上升速率,或者核酸片段的大小。
[0324]
在一些实施方式中,系统在4小时或更少、或3.5小时或更少、 或2.5小时或更少、或2小时或更少、或1.5小时或更少、或1小时 或更少、或45分钟或更少、或30分钟或更少、或15分钟或更少、 或10分钟或更少、或5分钟或更少的一段时间内处理生物样品。在 其他实施方式中,系统在4小时或更少、或3.5小时或更少、或2.5 小时或更少、或2小时或更少、或1.5小时或更少、或1小时或更少、 或45分钟或更少、或30分钟或更少、或15分钟或更少、或10分钟 或更少、或5分钟或更少的一段时间内处理和分析生物样品。
[0325]
在一些实施方式中,分析包括分析收集到的数据,以及在所述 仪器或系统的计算机系统或计算机可读介质中或者在其屏幕上生成 核酸谱(例如,dna谱,诸如法医数据库(例如,codis)中所使 用的一个或多个或者所有的str基因座以及可选地在人类身份识别 或性别确定中有用的其他基因座(例如,penta d、penta e和牙釉蛋 白)的谱)。在其他实施方式中,分析还包括将核酸谱发布到内部数 据库或外部数据库上。在某些实施方式中,仪器或系统在不超过约15 min、10min、5min、3min、2min、1min、30sec或10sec内执行分 析。在
其他实施方式中,仪器或系统在约2min至约10min、或约2min 至约5min、或约2min至约4min、或约3min至约4min、或约10sec 至约2min、或约30sec至约2min、或约30sec至约1min内执行分 析。
[0326]
在附加实施方式中,样品到结果处理和分析还包括将结合核酸 的微珠从微珠悬浮/捕获腔室转移至反应腔室,向反应腔室传送预混物, 将扩增反应产物转移至稀释剂腔室,以及将经稀释的扩增产物传送到 分离(例如,毛细管电泳)系统。预混物试剂可为液体或冻干形式, 并可例如含有引物、聚合酶、缓冲液和适用于扩增的任何其他试剂(例 如,盐,诸如氯化镁)。在某些实施方式中,仪器或系统在不超过约 10min、5min、4min、3min、2min、1min或30sec内,或者在约 30sec或1min至约5min、或约2min至约4min、或约2min至约3 min、或约1min至约2min内将结合核酸的微珠从微珠悬浮/捕获腔 室转移到反应腔室。在其他实施方式中,仪器或系统在不超过约10 min、8min、6min、5min、4min、3min、2min或1min内,或者 在约5min至约10min、或约5min至约8min、或约6min至约8min、 或约0.5min至约5min、或约1min至约5min、或约2min至约5min、 或约0.5min至约3min、或约1min至约3min、或约1min至约2min 内将预混物试剂传送至反应腔室。向反应腔室传送冻干预混物试剂可 能例如由于需要再水合所述冻干试剂而比传送液体形式的预混物试 剂花费更长的时间。
[0327]
在某些实施方式中,仪器或系统在不超过约3min、2min、1min、 30sec或10sec内,或者在约10或30sec至约3min、或约1min至 约3min、或约1min至约2min内将扩增反应产物转移至稀释剂腔室。 在一些实施方式中,经稀释的扩增产物向分离(例如,毛细管电泳) 系统的传送包括将经稀释的扩增产物转移至注射器,以及将经稀释的 扩增产物注射到毛细管中。在某些实施方式中,仪器或系统在不超过 约8min、6min、5min、4min、3min、2min、1min或30sec内, 或者在约30sec或1min至约6min、或约2min至约5min、或约2min 至约4min、或约1min至约3min内将经稀释的扩增产物传送至分离 系统。
[0328]
在样品(例如,带有含核酸的细胞的拭子)的处理的一些实施 方式中,本文所描述的仪器或系统向样品腔室传送裂解试剂,并在不 超过约15min、10min、8min、6min、5min、4min或3min内,或 者在约2min至约10min、或约5min至约10min、或约4min至约 8min、或约2min至约5min内执行含核酸的细胞的裂解。在某些实 施方式中,仪器或系统在不超过约5min、4min、3min、2min或1min 内,或者在约0.5min至约5min、或约0.5min至约3min、或约1min 至约3min、或约1min至约2min内将由此产生的裂解物从样品腔室 转移到微珠悬浮/捕获腔室。在其他实施方式中,仪器或系统在不超过 约10min、8min、6min、5min、4min、3min或2min内,或者在 约1min至约10min、或约2min至约8min、或约4min至约8min、 或约4min至约6min内执行核酸(例如,dna和/或rna)到微珠 悬浮/捕获腔室中的磁性颗粒或顺磁性颗粒(例如,微珠)的结合(或 捕获)。在一些实施方式中,第一洗涤腔室向微珠悬浮/捕获腔室传送 促进核酸到微珠的结合的试剂或溶液(例如,95%
‑
100%乙醇、90% 乙醇水溶液或70%乙醇水溶液),并且第二洗涤腔室向微珠腔室传送 移除杂质(例如,盐)并于同时促进核酸到微珠的固位的试剂或溶液 (例如,70%乙醇水溶液)。在某些实施方式中,仪器或系统在不超 过约3min、2min、1min或0.5min内,或者在约0.5min至约2min、 或约1min至约2min、或约0.5min至约1.5min、或约0.5min至约 1min内执行使用来自第二洗涤腔室的试剂或溶液对结合核酸的微珠 的洗涤。在其他实施方式中,在微珠由磁化作用保持在微珠悬浮/捕获 腔室中的同时,仪器或系统在微珠捕获完成之后并在添加来自第二洗 涤腔室的
试剂或溶液之前,以及/或者在添加来自第二洗涤腔室的试剂 或溶液之后,在不超过约2min、1min或0.5min内,或者在约15 秒(sec)至约2min、或约0.5min至约1.5min、或约0.5min至约1 min内将液体从微珠腔室转移到废液腔室。
[0329]
在附加的实施方式中,仪器或系统在不超过约5min、4min、3 min、2min或1min内,或者在约0.5min至约5min、或约1min至 约4min、或约2min至约3min内将结合核酸的微珠从微珠悬浮/捕 获腔室转移到反应腔室。在某些实施方式中,仪器或系统在不超过约 5min、4min、3min、2min或1min内,或者在约0.5min至约5min、 或约0.5min至约3min、或约0.5min至约2min、或约0.5min至约 1min内将预混物试剂(例如,液体形式)传送至反应腔室。在其他 实施方式中,仪器或系统在不超过约1hr、50min、40min、30min、 20min或10min内,或者在约10min至约1hr、或约20min至约40 min、或约30min至约40min、或约20min至约30min内执行核酸 (例如,在法医数据库(例如,codis)中所使用的一个或多个或者 所有的str基因座处以及可选地在人类身份识别或性别确定中有用 的其他基因座(例如,penta d、penta e和牙釉蛋白)处或者可选地 与之相邻之处的核酸)的pcr扩增。在某些实施方式中,仪器或系 统在不超过约3min、2min或1min内,或者在约0.5min至约3min、 或约1min至约2min、或约0.5min至约1min内将扩增反应产物从 反应腔室转移至稀释剂腔室。在一些实施方式中,稀释剂腔室含有大 小标准和合适的溶剂(例如,水)。在其他实施方式中,仪器或系统 在不超过约5min、4min、3min、2min或1min内,或者在约0.5min 至约5min、或约1min至约4min、或约0.5min至约3min、或约1 min至约2min内将经稀释的扩增产物从稀释剂腔室转移至注射器。 在某些实施方式中,注射器在不超过约2min、1min、30sec或15sec 内,或者在约10sec至约2min、或约10sec至约1.5min、或约0.5min 至约1min内将扩增产物注射到电泳系统的分离通道(例如,毛细管) 中。
[0330]
在一些实施方式中,仪器或系统在不超过约1hr、40min、30min、 20min或10min内,或者在15min至约45min、或约10min至约 40min、或约20min至约40min、或约15min至约30min、或约20 min至约30min内执行通过电泳(例如,毛细管电泳)——可选地在 高温下(例如,在约60℃下)——进行的核酸分离以及数据收集。 在其他实施方式中,仪器或系统在不超过约10min、6min、5min、4 min、3min、2min、1min或30sec内,或者在约30sec或1min至 约10min、或约2min至约6min、或约2min至约4min内分析收集 到的数据,以及在所述仪器或系统的计算机系统或计算机可读介质中 或者在其屏幕上生成核酸谱(例如,dna谱,诸如法医数据库(例 如,codis)中所使用的一个或多个或者所有的str基因座以及可选 地在人类身份识别或性别确定中有用的其他基因座(例如,penta d、 penta e和牙釉蛋白)的谱)。图51a示出可从收集到的数据生成的 典型电泳图。图51b示出从收集到的数据生成的核酸谱的典型曲线图。
[0331]
在某些实施方式中,从开始(例如,样品到结果流程的启动) 到产生纯化dna(例如,完成dna在裂解后到微珠和微珠洗剂的捕 获)的时间花费不超过约65分钟(如果样品储存在纸(例如,纸)上,则从储存在纸上的细胞提取dna可能比从储存在拭子上的 细胞提取dna花费更长时间),从产生纯化dna到开始电泳(例如, 毛细管注射)的时间花费不超过约80分钟,从开始电泳到完成数据 收集的时间花费不超过约80分钟,并且从完成数据收集到生成数据 文件(例如,含有dna谱的文件)的时间花费不超过约15分钟,总 用时不超过约240分钟。
[0332]
在其他实施方式中,从开始(例如,样品到结果流程的启动) 到产生纯化dna(例如,完成dna在裂解后到微珠和微珠洗剂的捕 获)的时间花费不超过约30分钟,从产生纯化dna到开始电泳(例 如,毛细管注射)的时间花费不超过约45分钟,从开始电泳到完成 数据收集的时间花费不超过约40分钟,并且从完成数据收集到生成 数据文件(例如,含有dna谱的文件)的时间花费不超过约5分钟, 总用时不超过约120分钟。
[0333]
在附加实施方式中,从开始(例如,样品到结果流程的启动) 到产生纯化dna(例如,完成dna在裂解后到微珠和微珠洗剂的捕 获)的时间花费不超过约20分钟,从产生纯化dna到开始电泳(例 如,毛细管注射)的时间花费不超过约35分钟,从开始电泳到完成 数据收集的时间花费不超过约30分钟,并且从完成数据收集到生成 数据文件(例如,含有dna谱的文件)的时间花费不超过约5分钟, 总用时不超过约90分钟。
[0334]
在一些实施方式中,系统以小于约20%、15%、10%、5%、1%、 0.5%、0.1%或更小的变异系数来处理生物样品。在一些情况下,系统 以至少约80%、90%、95%、99%、99.9%或更高的准确度来处理生物 样品。
[0335]
d.监控系统
[0336]
系统借助于配置用于容纳样品和执行各种处理例程的盒(或匣) 来帮助样品处理和/或分析。该系统包括用于容纳所述盒的贮器。该盒 可从系统移除。盒可包括识别信息,诸如条码、序列号或电可擦可编 程只读存储器(eeprom)或电可编程只读存储器(eprom)或射 频id(rfid)标签。在一些示例中,这样的识别信息使系统的控制 器能够识别盒以及配置系统用于适当的处理和/或分析例程。相应地, 可以用有关所加载的样品的信息来标明匣中的每个流体回路。举例而 言,可以将例如在收集现场取得的信息与对应于样品的流体回路中的 匣相关联。此类信息例如可以包括收集时间、收集地点以及有关取得 的样品所来自的受试者的信息。
[0337]
例如,盒可包括可读和/或可写存储器装置(例如,eeprom芯 片),所述可读和/或可写存储器装置配置用于存储信息和与系统通信 以传输或接收各类信息。这样的信息可例如包括有关盒的配置和/或历 史的信息,诸如盒的批号、地点/时间来源信息、盒的失效日期、盒的 抽汲参数/顺序、由盒的每个泳道进行的化学的标识(例如,板载的试 剂、所进行的化学反应),以及样品和/或对照的位置。可以例如利用 存储器装置来识别和跟踪盒,以及定制样品处理。存储器装置还可配 置用于在盒正确接合时(例如,在盒贮器中就位时)向系统传输信号。 该信号可例如在存储器装置与盒贮器之间建立电连接的情况下传输。 系统可配置成仅当来自存储器装置的信号指示出盒正确就位时才运 行。存储器装置可配置用于接收有关在特定泳道中运行的样品的性质 的信息,例如收集样品的日期、时间和地点、收集方法、样品类型(例 如,血液、唾液)、采集的样品所来自的人的身份。存储器装置可配 置用于记录来自系统的指示出盒已被运行或者盒批号是否已过期的 信号,并且系统可配置成不运行带有盒已在先前被运行过的记录的盒。 存储器装置还可配置用于接收有关运行结果的信息。例如,存储器装 置可配置用于记录有关运行时间和日期、运行所产生的结果的信息 (例如,记录str谱或者存在或不存在分析物)。
[0338]
检测盒在其适当插槽/储器中的存在以及该盒在系统中任何时 候的状况的传感器有助于确定盒的保管链。盒传感器可以是识别、读 取和存储插入在系统中的每个盒的状态的eeprom存储器芯片。软 件识别盒在插槽/贮器中的存在,并将空的插槽/贮器标示为
empty (空的)。软件还例如将插槽/贮器中的盒的状态识别为new(新的)、 used(用过的)或expired(过期的)。样品盒和对照盒或者系统 还可具有例如指示出如本文所述的拭子向样品腔室中的插入或者拭 子从样品腔室的移除的传感器,所述传感器也辅助于确定盒或样品的 保管链。
[0339]
在一些实施方式中,物理地改变盒以防止重复使用,诸如刺穿 盒的易碎密封或pdms层,或者物理破坏、化学降解或以其他方式改 变盒以防止盒的重复使用。在一些情况下,盒的板载eeprom可以 重置,并且/或者盒的试剂腔室可以重新填充。
[0340]
在一些实施方式中,系统配置用于检测在样品贮器中存在或不 存在物品。所述物品可例如为配置用于保持用于分析的生物样品的物 品,诸如拭子(例如,棉签或毛刷拭子)或者纸张(例如,纸)。 盒模块在与盒相接合时可包含配置用于检测在贮器中存在或不存在 物品的传感器。该传感器可例如配置用于检测透光性或电场的变化。 电场的变化可使用电容式传感器或电感式传感器来检测。透光性的变 化可使用光源和检测器来检测。例如,系统可包含这样的光源:其产 生沿着穿过样品贮器的光路行进的光。该路径可例如包括对光透明的 模块中的窗口。系统可包含定位成沿着光路传光的光源,诸如led 或激光器以及检测器。当样品贮器不含物品或者是空的或透明的时, 光可穿过光路而抵达检测器。当向样品贮器中引入物品时,其阻挡或 衰减光路,从而减少或阻止来自光源的光抵达检测器。通过未检测到 或检测到来自光源的信号而相应地确定的在样品贮器中存在或不存 在物品被报告给可基于该结果而运行多个子例程的的软件。举例而言, 该软件可向用户报告每个样品贮器的状态,例如,每个贮器是否含有 或不含物品,或者是否已经将物品引入贮器并继而将其从贮器中移除。 软件可基于这些结果——例如,是否已经引入物品并将其从贮器中移 除——来运行子例程,所述子例程可提示用户运行或废弃来自贮器中 的物品的结果。系统还可包括门,该门关闭以将盒封闭在系统内。系 统还可包含这样的传感器:其指示出所述门是敞开的还是关闭的,以 及门在已关闭之后在运行期间是否以及于何时被敞开。该信息可写入 到数据库或者显示在用户显示器上。
[0341]
为了加强含样品的物品(例如,拭子)的保管链的维护,可将 射频识别(rfid)标签或2
‑
d条码贴到(例如,永久性地贴到)所 述物品的一部分上,例如,贴到不会接触盒的样品贮器/腔室中的试剂 或液体的所述物品的部分(例如,拭子的末端)。rfid标签或2
‑
d 条码可用于贯穿包括样品收集、样品测试、样品储存和样品向任何其 他持有者的转移在内的整个过程中对含样品的物品保持跟踪。
[0342]
e.远程通信和数据存储
[0343]
在本发明的另一方面,样品制备、处理和分析系统通信地耦合 至一个或多个远程系统。这允许系统——诸如上文所述的系统 100——向和从远程系统传输信息。这可以用于远程数据存储,或者 用于远程数据库探询,或者用以向远程分析提供信息。远程通信可用 于云计算。
[0344]
图19示出系统1900,其具有样品制备、处理和分析装置1901 (其可为图1的系统100),该装置1901可操作地耦合至各个组件。 该样品制备、处理和分析系统配置用于与远程便携式电子装置1902 通信,所述远程便携式电子装置1902诸如为便携式个人计算机(pc)、 智能电话(例如,apple支持安卓(android)的电话、blackberry)、平板
或板型pc(例如,applegalaxy tab)或者其 他便携式装置。便携式电子装置1902可包括图形用户界面,用于允 许用户与设备1901交互。这可使得用户能够远程地审核结果和设置 处理任务。装置1901可无线地,诸如借助于无线网络接口(例如, wifi接口)或蓝牙,来与便携式电子装置1902通信。
[0345]
继续参考图19,装置1901配置用于经由有线或无线连接性或 者卫星来与网络1903(例如,内联网或因特网)通信。系统可借助于 无线通信装置1904来与网络1903进行无线通信,所述无线通信装置 1904可为无线路由器或者用于各种空中通信协议(例如,2g、3g、4g或lte连接性)的基站塔。电子装置1905借助于网络1903来与 装置1901通信。在一些情况下,电子装置1905为用以允许用户远程 地与装置1901交互的远程计算机。在其他情况下,电子装置1905为 数据存储系统,诸如具有用于远程存储制备、处理和/或分析数据的一 个或多个数据库的计算机系统。这可有利地允许装置1901远程地存 储信息并在需要时检索信息。在一些情况下,远程数据存储系统可允 许装置1901备份信息和/或从存储中检索信息。
[0346]
在一些情况下,装置1901为上文在图1的背景下描述的装置 100。装置1901可包括显示器1906,该显示器1906具有用户界面, 诸如图形用户界面(gui),用以允许用户与装置1901交互。在一些 实施方式中,装置1901包括控制器,该控制器具有一个或多个处理 器,举例而言,诸如一个或多个中央处理器(cpu)。装置1901在 一些情况下还包括存储器(例如,只读存储器、随机存取存储器)、 高速缓存和硬盘中的一种或多种。
[0347]
装置1901的显示器、便携式电子装置1902和电子装置1905 可为触摸屏,诸如电容式触摸屏或电阻式触摸屏,其可允许用户使用 用户的手指来与电子装置的图形用户界面(gui)交互。装置1901 还可通过语音命令或其他输入模式来控制。
[0348]
系统1900可允许在位于第一位置的装置1901上进行样品制备、 处理和分析,并允许从不同于该第一位置的第二位置检索信息以供使 用。在一个示例中,使用装置1901在第一位置处理组织样品,并将 数据无线地传输至远离该第一位置的第二位置用于分析。这样的分析 可包括用于匹配的数据对比。系统1900在其中需要在与处理样品的 位置不同的远程位置上进行数据对比的情况中可以是有利的。
[0349]
可以使用复制功能、usb驱动器或通过以太网连接来将收集到 的数据传送到位于系统内或系统外的数据库。收集到的数据能够以其 原始格式传送,或者可将数据分解为适合于搜索的成分。例如,电泳 图数据可分解为代表特定基因座的峰高、到达时间或str计数的数 字。数据库存储来自运行的解析数据,以创建被认为有可能与生物样 品的供体相匹配的一群个体。搜索功能允许在数据库中快速搜索数据 以对比得自供体样品的str谱(最小搜索速度:每秒100次尝试匹 配)或者对比任何其他解析到数据库中的数字。匹配能够以各种限定 的严格性水平来进行。如果可用,则可以显示匹配的数据记录,包括 识别信息和辅助生物特征数据。
[0350]
v.套件
[0351]
还提供了包含耗材试剂的套件。该套件可包含第一容器和第二 容器,所述第一容器配置用于接收样品以供分析,而所述第二容器包 含至少一种耗材试剂用于在样品分析中使用。用于在样品分析中使用 的耗材试剂可例如包括溶液(例如,洗涤溶液、反应缓冲液或电泳缓 冲液)、用于进行化学反应或生化反应的酶(例如,聚合酶)、化学 试剂(例如,扩
增引物、标记试剂)。所述容器中的一个或多个容器 可为盒,其配置用于接合执行部分或所有的样品分析的分析仪器的组 装件。例如,适于接收样品的容器可为本发明的样品盒。包含至少一 种耗材试剂的容器可为本发明的缓冲液盒或阳极盒。在一些实施方式 中,第一容器或盒还可包含用于在样品分析中使用的耗材试剂。例如, 样品盒可含有一种或不止一种对分析物进行化学反应所必需的试剂。 在一些实施方式中,在所提供的套件中的容器可配置用于仪器中的单 一分析。容器可以是一次性的。相应地,套件可包括一次性的单次使 用容器(例如,盒),用于接收样品(以及可选地用于对样品中的分 析物进行化学(例如,生化)反应)。在其他实施方式中,含有至少 一种耗材试剂的第二容器(例如,盒)可配置用于一个或不止一个分 析运行。配置用于不止一个分析运行的容器可含有足以用于不止一个 分析运行的耗材试剂。在一些实施方式中,套件包含:多个第一容器, 每个第一容器配置用于接收样品并且配置用于在单一分析运行中使 用;以及一个或多个第二容器,每个第二容器含有用于在样品分析中 使用的一种或多种耗材试剂,所述耗材试剂的量足以用于等于多个第 一容器的数目的分析运行。例如,套件可含有10个样品盒和一个具 有试剂的耗材试剂盒,该试剂的量足以用于10个分析运行。在一些 实施方式中,套件可包括由该套件所配置用于的分析仪器进行的分析 运行中的每个步骤所必需的所有耗材试剂。例如,用于str分析的 套件可包括用于从样品的dna提取的试剂(例如,裂解缓冲液、捕 获颗粒、洗涤溶液)、用于进行str扩增的试剂(例如,引物、聚 合酶)以及用于电泳的试剂(例如,电泳缓冲液、分离介质)。这样 的套件还可包括对照和标准(例如,等位基因标准物、大小标准)。
[0352]
iv.便携式仪器或系统
[0353]
本公开的一些实施方式涉及本文所述的样品到结果仪器或系统 的便携式版本,其可制造得足够坚固以用于预期用途,例如,由在现 场进行操作的军事或执法人员所使用。这样的便携式仪器或系统的应 用的非限制性示例包括:灵敏现场开发、智能操作、人质确认或否认、 远征取证能力、刑事鉴定和犯罪现场评估。便携式仪器或系统的特征 可例如包括:可在环境温度下储存的试剂、较短的样品到结果时间(例 如,不超过约45min、60min、75min或90min)、减轻的重量,以 及增强的坚固性以承受可能在跨崎岖地形运输期间遭受的振动和冲 击以及跨包括高海拔、极端温度和极端湿度在内的范围广泛的环境条 件进行的操作。
[0354]
在一些实施方式中,便携式仪器或系统配置成可在可以用手、 肩或背部(例如,背包)携带的容器中运送,其中该仪器或系统可包 含一个或多个模块,并且其中所述一个或多个模块中的每个模块可在 容器(例如,背包)中运送。在某些实施方式中,所述一个或多个模 块中的每个模块重量不超过约30磅(lb)、35lb、40lb、45lb、50lb、 55lb、60lb、65lb或70lb。便携式仪器或系统的重量可例如通过减 轻仪器或系统的各个组件的重量,以及/或者通过消除或重新设计某些 组件而得到减轻。例如,可以将仪器或系统设计成使用单一样品盒, 这将不需要提供通向两个样品盒的气动连接和流体连接的样品盒接 口模块。样品盒可配置用于接收和处理多个不同的样品,诸如8个、 10个、16个、24个、32个、48个或更多个不同的样品。作为另一示 例,可将具有减轻的重量的固定件用于各个组件,诸如阳极盒接口模 块和/或光学模块。作为又一示例,所述一个或多个模块中的每个模块 可具有重量减轻的机架和外壳。例如,所述一个或多个模块中的每个 模块可具有由诸如铝等较轻金属或金属片制成的机架和/或外壳。
[0355]
在某些实施方式中,便携式仪器或系统包含两个模块,所述模 块可各自在可以用手、肩或背部(例如,背包)携带的单独的容器中 运送,并且可在目的地点彼此连接以创建出功能性的核酸(例如,dna) 分析仪器或系统。图56的a和图56的b示出了包含两个能够以背 包形式运送的模块的便携式仪器或系统的实施方式。在一些实施方式 中,便携式仪器或系统的两个模块中之一为样品分析模块(图56的 a),该样品分析模块除其他组件之外,包含针对一个或多个样品盒 的接口、分离与检测系统(包括毛细管电泳阵列、用于以凝胶来填充 毛细管的泵,以及检测器)、用于再水合干燥试剂的装置,以及高电 压电源。在某些实施方式中,样品分析模块配置用于收取单一样品盒。 在其他实施方式中,样品分析模块配置用于收取多个样品盒(例如, 两个样品盒)。所有的样品处理,包括dna提取以及经扩增dna(例 如,str)片段的分离和检测在内,均可在样品分析模块中进行。在 某些实施方式中,样品分析模块具有约14.5英寸x约14.5英寸x约 23英寸的尺寸,或者在小于或大于这些尺寸约10%或20%的范围内。 在某些实施方式中,样品分析模块的重量为约50、53或55lb,或者 比50、53或55lb更小或更大约10%或20%。在其他实施方式中,便 携式仪器或系统的另一模块为支持模块(图56的b),该支持模块 除其他组件之外,包含用于向所述一个或多个样品盒以及针对其的接 口供应真空或压力的泵、计算机系统,以及触摸屏显示器。在一些实 施方式中,支持模块具有基本上与样品分析模块的尺寸相似的尺寸。 在某些实施方式中,支持模块的重量为约40、42或45lb,或者比约 40、42或45lb更小或更大约10%或20%。图56的a和图56的b 示出各自安装在背包框架上的样品分析模块和支持模块。在某些实施 方式中,用于样品分析模块和支持模块的背包框架的重量为约1lb、2 lb、3lb、4lb或5lb。样品分析模块和支持模块可例如通过具有内部 拱式子框架而得到加固,以便承受振动和冲击。在其他实施方式中, 所述两个模块中之一包含用于进行核酸提取和纯化以及pcr扩增的 系统,而另一模块包含用于进行分离、检测和数据分析的系统。
[0356]
在一些实施方式中,便携式仪器或系统在不超过约45min、60 min、75min或90min内进行样品到结果处理与分析。在一些实施方 式中,仪器或系统通过采用更快的热循环器和/或更快的热循环方法来 实现更短的样品到结果时间。在某些实施方式中,仪器或系统具有珀 尔帖热循环系统,该系统具有约10
‑
15℃/秒或更高的加热速率,以及 约5
‑
10℃/秒或更高的冷却速率。更快的热循环器可允许在约30min、 25min、20min、15min或更短时间内进行pcr扩增(例如,对str 基因座的pcr扩增)。更快的pcr扩增还可通过利用更快的热循环 方法,例如通过连续流pcr扩增来实现。连续流pcr扩增可通过让 pcr流体在其于固定温度区之间移动时经历快速温度转变来实现快 速pcr扩增。更快的pcr扩增还可通过进行穿梭循环来实现。在其 他实施方式中,便携式仪器或系统通过在更短的时间内分离dna片 段(例如,str基因座的扩增子)来实现更快的样品到结果时间。dna 片段的更快的电泳分离可通过各种方式来实现,例如,通过减小注射 的样品塞长度和增多注射到毛细管中的dna的数量。作为另一示例, 更窄的样品注射塞可允许以足够的dna片段分辨率在更短的毛细管 中分离。作为又一示例,使用电动样品堆积注射过程(例如,瞬时等 速电泳)可显著提高电泳中样品注射的效率,这可导致样品检测的灵 敏度提高,并且可减少扩增所需的pcr循环的数目。更少的pcr循 环可以缩短扩增时间。
[0357]
vii.代表性实施方式
[0358]
仅通过示例方式提供本公开的以下实施方式:
1.一种匣,包括:(a)容器,其包含多个封闭的且流体隔离的腔室,其中所述多个 腔室中的每个腔室包含易碎密封;以及(b)微流体装置,其包含多个穿刺元件和微流体通道,其中多 个穿刺元件与所述多个腔室相对地安设,其中,当将微流体装置与容器相接合时,所述穿刺元件刺穿所述 多个腔室中的每个腔室的易碎密封,从而创造出所述流体隔离的腔室 之间经过所述微流体通道的流体流动路径。2.实施方式1的匣,还包括端口,所述端口使所述多个封闭的 且流体隔离的腔室中的单个腔室与压力源流体连通。3.实施方式1或2的匣,其中所述流体流动路径为多向流体流 动路径。4.前述实施方式中任一项的匣,其中所述多个穿刺元件包括开 口,所述开口与所述微流体通道流体连通。5.前述实施方式中任一项的匣,其中所述微流体通道包含一个 或多个可选择性地关闭的通道。6.前述实施方式中任一项的匣,其中所述微流体通道与一个或 多个阀流体连通。7.实施方式6的匣,其中所述一个或多个阀为隔膜阀。8.实施方式6或7的匣,其中所述一个或多个阀为气动致动阀。9.实施方式6或7的匣,其中所述一个或多个阀为压电阀。10.前述实施方式中任一项的匣,其中:所述微流体通道包含多个微流体通道;所述多个腔室中的至少一个或每个腔室包含可连接至微流体通 道的第一端口和可连接至微流体通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。11.前述实施方式中任一项的匣,其中所述多个封闭的且流体隔 离的腔室包含微流体腔室。12.前述实施方式中任一项的匣,其中所述多个封闭的且流体隔 离的腔室包含宏观流体腔室。13.前述实施方式中任一项的匣,还包括热循环器组装件,该热 循环器组装件适于从所述容器接收样品以及加热和冷却该样品。14.实施方式13的匣,其中所述热循环器组装件配置用于聚合 酶链反应(pcr)。15.实施方式13或14的匣,其中所述热循环器组装件包含热循 环腔室。16.实施方式15的匣,还包括预混物施加构件,该预混物施加 构件与所述微流体通道和所述热循环腔室流体连通。17.实施方式15或16的匣,还包括磁场施加构件,该磁场施加 构件与所述热循环腔室相邻。18.前述实施方式中任一项的匣,其中当将所述微流体装置与所 述容器相接合
时,所述容器覆盖所述微流体通道。19.前述实施方式中任一项的匣,还包括样品贮器,该样品贮器 包含适于接收样品的样品腔室。20.实施方式19的匣,其中所述样品腔室具有开口,所述开口 与被置于所述微流体装置与所述容器之间的所述微流体装置的表面 平行。21.实施方式19或20的匣,其中所述样品腔室适于保存拭子(例 如,棉签或毛刷拭子)。22.实施方式19至21中任一项的匣,其中所述微流体通道包含 样品通道,该样品通道与所述样品腔室流体连通。23.实施方式22的匣,其中所述容器覆盖整个所述样品通道或 其绝大部分。24.实施方式19至23中任一项的匣,其中所述样品贮器与所述 微流体装置成为一体。25.前述实施方式中任一项的匣,其中所述微流体通道包含试剂 通道,该试剂通道与所述多个封闭的且流体隔离的腔室的试剂腔室流 体连通。26.实施方式25的匣,其中所述容器覆盖整个所述试剂通道或 其绝大部分。27.前述实施方式中任一项的匣,其中所述多个封闭的且流体隔 离的腔室包含:保存稀释剂的第一腔室;保存一种或多种裂解试剂的第二腔室,其中该第二腔室与所述样 品腔室流体连通;具有捕获颗粒的第三腔室;以及具有洗涤溶液的第四腔室。28.实施方式27的匣,其中所述第二腔室为废液腔室,配置用 于保存废料。29.实施方式27或28的匣,其中:所述微流体通道包含多个微流体通道;所述第一腔室、所述第二腔室、所述第三腔室和所述第四腔室中 的每一个都包含可连接至微流体通道的第一端口和可连接至微流体 通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。30.前述实施方式中任一项的匣,还包括位于所述容器与所述微 流体装置之间的可变形材料层。31.实施方式30的匣,其中所述容器借助于所述可变形材料层 而附接至所述微流体装置。32.实施方式30或31的匣,其中所述可变形材料层具有第一粘 贴面和与所述第一粘贴面相对的第二粘贴面,其中所述第一粘贴面与 所述微流体装置相邻,而所述第二粘贴面与所述容器相邻。33.实施方式30至32中任一项的匣,其中所述可变形材料由可 压缩材料形成。34.实施方式30至33中任一项的匣,其中所述可变形材料由可 热柔化材料形成。35.实施方式30至34中任一项的匣,其中所述可变形材料包含 一个或多个弹簧。
36.前述实施方式中任一项的匣,其中所述容器与所述微流体装 置成为一体。37.前述实施方式中任一项的匣,其中所述容器被按入或压在所 述微流体装置上。38.前述实施方式中任一项的匣,其中所述易碎密封由金属材料 形成。39.前述实施方式中任一项的匣,其中所述易碎密封由聚合物材 料形成。40.前述实施方式中任一项的匣,其中所述容器安设在整个或基 本上整个所述微流体通道上。41.一种用于处理生物样品的装置,包括:(a)微流体装置,其包含微流体通道,该微流体通道与一个或多 个端口流体连通,其中所述微流体装置包括多个穿刺元件;以及(b)容器,其安设在所述微流体装置上,该容器包含多个密封 腔室,其中所述多个密封腔室中的每个腔室借助于易碎密封而得到密 封,其中所述容器借助于可变形材料层而附接至所述微流体装置,其中通过将所述微流体装置与所述容器相接合而刺穿所述易碎 密封并创造出所述密封腔室中的每个密封腔室与所述微流体通道之 间的流体流动路径。42.实施方式41的装置,还包括端口,所述端口使所述多个密 封腔室中的单个腔室与压力源流体连通。43.实施方式41或42的装置,其中所述流体流动路径为多向流 体流动路径。44.实施方式41至43中任一项的装置,其中所述多个穿刺元件 包括开口,所述开口与所述微流体通道流体连通。45.实施方式41至44中任一项的装置,其中所述微流体通道包 含一个或多个可选择性地关闭的通道。46.实施方式41至45中任一项的装置,其中所述微流体通道与 一个或多个阀流体连通。47.实施方式46的装置,其中所述一个或多个阀为隔膜阀。48.实施方式46或47的装置,其中所述一个或多个阀为气动致 动阀。49.实施方式46或47的装置,其中所述一个或多个阀为压电阀。50.实施方式41至49中任一项的装置,其中:所述微流体通道包含多个微流体通道;所述多个腔室中的至少一个或每个腔室包含可连接至微流体通 道的第一端口和可连接至微流体通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。51.实施方式41至50中任一项的装置,其中所述多个密封腔室 包含微流体腔室。52.实施方式41至51中任一项的装置,其中所述多个密封腔室 包含宏观流体腔室。53.实施方式41至52中任一项的装置,还包括热循环器组装件, 该热循环器组装件与所述微流体通道流体连通。
54.实施方式53的装置,其中所述热循环器组装件配置用于聚 合酶链反应(pcr)。55.实施方式53或54的装置,其中所述热循环器组装件包含热 循环腔室。56.实施方式55的装置,还包括预混物施加构件,该预混物施 加构件与所述微流体通道和所述热循环腔室流体连通。57.实施方式55或56的装置,还包括磁场施加构件,该磁场施 加构件与所述热循环腔室相邻。58.实施方式41至57中任一项的装置,其中所述容器覆盖所述 微流体通道的绝大部分。59.实施方式41至58中任一项的装置,还包括样品贮器,该样 品贮器包含适于接收样品的样品腔室。60.实施方式59的装置,其中所述样品腔室具有开口,所述开 口与所述微流体装置的表面平行,所述表面被置于所述微流体装置与 所述容器之间。61.实施方式59或60的装置,其中所述样品腔室适于保存拭子 或毛刷。62.实施方式59至61中任一项的装置,其中所述微流体通道包 含样品通道,该样品通道与所述样品腔室流体连通。63.实施方式62的装置,其中所述容器覆盖整个所述样品通道 或其绝大部分。64.实施方式59至63中任一项的装置,其中所述样品贮器与所 述微流体装置成为一体。65.实施方式41至64中任一项的装置,其中所述微流体通道包 含试剂通道,该试剂通道与所述多个密封腔室的试剂腔室流体连通。66.实施方式65的装置,其中所述容器覆盖整个所述试剂通道 或其绝大部分。67.实施方式41至66中任一项的装置,其中所述多个密封腔室 包含:保存稀释剂的第一腔室;保存一种或多种裂解试剂的第二腔室,其中该第二腔室与所述样 品腔室流体连通;具有捕获颗粒的第三腔室;以及具有洗涤溶液的第四腔室。68.实施方式67的装置,其中所述第二腔室为废液腔室,配置 用于保存废料。69.实施方式67或68的装置,其中:所述微流体通道包含多个微流体通道;所述第一腔室、所述第二腔室、所述第三腔室和所述第四腔室中 的每一个都包含可连接至微流体通道的第一端口和可连接至微流体 通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。70.实施方式41至69中任一项的装置,还包括位于所述容器与 所述微流体装置之间的可变形材料层。71.实施方式70的装置,其中所述容器借助于所述可变形材料 层而附接至所述微流体装置。
72.实施方式70或71的装置,其中所述可变形材料层具有第一 粘贴面和与所述第一粘贴面相对的第二粘贴面,其中所述第一粘贴面 与所述微流体装置相邻,而所述第二粘贴面与所述容器相邻。73.实施方式70至72中任一项的装置,其中所述可变形材料由 可压缩材料形成。74.实施方式70至73中任一项的装置,其中所述可变形材料由 可热柔化材料形成。75.实施方式70至74中任一项的装置,其中所述可变形材料包 含一个或多个弹簧。76.实施方式41至75中任一项的装置,其中所述容器与所述微 流体装置成为一体。77.实施方式41至76中任一项的装置,其中所述容器被按入或 压在所述微流体装置上。78.实施方式41至77中任一项的装置,其中所述易碎密封由金 属材料形成。79.实施方式41至78中任一项的装置,其中所述易碎密封由聚 合物材料形成。80.实施方式41至79中任一项的装置,其中所述容器安设在整 个或基本上整个所述微流体通道上。81.一种用于处理生物样品的匣,包括:(a)微流体装置,其包含微流体通道以及一个或多个穿刺元件; 以及(b)容器,其包含多个腔室,所述容器安设在整个所述微流体 通道或其绝大部分上,其中所述多个腔室中的每个腔室包含易碎密封,其中当将所述微流体装置倚靠所述容器夹紧时,所述穿刺元件刺 穿所述多个腔室中的每个腔室的易碎密封,从而形成所述多个腔室中 的每个腔室与所述微流体通道之间的流体流动路径。82.实施方式81的匣,还包括端口,所述端口使所述多个腔室 中的单个腔室与压力源流体连通。83.实施方式81或82的匣,其中:所述微流体通道包含多个微流体通道;所述多个腔室中的至少一个或每个腔室包含可连接至微流体通 道的第一端口和可连接至微流体通道的第二端口;并且通过将所述微流体装置倚靠所述容器夹紧而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。84.实施方式81至83中任一项的匣,其中所述流体流动路径为 多向流体流动路径。85.实施方式81至84中任一项的匣,其中所述多个腔室包含:保存稀释剂的第一腔室;保存一种或多种裂解试剂的第二腔室,其中该第二腔室与所述样 品腔室流体连通;具有捕获颗粒的第三腔室;以及
具有洗涤溶液的第四腔室。86.实施方式85的匣,其中所述第二腔室为废液腔室,配置用 于保存废料。87.实施方式85或86的匣,其中:所述微流体通道包含多个微流体通道;所述第一腔室、所述第二腔室、所述第三腔室和所述第四腔室中 的每一个都包含可连接至微流体通道的第一端口和可连接至微流体 通道的第二端口;并且通过将所述微流体装置倚靠所述容器夹紧而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。88.实施方式81至87中任一项的匣,其中所述易碎密封由金属 材料形成。89.实施方式81至88中任一项的匣,其中所述易碎密封由聚合 物材料形成。90.实施方式81至89中任一项的匣,其中所述容器安设在整个 或基本上整个所述微流体通道上。91.实施方式81至90中任一项的匣,其中所述容器覆盖整个所 述微流体通道或其绝大部分。92.实施方式81至91中任一项的匣,还包括样品贮器,该样品 贮器包含适于接收样品的样品腔室,所述样品腔室与所述微流体通道 流体连通。93.实施方式92的匣,其中所述样品贮器与所述微流体装置成 为一体。94.一种用于处理生物样品的匣,包括:(a)微流体装置,其包含第一微流体通道和与所述第一微流体通 道流体隔离的第二微流体通道,其中所述微流体装置包括多个穿刺元 件;以及(b)容器,其包含第一多个封闭的且流体隔离的腔室以及第二 多个封闭的且流体隔离的腔室,所述第一多个封闭的且流体隔离的腔 室和所述第二多个封闭的且流体隔离的腔室中的每个腔室包含易碎 密封,其中,当将所述微流体装置与所述容器相接合时,所述穿刺元件 刺穿所述第一多个封闭的且流体隔离的腔室和所述第二多个封闭的 且流体隔离的腔室中的每个腔室的易碎密封,从而形成所述第一微流 体通道与所述第一多个封闭的且流体隔离的腔室之间的流体流动路 径以及所述第二微流体通道与所述第二多个封闭的且流体隔离的腔 室之间的另一流体流动路径。95.实施方式94的匣,还包括用于所述第一多个封闭的且流体 隔离的腔室和所述第二多个封闭的且流体隔离的腔室中的每个腔室 的端口,所述端口使所述第一多个封闭的且流体隔离的腔室和所述第 二多个封闭的且流体隔离的腔室中的每个单个腔室与压力源流体连 通。96.实施方式94或95的匣,其中:(1)所述第一微流体通道包含多个微流体通道;所述第一多个腔室中的至少一个或每个腔室包含可连接至 微流体通道的第一端口和可连接至微流体通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流 动路径,该流体流动路径包含连接至所述第一多个腔室中的腔室的第 一端口的微流体通道、所述腔室以及连
接至该腔室的第二端口的微流 体通道。(2)所述第二微流体通道包含多个微流体通道;所述第二多个腔室中的至少一个或每个腔室包含可连接至 微流体通道的第一端口和可连接至微流体通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流 动路径,该流体流动路径包含连接至所述第二多个腔室中的腔室的第 一端口的微流体通道、所述腔室以及连接至该腔室的第二端口的微流 体通道。97.实施方式94至96中任一项的匣,其中所述流体流动路径为 多向流体流动路径。98.实施方式94至97中任一项的匣,其中所述第一微流体通道 基本上平行于并且/或者不与所述第二微流体通道相交。99.实施方式94至98中任一项的匣,还包括第一样品贮器和第 二样品贮器,所述第一样品贮器包含适于接收第一样品的第一样品腔 室,而所述第二样品贮器包含适于接收第二样品的第二样品腔室。100.实施方式99的匣,其中所述第一样品腔室与所述第一微流 体通道流体连通,并且所述第二样品腔室与所述第二微流体通道流体 连通。101.实施方式99或100的匣,其中所述第一样品腔室包括具有 已知遗传谱的生物样品。102.实施方式94至101中任一项的匣,其中所述样品贮器与所 述微流体装置成为一体。103.一种系统,包括:(a)贮器,用于接收匣;(b)匣,其被接收在所述贮器中,所述匣包含:(i)容器,其包含多个封闭的且流体隔离的腔室,其中所 述多个封闭的且流体隔离的腔室中的每个腔室包含易碎密封;以及(ii)微流体装置,其包含多个穿刺元件以及与一个或多个 端口流体连通的微流体通道,其中:所述容器借助于可变形材料层而附接至所述微流体 装置;并且/或者所述多个穿刺元件中的两个或更多个穿刺元件安设 在与所述多个封闭的且流体隔离的腔室中的每个腔室相对之处;以及 (c)压力施加构件,用于将所述微流体装置与所述容器相接合, 其中通过将所述微流体装置与所述容器相接合而刺穿所述多个封闭 的且流体隔离的腔室中的每个腔室的易碎密封并且创造出所述多个 封闭的且流体隔离的腔室中的每个腔室与所述微流体通道之间的流 体流动路径。104.实施方式103的系统,其中:所述微流体通道包含多个微流体通道;所述多个腔室中的至少一个或每个腔室包含可连接至微流体通 道的第一端口和可连接至微流体通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口
的微流体通道。105.实施方式103或104的系统,其中所述系统在约2小时或 更短时间内或者在约1.5小时或更短时间内处理或者处理和分析生物 样品。106.实施方式103至105中任一项的系统,其中所述系统以小 于约20%的变异系数来处理和/或分析生物样品。107.实施方式106的系统,其中所述系统以小于约10%的变异 系数来处理和/或分析生物样品。108.实施方式107的系统,其中所述系统以小于约1%的变异系 数来处理和/或分析生物样品。109.实施方式103至108中任一项的系统,其中所述系统以至 少约80%的准确度来处理和/或分析生物样品。110.实施方式109的系统,其中所述系统以至少约90%的准确 度来处理和/或分析生物样品。111.实施方式110的系统,其中所述系统以至少约95%或99% 的准确度来处理和/或分析生物样品。112.一种用于处理生物样品的方法,包括:(a)提供如实施方式1中的匣;(b)在所述匣的样品腔室中提供样品,其中所述样品腔室与所 述匣的微流体通道流体连通;(c)将所述微流体装置与所述容器相接合,以形成所述多个封闭 的且流体隔离的腔室中的每个腔室与所述微流体通道之间的流体流 动路径;以及(d)处理所述生物样品。113.实施方式112的方法,其中所述多个封闭的且流体隔离的 腔室包含:保存稀释剂的第一腔室;保存一种或多种裂解试剂的第二腔室,其中该第二腔室与所述样 品腔室流体连通;具有捕获颗粒的第三腔室;以及具有洗涤溶液的第四腔室。114.实施方式113的方法,其中:所述微流体通道包含多个微流体通道;所述第一腔室、所述第二腔室、所述第三腔室和所述第四腔室中 的每一个都包含可连接至微流体通道的第一端口和可连接至微流体 通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。115.实施方式112至114中任一项的方法,其中处理生物样品 包括:将所述一种或多种裂解试剂从所述第二腔室引向所述样品腔室;使所述一种或多种裂解试剂与所述样品腔室中的生物样品相接 触,从而从所述生物样品提取核酸样品;
将所述核酸样品从所述样品腔室引向所述第三腔室,从而使所述 核酸样品的至少一部分附接至捕获颗粒;以及将所述捕获颗粒引向热循环腔室,该热循环腔室通过所述微流体 通道而与所述第三腔室流体连通。116.实施方式115的方法,其中借助于负压或正压来将所述裂 解试剂从所述第二腔室引向所述样品腔室。117.实施方式115或116的方法,还包括在所述热循环腔室中 扩增所述核酸样品。118.实施方式115至117中任一项的方法,其中将捕获颗粒引 向热循环腔室包括将捕获颗粒引向热循环器组装件的热循环腔室。119.实施方式118的方法,还包括向所述热循环腔室提供预混 物溶液。120.实施方式119的方法,还包括在所述热循环腔室中对所述 核酸样品进行热循环,从而扩增由所述捕获颗粒所提供的核酸样品以 便产生核酸扩增产物。121.实施方式120的方法,还包括将所述核酸扩增产物从所述 热循环腔室引向所述第一腔室。122.实施方式112至121中任一项的方法,其中将所述微流体 装置与所述容器相接合包括在所述微流体装置的方向上对所述容器 施加压力。123.一种用于处理生物样品的系统,包括:壳体;贮器,其位于所述壳体之中,该贮器配置用于接收匣,所述匣具 有微流体装置和与所述微流体装置相邻的容器,其中所述容器包括用于样品处理的腔室,其中所述容器借助于易碎密封而得到密封,并且其中所述微流体装置包含端口,该端口使所述腔室与压力 源流体连通;接合构件,其与所述贮器相邻,其中所述接合构件将所述微流体 装置与所述容器相接合,从而刺穿所述易碎密封,其中刺穿所述易碎 密封使所述腔室与所述微流体装置的微流体通道流体连通;以及控制器,其位于所述壳体之中,所述控制器具有处理器和存储器, 该存储器带有机器可执行代码,用于实现借助于所述匣来处理生物样 品的方法。124.实施方式123的系统,其中:所述容器包含多个腔室;所述微流体装置包含多个微流体通道;所述多个腔室中的至少一个或每个腔室包含可连接至微流体通 道的第一端口和可连接至微流体通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。125.实施方式123或124的系统,还包括显示器,其中该显示 器具有可操作地耦合至所述控制器的图形用户界面(gui),其中该 gui使得使用者能够与所述系统交互。126.一种用于确定生物体的遗传谱的方法,包括在20个或更少 个步骤中或者在
10个或更少个步骤中处理和分析来自所述生物体的 生物样品。127.实施方式126的方法,其中所述遗传谱在约3小时或更短 时间内确定。128.实施方式127的方法,其中所述遗传谱在约2小时或更短 时间内确定。129.实施方式128的方法,其中所述遗传谱在约1.5小时或更短 时间内、或者约1小时或更短时间内、或者约45min至更短时间内 确定。130.实施方式126至129中任一项的方法,其中所述确定包括 对所述生物体的短串联重复(str)分析。131.一种用于自动化法医分析的方法,包括使用具有约20ft3或 更小体积的完全集成样品处理与分析系统,在20个或更少个步骤中 或者在10个或更少个步骤中确定生物体的遗传谱。132.实施方式131的方法,其中所述完全集成样品处理与分析 系统具有约16ft3或更小的体积。133.实施方式132的方法,其中所述完全集成样品处理与分析 系统具有约15ft3或更小的体积。134.实施方式133的方法,其中所述完全集成样品处理与分析 系统具有约10ft3或更小的体积。135.实施方式134的方法,其中所述完全集成样品处理与分析 系统具有约5ft3或更小的体积。136.一种匣,包括:(a)容器,其包含至少一个封闭的且流体隔离的腔室,所述腔室 包含易碎密封;以及(b)微流体装置,其包含多个通道,其中所述多个通道中的每 个通道在端口处终止,其中通过将所述微流体装置与所述容器相接合而刺穿所述易碎 密封,从而使所述端口通过所述腔室而彼此流体连通。137.实施方式136的匣,其中所述多个通道中的每个通道在第 一端口处敞开并在第二端口处终止。138.实施方式137的匣,其中所述第二端口在所述微流体装置 接合所述容器之处通向所述封闭的且流体隔离的腔室。139.实施方式136至138中任一项的匣,其中所述多个通道中 的至少一个通道与多个腔室流体连通。140.实施方式136至139中任一项的匣,其中所述容器包含两 个封闭的且流体隔离的腔室,并且其中通过将所述微流体装置与所述 容器相接合而使所述两个封闭的且流体隔离的腔室经过所述微流体 装置中一个或多个通道而彼此流体连通。141.一种用于处理样品的方法,包括:将容器与微流体装置相接合,其中所述容器包含至少一个封闭的 且流体隔离的腔室,所述腔室包含易碎密封,其中所述微流体装置包 含多个通道,其中所述多个通道中的每个通道在端口处终止,其中通过将所述微流体装置与所述容器相接合而刺穿所述易碎 密封,从而使所
述端口经过所述腔室而彼此流体连通。142.一种匣,包括:(a)容器,其包含借助于易碎密封而关闭且流体隔离的腔室;以 及(b)微流体装置,其包含第一通道和第二通道以及与所述腔室 相邻的穿刺元件,所述第一通道和第二通道中的每个通道在端口处终 止,其中,当将所述微流体装置与所述容器相接合时,所述穿刺元件 刺穿所述易碎密封,从而创造出流体流动路径,该流体流动路径包含 所述第一通道、腔室和第二通道。143.实施方式142的匣,其中当接合所述微流体装置时,所述 第一通道和第二通道中的每个通道的端口通向所述腔室。144.一种物品,包括:主体,其含有位于开口之间的通路;第一可移动阻挡器和第二可移动阻挡器,所述阻挡器定位在所述 通路中,以便限定介于其间的隔室;以及所述隔室中的流体,所述流体包含扩增预混物,其中对第一可移动阻挡器施加的外部压力传递到所述第二可移 动阻挡器,以使所述第二可移动阻挡器朝向开口移动。145.实施方式144的物品,其中所述主体被配置成桶,并且所 述第二可移动阻挡器被配置成球状体。146.实施方式144或145的物品,其中所述第一可移动阻挡器 被配置成球状体或柱塞。147.实施方式144至146中任一项的物品,还包括唇部,该唇 部适于接合夹子或夹钳。148.实施方式144至147中任一项的物品,其中所述第二可移 动阻挡器定位成朝向所述主体的逐渐变细的末端。149.实施方式148的物品,其中所述逐渐变细的末端接合接收 元件以便形成扣压密封。150.一种用于处理生物样品的系统,包括:(a)匣,其具有腔室,其中所述匣包括与所述腔室相邻的微流体装置,并且其中所述微流体装置包括沿着所述微流体装置的微流体通 道的多个隔膜阀,所述多个隔膜阀中的单个隔膜阀具有流体层、气动 层和位于所述流体层与气动层之间的弹性层;(b)压力源,其通过所述微流体装置的端口而与所述腔室流体 连通,其中所述压力源向所述腔室提供正压或负压,从而使流体以约 5000微升(ul)/s或更小或者1000ul/s或更小的流速移动经过所述微 流体通道;以及(c)气动歧管,其与所述气动层流体连通,所述气动层用于致动 所述弹性层,从而使流体以约100ul/s或更小或者10ul/s或更小的流 速移动经过所述微流体通道。151.实施方式150的系统,其中:所述压力源可使流体以小于或等于约5000ul/s、4000ul/s、3000 ul/s、2000ul/s、
1000ul/s、500ul/s、400ul/s、300ul/s、200ul/s、100 ul/s、50ul/s或更小的流速移动经过所述微流体通道;并且所述气动层的致动可使流体以小于或等于约100ul/s、90ul/s、80 ul/s、70ul/s、60ul/s、50ul/s、40ul/s、30ul/s、20ul/s、10ul/s、5ul/s、 2.5ul/s、1ul/s或更小的流速移动经过所述微流体通道。152.实施方式151的系统,其中:所述压力源可使流体以小于或等于约100ul/s或更小的流速移动 经过所述微流体通道;并且所述气动层的致动可使流体以小于或等于约5ul/s或更小的流速 移动经过所述微流体通道。153.实施方式150至152中任一项的系统,其中所述微流体通 道通过所述腔室的易碎密封而与所述腔室流体连通。154.一种盒模块,包括:贮器,用于容纳具有样品和用于处理所述样品的一种或多种试剂 的盒,所述盒具有用于样品处理的一个或多个腔室以及用于帮助流体 流向所述一个或多个腔室的一个或多个阀;第一组装件,其具有第一压力歧管,该第一压力歧管接合所述盒 的第一面,并使所述一个或多个腔室与压力源流体连通;第二组装件,其具有第二压力歧管,该第二压力歧管接合所述盒 的第二面,并使所述一个或多个阀与用于气动致动的压力源流体连通; 以及伸长或移动构件,其朝向所述盒移动所述第一压力歧管和所述第 二压力歧管中之一或全部两者。155.实施方式154的盒模块,其中所述伸长或移动构件通过线 缆而耦合至所述第一组装件和所述第二组装件中之一或全部两者。156.实施方式155的盒模块,其中所述线缆为波顿线缆。157.实施方式154至156中任一项的盒模块,其中所述伸长或 移动构件将所述第一压力歧管和所述第二压力歧管中之一或全部两 者从所述盒移开。158.实施方式154至157中任一项的盒模块,其中所述伸长或 移动构件包含空气驱动活塞,所述空气驱动活塞的移动将所述第一压 力歧管和所述第二压力歧管中之一或全部两者朝向所述盒移动。159.一种包含一组或多组腔室和流体通道的盒,其中:所述盒配置成可以可拆卸地与盒模块相接合;对于包含多组腔室和流体通道的盒,每组腔室和流体通道在所述 盒与所述盒模块的接合之前或之后与每一其他组腔室和流体通道流 体隔离;每组腔室和流体通道包含多个腔室,所述多个腔室在所述盒与所 述盒模块的接合之前关闭并与彼此和与所述流体通道流体隔离;每组腔室和流体通道中的腔室在所述盒与所述盒模块相接合时 经由所述流体通道而彼此流体连通;并且对于每组腔室和流体通道中的多个封闭的且流体隔离的腔室中 的每个腔室,所
述盒与所述盒模块的接合创造出流体流动路径,该流 体流动路径包含与所述腔室的第一端口流体连通的流体通道、所述腔 室以及与所述腔室的第二端口流体连通的流体通道。160.实施方式159的盒,其中每组腔室和流体通道中的所述多 个封闭的且流体隔离的腔室中的每个腔室的所述第一端口和所述第 二端口基本上处于同一平面、处于同一表面或处于所述腔室的基部或 底部,或者其任何组合。161.实施方式159或160的盒,其中所述多个封闭的且流体隔 离的腔室中的每个腔室在所述盒与所述盒模块的接合之前借助于易 碎或可刺穿密封而封闭并流体隔离。162.实施方式161的盒,其中当所述盒与所述盒模块相接合时, 所述盒中的两个穿刺元件刺穿所述多个封闭的且流体隔离的腔室中 的每个腔室的所述易碎或可刺穿密封,从而创造出流体流动路径,该 流体流动路径包含与所述腔室的第一端口流体连通的流体通道、所述 腔室以及与所述腔室的第二端口流体连通的流体通道。163.实施方式162的盒,其中所述流体流动通道借助于一个或 多个(例如,两个)垫片而在所述腔室的每个端口处得到密封。164.实施方式162或163的盒,其中每个穿刺元件具有开口, 该开口与流体通道流体连通。165.实施方式162至164中任一项的盒,其中与腔室的端口流 体连通的每个流体通道可向所述腔室提供流体(例如,液体或气体)。166.实施方式161至165中任一项的盒,其中所述易碎或可刺 穿密封由金属材料(例如,铝箔)构成。167.实施方式161至166中任一项的盒,其中所述易碎或可刺 穿密封由聚合物材料构成。168.实施方式159至167中任一项的盒,其还包括用于每组腔 室和流体通道的一个或多个端口,所述端口使每组中的腔室经由流体 通道而与正压源或负压源流体连通。169.实施方式159至168中任一项的盒,其中对于包含多组腔 室和流体通道的盒,每组腔室和流体通道中的流体通道的路径基本上 平行于并且/或者不与每一其他组腔室和流体通道中的流体通道的路 径相交。170.实施方式159至169中任一项的盒,其配置用于:从样品提取核酸(例如,dna);分离提取出的核酸(例如,通过将提取出的核酸捕获至基底(例 如,磁响应颗粒));可选地纯化经分离的核酸;扩增(例如,通过聚合酶链反应(pcr)来扩增)经分离的核酸 的一个或多个选定的核苷酸(例如,短串联重复(str))序列以产 生扩增产物;以及可选地分离,或者可选地分离和检测扩增产物(例如,通过电泳)。171.实施方式170的盒,其中每组腔室包含:(a)包含用于从样品提取核酸的处于溶液或缓冲液中的试剂(例 如,裂解试剂)并且可选地包含消泡试剂的腔室;(b)包含用于分离提取出的核酸的、可选地处于溶液或缓冲液 中的基底(例如,磁响应颗粒)的腔室;
(c)包含用于纯化经分离的核酸的溶液(例如,洗涤溶液或缓冲 液)的一个或多个(例如,两个)腔室;以及(d)包含用于在扩增产物的分离之前稀释扩增产物的溶液(例 如,水)的腔室。172.实施方式171的盒,其中对于每组腔室:腔室(a)配置用于接收和/或储存废料;并且腔室(d)可选地还包括对照(例如,包含样品的一组腔室中的 大小标准,或者不含样品的一组腔室中的等位基因标准物(以及可选 地,大小标准))。173.实施方式171或172的盒,其中对于每组腔室:腔室(a)预先装载有用于从样品提取核酸的、溶液或缓冲液中的 试剂(例如,裂解试剂),并且可选地预先装载有消泡试剂;腔室(b)预先装载有用于分离提取出的核酸的、可选地处于溶 液或缓冲液中的基底(例如,磁响应颗粒);一个或多个(例如,两个)腔室(c)预先装载有用于纯化经分离 的核酸的溶液(例如,洗涤溶液或缓冲液);并且腔室(d)预先装载有用于稀释扩增产物的溶液(例如,水), 并且可选地预先装载有对照(例如,包含样品的一组腔室中的大小标 准,或者不会含有样品的一组腔室中的等位基因标准物(以及可选地, 大小标准))。174.实施方式171至173中任一项的盒,其中对于每组腔室, 腔室(b)包含或者预先装载有一定量的磁响应颗粒,所述量被选择 用于控制分离出的核酸的量。175.实施方式171至174中任一项的盒,其中对于每组腔室:腔室(a)、腔室(b)、腔室(c)和腔室(d)中的每个腔室在 所述盒与所述盒模块的接合之前封闭并流体隔离;并且对于腔室(a)、腔室(b)、腔室(c)和腔室(d)中的每个腔 室,所述盒与所述盒模块的接合创造出流体流动路径,该流体流动路 径包含与所述腔室的第一端口流体连通的流体通道、所述腔室以及与 所述腔室的第二端口流体连通的流体通道。176.实施方式170至175中任一项的盒,其中每组腔室包含:用于接收样品的腔室;以及用于扩增(例如,通过pcr来扩增)经分离的核酸的一个或多个 选定的核苷酸序列的腔室。177.实施方式176的盒,其中所述样品腔室配置用于接收纤维 素基底(例如,fta纸)或拭子(例如,棉签或毛刷拭子)。178.实施方式176或177的盒,其中所述样品腔室还配置用于 从所述样品提取核酸。179.实施方式176至178中任一项的盒,其中所述核酸扩增腔 室还配置用于借助于加热与冷却装置(例如,珀尔帖加热与冷却元件), 利用热循环来进行核酸扩增。180.实施方式179的盒,还包括导热元件,该导热元件配置用 于向每组腔室中的核酸扩增腔室施加或分布热量和冷却。181.实施方式180的盒,其中所述导热元件安设在每组腔室中 的核酸扩增腔室上。
182.实施方式171至181中任一项的盒,其还包括与每组腔室 中的腔室(b)和/或核酸扩增腔室相邻的磁场源(例如,磁体)。183.实施方式176至182中任一项的盒,其中每组腔室还包括 含有用于扩增一个或多个选定的核苷酸序列的试剂的腔室。184.实施方式183的盒,其中对于每组腔室,所述扩增试剂腔 室预先装载有用于扩增一个或多个选定的核苷酸序列的试剂。185.实施方式183或184的盒,其中用于扩增一个或多个选定 的核苷酸序列的试剂包含dna聚合酶(例如,taq聚合酶)、一对 或多对用于扩增所述一个或多个选定的核苷酸序列的正向引物和反 向引物、脱氧核糖核苷三磷酸以及可选的金属盐(例如,氯化镁), 并且其中所述一对或多对正向引物和反向引物可选地用染料(例如, 荧光染料)标记。186.实施方式183至185中任一项的盒,其中对于每组腔室, 所述扩增试剂腔室在传送机构的致动(例如,柱塞下推以打破所述扩 增试剂腔室的底部处的密封)时与所述核酸扩增腔室流体连通。187.实施方式183至186中任一项的盒,其中用于扩增一个或 多个选定的核苷酸序列的试剂经由不包含阀的通道而传送至所述核 酸扩增腔室。188.实施方式183至187中任一项的盒,其中对于不包含或者 将不包含样品的一组腔室,所述扩增试剂腔室还包含或者还预先装载 有阳性对照(例如,纯化基因组dna)。189.实施方式171至188中任一项的盒,其中对于所有的所述 一组或多组腔室,所有的腔室(a)、腔室(b)、腔室(c)和腔室 (d)、所述一个或多个样品腔室和所述一个或多个核酸扩增腔室以 及可选的所述一个或多个扩增试剂腔室全都基本上共面。190.实施方式170至189中任一项的盒,其包括用于每组腔室 和流体通道的分离通道。191.实施方式190的盒,其还包括:一个或多个加热元件,配置用于在分离期间或者在分离之前和在 此期间施加热量以使扩增产物变性;以及热控装置,配置用于控制所述扩增产物的加热。192.实施方式159至191中任一项的盒,其中对于每组腔室, 每个所述腔室可为宏观流体腔室或微流体腔室。193.实施方式159至192中任一项的盒,其中每组腔室和流体 通道中的一个或多个或者所有的流体通道包含一个或多个阀。194.实施方式193的盒,其中所述一个或多个阀中的一个或多 个或者所有的阀为隔膜阀。195.实施方式194的盒,其中所述隔膜阀包含常开阀或常闭阀, 或者同时包含常开阀和常闭阀。196.实施方式195的盒,其中常开隔膜阀被包含在包括流体层、 气动层和夹在所述流体层与所述气动层之间的弹性层的组合之中,并 且其中所述常开隔膜阀包含:(a)隔膜,其位于所述弹性层中并且由弹性体材料(例如,聚二 甲基硅氧烷(pdms))构成;(b)阀座,其位于所述流体层中并且从所述流体层的表面凹陷 (例如,阀座具有相
对于所述流体层的表面的凹形),使得所述隔膜 除在所述隔膜上施加正压的情况之外不关闭所述隔膜阀;以及(c)阀入口和阀出口,位于所述流体层中并且与流体通道流体连 通;其中所述隔膜由经由所述气动层中的气动导管传递到所述隔膜 的正压或负压来致动。197.实施方式193至196中任一项的盒,其中所述一个或多个 阀中的一个或多个或者所有的阀为气动致动阀。198.实施方式193至197中任一项的盒,其中所述一个或多个 阀中的一个或多个或者所有的阀为电致动阀。199.实施方式159至198中任一项的盒,其中每组腔室和流体 通道中的一个或多个或者所有的流体通道包含一个或多个泵。200.实施方式199的盒,其中所述一个或多个泵中的一个或多 个或者所有的泵包含多个(例如,3个或4个)泵(例如,隔膜泵)。201.实施方式159至200中任一项的盒,其包括4组、8组、10 组、16组、24组、32组、40组、48组或更多组腔室和流体通道,其 中每组腔室和流体通道可用于运行不同的样品,或者一组或多组腔室 和流体通道可用于运行不同的对照(例如,等位基因标准物、阳性对 照或阴性对照)并且每一其他组腔室和流体通道可用于运行不同的样 品。202.实施方式201的盒,其中:第一组腔室包含等位基因标准物和大小标准;第二组腔室包含阳性对照和大小标准;第三组腔室包含阴性对照和大小标准;并且每一其他组腔室包含不同的样品和大小标准。203.实施方式159至202中任一项的盒,其中每组腔室和流体 通道中的一个或多个或者所有的流体通道为微流体通道。204.实施方式159至203中任一项的盒,其可配置用于单次使 用或多次使用。205.实施方式159至204中任一项的盒,其还包括可读和/或可 写存储器装置(例如,eeprom存储器芯片),该可读和/或可写存 储器装置配置用于存储、接收和/或传输与盒有关的信息(例如,与盒 的历史、建议使用期限、当前使用(例如,盒是否可操作地与盒模块 相接合、从用户输入的信息以及/或者由在操作中利用到盒的系统/仪 器所生成的信息)、配置、条件、物理特征和/或化学特征有关的信息)。206.实施方式159至205中任一项的盒,其中当所述盒与所述 盒模块相接合时,所述盒的纵轴线相对于与包含所述盒模块的系统所 处于的表面的平面垂直的垂直面成约15
‑
45度、20
‑
40度或25
‑
35度或 者约30度的角度。207.实施方式159至206中任一项的盒,其为样品盒或对照盒。208.实施方式159至207中任一项的盒,其中在不添加任何样 品或试剂的情况下,所述盒按质量计的至少约50%、60%、70%、80%、 90%、95%或99%由一种或多种聚合物材料(例如,一种或多种塑料, 诸如聚烯烃(例如,聚丙烯)以及/或者环烯烃均聚物或共聚物(例如, 1060r))构成。209.实施方式208的盒,其中所述盒的框架(包括外侧部分)、 腔室、流体通道以及
阀(例如,常开阀和/或常闭阀)的流体层和气动 层由一种或多种聚合物材料(例如,一种或多种塑料,诸如聚烯烃(例 如,聚丙烯)以及/或者环烯烃均聚物或共聚物(例如,1060r)) 形成。210.实施方式208或209的盒,其中所述盒按质量计的至少约 50%、75%、90%或95%通过注射模塑制成。211.一种盒,包括:(a)框架;(b)样品容器,其包含多个样品腔室,其中所述样品容器可为所述框架的一部分,或者可附接至 所述框架的第一面,并且其中每个样品腔室配置用于接收不同的样品;(c)试剂容器,其附接至所述框架的所述第一面,其中该试剂容 器包含针对每个样品腔室的多个试剂腔室;(d)反应容器,其附接至所述框架的所述第一面,其中该反应 容器包含多个反应腔室,针对每个样品腔室有一个反应腔室;以及(e)流体装置,其附接至所述框架的相对面,其中该流体装置针 对每组样品腔室、试剂腔室和反应腔室包含多个流体通道、用于调控 经由所述流体通道向和从所述腔室的流体流动的多个阀,以及用于所 述流体通道与所述腔室的流体连通的多个端口;其中:每个所述样品腔室通过所述流体装置的端口而与所述流体装置 中的流体通道流体连通;对于每组样品腔室、试剂腔室、反应腔室和流体通道,每个所述 试剂腔室在所述试剂容器与所述流体装置的接合之前封闭并且与每 一其他腔室和与所述流体通道流体隔离;每个所述反应腔室通过所述流体装置的端口而与所述流体装置 中的流体通道流体连通;并且每组样品腔室、试剂腔室、反应腔室和流体通道在所述试剂容器 与所述流体装置的接合之前和之后与每一其他组样品腔室、试剂腔室、 反应腔室和流体通道流体隔离。212.实施方式211的盒,其中所述多个样品腔室中的每个样品 腔室为所述盒的所述框架的一部分。213.实施方式211或212的盒,其中所述框架的所述第一面包 含用于与所述试剂容器和所述反应容器配合的插槽或其他装置,并且 如果所述样品容器不为所述框架的一部分,则还包含用于与所述样品 容器配合的插槽或其他装置。214.实施方式211至213中任一项的盒,其中对于每组样品腔 室、试剂腔室、反应腔室和流体通道,所述试剂容器与所述流体装置 的接合使所述腔室经由所述流体通道而彼此流体连通。215.实施方式211至214中任一项的盒,其中对于每组腔室和 流体通道中的所述封闭的且流体隔离的试剂腔室中的每个试剂腔室, 所述试剂容器与所述流体装置的接合创造出流体流动路径,该流体流 动路径包含与所述腔室的第一端口流体连通的流体通道、
所述腔室以 及与所述腔室的第二端口流体连通的流体通道。216.实施方式215的盒,其中每组腔室中的每个所述试剂腔室 的所述第一端口和所述第二端口基本上处于同一平面、处于同一表面 或处于所述腔室的基部或底部,或者其任何组合。217.实施方式211至216中任一项的盒,其中对于每组腔室, 每个所述试剂腔室在所述试剂容器与所述流体装置的接合之前借助 于易碎或可刺穿密封而封闭并流体隔离。218.实施方式217的盒,其中当所述试剂容器与所述流体装置 相接合时,所述流体装置上的两个穿刺元件刺穿每个所述试剂腔室的 所述易碎或可刺穿密封,从而创造出流体流动路径,该流体流动路径 包含与所述腔室的第一端口流体连通的流体通道、所述腔室以及与所 述腔室的第二端口流体连通的流体通道。219.实施方式218的盒,其中每个穿刺元件具有开口,该开口 与流体通道流体连通。220.实施方式211至219中任一项的盒,其中当所述盒由盒模 块所接收并与之相接合时,所述试剂容器变为与所述流体装置相接合。221.实施方式220的盒,其中当所述盒与所述盒模块相接合时, 所述盒的纵轴线相对于与包含所述盒模块的系统所处于的表面的平 面垂直的垂直面成约15
‑
45度、20
‑
40度或25
‑
35度或者约30度的角 度。222.实施方式211至221中任一项的盒,其中所述流体装置包 含针对每组腔室和流体通道的一个或多个端口,所述一个或多个端口 使每组中的腔室经由流体通道而与正压源或负压源流体连通。223.实施方式211至222中任一项的盒,其中每组腔室和流体 通道中的流体通道的路径基本上平行于并且/或者不与每一其他组腔 室和流体通道中的流体通道的路径相交。224.实施方式211至223中任一项的盒,其中对于每组腔室, 所述试剂容器中的所述多个试剂腔室包含:(a)包含(例如,预先装载有)用于从样品提取核酸的处于溶液 或缓冲液中的试剂(例如,裂解试剂)并且可选地包含(例如,预先 装载有)消泡试剂的腔室;(b)包含(例如,预先装载有)用于分离提取出的核酸的、可 选地处于溶液或缓冲液中的基底(例如,磁响应颗粒)的腔室;(c)包含(例如,预先装载有)用于纯化经分离的核酸的溶液(例 如,洗涤溶液或缓冲液)的一个或多个(例如,两个)腔室;以及(d)包含(例如,预先装载有)用于在扩增产物的分离(例如, 通过电泳来分离)之前稀释扩增产物的溶液(例如,水)的腔室。225.实施方式224的盒,其中对于每组腔室:腔室(a)配置用于接收和/或储存废料;并且腔室(d)可选地还包括(例如,可选地还预先装载有)对照(例 如,包含样品的一组腔室中的大小标准,或者不含样品的一组腔室中 的等位基因标准物(以及可选地,大小标准))。226.实施方式224或225的盒,其中对于每组腔室,腔室(b) 包含(例如,预先装载
有)一定量的磁响应颗粒,所述量被选择用于 控制分离出的核酸的量。227.实施方式211至226中任一项的盒,其中每个样品腔室还 配置用于从样品提取核酸。228.实施方式211至227中任一项的盒,其中所述多个反应腔 室中的每个反应腔室配置用于进行化学反应或生化反应。229.实施方式228的盒,其中每个所述反应腔室配置用于扩增 经分离的核酸的一个或多个选定的核苷酸序列(例如,通过pcr,诸 如等温pcr或涉及热循环的pcr)。230.实施方式211至229中任一项的盒,其中所述反应容器还 包含导热元件,该导热元件配置用于向每个所述反应腔室施加或分布 热量和冷却。231.实施方式230的盒,其中所述导热元件安设在每个所述反 应腔室上。232.实施方式224至231中任一项的盒,其还包括与每组腔室 中的腔室(b)和/或反应腔室相邻的磁场源(例如,磁体)。233.实施方式211至232中任一项的盒,其中针对每个反应腔 室,所述反应容器还包含含有(例如,预先装载有)用于进行化学反 应或生化反应(例如,用于扩增一个或多个选定的核苷酸序列)的试 剂的腔室。234.实施方式233的盒,其中所述用于扩增一个或多个选定的 核苷酸序列的试剂包含dna聚合酶(例如,taq聚合酶)、一对或 多对用于扩增所述一个或多个选定的核苷酸序列的正向引物和反向 引物、脱氧核糖核苷三磷酸以及可选的金属盐(例如,氯化镁),并 且其中所述一对或多对正向引物和反向引物可选地用染料(例如,荧 光染料)标记。235.实施方式233或234的盒,其中对于每组腔室,所述反应 试剂腔室在传送机构的致动(例如,柱塞下推以打破所述反应试剂腔 室的底部处的密封)时与所述反应腔室流体连通。236.实施方式233至235中任一项的盒,其中对于每组腔室, 所述用于进行化学反应或生化反应(例如,用于扩增一个或多个选定 的核苷酸序列)的试剂经由不包含阀的通道传送到所述反应腔室。237.实施方式233至236中任一项的盒,其中对于不包含(或 者将不包含)样品的一组腔室,所述反应试剂腔室还包含(例如,还 预先装载有)阳性对照(例如,纯化基因组dna)。238.实施方式224至237中任一项的盒,其中对于所述多组腔 室中的所有腔室,所有的腔室(a)、腔室(b)、腔室(c)和腔室 (d)、所述样品腔室和所述反应腔室以及可选的所述反应试剂腔室 全都基本上共面。239.实施方式211至238中任一项的盒,其中对于每组腔室, 每个腔室可为宏观流体腔室或微流体腔室。240.实施方式211至239中任一项的盒,其中对于每组腔室和 流体通道,所述多个阀中的一个或多个或者所有的阀为隔膜阀。241.实施方式240的盒,其中每个隔膜阀可为常开式或常闭式。242.实施方式211至241中任一项的盒,其中对于每组腔室和 流体通道,每个所述阀可为气动致动式或电致动式。243.实施方式211至242中任一项的盒,其中对于每组腔室和 流体通道,所述流体
装置还包含一个或多个泵。244.实施方式243的盒,其中对于每组腔室和流体通道,所述 一个或多个泵中的一个或多个或者所有的泵包含多个(例如,3个或 4个)阀(例如,隔膜阀)。245.实施方式211至244中任一项的盒,其包括4组、8组、10 组、16组、24组、32组、40组、48组或更多组腔室和流体通道,其 中每组腔室和流体通道可用于运行不同的样品,或者一组或多组腔室 和流体通道可用于运行不同的对照(例如,等位基因标准物、阳性对 照或阴性对照)并且每一其他组腔室和流体通道可用于运行不同的样 品。246.实施方式245的盒,其中:第一组腔室包含等位基因标准物和大小标准;第二组腔室包含阳性对照和大小标准;第三组腔室包含阴性对照和大小标准;并且每一其他组腔室包含不同的样品和大小标准。247.实施方式211至246中任一项的盒,其中所述流体装置为 微流体装置,并且每组腔室和流体通道中的一个或多个或者所有的流 体通道为微流体通道。248.实施方式211至247中任一项的盒,其可配置用于单次使 用或多次使用。249.实施方式211至248中任一项的盒,其还包括可读和/或可 写存储器装置(例如,eeprom存储器芯片),该可读和/或可写存 储器装置配置用于存储、接收和/或传输与盒有关的信息(例如,与盒 的历史、建议使用期限、当前使用(例如,盒是否可操作地与盒模块 相接合、从用户输入的信息以及/或者由在操作中利用到盒的系统/仪 器所生成的信息)、配置、条件、物理特征和/或化学特征有关的信息)。250.实施方式211至249中任一项的盒,其为样品盒或对照盒。251.实施方式211至250中任一项的盒,其中在不添加任何样 品或试剂的情况下,所述盒按质量计的至少约50%、60%、70%、80%、 90%、95%或99%由一种或多种聚合物材料(例如,一种或多种塑料, 诸如聚烯烃(例如,聚丙烯)以及/或者环烯烃均聚物或共聚物(例如, 1060r))构成。252.实施方式251的盒,其中所述框架、所述样品容器、所述 试剂容器、所述反应容器以及所述流体装置由一种或多种聚合物材料 (例如,一种或多种塑料,诸如聚烯烃(例如,聚丙烯)以及/或者环 烯烃均聚物或共聚物(例如,1060r))形成。253.实施方式251或252的盒,其中所述盒按质量计的至少约 50%、75%、90%或95%通过注射模塑制成。254.一种盒模块,包括:盒贮器,其配置用于接收和保持盒,所述盒包含多个腔室以及用 于调控向和从所述多个腔室的流体流动的多个阀;第一组装件,其包含第一压力歧管,该第一压力歧管配置用于接 合所述盒的第一面,并从而使所述多个腔室与正压源或负压源流体连 通;第二组装件,其包含第二压力歧管,该第二压力歧管配置用于接 合所述盒的第二面,并从而使所述多个阀与用于阀的气动致动的正压 源或负压源流体连通;以及移动构件,其配置用于将所述第一压力歧管和/或所述第二压力歧 管移向或移离被保持在所述盒贮器中的盒。
255.实施方式254的盒模块,其中所述移动构件包含气动(例 如,空气驱动)活塞,该活塞的移动将所述第一压力歧管和/或所述第 二压力歧管移向或移离被保持在所述盒贮器中的盒。256.实施方式254或255的盒模块,还包括存储器装置(例如,eeprom)读取器。257.实施方式254至256中任一项的盒模块,其中所述盒为实 施方式159至210中任一项的盒或者实施方式211至253中任一项的 盒。258.实施方式254至257中任一项的盒模块,其中所述盒贮器 配置用于接收和保持样品盒或对照盒。259.实施方式254至258中任一项的盒模块,其包括被配置用 于接收和保持多个盒的多个盒贮器。260.一种盒模块,包括:盒贮器,其配置用于接收和保持盒;以及多个管道,其中所述多个管道中的每个管道独立地受压力驱动, 并且配置用于与被保持在所述盒贮器中的盒的多个端口中的一个端 口密封地接合,并且其中管道的末端与端口的接合在所述端口与所述 管道的未接合末端之间创造出流体连通。261.实施方式260的盒模块,其中所述盒贮器被配置成插槽。262.实施方式260或261的盒模块,其中所述多个管道中的两 个或更多个或者所有的管道是独立弹簧偏置(或弹簧加载)的。263.实施方式260至262中任一项的盒模块,其中所述多个端 口与盒中的流体(例如,微流体)通道连通。264.实施方式260至263中任一项的盒模块,其中所述盒包含 流体(例如,微流体)装置,并且其中所述多个管道接合位于所述流 体装置的不同的(例如,相对的)面(例如,流体面和气动面)上的 端口。265.实施方式264的盒模块,其中所述流体装置包含流体通道 和气动通道,并且其中所述多个管道接合与所述流体通道流体连通的 端口和与所述气动通道流体连通的端口。266.实施方式260至265中任一项的盒模块,其中所述多个管 道配置用于向与所述多个端口流体连通的所述盒中的导管传递正压 或负压。267.实施方式260至266中任一项的盒模块,其中所述多个管 道配置用于将流体(例如,液体或气体)传入和/或传出与所述多个端 口流体连通的所述盒中的导管。268.实施方式260至267中任一项的盒模块,还包括存储器装 置(例如,eeprom)读取器。269.实施方式260至268中任一项的盒模块,其中所述盒为实 施方式159至210中任一项的盒或者实施方式211至253中任一项的 盒。270.实施方式260至269中任一项的盒模块,其中所述盒贮器 配置用于接收和保持样品盒或对照盒。271.实施方式260至270中任一项的盒模块,其包括配置用于 接收和保持多个盒的多个盒贮器。272.一种用于进行样品的遗传分析的集成的和自动化的系统, 包括:
(a)分离模块,配置用于从样品分离核酸(例如,dna);(b)扩增模块,配置用于扩增经分离的核酸的一个或多个选定 的核苷酸序列,以产生扩增产物;(c)分离与检测模块,配置用于分离和检测所述扩增产物;(d)分析模块,配置用于分析检测到的扩增产物,其中所述分 析模块包含存储器和执行代码的处理器,该代码识别一个经扩增核苷 酸序列的等位基因,或者多个经扩增核苷酸序列中的至少一个或所有 的核苷酸序列的等位基因;(e)盒模块,配置用于接收和接合盒;以及(f)由所述盒模块所接收的盒;其中:所述分离模块和所述扩增模块为所述盒的一部分;所述盒包含腔室,所述腔室在所述盒与所述盒模块相接合时经由 流体通道而彼此流体连通;并且对于所述腔室中的一个或多个或者所有的腔室,所述盒与所述盒 模块的接合创造出流体流动路径,该流体流动路径包含与腔室的第一 端口流体连通的流体通道、所述腔室以及与该腔室的第二端口流体连 通的流体通道。273.实施方式272的系统,其中所述盒还包含阀(例如,隔膜 阀),所述阀调控试剂和/或流体经由所述流体通道向和从所述腔室的 移动。274.实施方式272或273的系统,其中所述分离模块还配置用 于从样品提取核酸以及用于通过将提取出的核酸捕获至基底(例如, 磁响应颗粒)而分离提取出的核酸。275.实施方式272至274中任一项的系统,其中所述分离模块 还配置用于纯化经分离的核酸。276.实施方式272至275中任一项的系统,其中所述扩增模块 配置用于通过聚合酶链反应(pcr)来扩增经分离的核酸的一个或多 个选定的核苷酸序列。277.实施方式272至276中任一项的系统,其中所述扩增模块 或所述系统的另一组件(例如,盒模块)包含加热与冷却装置(例如, 珀尔帖加热与冷却元件),该加热与冷却装置配置用于进行热循环以 供扩增经分离的核酸的一个或多个选定的核苷酸序列(例如,通过 pcr)。278.实施方式277的系统,其中所述盒和/或所述加热与冷却装 置配置用于进行移动以使得从中扩增一个或多个选定的核苷酸序列 的腔室在热循环期间与所述加热与冷却装置相接触或者变得与之相 邻(例如,经由接触到所述腔室的导热元件)。279.实施方式272至278中任一项的系统,其中所述扩增模块 配置用于扩增经分离的核酸的一个或多个选定的短串联重复(str) 基因座。280.实施方式279的系统,其中所述一个或多个选定的str基 因座包括在法医数据库(例如,codis)中利用到的至少5个str 基因座。281.实施方式280的系统,其中所述一个或多个选定的str基 因座包括在codis中利用到的所有的str基因座(例如,csf1po、 d3s1358、d5s818、d7s820、d8s1179、d13s317、d16s539、d18s51、 d21s11、fga、th01、tpox和vwa)。282.实施方式279至281中任一项的系统,其中所述一个或多 个选定的核苷酸序
列还包括penta d、penta e和牙釉蛋白。283.实施方式272至282中任一项的系统,其中所述盒包含:(a)包含用于从样品提取核酸的处于溶液或缓冲液中的试剂(例 如,裂解试剂)并且可选地包含消泡试剂的腔室;(b)包含用于分离提取出的核酸的、可选地处于溶液或缓冲液 中的基底(例如,磁响应颗粒)的腔室;(c)包含用于纯化经分离的核酸的溶液(例如,洗涤溶液或缓冲 液)的一个或多个(例如,两个)腔室;以及(d)包含用于在扩增产物的分离之前稀释扩增产物的溶液(例 如,水)的腔室。284.实施方式283的系统,其中:腔室(a)配置用于接收和/或储存废料;并且腔室(d)可选地包括溶液中的对照(例如,运行样品的泳道中 的大小标准,或者不运行样品的泳道中的等位基因标准物(以及可选 地,大小标准))。285.实施方式283或284的系统,其中:腔室(a)、腔室(b)、腔室(c)和腔室(d)中的每个腔室在 所述盒与所述盒模块的接合之前封闭并流体隔离;并且对于腔室(a)、腔室(b)、腔室(c)和腔室(d)中的每个腔 室,所述盒与所述盒模块的接合创造出流体流动路径,该流体流动路 径包含与所述腔室的第一端口流体连通的流体通道、所述腔室以及与 所述腔室的第二端口流体连通的流体通道。286.实施方式285的系统,其中腔室(a)、腔室(b)、腔室(c) 和腔室(d)中的每个腔室的所述第一端口和所述第二端口基本上处 于同一平面、处于同一表面或处于所述腔室的基部或底部,或者其任 何组合。287.实施方式272至286中任一项的系统,其中所述盒包含:配置用于接收样品的腔室;以及配置用于扩增(例如,通过pcr)经分离的核酸的一个或多个选 定的核苷酸序列的腔室。288.实施方式287的系统,其中所述样品腔室还配置用于从样 品提取核酸。289.实施方式287或288的系统,其中所述盒还包含含有用于 扩增所述一个或多个选定的核苷酸序列的试剂的腔室。290.实施方式289的系统,其中所述用于扩增所述一个或多个 选定的核苷酸序列的试剂经由不包含阀的通道而传送到所述核酸扩 增腔室。291.实施方式272至290中任一项的系统,其中所述分离与检 测模块配置用于通过电泳(例如,毛细管电泳)来分离所述扩增产物。292.实施方式272至291中任一项的系统,其中所述分离与检 测模块包含:一个或多个加热元件,配置用于在分离期间施加热量以使所述扩 增产物变性;以及热控装置,配置用于控制所述扩增产物的加热。293.实施方式272至292中任一项的系统,其中所述扩增产物 在作为所述盒的一部分的分离通道(例如,毛细管)中得到分离。
294.实施方式272至292中任一项的系统,其中所述扩增产物 在不作为所述盒的一部分的分离通道(例如,毛细管)中得到分离。295.实施方式293或294的系统,其中在将扩增产物引入(例 如,注射到)所述分离通道中之前通过变性加热器来加热所述扩增产 物。296.实施方式293至295中任一项的系统,其中所述分离与检 测模块还配置用于通过场放大堆积或者通过在电泳组装件的流体导 管(例如,电泳样品通道)中所述扩增产物的下游放置具有不同电导 率的材料(例如,空气)团块来制备所述扩增产物以供注射到所述分 离通道之中。297.实施方式272至296中任一项的系统,其中所述流体通道 中的一个或多个或者所有的流体通道为微流体通道。298.实施方式272至297中任一项的系统,其中所述盒还包含 可读和/或可写存储器装置(例如,eeprom存储器芯片),该可读 和/或可写存储器装置配置用于存储、接收和/或传输与盒有关的信息 (例如,与盒的历史、建议使用期限、当前使用(例如,盒是否可操 作地与盒模块相接合、从用户输入的信息以及/或者由所述系统在操作 中所生成的信息)、配置、条件、物理特征和/或化学特征有关的信息)。299.实施方式272至298中任一项的系统,其中当所述盒与所 述盒模块相接合时,所述盒的纵轴线相对于与所述系统所处于的表面 的平面垂直的垂直面成约15
‑
45度、20
‑
40度或25
‑
35度或者约30度 的角度。300.实施方式272至299中任一项的系统,其中所述盒可配置 用于单次使用或多次使用。301.实施方式272至300中任一项的系统,其中所述盒为实施 方式159至210中任一项的盒或者实施方式211至253中任一项的盒。302.实施方式272至301中任一项的系统,其中所述分析模块 的处理器还执行确定核酸来源与遗传谱被存储在数据库(例如, codis)中的个体之间匹配的可能性的代码。303.实施方式272至302中任一项的系统,其中所述分析模块 的处理器还执行确定核酸来源与另一个体之间的遗传关系(例如,血 缘关系)的可能性的代码。304.实施方式272至303中任一项的系统,其中所述分析模块 还配置用于将遗传分析的结果(例如,原始数据、解析数据、核酸来 源的遗传谱、核酸来源与个体之间匹配的可能性、或核酸来源与另一 个体之间遗传关系的可能性,或者其任何组合)传输到内部数据库和 /或外部数据库(例如,由执法人员使用的数据库)。305.实施方式272至304中任一项的系统,其还包括具有图形 用户界面(gui)的显示器,其中该gui允许用户进行样品的遗传分 析、控制系统的操作、查看遗传分析的结果(例如,电泳图)以及处 置(例如,传输)遗传分析的结果。306.实施方式272至305中任一项的系统,其能够在用于进行 样品的遗传分析的流程开始之后的约2小时、1.5小时或1小时内识 别一个经扩增核苷酸序列的等位基因,或者识别多个经扩增核苷酸序 列中的至少一个或所有的核苷酸序列的等位基因(例如,用于人类身 份识别和/或血缘关系分析),确定核酸来源与个体之间匹配的可能性, 或者确定核酸来源与另一个体之间遗传关系的可能性,或者其任何组 合。307.实施方式272至306中任一项的系统,其能够以不大于约 10%、5%或1%的变
异系数和/或以至少约90%、95%或99%的准确度 来进行遗传分析(例如,用于人类身份识别和/或血缘关系确定的str 分析)。308.实施方式272至307中任一项的系统,其具有约10ft3或更 小的体积。309.一种进行样品的遗传分析的方法,包括:从样品分离核酸(例如,dna);扩增经分离的核酸的一个或多个选定的核苷酸序列,以产生扩增 产物;分离和检测该扩增产物;以及分析检测到的扩增产物,以识别一个经扩增核苷酸序列的等位基 因或者多个经扩增核苷酸序列中的至少一个或所有的核苷酸序列的 等位基因;其中:所述方法在约2小时内完成;所述方法使用集成的和自动化的系统来执行,该系统包含被配置 用于接收和接合盒的盒模块;所述分离和所述扩增使用盒来执行,该盒包含当所述盒与所述盒 模块相接合时经由流体通道而彼此流体连通的腔室;并且对于所述腔室中的一个或多个或者所有的腔室,所述盒与所述盒 模块的接合创造出流体流动路径,该流体流动路径包含与腔室的第一 端口流体连通的流体通道、所述腔室以及与该腔室的第二端口流体连 通的流体通道。310.实施方式309的方法,还包括:在分离核酸之前从所述样品提取核酸;以及在扩增经分离的核酸的一个或多个选定的核苷酸序列之前纯化 经分离的核酸。311.实施方式310的方法,其中从样品提取核酸是利用伴有气 体(例如,空气)泡的搅拌来进行的,并且/或者纯化经分离的核酸(例 如,洗涤被捕获到磁响应颗粒的核酸)是利用伴有气体(例如,空气) 泡的搅拌来进行的。312.实施方式309至311中任一项的方法,还包括在分离扩增 产物之前稀释所述扩增产物。313.实施方式309至312中任一项的方法,其中分离核酸是通 过将核酸捕获至基底来进行的。314.实施方式313的方法,其中捕获基底包含磁响应颗粒。315.实施方式314的方法,还包括通过控制所使用的磁响应颗 粒的量来控制分离的核酸的量。316.实施方式309至315中任一项的方法,其中扩增经分离的 核酸的一个或多个选定的核苷酸序列是通过聚合酶链反应(pcr)来 进行的。317.实施方式309至316中任一项的方法,其中扩增(例如, 通过pcr)经分离的核酸的一个或多个选定的核苷酸序列包括借助于 加热与冷却装置(例如,珀尔帖加热与冷却元件)来进行热循环。318.实施方式309至317中任一项的方法,其中对经分离的核 酸的一个或多个选定的短串联重复(str)基因座进行扩增。319.实施方式318的方法,其中对在法医数据库(例如,codis) 中利用到的至少5
个str基因座进行扩增。320.实施方式319的方法,其中对在codis中利用到的所有的 str基因座(例如,csf1po、d3s1358、d5s818、d7s820、d8s1179、 d13s317、d16s539、d18s51、d21s11、fga、th01、tpox和vwa) 进行扩增。321.实施方式318至320中任一项的方法,其中被扩增的所述 一个或多个选定的核苷酸序列还包括penta d、penta e和牙釉蛋白。322.实施方式309至321中任一项的方法,其中所述盒包含:(a)包含用于从样品提取核酸的处于溶液或缓冲液中的试剂(例 如,裂解试剂)并且可选地包含消泡试剂的腔室;(b)包含用于分离提取出的核酸的、可选地处于溶液或缓冲液 中的基底(例如,磁响应颗粒)的腔室;(c)包含用于纯化经分离的核酸的溶液(例如,洗涤溶液或缓冲 液)的一个或多个(例如,两个)腔室;以及(d)包含用于在扩增产物的分离之前稀释扩增产物的溶液(例 如,水)的腔室。323.实施方式322的方法,其中:腔室(a)配置用于接收和/或储存废料;并且腔室(d)可选地还包括溶液中的对照(例如,运行样品的泳道 中的大小标准,或者不运行样品的泳道中的等位基因标准物(以及可 选地,大小标准))。324.实施方式322或323的方法,其中:腔室(a)、腔室(b)、腔室(c)和腔室(d)中的每个腔室在 所述盒与所述盒模块的接合之前封闭并流体隔离;并且对于腔室(a)、腔室(b)、腔室(c)和腔室(d)中的每个腔 室,所述盒与所述盒模块的接合创造出流体流动路径,该流体流动路 径包含与所述腔室的第一端口流体连通的流体通道、所述腔室以及与 所述腔室的第二端口流体连通的流体通道。325.实施方式324的方法,其中腔室(a)、腔室(b)、腔室(c) 和腔室(d)中的每个腔室的所述第一端口和所述第二端口基本上处 于同一平面、处于同一表面或处于所述腔室的基部或底部,或者其任 何组合。326.实施方式309至325中任一项的方法,其中所述盒包含:配置用于接收样品的腔室;以及配置用于扩增经分离的核酸的一个或多个选定的核苷酸序列的 腔室。327.实施方式326的方法,其中所述样品腔室还配置用于从样 品提取核酸。328.实施方式326或327的方法,其中所述盒还包含含有用于 扩增所述一个或多个选定的核苷酸序列的试剂的腔室。329.实施方式309至328中任一项的方法,其中分离所述扩增 产物是通过电泳(例如,毛细管电泳)来进行的。330.实施方式309至329中任一项的方法,其中在分离期间或 者在分离之前和在此期间通过施加热量而使所述扩增产物变性。331.实施方式309至330中任一项的方法,其中所述扩增产物 在作为所述盒的一部分的分离通道(例如,毛细管)中得到分离。
332.实施方式309至330中任一项的方法,其中所述扩增产物 在不作为所述盒的一部分的分离通道(例如,毛细管)中得到分离。333.实施方式329至332中任一项的方法,还包括通过场放大 堆积(fas)来制备所述扩增产物以供引入(例如,注射)到分离通 道之中,其中fas是通过在电泳样品通道中的包含较高盐浓度或较 高离子强度的电泳缓冲液的区域之间放置包含较低盐浓度或较低离 子强度的扩增产物的经稀释混合物来进行的。334.实施方式309至333中任一项的方法,其中所述流体通道 中的一个或多个或者所有的流体通道为微流体通道。335.实施方式309至334中任一项的方法,其使用实施方式159 至210中任一项的盒或者实施方式211至253中任一项的盒来执行。336.实施方式309至335中任一项的方法,还包括确定核酸来 源与其遗传谱存储于数据库(例如,codis)中的个体之间匹配的可 能性。337.实施方式309至336中任一项的方法,还包括确定核酸来 源与另一个体之间遗传关系(例如,血缘关系)的可能性。338.实施方式309至337中任一项的方法,还包括将遗传分析 的结果(例如,原始数据、解析数据、核酸来源的遗传谱、核酸来源 与个体之间匹配的可能性、或核酸来源与另一个体之间遗传关系的可 能性,或者其任何组合)传输到内部数据库和/或外部数据库(例如, 由执法人员使用的数据库)。339.实施方式309至338中任一项的方法,其在约1.5小时或约 1小时内完成。340.实施方式309至339中任一项的方法,其以不大于约10%、 5%或1%的变异系数和/或以至少约90%、95%或99%的准确度来执行。341.实施方式309至340中任一项的方法,其使用实施方式272 至308中任一项的集成的和自动化的系统来执行。342.一种定位样品/分析物以供注射到分离通道中的方法,包括:(i)提供电泳组装件,其包含:(a)流体导管(例如,样品/分析物通道),其具有通道入 口和通道出口;(b)分离通道(例如,电泳毛细管),其具有分离通道入 口和分离通道出口,其中所述分离通道包含导电分离介质(例如,聚合物 或凝胶),并且其中所述分离通道入口与所述流体导管在连接点处 流体连通并且电连通;(c)阳极和阴极,它们限定电路径并且配置用于跨所述分 离通道入口和所述分离通道出口施加电压,其中所述阳极或所述阴极(例如,当所述样品/分析物 为核酸时,是阴极)位于所述流体导管中或者在连接点处或与连接点 相邻处邻近所述流体导管;(d)仪表,其配置用于测量通过所述分离通道的电流或者 跨所述分离通道的电压;(ii)在所述流体导管中的样品/分析物的下游定位材料(例如, 空气)团块,其中所述材料具有与电泳缓冲液或样品/分析物的电导率 不同的电导率;(iii)在所述流体导管中所述分离通道的方向上移动所述材料团 块和所述样品/分析物,同时用所述仪表测量电流或电压;
(iv)用所述仪表检测电流或电压的变化,所述变化对应于所述 材料团块向所述电路径中的移动;以及(v)基于所述检测,将所述样品/分析物向所述电路径中移动。343.实施方式342的方法,还包括:(vi)施加足够的电压量(例如,约3kv至约5kv,或者约4kv), 以将所述样品/分析物注射到所述分离通道中。344.实施方式342或343的方法,其中所述阴极为叉形阴极, 其包含两个或更多个(例如,3个)叉。345.一种用于检测物品的系统,包括:盒,其与盒模块相接合,其中所述盒包含样品贮器,该样品贮器 配置用于接收可选地包含样品的物品;以及检测组装件,其配置用于检测在所述样品贮器中存在或不存在物 品。346.实施方式345的系统,其中所述检测组装件包含传感器, 该传感器配置用于检测响应于在所述样品贮器中存在或不存在物品 而产生的信号(例如,光信号或电信号)。347.实施方式345或346的系统,其中所述检测组装件包含光 源和光检测器,所述光源和光检测器配置成使得由所述光源发出的光 在穿过所述样品贮器的光路上行进,并且其中当在所述样品贮器中不 存在物品时由所述光检测器检测到的光的量或质量不同于当在所述 样品贮器中存在物品时由所述光检测器检测到的光的量或质量。348.实施方式347的系统,其中当在所述样品贮器中存在物品 时,由所述光检测器检测到的光的量与当在所述样品贮器中不存在物 品时由所述光检测器检测到的光的量相比是由所述光检测器检测到 的更少的光或没有光。349.实施方式347或348的系统,其中所述光源为发光二级管 (led)或激光器。350.实施方式346至349中任一项的系统,其中将检测到信号 与否或者检测到的信号(例如,光)的量或质量传达至所述系统的软 件或用户显示器。351.实施方式345至350中任一项的系统,其中所述盒为实施 方式159至210中任一项的盒或者实施方式211至253中任一项的盒。352.一种用于控制样品保管的系统,包括:(a)盒,其包含样品贮器,该样品贮器配置用于接收物品(例如, 拭子),该物品可选地包含样品;(b)盒模块,其具有盒贮器,该盒贮器配置用于接收所述盒;(c)壳体,其封闭所述盒模块和所述盒,其中所述壳体包含可关 闭门;(d)至少一个传感器,其产生信号,该信号指示出:(1)物品向所述样品贮器中的插入或从其的移除;(2)所述盒是否插入到所述盒贮器中;或者(3)所述门是敞开的还是关闭的;以及(e)计算机,其被编程用于在记录时段中记录来自所述至少一个 传感器的信号以及向用户显示信号历史。353.实施方式352的系统,其还包括实施方式345至351中任 一项的检测组装件。354.实施方式352或353的系统,其中所述至少一个传感器包 含可操作地连接至
所述计算机的信号输出端子。355.实施方式352至354中任一项的系统,其中所述计算机包 含如下逻辑,该逻辑从所述信号历史确定:(1)物品是否或何时插入到所述样品贮器中或从所述样品贮器 移除;(2)所述盒是否或何时插入到所述盒贮器中或从所述盒贮器移 除;(3)所述门是否或何时被打开或被关闭。356.实施方式352至355中任一项的系统,其中所述盒模块还 包含存储器装置(例如,eeprom)读取器。357.实施方式352至356中任一项的系统,其中所述盒还包含 可读和/或可写存储器装置(例如,eeprom存储器芯片),该可读 和/或可写存储器装置配置用于存储、接收和/或传输与盒有关的信息 (例如,与盒的历史、建议使用期限、当前使用(例如,盒是否可操 作地与盒模块相接合、从用户输入的信息以及/或者由在操作中利用到 盒的系统/仪器所生成的信息)、配置、条件、物理特征和/或化学特 征有关的信息)。358.实施方式352至357中任一项的系统,其中所述盒为实施 方式159至210中任一项的盒或者实施方式211至253中任一项的盒。359.实施方式352至358中任一项的系统,其中将射频识别(rfid) 标签或2
‑
d条码贴到(例如,永久性地贴到)所述物品的一部分上。360.实施方式359的系统,其中将rfid标签或2
‑
d条码贴到(例 如,永久性地贴到)不会接触所述样品贮器中的试剂或液体的所述物 品的部分(例如,拭子的末端)。361.一种套件,包括:至少一个第一容器,其配置用于接收包含用于分析的分析物的至 少一个样品;以及至少一个第二容器,其包含用于在所述分析物的分析中使用的至 少一种耗材试剂。362.实施方式361的套件,其中所述分析物为生物分子分析物 (例如,包含dna和/或rna核苷酸的多核苷酸、多肽或多糖,或 者其任何组合)。363.实施方式361或362的套件,其包含多个第二容器。364.实施方式361至363中任一项的套件,其中所述至少一个 第一容器中的至少一个或者所述至少一个第二容器中的至少一个是 一次性的。365.实施方式361至364中任一项的套件,其中所述至少一个 第一容器中的所有第一容器或所述至少一个第二容器中的所有第二 容器,或者所述至少一个第一容器中的所有第一容器和所述至少一个 第二容器中的所有第二容器,是一次性的。366.实施方式361至365中任一项的套件,其中所述至少一种 耗材试剂包含用于对所述分析物进行化学反应或生化反应(例如,核 酸扩增)的一种或多种试剂。367.实施方式361至366中任一项的套件,其中所述至少一个 第一容器包含用于在所述分析物的分析中使用的至少一种耗材试剂。368.实施方式361至367中任一项的套件,其中所述至少一种 耗材试剂选自溶液和缓冲液(例如,洗涤溶液和缓冲液、反应溶液和 缓冲液、用于从样品提取分析物的溶液和缓冲液、用于分离分析物(例 如,用于将分析物捕获至磁响应颗粒)的溶液和缓冲液、稀释
溶液和 缓冲液以及电泳溶液和缓冲液)、用于进行化学反应和生化反应的酶 (例如,介导核酸反应的酶,诸如dna聚合酶、rna聚合酶和逆转 录酶)、化学试剂(例如,扩增引物、逆转录引物、标记试剂(例如, 荧光染料)、脱氧核糖核苷三磷酸、核糖核苷三磷酸、裂解试剂、消 泡试剂以及金属盐(例如,氯化镁))和分离介质(例如,用于电泳 的聚合物和凝胶)。369.实施方式361至368中任一项的套件,其包括:(a)多个所述第一容器,其中每个所述第一容器配置用于在单一 分析运行中使用;以及(b)(i)一个第二容器,其中所述第二容器包含至少一种耗材 试剂,该耗材试剂的量足以用于进行与所述第一容器的数目相等的数 目的分析运行;或者(ii)多个所述第二容器,其中每个所述第二容器包含至少 一种耗材试剂,该耗材试剂的量足以用于进行与第一容器的数目相等 的数目的分析运行。370.实施方式361至369中任一项的套件,其中所述至少一个 第一容器中的每个第一容器:配置用于在多个样品贮器中的每个样品贮器中接收不同的样品; 以及包含多个反应腔室,针对每一样品贮器有一个反应腔室,其中每 个反应腔室配置用于对多个不同的样品中的每个样品中所包含的生 物分子分析物进行化学反应或生化反应(例如,核酸扩增)。371.实施方式361至370中任一项的套件,其中所述至少一个 第一容器中的每个第一容器配置用于在使用被配置用于对所述分析 物进行分析的系统或仪器的单一分析运行中使用。372.实施方式361至371中任一项的套件,其中所述至少一个 第二容器中的每个第二容器配置用于在使用被配置用于对所述分析 物进行分析的系统或仪器的多个分析运行中使用。373.实施方式361至372中任一项的套件,其包含对所述分析 物进行分析所必需的所有的耗材试剂。374.实施方式361至373中任一项的套件,其中:所述分析包括短串联重复(str)分析;并且所述至少一种耗材试剂包括:(i)用于从所述至少一个样品提取dna、分离提取出的dna和纯化经分离的dna的试剂(例如,裂解试剂、捕获颗粒,以 及洗涤溶液或缓冲液)、用于进行(例如,通过pcr)一个或多个选 定的str基因座的扩增的试剂(例如,一对或多对用染料(例如, 荧光染料)标记的正向引物和反向引物、dna聚合酶(例如,taq 聚合酶)、脱氧核糖核苷三磷酸,以及可选的金属盐(例如,氯化镁)), 以及用于进行电泳的试剂(例如,电泳缓冲液和分离介质(例如,聚 合物或凝胶));以及(ii)可选地,用于在通过电泳来分离核酸扩增产物之前将 其稀释的试剂(例如,水或缓冲液),以及可选地,用于分析经分离 的扩增产物的对照(例如,大小标准、等位基因标准物和阳性对照)。375.实施方式374的套件,其包括足以用于从所述至少一个样 品分离dna、扩增经分离的dna的一个或多个选定的str基因座、 以及分析(包括分离)扩增产物的耗材试剂。
376.实施方式361至375中任一项的套件,其中所述至少一个 第一容器中的每个第一容器被单独地包含在第一盒中,该第一盒配置 用于接合进行对所述分析物的一部分或所有的分析的系统或仪器的 组装件。377.实施方式376的套件,其中所述第一盒为实施方式159至 210中任一项的盒或者实施方式211至253中任一项的盒。378.实施方式376或377的套件,其中:所述一个第二容器被包含在,或者所述多个第二容器中的每个第 二容器被单独地包含在第二盒中,该第二盒配置用于接合所述系统或 仪器的组装件;或者所述多个第二容器中的两个或更多个第二容器被包含在不同种 类的盒中,其中所述不同种类的盒中的每个盒配置用于接合所述系统 或仪器的组装件。379.实施方式378的套件,其包括:(a)第一盒,其包含至少一个样品贮器、用于从样品提取、分离 和纯化dna的试剂、以及用于扩增(例如,通过pcr)一个或多个 选定的核苷酸序列的试剂;(b)第二盒,其包含用于电泳的分离介质(例如,聚合物或凝 胶)和电泳缓冲液;以及(c)第三盒,其包含相同或不同的电泳缓冲液,并且可选地包含 用于阴极制备和清洗的溶液(例如,水)。380.一种盒,包括:a)流体装置,其包含基本上布置于第一平面中的一个或多个流体 通道;以及b)样品容器,其包含一个或多个样品贮器,每个贮器具有细长 形状,该细长形状由形状的长维度上的轴线所限定,其中每个细长轴 线基本上布置于第二平面中;其中:所述流体通道和所述样品贮器彼此流体相连;并且所述第一平面和第二平面基本上彼此平行。381.实施方式380的盒,还包括:c)试剂容器,其包含一个或多个试剂腔室,每个试剂腔室具有细 长形状,该细长形状由形状的长维度上的轴线所限定,其中每个细长 轴线基本上布置于第三平面中;以及d)反应容器,其包含一个或多个反应腔室,每个反应腔室具有 细长形状,该细长形状由形状的长维度上的轴线所限定,其中每个细 长轴线基本上布置于第四平面中;其中:所述流体通道、所述样品贮器、所述试剂腔室和所述反应腔室彼 此流体相连;并且所述第一平面、第二平面、第三平面和第四平面基本上彼此平行。382.一种样品盒,包括:a)流体装置,其包含基本上布置于第一平面中的一个或多个流体 通道;以及b)样品容器,其包含一个或多个样品贮器,其中所述流体通道 与所述样品贮器彼此流体相连;其中所述样品盒被配置成当所述样品盒与配置用于接收所述样 品盒的盒模块相接合时,将样品装载到样品贮器中,以及将来自样品 的分析物移入所述流体通道之中,并且所述第一平面定向成偏离水平 面至少10
°
、至少20
°
、至少30
°
、至少40
°
、至少50
°
、至少
60
°
、至 少70
°
、至少80
°
或者至少90
°
。383.一种匣,包括:(a)容器,其包含多个封闭的且流体隔离的腔室,其中所述多个 腔室中的每个腔室包含易碎密封;以及(b)微流体装置,其包含多个穿刺元件和微流体通道,其中多 个穿刺元件安设在与所述多个腔室中的每个腔室相对之处,其中,当将所述微流体装置与所述容器相接合时,所述穿刺元件 刺穿所述多个腔室中的每个腔室的所述易碎密封,从而创造出所述流 体隔离的腔室之间经过所述微流体通道的流体流动路径。384.根据实施方式383的匣,还包括端口,该端口使所述多个 封闭的且流体隔离的腔室中的单个腔室与压力源流体连通。385.根据实施方式383的匣,其中所述多个穿刺元件包括开口, 所述开口与所述微流体通道流体连通。386.根据实施方式383的匣,其中所述微流体通道与一个或多 个阀流体连通。387.根据实施方式386的匣,其中所述一个或多个阀为隔膜阀。388.根据实施方式383的匣,其中:所述微流体通道包含多个微流体通道;所述多个腔室中的至少一个或每个腔室包含可连接至微流体通 道的第一端口和可连接至微流体通道的第二端口;并且通过将所述微流体装置与所述容器相接合而创造出流体流动路 径,该流体流动路径包含连接至腔室的第一端口的微流体通道、所述 腔室以及连接至该腔室的第二端口的微流体通道。389.根据实施方式383的匣,还包括热循环器组装件,该热循 环器组装件适于接收来自所述容器的样品以及加热和冷却该样品。390.根据实施方式383的匣,还包括样品贮器,该样品贮器包 含适于接收样品的样品腔室。391.根据实施方式383的匣,其中所述多个封闭的且流体隔离 的腔室包括:第一腔室,其保存稀释剂;第二腔室,其保存一种或多种裂解试剂,其中该第二腔室与所述 样品腔室流体连通;第三腔室,其具有捕获颗粒;以及第四腔室,其具有洗涤溶液。392.一种用于处理生物样品的匣,包括:(a)微流体装置,其包含微流体通道以及一个或多个穿刺元件; 以及(b)容器,其包含多个腔室,所述容器安设在整个所述微流体 通道或其绝大部分上,其中所述多个腔室中的每个腔室包含易碎密封,其中当将所述微流体装置倚靠所述容器夹紧时,所述穿刺元件刺 穿所述多个腔室中的每个腔室的所述易碎密封,从而形成所述多个腔 室中的每个腔室与所述微流体通道之间的流体流动路径。
393.根据实施方式392的匣,其中所述多个腔室包括:第一腔室,其保存稀释剂;第二腔室,其保存一种或多种裂解试剂,其中该第二腔室与所述 样品腔室流体连通;第三腔室,其具有捕获颗粒;以及第四腔室,其具有洗涤溶液。394.一种用于处理生物样品的匣,包括:(a)微流体装置,其包含第一微流体通道和与所述第一微流体通 道流体隔离的第二微流体通道,其中所述微流体装置包括多个穿刺元 件;以及(b)容器,其包含第一多个封闭的且流体隔离的腔室和第二多 个封闭的且流体隔离的腔室,所述第一多个封闭的且流体隔离的腔室 和第二多个封闭的且流体隔离的腔室中的每个腔室包含易碎密封,其中,当将所述微流体装置与所述容器相接合时,所述穿刺元件 刺穿所述第一多个封闭的且流体隔离的腔室和第二多个封闭的且流 体隔离的腔室中的每个腔室的所述易碎密封,从而形成所述第一微流 体通道与所述第一多个封闭的且流体隔离的腔室之间的流体流动路 径以及所述第二微流体通道与所述第二多个封闭的且流体隔离的腔 室之间的另一流体流动路径。395.一种匣,包括:(a)容器,其包含腔室,该腔室借助于易碎密封而封闭并流体隔 离;以及(b)微流体装置,其包含第一通道和第二通道,以及邻近于所 述腔室的穿刺元件,所述通道中的每个通道在端口处终止,其中,当将所述微流体装置与所述容器相接合时,所述穿刺元件 刺穿所述易碎密封,从而创造出流体流动路径,该流体流动路径包含 所述第一通道、腔室和第二通道。396.根据实施方式395的匣,其中当接合所述微流体装置时, 所述第一通道和第二通道中的每个通道的端口通向所述腔室。397.一种匣,包括:(a)容器,其包含至少一个封闭的且流体隔离的腔室,所述腔室 包含易碎密封;以及(b)微流体装置,其包含多个通道,其中所述多个通道中的每 个通道在端口处终止,其中通过将所述微流体装置与所述容器相接合而刺穿所述易碎 密封,从而使所述端口经过所述腔室而彼此流体连通。398.一种盒,包括:(a)框架;(b)样品容器,其包含多个样品腔室,其中所述样品容器可为所述框架的一部分或者可附接至所 述框架的第一面,并且其中每个样品腔室配置用于接收不同的样品;(c)试剂容器,其附接至所述框架的所述第一面,其中所述试剂 容器包含针对每
个样品腔室的多个试剂腔室;(d)反应容器,其附接至所述框架的所述第一面,其中所述反 应容器包含多个反应腔室,针对每个样品腔室有一个反应腔室;以及(e)流体装置,其附接至所述框架的相对面,其中该流体装置针 对每组样品腔室、试剂腔室和反应腔室包含多个流体通道、用于调控 经由所述流体通道向和从所述腔室的流体流动的多个阀,以及用于所 述流体通道与所述腔室的流体连通的多个端口;其中:每个所述样品腔室通过所述流体装置的端口而与所述流体装置 中的流体通道流体连通;对于每组样品腔室、试剂腔室、反应腔室和流体通道,每个所述 试剂腔室在所述试剂容器与所述流体装置的接合之前封闭并且与每 一其他腔室和与所述流体通道流体隔离;每个所述反应腔室通过所述流体装置的端口而与所述流体装置 中的流体通道流体连通;并且每组样品腔室、试剂腔室、反应腔室和流体通道在所述试剂容器 与所述流体装置的接合之前和之后与每一其他组样品腔室、试剂腔室、 反应腔室和流体通道流体隔离。399.一种盒,其包括一组或多组腔室和流体通道,其中:所述盒配置成可以可拆卸地与盒模块相接合;对于包括多组腔室和流体通道的盒,每组腔室和流体通道在所述 盒与所述盒模块的接合之前和之后与每一其他组腔室和流体通道流 体隔离;每组腔室和流体通道包含多个腔室,所述多个腔室在所述盒与所 述盒模块的接合之前封闭并且与彼此和与所述流体通道流体隔离;每组腔室和流体通道中的腔室在所述盒与所述盒模块相接合时 经由所述流体通道而彼此流体连通;并且对于每组腔室和流体通道中的多个封闭的且流体隔离的腔室中 的每个腔室,所述盒与所述盒模块的接合创造出流体流动路径,该流 体流动路径包含与所述腔室的第一端口流体连通的流体通道、所述腔 室以及与所述腔室的第二端口流体连通的流体通道。400.根据实施方式399的盒,其配置用于:从样品提取核酸(例如,dna);分离提取出的核酸(例如,通过将提取出的核酸捕获至基底(例 如,磁响应颗粒));可选地纯化经分离的核酸;扩增经分离的核酸的一个或多个选定的核苷酸(例如,短串联重 复(str))序列(例如,通过聚合酶链反应(pcr))以产生扩增 产物;以及可选地分离,或者可选地分离和检测所述扩增产物(例如,通过 电泳)。401.一种盒,包括:a)流体装置,其包含基本上布置于第一平面中的一个或多个流体 通道;以及b)样品容器,其包含一个或多个样品贮器,每个贮器具有细长 形状,该细长形状由形状的长维度上的轴线所限定,其中每个细长轴 线基本上布置于第二平面中;
其中:所述流体通道和所述样品贮器彼此流体相连;并且所述第一平面和所述第二平面基本上彼此平行。402.根据实施方式401的盒,还包括:c)试剂容器,其包含一个或多个试剂腔室,每个试剂腔室具有细 长形状,该细长形状由形状的长维度上的轴线所限定,其中每个细长 轴线基本上布置在第三平面中;以及d)反应容器,其包含一个或多个反应腔室,每个反应腔室具有 细长形状,该细长形状由形状的长维度上的轴线所限定,其中每个细 长轴线基本上布置在第四平面中;其中:所述流体通道、所述样品贮器、所述试剂腔室和所述反应腔室彼 此流体相连;并且所述第一平面、第二平面、第三平面和第四平面彼此基本上平行。403.一种样品盒,包括:a)流体装置,其包含基本上布置于第一平面中的一个或多个流体 通道;以及b)样品容器,其包含一个或多个样品贮器,其中所述流体通道 与所述样品贮器彼此流体相连;其中所述样品盒被配置成当所述样品盒与配置用于接收所述样 品盒的盒模块相接合时,将样品装载到样品贮器中,以及将来自样品 的分析物移入所述流体通道之中,并且所述第一平面定向成偏离水平 面至少10
°
、至少20
°
、至少30
°
、至少40
°
、至少50
°
、至少60
°
、至 少70
°
、至少80
°
或者至少90
°
。404.一种用于处理生物样品的装置,包括:(a)微流体装置,其包含微流体通道,该微流体通道与一个或多 个端口流体连通,其中所述微流体装置包括多个穿刺元件;以及(b)容器,其安设在所述微流体装置上,该容器包含多个密封 腔室,其中所述多个密封腔室中的每个密封腔室借助于易碎密封而得 到密封,其中所述容器借助于可变形材料层而附接至所述微流体装置,其中通过将所述微流体装置与所述容器相接合而刺穿所述易碎 密封并创造出所述密封腔室中的每个密封腔室与所述微流体通道之 间的流体流动路径。405.根据实施方式404的装置,其中所述多个密封腔室包括:第一腔室,其保存稀释剂;第二腔室,其保存一种或多种裂解试剂,其中该第二腔室与所述 样品腔室流体连通;第三腔室,其具有捕获颗粒;以及第四腔室,其具有洗涤溶液。406.一种盒模块,包括:贮器,用于容纳具有样品和用于处理所述样品的一种或多种试剂 的盒,所述盒具有用于样品处理的一个或多个腔室以及用于帮助流体 流向所述一个或多个腔室的一个或多个阀;第一组装件,其具有第一压力歧管,该第一压力歧管接合所述盒 的第一面,并使
所述一个或多个腔室与压力源流体连通;第二组装件,其具有第二压力歧管,该第二压力歧管接合所述盒 的第二面,并使所述一个或多个阀与用于气动致动的压力源流体连通; 以及伸长或移动构件,其朝向所述盒移动所述第一压力歧管和所述第 二压力歧管中之一或全部两者。407.一种盒模块,包括:盒贮器,其配置用于接收和保持盒,所述盒包含多个腔室以及用 于调控向和从所述多个腔室的流体流动的多个阀;第一组装件,其包含第一压力歧管,该第一压力歧管配置用于接 合所述盒的第一面,并从而使所述多个腔室与正压源或负压源流体连 通;第二组装件,其包含第二压力歧管,该第二压力歧管配置用于接 合所述盒的第二面,并从而使所述多个阀与用于阀的气动致动的正压 源或负压源流体连通;以及移动构件,其配置用于将所述第一压力歧管和/或所述第二压力歧 管移向或移离被保持在所述盒贮器中的盒。408.一种盒模块,包括:盒贮器,其配置用于接收和保持盒;以及多个管道,其中所述多个管道中的每个管道独立地受压力驱动, 并且配置用于与被保持在所述盒贮器中的盒的多个端口中的一个端 口密封地接合,并且其中管道的末端与端口的接合在所述端口与所述 管道的未接合末端之间创造出流体连通。409.一种系统,包括:(a)贮器,用于接收匣;(b)匣,其被接收在所述贮器中,所述匣包含:(i)容器,其包含多个封闭的且流体隔离的腔室,其中所 述多个封闭的且流体隔离的腔室中的每个腔室包含易碎密封;以及(ii)微流体装置,其包含多个穿刺元件以及与一个或多个 端口流体连通的微流体通道,其中:所述容器借助于可变形材料层而附接至所述微流体 装置;并且/或者所述多个穿刺元件中的两个或更多个穿刺元件安设 在与所述多个封闭的且流体隔离的腔室中的每个腔室相对之处;以及 (c)压力施加构件,用于将所述微流体装置与所述容器相接合, 其中通过将所述微流体装置与所述容器相接合而刺穿所述多个封闭 的且流体隔离的腔室中的每个腔室的易碎密封并且创造出所述多个 封闭的且流体隔离的腔室中的每个腔室与所述微流体通道之间的流 体流动路径。410.一种用于处理生物样品的系统,包括:壳体;贮器,其位于所述壳体之中,该贮器配置用于接收匣,所述匣具 有微流体装置和与所述微流体装置相邻的容器,其中所述容器包括用于样品处理的腔室,其中所述容器借助于易碎密封而得到密封,并且其中所述微流体装置包含端口,该端口使所述腔室与压力 源流体连通;
接合构件,其邻近于所述贮器,其中所述接合构件将所述微流体 装置与所述容器相接合,从而刺穿所述易碎密封,其中刺穿所述易碎 密封使所述腔室与所述微流体装置的微流体通道流体连通;以及控制器,其位于所述壳体之中,所述控制器具有处理器和存储器, 该存储器带有机器可执行代码,用于实现借助于所述匣来处理生物样 品的方法。411.一种用于处理生物样品的系统,包括:(a)匣,其具有腔室,其中所述匣包括与所述腔室相邻的微流体装置,并且其中所述微流体装置包括沿着所述微流体装置的微流体通 道的多个隔膜阀,所述多个隔膜阀中的单个隔膜阀具有流体层、气动 层和位于所述流体层与气动层之间的弹性层;(b)压力源,其通过所述微流体装置的端口而与所述腔室流体 连通,其中所述压力源向所述腔室提供正压或负压,从而使流体以约 5000微升(ul)/s或更小或者1000ul/s或更小的流速移动经过所述微 流体通道;以及(c)气动歧管,其与所述气动层流体连通,所述气动层用于致动 所述弹性层,从而使流体以约100ul/s或更小或者10ul/s或更小的流 速移动经过所述微流体通道。412.一种用于处理生物样品的方法,包括:(a)提供如实施方式383中的匣;(b)在所述匣的样品腔室中提供样品,其中所述样品腔室与所 述匣的微流体通道流体连通;(c)将所述微流体装置与所述容器相接合,以形成所述多个封闭 的且流体隔离的腔室中的每个腔室与所述微流体通道之间的流体流 动路径;以及(d)处理所述生物样品。413.一种用于处理样品的方法,包括:将容器与微流体装置相接合,其中所述容器包含至少一个封闭的 且流体隔离的腔室,所述腔室包含易碎密封,其中所述微流体装置包 含多个通道,其中所述多个通道中的每个通道在端口处终止,其中通过将所述微流体装置与所述容器相接合而刺穿所述易碎 密封,从而使所述端口经过所述腔室而彼此流体连通。414.一种用于进行样品的遗传分析的集成的和自动化的系统, 包括:(a)分离模块,配置用于从样品分离核酸(例如,dna);(b)扩增模块,配置用于扩增分离出的核酸的一个或多个选定 的核苷酸序列,以产生扩增产物;(c)分离与检测模块,配置用于分离和检测所述扩增产物;(d)分析模块,配置用于分析检测到的扩增产物,其中所述分 析模块包含存储器和执行代码的处理器,该代码识别一个经扩增核苷 酸序列的等位基因,或者多个经扩增核苷酸序列中的至少一个或所有 的核苷酸序列的等位基因;(e)盒模块,配置用于接收和接合盒;以及(f)由所述盒模块所接收的盒;
其中:所述分离模块和所述扩增模块为所述盒的一部分;所述盒包含腔室,所述腔室在所述盒与所述盒模块相接合时经由 流体通道而彼此流体连通;并且对于所述腔室中的一个或多个或者所有的腔室,所述盒与所述盒 模块的接合创造出流体流动路径,该流体流动路径包含与腔室的第一 端口流体连通的流体通道、所述腔室以及与该腔室的第二端口流体连 通的流体通道。415.根据实施方式414的系统,其中所述盒包含:(a)包含用于从样品提取核酸的处于溶液或缓冲液中的试剂(例 如,裂解试剂)并且可选地包含消泡试剂的腔室;(b)包含用于分离提取出的核酸的、可选地处于溶液或缓冲液 中的基底(例如,磁响应颗粒)的腔室;(c)包含用于纯化经分离的核酸的溶液(例如,洗涤溶液或缓冲 液)的一个或多个(例如,两个)腔室;以及(d)包含用于在扩增产物的分离之前稀释所述扩增产物的溶液 (例如,水)的腔室。416.根据实施方式415的系统,其中:腔室(a)配置用于接收和/或储存废料;并且腔室(d)可选地包含溶液中的对照(例如,运行样品的泳道中 的大小标准,或者不运行样品的泳道中的等位基因标准物(以及可选 地,大小标准))。417.根据实施方式414的系统,其中:腔室(a)、腔室(b)、腔室(c)和腔室(d)中的每个腔室在 所述盒与所述盒模块的接合之前封闭并流体隔离;并且对于腔室(a)、腔室(b)、腔室(c)和腔室(d)中的每个腔 室,所述盒与所述盒模块的接合创造出流体流动路径,该流体流动路 径包含与所述腔室的第一端口流体连通的流体通道、所述腔室以及与 所述腔室的第二端口流体连通的流体通道。418.一种用于检测物品的系统,包括:盒,其与盒模块相接合,其中所述盒包含样品贮器,该样品贮器 配置用于接收物品,该物品可选地包含样品;以及检测组装件,其配置用于检测在所述样品贮器中存在或不存在物 品。419.一种用于控制样品保管的系统,包括:(a)盒,其包含样品贮器,该样品贮器配置用于接收物品(例如, 拭子),该物品可选地包含样品;(b)盒模块,其具有盒贮器,该盒贮器配置用于接收所述盒;(c)壳体,其封闭所述盒模块和所述盒,其中所述壳体包含可关 闭门;(d)至少一个传感器,其产生信号,该信号指示出:(1)物品向所述样品贮器中的插入或从其的移除;(2)所述盒是否插入到所述盒贮器中;或者(3)所述门是敞开的还是关闭的;以及
(e)计算机,其被编程用于在记录时段中记录来自所述至少一个 传感器的信号以及向用户显示信号历史。420.根据实施方式419的系统,其中所述计算机包含如下逻辑, 该逻辑从所述信号历史确定:(1)物品是否或何时插入到所述样品贮器中或从所述样品贮器 移除;(2)所述盒是否或何时插入到所述盒贮器中或从所述盒贮器移 除;(3)所述门是否或何时被打开或被关闭。421.一种进行样品的遗传分析的方法,包括:从样品分离核酸(例如,dna);扩增经分离的核酸的一个或多个选定的核苷酸序列,以产生扩增 产物;分离和检测所述扩增产物;以及分析检测到的扩增产物,以识别一个经扩增核苷酸序列的等位基 因或者多个经扩增核苷酸序列中的至少一个或所有的核苷酸序列的 等位基因;其中:所述方法在约2小时内完成;所述方法使用集成的和自动化的系统来执行,该系统包含被配置 用于接收和接合盒的盒模块;所述分离和所述扩增使用盒来执行,该盒包含腔室,所述腔室在 所述盒与所述盒模块相接合时经由流体通道而彼此流体连通;并且对于所述腔室中的一个或多个或者所有的腔室,所述盒与所述盒 模块的接合创造出流体流动路径,该流体流动路径包含与腔室的第一 端口流体连通的流体通道、所述腔室以及与该腔室的第二端口流体连 通的流体通道。422.一种套件,包括:至少一个第一容器,其配置用于接收包含用于分析的分析物的至 少一个样品;以及至少一个第二容器,其包含用于在所述分析物的分析中使用的至 少一种耗材试剂。423.根据实施方式422的套件,其包括:(a)多个所述第一容器,其中每个所述第一容器配置用于在单一 分析运行中使用;以及(b)(i)一个第二容器,其中所述第二容器包含至少一种耗材 试剂,该耗材试剂的量足以用于进行与所述第一容器的数目相等的数 目的分析运行;或者(ii)多个所述第二容器,其中每个所述第二容器包含至少 一种耗材试剂,该耗材试剂的量足以用于进行与第一容器的数目相等 的数目的分析运行。424.一种定位样品/分析物以供注射到分离通道中的方法,包括:(i)提供电泳组装件,其包含:(a)流体导管(例如,样品/分析物通道),其具有通道入 口和通道出口;(b)分离通道(例如,电泳毛细管),其具有分离通道入 口和分离通道出口,其中所述分离通道包含导电分离介质(例如,聚合物 或凝胶),并且
其中所述分离通道入口与所述流体导管在连接点处 流体连通并且电连通;(c)阳极和阴极,它们限定电路径并且配置用于跨所述分 离通道入口和所述分离通道出口施加电压,其中所述阳极或所述阴极(例如,当所述样品/分析物 为核酸时,是阴极)位于所述流体导管中或者在连接点处或与连接点 相邻处邻近所述流体导管;(d)仪表,其配置用于测量通过所述分离通道的电流或者 跨所述分离通道的电压;(ii)在所述流体导管中的样品/分析物的下游定位材料(例如, 空气)团块,其中所述材料具有与电泳缓冲液或样品/分析物的电导率 不同的电导率;(iii)在所述流体导管中所述分离通道的方向上移动所述材料团 块和所述样品/分析物,同时用所述仪表测量电流或电压;(iv)用所述仪表检测电流或电压的变化,所述变化对应于所述 材料团块向所述电路径中的移动;以及(v)基于所述检测,将所述样品/分析物向所述电路径中移动。425.一种物品,包括:主体,其含有位于开口之间的通路;第一可移动阻挡器和第二可移动阻挡器,所述阻挡器定位在所述 通路中,以便限定介于其间的隔室;以及所述隔室中的流体,所述流体包含扩增预混物,其中对所述第一可移动阻挡器施加的外部压力传递到所述第二 可移动阻挡器,以使所述第二可移动阻挡器朝向开口移动。426.一种用于确定生物体的遗传谱的方法,包括在20个或更少 个步骤中或者在10个或更少个步骤中处理和分析来自所述生物体的 生物样品。427.一种用于自动化法医分析的方法,包括使用具有约20ft3或 更小体积的完全集成样品处理与分析系统,在20个或更少个步骤中 或者在10个或更少个步骤中确定生物体的遗传谱。
[0359]
示例1
[0360]
图34a
‑
图34d示出用于处理样品的盒的示例。图34a示出如 本文所述的具有配备试剂腔室和处理腔室的容器3401的盒3400。盒 3400配置用于随本发明的系统一起使用。该盒包括样品腔室,用于容 纳样品,诸如借助于q
‑
tip或棉签来容纳样品。热导体3406安设在盒 3400的热循环腔室(见下文)上。热导体3406配置用于将来自加热 元件(例如,珀尔帖)的热量分布(或散布)到热循环器组装件3405 的腔室3407。热导体可由石墨、石墨烯、铜、钽或铝形成。在一些情 况下,热导体由一层导热材料形成。在其他情况下,热导体由多个层 形成,诸如由适于与加热元件热连通的导热材料(例如,石墨)层以 及与该导热材料层相邻的、适于与热循环器组装件3405的每个腔室 3407中的样品相接触的聚合物材料(例如,聚丙烯)层所形成。例如, 热导体可包括层压至聚丙烯层的石墨层。聚丙烯层可适于在样品处理 期间与腔室3407中的样品相接触。
[0361]
参考图34b,盒3400包括用于保持容器3401的托架或框架3402。 托架3402包括保持构件3402a,用于使得使用者能够装载盒3400, 诸如将盒3400插入到用于处理样品的系
统中。参考图34c,盒3400 包括:可变形材料层3403,其被配置成位于与容器3401相邻之处; 以及微流体装置3404,其具有用于向和从容器3401的腔室输送样品 和试剂的微流体通道,以及用于致动盒3400的微流体通道的阀的气 动致动通道。图34d示出热循环器组装件3405,用于进行样品的温 度调控处理,诸如pcr。热循环器组装件3405配置成安装在微流体 装置3404上,微流体装置3404配置成借助于托架3402而与盒3400 的其他组件相集成。
[0362]
热循环器组装件3405为用螺栓固定到微流体装置3404的外表 面的塑料件。热循环器组装件3405包括4个腔室3407,其中每个腔 室3407具有细长形状,该细长形状可具有在腔室3407的大部分长度 上延伸的开口——即,腔室3407可为槽状。在一些情况下,腔室3407 具有约0.02英寸(或约508微米)的深度和约20微升的容积。参考 图44,腔室3407覆盖有热导体层3406,该热导体层3406配置用于 在样品处理期间和加热与冷却元件(未示出)相接触。加热与冷却元 件可位于盒3400之外(例如,见图42中的热循环加热与冷却装置 4200)。在一些情况下,热导体层的表面适于在样品处理期间通过在 每个腔室的大部分长度上延伸的开口来接触热循环器组装件3405的 每个腔室中的样品。
[0363]
在样品处理期间,将可磁场吸引微珠(本文中亦称“磁珠”)从 容器3401导引至热循环器组装件3405的反应腔室3407中,在该处 借助于由与腔室3407相邻的磁场源(例如,磁体,感应线圈)所提 供的磁场来对可磁场吸引微珠加以固定。磁场源可提供在盒中,举例 而言,诸如安设在热循环器组装件3405与微流体装置3404之间的隔 室中。该隔室可形成在热循环器组装件3405中,并且可在将热循环 器组装件3405附接至微流体装置3404之前将磁场源提供在该隔室中 (见图45)。向腔室3407提供扩增预混物,并且在将微珠固定于腔 室3407中的情况下对样品进行扩增。在扩增之后,将经扩增样品引 出腔室3407并引向容器3401。微珠留在热循环器组装件3405的腔室 3407中。
[0364]
本文所提供的系统和方法,包括此类系统的组件和此类方法的 各个例程,可以与其他系统和方法相结合,或者由其他系统和方法来 修改。在一些情况下,上文在图1
‑
图7的背景下描述的系统100,包 括该系统的各个组件在内,可与通过引用而整体并入本文的属于 jovanovich等人的美国专利公开no.2011/0005932(“universalsample preparation system and use in an integratedanalysis system”)(“jovanovich”)中所描述的系统相结合,或 者由其来修改。例如,图5的电泳毛细管以及图6的阳极盒和接口模 块的各个特征可与jovanovich的教导相结合,或者由其修改或阐述。
[0365]
从前文中应当理解,虽然已经图示和描述了特定的实现方案, 但在此设想到并可向其做出各种修改。本发明并不旨在受限于本说明 书内所提供的具体示例。虽然已参考前述说明书描述了本发明,但本 文中对本发明的实施方式的描述和图示并不意味着要以限制性的意 义来解释。此外,应当理解,本发明的所有方面都不限于本文所阐述 的具体描绘、配置或相对比例,它们取决于多种条件和变量。本发明 的实施方式的形式和细节上的各种修改对于本领域技术人员将会是 显而易见的。因此设想到本发明还应涵盖任何此类修改、改变和等效 方案。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。