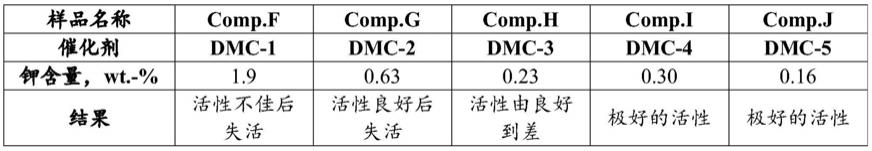
siremadlin琥珀酸酯
1.本发明涉及用于制备药物产品的方法,包括用真空辅助计量与填充装置将活性药物成分粉末填充到药物载体中。本文披露的方法可以用于连续过程中,比如用于生产药物产品的高产量工艺中。本发明进一步涉及可以在本发明的制备方法中使用的特定品质的以琥珀酸共晶体形式存在的净活性药物成分(api)hdm201,即siremadlin。
背景技术:
2.从发现到临床早期一直到临床后期再到最终的商业产品,配制活性药物成分(api)都是要求高且资源密集的。包含api的商业配制品和相关制造工艺通常包含赋形剂共混或制粒。几何稀释、湿法制粒和干法共混尤其适用于低剂量配制品的制造。为了实现适当的混合方法以确保赋形剂与api之间的剂量均匀性和均质性,付出了很多努力。此外,在规模扩大的操作上需要进行大量的努力,并且只要早期阶段(或第一种途径)的配制品显示出不期望的生物药物曲线或表现得不适用于后期阶段的加工,就进行重新配制。为了加速开发,可以在早期阶段将净api装入胶囊中。胡椒罐投加原理与经典称重相组合是广泛使用的解决方案。然而,在后面的阶段中,仍在开发含赋形剂的经典配制品。
3.通过在胶囊中使用净api,可以通过简单地评估胶囊外壳与api之间的相容性,代替研究赋形剂的相容性以及完全配制一种剂型,来减少配制品开发时间。由于不需要满足特异性,还可以减少分析方法的开发时间,因为不存在干扰性的赋形剂。因此,药品物质的分析方法可以足够满足该药品产品。然而,实现以一致的填充量、尤其是以低填充重量将净api填充到胶囊中存在挑战。
技术实现要素:
4.本发明涉及一种工程与制造概念,其目的是在直至商业制造的药物产品整个开发历程中,以非常宽的剂量范围直接封装净api(或具有非常少量的添加剂的api)。本披露的方法在连续过程中、比如在用于生产药物产品的高产量工艺中特别有用。
5.本披露的方法具有适应异常广泛的粉末特性(包括无法在任何其他设备中填充的粉末)的独特能力,从而使平台的使用者能够应对净api粉末的特殊性(例如,过量的内聚性、附着性、差的流动性等)。所披露的方法能够以相对简单的技术和管控解决方案的组合来应对药物开发的众多复杂方面,这些技术和管控解决方案从根本上简化了口服药物形式的开发和制造。所述方法可以递归地用于进入药物研究和开发的开发历程中的任何新api(其中,固有的溶解度特征是足够有利的),直至并且包括商业制造。
6.为了实现上述目的,本披露的方法应用了罕见的设备与技术的组合以及新颖的流程,以用于了解、预测、选择、改良和控制粉末行为。
7.相应地,本发明提供了一种用于制备药物产品的方法,所述方法包括以下步骤:
8.(a)提供活性药物成分(api),所述活性药物成分符合如通过使用ft4粉末流变仪确定的以下参数(i)
‑
(viii)中的至少五个参数:
9.(i)最多60mj/g的比基本流动能(sbfe);
10.(ii)0.75至1.25的稳定指数(si);
11.(iii)最多10mj/g的比能(se);
12.(iv)在15kpa(mps
‑
15)下最多40的最大主应力;
13.(v)在15kpa(ff
‑
15)下至少1.3的流函数;
14.(vi)在15kpa(cbd
‑
15)下至少0.26g/ml的压实堆积密度;
15.(vii)最多47%的压缩率;以及
16.(viii)最多40
°
的壁摩擦角(wfa);
17.(b)使用真空辅助计量与填充装置来将步骤(a)的所述api分配到药物载体的底部中;以及
18.(c)用所述药物载体的互补盖部来包封所述药物载体的底部,从而生产药物产品。
19.在相关方面,本发明提供了一种用于以净活性药物成分(api)粉末来填充药物载体或剂型的方法,所述方法包括:
20.(a)使用真空辅助计量与填充装置来将所述api粉末分配到所述药物载体或剂型的底部中;以及
21.(b)用所述药物载体或剂型的互补盖部来包封所述药物载体或剂型的底部,从而生产经填充的药物载体或剂型;
22.其中,所述净api符合如通过使用ft4粉末流变仪确定的以下参数(i)
‑
(viii)中的至少五个参数:
23.(i)最多60mj/g的比基本流动能(sbfe);
24.(ii)0.75至1.25的稳定指数(si);
25.(iii)最多10mj/g的比能(se);
26.(iv)在15kpa(mps
‑
15)下最多40的最大主应力;
27.(v)在15kpa(ff
‑
15)下至少1.3的流函数;
28.(vi)在15kpa(cbd
‑
15)下至少0.26g/ml的压实堆积密度;
29.(vii)最多47%的压缩率;以及
30.(viii)最多40
°
的壁摩擦角(wfa)。
31.因此,药物载体/剂型一旦经填充和密封就典型地仅包含净api(应注意的是,净api可以包含不超过5%、4%、3%、2%、1%、0.5%或0.1%的添加剂)。
32.本发明还提供了一种通过在本文任何实施例中描述的本发明方法所获得或可获得的仅包含净api(应注意的是,净api可以包含不超过5%、4%、3%、2%、1%、0.5%或0.1%的添加剂)的药物载体/剂型、比如口服剂型。
33.本发明人开发了一种用于预测api是适合于被直接作为净api配置在药物产品中、还是需要进一步改进(颗粒工程)的方法。相应地,步骤(a)表示品质检查,定义了将api作为净api配置在药物产品中所需的某些粉末参数的新的最低标准。
34.因此,本发明还提供了一种用于预测api是否适合于被直接作为净api配置在药物产品中的方法,所述方法包括使用ft4粉末流变仪来确定api是否符合如通过使用ft4粉末流变仪确定的以下参数(i)
‑
(viii)中的至少五个参数:
35.(i)最多60mj/g的比基本流动能(sbfe);
36.(ii)0.75至1.25的稳定指数(si);
37.(iii)最多10mj/g的比能(se);
38.(iv)在15kpa(mps
‑
15)下最多40的最大主应力;
39.(v)在15kpa(ff
‑
15)下至少1.3的流函数;
40.(vi)在15kpa(cbd
‑
15)下至少0.26g/ml的压实堆积密度;
41.(vii)最多47%的压缩率;以及
42.(viii)最多40
°
的壁摩擦角(wfa)。
43.虽然先前已经在药物行业中关于包含赋形剂(比如,乳糖共混物或工程化颗粒,例如pulmospherestm)的吸入产品描述了真空辅助计量与填充装置、比如滚筒填充器技术的用途,但是其针对使用净api制成的剂型、包括口服剂型的应用被视为是独特的。在工业中,更常见的是使用定量器或捣固销填充原理将配制好的共混物或粒状材料投加到胶囊中。
44.在所描述的另外的实施例中,真空滚筒分配器包括粉末沟槽,所述粉末沟槽配备有流化装置,尤其声换能器、更具体地超声换能器。此外,可以在步骤(c)之前通过振动、摇动或敲击,使api在所述药物载体的底部中压实。
45.在特定实施例中,该药物产品是口服剂型。口服剂型的实例是在以下实施例和本说明书中其他地方描述的注射模制成的片剂形状的载体。
46.在一个实施例中,步骤(c)中的药物载体是作为新颖的药物剂型的片剂形状载体(本文还被称为prescido
tm
)。这个载体被设计成具有标准药物胶囊的功能、同时维持患者的片剂诉求。本文所描述的载体是经由精密注射模制工艺、使用被设计成在热处理中表现良好的配制品来制造的。该配制品在注射模制工艺中的高性能使得载体的设计具有灵活性,从而允许鲁棒地制造具有非常小尺寸的设计特征,这在传统上是注射模制中的挑战。设计与制造特征连同其益处尤其包括薄壁区段(在水性介质中快速的载体崩解时间)、小的卡扣闭合特征(紧密闭合防止载体在输送期间被打开并且限制载体内容物被窃启)、空腔的编号(使用前多个部分的可追溯性和分类)以及高的重量与尺寸精度(鲁棒的操纵过程)。
47.与传统胶囊相比,除了具有精妙的热处理特性之外,所开发的配制品还为载体带来了许多益处,比如低含水量(与水敏活性物质的相容性提高)、在标准的制造条件下的低吸湿性和湿度敏感度、以及比较快的溶解性(载体在水介质中快速破裂)。因此,prescido
tm
载体由于具有有利的含水量和吸收特性(这对于水敏化合物的加工和稳定性是优势)而具有优于传统胶囊的优势。
48.本发明进一步提供了hdm201(siremadlin)琥珀酸共晶体(hdm201
‑
bba),其品质适合作为净api用于制备如本文所述的药物产品的方法。
49.这种合适的品质可以定义如下:
50.以琥珀酸共晶体的形式存在的净活性药物成分(api)hdm201(siremadlin),其品质符合如通过使用ft4粉末流变仪确定的以下参数(i)
‑
(viii)中的至少五个参数:
51.(i)最多60mj/g的比基本流动能(sbfe);
52.(ii)0.75至1.25的稳定指数(si);
53.(iii)最多10mj/g的比能(se);
54.(iv)在15kpa(mps
‑
15)下最多40的最大主应力;
55.(v)在15kpa(ff
‑
15)下至少1.3的流函数;
56.(vi)在15kpa(cbd
‑
15)下至少0.26g/ml的压实堆积密度;
57.(vii)最多47%的压缩率;以及
58.(viii)最多40
°
的壁摩擦角(wfa)。
附图说明
59.图1示出了在胶囊填充机中使用基于电容的传感器进行测量的简化方案,
60.图2示出了在用于制备药物产品的方法中包括的步骤的流程图,
61.图3示出了在胶囊填充机中使用多个基于电容的传感器进行测量的简化方案,
62.图4示出了药物载体的各种设计,
63.图5示出了根据图4的药物载体的示例性实施例的盖部(左侧)和底部(右侧)的截面视图,包括设置在盖部和底部上的闭合机构的详细视图,
64.图6a示出了如图5右侧上所示的载体底部的三维视图,
65.图6b示出了设置在根据图5的药物载体的盖部和底部上的闭合机构的另外详细视图,
66.图7a/b示出了标准真空滚筒填充器的设置,其中使用振动(振动料斗)将粉末摇入槽中,搅拌器搅拌槽中的粉末,并且真空将粉末吸入空腔(7a)中,使用超压来从空腔(7b)中释放粉末团,使用amw传感器来实现100%填充重量控制。
具体实施方式
67.本发明提供了一种用于制备药物产品的方法,所述方法包括以下步骤:
68.(a)提供活性药物成分(api),所述活性药物成分符合如通过使用ft4粉末流变仪确定的以下参数(i)
‑
(viii)中的至少五个参数:
69.(i)最多60mj/g的比基本流动能(sbfe);
70.(ii)0.75至1.25的稳定指数(si);
71.(iii)最多10mj/g的比能(se);
72.(iv)在15kpa(mps
‑
15)下最多40的最大主应力;
73.(v)在15kpa(ff
‑
15)下至少1.3的流函数;
74.(vi)在15kpa(cbd
‑
15)下至少0.26g/ml的压实堆积密度;
75.(vii)最多47%的压缩率;以及
76.(viii)最多40
°
的壁摩擦角(wfa);
77.(b)使用真空辅助计量与填充装置来将步骤(a)的所述api分配到药物载体的底部中;以及
78.(c)用所述药物载体的互补盖部来包封所述药物载体的底部,从而生产药物产品;如权利要求中进一步定义的。
79.图2中提供了本文披露的方法的流程图,所述方法在任何规模上均有效。
80.净api的选择和改良
81.我们已经开发出一种“8参数模型”,所述模型能够区分和预测粉末的填充行为。这八个参数为:
82.sbfe:比基本流动能(mj/g):由bfe(由标准的ft4测试平台获得)除以样本的划分质量获得
83.si:稳定指数,标准变量、无量纲
84.se:比能(mj/g),标准变量
85.mps@15kpa:最大主应力,标准变量
86.ff@15kpa:流函数(无量纲),来自剪切单元、标准变量
87.cbd@15kpa:压实堆积密度(g/ml),标准变量(来自剪切单元)
88.cps:压缩率(%),标准变量
89.wfa:壁摩擦角(度
°
),标准变量
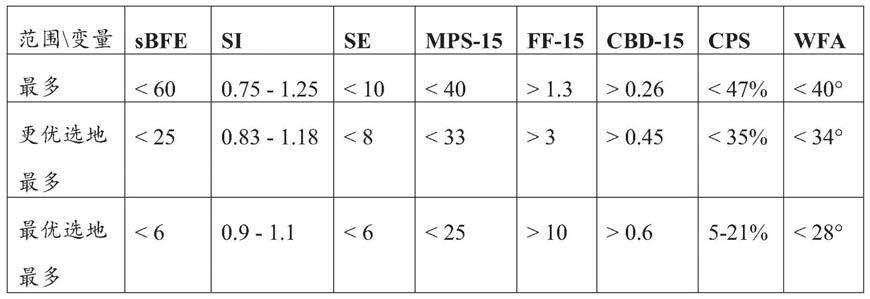
90.下表示出了构成该模型的一部分的每个参数的范围和优选范围。每个参数的每个优选和最优选范围可以与任何其他参数的每个优选和最优选范围独立地组合。
[0091][0092]
在优选的实施例中,步骤(a)中的粉末参数满足以下要求,优选地满足以下要求中的至少五个要求:
[0093]
(i)所述sbfe为最多25mj/g、尤其最多6mj/g;和/或
[0094]
(ii)所述si为0.83至1.18、尤其0.9至1.1;和/或
[0095]
(iii)所述se为最多8mj/g、尤其最多6mj/g;和/或
[0096]
(iv)所述mps
‑
15为最多33、尤其最多25;和/或
[0097]
(v)所述ff
‑
15为至少3、尤其至少10;和/或
[0098]
(vi)所述cbd
‑
15为至少0.45g/ml、尤其至少0.6g/ml;和/或
[0099]
(vii)所述压缩率为最多35%、尤其3
‑
15%;和/或
[0100]
(viii)所述wfa为最多34
°
、尤其最多28
°
。
[0101]
标准的ft4粉末流变仪提供至少6种粉末表征方法(按每个测量圆筒直径)。被选择来进行分析的是
[0102]
25mm_1c_划分_rep vfr_r01;
[0103]
25mm_shear_15kpa;
[0104]
25mm_压缩率_1
‑
15kpa;
[0105]
25mm_壁摩擦_30kpa。
[0106]
基于所选择的这四种表征方法,可以将参数分为四组。
[0107]
第1组
‑
(i)sbfe;(ii)si;(iii)se
[0108]
第2组
‑
(iv)mps
‑
15;(v)ff
‑
15;(vi)cbd
‑
15
[0109]
第3组
‑
(vii)cps
[0110]
第4组
‑
(viii)wfa。
[0111]
ft4粉末流变仪可从freeman technology(弗里曼技术公司)商购。
[0112]
如果其中四个参数在指示的范围之外,则预测该粉末在可制造性方面为临界点。如果多于四个参数在指示的范围之外,则粉末在本文描述的任何自动机器中极有可能且实际上无法作为净api工作。此外,已经发现,如果mps很高,并且以较小的方式wfa也很高,则粉末易于积聚在填充与投加装置中。这对于音波/超声波填充技术是不利的特征。另一方面,如果si太高,则粉末会随时间改变其特征,从而使其对剪切力更加敏感。在使用搅拌器的标准真空滚筒填充技术中,这样的粉末工作性较差。
[0113]
在优选的实施例中,所述参数中的至少一个参数选自参数(i)至(iii),并且所述参数中的至少一个参数选自参数(iv)至(vi),即,至少一个选自第1组并且至少一个选自第2组。优选地,第1组参数中的至少一个参数是参数(i)或(iii),并且第2组参数中的至少一个参数是参数(iv)或(v)。
[0114]
在可以与前一个实施例结合使用的另一个实施例中,至少一个参数是参数(vii)或(viii),即,第3组或第4组。
[0115]
在真空辅助计量与填充装置配备有超声波装置以辅助api的计量和分配的情况下,sbfe为29或更小、比如不超过25可以是有利的。在这种情形下,cps可以高达65%。
[0116]
在一个实施例中,wfa不超过34,和/或cps不超过35。
[0117]
在真空辅助计量与填充装置配备有搅拌器以辅助api的计量和分配的情况下,si为0.83至1.18、比如0.9至1.1,并且cps不超过35%,可以是有利的。
[0118]
因此,本发明还提供了一种用于使用上文描述的8参数模型(其所有实施例)来预测api是否适合于被直接作为净api配制在药物产品中的方法。
[0119]
通常,该方法的步骤(a)包括湿法阶段(图2,非常左侧的部分),在该阶段中,产生净api。常见地,这样的湿法阶段包括结晶步骤。这个结晶步骤已经可以以实现净api的晶体的期望粒度的方式被控制。用于在结晶过程中控制粒度的参数和手段是本领域熟知的,并且包括温度、湿度、ph、搅动的设置以及合适的盐、缓冲剂和有机溶剂的选择。这些参数的选择随着所讨论的api而变化,并且它们的确定是api产生过程的一部分。在结晶后,通常将api过滤并干燥。
[0120]
然而,在另外的实施例中,该方法的步骤(a)可以进一步包括api的湿法碾磨,这将进一步减小粒度。
[0121]
粒度也可以通过在湿法阶段期间添加添加剂来控制。合适的添加剂典型地用作悬浮液、溶液或固体。在添加所述添加剂的过程期间添加剂是身份和时间点是特异于开发过程所针对的api的。替代性地或另外,还可以在湿法阶段期间对api添加添加剂以改善工艺性能或表面特性益处,比如更好的可润湿性。
[0122]
可以在制造过程期间,例如在结晶步骤期间、在过滤步骤期间、和/或在干燥步骤期间,在一个或多个时间点添加添加剂。例如,api主颗粒可以在结晶期间在湿法阶段中用聚合物涂覆,或在结晶之后或在碾磨之后以悬浮液的形式涂覆。
[0123]
所使用的添加剂的比率始终足够低,以便不影响api的含量均匀性也不会影响质量传感器测量的准确性。这是与传统配制品相反的概念,在传统配制品中,api总是在显著量的赋形剂中稀释,尤其是对于低剂量而言。相应地,添加剂的添加量非常低。例如,可以在结晶步骤、过滤步骤或干燥步骤期间或之后添加一种或多种添加剂,其量为最多2%(w/w)、优选地最多1.5%(w/w)、更优选地最多1%(w/w)、甚至更优选地最多0.5%(w/w)、并且最优
选地最多0.1%(w/w)。所述一种或多种添加剂可以选自由以下组成的组:羟丙基纤维素、羟丙基甲基纤维素、聚乙烯基吡咯烷酮、丙烯酸类聚合物、月桂基硫酸钠、明胶、糖酯(比如蔗糖单硬脂酸酯和蔗糖单棕榈酸酯)、及其任意组合。
[0124]
在湿法阶段之后,可以可选地将api在干法阶段中进一步调节。例如,该方法的步骤(a)可以进一步包括api的干法碾磨和/或筛分。筛分可以选自通过锥形筛分设备的筛分、振荡筛分、或借助超声振动的筛子筛分。
[0125]
并且,在干法阶段中,可以在物理特性增强的背景下对api加工并且进一步用细的添加剂涂覆,以获得工艺性能益处(加工助剂和表面特性助剂;参见图2的左中部分)。例如,在一些实施例中,该方法的步骤(a)进一步包括干法阶段,在所述干法阶段中,添加一种或多种添加剂,其量为最多5%(w/w)、优选地最多4%(w/w)、更优选地最多3%(w/w)、甚至更优选地最多2%(w/w)、并且最优选地最多1%(w/w)。
[0126]
添加剂典型地可以在湿法阶段中将api隔离之后再添加,由此正好在干法阶段api调节过程之前或作为该过程的一部分而添加。可以利用在商业环境中可获得的成熟技术。例如,通过以下方式来添加一种或多种添加剂:(i)低剪切混合、尤其在转鼓混合器中;(ii)高剪切混合、尤其在旋转混合器中;或(iii)非常高的剪切混合、尤其在机械融合机中。混合典型地进行至少3分钟且最多三小时的持续时间。
[0127]
在干法阶段期间,典型地将添加剂作为固体使用。在某些实施例中,一种或多种添加剂选自下组:疏水性胶体二氧化硅、亲水性胶体二氧化硅、硬脂酸镁、硬脂酸、硬脂富马酸钠、泊洛沙姆188、氢化植物油、或其任意组合。
[0128]
在本发明方法的步骤(a)中的添加剂添加及其不同的加工方法的意图首先是为了获得足够水平的粉末流变特征。
[0129]
在任何情况下,步骤(a)中提供的最终净api包含最多5%(w/w)的添加剂,优选地最多4%(w/w)、更优选地最多3%(w/w)、甚至更优选地最多2%(w/w)、并且最优选地最多1%(w/w)。
[0130]
如上所述,技术人员知道如何调节粉末参数以符合步骤(a)中提出的要求。在一种并列情形下,还可以在指示的范围内添加添加剂,以实现api的生物药物曲线方面的改善。此外,扫描电子显微镜(sem)给出了粒度和形状的定性印象。它只能用作视觉指导,因为小的样本大小可能无法代表批次。
[0131]
作为品质适合于直接封装的净api的hdm201
[0132]
hdm201(inn:siremadlin)还被称为(6s)
‑5‑
(5
‑
氯
‑1‑
甲基
‑2‑
氧代
‑
1,2
‑
二氢吡啶
‑3‑
基)
‑6‑
(4
‑
氯苯基)
‑2‑
(2,4
‑
二甲氧基嘧啶
‑5‑
基)
‑1‑
(丙
‑2‑
基)
‑
5,6
‑
二氢吡咯并[3,4
‑
d]咪唑
‑
4(1h)
‑
酮;或(s)
‑5‑
(5
‑
氯
‑1‑
甲基
‑2‑
氧代
‑
1,2
‑
二氢
‑
吡啶
‑3‑
基)
‑6‑
(4
‑
氯
‑
苯基)
‑2‑
(2,4
‑
二甲氧基
‑
嘧啶
‑5‑
基)
‑1‑
异丙基
‑
5,6
‑
二氢
‑
1h
‑
吡咯并[3,4
‑
d]咪唑
‑4‑
酮。
[0133]
hdm201可以呈现为共晶、或包括水合物的溶剂化物、并且能够分别抑制肿瘤抑制蛋白p53或其变体与mdm2和/或mdm4蛋白或其变体之间的相互作用,尤其是与mdm2和/或mdm4蛋白或其变体的结合。
[0134]
在wo 2013/111105 a1(第205
‑
207页)中、尤其在实例101和102中描述了hdm201的合成。
[0135]
在wo 2013/111105 a1(第391
‑
393页)中还描述了hdm201的晶型、尤其琥珀酸共晶
体(方法d,实例102的晶型b)、乙醇溶剂化物(方法c,实例102的晶型a)和水合物(方法e,实例102的晶型a)。
[0136]
wo 2013/111103 a1的内容(尤其第205
‑
207和391
‑
393页、pct权利要求21至23、图3至图5)通过引用并入本文。
[0137]
hdm201琥珀酸共晶体(本文还称为hdm201
‑
bba)在hdm201游离形式与作为共晶形成剂的琥珀酸之间具有1∶1的化学计量摩尔比。hdm201
‑
bba对药学过程尤其具有挑战性,因为它可能在水性介质中歧化成游离形式。甚至在存在润滑剂的情况下进一步粘至工艺设备(例如冲头)。
[0138]
然而,发现可以通过一些结晶程序来制备hdm201
‑
bba,其品质适合于根据本文所述的方法直接封装。
[0139]
从hdm201游离形式的乙醇溶剂化物开始,可以通过从溶剂体系乙酸乙酯(estp)/水中结晶并去除乙醇和水、例如通过共沸蒸馏,来获得合适品质的hdm201
‑
bba。优选地,结晶包括以下步骤:将hdm201溶液加热至60
‑
75℃(优选70℃)并且在40
‑
60℃(优选45
‑
50℃)下接种并结晶。
[0140]
替代性地,可以由溶剂体系甲基乙基酮(mek)/正庚烷(hptn)来获得hdm201
‑
bba。优选地,所述结晶包括以下步骤:将hdm201乙醇溶剂化物与甲基乙基酮中的琥珀酸加热至70
‑
80℃、在冷却至60
‑
70℃后添加庚烷并在此温度下接种。优选地,非常缓慢地加入庚烷。
[0141]
通过上述结晶过程,可以获得高堆积密度的块状致密颗粒形状、并且其品质非常符合期望的ft4特性的hdm201
‑
bba。
[0142]
可以通过针磨将hdm201
‑
bba晶体研磨成期望的粒度。
[0143]
较粗糙的品质可以直接用标准的真空滚筒填充器装置封装。非常精细的批次适合于音波填充器装置。
[0144]
因此,通过如本文描述的结晶方法产生的hdm201
‑
bba适用于在宽粒度范围内(x90(lld):10
‑
200微米)直接封装。
[0145]
净api填充到胶囊中
[0146]
在该方法的步骤(b)中,使用真空辅助计量与填充装置来将步骤(a)的api分配到药物载体的底部中。这样的装置允许从低于0.25mg到半克的投加量,从而在整个范围内提供高精度的投加。因此,本披露的方法允许高精度地投加可以低至0.25mg的总填充质量,而无需包括任何经典的配制步骤。真空辅助计量与填充装置允许填充流动性差且内聚性的粉末。在剂型形成过程中,对粉末施加的机械应力低,并且相对于其他填充原理,降低了粘附到设备表面的风险。与传统上用于固体口服产品的大规模封装的常规技术相比,这些优点为净药物物质的封装提供了更大范围的可加工粉末特性和更高的工艺鲁棒性。
[0147]
步骤(b)仅在步骤(a)的要求被满足时才起作用,因此步骤(a)和(b)是相互关联的。相应地,本披露允许使用真空辅助计量与填充装置来确定粉末是否可以被分配和计量。与此同时,本披露向技术人员提供了有价值的指导:某种api必须如何(重新)配置来使得其适合于通过真空辅助计量与填充装置进行分配。
[0148]
虽然使用真空辅助计量与填充装置、比如滚筒填充器技术是在以吸入产品为重点的制药工业中熟知的,但是其针对使用净api的口服剂型制造的应用却被认为是独特的。相应地,在优选的实施例中,该药物产品是口服剂型。在工业中,更常见的是使用定量器或捣
固销填充原理将配制好的共混物或粒状材料投加到胶囊中。
[0149]
使用真空辅助计量与填充装置是特别有利的,因为它允许在连续过程中应用本披露的方法。因此,本发明的方法可以在用于生产药物产品的高产量工艺中使用,从而允许70,000单元/小时或甚至更高的生产率。因此,本方法允许在药物药品的所有开发阶段(包括其最终的商业生产)中使用“净api”、即包含最多5%(w/w)的添加剂的api来制备药物产品。不包括本方法的步骤(a)和(b)的现有技术方法仅展现出低产量。为了实现高产量生产,必须在各个开发阶段以药物组合物的形式来(重新)配制api。
[0150]
在优选的实施例中,所述真空辅助计量与填充装置是可旋转滚筒。例如,对滚筒空腔施加
‑
100至
‑
800mbar、比如
‑
200至
‑
800mbar、优选也
‑
300至
‑
800mbar、更优选地
‑
400至
‑
800mbar、比如
‑
500至
‑
800mbar、或甚至
‑
600至
‑
800mbar的真空。在某些实施例中,真空还可以高于
‑
800mbar。独立于所施加的真空,可以在100至1500mbar、优选地从200至1500mbar、更优选地从300至1500mbar、比如从400至1500mbar、特别地从500至1500mbar、更优选地从600至1500mbar、比如700至1500mbar、甚至更优选地800至1500mbar、尤其900至1500mbar、或甚至1000至1500mbar的弹出压力下分配api。在某些实施例中,甚至可能有利的是,在超过1500mbar的弹出压力下分配api。
[0151]
在真空辅助计量与填充装置是可旋转滚筒的情况下,所述可旋转滚筒可以由一些特定的额外特征来辅助,这些特征扩宽了可以填充的粉末特征的范围。这些特征包括使用超声换能器(超声仪)在滚筒空腔附近的沟槽中对粉末进行流化,所述超声换能器使探头附近的粉末流化,并且允许api更自由地流入滚筒空腔中,以克服某些粉末的差流动特征。例如,真空辅助计量与填充装置可以配备有搅拌器,并且其中,所述搅拌器被设定为1
‑
4转每循环、例如从约2转至4转每循环或从约1转至3转每循环或从约2转至约3转每循环。在替代方案中,所述真空辅助计量与填充装置可以配备有音波/超声波装置、尤其将粉末推到可旋转滚筒空腔中并破坏粉末的微桥的弹簧杆(pogo)或杆柱(pole)。例如,所述弹簧杆或杆柱采用10,000hz至180,000hz、优选地11,000hz至170,000hz、更优选地12,000hz至160,000hz、更优选地13,000hz至150,000hz、更优选地14,000hz至140,000hz、更优选地15,000hz至130,000hz、更优选地16,000hz至120,000hz、更优选地17,000hz至110,000hz、更优选地18,000hz至100,000hz、更优选地19,000hz至90,000hz、更优选地20,000hz至80,000hz、更优选地21,000hz至70,000hz、更优选地21,500hz至60,000hz、更优选地22,000hz至50,000hz、更优选地22,000hz至40,000hz、更优选地22,000hz至30,000hz的的频率,并且最优选地约22,000hz的频率。
[0152]
技术人员可以取决于api的粉末流变学在搅拌器或音波/超声波装置之间选择。具体地,如果mps
‑
15为28或更小,和/或wfa为31
°
或更小,则api适合于结合配备有音波/超声波装置以辅助api的计量和分配的真空辅助计量与填充装置来使用。另一方面,如果si大于1.1,则api不适合结合配备有搅拌器以辅助api的计量和分配的真空辅助计量与填充装置来使用。同样参见下文的实例。
[0153]
其他实施例涉及使用声学装置与包封件,其用于将沟槽中的api整平并且确保均匀的粉末床。还使用类似的声学系统来调节料斗中的粉末并确保从料斗流到沟槽。相应地,在另外的实施例中,真空辅助计量与填充装置可以包括配备有流化装置的粉末沟槽。这样的装置的实例是声学扬声器,其可以由或不由超声换能器支撑。在特定的实施例中,考虑了
从振动料斗到粉末沟槽进行给料,其中,所述料斗优选地由传感器激活。在优选的实施例中,传感器是电容传感器。在某些实施例中,从料斗到粉末沟槽进行给料而进入所述粉末沟槽中,其各自配备有使用100hz至1000hz的频率的音波装置,其中,所述料斗优选地由传感器、尤其电容传感器激活。可以使用200hz至900hz、300hz至800hz、400hz至700hz、或500hz至600hz的频率。
[0154]
步骤(b)中api的剂量可以在0.1mg至550mg、优选地0.2mg至500mg、并且最优选地0.25mg至450mg的范围内适当地选择。优选地,步骤(b)中api的投加具有小于5%、优选地小于4%、更优选地小于3%的相对标准偏差(rsd)。通常,使用填充质量测量技术对在步骤(b)中api的投加进行重量检查。例如,可以使用毛重
‑
皮重(brutto
‑
tara)称重来对api的投加进行离线重量检查。然而,在优选的实施例中,使用电容和/或微波传感器、尤其通过使用电容传感器,来对api的投加进行实时重量检查,以实现100%填充重量控制。从低产量设备到高产量设备均可获得这种在线填充质量验证。该传感器的工作原理是对掉落穿过两个电容器板之间的空腔中的粉末进行微波和/或电容性的非接触式测量。在测量期间,捕获电场的变化并将其与粉末的填充重量关联。
[0155]
如今,基于电容的传感器集成到胶囊填充机器中,并且通常用于投加几毫克粉末。理论上将传感器针对亚毫克范围进行设定的方式也是公知常识:电容器到传感器中的距离需要减小,从而得到更高的电场。然而,这最终导致传感器通道的直径较小,粉末团掉落穿过所述传感器通道并被测量。对于未优化的粉末,这通常会导致粉末团碰撞通道壁、或甚至掉落到传感器的顶部边缘上或胶囊本体之外。此外,普通粉末的分配通常导致形成翻滚的团,因此在动态测量此类下落物体时传感器读数不充分。为了在亚毫克区域内使用此类基于电容的传感器,配制品需要产生稳定的粉末团或独特的气载质量,从而能够穿过小直径的传感器通道而不会破碎或翻滚,这是本发明的方法所追求且已获得的。
[0156]
在图1中,示出了在胶囊填充机中使用这样的传感器进行测量的简化方案。所述胶囊填充机包括真空滚筒10,所述真空滚筒可围绕轴线r旋转并且设有空腔12。空腔12的至少底部由压力可渗透的材料制成,例如允许在空腔12内集聚期望压力的过滤材料。为了对空腔12填充粉末,将真空滚筒10旋转以将空腔12置于粉末储存器(未示出)下方。此外,在空腔12内建立低于大气压的压力。因此,来自粉末储存器的粉末被供应到空腔12中,在该空腔中,可以以高精度来控制粉末的投加。之后,将真空滚筒10旋转到图1所示的位置,并且在空腔12内建立高于大气压的压力。因此,在空腔12中形成的粉末团14从空腔12中弹出。在空腔12中形成的粉末团14穿过基于电容的传感器16落入胶囊本体18中,从而允许在线测量粉末填充重量。
[0157]
空中测量是几乎即时的;它对机器的运行振动不敏感并且尤其直接地实时确定净填充重量。此外,这些测量原理与胶囊外壳的重量变化无关。这些传感器典型地用于监测、优选地100%分选常规载体(例如胶囊)或具有片剂方面的专用载体、最优选地用于实时释放测试。这些传感器典型地用于确定载体的填充重量。已经开发出流程来分析验证这些传感器。这些验证流程已经从用于片剂的近红外光谱法适配,在所述方法中,使用预测均方根误差对nir与hplc进行一对一并行测试是常见的做法。因此,当使用通过电容和/或微波传感器进行实时重量控制时,传感器相对于分析参考工具(比如hplc或天平)的预测均方根误差(rmsep)小于5%、优选地小于4.5%、更优选地小于4%、并且最优选地小于3.5%。
[0158]
接着,将净或改良的api封装到具有至少两个部分、比如盖部和底部的常规药物载体中。在实施例中,在步骤(c)之前通过振动、摇动或敲击,使所述api在所述药物载体的底部中压实。
[0159]
将载体部件(本体和盖)分别装入机器中,所述机器能够操作这些零件、将其定向、并且输送穿过两个独立的通道直至粉末填充站。在填充之后,将底部和顶部接合并压到一起,以形成最终的载体单元。
[0160]
通过并行的投加生产线可以容易地实现技术的规模扩大,这允许在开发过程的所有填充试验阶段获得代表性的且可传递的结果。设备之中使用的传感器系统始终相同。这种总体组合实现了非常灵活的填充系统,所述系统允许快速响应于不同的临床和市场需求,从而适应基于不同api的多种药物产品、使用小的制造区域占地面积、并且潜在地降低了药物开发和加工的成本。相应地,本披露设想了在连续过程中、和/或在用于生产药物产品的高产量工艺中使用上述方法。在这种背景下,高产量是指至少25,000单元/小时、优选地大于30,000单元/小时、更优选地大于40,000单元/小时、更优选地大于50,000单元/小时、更优选地大于60,000单元/小时、并且最优选地至少70,000单元/小时。
[0161]
在图3中,示出了在胶囊填充机中使用多个传感器16进行测量的简化方案(例如,三个轨道)。如上文参见图1详细描述的,在具有若干个空腔12的滚筒10中产生的粉末团14掉落穿过传感器16进入胶囊18中,从而允许对于多个投加站来在线测量粉末质量,以给出独立的填充重量值。
[0162]
药物载体
[0163]
药物载体包括口服剂型以及干粉吸入器单剂量形式。药物载体包括常规胶囊,例如由比如明胶或羟丙甲纤维素等材料制成的两件式胶囊。作为将净或改良的api填充到常规胶囊中的替代方案,还可以将api填充到注射模制的容器中,比如本文描述的prescido
tm
容器。prescido
tm
容器是以与胶囊相同的方式进行填充的胶囊,但是具有膜包衣片剂的外观。在希望除了常规胶囊剂外的剂型呈现的情况下,这为市场创造了额外的呈现选项以供选择。图4(顶行)示出了prescido
tm
平台的一系列设计。
[0164]
如从图4中显而易见的,prescido
tm
容器可以具有不同的设计和不同的填充体积。具体地,这些容器可以具有各种直径和高度,使得可以例如根据要填充到容器中的粉末的体积来选择适当的容器。相比胶囊形状,这些容器典型地被选择成具有片剂形状、比如盘形形状。当考虑药物载体的盖部和底部时,胶囊形状将沿着从底部的中心到盖部的中心延伸的中央轴线是长形的。因此,对于传统的胶囊,盖部和底部的横向延伸量、尤其直径与组装好的盖部和底部沿着中央轴线的高度之比将小于1∶1、比如0.5∶1或更小。例如,类型000的胶囊的直径为5.32mm并且高度为14.3mm(比率为0.37∶1),而类型4的胶囊的直径为9.55mm并且高度为26.1mm(比率也为0.37∶1)。相比之下,片剂形状的载体具有更扁平的形状、并且具有大于1的比率(1∶1基本上为球形)。因此,药物载体优选地被设计成使得盖部和底部的横向延伸量、尤其直径与组装好的盖部和底部的高度之比是>1、优选地≥1.4、更优选地≥1.5、甚至更优选地≥2、最优选地≥2,4、并且尤其≥2.5。
[0165]
优选地,所述药物载体的盖部和底部具有互补的闭合机构。进一步优选的是,所述互补的闭合机构是互锁卡扣机构。这种操纵原理是独特的,并在全球范围内首次在药物粉末填充机上实现。
[0166]
可商购的胶囊通过浸涂工艺来制造。这涉及具有聚合物/水混合物的储液并将销浸入,使得销涂覆有混合物。然后将销从混合物中提起,并且将销上的聚合物混合物干燥以形成硬胶囊,然后将其移除。另一方面,prescido
tm
载体是经由注射模制来制造的。注射模制涉及在螺杆中使材料熔融,然后用其将熔体在高压下注入到模具中,在模具中熔体被快速冷却,然后被弹出。这个过程具有优于浸涂的许多优点:过程可以极其精确,因为电驱动器精确地控制机器的运动,这与对于过程参数(比如,温度、压力以及模具精度)的非常紧的控制一起得到了部件的高均匀性。
[0167]
此外,使用注射模制为复杂的部件几何形状提供了机会。在浸渍模制中,胶囊的外部和内部几何形状两者都限于销的形状,而注射模制成的部件的形状由模具形状限定,这可以在载体的每个面上获得多个特征。
[0168]
传统胶囊的组成限于聚合物,聚合物在分散于水中时具有正确的流变特性和成膜特性。然而,注射模制是热熔工艺,其需要非常不同的材料特性。这样既提出了摆脱比如明胶(是源自动物的,其机械性能取决于环境条件)和hpmc(溶解滞后时间)等传统胶囊材料的机会,还因为注射模制工艺对所需的材料特性要求很高而提出了挑战。这些材料在工艺期间必须是热稳定的、必须具有良好的熔体流动特性
‑
特别是在高剪切条件下、必须在冷却后足够柔性以从机器中弹出、并且对于本技术而言必须机械强度高以能够进行药物加工并迅速溶于水中。此外,该材料必须适合人类食用并且已被批准用于药物用途。
[0169]
本发明人已经发现,适合于注射模制的配制品可以是基于聚环氧乙烷(peo)。测试了不同分子量peo的比率,以实现具有正确的理化特性的配制品。
[0170]
在本背景下,本披露进一步提供了一种用于注射模制药物载体的配制品,其中,所述配制品包括43.5
‑
97%(w/w)的一种或多种重均分子量为m
w 94,000
‑
188,000的聚环氧乙烷聚合物;3
‑
7%(w/w)的抗粘剂;以及可选地一种或多种赋形剂。
[0171]
适合于注射模制药物载体的配制品具有m
w 94,000
‑
188,000的重均分子量。在优选的实施例中,所述聚环氧乙烷聚合物的重均分子量为m
w 95,000
‑
185,500、更优选地为m
w 97,500
‑
183,000、更优选地为m
w 100,000
‑
175,000、更优选地为m
w 102,000
‑
165,000、更优选地为m
w 105,000
‑
150,000、甚至更优选地为107,500
‑
130,000、并且最优选地为m
w 110,000
‑
115,000。
[0172]
所述聚环氧乙烷聚合物可以包括一种或多种重均分子量为约m
w 100,000的聚环氧乙烷、重均分子量为约m
w 200,000的聚环氧乙烷、重均分子量为约m
w 300,000的聚环氧乙烷、重均分子量为约m
w 600,000的聚环氧乙烷、以及重均分子量为m
w 8,000的聚环氧乙烷,优选地由其组成。此类聚环氧乙烷是可商购的。
[0173]
在特定的优选实施例中,所述聚环氧乙烷聚合物包括35
‑
80%(w/w)的重均分子量为m
w 100,000的第一聚环氧乙烷、以及4
‑
28.5%(w/w)的重均分子量为m
w 200,000的第二聚环氧乙烷。在另外的优选实施例中,所述配制品可以包括41
‑
77.5%(w/w)、优选地42
‑
76%(w/w)、更优选地43
‑
75%(w/w)、更优选地45
‑
74%(w/w)、更优选地50
‑
74%(w/w)、并且最优选地约73.5%(w/w)的所述第一聚环氧乙烷。在某些优选的实施例中,所述配制品包括4
‑
27.5%(w/w)、优选地5
‑
25%(w/w)、更优选地6
‑
22%(w/w)、更优选地10
‑
21%(w/w)、更优选地11
‑
20.5%(w/w)、并且最优选地约20%(w/w)的所述第二聚环氧乙烷。
[0174]
在另外的实施例中,所述用于注射模制药物载体的配制品包括3.5
‑
6.5%、优选地
4
‑
6%(w/w)、甚至更优选地4.5
‑
5.5%(ww)、并且最优选地约5%的抗粘剂。特别优选的抗粘剂是滑石。
[0175]
在一个实施例中,所述配制品包括0
‑
6%(w/w)的一种或多种着色剂和/或遮光剂、优选地0.01
‑
5%(w/w)的一种或多种着色剂和/或遮光剂、更优选地0.25
‑
4%(w/w)的一种或多种着色剂和/或遮光剂、更优选地0.5
‑
3%(w/w)的一种或多种着色剂和/或遮光剂、更优选地0.75
‑
2.5%(w/w)的一种或多种着色剂和/或遮光剂、更优选地1
‑
2%(w/w)的一种或多种着色剂和/或遮光剂、更优选地1
‑
1.5%(w/w)的一种或多种着色剂和/或遮光剂、并且最优选地约1%(w/w)的一种或多种着色剂和/或遮光剂。
[0176]
进一步优选的是,所述配制品包括0.01
‑
1%(w/w)的抗氧化剂、优选地0.05
‑
0.8%(w/w)的抗氧化剂、更优选地0.1
‑
0.75(w/w)的抗氧化剂、更优选地0.2
‑
0.7(w/w)的抗氧化剂、更优选地0.3
‑
0.6(w/w)的抗氧化剂、更优选地0.4
‑
0.5(w/w)的抗氧化剂、并且最优选地约0.5%(w/w)的抗氧化剂。
[0177]
在某些实施例中,配制品包含:30
‑
38%(w/w)的填充剂,优选地32
‑
38%(w/w)、更优选地34
‑
36%(w/w);特别地其中,所述填充剂是滑石。
[0178]
所述盖部和所述底部中的至少一者具有厚度为180
‑
250μm、优选地185
‑
225μm并且甚至更优选地190
‑
220μm的第一壁区段,以及厚度为350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的第二壁区段。
[0179]
第一壁区段的厚度已经被优化为190至220μm。这足够厚而使得在经由注射模制来制造药物载体期间,材料可以流动穿过薄的第一壁区段、并且仍可靠地填充第二壁区段的较厚的带壁的面积;同时又足够薄以实现为了获得填充化合物的立即释放溶解曲线而需要的快速载体崩解。第二壁区段已经被优化为400μm的厚度。在此,在具有更大的可用于填充的内部容积与具有进行填充和操纵所需的机械强度(包括在填充后抵抗打开)之间实现了平衡。
[0180]
盖部的第一壁区段可以限定盖部的顶部分的至少一部分。优选地,盖部的第一壁区段限定盖部的整个顶部分,使得在薄的第一壁区段崩解时,实现填充到药物载体中的化合物经由盖部的顶部分崩解而快速且可靠地释放。
[0181]
盖部的第二壁区段可以限定盖部的侧壁部分的至少一部分。例如,盖部的第二壁区段可以限定盖部的、邻近于盖部的顶部分布置的肩部或拐角。具体地,盖部的第二壁区段可以从第一壁区段、即特别是盖部顶部分、沿着其外圆周朝底部的方向延伸。这种设计使盖部具有操纵盖部以及将其与底部相连形成期望的药物载体所需要的机械稳定性。
[0182]
在药物载体的优选实施例中,底部的第一壁区段限定底部的底部分的至少一部分。优选地,底部的第一壁区段限定底部的底部分,使得在薄的第一壁区段崩解时,实现填充到药物载体中的化合物经由底部的底部分崩解而快速且可靠地释放。
[0183]
底部的第二壁区段可以限定盖部的侧壁部分的至少一部分。具体地,底部的第二壁区段可以从第一壁区段、即特别是底部的底部分、沿着其外圆周朝盖部的方向延伸。优选地,底部的第二壁区段的高度大于盖部的第二壁区段的高度。换言之,在药物载体的优选实施例中,底部具有总体上中空的圆柱形形状、并且因此限定了可以被填充药物化合物的“器皿”。相反,盖部(可以设有第二壁区段,第二壁区段仅限定了环绕盖部的顶部分的肩部或拐角)可以具有总体上“扁平的”形状。与第一壁区段相比,第二壁区段的更大壁厚度对底部提
供了机械强度和稳定性,以允许不受阻碍地对底部填充药物化合物。
[0184]
在优选的实施例中,盖部和底部通过互补的闭合机构彼此连接。互补的闭合机构提供了盖部与底部之间的可靠且易于建立的连接。
[0185]
更具体地,闭合机构可以包括第一卡扣部,第一卡扣部从底部的第二壁区段突出以便面向第二卡扣部并与之相互作用,第二卡扣部从盖部的第二壁区段突出。在闭合药物载体时,即,在将盖部连接至底部时,第一和第二卡扣部中的至少一者可以弹性地变形。在盖部和底部已经到达其最终相对位置时,即,在盖部被定位在底部的顶上而根据期望来密封底部的内部时,第一和第二卡扣部中的至少一者的弹性变形可以释放,其方式为使得这些卡扣部彼此完好从而将盖部和底部可靠地相连。
[0186]
例如,第一卡扣部可以包括突出部,突出部被适配成与设置在第二卡扣部上的对应突出部相接合,以便阻止第一卡扣部和第二卡扣部的分离、并且因此防止盖部和底部的分离。特别地,第一卡扣部的突出部可以包括第一抵接表面,第一抵接表面面向底部并且被适配成抵接第二抵接表面,第二抵接表面被形成在第二卡扣部上、并且在底部和盖部彼此连接时面向盖部。形成在第一卡扣部上的第一抵接表面可以相对于底部的侧壁部分呈90至150
°
角延伸。形成在第二卡扣部上的第二抵接表面可以相对于盖部的侧壁部分呈90至150
°
角延伸。
[0187]
设置在第一卡扣部上的突出部可以沿第一卡扣部的自由端的方向渐缩以便形成第一倾斜接合表面。第一倾斜接合表面可以被适配成与第二倾斜接合表面相接合,第二倾斜接合表面在设置在第二卡扣部上的、沿第二卡扣部的自由端的方向渐缩的突出部上形成。在将药物载体的盖部连接至底部时,第二倾斜接合表面可以沿着第一倾斜接合表面滑动,由此引导设置在第一卡扣部上的突出部与设置在第二卡扣部上的对应突出部相接合。因此,简化了盖部与底部的连接。
[0188]
第一和第二卡扣部中的一者可以从盖部或底部的第二壁区段在第二壁区段的内圆周的区域中突出,其中,第一和第二卡扣部中的另一者可以从盖部或底部的第二壁区段在底部的第二壁区段的外圆周的区域中突出。优选地,设置在药物载体的底部上的第一卡扣部从底部的第二壁区段在第二壁区段的内圆周的区域中延伸。如此设计的第一卡扣部特别适合于与从盖部的特别是肩部或拐角形第二壁区段在盖部的第二壁区段的外圆周的区域中突出的第二卡扣部相互作用。
[0189]
闭合机构可以进一步包括内肋,内肋从盖部或底部的第二壁区段在第二壁区段的内圆周的区域中、在距从盖部或底部的第二壁区段在第二壁区段的外圆周的区域中突出的第一或第二卡扣部一定距离处突出。特别地,闭合机构可以包括内肋,内肋从盖部的第二壁区段在其内圆周的区域中、并且因此在距从盖部的特别是肩部或拐角形第二壁区段沿在外圆周的区域突出的第二卡扣部一定距离处突出。因此,内肋和第二卡扣部之间限定了空隙,空隙被适配从在药物载体的盖部和底部彼此连接时容纳第一卡扣部。在盖部和底部的已连接状态下,第一卡扣部由于与第二卡扣部的相互作用、即特别是由于形成在第一卡扣部上的第一抵接表面与形成在第二卡扣部上的第二抵接表面的相互作用,而在内肋与第二卡扣部之间的空隙中被固持在位,同时内肋提供了闭合机构的额外的机械稳定性和刚度。
[0190]
然而,还设想了特别是在底部设有以下第一卡扣部的情况下对药物载体的底部提供内肋,第一卡扣部从底部的第二壁区段在其外圆周的区域中突出、并且被适配成与第二
卡扣部相互作用,第二卡扣部从盖部的第二壁区段在其外圆周的区域中突出。在这种情况下,内肋和第一卡扣部之间可以限定空隙,空隙被适配成在药物载体的盖部和底部彼此连接时容纳第二卡扣部。
[0191]
优选地,内肋比与内肋相对布置的卡扣部更短。换言之,优选地,一个卡扣部与内肋一起限定了用于容纳另一个卡扣部的空隙,这个卡扣部从盖部的第二壁区段突出得比内肋突出的更远。另外,内肋可以沿内肋的自由端的方向渐缩以便形成第三倾斜接合表面,第三倾斜接合表面面向从盖部或底部的第二壁区段在第二壁区段的外圆周的区域中突出的并且因此与内肋相对布置的第一或第二卡扣部。优选地,设置在内肋上的第三倾斜接合表面基本上平行于设置在与内肋相对布置的卡扣部的突出部上的抵接表面延伸。因此,被适配成在药物载体的盖部和底部相连时容纳在内肋与同内肋相对布置的卡扣部之间所限定的空隙中的卡扣部被引导至与同内肋相对布置的卡扣部相接合。另外,所述内肋使卡扣闭合件稳定而不会打开。
[0192]
在药物载体的优选实施例中,盖部的第一壁区段、尤其在由制造盖部时到模具中的材料注入点所限定的区域中设有凹窝。这个凹窝的壁厚度可以大于第一壁区段的其余部分的壁厚度、但是小于盖部的第二壁区段的壁厚度。例如,凹窝可以布置在盖部的顶部分的中央区域中。可以在凹窝的表面上、尤其内表面上印制标记,所述标记指示在注射模制工艺期间在多腔模制工具上的模制出盖部的空腔。对于需要严格的重量均匀性的应用,这允许将盖部按腔室进行自动分类。
[0193]
替代于或附加于此,底部的第一壁区段、尤其在由制造底部时到模具中的材料注入点所限定的区域中设有凹窝。这个凹窝的壁厚度可以大于第一壁区段的其余部分的壁厚度、但是小于盖部的第二壁区段的壁厚度。例如,凹窝可以布置在底部的底部分的中央区域中。可以在凹窝的表面上、尤其内表面上印制标记,所述标记指示在注射模制工艺期间在多腔模制工具上的模制出底部的空腔。对于需要严格的重量均匀性的应用,这允许将底部按腔室进行自动分类。
[0194]
盖部和底部中的至少一者在其内表面的区域中可以设有多个内突出部,内突出部从第二壁区段的内表面、和/或内肋的内表面径向地向内突出。在设有内突出部的盖部或底部还设有内肋的情况下,内突出部在盖部或底部的中央轴线的方向上可以从盖部的顶部分或底部的底部分、沿着底部的盖部的第二壁区段、并且最终沿着从第二壁区段在其内圆周的区域中突出的内肋延伸。在设有内突出部的底部的盖部不包括内肋的情况下,内突出部在盖部或底部的中央轴线的方向上可以从盖部的顶部分或底部的底部分沿着盖部或底部的第二壁区段延伸。内突出部中的至少一个、特别是每一个可以包括突出鼻部,突出鼻部突出超过第二壁区段和/或内肋。
[0195]
内突出部特别是在设有突出鼻部时减少了所谓“嵌套”现象,即,使彼此上下堆叠的部和/或底部粘附在一起。因此,可以消除在手动和自动操纵期间可能由于难以分离的堆叠部“嵌套体”导致的困难。
[0196]
在药物载体的优选实施例中,底部可以设有成角度凹口。所述成角度凹口可以在底部的第二壁区段的外表面的、尤其邻近于第一卡扣部的区域中形成。所述成角度凹口可以从第一卡扣部的外圆周朝向第二壁区段的外表面径向地向外倾斜。有待填充到药物载体中的、在填充或闭合药物载体时意外地落到底部的凹口上的粉末可以被容易地去除。
[0197]
图5、图6a和图6b中更详细地示出了示例性药物载体20。载体20包括盖部22和底部24。盖部22(在图5的左侧和图6a中示出)包括第一壁区段26和第二壁区段28,所述第一壁区段限定盖部22的顶部分,所述第二壁区域限定所述盖部22的侧壁部分。特别地,盖部22的第二壁区段28限定盖部22的、邻近于盖部22的顶部分布置的肩部或拐角。具体地,盖部22的第二壁区段28从盖部22的顶部分沿着其外圆周、朝底部24的方向延伸。第一壁区段26具有的壁厚度小于第二壁区段28的壁厚度。在图5中所示出的载体20的优选实施例中,第一壁区段26具有的壁厚度为190μm至220μm,而第二壁区段28具有的壁厚度为约400μm。
[0198]
类似地,底部24(在图5的右侧示出)包括第一壁区段30和第二壁区段32,第一壁区段限定底部24的底部分,第二壁区段限定底部24的侧壁部分。底部24的第二壁区段32从底部24的底部分沿着其外圆周、朝盖部22的方向延伸。第一壁区段30具有的壁厚度小于第二壁区段32的壁厚度。在图5中所示出的载体20的优选实施例中,第一壁区段30具有的壁厚度为190μm至220μm,而第二壁区段32具有的壁厚度为约400μm。
[0199]
盖部22和底部24通过互补的闭合机构34彼此连接,所述闭合机构在图5以及图6b所示的详细视图中更详细地展示。闭合机构34包括第一钩形卡扣部36,第一钩形卡扣部从底部24的第二壁区段32在第二壁区段32的内圆周的区域中突出。第一钩形卡扣部36面向对应形状的第二钩形卡扣部38并与之相互作用,第二钩形卡扣部从盖部22的第二壁区段28在沿第二壁区段28的外圆周的区域中突出。然而,还可设想到对闭合机构34提供第一卡扣部36和第二卡扣部36,第一卡扣部从底部24的第二壁区段32在第二壁区段32的外圆周的区域中突出,第二卡扣部从盖部22的第二壁区段28在第二壁区段28的内圆周的区域中突出。
[0200]
如在图5和图6b所示出的详细视图中变得显而易见的,第一卡扣部36包含突出部37,该突出部在连接盖部22和底部24时被适配于与设置在第二卡扣部38上的对应突出部39接合。第一卡扣部36的突出部37包括面向底部24的第一抵接表面41。类似地,盖部22的突出部39包括面向盖部22的第二抵接表面43。形成在第一卡扣部36的突出部37上的第一抵接表面41相对于底部24的侧壁部分呈大致135
°
角延伸。形成在第二卡扣部38的突出部39上的第二抵接表面43相对于盖部22的侧壁部分呈大致135
°
角延伸。进一步,设置在第一卡扣部36上的突出部37沿第一卡扣部36的自由端的方向渐缩以便形成第一倾斜接合表面45。类似地,设置在第二卡扣部38上的突出部39同样沿第一卡扣部38的自由端的方向渐缩以便形成第二倾斜接合表面47。
[0201]
闭合机构34进一步包括内肋40,该内肋从盖部22的肩部或拐角形第二壁区段28在第二壁区段28的内圆周的区域中突出。因此,内肋40从盖部22的第二壁区段28、在距从盖部22的第二壁区段28在第二壁区段28的外圆周的区域中突出的第二卡扣部36一定距离处突出。因此,内肋40和第二卡扣部38之间限定了空隙,该空隙被适配用于在药物载体20的盖部22和底部24彼此连接时容纳第一卡扣部36。然而,在盖部22设有第二卡扣部38,该第二卡扣部被布置在第二壁区段28的内圆周的区域中以便与布置在底部24的第二壁区段32的外圆周的区域中的第一卡扣部38相互作用的情况下,还可设想到,闭合机构34包括内肋40,该内肋从底部24的第二壁区段32在第二壁区段32的内圆周的区域中突出。在这种情况下,是第一卡扣部36与内肋40一起限定了空隙,该空隙被适配用于在药物载体20的盖部22和底部24彼此连接时容纳第二卡扣部38。
[0202]
内肋40比与内肋40相对布置的第二卡扣部38更短,即,第二卡扣部38从盖部22的
第二壁区段28突出得比内肋40突出的更远。另外,内肋40沿内肋40的自由端的方向渐缩以便形成第三倾斜接合表面49,第三倾斜接合表面面向从盖部22的第二壁区段28在第二壁区段28的外圆周的区域中突出的并且与内肋40相对的第二卡扣部38。第三倾斜接合表面49基本上平行于设置在与内肋40相对布置的第二卡扣部38的突出部39上的第二抵接表面43延伸。在盖部22设有第二卡扣部38,该第二卡扣部被布置在第二壁区段28的内圆周的区域中以便与布置在底部24的第二壁区段32的外圆周的区域中的第一卡扣部38相互作用的情况下,形成在内肋40上的第三倾斜接合表面49可以面向从底部24的第二壁区段32在第二壁区段32的外圆周的区域中突出的并且与内肋40相对的第一卡扣部36。
[0203]
在闭合药物载体20时,即,在盖部22连接至底部24时,设置在第一卡扣部36的突出部37上的第一倾斜接合表面45与设置在第二卡扣部38的突出部39上的第二倾斜接合表面47相接触。当盖部22接近底部24时,第二倾斜接合表面47沿着第一倾斜接合表面45滑动,这造成第一卡扣部36和第二卡扣部38的略微弹性变形。具体地,第一卡扣部38略微径向地向内弯曲,而第二卡扣部36略微径向地向外弯曲。然而,第一卡扣部38的向内弯曲由内肋40限制。另外,设置在内肋40上的第三倾斜接合表面49将第二卡扣部38引导到第二卡扣部38与内肋40之间限定的空隙中的最终位置,参见图6b。
[0204]
当盖部22和底部24已经到达其最终相对位置,即,当盖部22定位在底部24的顶上以便密封底部24的内部时,第一卡扣部36和第二卡扣部38的弹性变形被释放,并且设置在第一卡扣部36的突出部37上的第一抵接表面41抵接设置在第二卡扣部38的突出部39上的第二抵接表面43。第一抵接表面41与第二抵接表面43之间的相互作用阻止底部24和盖部22的分离。内肋40提供了闭合机构34的额外的机械稳定性和刚度。
[0205]
盖部22的第一壁区段26在由制造盖部22时到模具中的材料注入点所限定的中央区域中设有凹窝42,所述凹窝的壁厚度大于第一壁区段26的其余部分的壁厚度、但仍小于盖部22的第二壁区段28的壁厚度。在凹窝42的内表面上印制了数字,在附图中为数字“1”,以指示在多腔模制工具上的模制出盖部22的空腔。类似地,底部24的第一壁区段30在由制造底部24时到模具中的材料注入点所限定的中央区域中也设有凹窝44,所述凹窝的壁厚度大于第一壁区段30的其余部分的壁厚度、但仍小于底部24的第二壁区段32的壁厚度。在凹窝44的内表面上印制了数字(附图中未示出),以指示在多腔模制工具上的模制出底部24的空腔。
[0206]
如从图6a变得显而易见的,盖部22进一步设有多个内突出部46,该内突出部分别从第二壁区段28的内表面和内环40的内表面径向地向内突出。在附图中所示出的盖部22的具体实施例中,设置有三个内突出部46。然而还可设想到,对盖部22提供少于或大于三个内突出部46。内突出部46用于放置彼此上下堆叠的多个部22在操纵期间卡住。每个内突出部46包括鼻部48,该鼻部从内肋40突出并且进一步降低了彼此上下堆叠的部22卡住的风险。在附图中所展示的载体20的实施例中,只有盖部22设置有内突出部46。然而还可设想到,替代性地或另外,载体20的底部24也设有内突出部,如本文所描述的。
[0207]
最终,如从图6b变得显而易见的,底部24设有成角度凹口50,该成角度凹口在第二壁区段32的外表面的邻近于第一钩形卡扣部36的区域中形成、并且从钩形卡扣部38的外圆周朝向第二壁区段32的外表面径向地向外倾斜。在闭合载体20时意外地落到凹口50上的粉末可以被容易地去除。
[0208]
有利的是,所述药物载体展现出各个载体部分的标准质量偏差为小于1mg、优选地小于0.8mg、更优选地小于0.6mg、甚至更优选地小于0.4mg、还更优选地小于0.3mg、还甚至更优选地小于0.2mg、并且最优选地小于0.1mg。
[0209]
实施例
[0210]
通过以下实施例进一步描述本发明。
[0211]
1.一种用于制备药物产品的方法,包括以下步骤:
[0212]
(a)提供活性药物成分(api),所述净活性药物成分符合如通过使用ft4粉末流变仪确定的以下参数(i)
‑
(viii)中的至少五个参数:
[0213]
(i)最多60mj/g的比基本流动能(sbfe);
[0214]
(ii)0.75至1.25的稳定指数(si);
[0215]
(iii)最多10mj/g的比能(se);
[0216]
(iv)在15kpa(mps
‑
15)下最多40的最大主应力;
[0217]
(v)在15kpa(ff
‑
15)下至少1.3的流函数;
[0218]
(vi)在15kpa(cbd
‑
15)下至少0.26g/ml的压实堆积密度;
[0219]
(vii)最多47%的压缩率;以及
[0220]
(viii)最多40
°
的壁摩擦角(wfa);
[0221]
(b)使用真空辅助计量与填充装置来将步骤(a)的所述api分配到药物载体的底部中;以及
[0222]
(c)用所述药物载体的互补盖部来封装所述药物载体的底部,从而生产药物产品。
[0223]
2.如实施例1所述的方法,其中,
[0224]
(i)所述sbfe为最多25mj/g、尤其最多6mj/g;和/或
[0225]
(ii)所述si为0.83至1.18、尤其0.9至1.1;和/或
[0226]
(iii)所述se为最多8mj/g、尤其最多6mj/g;和/或
[0227]
(iv)所述mps
‑
15为最多33、尤其最多25;和/或
[0228]
(v)所述ff
‑
15为至少3、尤其至少10;和/或
[0229]
(vi)所述cbd
‑
15为至少0.45g/ml、尤其至少0.6g/ml;和/或
[0230]
(vii)所述压缩率为最多35%、尤其3
‑
15%;和/或
[0231]
(viii)所述wfa为最多34
°
、尤其最多28
°
。
[0232]
3.如实施例1或2所述的方法,其中,通过使用ft4粉末流变仪和粉末表征方法、按每测量圆筒直径来确定参数(i)
‑
(viii):
[0233]
(i)25mm_1c_划分_rep vfr_r01;
[0234]
(ii)25mm_shear_15kpa;
[0235]
(iii)25mm_压缩率_1
‑
15kpa;以及
[0236]
(iv)25mm壁摩擦30kpa。
[0237]
4.如实施例1至3中任一项所述的方法,其中,所述真空辅助计量与填充装置是可旋转滚筒(10)。
[0238]
5.如实施例4所述的方法,其中,对所述滚筒空腔施加
‑
100mbar至
‑
800mbar的真空;和/或在100mbar至1500mbar的弹出压力下分配api。
[0239]
6.如实施例4或5所述的方法,其中,所述真空辅助计量与填充装置是可旋转滚筒
(10),所述可旋转滚筒配备有搅拌器或音波/超声波装置,以辅助所述api的计量和分配。
[0240]
7.如实施例6所述的方法,其中,所述真空辅助计量与填充装置配备有搅拌器,并且其中,所述搅拌器被设定为1
‑
4转每循环。
[0241]
8.如实施例6所述的方法,其中,所述真空辅助计量与填充装置配备有音波/超声波装置、尤其将粉末推到可旋转滚筒空腔中并破坏所述粉末的微桥的弹簧杆或杆柱,尤其其中,所述弹簧杆或杆柱的频率为10000hz至180,000hz、优选地约22,000hz。
[0242]
9.如实施例6至8中任一项所述的方法,其中,
[0243]
(i)如果所述mps
‑
15为28或更小,和/或所述wfa为31或更小,则所述api适合于结合配备有音波/超声波装置以辅助所述api的计量和分配的真空辅助计量与填充装置来使用;并且
[0244]
(ii)如果所述si大于1.1,则所述api不适合于结合配备有搅拌器以辅助所述api的计量和分配的真空辅助计量与填充装置来使用。
[0245]
10.如实施例4至8中任一项所述的方法,其中,所述真空辅助计量与填充装置包括粉末沟槽,所述粉末沟槽配备有超声换能器以及流化装置、尤其声学扬声器。
[0246]
11.如实施例10所述的方法,其中,从振动料斗到粉末沟槽进行给料而进入所述粉末沟槽中,其中,所述料斗优选地由传感器、尤其电容传感器激活。
[0247]
12.如实施例11所述的方法,其中,从料斗到粉末沟槽进行给料而进入所述粉末沟槽中,其各自配备有使用100hz至1000hz的频率的音波装置,其中,所述料斗优选地由传感器、尤其电容传感器激活。
[0248]
13.如实施例1至12中任一项所述的方法,其中,使用填充质量测量技术对所述api的投加进行重量检查。
[0249]
14.如实施例13所述的方法,其中,使用电容和/或微波传感器(16)、尤其通过使用电容传感器,来对所述api的投加进行实时重量检查。
[0250]
15.如实施例14所述的方法,其中,所述传感器(16)相对于分析参考工具、比如hplc或天平的预测均方根误差(rmsep)小于5%、优选地小于4.5%、更优选地小于4%、并且最优选地小于3.5%。
[0251]
16.如实施例13所述的方法,其中,使用毛重
‑
皮重称重来对所述api的投加进行离线重量检查。
[0252]
17.如实施例1至16中任一项所述的方法,其中,所述api包含最多5%(w/w)的添加剂,优选地最多4%(w/w)、更优选地最多3%(w/w)、甚至更优选地最多2%(w/w)、并且最优选地最多1%(w/w)。
[0253]
18.如实施例17所述的方法,其中,一种或多种添加剂选自下组:疏水性胶体二氧化硅、亲水性胶体二氧化硅、硬脂酸镁、硬脂酸、硬脂富马酸钠、月桂基硫酸钠、泊洛沙姆188、氢化植物油、或其任意组合。
[0254]
19.如实施例1至18中任一项所述的方法,其中,步骤(a)进一步包括对所述apu进行筛分,其中,筛分选自通过锥形筛分设备的筛分、振荡筛分、或借助超声振动的筛子筛分。
[0255]
20.如实施例1至19中任一项所述的方法,其中,步骤(b)中所述api的剂量在0.1mg至550mg、优选地0.2mg至500mg、并且最优选地0.25mg至450mg的范围内。
[0256]
21.如实施例1至20中任一项所述的方法,其中,步骤(b)中所述api的投加具有小
于5%、优选地小于4%、更优选地小于3%的相对标准偏差(rsd)。
[0257]
22.如实施例1至21中任一项所述的方法,其中,在步骤(c)之前通过振动、摇动或敲击,使所述api在所述药物载体的底部中压实。
[0258]
23.如实施例1至22中任一项所述的方法,其中,所述药物载体(20)的盖部(22)和底部(24)中的至少一者具有厚度为180
‑
250μm、优选地185
‑
225μm并且甚至更优选地190
‑
220μm的第一壁区段(26,30),以及厚度为350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的第二壁区段(28,32)。
[0259]
24.如实施例1至23中任一项所述的方法,其中,所述盖部(22)和所述底部(24)通过互补的闭合机构(34)彼此连接;
[0260]
特别地其中所述闭合机构(34)包括第一卡扣部(36),所述第一卡扣部从所述底部(24)的第二壁区段(32)突出以便面向第二卡扣部(38)并与之相互作用,所述第二卡扣部从所述盖部(22)的第二壁区段(28)突出;
[0261]
更特别地其中所述第一卡扣部(36)包括突出部(37),所述突出部被适配成与设置在所述第二卡扣部(38)上的对应突出部(39)相接合,以便阻止所述第一卡扣部(36)和所述第二卡扣部(38)的分离、并且因此防止所述盖部(22)和所述底部(24)的分离;
[0262]
甚至更特别地其中设置在所述第一卡扣部(36)上的突出部(37)沿所述第一卡扣部(36)的自由端的方向渐缩,以便形成第一倾斜接合表面(45),所述第一倾斜接合表面被适配成与第二倾斜接合表面(47)相接合,所述第二倾斜接合表面在设置在所述第二卡扣部(38)上的、沿所述第二卡扣部(36)的自由端的方向渐缩的突出部(39)上形成;
[0263]
最优选地其中所述第一和第二卡扣部(36,38)中的一者从所述盖部(22)或所述底部(24)的第二壁区段(28,32)、在所述第二壁区段(28,32)的内圆周的区域中突出,并且其中,所述第一和第二卡扣部(36,38)中的另一者从所述盖部(22)或所述底部(24)的第二壁区段(28,32)、在所述第二壁区段(28,32)的外圆周的区域中突出。
[0264]
25.如实施例24所述的方法,其中所述闭合机构(34)进一步包括内肋(40),所述内肋从所述盖部(22)或所述底部(24)的第二壁区段(28)在所述第二壁区段(28,32)的内圆周的区域中、在距从所述盖部(22)或所述底部(24)的第二壁区段(28,32)在所述第二壁区段(28,32)的外圆周的区域中突出的所述第一或第二卡扣部(36,38)一定距离处突出;
[0265]
特别地其中所述内肋(40)沿所述内肋(40)的自由端的方向渐缩,以便形成第三倾斜接合表面(49),所述第三倾斜接合表面面向从所述盖部(22)或所述底部(24)的第二壁区段(28,32)在所述第二壁区段(28,32)的外圆周的区域中突出的所述第一或第二卡扣部(36,38)。
[0266]
26.如实施例1至25中任一项所述的方法,其中,所述底部(24)设有成角度凹口(50),所述成角度凹口在所述底部(24)的第二壁区段(32)的外表面的、尤其邻近于所述第一卡扣部(36)的区域中形成;并且尤其从所述第一卡扣部(36)的外圆周朝向所述第二壁区段(32)的外表面径向地向外倾斜。
[0267]
27.如实施例1至26中任一项所述的方法在连续过程中的用途。
[0268]
28.如实施例1至26中任一项所述的方法在用于生产药物产品的高产量工艺中的用途。
[0269]
涉及hdm201琥珀酸共晶体的实施例
[0270]
通过以下实施例来进一步描述本发明,以下实施例具体涉及hdm201琥珀酸共晶体:
[0271]
1.以琥珀酸共晶体的形式存在的净活性药物成分(api)hdm201(siremadlin),其品质符合如通过使用ft4粉末流变仪确定的以下参数(i)
‑
(viii)中的至少五个参数:
[0272]
(i)最多60mj/g的比基本流动能(sbfe);
[0273]
(ii)0.75至1.25的稳定指数(si);
[0274]
(iii)最多10mj/g的比能(se);
[0275]
(iv)在15kpa(mps
‑
15)下最多40的最大主应力;
[0276]
(v)在15kpa(ff
‑
15)下至少1.3的流函数;
[0277]
(vi)在15kpa(cbd
‑
15)下至少0.26g/ml的压实堆积密度;
[0278]
(vii)最多47%的压缩率;以及
[0279]
(viii)最多40
°
的壁摩擦角(wfa)。
[0280]
2.根据实施例1所述的净api,其中,所述品质符合如通过使用ft4粉末流变仪确定的以下参数(i)
‑
(viii)中的至少五个参数:
[0281]
(i)最多25mj/g的比基本流动能(sbfe);
[0282]
(ii)0.83至1.18的稳定指数(si);
[0283]
(iii)最多9mj/g的比能(se);
[0284]
(iv)在15kpa(mps
‑
15)下最多34的最大主应力;
[0285]
(v)在15kpa(ff
‑
15)下至少3的流函数;
[0286]
(vi)在15kpa(cbd
‑
15)下至少0.5g/ml的压实堆积密度;
[0287]
(vii)最多36%的压缩率;以及
[0288]
(viii)最多35
°
的壁摩擦角(wfa)。
[0289]
3.根据实施例1所述的净api,其中,所述品质符合所述参数(i)
‑
(viii)中的至少七个参数。
[0290]
4.根据实施例2所述的净api,其中,所述品质符合所述参数(i)
‑
(viii)中的至少六个参数。
[0291]
5.根据前述实施例中任一项所述的净api,其中,api从包含甲基乙基酮(mek)和正庚烷(hptn)的溶剂体系中结晶。
[0292]
6.根据前述实施例中任一项所述的净api,其中,api从包含乙酸乙酯(estp)和水的溶剂体系中结晶,并且所述结晶过程包括优选地通过共沸蒸馏来去除乙醇和水、以及将hdm201溶液加热至60
‑
75
°
、优选地至70℃、并且在40
‑
60℃、优选地在45
‑
50℃下接种并结晶。
[0293]
7.一种用于制备包含如前述实施例中任一实施例定义的净api的药物产品的方法,所述方法包括以下步骤:
[0294]
(a)提供所述净api;
[0295]
(b)使用真空辅助计量与填充装置来将步骤(a)的所述净api分配到药物载体的底部中;以及
[0296]
(c)用所述药物载体的互补盖部来封装所述药物载体的底部,从而生产药物产品。
[0297]
8.如实施例7所述的方法,其中,所述真空辅助计量与填充装置是可旋转滚筒。
[0298]
9.如实施例7或8所述的方法,其中,所述真空辅助计量与填充装置是可旋转滚筒,所述可旋转滚筒配备有搅拌器或音波/超声波装置,以辅助所述api的计量和分配;
[0299]
其中,如果所述真空辅助计量与填充装置配备有搅拌器,则所述搅拌器被设定为1
‑
4转每循环;并且
[0300]
其中,如果所述真空辅助计量与填充装置配备有超声波装置,所述超声波装置是将粉末推到可旋转滚筒空腔中并破坏所述粉末的微桥的弹簧杆或杆柱,则所述弹簧杆或杆柱的频率为10,000hz至180,000hz。
[0301]
10.如实施例7至9中任一项所述的方法,其中,所述真空辅助计量与填充装置包括粉末沟槽,所述粉末沟槽配备有流化装置和超声换能器。
[0302]
11.如实施例10所述的方法,其中,从振动料斗到粉末沟槽进行给料而进入所述粉末沟槽中,其中,所述料斗由传感器激活。
[0303]
12.如实施例10所述的方法,其中,从料斗到粉末沟槽进行给料而进入所述粉末沟槽中,其各自配备有使用100hz至1000hz的频率的音波装置,其中,所述料斗优选地由传感器激活。
[0304]
13.一种通过如实施例7至12中任一项所述的方法获得的或可获得的药物产品。
[0305]
14.根据实施例1至6中任一项所述的净api或根据实施例7至12中任一项所述的方法或根据实施例13所述的药物产品,其中,所述净api包含最多5%(w/w)的添加剂、优选地不包含添加剂(0%w/w)。
[0306]
15.如实施例7至12和14中任一项所述的方法,其中,步骤(b)中所述api的剂量在2.5mg至100mg,所述mg值是指所述apu的自由形式。
[0307]
16.如实施例7至12、或14至15中任一项所述的方法,其中,在步骤(b)中所述净api的投加具有小于5%的平方根偏差(rsd)。
[0308]
17.如实施例7至12、或14至16中任一项所述的方法,其中,在步骤(c)之前通过振动、摇动或敲击,使所述净api在所述药物载体的底部中压实。
[0309]
18.如实施例7至12、或14至17中任一项所述的方法,其中,所述方法是连续的过程。
[0310]
19.一种包含根据实施例1至6中任一项所述的api的药物产品。
[0311]
20.根据实施例19所述的药物产品,其中,所述api封装在包括盖部和底部的载体单元内。
[0312]
21.根据实施例19或实施例20所述的药物产品,呈胶囊、尤其明胶胶囊的形式。
[0313]
22.根据实施例7至12和14至18中任一项所述的方法,或根据实施例13或14所述的药物产品,其中,所述药物载体是胶囊、尤其明胶胶囊。
[0314]
实例
[0315]
在下文中,通过以下实例来进一步展示实施例中定义的本发明,这些实例不旨在限制本发明的范围。本文引用的所有参考文献通过援引明确地并入。
[0316]
标准的ft4粉末流变仪提供至少6种粉末表征方法(按每个测量圆筒直径)。被选择来进行分析的是
[0317]
25mm_1c_划分_rep vfr_r01;
[0318]
25mm_shear_15kpa;
[0319]
25mm_压缩率_1
‑
15kpa;
[0320]
25mm_壁摩擦_30kpa。
[0321]
每种表征方法都会产生若干种响应参数(默认或可手动选择)。使用标准的ft4粉末流变仪,对多于350种不同的粉末和多于60种不同的化合物测量了一组完整的粉末表征(每行至少22个响应参数),并将其汇编到数据库中。将各个参数与各自的填充行为相关联,以确定能够区分和预测粉末的填充行为的一组参数和参数范围。获得了以下8参数模型:
[0322][0323]
其中,这些参数为:
[0324]
sbfe:比基本流动能(mj/g):由bfe(由标准的ft4测试平台获得)除以样本的划分质量获得。
[0325]
si:稳定指数,标准变量、无量纲。
[0326]
se:比能(mj/g),标准变量
[0327]
mps@15kpa:最大主应力,标准变量
[0328]
ff@15kpa:流函数(无量纲),来自剪切单元、标准变量
[0329]
cbd@15kpa:压实堆积密度(g/ml),标准变量(来自剪切单元)
[0330]
cps:压缩率(%),标准变量
[0331]
wfa:壁摩擦角(度
°
),标准变量。
[0332]
如果其中四个参数在指示的范围之外,则预测该粉末在可制造性方面为临界点。如果多于四个参数在指示的范围之外,则粉末在本文描述的任何自动机器中极有可能且实际上无法作为净api工作。此外,已经发现,如果mps很高,并且以较小的方式wfa也很高,则粉末易于积聚在填充与投加装置中。这对于音波/超声波填充技术是不利的特征。另一方面,如果si太高,则粉末会随时间改变其特征,从而使其对剪切力更加敏感。在使用搅拌器的标准真空滚筒填充技术中,这样的粉末工作性较差。
[0333]
发现的“8参数模型”能够区分和预测数据库中的粉末的填充行为,其中还报道了至少有40%的粉末在胶囊填充设备上的实验响应/得分。以下案例例示了8参数模型预测和驱动适合作为净api进行投加的粉末的开发的能力。粗体数字落在期望范围之外。
[0334][0335]
在以下实例中讨论这些粉末中的大多数。
[0336]
实例1(参考实例:lee011)
[0337]
从此类化合物的开发生命周期的早期开始,就需要大量生产包含lee011的药物药品产品。通过本文描述的设备平台,使用两种类型的真空滚筒设备:标准填充器和音波填充器,来将几批api进行结晶、筛分并填充到胶囊中。大多数使用过的粉末变体尤其是在剂量均匀性方面(剂量范围为10至250mg)的填充性能足够好,但是,平均而言,机器料斗中的粉末行为/流动性以及移动时部件之间的摩擦产生带来了挑战,而在长运行时间上造成某些问题和工艺停工。标准的填充技术(尤其是在一些优化之后)可以应对与lee011粉末相关的此类固有困难(成功填充了数百万个胶囊单元),而音波填充技术已显示出工艺停工以及由于粉末堆积在粉末沟槽内而造成的部件损坏的重要事件,尤其是当mps参数被测量为特别高时。“8参数模型”能够建议对同时具有高mps和wf的粉末不选择音波填充,尽管在存在这些值的情况下有一个实例(6.)能够被填充。
[0338]
实例2(参考实例:lxs196)
[0339]
以某个产量(适于大批量制造)来填充净药品物质在工业上并不普遍成熟。对于apilxs196,以一体方式开发了颗粒特性和填充过程。所描述的方法能够以在6小时内优于40
′
000个胶囊的产量制造lxs196胶囊,用于临床供应。好胶囊的百分比为所生产胶囊总数
的98.8%。实现了简化的制造过程,仅执行了净药品物质的筛分和封装(包括通过电容传感器进行的100%重量控制、除尘和金属检查)。还有,将多达400毫克的剂量填充到规格0的胶囊中。此外,应用内部开发的高剂量技术(敲击机制),在自动滚筒填充设备上封装450mg以上的剂量。
[0340]
实例3(参考实例:fty720)
[0341]
投加包含亚毫克的量的api的粉末是在胶囊填充的切割边缘处进行。为了克服挑战,在盖仑制剂(galenical)的开发中,低剂量配制品的标准工艺描述了在若干共混步骤中将api与赋形剂共混并稀释,这允许将几毫克的被稀释的共混物最终投加到胶囊中。对于配备有用于质量检查的电容传感器的机器也是如此,所述传感器典型地用于以最小从几毫克及以上开始的胶囊填充。
[0342]
本文描述的方法允许使用进行100%填充质量确认(对应于100%的含量均匀性检查,这是首次被推广至亚毫克级范围)的过程分析技术来加工fty720的净api,其含有少于1%的添加剂(api>99%)、具有最佳的物理特性、适合于以非常低的剂量(例如0.5mg和0.25mg)进行精确的胶囊填充。
[0343]
此外,与当前市售的配制品相比,本披露的方法给出了非常简单的过程,在当前的配制品中使用了多个工艺步骤(即,若干个筛分
‑
共混通路,用于逐步稀释共混物)。
[0344]
最终的药物产品还显示出比对应的市售配制品更长的保存期限,因为只有两种成分(二氧化硅和明胶)与药品物质直接接触。
[0345]
实例4(参考实例:nbu928)
[0346]
nbu928是富马酸盐,具有富挑战性的结晶过程。所得颗粒通常具有细长的长宽比,晶体为板条形状、长达400μm,具有强烈的团聚趋势。这种晶体形状给出的所得粉末块不能在任何胶囊填充设备中直接加工。因此,对该apu粉末进行了颗粒工程处理,以选择性地生长晶体的喷射侧(shot side),然后通过针磨设备将其碾小而获得相当规则的碎片,从而得到了具有更稳定长宽比、无团聚的较小颗粒,其平均直径(x50)为约25μm。新碾磨的api粉末(批号#nbu928
‑
metzgch4
‑
001
‑
03)的流变特征表明了用标准的pdp填充技术(由于预期存在整体充气水平的一定的不稳定性,粉末在搅拌器剪切力的作用下在料斗中桥接)难以加工,但是用“音波填充器”真空滚筒设备实现了完美的可加工性。事实上,在5至50mg的所需剂量范围内,获得了非常好的胶囊填充性能。
[0347]
实例5(参考实例:cdz173)
[0348]
cdz173是单磷酸盐化合物。它的特征在于长宽比>10的针状晶体、团聚/熔合的棒状晶体、极低的堆积密度(始终<0.2g/ml,通常<0.12g/ml)。在此在两个不同的变体(经碾磨和未经碾磨)中进行了报告。第6行是可填充的临界点(速度/产量非常低),尽管其特征落在模型的参数之外(4/8的指标被满足),而第7行的材料也无法用本披露的加工方法填充,除非追求结晶的重要变化(此处未描述)。
[0349]
实例6:结晶api hdm201琥珀酸共晶体的制备
[0350]
hdm201
‑
bba批次结晶程序a1乙酸乙酯/水工艺a2乙酸乙酯/水工艺a3乙酸乙酯/水工艺
b1乙酸乙酯/水工艺(优化接种)b2乙酸乙酯/水工艺(优化接种)b3乙酸乙酯/水工艺(优化接种)c1甲乙酮/庚烷工艺c2甲乙酮/庚烷工艺c3甲乙酮/庚烷工艺
[0351]
乙酸乙酯/水工艺:
[0352]
1.将hdm201游离形式(20.2kg)、乙醇溶剂化物溶解在乙酸乙酯(202kg)(estp)中,加热至内部温度(it)=50℃
[0353]
2.颗粒过滤
[0354]
3.将琥珀酸(3.97kg)溶解在50℃的水(34.28kg)中,并在it=50℃时将其加入。
[0355]
4.通过同时添加estp(522kg),在jt=100℃时以恒定体积在常压下共沸蒸馏来去除水和乙醇并减小至最终体积。
[0356]
5.将溶液冷却至it=40℃,并用悬浮在estp中的hdm201琥珀酸共晶体接种(在蒸馏之前已经开始沉淀)。
[0357]
6.将悬浮液在2小时内冷却至25℃、并陈化至少3小时。
[0358]
7.过滤并用25℃的estp(92.4kg)洗涤。
[0359]
8.在夹套温度(jt)=25℃和真空下干燥5小时,然后升高至jt=60℃持续5小时。
[0360]
乙酸乙酯/水工艺(优化接种)
[0361]
1.将hdm201游离形式(20kg)乙醇溶剂化物和琥珀酸(3.92kg)溶解在estp(273.1kg)和水(8.4kg)(97:3w/w)中、加热至it=75℃以溶解
[0362]
2.颗粒过滤
[0363]
3.通过同时添加estp(484kg),在jt=100℃时以恒定体积在常压下共沸蒸馏(随着水含量降低而沉淀)来去除乙醇(和水)。冷却以进行ipc(过程中控制)(乙醇≤0.05%和水≤3%)。
[0364]
4.水含量调整为3%wt,ipc水确定为3%
[0365]
5.加热至it=70℃以再次溶解所有物质。冷却至it=50℃。
[0366]
6.用在it=50℃下的hdm201琥珀酸共晶体(84g研磨后的,悬浮在750g estp中)来接种并搅拌2小时。冷却至it=45℃并搅拌1小时
[0367]
7.通过同时添加estp(243kg),在150
‑
500毫巴(t壁=45℃)下以恒定体积进行共沸蒸馏以去除水。对水进行ipc。
[0368]
8.蒸馏至最终体积(约4/7)
[0369]
9.将悬浮液在3小时内冷却至it=0℃并陈化10小时。
[0370]
10.过滤并用0℃的estp(92.4kg)洗涤。
[0371]
11.在夹套温度(jt)=25℃和真空下干燥5小时,然后升高至jt=60℃持续5小时。
[0372]
甲乙酮/庚烷工艺
[0373]
1.将hdm201游离形式(13kg)、乙醇溶剂化物和琥珀酸(2.936kg)悬浮在甲基乙基酮(mek)(154.4kg)和水(0.391kg)中并加热至it=78℃直至全部溶解
[0374]
2.颗粒过滤
[0375]
3.冷却至it=68℃,在it=68℃时添加10%的正庚烷(hptn)(15.4kg)。
[0376]
4.用悬浮在mek/hptn(550g)1∶1混合物中的hdm201琥珀酸共晶体(74g)来接种,陈化至少60分钟
[0377]
5.缓慢加入剩余的90%hptn(139kg)并陈化60分钟
[0378]
6.将溶液冷却至it=25℃
[0379]
7.过滤并用mek/hptn 1∶1混合物(54kg)洗涤
[0380]
8.在夹套温度(jt)=25℃和真空下干燥5小时,然后以最少10小时升高至jt=50℃和<20mbar。
[0381]
用被针磨至x90值等于或小于100微米的hdm201琥珀酸共晶体进行接种。可以例如通过如wo 2013/111105 a1中针对实例102的晶型b(第391
‑
393页)描述的方法d获得这样的晶种,然后进行针磨。
[0382]
通过上述工艺,可以获得高堆积密度的块状致密颗粒形状的hdm201
‑
bba。
[0383]
所有的结晶api通过针磨来研磨成期望的粒度。
[0384]
实例7:结晶api的表征
[0385]
ft4数据概览
[0386]
[0387][0388]1测量错误(根据错误读数计算出的值15)。2未测试,因为粉末特性不支持此技术(cps太高)。3未测试,因为此批次的优选是标准真空滚筒。4未测试,因为粉末特性不支持此技术(sbfe太高)。
[0389]
ft4特征表明所制备的hdm201
‑
bba批次非常适合通过本文描述的本发明方法直接封装。
[0390]
粒度分布数据概览
[0391]
数值以微米为单位,测量是通过激光衍射(lld)进行。
[0392]
批次x10x50x90a11514a242860a394595b131650b242171b352687c12169163c263583c331958
[0393]
可以用标准真空滚筒填充器来操作较粗糙的品质(批次a2
‑
c3)。非常精细的批次a1适合于音波填充器装置。
[0394]
因此,发现通过如本文描述的结晶方法产生的hdm201
‑
bba适用于宽粒度范围内(x90(lld):10
‑
200微米)的直接封装
[0395]
实例8:用音波填充器进行的过程
[0396]
进行填充试验以确认批次a1在音波填充器上的可加工性。api无需过筛而直接加入填充器中。进行两次填充doe(实验设计),以确认在剂量范围上的良好加工性和在0.92
‑
2.58%范围内的填充rsd(平方根偏差)。
[0397]
实例9:真空滚筒填充器进行的过程
[0398]
对于含有hdm201的药品产品的商业生产,需要一定的产量。将hdm201琥珀酸共晶体(hdm201
‑
bba,药物物质转换因子:1.213)api装入胶囊填充机(例如haromodu
‑
c ls封装机),其中包含标准真空滚筒填充单元而无需过筛。以高达每小时14400粒胶囊的产量制造10mg、20mg、和40mg剂量单位的大规模试点批次,而不会因粉末堵塞而中断。实现了简单的制造过程,其仅由封装、除尘和金属检查构成,封装包括通过基于电容的传感器进行100%的重量控制。
[0399][0400]
上表中显示的速度值与试点工厂的生产有关,并且尚未优化。因此,更高的速度会是有可能的。商业工厂的生产速度将允许提高4倍。与工业标准xceldose(约200
‑
300粒胶囊/小时)相比,本发明的生产方法的速度至少高一个数量级。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。