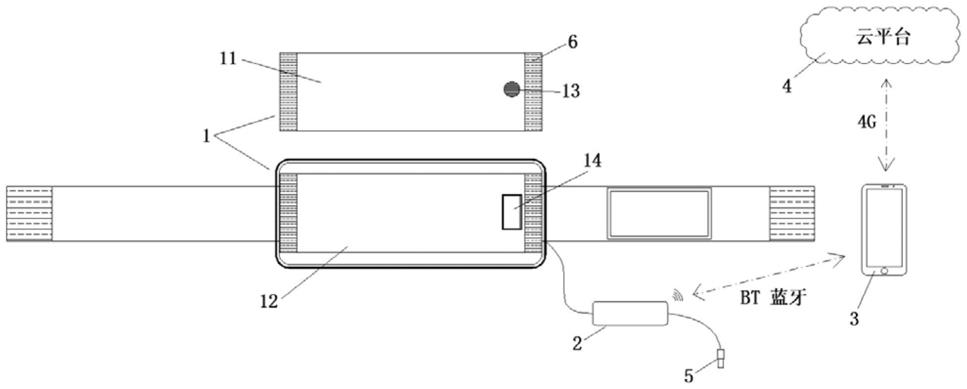
1.本发明涉及党参黄芪组合物在制备治疗晚期肿瘤相关症状的药物中的用途。更具体地,本发明涉及参芪扶正注射液在制备治疗晚期肿瘤患者的癌因性疲乏和/或体重减轻的药物中的用途。
背景技术:
2.癌症是目前临床危害健康和导致死亡的主要疾病。癌因性疲乏是癌症患者最常见的主观症状之一。癌因性疲乏(cancer
‑
related fatigue,crf)被定义为与癌症或其治疗有关的,扰乱机体正常功能的、持久的、主观的劳累感,与活动不成比例,并常伴有功能障碍。与普通的疲乏相比,癌因性疲乏具有发生快、程度重、持续时间长、且不能通过休息来缓解等特点。目前其治疗牵涉到病因学与症状学治疗两个方面,前者针对与之相关的潜在因素,通过因素干预使之影响结果出现逆转;后者主要针对患者的自身疲乏症状,减轻患者的不适感,提高舒适度。
3.同时,大约超过80%的晚期癌症患者会经历体重下降或恶病质,体重的持续下降致使癌症患者独立活动能力和生命质量下降,甚至缩短患者的预期寿命。因此,厌食和体重下降也是是肿瘤内科常见且重大的临床问题。虽然营养替代、适当锻炼、食欲促进药物、非甾体抗炎药等均可用于改善晚期癌症患者体重下降情况,但是目前仍无标准的治疗和干预方案。
4.参芪扶正注射液是以黄芪、党参为主要原料的注射液,提取其有效成分,制成的纯中药大输液,属国内首创的纯中药澄清透明大输液,毒副作用较低(宋崇顺等,参芪扶正注射液论文汇编。1999:96
‑
99),主要用于肺癌、胃癌的辅助治疗。
5.目前,迫切需要一种有效治疗晚期肿瘤患者的癌因性疲乏和/或体重减轻的药物。
技术实现要素:
6.本发明人令人惊奇地发现,党参黄芪组合物,特别是参芪扶正注射液可以用于治疗晚期肿瘤相关症状。因此,党参黄芪组合物,特别是参芪扶正注射液可以用来制备治疗晚期肿瘤患者的癌因性疲乏和/或体重减轻的药物。
7.为此,本发明提供了党参黄芪组合物在制备预防和/或治疗晚期肿瘤相关症状的药物中的用途。
8.在一个实施方案中,所述晚期肿瘤相关症状是癌因性疲乏。
9.在一个优选的实施方案中,所述癌因性疲乏是由机体氧化损伤导致炎症因子水平升高所引起的癌因性疲乏。
10.在另一个优选的实施方案中,所述癌因性疲乏是与骨骼肌线粒体结构和功能的完整性相关的癌因性疲乏。
11.在又一个优选的实施方案中,所述癌因性疲乏是与c2c12成肌细胞的线粒体膜电
位相关的、导致氧化应激损伤和细胞凋亡的癌因性疲乏。
12.在另一个实施方案中,所述晚期肿瘤相关症状是体重减轻。
13.在本发明的用途中,所述党参黄芪组合物是由作为活性成分的重量比为0.5:1至1:0.5,优选为1:1的党参和黄芪制备的。
14.本发明所述的党参(codonopsis pilosula(franch.)nannf)为桔梗科植物的干燥根。优选地,所述黄芪是膜荚黄芪(astragalus membranaceus(fisch.)bge.)或蒙古黄芪(astragalus membranaceus(fisch.)bge.var.mongholicus(bge.)hsiao)的干燥根。
15.在本发明的实施方案中,所述党参黄芪组合物可以为药学上可接受的任何剂型,包括但不限于口服液、片剂、胶囊剂、颗粒剂以及注射剂中的一种或多种。
16.在本发明的优选实施方案中,所述党参黄芪组合物为注射液,例如参芪扶正注射液。
17.在一个实施方案中,所述注射液的制备方法包括:
18.(1)向党参和黄芪中加水,加热提取1至3次,得到提取液;
19.(2)向提取液加入乙醇,沉淀,过滤,得到滤液;
20.(3)向滤液中加入注射用水,调节ph值,过滤,灭菌,得到注射液。
21.在一个优选实施方案中,所述注射液的制备方法包括:
22.(1)向党参和黄芪中加入去离子水,加热提取1至3次,得到提取液;
23.(2)将提取液并浓缩,加入乙醇,沉淀,过滤,浓缩滤液,得到浓缩滤液;
24.(3)向浓缩滤液中加入注射用水,调节ph值,过滤,灭菌,得到注射液。
25.首先,本发明人构建了肿瘤全身转移的小鼠模型,并通过pet/ct和he染色确定了模型构建的成功。然后,在模型成立的基础上,进行了癌因性疲乏的诱导和参芪扶正注射液的干预。结果发现,党参黄芪组合物,特别是参芪扶正注射液虽不具有延缓肿瘤生长和延长生存时间的作用,但具有较好的维持小鼠体重的作用。通过力竭游泳和自主活动实验,发现参芪扶正注射液具有明显的缓解癌因性疲乏的作用。同时,悬尾实验结果证实了参芪扶正注射液的疗效与小鼠本身的抑郁情绪无关。
26.在进一步研究中,进行了小鼠血清和腓肠肌相关的检测。腓肠肌的检测发现,参芪扶正注射液可以明显提升腓肠肌的重量,增加腓肠肌横截面面积。通过透射电镜发现参芪扶正注射液可以维持肌肉线粒体的数量的高水平,保护肌肉线粒体结构的完整性,增加肌肉线粒体mtdna的表达水平和atp的含量,减少氧化应激损伤。小鼠血清的检测发现,参芪扶正注射液可以显著降低血清炎症因子il
‑
6、il
‑
1和crp的表达水平。
27.为了评估小鼠结肠癌细胞(ct
‑
26)对骨骼肌细胞凋亡和坏死程度的影响,在ct
‑
26细胞和c2c12细胞共培养6h、12h或24h,和在双氧水(h2o2)作用2h后对c2c12成肌细胞的凋亡情况进行检测。结果显示,ct26细胞对c2c12小鼠成肌细胞的损伤具有时间依赖性,总凋亡事件的百分率分别达到约11.2%、23.4%和17.9%(6h,12h,24h),而h2o2中2h总凋亡率为19.1%。而在细胞共培养微环境下破坏c2c12小鼠成肌细胞12小时后,给予不同剂量(5mg/ml、10mg/ml和20mg/ml)的参芪扶正注射液,凋亡细胞的百分比降低至约15.3%、11.6%和10.8%。线粒体膜电位(δψcm)的变化是细胞凋亡的标志现象,耗散δcm直接表明线粒体膜被破坏。此外,使用荧光探针jc
‑
1测量了参芪扶正注射液对δψcm的影响。结果显示,暴露于ct
‑
26或h2o2条件下,c2c12成肌细胞中jc
‑
1红色荧光与绿色荧光的比率显著降低,表明
共培养微环境导致δψcm损伤。但是,参芪扶正注射液可以显著减轻肿瘤细胞引起的c2c12成肌细胞中δψcm的损伤。同时,线粒体电子运输链(etc)在活动过程中会产生活性氧(ros),这是骨骼肌氧化剂的最大来源。更进一步地,参芪扶正注射液处理会改变ros水平。通过dcfh
‑
da荧光检测方法检查了胞质氧化剂的活性,结果表明参芪扶正注射液处理减少ros的增加。继续测量mn
‑
sod蛋白,以通过western blot分析验证参芪扶正注射液的线粒体氧化活性,证实参芪扶正注射液保护了c2c12小鼠成肌细胞中线粒体的功能。
28.从以上实验结果可以看出,本发明的优点在于:
29.1.本发明发现党参黄芪组合物在医学上的新治疗用途,开拓了新的应用领域,有良好的应用前景;
30.2.本发明的党参黄芪组合物原料丰富,制备方法简单,可以做成各种剂型,特别是注射液,应用范围广;
31.3.本发明的党参黄芪组合物具有明显的缓解癌因性疲乏的作用,可以维持肌肉线粒体的数量的高水平,保护肌肉线粒体结构的完整性,增加肌肉线粒体mtdna的表达水平和atp的含量,减少氧化应激损伤,并且显著降低血清炎症因子il
‑
6、il
‑
1和crp的表达水平;
32.4.本发明的党参黄芪组合物显著减轻肿瘤细胞引起的c2c12成肌细胞中线粒体膜的损伤,减少ros的增加,进而保护成肌细胞中线粒体的功能;
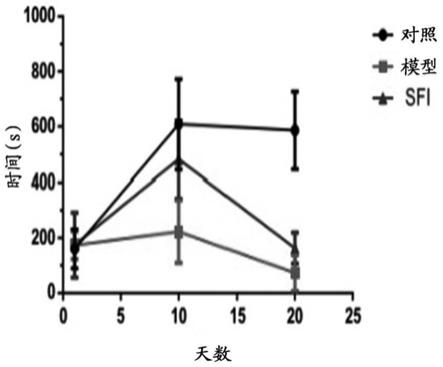
33.5.本发明的党参黄芪组合物具有较好的维持体重,防止体重减轻的作用。
附图说明
34.以下,结合附图来详细说明本发明的实施方案,其中:
35.图1显示了力竭游泳时间检测实验的结果。
36.图2显示了旷场实验的结果。
37.图3显示了小鼠一般情况观察(体重)的结果。
38.图4显示了腓肠肌线粒体mtdna检测实验的结果。
39.图5显示了腓肠肌总atp酶含量检测实验的结果。
40.图6显示了腓肠肌线粒体透射电镜观察实验的结果。
41.图7显示了成肌细胞凋亡实验的结果。
42.图8显示了成肌细胞活性氧(ros)水平检测实验的结果。
43.图9显示了成肌细胞线粒体膜电位(jc
‑
1)检测实验的结果。
具体实施方案
44.下面结合具体实施方式对本发明作进一步的详细描述,根据下述实施例可以更好地理解本发明。然而,本领域技术人员应容易理解的是,以下实施例只是描述性的,不意味着将本发明局限于这些具体实施例。本领域技术人员应该意识到,本发明涵盖了权利要求书范围内可能包括的所有改进方案、备选方案和等效方案。
45.为了更好的理解本发明,实施例将采用以下体内动物实验和体外细胞分子学实验来验证和说明本发明的党参黄芪组合物在制备治疗晚期肿瘤相关症状的药物中的新用途。
46.1.体内动物实验:构建了癌因性疲乏的转移瘤小鼠模型,并通过观察给药后小鼠的一般情况、肿瘤生长情况、生存曲线、腓肠肌重量,和进行疲劳相关的旷场实验、悬尾实验
和力竭游泳实验,并应用elisa方法和rt
‑
pcr检测小鼠血清炎症因子tgf
‑
ɑ
、il
‑
6、il
‑
3、il
‑
1β和骨骼肌氧化应激蛋白及线粒体mtdna的表达,以及应用he染色和透射电镜观察小鼠骨骼肌细胞形态和线粒体结构,证实了参芪扶正注射液对癌因性疲乏具有防治作用,其作用机制与降低机体氧化损伤导致炎症因子水平升高和保护骨骼肌线粒体结构和功能的完整性相关。
47.2.体外细胞实验:通过流式细胞术和代谢组学检测证实,参芪扶正注射液可以保护c2c12成肌细胞的线粒体膜电位,减少氧化应激损伤和细胞凋亡。
48.3.还通过体内动物实验发现,参芪扶正注射液具有较好的维持体重,防止体重减轻的作用。
49.实施例1参芪扶正注射液的制备
50.将党参、黄芪除去杂质,加工成饮片。准确称取党参、黄芪各400克,用去离子水冲洗干净,加入6400ml去离子水,加热煮沸提取1小时,放出提取液;渣再加入3600ml去离子水,加热煮沸提取1小时,放出提取液;渣再加入3600ml去离子水,加热煮沸提取0.5小时,放出提取液;三次提取液合并过滤浓缩成520ml,在搅拌下加入85%以上浓度的乙醇使含乙醇量为75%,放置24小时以上,过滤回收乙醇至440ml,在搅拌下加入95%浓度的乙醇使含乙醇量为85%,放置24小时以上,过滤回收乙醇并浓缩至240ml。取上述浓缩液加入注射用水440ml,加热煮沸20分钟,搅拌下加入活性炭0.8g,继续煮沸10分钟,取出冷却,过滤除炭,加入注射用水至近400ml,用10%的naoh溶液调ph值为6.5,粗滤,精滤,灌封于20ml的安瓿中100℃,30分钟灭菌,检查合格后即得参芪扶正注射液。
51.实施例2动物实验部分:
52.(1)模型构建
53.疲劳小鼠模型的造模:接种ct
‑
26细胞前,将所有裸鼠置于游泳箱(高30cm,直径25cm)适应性游泳训练2天,5min/天,水温25℃
±
1℃。剔除游泳时间过长和过短的小鼠以及过于兴奋和过于安静的裸鼠。将培养的ct
‑
26细胞消化离心,制成约1
×
107个细胞/ml的混悬液。消毒小鼠腹部皮肤,取0.2ml(约1
×
106个瘤细胞)通过腹腔接种,接种后1周,通过pet/ct影像学观察肿瘤转移情况,待结肠癌腹腔转移模型成功后,继续饲养模型裸鼠2
‑
3周,待观察到裸鼠全身活动迟缓、饮食减少、消瘦等,再通过行为学检测观察裸鼠疲乏情况,即制得癌因性疲乏小鼠模型。
54.(2)药物分组及干预
55.遵循随机分组的原则分为3组,每组20只,共60只。分别为正常对照组、crf模型组、sfi干预组,具体实验分组如下:
56.正常对照组:给予相应体积生理盐水腹腔注射;
57.crf模型组:给予相应体积生理盐水腹腔注射;
58.sfi干预组:参芪扶正注射液(sfi),3.0g/kg(0.75ml/kg),腹腔注射,每日一次,共21天。
59.(3)疲劳指标评价
60.a.力竭游泳时间检测
61.于开始给药前、给药第7天、给药第14天、给药第21天,测定各组裸鼠力竭游泳时间。具体方法:用7%体重的铅坠系于裸鼠尾部,将裸鼠放入水温25℃
±
1℃的游泳箱(高
30cm,直径25cm)中进行力竭游泳测试,并记录力竭游泳时间。力竭游泳标准为裸鼠鼻尖沉入水下10s。每7天进行1次。每次实验后,立即将裸鼠用干毛巾擦干。
62.结果如图1,可以看出,参芪扶正注射液干预组小鼠游泳时间在第10天时较模型组具有显著增加(p<0.05)。
63.b.旷场实验
64.在干预后的第14天、第21天对所有裸鼠进行旷场实验。握住裸鼠尾巴近端1/2~1/3处,轻轻将小鼠放入旷场实验箱的正中央格。待小鼠适应1min后,开始计时,由2人共同观察并记录裸鼠在5min内的行为,同时进行实时录相。应用鼠类精细行为自动识别软件记录裸鼠在实验箱内的总运动距离、外周格运动距离、中央格运动距离、理毛次数(前肢向上抬举,洗脸、抓痒、舔足的次数)、大便粒数、爬壁次数。在每只裸鼠实验结束后清除粪便,用70%乙醇喷洒实验箱底部并用洁净纱布抹干。测定条件为保持安静通风、室内暗光的行为学实验室,用手术灯照天花板反射到实验操作区;实验人员远离旷场分析箱(以操作角度看不到箱中实验动物为准)。实验前,裸鼠在测定房间中适应10min以上。
65.结果如图2,可见参芪扶正注射液干预组小鼠在运动时间、运动路程以及运动速度较模型组具有显著增加(p<0.05)。
66.(4)小鼠一般情况观察
67.每天观察裸鼠进食、饮水、精神状态。每隔3日称量裸鼠体重,注意观察裸鼠腹围。
68.结果如图3,可见参芪扶正注射液干预组小鼠体重在第15天后较模型组显著增加(p<0.05)。
69.(5)腓肠肌线粒体mtdna检测
70.①
基因组提取
71.a.腓肠肌样本处理:称取腓肠肌组织10mg,打碎为细胞悬液,12000g离心1min,弃上清,加200μl缓冲液ga,振荡至彻底悬浮,加入4μl rna酶a(100mg/ml)溶液,振荡15秒,室温放置5min。
72.b.加入20μl蛋白酶k溶液,混匀后,置于56℃,直至组织溶解,离心以去除管盖内壁的水珠。
73.c.加入200μl缓冲液gb,充分颠倒混匀,70℃放置10min,待溶液变清亮,离心以去除管盖内壁的水珠。
74.d.加入200μl无水乙醇,充分振荡混匀15秒,观察是否出现絮状沉淀,离心以去除管盖内壁的水珠。
75.e.将上一步所得溶液和絮状沉淀加入吸附柱cb3中,放入收集管中,12000g离心30秒,弃除废液,将吸附柱cb3放回收集管中。
76.f.向吸附柱cb3中加入500μl缓冲液gd,12000g离心30秒,弃除废液,将吸附柱cb3放入收集管中。
77.g.向吸附柱cb3中加入600μl漂洗液pw,12000g离心30秒,弃除废液,将吸附柱cb3放入收集管中,并重复操作。
78.h.将吸附柱cb3放回收集管中,12000g离心2min,弃除废液,将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
79.i.将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加200μl洗
脱缓冲液te,室温放置5min,12000g离心2min,将溶液收集到离心管中。
80.②
定量pcr反应
81.a.引物:引物由生工生物工程(上海)公司合成。引物序列见表1。
[0082][0083]
b.取0.2ml pcr管,配制如下反应体系:
[0084][0085][0086]
c.pcr扩增,循环结束后从55℃升高到95℃获取熔解曲线。
[0087][0088]
结果如图4,可见参芪扶正注射液干预组线粒体mtdna含量较模型组显著增加(p<0.05)。
[0089]
(6)腓肠肌总atp酶含量检测
[0090]
给药21天后,处死小鼠,剥离腓肠肌,称取约0.1g腓肠肌组织,加入10倍体积pbs研磨,离心取上清,加入稀释液50
×
稀释,按每孔100μl依次加入微孔板,37℃孵育反应2h后移除液体,不洗涤,并每孔依次加入100μl检测试剂a,37℃孵育反应1h后洗涤,再每孔依次加入100μl检测试剂b,37℃孵育反应30min后洗涤,每孔依照次序分别加入底物约90μl,充分混匀,室温下避光反应25min,加入终止液50μl,充分混匀,30min内于酶标仪450nm下检测。
[0091]
结果如图5,可见参芪扶正注射液干预组atp含量较模型组显著增加(p<0.05)。
[0092]
(7)腓肠肌线粒体透射电镜观察
[0093]
①
取材固定:给药21天后,处死小鼠,取腓肠肌组织切片,大小不超过1mm
×
1mm
×
1mm,迅速投入电镜固定液4℃固定2
‑
4h。pbs漂洗3次,每次15min。
[0094]
②
后固定:1%的锇酸
·
pbs(ph 7.4)室温(20℃)固定2h。pbs漂洗3次,每次15min。
[0095]
③
脱水:组织依次入50%
‑
70%
‑
80%
‑
90%
‑
95%
‑
100%
‑
100%乙醇
‑
100%丙酮
‑
100%丙酮上脱水,每次15min。
[0096]
④
渗透:丙酮:812包埋剂=1:1处理2h,丙酮:812包埋剂=1:2渗透过夜,纯812包埋剂处理5h,将纯812包埋剂倒入包埋板,将样品插入包埋板后37℃烤箱过夜。
[0097]
⑤
包埋:60℃烤箱聚合48h。
[0098]
⑥
切片:超薄切片机切片60
‑
80nm超薄切片。
[0099]
⑦
染色:铀铅双染色(2%醋酸铀饱和乙醇溶液,枸橼酸铅,各染色15min),切片室温干燥过夜。
[0100]
⑧
透射电子显微镜下观察,采集图像分析。
[0101]
结果如图6,透射电镜可见参芪扶正注射液干预组线粒体数量显著多于模型组(p<0.05),结构完整性较模型组更佳。
[0102]
实施例3细胞实验部分:
[0103]
(1)细胞复苏、培养与传代
[0104]
从液氮里取出ct26细胞和c2c12成肌细胞冻存管,迅速放置恒温水浴锅中,将细胞悬液转移至预先准备的pbs中,250g离心4min,弃上清,用dmem完全培养基(含10%fbs)重悬后,在5%co2、37℃恒温培养箱中培养。当细胞长满培养皿底部的80%时,0.25%胰酶消化,按照1:2稀释传代。
[0105]
(2)c2c12成肌细胞线粒体损伤模型构建
[0106]
观察ct26结肠癌细胞及c2c12成肌细胞分别长至覆盖75cm2培养瓶瓶底壁70%底面积时,弃旧培养基,0.25%胰酶消化,250g离心5min,弃上清,加入dmem培养基吹打均匀,调整细胞密度为5
×
107个/l,c2c12成肌细胞以每孔1.2ml细胞悬液量均匀接种于transwell 12孔板下层,同时将ct26结肠癌细胞以每孔1ml细胞悬液量均匀接种在transwell小室中,空白组则用等密度接种c2c12成肌细胞,培养条件为37℃,5%co2培养。
[0107]
(3)细胞分组和药物干预
[0108]
细胞实验共分为5组,分别为c2c12细胞组、c2c12细胞 参芪扶正注射液(sfi)干预组、c2c12细胞线粒体损伤模型组、线粒体损伤细胞模型 参芪扶正注射液(sfi)干预组和双氧水(h2o2)阳性对照组。双氧水(h2o2)的干预浓度为100μmol/l,干预时间为2h;参芪扶正注射液(sfi)干预浓度由细胞凋亡实验筛选确定为10mg/ml,开始干预后,各组细胞根据实验需求继续培养6、12、24、48h。
[0109]
c2c12细胞组(对照):c2c12成肌细胞常规培养;
[0110]
c2c12细胞线粒体损伤模型组(c2c12 ct26):ct26结肠癌细胞与c2c12成肌细胞共培养;
[0111]
c2c12细胞 参芪扶正注射液(sfi)干预组(c2c12 sfi):c2c12成肌细胞加入参芪扶正注射液(sfi),常规培养;
[0112]
线粒体损伤细胞模型 参芪扶正注射液(sfi)干预组(c2c12 ct26 sfi):ct26结肠癌细胞与c2c12成肌细胞共培养,加入参芪扶正注射液(sfi)干预;
[0113]
双氧水(h2o2)阳性对照组:c2c12成肌细胞加入双氧水(h2o2)干预,构建线粒体损伤阳性对照。
[0114]
(4)成肌细胞凋亡实验
[0115]
使用膜联蛋白
‑
v fitc/pi双染法检测成肌细胞凋亡,将对数生长期的ct
‑
26结肠癌细胞和c2c12成肌细胞分别消化接种至transwell 12孔板共培养6h、12h、24h,构建c2c12
成肌细胞线粒体损伤模型,并在确定最佳凋亡干预时间后,分别加入不同浓度参芪扶正注射液干预(5mg/ml、10mg/ml、20mg/ml)以确定药物最佳干预浓度。具体操作如下:
[0116]
a.细胞共培养不同时间和不同浓度药物作用后,用0.25%胰酶消化收集成肌细胞;
[0117]
b.用pbs缓冲液洗涤2次,12000g离心5min,加入500μl的binding buffer悬浮细胞,调整细胞浓度为5
×
105/ml;
[0118]
c.加入5μl膜联蛋白
‑
v fitc混匀后,再加入5μl pi混匀,室温避光反应5
‑
15min,流式细胞仪上机检测成肌细胞凋亡情况。
[0119]
结果如图7,时间点和参芪扶正注射液剂量的代表性凋亡分析,ct
‑
26培养基分别诱导6、12、24h和h2o
2 2h诱导c2c12小鼠成肌细胞。在ct
‑
26培养基刺激12h后,以5、10、20mg/ml的剂量给予参芪扶正注射液(与模型组相比,*p<0.05,其值表示为平均值
±
sd,n=3)。
[0120]
(5)成肌细胞活性氧(ros)水平检测
[0121]
将对数生长期的ct
‑
26结肠癌细胞和c2c12成肌细胞分别消化接种至transwell 12孔板共培养,构建c2c12成肌细胞线粒体损伤模型,根据细胞实验组别设置加入参芪扶正注射液和双氧水干预。具体操作如下:
[0122]
a.药物干预结束后,用0.25%胰酶消化收集成肌细胞;
[0123]
b.用pbs缓冲液洗3次,12000g离心5min,调整细胞浓度为5
×
105/ml,10000g离心5min,弃上清;
[0124]
c.用无血清dmem培养基按1000:1配制dcfh
‑
da(工作液),加入1ml工作液重悬细胞,置于37℃,5%co2培养箱孵育30min,每隔5min摇晃混匀;
[0125]
d.孵育结束后,10000g离心5min,弃上清,pbs缓冲液洗3次,10000g再离心5min,弃上清;
[0126]
e.pbs缓冲液重悬,流式细胞仪上机检测活性氧(ros)水平,激发波长为488nm,发射波长为525nm。
[0127]
结果如图8,孵育6h后减少了细胞内ros。
[0128]
(6)成肌细胞线粒体膜电位(jc
‑
1)检测
[0129]
a.jc
‑
1工作液配制:按照jc
‑
1(200x)50μl:超纯水8ml:jc
‑
1染色缓冲液(5x)2ml比例稀释,充分混匀,即配制完成jc
‑
1染色工作液;
[0130]
b.细胞处理:根据实验设计常规处理细胞后,离心收集细胞,处结pbs缓冲液洗涤3次,添加1ml jc
‑
1染色工作液,充分混匀,置于37℃,5%co2培养箱孵育20min;期间配制jc
‑
1染色缓冲液(1x),4℃保存;待孵育结束后,移除上清,jc
‑
1染色缓冲液(1x)洗涤2次后,加入1ml pbs缓冲液,于流式细胞仪上机检测。
[0131]
结果如图9,参芪扶正注射液显著增强了jc
‑
1线粒体膜(****p<0.0001v.s.ct
‑
26,值表示为平均值
±
sd,n=3)。
[0132]
尽管在此公开了本发明的各个方面和实施例,但其他方面和实施例对于本领域技术人员而言也是显而易见的。在此公开的各个方面和实施例仅用于说明目的,而非限制目的。本发明的保护范围和主题仅通过本发明的权利要求书来确定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。