1.本发明属于荧光发光材料技术领域,涉及一种碳量子点,特别是一种具有橙光发射的碳量子点材料。本发明的橙光发射碳量子点可以应用于高尔基体的靶向成像中。
背景技术:
2.细胞器是散布在细胞质内具有一定形态和功能的微器官。高尔基体是合成蛋白质、脂质和碳水化合物等生物大分子以用于胞外分泌或其他胞内细胞器再次加工的细胞器。当细胞发生癌变后,过度分泌蛋白和蛋白酶,增加蛋白质分泌的需求,进而影响高尔基体的大小和容量,导致高尔基体肿大。同时,高尔基体的异常会诱发很多疾病,比如阿尔兹海默病、帕金森疾病和多种自身免疫性疾病等。
3.因此,设计和发展一种能够准确定位高尔基体的荧光探针,对其形态等的改变进行监测和分析,进而阐明其生理和病理过程,对于疾病的诊断具有实际的应用价值。
4.碳量子点是一种尺寸小于10nm的新型准零维碳纳米材料,因具有合成过程简单、易操作、低成本、优越的光稳定性、抗光漂白、发射波长可调、易功能化、低毒性和良好的生物相容性等突出特点,而被广泛应用于细胞成像等领域。
5.但遗憾的是,目前报道的用于细胞成像的碳量子点基本上都是属于短波长的蓝绿光发射。为了避免自体荧光干扰,增加碳量子点的组织穿透深度,并减小其对生物组织的光损伤,合成长波长发射的碳量子点也是必要的。
6.进而,大多数的碳量子点都是针对整个细胞质进行染色的,由于其不具有靶向性,不能定位到细胞质中的某个细胞器,无法精确地观察到某个细胞器的变化,无法精确了解细胞的动态。为此,需要对碳量子点进行功能化,合成富含靶向性官能团的碳量子点,从而实现细胞器的靶向成像。
7.在高尔基体表面含有半胱氨酸受体,因此,可以利用配体受体结合的原理,采用半胱氨酸作为高尔基体的靶向单元,合成碳量子点用于高尔基体靶向成像。
8.ni. et al(optical properties of nitrogen and sulfur co
‑
doped carbon dots and their applicability as fluorescent probes for living cell imaging. appl. surf. sci., 2019, 494: 377
‑
383.)以半胱氨酸为原料,于180℃一步水热合成反应18h,制备得到了一种表面含有
‑
oh、
‑
nh2和
‑
cooh官能团的蓝光发射碳量子点。
9.然而,进一步的细胞成像实验结果却表明,该碳量子点能够通过细胞膜进入到细胞质和细胞核中,将整个细胞染色,并不具有靶向性。
10.文献(chemical science, 2017, 8(10): 6829
‑
6835.;new journal of chemistry, 2019, 43(35): 13735
‑
13740.)分别采用两步法合成了靶向高尔基体的碳量子点,具体是先合成得到碳量子点,然后再在温和的反应条件下,将半胱氨酸或含半胱氨酸结构的青霉胺修饰于碳量子点表面,使半胱氨酸残基得以保留,从而实现了碳量子点对高尔基体的靶向成像。
11.然而,上述用于实现高尔基体靶向成像的碳量子点的制备方法复杂,且其发射波
长处于短波长。因此,需要制备出一种既能实现半胱氨酸结构的保留,又具有长波长发射性能的可以一步碳化得到的碳量子点。
技术实现要素:
12.本发明的目的是提供一种橙光碳量子点,以及该碳量子点的制备方法。本发明制备的橙光碳量子点表面富含半胱氨酸残基,以其应用于细胞成像,能够实现针对高尔基体的靶向成像。
13.为实现上述发明目的,本发明提供的橙光碳量子点是以中性红为碳源,半胱氨酸为靶向源,将其溶于水或乙醇水溶液中,密闭下120~160℃溶剂热反应6~14h,反应产物提纯后得到的碳量子点固体粉末。
14.其中,作为靶向源的半胱氨酸可以是l
‑
半胱氨酸、d
‑
半胱氨酸或dl
‑
半胱氨酸。
15.进一步地,所述原料半胱氨酸与中性红的摩尔比为1000∶1~80。
16.更进一步地,其中的溶剂乙醇水溶液优选为体积浓度12~87%的乙醇水溶液。
17.本发明制备的碳量子点固体粉末粒径范围1.5~5.0nm,具有良好的水溶性,在激发光照射下发射580~620nm的荧光,属于橙光发射,且具有激发依赖性。
18.进而,本发明提供了所述橙光碳量子点的一种制备方法。
19.将摩尔比为1000∶1~80的半胱氨酸和中性红溶于水或体积浓度12~87%的乙醇水溶液中,密闭下升温至120~160℃溶剂热反应6~14h,反应产物经过滤、提纯后,冷冻干燥得到纯化的橙光碳量子点固体粉末。
20.优选地,本发明上述进行溶剂热反应的反应体系中,半胱氨酸与中性红的质量占反应体系总质量的3.0~3.6%。
21.本发明采用透析袋对上述制备得到的反应产物进行提纯。更具体地,所述提纯使用的是截留分子量为1000da的透析袋。
22.更进一步地,本发明将所述透析后的碳量子点溶液用冷冻干燥机进行冷冻干燥,制备得到碳量子点固体粉末。
23.本发明制备的橙光碳量子点可以作为医学成像剂应用。
24.进一步的,本发明制备的橙光碳量子点可以作为成像剂,应用于高尔基体的靶向成像中。
25.以本发明制备的橙光碳量子点作为成像剂,与宫颈癌hela细胞进行共同孵育,在激光共聚焦显微镜下观察到橙光碳量子点染色后的细胞呈现局部聚集现象,能够标记细胞中的某一部位,并发射橙光。将其与商业高尔基体靶向绿色荧光染色剂nbd c6
‑
ceramide染色的hela细胞比较,发现两者的标记位置高度重叠,证明本发明的橙光碳量子点具有高尔基体靶向能力。
26.本发明制备的橙光碳量子点呈类球形,具有激发依赖的荧光特性,且具有良好的水溶性,在高尔基体靶向成像等方面具有良好的应用前景。
附图说明
27.图1是实施例1和实施例2制备l
‑
碳量子点和d
‑
碳量子点的透射电子显微镜像。
28.图2是l
‑
和d
‑
碳量子点的红外光谱图。
29.图3是l
‑
、d
‑
和dl
‑
碳量子点的圆二色光谱图。
30.图4是l
‑
、d
‑
和dl
‑
碳量子点水溶液在不同激发波长下的荧光发射光谱图。
31.图5是d
‑
碳量子点水溶液的光强度随光照时间的变化图。
32.图6是实施例4制备l
‑
碳量子点水溶液在不同激发波长下的荧光发射光谱图。
33.图7是实施例5制备l
‑
碳量子点水溶液在不同激发波长下的荧光发射光谱图。
34.图8是实施例6制备l
‑
碳量子点水溶液在不同激发波长下的荧光发射光谱图。
35.图9是实施例7制备l
‑
碳量子点水溶液在不同激发波长下的荧光发射光谱图。
36.图10是l
‑
和d
‑
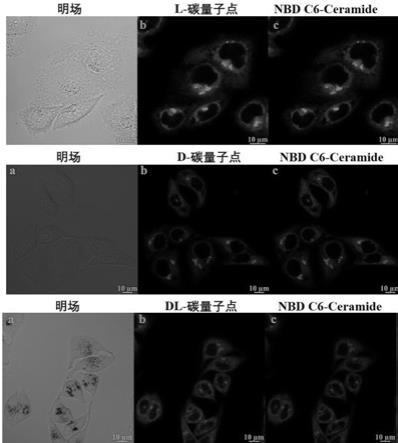
碳量子点对hela细胞的毒性结果。
37.图11是不同碳量子点对hela细胞高尔基体的靶向成像结果。
具体实施方式
38.下面结合附图和实施例对本发明的具体实施方式作进一步的详细描述。以下实施例仅用于更加清楚地说明本发明的技术方案,从而使本领域技术人员能很好地理解和利用本发明,而不是限制本发明的保护范围。
39.本发明实施例和对比例中涉及到的实验方法、生产工艺、仪器以及设备,其名称和简称均属于本领域内常规的名称,在相关用途领域内均非常清楚明确,本领域内技术人员能够根据该名称理解常规工艺步骤并应用相应的设备,按照常规条件或制造商建议的条件进行实施。
40.本发明实施例和对比例中使用的各种原料或试剂,并没有来源上的特殊限制,均为可以通过市售购买获得的常规产品。也可以按照本领域技术人员熟知的常规方法进行制备。
41.实施例1。
42.称取1.2167g(10mmol)l
‑
半胱氨酸和0.058g(0.2mmol)中性红,加入到由30ml乙醇与10ml超纯水组成的混合溶剂中,室温搅拌至完全溶解,得到前驱体溶液。
43.将所述前驱体溶液置于100ml带四氟乙烯内衬的不锈钢高压反应釜中,密闭,140℃烘箱中溶剂热反应8h。
44.反应结束后冷却至室温,取出反应液,以0.22μm微孔滤膜过滤。
45.将滤液装入1000da透析袋中,置于超纯水中透析48h后,收集留存于透析袋内的溶液,得到l
‑
碳量子点溶液。
46.将l
‑
碳量子点溶液移入干燥瓶中,于真空冷冻干燥机中冷冻干燥,制备得到l
‑
碳量子点固体粉末。
47.实施例2。
48.以d
‑
半胱氨酸代替l
‑
半胱氨酸,其他与实施例1相同,制备得到d
‑
碳量子点固体粉末。
49.实施例3。
50.以纯度97%的dl
‑
半胱氨酸代替l
‑
半胱氨酸,其他与实施例1相同,制备得到dl
‑
碳量子点固体粉末。
51.在透射电子显微镜下观察l/d
‑
碳量子点固体粉末的形貌。根据图1形貌可以看出,l
‑
和d
‑
碳量子点呈类球形,分散性良好,粒径范围分别为1.0~4.0nm和0.5~3.0nm,没有团
聚现象发生。
52.根据图2的l/d
‑
碳量子点红外光谱图可以看出,在l
‑
和d
‑
碳量子点表面含有丰富的官能团,3421cm
‑1处的吸收带归因于o
‑
h/n
‑
h的伸缩振动,2546cm
‑1较弱的吸收带是s
‑
h的特征吸收带,1620和1395cm
‑1分别对应于coo
‑
的不对称和对称伸缩振动,c=n、o=cnh中的c
‑
n伸缩振动分别位于1441和1395cm
‑1,638cm
‑1归因于c
‑
s的伸缩振动。o=cnh的存在,表明在溶剂热反应过程中发生了
‑
cooh与
‑
nh2的脱水反应。在碳量子点表面含有丰富的亲水官能团,赋予了碳量子点良好的水溶性。
53.图3所示为l/d/dl
‑
碳量子点水溶液的圆二色谱图。
54.其中,l
‑
和d
‑
碳量子点显示出对左右圆偏振光不同的吸收程度,在210和250nm附近具有相反且对称的圆二色信号,表明它们是一对对映异构体。210nm左右的圆二色信号继承于l
‑
和d
‑
半胱氨酸,由此间接地证明半胱氨酸的结构在碳量子点中得到了保留。另外,l
‑
和d
‑
碳量子点产生的新的手性中心而引起250nm附近的圆二色信号,其归因于sp2杂化碳的π
‑
π*跃迁。
55.进而,由于dl
‑
碳量子点是以纯度97%的dl
‑
半胱氨酸为原料制备的,因此在其圆二色谱图中也显示出了相对较小的手性信号。
56.图4给出了l/d/dl
‑
碳量子点水溶液在不同激发波长下的荧光发射光谱。在360~560nm范围内的激发光下,l/d/dl
‑
碳量子点的发射峰位随着激发波长的变化而变化,表现为激发依赖性。
57.另外,随着激发波长不断增加到440nm,碳量子点的荧光强度逐渐增加;然后激发波长再增加,荧光强度反而逐渐下降,在440nm达到最大值,表明在440nm激发波长照射下,所制备l/d/dl
‑
碳量子点具有最佳的荧光发射亮度。
58.图5是上述制备d
‑
碳量子点水溶液在不同光照时间下的光强度变化图。在波长440nm的紫外光下连续紫外激发60min后,没有发现明显的光漂白,说明d
‑
碳量子点的光稳定性较高。
59.实施例4。
60.称取1.2167g(10mmol)l
‑
半胱氨酸和0.0029g(0.01mmol)中性红,加入到40ml超纯水中,室温搅拌至完全溶解,得到前驱体溶液。
61.将所述前驱体溶液置于100ml带四氟乙烯内衬的不锈钢高压反应釜中,密闭,140℃烘箱中溶剂热反应8h。
62.反应结束后冷却至室温,取出反应液,以0.22μm微孔滤膜过滤。
63.将滤液装入1000da透析袋中,置于超纯水中透析48h后,收集留存于透析袋内的溶液,得到l
‑
碳量子点溶液。
64.将l
‑
碳量子点溶液移入干燥瓶中,于真空冷冻干燥机中冷冻干燥,制备得到l
‑
碳量子点固体粉末。
65.图6是l
‑
碳量子点水溶液在不同激发波长下的荧光发射光谱。在320~540nm激发光下,l
‑
碳量子点的发射峰位随着激发波长的变化而变化,表现为激发依赖性。另外,激发波长从320nm增加到400nm,碳量子点的荧光强度增加;从400nm增加到540nm时,荧光强度逐渐下降,并在400nm达到最大值,表明在400nm激发波长照射下,所制备l
‑
碳量子点具有最佳的荧光发射亮度。
66.实施例5。
67.称取1.2167g(10mmol)l
‑
半胱氨酸和0.058g(0.2mmol)中性红,加入到由30ml乙醇与10ml超纯水组成的混合溶剂中,室温搅拌至完全溶解,得到前驱体溶液。
68.将所述前驱体溶液置于100ml带四氟乙烯内衬的不锈钢高压反应釜中,密闭,140℃烘箱中溶剂热反应6h。
69.反应结束后冷却至室温,取出反应液,以0.22μm微孔滤膜过滤。
70.将滤液装入1000da透析袋中,置于超纯水中透析48h后,收集留存于透析袋内的溶液,得到l
‑
碳量子点溶液。
71.将l
‑
碳量子点溶液移入干燥瓶中,于真空冷冻干燥机中冷冻干燥,制备得到l
‑
碳量子点固体粉末。
72.从图7不同激发波长下l
‑
碳量子点水溶液的荧光发射光谱看出,在420~560nm激发光下,l
‑
碳量子点的发射峰位随着激发波长的变化而变化,表现为激发依赖性。另外,激发波长从420nm增加到440nm,碳量子点的荧光强度增加;从440nm增加到560nm,荧光强度逐渐下降,并在440nm达到最大值,表明在440nm激发波长照射下,所制备l
‑
碳量子点具有最佳的荧光发射亮度。
73.实施例6。
74.称取1.2167g(10mmol)l
‑
半胱氨酸和0.058g(0.2mmol)中性红,加入到由30ml乙醇与10ml超纯水组成的混合溶剂中,室温搅拌至完全溶解,得到前驱体溶液。
75.将所述前驱体溶液置于100ml带四氟乙烯内衬的不锈钢高压反应釜中,密闭,140℃烘箱中溶剂热反应14h。
76.反应结束后冷却至室温,取出反应液,以0.22μm微孔滤膜过滤。
77.将滤液装入1000da透析袋中,置于超纯水中透析48h后,收集留存于透析袋内的溶液,得到l
‑
碳量子点溶液。
78.将l
‑
碳量子点溶液移入干燥瓶中,于真空冷冻干燥机中冷冻干燥,制备得到l
‑
碳量子点固体粉末。
79.从图8不同激发波长下l
‑
碳量子点水溶液的荧光发射光谱看出,在380~560nm激发光下,l
‑
碳量子点的发射峰位随着激发波长的变化而变化,表现为激发依赖性。另外,激发波长从380nm增加到440nm,碳量子点的荧光强度增加;从440nm增加到560nm,荧光强度逐渐下降,并在440nm达到最大值,表明在440nm激发波长照射下,所制备l
‑
碳量子点具有最佳的荧光发射亮度。
80.实施例7。
81.称取1.2167g(10mmol)l
‑
半胱氨酸和0.058g(0.2mmol)中性红,加入到由30ml乙醇与10ml超纯水组成的混合溶剂中,室温搅拌至完全溶解,得到前驱体溶液。
82.将所述前驱体溶液置于100ml带四氟乙烯内衬的不锈钢高压反应釜中,密闭,160℃烘箱中溶剂热反应8h。
83.反应结束后冷却至室温,取出反应液,以0.22μm微孔滤膜过滤。
84.将滤液装入1000da透析袋中,置于超纯水中透析48h后,收集留存于透析袋内的溶液,得到l
‑
碳量子点溶液。
85.将l
‑
碳量子点溶液移入干燥瓶中,于真空冷冻干燥机中冷冻干燥,制备得到l
‑
碳
量子点固体粉末。
86.从图9不同激发波长下l
‑
碳量子点水溶液的荧光发射光谱看出,在400~540nm激发光下,l
‑
碳量子点的发射峰位随着激发波长的变化而变化,表现为激发依赖性。另外,激发波长从400nm增加到440nm,碳量子点的荧光强度增加;从440nm增加到540nm,荧光强度逐渐下降,并在440nm达到最大值,表明在440nm激发波长照射下,所制备l
‑
碳量子点具有最佳的荧光发射亮度。
87.应用例1:碳量子点的细胞毒性测试。
88.采用hela细胞,以cck
‑
8法测试实施例1和实施例2制备l
‑
碳量子点和d
‑
碳量子点的细胞毒性。
89.当培养的hela细胞密度达到80~90%时,以胰酶消化。将消化下来的细胞用1640培养基稀释,1000rpm离心5min,去除上清液后,将细胞再分散在1640培养基中,以细胞计数板计数,调整细胞悬液的密度为2.5
×
104cells/ml,接种于96孔细胞培养板中,每孔0.1ml,培养24h。
90.将培养液更换为含有碳量子点的培养液,分别设置碳量子点的浓度为0、3.125、6.25、12.5、25、50、100、200和400μg/ml,平行做6个复孔,在含5% co2的培养箱中37℃继续培养24h,弃去碳量子点培养液,用ph7.4的无菌pbs缓冲液冲洗三次,每孔加入100μl含10% cck
‑
8的1640培养液,继续培养1h后,以酶标仪测定450nm处的od值。
91.以未经碳量子点孵育的细胞作为对照,设置其的细胞存活率为100%,计算不同浓度碳量子点处理后细胞的存活率。
92.图10给出了l
‑
和d
‑
碳量子点对hela细胞的毒性结果。从图中可以看出,在不同浓度的碳量子点中孵育24h,hela细胞的存活率可以达到90%以上,即便将hela细胞在浓度400
µ
g/ml的碳量子点中孵育长达24h,都对细胞没有毒性,证明无论是l
‑
还是d
‑
碳量子点,都具有良好的生物相容性且毒性低。
93.应用例2。
94.按照商业说明书制备高尔基体特异性荧光染料nbd c6
‑
ceramide
‑
bsa复合物。
95.分别以实施例1制备l
‑
碳量子点、实施例2制备d
‑
碳量子点、实施例3制备dl
‑
碳量子点和nbd c6
‑
ceramide
‑
bsa复合物对hela细胞进行细胞染色和成像。
96.将1
×
105个hela细胞铺于共聚焦培养皿中,于37℃、5% co2细胞培养箱中培养过夜。待细胞贴壁后,分别加入含200μg/ml各实施例碳量子点的培养液,孵育4h后,弃去培养液,以pbs溶液洗涤3次,除去残余的碳量子点。
97.继续在上述经各碳量子点染色后的hela细胞中加入高尔基体特异性荧光染料nbd c6
‑
ceramide
‑
bsa复合物,在4℃下孵育30min,以pbs溶液洗涤3次。
98.最后用激光共聚焦显微镜对hela细胞进行观察并拍摄。
99.选用458nm激光作为激发光源,分别在515~550nm范围采集nbd c6
‑
ceramide
‑
bsa复合物的发射光信号,580~620nm范围采集碳量子点的发射光信号,进行体外细胞成像。
100.图11给出了本发明制备l
‑
、d
‑
和dl
‑
碳量子点进入宫颈癌hela细胞后的光学显微镜图。图中,与明场细胞比较,l
‑
、d
‑
和dl
‑
碳量子点处理后的细胞图像清楚地表明l
‑
、d
‑
和dl
‑
碳量子点很容易被细胞吸收。而与商业高尔基体靶向绿色荧光染色剂nbd c6
‑
ceramide
‑
bsa复合物染色后的细胞图像比较,两者的染色部位高度重叠,证明l
‑
、d
‑
和dl
‑
碳量子点具有高尔基体靶向性。
101.同时,细胞没有明显的形态学损伤,进一步证实了l
‑
、d
‑
和dl
‑
碳量子点具有低的细胞毒性和良好的生物相容性。
102.本发明以上实施例并没有详尽叙述所有的细节,也不限制本发明仅为以上所述实施例。本领域普通技术人员在不脱离本发明原理和宗旨的情况下,针对这些实施例进行的各种变化、修改、替换和变型,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。