检测血清4型禽腺病毒变异株的微滴式数字pcr引物探针组合及其应用
技术领域
1.本发明涉及生物技术领域中,检测血清4型禽腺病毒变异株的微滴式数字pcr引物探针组合及其应用。
背景技术:
2.血清4型禽腺病毒(fowl adenovirus serotype,fadv-4)是引起心包积液-肝炎综合征(hydropericardium-hepatitis syndrome,hhs)的病原体,病鸡剖检可见心包内有淡黄色液体或胶冻状渗出物,肝脏病变肿大黄染,并出现大量嗜碱性包涵体。1987年,由fadv-4感染引起家禽hhs症状首次在巴基斯坦报道,随后陆续在多个国家和地区的家禽暴发和感染,造成了巨大的经济损失。目前,已有研究表明fadv-4还感染鸭和多种鸟类,这种从鸡到鸭的传播对养禽业构成严重威胁和隐患。从2015年起,我国多地暴发了由fadv-4感染引起鸡hhs的疫情。经过对此次疫情中fadv-4的基因测序分析,结果表明,引发此次疫情暴发的fadv-4与国内外毒株相比,全基因组均存在核苷酸序列的变异,主要包括基因组右端长度约1966bp大片段缺失和多个氨基酸突变,确认国内新发流行的fadv-4为变异毒株。有研究表明,fadv-4变异株毒力较之前的毒株有所上升,因此,fadv-4变异株的防控变得更为迫切和必要。
3.数字pcr(dpcr)是近年迅速发展起来的一种新型核酸定量分析技术,dpcr的基础原理是将样品总体分散成无数个独立反应单元的定量pcr技术,以实现在单分子水平上进行绝对定量检测。其中微滴式数字pcr(ddpcr)通过微滴生成仪将pcr反应体系分散成无数微滴,并用微滴生成油包裹,形成“油包水”微滴单元。每个微滴单元中可能包含1个拷贝或不包含dna模板分子,对所有独立的反应单元进行平行扩增。在扩增结束后,通过读取收集各反应单元的荧光信号阴阳性情况,并采用泊松分布的统计学方法进行分析,就可以计算出样本的原始模板拷贝数。关于fadv-4的检测也有ddpcr方法建立的报道,但该方法尚未被证明能否区分鉴别新发的fadv-4变异株与2015年暴发前的fadv-4毒株。因此,建立一种具有高灵敏度、高准确性,能够区分鉴别fadv-4变异株的快速检测方法对新发流行fadv-4毒株的防控极为重要。
技术实现要素:
4.本发明所要解决的技术问题是如何检测血清4型禽腺病毒变异株。
5.为解决上述技术问题,本发明首先提供了一种用于检测血清4型禽腺病毒变异株的引物探针组合,所述引物探针组合由名称分别为f1、r1的两条引物与名称为p1的探针组成,所述f1、所述r1分别为序列表中seq id no.1、seq id no.2所示的单链dna,所述p1的序列为seq id no.3。
6.上述引物探针组合中,所述p1两端分别标记有荧光淬灭基团(如tamra)与荧光基团(如fam、rox)。
7.上述引物探针组合中各引物探针均可独立包装。其中,所述f1、所述r1、所述p1的摩尔比可为7:7:6。
8.上述引物探针组合的下述任一应用,也属于本发明的保护范围:
9.x1、制备检测或辅助检测血清4型禽腺病毒变异株的产品;
10.x2、检测或辅助检测血清4型禽腺病毒变异株;
11.所述血清4型禽腺病毒变异株为基因组中缺失seq id no.4所示片段的血清4型禽腺病毒毒株。
12.本发明还提供了一种用于检测血清4型禽腺病毒变异株的试剂盒,所述试剂盒含有所述引物探针组合。
13.上述试剂盒还含有进行微滴式数字pcr所需的其他试剂(如droplet pcr supermix)。微滴式数字pcr所需的其它试剂可包括dna聚合酶和/或pcr缓冲液和/或datp、dttp、dctp和dgtp的dntp的混合物和/或mgcl2。
14.上述试剂盒的下述任一应用,也属于本发明的保护范围:
15.x1、制备检测或辅助检测血清4型禽腺病毒变异株的产品;
16.x2、检测或辅助检测血清4型禽腺病毒变异株;
17.所述血清4型禽腺病毒变异株为基因组中缺失seq id no.4所示片段的血清4型禽腺病毒毒株。
18.本发明的引物探针组合特异性好,可特异性检测fadv-4变异株,与其它血清型禽腺病毒和常见禽病病原体无交叉反应;敏感性好,可以检测浓度为2copies/μl血清4型禽腺病毒变异株;重复性好,批内与批间重复性试验的变异系数均小于2%;准确性好,可检测出近年流行的血清4型禽腺病毒变异株。本发明的引物探针组合可以用于检测血清4型禽腺病毒变异株,具有很好的应用前景。
19.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
附图说明
20.图1为本发明引物探针组合检测7株fadv-4广西分离株特异性试验结果。n:阴性对照;1~7:fadv-4gx2019-003~005、gx2019-009~011、gx2019-016。
21.图2为本发明引物探针组合检测fadv-4av211非变异株特异性试验结果。n:阴性对照;p:阳性对照;1:fadv-4av211。
22.图3为本发明引物探针组合敏感性试验检测结果。n:阴性对照;1-7:10-9
、10-8
、10-7
、10-6
、10-5
、10-4
、10-3
的质粒稀释液。
23.图4为荧光定量qpcr敏感性试验检测结果。n:阴性对照;1-7:10-3
、10-4
、10-5
、10-6
、10-7
、10-8
、10-9
的质粒稀释液。
具体实施方式
24.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如
无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置至少三次重复,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna/rna的5
′
末端核苷酸,末位均为相应dna/rna的3
′
末端核苷酸。
25.fadv-4广西分离株7株(gx2019-003、gx2019-004、gx2019-005、gx2019-009、gx2019-010、gx2019-011、gx2019-016)、h9型禽流感病毒(avian influenza virus,aiv h9)、禽呼肠孤病毒(avian reovirus,arv)、新城疫病毒(newcastle disease virus,ndv)、鸡传染性支气管炎病毒(infectious bronchitis virus,ibv)、鸡传染性法氏囊炎病毒(infectious bursal disease virus,ibdv)、减蛋综合征病毒(egg drop syndrome virus,edsv)由本实验室分离保存,均记载在文献“梁思敏,谢芝勋,罗思思,邓显文,韦悠,谢志勤,李小凤,万丽军,范晴,任红玉.血清4型禽腺病毒夹心elisa检测方法的建立[j].中国兽医科学,2023,53(04):434-438.doi:10.16656/j.issn.1673-4696.2023.0089.”中,公众按照国家生物安全的有关规定可从申请人获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0026]
fadv-4非变异株av211和其它血清型禽腺病毒fadv(fadv-1、fadv-2、fadv-3、fadv-5、fadv-6、fadv-7、fadv-8a、fadv-8b、fadv-9、fadv-10、fadv-11)毒株均为中国兽医药品监察所产品。
[0027]
其中,7株fadv-4广西分离株基因组右端均存在约1966bp大片段的缺失,缺失序列为seq id no.4,fadv-4非变异株av211不存在这种缺失。
[0028]
重组质粒的制备:
[0029]
以fadv-4变异株(gx2019-010)的基因组dna为模板,利用标准品引物f1与r1进行pcr扩增,将得到的pcr产物与-t1 cloning kit(北京全式金生物产品)中的载体相连,将得到的序列正确的重组质粒记为-blunt-bian。
[0030]
所用引物序列如下:
[0031]
标准品引物f1:5
′‑
tatcggaatgcgcgacctaa-3
′
;
[0032]
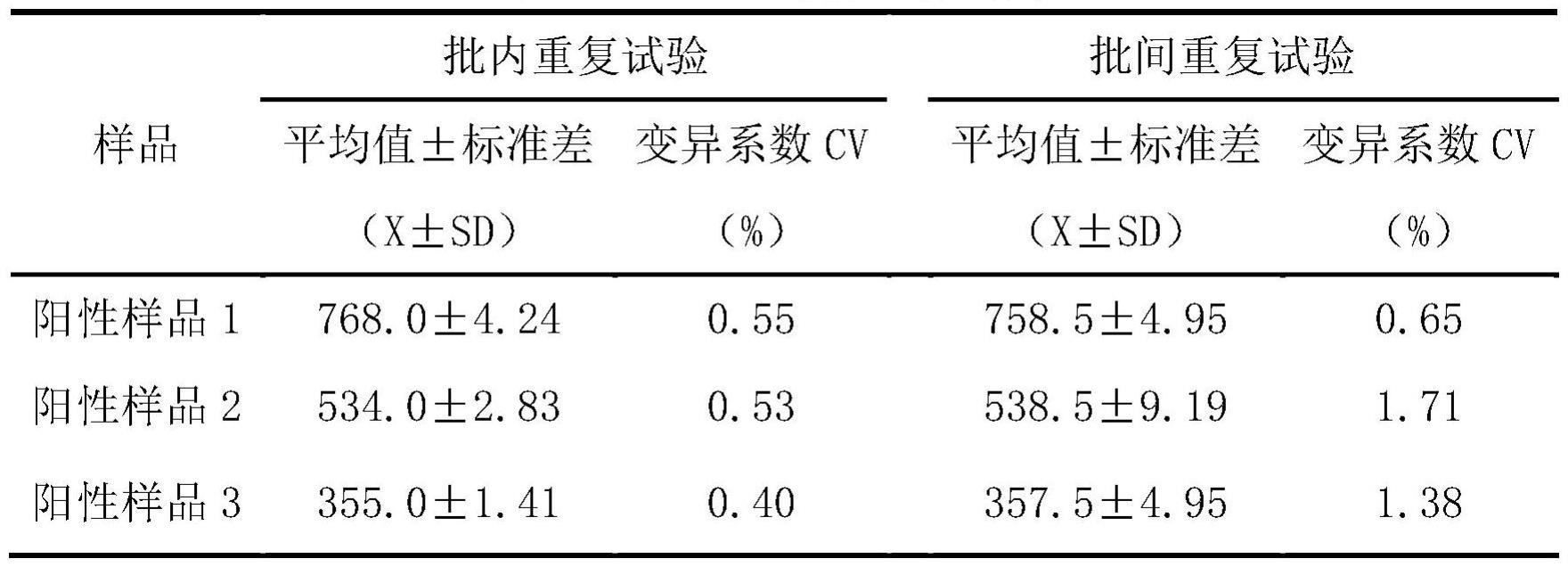
标准品引物r1:5
′‑
gtgtttatatggcggatgtt-3
′
。
[0033]
使用核酸测定仪测定质粒浓度后,计算所提取质粒的拷贝数。
[0034]
实施例1、用于检测血清4型禽腺病毒变异株的引物探针组合的制备
[0035]
本实施例提供了用于检测血清4型禽腺病毒变异株的引物探针组合,该引物组由引物f1、r1与探针p1组成,探针两端分别标记荧光染料(fam)以荧光淬灭基团,具体序列如下:
[0036]
f1:5
′‑
ccgtatactaatcccgtcac-3
′
(seq id no.1);
[0037]
r1:5
′‑
gatgttcggatcggagttta-3
′
(seq id no.2);
[0038]
p1:5
′‑
fam-acgacacccacaatcacgcaatgcata-tamra-3
′
(seq id no.3)。
[0039]
该用于检测血清4型禽腺病毒变异株的引物探针组合中,f1、r1、p1的摩尔比为7:7:6。
[0040]
实施例2、微滴式数字pcr反应条件的优化
[0041]
1、微滴式数字pcr(ddpcr)反应方法
[0042]
1)反应体系的配置
[0043]
20μl反应体系如下:droplet pcr supermix(美国伯乐bio-rad)10μl,引物(f1、
r1),探针(p1),模板2μl,用ddh2o补足20μl。以rnase-free water替换模板作为阴性对照。
[0044]
2)样品的微滴生成
[0045]
在微滴生成卡(dg8 cartridges for qx100/qx200 droplet generator微滴发生卡,美国伯乐bio-rad)第2行加入样品的反应体系20μl,第3行的反应孔中加入70μl微滴生成油(美国伯乐bio-rad),全程避免气泡的产生。将微滴生成卡轻轻地平稳放入已预热30min的qx200droplet generator微滴生成仪,微滴生成过程约2min。微滴生成卡第1行的反应孔中即为生成的微滴。
[0046]
3)pcr反应
[0047]
将微滴生成卡内的微滴转移至96孔板孔底,移液时注意要缓慢轻柔避免破坏微滴和产生气泡。打开px1热封仪(美国伯乐bio-rad)进行预热,温度达到180℃时,放入96孔板进行封膜,整个过程需要5s左右。封膜步骤完成后,取出96孔板仔细观察孔边缘,确认封膜完全将孔密封。封膜完成后应在30min内进行pcr反应,将96孔板放入t-100梯度pcr扩增仪(美国伯乐bio-rad)中,进行pcr反应。
[0048]
反应程序为:第一阶段,预变性:95℃反应10min;第二阶段:94℃反应30s、退火温度下退火1min,该阶段进行40个循环;第三阶段:98℃反应10min。每阶段升降温控制在2℃/sec。
[0049]
4)qx200仪器的微滴读取
[0050]
在进行微滴读取前30min打开qx200 droplet reader微滴数字读取仪(美国伯乐bio-rad)预热。打开quantasoft软件,点击flush system运行程序进行管路和取样针的清洗,完成清洗后,在软件上设置样品编号信息。将完成pcr反应的96孔板放在微滴读取仪支架上,按下左右固定开关,确保96孔板完全固定在支架上。关闭微滴读取仪前盖,点击run,对检测的荧光组进行确定后,等待微滴读取仪逐个收集已编辑孔的检测信号,每个孔读取时间为5min左右。读取完成后,打开微滴读取仪前盖,按下固定开关取出已使用过的96孔板丢弃,然后在quantasoft软件进行结果分析。
[0051]
2、引物和探针浓度的优化
[0052]
将-blunt-bian重组质粒作为标准品,以之为模板,对步骤1的方法中的引物探针浓度进行优化,引物f1与r1的浓度相同,均设置为0.2μmol/l、0.25μmol/l、0.3μmol/l、0.35μmol/l、0.4μmol/l、0.45μmol/l、0.5μmol/l,探针p1的浓度设置为0.05μmol/l、0.1μmol/l、0.15μmol/l、0.2μmol/l、0.25μmol/l、0.3μmol/l、0.35μmol/l。在模板质粒浓度统一的前提下,将散点图中阴阳性液滴分散情况和在微滴数统计在满足可信区间要求的情况下生成最多阳性微滴,两个条件作为引物和探针的最佳终浓度筛选标准。结果显示引物最佳终浓度为0.35μmol/l,探针最佳终浓度为0.3μmol/l。最佳反应体系如下:droplet pcr supermix(美国伯乐bio-rad)10μl,引物(f1、r1)(在体系中的浓度均为0.35μmol/l),探针(p1)(在体系中的浓度为0.3μmol/l),模板2μl,用ddh2o补足20μl。
[0053]
3、退火温度的优化
[0054]
将-blunt-bian重组质粒作为标准品,以之为模板,对步骤1的方法中的退火温度进行优化,所用反应体系为步骤2的最佳反应体系,退火温度设置为50℃、51℃、52℃、53℃、54℃、55℃、56℃。结果显示最佳退火温度为54℃。最终反应程序为:95℃反应10min;94℃反应30s、54℃退火1min,重复40个循环;98℃反应10min。全过程中升降温速率
需要控制在2℃/sec。
[0055]
实施例3、微滴式数字pcr特异性实验
[0056]
本实施例检测实施例1的引物探针组合的特异性,所用毒株为:7株fadv-4广西分离株(gx2019-003、gx2019-004、gx2019-005、gx2019-009、gx2019-010、gx2019-011、gx2019-016)、fadv-4非变异株av211、其他血清型禽腺病毒(fadv-1、fadv-2、fadv-3、fadv-5、fadv-6、fadv-7、fadv-8a、fadv-8b、fadv-9、fadv-10、fadv-11)、其它禽病病原体(aiv h9、arv、ndv、ibv、ibdv、edsv)。
[0057]
分别提取各病毒或病原体的基因组dna/rna,并分别以之为模板利用实施例1的引物探针组合进行微滴式数字pcr,所用反应体系为实施例2的最佳反应体系,所用反应程序为实施例2的最佳反应程序。以-blunt-bian重组质粒作为阳性对照,并以rnase-free water作为阴性对照。
[0058]
使用建立的ddpcr方法分别对7株fadv-4广西分离株、fadv-4非变异株(av211)、其它血清型禽腺病毒和其它常见禽病病原体进行特异性试验,所有ddpcr反应生成总微滴数均大于10000,表明ddpcr反应中微滴生成过程正常,结果可信。
[0059]
特异性试验结果显示7株fadv-4广西分离株(gx2019-003~005、gx2019-009~011、gx2019-016)均为阳性(如图1),fadv-4非变异株av211(如图2)、其它血清型禽腺病毒和其它常见禽病病原体均为阴性。
[0060]
因此,利用本发明的引物探针检测血清4型禽腺病毒变异株的判断方法如下:通过检测的微滴散点图(如图1、图2)判定,横坐标代表微滴数,纵坐标代表荧光强度,阴性微滴以灰色显示,阳性微滴以蓝色或绿色显示。阴阳性微滴的判定是由荧光阈值大小决定的,软件自动计算阈值并判定阴阳性。
[0061]
实施例4、微滴式数字pcr敏感性实验
[0062]
本实施例检测实施例1的引物探针组合的敏感性。使用rnase-free water将-blunt-bian分别进行10倍倍比稀释,分别得到10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
、10-8
、10-9
的质粒稀释液。
[0063]
分别以各质粒稀释液为模板,利用实施例1的引物探针组合进行微滴式数字pcr,所用反应体系为实施例2的最佳反应体系,所用反应程序为实施例2的最佳反应程序。以rnase-free water作为阴性对照。
[0064]
同时使用相同的引物和探针以及相同稀释度标准质粒进行荧光定量pcr方法的检验,荧光定量pcr反应体系为:premix ex taq(宝日医生物技术有限公司产品)10μl,f1/r1各1μl,探针p1 1μl,质粒稀释液2μl,以rnase-free water补足25μl;反应程序为:95℃反应30s,95℃反应5s、60℃退火34s并重复40个循环以收集荧光信号。根据结果,比较两种方法的敏感性。
[0065]
结果显示,ddpcr最低检出量为2.0copies/μl(10-8
稀释),如图3,图3中横坐标表示微滴数,纵坐标表示荧光强度。荧光定量pcr最低检出量为20copies/μl(10-7
稀释),如图4。ddpcr方法比荧光定量pcr检测的灵敏度更高。
[0066]
实施例5、微滴式数字pcr重复性实验
[0067]
选取3株fadv-4广西分离株,提取各病毒的基因组dna,分别以之为模板,利用实施例1的引物探针组合进行微滴式数字pcr,所用反应体系为实施例2的最佳反应体系,所用反
应程序为实施例2的最佳反应程序。以rnase-free water作为阴性对照。每个毒株做3次批内重复。在3个不同时间点,进行3次重复,即进行批间重复。
[0068]
对检测所得拷贝数浓度结果进行统计分析,结果显示批内试验的变异系数为0.4~0.55%;批间试验的变异系数为0.65~1.71%。批内与批间变异系数均小于2%(如表1),表明本发明的方法具有良好的重复性。
[0069]
表1、ddpcr重复性试验结果
[0070][0071]
实施例6、微滴式数字pcr的临床样品检测
[0072]
从广西南宁市不同地区活禽市场采集100份肛口拭子样品,充分浸泡和清洗棉拭子后,按照dna提取试剂盒操作说明书提取样品的dna。以各样本dna为模板,利用实施例1的引物探针组合进行微滴式数字pcr,所用反应体系为实施例2的最佳反应体系,所用反应程序为实施例2的最佳反应程序。
[0073]
利用荧光定量pcr方法检测这100份样品,结果显示两种方法均检测出同样的8份样品为阳性样品,其余的均为阴性。结果表明,本发明的ddpcr快速鉴别检测方法对100份临床样品的检测结果具有很好的准确性(如表2)。
[0074]
表2、临床样品检测结果
[0075][0076]
荧光定量pcr方法检测100份样品的步骤如下:
[0077]
反应体系为:模板2μl,引物f1与r1(在体系中的浓度均为0.25μmol/l),探针p1(在体系中的浓度均为0.4μmol/l),premix ex taq 10μl,以rnase-free water补至总体积为20μl。
[0078]
反应程序为:第一阶段,预变性:95℃反应30s;第二阶段:95℃反应5s、60℃退火34s,该阶段进行40个循环以收集荧光信号。
[0079]
上述实施例中涉及的seq id no.4如下:
[0080][0081][0082]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
