检测猪格拉瑟氏菌的raa引物对和探针组合及试剂盒
技术领域
1.本发明属于动物疫病检测技术领域,具体涉及一种检测猪格拉瑟氏菌的raa引物对和探针组合及试剂盒,可通过重组酶介导等温扩增(recombinase aided amplification,raa)方法来快速检测猪格拉瑟氏菌。
背景技术:
2.猪格拉瑟氏菌(glaesserella parasuis,gps)是猪格拉瑟病的病原,是属于巴斯德菌科嗜血杆菌属的一种非溶血、nad依赖性的革兰氏阴性杆菌。该病原广泛存在于健康猪群的鼻腔等上呼吸系统,为条件致病菌,应激条件下引起浆膜炎、脑膜炎、支气管肺炎和关节炎,给养猪业的发展带来了严重的危害。近年来,在楼房集群式养殖条件下,由于养殖规模扩大和饲养密度加大,猪格拉瑟病对养猪生产的危害呈现加重的趋势。
3.猪格拉瑟氏菌通过单独感染或与其他猪病病原共感染或继发感染造成猪的严重损害和死亡,已成为危害世界养猪业的一种重要病原菌。猪格拉瑟氏菌常与其他呼吸道病原混合感染,如猪繁殖与呼吸综合征病毒、猪伪狂犬病毒、猪圆环病毒2型、胸膜肺炎放线杆菌和猪链球菌等。猪格拉瑟氏病较高的流行率与发病率以及混合感染等情况给该病的防控带来了巨大的挑战。
4.根据荚膜抗原的差异可以将猪格拉瑟氏菌大致分成15个血清型,不过仍然有大量猪格拉瑟氏菌菌株无法分型。我国主要流行的猪格拉瑟氏菌血清型为血清4,5,13型。猪格拉瑟氏病的防控以疫苗免疫接种和抗生素治疗为主,但是由于gps的血清型较多,不同血清型gps的交叉保护效果十分有限或者是保护力不够,由于疫苗交叉保护力差以及耐药性严重等问题极大制约了当前对猪格拉泽氏病的治疗,所以目前对于该病的早期快速诊断对预防和控制疫病的发展至关重要。
5.目前,用于诊断gps的核酸检测手段主要有聚合酶链式反应(pcr),实时荧光定量pcr(qpcr),多重pcr(multiplex pcr),环介导等温扩增(lamp)等。但是以上常规的检测方法存在耗时长,操作困难,需要复杂的热循环仪器等不足,无法满足早期快速诊断的要求,也不适合在资源有限的环境、基层和现场即时检测(point of care testing,poct)。因此,建立一种简单快速、灵敏、特异的猪格拉瑟氏菌的检测方法,对该病的诊断、防控和根除具有重要意义。
技术实现要素:
6.本发明的目的是提供一种检测猪格拉瑟氏菌的raa引物对和探针组合及试剂盒,可以简单、快速、灵敏、特异性检测使猪格拉瑟氏菌。
7.本发明首先提供一种检测猪格拉瑟氏菌的raa引物对和探针,其中raa引物对包括用于鉴定猪格拉瑟氏菌infb基因的上游引物和下游引物,引物的序列信息如下:
8.上游引物gps-infb-f(seq id no:1):
[0009]5′‑
taaaccagaagcaaacctagagcgtgtagaac-3
′
;
[0010]
下游引物gps-infb-r(seq id no:2):
[0011]5′‑
ccgattgaagaagaatggcttcaagtaagtc-3
′
。
[0012]
所述的探针,其序列如下(seq id no:3):
[0013]5′‑
atttctgagaaattcggtggtgatgttcaatttgttcctgtttcagcg-3
′
;
[0014]
所述的探针gps-infb-probe自5
′
端起第31位碱基t标记fam发光基团,第32位碱基t被四氢呋喃thf代替,第33位碱基t标记bhq1淬灭基团,3
′
端进行c3-spacer阻断修饰;
[0015]
修饰后的探针如下:
[0016]5′‑
atttctgagaaattcggtggtgatgttcaa(fam-dt)(thf)(bhq1-dt)gttcctgtttcagcg[c3-spacer]-3
′
;
[0017]
本发明另一个方面提供一种基于重组酶介导等温扩增方法检测猪格拉瑟氏菌的试剂盒;所述的试剂盒包含有上述的引物对和探针组合;
[0018]
所述的试剂盒还包含有重组酶介导等温扩增反应的试剂体系,以及荧光基础反应单元。
[0019]
其中,所述试剂体系具体包括反应缓冲液、去核酸酶水、醋酸镁;
[0020]
所述荧光基础反应单元具体包含单链dna结合蛋白、重组酶和聚合酶,所述荧光基础反应单元以冻干粉的形式存在。
[0021]
本发明还提供一种基于重组酶介导等温扩增方法检测猪格拉瑟氏菌的方法,所述的方法是使用上述的基于重组酶介导等温扩增方法检测猪格拉瑟氏菌的试剂盒进行检测;其一种方法的步骤如下:
[0022]
1)以常规方法提取待测样品dna;
[0023]
2)以提取的dna为模板,进行raa扩增,控制42℃下恒温扩增30min;
[0024]
3)结果判定,所述结果判定步骤是通过荧光定量检测仪或蓝光检测仪进行判断的;
[0025]
其中阴性对照无扩增曲线或可视化结果为无色,且阳性对照出现扩增曲线或可视化结果为绿色,则实验数据有效,否则实验结果为无效,需要重新检测;待检测样品无扩增曲线或可视化结果为无色,样品判为阴性;出现扩增曲线或可视化结果为绿色,样品判为阳性。
[0026]
本发明针对于猪格拉瑟氏菌设计了基于raa的引物对和探针,筛选出适宜于raa快速检测的上游引物、下游引物和探针。所述引物对和探针可以实现对猪格拉瑟氏菌的快速检测,具有简单快速、反应灵敏、特异性优的特点。
[0027]
本发明所提供的基于上述引物对和探针用于检测猪格拉瑟氏菌的raa试剂盒,只需在42℃恒温条件下反应30min即可完成,整个反应过程对仪器设备要求低,耗时短,操作简单,结果可实现肉眼可视化,更适用于基层现场诊断和即时检测(point of care testing,poct),真正意义上实现了便携式快速核酸检测,可为格拉瑟氏病的快速诊断、实时监测防控提供技术支持。
附图说明
[0028]
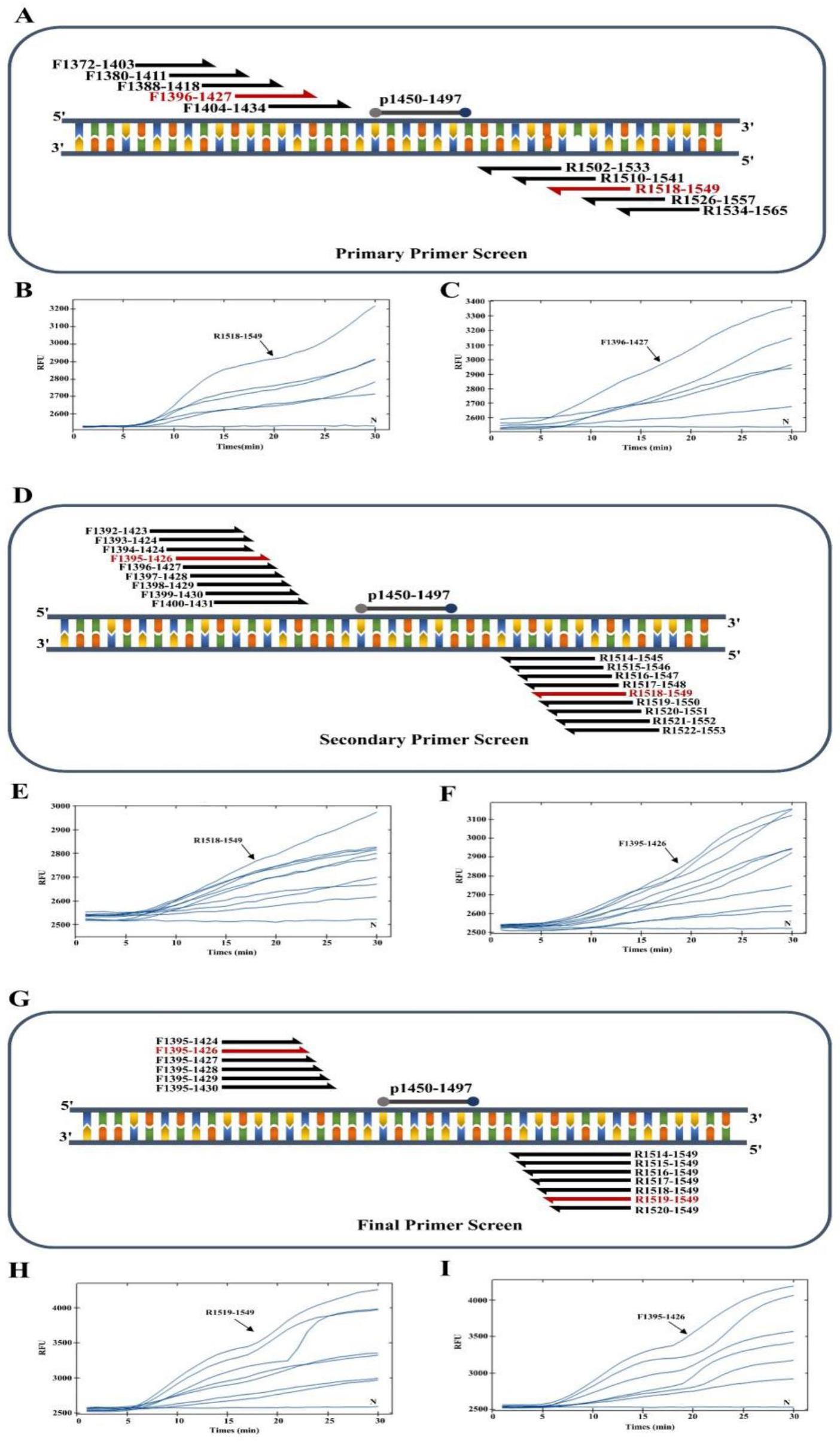
图1为本发明引物筛选的结果图;其中,图1中a是引物第一轮筛选模式图,图1中b是第一轮上游引物筛选结果图,图1中c是第一轮下游引物筛选结果图,图1中d是引物第一
轮筛选模式图,图1中e是第二轮上游引物筛选结果图,图1中f是第二轮下游引物筛选结果图,图1中g是引物第三轮筛选模式图,图1中h是第三轮上游引物筛选结果图,图1中i是第三轮下游引物筛选结果图。
[0029]
图2为本发明引物和探针的特异性检测结果图;其中,a是raa扩增结果,b是raa可视化的结果;管1:猪格拉瑟氏菌,管2:大肠杆菌,管3:鼠伤寒沙门氏菌,管4:猪链球菌,管5:金黄色葡萄球菌,管6:猪肺炎支原体,管7:肺炎克雷伯菌,管8:猪胸膜肺炎放线杆菌,管9:铜绿色假单胞菌,管10:阴性对照;
[0030]
图3为本发明引物和探针的灵敏性检测结果图;其中,a是qpcr扩增结果,b是raa扩增结果,c是raa可视化的结果;其中标准质粒gps-infb-peasy-blunt的浓度为1:106copies/2μl,2:105copies/2μl,3:104copies/2μl,4:103copies/2μl,5:102copies/2μl,6:101copies/2μl,7:100copies/2μl,8:阴性对照。
具体实施方式
[0031]
重组酶介导的等温扩增技术(recombinase-aided amplification,raa)是一种等温体外核酸扩增技术。该技术通过利用重组酶,单链结合蛋白(ssb)和dna聚合酶可以在37-42℃恒温条件下实现核酸的快速扩增,适用于临床现场的快速诊断,是一项在核酸检测领域具有推广应用前景的等温扩增技术。在恒温条件下,重组酶可以与特异性引物紧密结合形成聚合体从而对双链dna进行扫描,并在与引物互补的序列处使其解旋在ssb的作用下形成d环结构,防止双链dna的复性。同时在dna聚合酶的作用下,在引物和模板之间启动链置换反应形成新的dna互补链,通过对该过程的不断重复可以在30分钟内对目的片段进行指数扩增,最终实现核酸的高效扩增。raa等温扩增技术具有灵敏度高、特异性强、操作简单、不需要热循环仪器等优点。另外,由于fam是一种绿色荧光基团,其在蓝光下可以被激发出绿色荧光,因此可以结合便携式蓝光仪器对raa扩增产物进行可视化的判断,适用于资源有限的环境、基层和现场即时检测,在核酸快速检测方面具有巨大的应用前景。
[0032]
由于raa检测方法不需要复杂的热循环过程,扩增效率极高,然而不同的引物与模板的结合和扩增效率不同,对引物进行系统的筛选是raa检测方法建立过程中最为重要的一步,能够有效的避免非特异性的扩增进而提高检测的灵敏度。不仅如此,探针的设计对于raa检测方法也是至关重要的。在最合适的保守区域设计最适的探针是raa检测方法高特异性的保障,探针碱基错配会影响扩增效率,不合适的探针和引物组合也会导致背景值高,从而出现假阳性结果。在本发明中采用了系统的方法对引物和探针进行了严密的筛选和设计,从而确保本发明的实用性。
[0033]
本发明下述实施例中,所涉及到的实验方法如无特殊说明,均为常规方法。本发明下述实施例中,所述raa冻干酶粉包含单链dna结合蛋白、重组酶和聚合酶的冻干粉,购自潍坊安普未来生物科技有限公司。
[0034]
实施例1猪格拉瑟氏菌raa检测引物及探针的设计
[0035]
通过ncbi查找到309条公开的猪格拉瑟氏菌infb基因序列,利用mafft软件309株gpsinfb基因进行比对分析,根据infb基因的最为保守区域用snapgene软件设计raa的引物和探针。其中保守区域的选择需尽可能含有较少的重复序列和回文结构等。探针长度应为46-52个核甘酸,其中至少30个位于thf位点的5
′
端,另外至少15个位于其3
′
端。一个脱碱基
核苷酸类似物(四氢呋喃[thf]残基),一个侧翼dt-fam荧光团,在thf基团另一侧有一个相应的dt-bhq淬灭团,以及一个的3
′
c3-间臂修饰基团。探针设计完后需要对在ncbi重新进行特异性比对和验证,以免出现非特异性的交叉反应。
[0036]
raa引物的设计遵循以下基本原则:
[0037]
引物大小最小30bp,最大36bp;引物gc含量最小20%,最大70%;引物tm最小50,最大100;最大允许的单核苷酸重复长度设定为5;尽量避免引物直接形成发夹结构,或引物二聚体的形成等。为保证raa扩增的灵敏性,需要对引物进行三轮筛选,首先在选择合适的靶区域后,选择两组相向交错的寡核苷酸(即具有正向和反向)作为候选引物,分别包含五条上游引物和下游引物,固定某一条上游引物对所有下游引物进行筛选,然后将筛选出来的最优的下游引物固定对所有上游引物进行筛选,最终能筛选出一对最适引物。在获得了第一轮最适引物对后,将第一次筛选所得的最佳引物向前和向后以1个碱基的速度移动其在模板上的位置而得到一系列引物,然后按上述原则进行第二轮引物的筛选(图1)。最后将第二次筛选所得的最佳引物从3
′
末端逐一增减碱基而得到新的一系列引物,然后同样按照上述原则筛选这些引物,从而能获得灵敏性最佳的引物组合。
[0038]
最终筛选出的最适引物和探针序列如下表1所示:
[0039]
表1:引物和探针序列信息表
[0040][0041][0042]
实施例2猪格拉瑟氏菌raa反应体系的建立
[0043]
配制raa反应体系,反应体系的总量为25μl,具体包括如下组分:
[0044]
[0045]
在raa冻干酶粉中加入14.7μl的反应缓冲液a buffer(如20%peg缓冲液)、10pmol/μl gps-infb-f和gps-infb-r各1μl、10pmol/μlgps-infb-probe 0.3μl、去核酸酶水4.45μl、dna模板2μl,在反应管盖上加1.25μl醋酸镁b buffer,瞬离后充分混匀,恒温42℃反应30min。
[0046]
其中,阴性对照中的模板加入去核酸酶水,阳性对照中的模板为本实验室分离的猪格拉瑟氏菌的dna。
[0047]
将检测反应条件设置为:在42℃下恒温扩增30min。
[0048]
在本实施例中,可以使用天根生化科技有限公司的便携式tgreen monitor蓝光电泳监测仪(ose-470m)在暗室中直接进行肉眼判断,从而达到结果可视化的目的。
[0049]
质控标准:阴性对照无扩增曲线或可视化结果为无色,且阳性对照出现扩增曲线或可视化结果为绿色,则实验数据有效,否则实验结果为无效,需要重新检测。
[0050]
结果描述及判定:待检测样品无扩增曲线或可视化结果为无色,样品判为阴性;出现扩增曲线或可视化结果为绿色,样品判为阳性。
[0051]
实施例3猪格拉瑟氏菌raa特异性检测
[0052]
为了考察本发明方法的特异性,本实施例分别用猪格拉瑟氏菌、大肠杆菌、鼠伤寒沙门氏菌、猪链球菌、金黄色葡萄球菌、猪肺炎支原体、肺炎克雷伯菌、猪胸膜肺炎放线杆菌和铜绿色假单胞菌作为反应模板,并设置阴性对照,按照前述实施例2中加样方法进行raa核酸扩增。
[0053]
检测反应条件为:42℃恒温扩增30min,检测结果见图1所示。
[0054]
通过图1中a-b中的结果显示,除了猪格拉瑟氏菌dna对应的试验组出现了正常荧光检测曲线和可视化的绿色荧光结果,其他细菌及阴性对照组均未出现扩增曲线且可视化结果为无色。结果表明,本发明所使用的引物和探针可以实现对猪格拉瑟氏菌的特异性检测,不与其他相关细菌性病原发生交叉反应。特异性良好。
[0055]
实施例4引物探针的灵敏度检测
[0056]
为了检测本发明方法的灵敏度,分别使用10
6-100copies/反应gps-infb阳性质粒,按照前述实施例2加样方法进行raa核酸扩增。
[0057]
参照dna提取试剂说明书,提取gps的dna,扩增出gps-infb片段,胶回收后连接在peasy-blunt载体上,命为gps-infb-peasy-blunt。通过计算稀释至106copies/2μl,然后10倍分别稀释至105copies/2μl,104copies/2μl,103copies/2μl,102copies/2μl,101copies/2μl,100copies/2μl分别取2μl作为反应模板,并设置阴性对照,按照前述加样方法进行raa核酸扩增。同时用已发表文献(turni c,et al.2010)中的qpcr方法进行对比,检测结果见图2所示。
[0058]
通过图2中a-b中的结果显示,本发明设计的raa引物和探针组合能够保证检测时的灵敏性,根据实验结果,qpcr、raa和raa可视化检测方法灵敏性均可以达到100copies/2μl。通过spss软件对8次重复进行计算分析,其raa检测与qpcr检测方法灵敏度相当,为67copies/2μl,可视化的灵敏度为143copies/2μl。
[0059]
实施例5对实际样品的检测应用
[0060]
取临床组织病料样品共108份,按照dna提取试剂说明书分别提取待检的108份临床样品,提取的dna放在-20℃保存。
[0061]
按照前述实施例2中加样方法进行raa核酸扩增,同时用已发表文献(turni c,et al.2010)中的qpcr方法同时检测此临床样品进行对比,检测结果见下表2所示。
[0062]
结果显示,参与检测的108份临床样品raa检出阳性33份,qpcr检出阳性33份,可视化raa检出阳性31份。raa与qpcr的kappa值为1.0,p<0.001,可视化raa与qpcr的kappa值为0.956,p<0.001。
[0063]
表2:临床样品检测结果表
[0064][0065][0066]
可见,本发明中的方法可以实现对猪格拉瑟氏菌进行简单快速、灵敏、可视化的检测。该方法耗时短,操作简单,适合在资源有限的环境、基层和现场即时检测,可以真正实现便携式的快速核酸检测,为猪格拉瑟氏菌的早期诊断和实时监测提供技术支持。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。