1.本发明涉及生物医药领域,具体是一种重组质粒及乙肝病毒全基因组敲入小鼠模型的构建。
背景技术:
2.乙型肝炎病毒(hepatitis b virus,hbv)可造成乙型肝炎(简称乙肝),尽管随着乙肝疫苗接种持续推进,新发hbv感染已经大幅下降,但目前世界范围内仍存在大量hbv慢性感染者,hbv慢性感染极大增加了肝硬化、肝癌的风险,是危害公共健康的重要传染病之一。通过干扰素、核苷酸类似物等抗病毒治疗,慢性乙肝患者预后得到改善,但目前的治疗手段仍无法有效治愈慢性乙肝。
3.现有的多数与hbv相关的体外研究,比如,探讨hbv复制、转录调节和抗病毒机制等,都是通过将hbv dna重组质粒转染到肝癌细胞系(如hepg2和huh7细胞)来进行的。在体外可复制的hbv dna重组体至少要包含1.1倍以上的hbv基因组,由于hbv基因组的特殊结构,构建体外可复制重组体比较困难。文献报道,多数hbv体外重组体都需通过多步复杂的酶切连接过程对实验室标准病毒株进行片段置换而形成的,这些方法受制于hbv高度异质性,因此通用性较差,难以用于多样本的临床实验研究。
4.hbv是非致细胞病变病毒,其感染后导致地的急慢性肝炎通常认为是由宿主抗病毒免疫反应所引起的,建立能够密切模拟hbv自然感染史的动物模型对于理解宿主免疫系统与hbv相互作用的整个动态过程至关重要。
5.人类hbv具有高度宿主种属和组织特异性,自然条件下只能感染人、黑猩猩及树鼩。黑猩猩体积大、成本高及受伦理道德约束等限制了其应用,树鼩感染hbv是一过性的,感染后hbv滴度不高,且非近交系,不能作为常规实验动物。hbv相关病毒如土拨鼠hbv(whv)和鸭hbv(dhbv)也曾用于hbv相关研究,但这些模型与临床急慢性乙肝都存在较大差异,并非理想的hbv动物模型。
6.小鼠因遗传背景清楚且易于饲养,是构建hbv模型的最佳选择。近年来用于乙肝研究的小鼠模型取得一定进展,包括hbv转基因鼠,高压尾静脉注射裸hbv dna小鼠模型,腺病毒或腺相关病毒载体递送hbv基因组小鼠模型及人-鼠嵌合肝模型等。
7.经chisari等人的工作,将1.3倍hbv基因组插入到小鼠基因组构建出了高复制通量的hbv转基因小鼠。基于hbv转基因鼠模型,阐明了hbv并非通过直接致细胞病变作用导致宿主肝细胞损伤,而是hbv引起的免疫应答在介导病毒清除的同时,还导致了宿主肝细胞损伤。此外,hbv转基因鼠可持续产生高滴度病毒颗粒,该模型在抗病毒药物评估等方面发挥了重要作用。但该转基因鼠其hbv基因组的表达不可人为调控,在乳鼠阶段就开始有hbv的复制,导致了该转基因模型对hbv抗原免疫耐受,因而很大程度上不适合用于研究hbv的适应性免疫应答。
8.高压注射模型即在短时间内将大体积含有裸hbv dna的液体通过尾静脉注射输入小鼠体内。该模型可以进行hbv的复制,可部分用于宿主对hbv免疫应答过程的研究,例如基
于该模型表明了除cd8 ctl外,cd4 t细胞在hbv清除过程中也发挥重要角色。但高压注射将导致肝脏应激损伤,且hbv在高压尾静脉小鼠模型清除较快,通常只能模拟hbv的急性感染,因而不适合用于慢性乙肝的研究。近年来,报道了经腺病毒载体转导hbv基因组的小鼠模型,该模型中hbv可持续存在3个月以上,一定程度上模拟了hbv的慢性感染状态,但对于研究宿主对hbv免疫过程,腺病毒载体本身引起的免疫反应不容忽视。
9.嵌合肝模型基于3个方面:小鼠自身肝细胞被破坏,没有免疫排斥反应,移植人源肝细胞。小鼠自身肝细胞破坏可通过转入upa或fah敲除等途径达到,通过重组酶敲除等方式造成小鼠免疫缺陷则可避免移植排斥反应。该模型产生的hbv病毒颗粒可继续感染肝细胞,并且可以形成cccdna。因此适用于评估靶向cccdna的抗病毒药物。但人源肝细胞来源困难,成本较高,且该模型通常是免疫缺陷的,不利于饲养也不利于研究宿主抗病毒免疫过程。
10.因此为了更加准确地解析乙肝病毒感染自然史各期宿主免疫全景以开发治愈慢乙肝免疫治疗手段,构建能够密切模拟hbv感染自然史的小鼠模型至关重要。
技术实现要素:
11.本发明提供一种hbv全基因组1.3倍体重组质粒和具备正常免疫能力的乙肝病毒全基因组敲入小鼠模型,可用于急慢性乙肝抗病毒固有免疫及适应性免疫应答机制的研究,以及用于开发和评估治愈乙肝的药物及疫苗等应用研究。
12.为达此目的,本发明提供如下的技术方案:
13.本发明的第一个方面,提供了一种hbv全基因组1.3倍体重组质粒,所述重组质粒的核苷酸序列为seq id no.10。
14.由于现有技术中多数hbv体外重组体都需通过多步复杂的酶切连接过程对实验室标准病毒株进行片段置换而形成的,这些方法受制于hbv高度异质性,因此通用性较差,难以用于多样本的临床实验研究。而本技术提供的重组质粒具有hbv全基因组1.3倍体,不仅在体外可复制,还可用于筛选hbv耐药位点、研究hbv耐药机制、构建hbv小鼠模型等。
15.本发明的第二个方面,提供本发明所述的hbv全基因组1.3倍体重组质粒在筛选hbv耐药位点、研究hbv耐药机制、构建hbv小鼠模型中的应用。
16.本发明的第三个方面,提供了本发明所述的hbv全基因组1.3倍体重组质粒的制备方法,包括以下步骤:
17.s1、在hbv基因组nt202与nt203位点之间引入lsl表达盒,所述lsl表达盒包含三个终止信号bgh polya、sv40 polya和tk polya,所述lsl表达盒子的核苷酸序列两端为loxp;
18.s2、在lsl表达盒第一个loxp与终止信号位点之间进一步引入hdv genomic ribozyme-mirna122 target-hdv antigenomic ribozyme序列,其中,所述mirna122 target为5个重复;
19.s3、在lsl表达盒两侧分别添加来自pci-neo载体的5’端内含子和3’端内含子。
20.优选的,所述pci-neo载体的5’端内含子的核苷酸序列为seq id no.1。
21.优选的,所述pci-neo载体的3’端内含子的核苷酸序列为seq id no.2。
22.优选的,所述loxp的核苷酸序列为seq id no.3。
23.优选的,所述mirna122 target的核苷酸序列为seq id no.4。
24.优选的,所述hdv genomic ribozyme的核苷酸序列为seq id no.5。
25.优选的,所述hdv antigenomic ribozyme的核苷酸序列为seq id no.6。
26.优选的,所述bgh polya的核苷酸序列为seq id no.7。
27.优选的,所述sv40 polya的核苷酸序列为seq id no.8。
28.优选的,所述tk polya核苷酸序列为seq id no.9。
29.在本发明中,所述hbv全基因组在nt202与nt203之间插入“5’intron-loxp-hdv genomic ribozyme-mirna122 target-hdv antigenomic ribozyme-bgh polya-sv40 polya-tk polya-loxp-3’intron”对hbv基因组进行改造编辑;所述hdv基因组核酶和反基因组核酶(hdv genomic ribozyme,hdv antigenomic ribozyme)具有特异位点依赖性的rna自我切割活性,有效避免了非他莫西芬诱导的不成熟hbv mrna造成的hbcag、hbeag表达。
30.在本发明中,所述微小rna122靶标(mirna122 target)可通过和靶基因mrna碱基配对引导沉默复合体(risc)降解mrna或阻碍其翻译,有效避免了非他莫西芬诱导的不成熟hbv mrna造成的hbcag、hbeag表达。
31.在本发明中,所述内含子(5’intron,3’intron)的引入使得前体hbv mrna中“5’intron-loxp-3’intron”被剪切,因此成熟hbv mrna可无缝重组。
32.本发明的第四个方面,提供了一种具备正常免疫能力的乙肝病毒全基因组敲入小鼠模型的构建方法,包括以下步骤:
33.r1、获取权利要求1所述的hbv全基因组1.3倍体重组质粒;
34.r2、将hbv全基因组1.3倍体重组质粒通过同源重组的方法敲入小鼠;
35.r3、将步骤r2获得的小鼠与albcreert2小鼠配繁获得双转基因小鼠。
36.优选的,步骤r1包括本发明提供的hbv全基因组1.3倍体重组质粒的制备方法。
37.优选的,hbv全基因组1.3倍体重组质粒的制备方法,包括以下步骤:
38.s1、在hbv基因组nt202与nt203位点之间引入lsl表达盒,所述lsl表达盒包含三个终止信号bgh polya、sv40 polya和tk polya,所述lsl表达盒子的核苷酸序列两端为loxp;
39.s2、在lsl表达盒第一个loxp与终止信号位点之间进一步引入hdv genomic ribozyme-mirna122 target-hdv antigenomic ribozyme序列,其中,所述mirna122 target为5个重复;
40.s3、在lsl表达盒两侧分别添加来自pci-neo载体的5’端内含子和3’端内含子。
41.优选的,所述pci-neo载体的5’端内含子的核苷酸序列为seq id no.1。
42.优选的,所述pci-neo载体的3’端内含子的核苷酸序列为seq id no.2。
43.优选的,所述loxp的核苷酸序列为seq id no.3。
44.优选的,所述mirna122 target的核苷酸序列为seq id no.4。
45.优选的,所述hdv genomic ribozyme的核苷酸序列为seq id no.5。
46.优选的,所述hdv antigenomic ribozyme的核苷酸序列为seq id no.6。
47.优选的,所述bgh polya的核苷酸序列为seq id no.7。
48.优选的,所述sv40 polya的核苷酸序列为seq id no.8。
49.优选的,所述tk polya核苷酸序列为seq id no.9。
50.本发明的第五个方面,提供了一种小鼠hbv感染模型的构建方法,包括以下步骤:
向本发明的方法获得的双转基因小鼠模型施加hbv基因表达诱导剂。
51.优选的,所述hbv基因表达诱导剂包括他莫西芬。
52.优选的,婴幼期的双转基因小鼠单次或短时间多次注射hbv基因表达诱导剂,可建立hbv中枢免疫耐受模型。
53.优选的,成年期的双转基因小鼠单次或短时间多次注射hbv基因表达诱导剂,可建立急性hbv感染模型。进一步优选的,hbv基因表达诱导剂为他莫西芬注射剂,175mg/kg腹腔注射,每48小时一次,总计3次。
54.优选的,成年期的双转基因小鼠持续注射hbv基因表达诱导剂,可首先建立急性感染,随着免疫系统耗竭进而建立慢性hbv感染模型。进一步优选的,hbv基因表达诱导剂为他莫西芬注射剂,首剂175mg/kg,每48小时一次,总计3次;维持剂量120mg/kg,每6天一次。
55.优选的,所述婴幼期的小鼠为10天-4周龄小鼠。
56.优选的,所述成年期小鼠为6周-8周龄小鼠。
57.在本发明中,建立急慢性hbv感染模型可以用于宿主抗病毒免疫机制的相关研究。可以为开发和评估治愈乙肝新型药物提供新的平台。
58.与现有技术相比,本发明有益效果及显著进步在于:
59.1、本发明提供了一种hbv全基因组1.3倍体重组质粒,受cre严格调控,可用于筛选hbv耐药位点、研究hbv耐药机制、构建hbv小鼠模型等。
60.2、本发明建立了一种具备正常免疫能力的乙肝病毒全基因组敲入小鼠模型,该小鼠与albcreer
t2
配繁得到双转基因小鼠,通过调整他莫西芬给药方案以及受试双转基因小鼠年龄,可模拟hbv感染自然史的不同阶段。因此该模型可用于急性感染宿主免疫系统如何清除hbv以及慢性感染hbv如何导致宿主免疫系统耐受与耗竭等问题的基础研究,亦可以用于开发和评估治愈乙肝新型药物的应用研究。总之,该模型的建立为解析乙肝病毒感染自然史各期宿主免疫全景以开发治愈乙肝免疫治疗手段打下了坚实的基础。
附图说明
61.为更清楚地说明本发明的技术方案,下面将对本发明的实施例所需使用的附图作一简单介绍。
62.显而易见地,下面描述中的附图仅是本发明中的部分实施例的附图,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图,但这些其他的附图同样属于本发明实施例所需使用的附图之内。
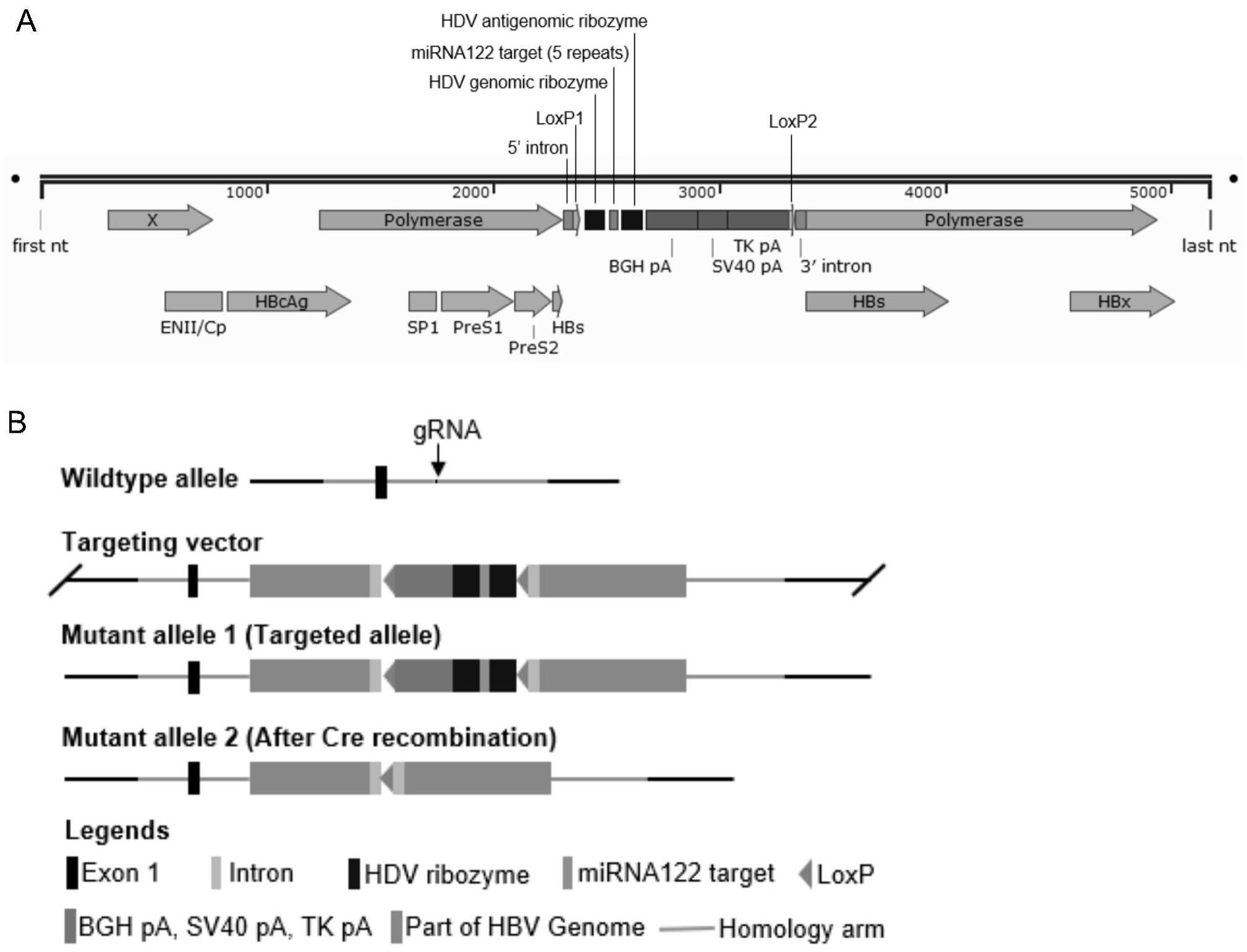
63.图1a为本发明实施例1中hbv全基因组1.3倍体重组质粒的示意图;
64.图1b为本发明实施例1中grna介导hbv基因组插入到宿主基因组的示意图;
65.图2a为本发明实施例3中southern blot鉴定酶切位点示意图;
66.图2b为本发明实施例3中southern blot确认敲入片段的插入;
67.图2c为本发明实施例3中pcr鉴定引物靶向区段示意图;
68.图2d为本发明实施例3中pcr鉴定结果图;
69.图3a为本发明实施例4中4周与8周hbv基因组单转基因小鼠及hbv基因组和albcreert2双转基因小鼠通过elisa检测血清中hbsag和hbeag;
70.图3b为本发明实施例4中10天龄(左)及6周龄(右)双转基因小鼠经他莫西芬诱导
后通过elisa检测血清中hbsa和hbeag;
71.图4为本发明实施例4中乙肝病毒全基因组敲入小鼠通过调整他莫西芬给药方案及受试小鼠年龄以模拟hbv感染自然史的不同阶段示意图。
具体实施方式
72.为使本发明实施例的目的、技术方案、有益效果及显著进步更加清楚,下面,将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。
73.显然,所有描述的这些实施例仅是本发明的部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
74.需要理解的是:
75.对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
76.还需要说明的是,以下的具体实施例可以相互结合,对于其中相同或相似的概念或过程可能在某些实施例中不再赘述。
77.下面,以具体的实施例对本发明的技术方案进行详细说明。
78.实施例1hbv基因组改造
79.按照如图1a所示的方法对hbv基因组进行改造。
80.1.1、首先在hbv基因组nt202与nt203位点之间引入loxp-stop-loxp(lsl)表达盒,lsl表达盒包含三个终止信号(bgh polya,sv40 polya,tk polya序列如下),序列两端为loxp(loxp序列如下)。因lsl表达盒上游已包含完整hbv核心抗原和e抗原(hbcag,hbeag)开放阅读框,非完整转录的残缺hbv转录本将导致非cre依赖的hbcag和hbeag表达;
81.1.2、在lsl表达盒第一个loxp与stop位点之间进一步引入“hdv genomic ribozyme-mirna122 target-hdv antigenomic ribozyme”序列,使得残缺hbv转录本与bgh polya、sv40 polya、tk polya等三个终止信号分割而被组织细胞降解以限制非cre依赖的hbcag和hbeag表达;因为,野生型丁肝病毒核酶(hdv genomic ribozyme,hdv antigenomic ribozyme,序列如下)具有特异位点依赖性的rna自我切割活性,通常认为其活性核心结构域为85nt,但有研究表明其侧翼序列可能影响其催化活性,因此,本研究使用126nt的基因组核酶序列及129nt的反基因组核酶序列。微小rna122(mirna122)分子在肝组织极为丰富,可通过和靶基因mrna形成互补配对而引导沉默复合体(risc)降解mrna或阻碍其翻译,因此,本研究将5个重复mirna122靶基因序列共计35nt置于两个核酶序列之间。
82.1.3、在lsl表达盒两侧分别添加来自pci-neo载体(promega)的5’端内含子和3’端内含子(5’intron,3’intron序列如下),通过内含子带来的转录后剪接效应,最终成熟hbv mrna可无缝重组。
83.总而言之,本发明在hbv基因组nt202与nt203之间插入“5’intron
–
loxp-hdv genomic ribozyme-mirna122 target-hdv antigenomic ribozyme-bgh polya-sv40 polya-tk polya-loxp-3’intron”对1.3倍的hbv基因组进行改造编辑。改造后的hbv全基因组1.3倍体重组质粒的核苷酸序列为seq id no.10。上述序列如下表1所示。
84.表1
85.86.87.88.[0089][0090]
实施例2乙肝病毒全基因组敲入小鼠模型的构建
[0091]
2.1、向小鼠受精卵显微注射实施例1的预先改造修饰的hbv全基因组1.3倍体重组质粒(seq id no.10),利用crispr-cas9的方法,通过grna引导使该hbv基因组反向插入到位于6号染色体rosa26位点的第一个内含子,具体操作原理见图1b。为了构建靶向载体,使用来自c57bl/6文库的bac克隆作为模板,通过pcr生成同源臂。将cas9 mrna和grna将与靶向载体共注射到受精卵中(grna序列为seq id no.11、seq id no.12),产生基因敲入小鼠。以上操作委托广州赛业生物科技有限公司完成。
[0092]
表2
[0093]
编号名称碱基序列seqidno.11grna15
’‑
ggcaggcttaaaggctaacctgg-3’seqidno.12grna25
’‑
ctccagtctttctagaagatggg-3’[0094]
实施例3基因层面验证小鼠
[0095]
本实施例是对实施例2制备的具备正常免疫能力的乙肝病毒全基因组敲入小鼠进行验证。对构建的乙肝病毒全基因组敲入小鼠在基因层面上用southern blot和pcr的方法对靶向序列插入进行了验证。
[0096]
实验分组:正常野生小鼠(wt)、实施例2制备的具备正常免疫能力的乙肝病毒全基因组敲入小鼠(mt)。
[0097]
实验方法:
[0098]
southern blot方法及结果
[0099]
3.1、制备待测dna获得wt组小鼠和mt组小鼠的基因组dna。采用适当的化学试剂裂解细胞,用蛋白酶和rna酶消化大部分蛋白质和rna;用有机试剂(酚/氯仿)抽提方法去除蛋白质。
[0100]
制备southern blot探针。取步骤3.1获得的wt组小鼠dna利用如下southern blot引物,分别进行pcr扩增,获得可与待检测dna样品形成碱基互补配对的5’端和3’杂交片段,将该片段分别克隆至puc19载体(含t7体外转录启动子),使用罗氏体外转录探针制备试剂
盒(cat.no.12039672910)进行体外转录及地高辛标记,分装探针-80℃保存备用。
[0101]
其中,southern blot引物序列如下:
[0102]
primers for 5’probe:
[0103]5’
probe forward primer(seq id no.13):5
’‑
aaacgtggagtaggcaatacccagg-3’[0104]5’
probe reverse primer(seq id no.14):5
’‑
aaagaagggtcacctcagtctccct-3’[0105]
primers for 3’probe:
[0106]3’
probe forward primer(seq id no.15):5
’‑
ttctgggcaggcttaaaggctaac-3’[0107]3’
probe reverse primer(seq id no.16):5
’‑
aggagcgggagaaatggatatgaag-3’[0108]
3.2、通过bsu36i限制性内切酶剪切。取步骤3.1获得的样品dna溶液,加入0.5ml的eppendorf管中,加2μl 10
×
限制性内切酶缓冲液,6~10个u的相应限制性内切酶,加消毒双蒸水至总体积20μl,于37℃保温酶解2小时,在65℃加热5分钟或用适量的0.5mol/l edtana2终止反应。
[0109]
结果如图2a所示,wt小鼠可获得4.48kb,mt小鼠可获得大小为6.52kb大小的片段。
[0110]
3.3、琼脂糖凝胶电泳分离dna样品。取步骤3.2获得的dna酶解液2μl加上样缓冲液10μl(含溴酚蓝指示剂和甘油),在0.8%琼脂糖(含0.5μg/ml溴化乙锭)凝胶进行水平电泳,电压《5v/cm,时间2小时左右。
[0111]
将经电泳分离的dna样品碱变性后转移至固相支持物(尼龙膜)。电泳完毕的琼脂糖凝胶于碱性变性液(0.5m naoh,1.5m nacl)中变性45min,双蒸水润洗3遍,中和液(1mtris-hcl,1.5m nacl,ph7.4)处理45min,按照下行毛细管转移法安装好转移系统,转膜8小时作用。
[0112]
固定于膜上的dna与地高辛标记探针退火杂交。将上述获得的含样品dna的尼龙膜80℃烘烤2小时后放置于杂交管,加入5ml杂交液42℃预杂交30分钟,再向其加入上述制备的southern blot探针(探针加入前65℃变性10分钟后立即冰浴5分钟),杂交8小时左右。
[0113]
膜与碱性磷酸酶标记的地高辛抗体孵育。弃去上述杂交管中的杂交液,加入低严谨洗液25℃洗涤5分钟,重复一次,再加入高严谨洗液68℃洗涤15分钟,重复一次,加入封闭液25℃封闭1小时,然后加入地高辛抗体25℃孵育30分钟。
[0114]
加入碱性磷酸酶底物显色。弃去上述杂交管中的抗体孵育缓冲液,加入洗涤缓冲液25℃洗涤15分钟,重复一次,再加入检测缓冲液洗涤5min,重复一次,将膜取出后置于油纸,滴加发光液显影检测。
[0115]
结果如图2b左图所示,图中wt表示wt小鼠组,9和13表示mt小鼠组。mt小鼠可获得6.52kb和4.48kb两种片段,而wt鼠则仅有4.48kb大小的片段。
[0116]
3.4、采用步骤3.2和3.3相同的方法,用另一限制性内切酶econi进行southern blot实验。
[0117]
结果如图2b右图所示,图中wt表示wt小鼠组,9和13表示mt小鼠组。mt小鼠可获得8.99kb和3.80kb两种片段,而wt鼠则仅有3.80kb大小的片段。
[0118]
pcr方法
[0119]
3.5、制备待测dna,采用步骤3.1的方法获得wt组小鼠和mt组小鼠的基因组dna。
[0120]
3.6、设计primes1和primes2两对特异性pcr引物,如图2c所示,primes1和primes2两对引物都分别包含与插入序列和非插入序列配对片段。
sv40 polya-tk polya-loxp”将被切除,残留一侧loxp序列。前体hbv mrna中的“5’intron-loxp-3’intron”序列经转录后剪接而被切除,因此hbv相关抗原得以诱导调控表达。
[0137]
通过elisa检测分析,单次剂量他莫西芬可诱导双转基因乳鼠模拟慢性hbv感染,在小鼠6周龄时血清hbsag达到峰值(约540iu/ml),而血清hbeag水平一直在10peiu/ml上下浮动,hbsag及hbeag持续存在时间超过9周;短程剂量他莫西芬可诱导双转基因成年小鼠模拟急性hbv感染,在注射后3天血清hbsag达到峰值(约160iu/ml),持续存在时间约2周;在注射后9天血清hbeag达到峰值(约5peiu/ml),持续存在时间超过18天。因此,本发明成功获得了1.3倍hbv基因组敲入小鼠,该小鼠与albcreert2配繁得到的双转基因小鼠,不存在非他莫西芬诱导的抗原表达,且经他莫西芬可诱导可模拟急慢性hbv感染。
[0138]
此外,如图4所示,通过调整他莫西芬给药方案以及受试小鼠年龄,可模拟hbv感染自然史的不同阶段。因此,我们设计并构建的具备正常能力的乙肝病毒全基因组敲入小鼠可以作为研究急慢性hbv感染中病毒动力学和宿主抗病毒免疫机制的重要工具,同时可为开发和评估治愈乙肝新型药物提供新的有效平台。
[0139]
综上所述,本发明设计了1.3倍hbv基因组敲入小鼠,该小鼠与albcreert2配繁得到双转基因小鼠,在该模型小鼠中hbv基因表达是他莫西芬依赖的,因此和常规hbv转基因小鼠相比本发明设计的乙肝小鼠模型并非天然针对hbv抗原免疫耐受。在本发明中对1.3倍hbv基因组进行改造编辑,通过引入mirna122靶标和hdv核酶等功能元件,有效避免了非他莫西芬诱导的不成熟hbv mrna造成的hbcag、hbeag表达。
[0140]
在上述说明书的描述过程中:
[0141]
术语“本实施例”、“本发明实施例”、“如
……
所示”、“进一步的”、“进一步改进的技术分方案”等的描述,意指该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中;在本说明书中,对上述术语的示意性表述不是必须针对相同的实施例或示例,而且,描述的具体特征、结构、材料或者特点等可以在任意一个或者多个实施例或示例中以合适的方式结合或组合;此外,在不产生矛盾的前提下,本领域的普通技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合或组合。
[0142]
最后应说明的是:
[0143]
以上各实施例仅用以说明本发明的技术方案,而非是对其的限制;
[0144]
尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换,而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,本领域技术人员根据本说明书内容所做出的非本质改进和调整或者替换,均属本发明所要求保护的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。