1.本发明涉及基因测序技术领域,具体为一种高通量测序检测肺癌基因变异的文库构建方法。
背景技术:
2.数据显示,2015年中国癌症新发病例392.9万例,死亡病例233.8万例,其中肺癌的发病率78.7万例和死亡率63.1万例,高居所有癌症之首。非小细胞肺癌(nsclc)是肺癌的主(常)要(见)病理亚型,约占85%,主要包括肺腺癌、肺鳞癌和大细胞癌。
3.近十年来,随着nsclc靶向治疗及免疫治疗的飞速发展,晚期nsclc的5年生存率已从不足5%,提高至16%。同时也涌现出越来越多的分子标志物(如egfr,ret,ntrk等),基于基因或基因组学的分子分型将逐步超越传统的病理组织形态学分型,成为临床肿瘤精准诊疗的关键环节,尤其在2021年4月,《非小细胞肺癌分子病理检测临床实践指南(2021版)》基于国内临床实践数据和国内已上市治疗药物等为导向,制定出更符合中国国情的nsclc分子病理检测临床实践指南,详细罗列了相关分子标志物的突变频率及检测建议:egfr突变频率45%~55%,alk重排/融合变异频率5%~10%,ros1重排/融合变异频率2%~3%,met ex14跳读突变频率2%~4%(上述为必检基因),met扩增变异频率3%~19%,her2突变频率2%~4%,braf v600突变频率1%~2%,ret重排/融合变异频率1%~4%,kras突变频率8%~10%,ntrk1/2/3重排/融合变异频率均<1%等(上述为扩展基因)。此外nccn指南以及cosmic肺癌分子靶标数据库等研究显示pik3ca,nras,akt1,c-kit等具有明确分子靶标意义的基因突变,在nsclc精准诊疗过程中也具有重要临床意义。
4.nsclc临床常用的分子病理检测方法包括sanger测序法,rt-pcr法,fish法,ihc法和ngs法(高通量测序法),相较于前面传统检测方法,ngs法可同时对多个靶点基因的突变、重排和扩增进行检测,从而有效地避免样本浪费、节约检测时间,并相对地降低检测费用,因此,初治患者可使用ngs法对nsclc的所有必检和扩展分子靶点进行检测,对于耐药的患者也推荐ngs法,以全面查找耐药原因。目前针对癌症多通路多靶标的ngs检测方法主要有两条路线:多重pcr扩增捕获和探针杂交捕获。针对少量基因及热点基因突变的检测往往推荐多重pcr扩增捕获法,但受多重引物设计的复杂性,目前无法完全一次性覆盖肺癌所有靶标位点的检测或需分多管多批次的捕获检测,大大增加了检测的复杂性及成本,此外目前基于dna水平进行基因重排/融合检测的灵敏度及特异性不够,也还需进一步开发完善dna rna联合检测的多重扩增捕获方法。
技术实现要素:
5.本发明的目的在于提供一种高通量测序检测肺癌基因变异的文库构建方法,该方法可以通过检测石蜡包埋组织或石蜡切片,新鲜病理组织,血浆、胸水、腹水、脑脊液等样本,一次性全面捕获nsclc相关的16个具有明确分子靶标意义的基因突变信息(点突变,短片段插入缺失,拷贝数变异和融合基因),尤其针对融合基因突变检测,基于dna rna联合检
id no.28,下游引物的序列为seq id no.29~seq id no.30;
22.针对c-kit基因设计的dna扩增引物,其中上游引物的序列为seq id no.31~seq id no.34,下游引物的序列为seq id no.35~seq id no.38;
23.针对egfr基因设计的dna扩增引物,其中上游引物的序列为seq id no.39~seq id no.42,下游引物的序列为seq id no.43~seq id no.46;
24.针对met基因设计的dna扩增引物,其中上游引物的序列为seq id no.47~seq id no.50,下游引物的序列为seq id no.51~seq id no.54;
25.针对braf基因设计的dna扩增引物,其中上游引物的序列为seq id no.55,下游引物的序列为seq id no.56;
26.针对ntrk1基因、ntrk2基因、ntrk3基因设计的dna扩增引物,其中上游引物的序列为seq id no.57~seq id no.61,下游引物的序列为seq id no.62~seq id no.66;
27.针对alk基因、ros1基因、ret基因设计的dna扩增引物,其中上游引物的序列为seq id no.67~seq id no.83,下游引物的序列为seq id no.84~seq id no.94。
28.dna扩增引物组具体如下表格所示:
29.30.[0031][0032]
较优化的方案,步骤(1)中,rna扩增引物组包括:
[0033]
针对ntrk1基因、ntrk2基因、ntrk3基因设计的rna扩增引物,其中上游引物的序列为seq id no.95~seq id no.103,下游引物的序列为seq id no.104~seq id no.111;
[0034]
针对alk基因、ros1基因、ret基因设计的rna扩增引物,其中上游引物的序列为seq id no.112~seq id no.141,下游引物的序列为seq id no.142~seq id no.154。
[0035]
rna扩增引物组具体如下表格所示:
[0036]
[0037]
[0038][0039]
较优化的方案,步骤(3)中,二轮pcr扩增时采用二轮上游引物和二轮下游引物,其中二轮上游引物的序列为seq id no.155,二轮下游引物的序列为seq id no.156。
[0040]
本发明中二轮上游引物和二轮下游引物是参照mgiseq2000测序平台的通用扩增引物进行设计,实际也可以根据其他测序平台的测序序列设计对应平台的扩增体系引物。二轮pcr扩增引物的引物结构为:上游引物为通用引物:从5’端到3’端均依次为,测序引物序列 接头序列,碱基序列为gaacgacatggctacgatccgact;下游引物为引入index标签,从5’端到3’端均依次为,测序引物序列 10个已知固定碱基(index) 接头序列。
[0041]
二轮pcr扩增引物体系中的接头序列与一轮pcr扩增引物上下游引物中的接头序列互补,同时10个已知固定碱基(index)序列,是作为测序标签序列,用于混合测序时样品间的区分,index标签序列以mgiseq2000测序平台序列的atcggaccta为例,具体二轮上游引物和二轮下游引物如下表所示:
[0042]
序列号引物名称引物序列(5
’→3’
)seq id no.1552pcr primer f(上游引物)gaacgacatggctacgatccgactseq id no.1562pcr primer r(下游引物)tgtgagccaaggagttgatcggacctattgtcttcctaagaccgcttggcc
[0043]
较优化的方案,步骤(3)中,dna扩增捕获时采用30μl的pcr反应体系,该pcr反应体系包括以下组分:8μl的dna扩增引物组混合物,12μl的样品dna,10μl的3x酶混合物;
[0044]
dna扩增捕获程序为:95℃,3min,95℃,30sec,60℃,4min,20个循环,72℃,4min。
[0045]
较优化的方案,步骤(3)中,rna扩增捕获时采用30μl的pcr反应体系,该pcr反应体系包括以下组分:10μl的rna扩增引物组混合物,10μl的样品rna逆转录产物,10μl的3x酶混合物,2μ l的无核酸水;
[0046]
rna扩增捕获程序为:95℃,3min,95℃,30sec,56℃,4min,20个循环,72℃,4min。
[0047]
较优化的方案,步骤(4)中,二轮pcr扩增体系包括以下组分:30μl的混合捕获产物,17μl的3x酶混合物,1.25μl的二轮上游引物、1.25μl的二轮下游引物。
[0048]
较优化的方案,步骤(4)中,二轮pcr扩增程序为:95℃,3min,95℃,15sec,58℃,15sec,72℃,30sec,10个循环,72℃,4min。
[0049]
较优化的方案,步骤(3)中,片段分选纯化步骤为:
[0050]
s1:取磁珠,室温平衡30~40min,加入浓度为75%的乙醇溶液,混匀,得到纯化磁珠;
[0051]
s2:取dna捕获产物或rna捕获产物,与纯化磁珠混合,室温孵育5min,离心后置于磁力架上,分离5~6min,待溶液澄清后移除上清;
[0052]
s3:加入新鲜的浓度为75%乙醇,漂洗磁珠,室温孵育30sec,移除上清;
[0053]
s4:重复s3步骤2~3次,空气干燥0~5min,取下,加入双蒸水,吹打混匀重悬磁珠,得到带磁珠的重悬dna捕获产物或带磁珠的重悬rna捕获产物。
[0054]
较优化的方案,步骤(3)中,片段纯化分选时,dna捕获产物与纯化磁珠的体积比为1∶1.5;rna捕获产物与纯化磁珠的体积比为1∶1。
[0055]
较优化的方案,一种用于高通量测序检测肺癌基因变异的检测试剂盒,所述检测
试剂盒根据以上任一项所述的方法检测肺癌基因变异情况。
[0056]
较优化的方案,所述检测试剂盒包括提取试剂盒模块、扩增捕获试剂盒模块、接头测序试剂盒模块、阳性质控品和阴性质控品;
[0057]
其中提取试剂盒模块用于提取样品dna和样品rna;扩增捕获试剂盒模块用于一轮pcr扩增捕获,纯化后得到dna捕获产物和rna捕获产物;接头测序试剂盒模块用于二轮pcr扩增引入标签序列,可根据对应的测序平台选择测序引物和接头试剂。
[0058]
本发明提供一种用于检测肺癌分子靶向用药指导试剂盒,一次性全面捕获nsclc相关的16个具有明确分子靶标意义的基因突变信息(点突变,短片段插入缺失,拷贝数变异和融合基因),总共536个热点突变。从而辅助临床医生制定个体化用药方案,使精准治疗达到最好效果。
[0059]
与现有技术相比,本发明所达到的有益效果是:
[0060]
(1)本发明适用于石蜡包埋组织或石蜡切片、新鲜病理组织、血浆、胸水、腹水、脑脊液等多种样本类型,起始建库量可低至5ng,相对杂交捕获法,样品要求大大降低,提高了临床检测使用的便捷性,检测时首先一轮pcr扩增引物分别针对dna和rna进行目标区域扩增捕获,捕获产物之后合并为一管,之后基于二轮pcr扩增引物扩增,完成测序序列及样品标签(index)的添加并进一步完成文库构建。
[0061]
(2)整个操作流程基于单管建库流程,大部分操作为pcr扩增,手动操作较少,仅约30min左右,大大降低了实验操作的复杂性以及减少捕获模板间的不均一性,从而提高相关突变检测的稳定性及灵敏度。
[0062]
(3)本发明一次性全面捕获nsclc相关的16个具有明确分子靶标意义的基因突变信息(点突变,短片段插入缺失,拷贝数变异和融合基因),相对以往类似检测产品,检测基因及位点更加全面,不给患者遗漏漏检的一丝机会。
[0063]
(4)本发明尤其针对融合基因突变检测,不同于传统只设计rna或dna捕获引物,本发明基于dna和rna联合检测进行设计,分别针对目标基因alk、ros1、ret、ntrk1、ntrk2、ntrk3的热点突变均设计pcr1捕获引物,可有效提高相关融合突变检出概率,使精准治疗达到最好效果。
附图说明
[0064]
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
[0065]
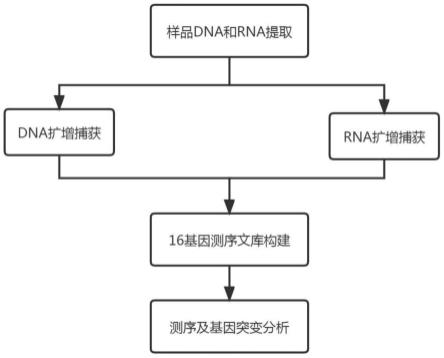
图1是本发明的文库构建流程图。
具体实施方式
[0066]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0067]
实施例:
[0068]
以下结合l例已知突变(egfr p.e746_a750del&eml4-alk融合双突变)的肺癌石蜡
包埋病例组织进行16基因mgiseq2000平台(bgi)测序检测为具体实施例,具体操作过程如下:
[0069]
1、dna&rna提取:
[0070]
取1例测试石蜡包埋病理组织10~20片组织切片,按照magmax
tm
ffpe dna/rna ultra试剂盒(thermofisher)说明书,对石蜡包埋病理组织样品进行dan和rna提取,之后采用qubit定量(thermofisher),dna总量至少大于5ng;rna总量至少大于50ng。
[0071]
2、dna和rna扩增捕获(一轮pcr扩增):
[0072]
2.1、rna逆转录:取样品rna,利用rna逆转录酶试剂盒(takara),于无菌0.2ml pcr管中进行操作,反应时总反应体系为10μl,包括2μl的缓冲液混合物(buffer mix)、8μl的样品rna;使用移液器轻轻吹打或振荡混匀,并短暂离心将反应液离心至管底,之后置于pcr仪上,37℃,15min,85℃,5s。反应结束后放置于4度暂存,得到rna逆转录产物。
[0073]
2.2、一次pcr扩增捕获:将dna扩增引物组和rna扩增引物组提前进行合理稀释混合;取样品dna和rna逆转录产物,进行dna和rna扩增捕获。
[0074]
其中dna扩增捕获时采用30μl的pcr反应体系,该pcr反应体系包括以下组分:8μl的dna扩增引物组混合物(dna pro panel mix),12μl的样品dna,10μl的3x酶混合物(3x enzyme mix);dna扩增捕获程序为:95℃,3min,95℃,30sec,60℃,4min,20个循环,72℃,4min。
[0075]
rna扩增捕获时采用30μl的pcr反应体系,该pcr反应体系包括以下组分:10μl的rna扩增引物组混合物(rna pro panel mix),10μl的样品rna逆转录产物,10μl的3x酶混合物(3x enzyme mix),2μl的无核酸水(nuclease-free water);rna扩增捕获程序为:95℃,3min,95℃,30sec,56℃,4min,20个循环,72℃,4min。
[0076]
2.3、对一次pcr扩增产物进行片段分选与纯化,具体步骤如下:
[0077]
s1:将selection beads(vazyme)磁珠由冰箱中取出,室温平衡30min,加入浓度为75%的乙醇溶液,涡旋振荡或充分颠倒磁珠以保证充分混匀,得到纯化磁珠;
[0078]
s2:取dna捕获产物或rna捕获产物,与纯化磁珠混合,室温孵育5min,离心后置于磁力架上,分离5min,待溶液澄清后移除上清;dna捕获产物与纯化磁珠的体积比为1∶1.5(30μl体系加45μl);rna捕获产物与纯化磁珠的体积比为1∶1(30μl体系加30μl)。
[0079]
s3:保持pcr管始终置于磁力架中,加入200μl新鲜配制的75%乙醇漂洗磁珠,室温孵育30sec,小心移除上清;
[0080]
s4:重复s3步骤2次,开盖空气干燥磁珠至刚刚出现龟裂(不超过5min),将pcr管从磁力架中取出,加入16μlddh2o,轻轻吹打混匀重悬磁珠,得到带磁珠的重悬dna捕获产物或带磁珠的重悬rna捕获产物。
[0081]
3、二轮pcr扩增
[0082]
分别取15μl的带磁珠的重悬dna捕获产物、带磁珠的重悬rna捕获产物,移至新0.2ml pcr管中进行混合合并,进行二轮pcr扩增;其中二轮pcr扩增体系包括以下组分:30μl的混合捕获产物,17μl的3x酶混合物(3x enzyme mix),1.25μl的二轮上游引物、1.25μl的二轮下游引物。二轮pcr扩增程序为:95℃,3min,95℃,15sec,58℃,15sec,72℃,30sec,10个循环,72℃,4min。
[0083]
扩增完成后,使用0.9倍体积selection beads(vazyme)(50μl体系加45μl)进行片
段分选与纯化。纯化产物需进行qubit-br定量(thermofisher)和2100生物分析仪(agilent)质控。通常合格的文库产物要求浓度大于20ng/μl,目标片段主峰约300~400bp左右双带。
[0084]
4、采用mgiseq2000测序仪(bgi)进行pe100上机测序,测序实验操作按照制造商提供的操作说明书进行上机测序操作。数据下机后,基于index序列拆分检测样本,同时使用相关生物信息分析软件进行检测结果分析。
[0085]
检测结果:样品覆盖均一性质控合格(0.94)。
[0086][0087]
结论:已知突变egfr p.e746_a750del&eml4-alk融合均正常检出,准确性100%。
[0088][0089]
根据该检测结果,可参考进行用药:基于靶向基因egfr p.e746_a750del变异,预示该患者可使用egfr-tkis药物敏感,如厄洛替尼,奥希替尼,达可替尼,吉非替尼,埃克替尼,阿法替尼,阿美替尼等。基于靶向基因eml4-alk融合突变,预示该患者可考虑使用克唑替尼、艾乐替尼、色瑞替尼、布加替尼、劳拉替尼等alk抑制剂。
[0090]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。