高唾液酸化igg的制备和纯化
1.优先权要求
2.本技术要求2020年5月19日提交的美国临时申请序列号63/026,875的权益。上述临时申请的全部内容以引用方式并入本文。
技术领域
3.本公开涉及用于制备以及纯化高唾液酸化igg的方法。
背景技术:
4.由人供体的混合血浆(例如,来自至少1,000个供体的混合血浆)制备的静脉内免疫球蛋白(ivig)用于治疗各种炎性疾病。然而,ivig制剂具有不同的限制,诸如功效可变、临床风险、高成本和供给有限。不同的ivig制剂在临床上经常被当作可互换的产品,但众所周知,存在产品制剂的显著差异,这可影响在所选临床应用中的耐受性和活性。在当前的最大给药方案中,在许多情况下仅获得部分且不持续性的响应。另外,与高体积ivig治疗相关联的长输注时间(4小时至6小时)会消耗输注中心的大量资源,并且会对患者报告的结果产生负面影响,诸如生活的便利性和生活质量。
5.对fc结构域唾液酸化的重要抗炎作用的鉴定已经呈现出开发更有效的免疫球蛋白疗法的机会。可商购获得的ivig制剂通常在所存在的抗体的fc结构域上表现出低水平的唾液酸化。具体地讲,它们在fc区上表现出支链聚糖的低水平二唾液酸化。
6.washburn等人(proceedings of the national academy of sciences,usa,第112卷:第e1297-e1306页(2015年))描述了一种受控的唾液酸化工艺,以产生高度四-fc-唾液酸化ivig,并且表明该工艺得到具有一致增强的抗炎活性的产物。
技术实现要素:
7.因此,本文描述了用于制备免疫球蛋白g(igg)的方法,该igg具有非常高的fc唾液酸化水平,特别是二唾液酸化(asn297(eu编号)处的聚糖的α1,3分支和α1,6分支两者上的唾液酸化)。本文所述的方法可提供高唾液酸化igg(hsigg),其中fc结构域上大于70%的支链聚糖在两个分支上(即,在α1,3分支和α1,6分支上)均被唾液酸化。hsigg含有igg抗体(主要是igg1抗体)的多种混合物。抗体的多样性很高。用于制备hsigg的免疫球蛋白可以例如从人类混合血浆(例如,来自至少1,000至30,000个供体的混合血浆)获得。免疫球蛋白可以从ivig获得,包括可商购获得的ivig。hsigg在fc区上的支链聚糖上的唾液酸水平远高于ivig。这产生在结构和活性两方面不同于ivig的组合物。hsigg可如wo2014/179601或washburn等人(proceedings of the national academy of sciences,usa第112卷:第e1297-e1306页(2015年))中所述进行制备,两者均以引用方式并入本文。
8.本文描述了用于制备以及纯化hsigg的改进方法。在一些实施方案中,这些方法产生未纯化的hsigg组合物,可从该组合物中分离出纯化的hsigg和用于产生制备hsigg的酶两者。在一些情况下,可重复使用所分离的酶。
9.本文描述了产生纯化的高唾液酸化igg(hsigg)组合物的方法,其中hsigg上大于75%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸,这些方法包括:(a)提供包含hsigg以及st6gal或其酶活性部分的hsigg组合物;(b)将该组合物稀释在约50mm、约ph 4.5的柠檬酸盐缓冲液中,从而产生缓冲抗体组合物;(c)在结合hsigg以及st6gal或其酶活性部分的条件下,将该缓冲抗体组合物施加到包括具有磺酸官能团的树脂的色谱柱;以及(d)从该柱选择性地洗脱igg,从而产生纯化的hsigg组合物,其中hsigg上大于75%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
10.在一些实施方案中,提供hsigg组合物的步骤包括提供包含hsigg的组合物,以及将该组合物以约1∶1稀释度稀释在5x pbs中。
11.在一些实施方案中,cex柱包括具有so
3-官能团的树脂。
12.在一些实施方案中,选择性地洗脱hsigg包括在包含约400mm或更多nacl的缓冲液中进行洗脱。
13.在一些实施方案中,该缓冲液是约50mm和约ph 4.5的柠檬酸盐缓冲液。
14.在一些实施方案中,该方法不包含在进行步骤(c)之前的除(a)和(b)之外的任何附加过滤、分馏或纯化步骤。
15.在一些实施方案中,该方法包括在步骤(c)之前的除步骤(a)和(b)之外的单个深层过滤步骤。
16.在一些实施方案中,该附加深层过滤步骤在步骤(a)与(c)之间进行。
17.在一些实施方案中,该方法不包括在进行步骤(c)之前的除单个深层过滤步骤之外的任何附加过滤、分馏或纯化步骤。
18.在一些实施方案中,该方法包括在步骤(c)之前的病毒灭活步骤。
19.在一些实施方案中,步骤(c)中的施加通过1、2或3次施加间隔开。
20.在一些实施方案中,步骤(e)重复一次或多次。
21.在一些实施方案中,步骤(c)以为或约为1、2、3、4、5或6分钟的停留时间进行。
22.在一些实施方案中,该方法还包括在步骤(e)之后的以下步骤中的一者或多者:(f)蓝色染料色谱,(g)de垫过滤步骤,(h)深层过滤步骤,或(g)ps20掺入和过滤步骤。
23.在一些实施方案中,纯化的hsigg组合物包含来自步骤(a)的组合物的80%、85%、90%或95%或更多量的未纯化的hsigg。
24.在一些实施方案中,纯化的hsigg组合物包含100ppm、90ppm、80ppm、70ppm、60ppm、50ppm、40ppm或30ppm或更少的st6gal或其酶活性部分。
25.本文还提供了产生纯化的高唾液酸化igg(hsigg)组合物的方法,该方法包括:(a)提供包含hsigg以及st6gal或其酶活性部分的hsigg组合物,并且任选地淬灭该反应;(b)将该组合物稀释在适合与柱一起使用的缓冲液中,从而产生缓冲抗体组合物;(c)在允许80%或更多的hsigg流通但允许仅100ppm或更少的st6或其酶活性部分流通的条件下,将该缓冲抗体组合物施加到蓝色染料柱,例如本文所述的蓝色柱,从而产生纯化的hsigg。
26.在一些实施方案中,该蓝色染料色谱柱是trisacryl blue(tabs)柱,并且适合与柱一起使用的缓冲液是含有约800mm nacl的约100mm、约ph 4.5的柠檬酸盐缓冲液。
27.在一些实施方案中,该蓝色染料色谱柱是capto
tm
blue或capto
tm
blue hs柱,并且缓冲液是含有约800mm nacl的约250mm、约ph 4.5的甘氨酸。
28.在一些实施方案中,提供hsigg组合物的步骤包括提供包含hsigg的组合物,以及将该组合物以约1∶1稀释度稀释在5x pbs中。
29.在一些实施方案中,该方法不包含在进行步骤(c)之前的除(a)和(b)之外的任何附加过滤、分馏或纯化步骤。
30.在一些实施方案中,该方法包括在步骤(c)之前的除步骤(a)和(b)之外的单个深层过滤步骤。
31.在一些实施方案中,该附加过滤步骤在步骤(a)与(c)之间进行。
32.在一些实施方案中,该方法不包括在进行步骤(c)之前的除单个深层过滤步骤之外的任何附加过滤、分馏或纯化步骤。
33.在一些实施方案中,该方法包括在步骤(c)之前的病毒灭活步骤。
34.在一些实施方案中,步骤(c)中的施加通过1、2或3次施加间隔开。
35.在一些实施方案中,步骤(c)以为或约为1、2、3、4、5或6分钟的停留时间进行。
36.在一些实施方案中,该方法还包括在步骤(e)之后的以下步骤中的一者或多者:(f)蓝色染料色谱,(g)de垫过滤步骤,(h)深层过滤步骤,或(g)ps20掺入和过滤步骤。
37.本文还描述了产生高唾液酸化igg(hsigg)组合物的方法,这些方法包括:(a)提供hsigg;(b)通过添加饱和硫酸铵溶液使hsigg沉淀,从而产生沉淀的hsigg溶液;以及(c)分离沉淀的hsigg,从而产生纯化的hsigg组合物。
38.在一些实施方案中,分离沉淀的hsigg包括过滤和/或离心。
39.本文还提供了产生高唾液酸化igg(hsigg)组合物的方法,这些方法包括:(a)提供混合igg抗体;(b)在包含β1,4-半乳糖基转移酶(b4galt)或其酶活性部分以及udp-gal或其盐的反应混合物中孵育这些混合igg抗体;以及(c)在包含st6gal或其酶活性部分以及cmp-nana或其盐的反应混合物中孵育这些半乳糖基化igg抗体;(d)根据本文所述的方法中的任一种方法纯化hsigg。
40.本文还描述了制备高唾液酸化igg(hsigg)的方法,这些方法包括:(a)提供混合igg抗体;(b)在包含β1,4-半乳糖基转移酶(b4galt)或其酶活性部分、udp-gal或其盐、st6gal或其酶活性部分以及cmp-nana或其盐的反应混合物中孵育这些混合igg抗体;以及(c)根据本文所述的方法中的任一种方法纯化hsigg,从而产生hsigg制剂。
41.本文还描述了制备高唾液酸化igg(hsigg)的方法,这些方法包括:(a)提供混合igg抗体;(b)在包含β1,4-半乳糖基转移酶(b4galt)或其酶活性部分以及udp-gal或其盐的半乳糖基化反应混合物中孵育这些混合igg抗体,从而产生半乳糖基化igg抗体;(c)将st6gal或其酶活性部分以及cmp-nana或其盐添加到该半乳糖基化反应混合物中,以产生唾液酸化反应混合物;(d)孵育该唾液酸化反应混合物;以及(e)根据本文所述的方法中的任一种方法纯化hsigg,从而产生hsigg。
42.本文还描述了制备纯化的高唾液酸化igg(hsigg)组合物的方法,这些方法包括:(a)提供igg抗体混合物;(b)在包含β1,4-半乳糖基转移酶(β4galt)或其酶活性部分和udp-gal的反应混合物中孵育该igg抗体混合物,以产生半乳糖基化igg抗体;(c)在包含st6gal或其酶活性部分和cmp-nana的第二反应混合物中孵育这些半乳糖基化igg抗体,以产生hsigg混合物;(d)在结合igg抗体的条件下将该hsigg混合物施加到蛋白质a柱;以及(e)从该蛋白质a柱洗脱hsigg。
43.在一些实施方案中,该方法还包括(f)使用三丙烯酰基蓝色柱进一步纯化步骤(e)中产生的hsigg。
44.在一些实施方案中,步骤(e)包括用包含甘氨酸的缓冲液洗脱hsigg。
45.在一些实施方案中,在步骤(d)与步骤(e)之间用乙酸盐缓冲液洗涤蛋白质a柱。
46.在一些实施方案中,在将步骤(e)中产生的hsigg施加到三丙烯酰基蓝色柱之前改变其ph和盐含量。
47.在一些实施方案中,步骤(f)包括用高盐缓冲液洗脱hsigg。
48.在一些实施方案中,该高盐缓冲液包括2m nacl。
49.在一些实施方案中,该高盐缓冲液包括2m kcl
50.在一些实施方案中,步骤(e)中产生的hsigg改变为0.4m nacl并且ph 4.5。
51.本文还描述了制备高唾液酸化igg(hsigg)的方法,这些方法包括:(a)提供igg抗体混合物;(b)在包含β1,4-半乳糖基转移酶(b4galt)或其酶活性部分、udp-gal、st6gal或其酶活性部分和cmp-nana的反应混合物中孵育该igg抗体混合物,从而产生hsigg制剂;(d)在结合igg抗体的条件下将该hsigg制剂施加到蛋白质a柱;以及(e)从该蛋白质a柱洗脱hsigg。
52.在一些实施方案中,b4galt或其酶活性部分为至少90%相同的seq id no:12或seq id no:13,并且st6gal或其酶活性部分包含为至少90%相同的seq id no:19或seq id no:20的氨基酸序列。
53.在一些实施方案中,igg抗体包括从至少1000个供体中分离的igg抗体。
54.在一些实施方案中,igg抗体的至少70%w/w是igg1抗体。
55.在一些实施方案中,供体受试者的至少90%已经暴露于病毒。
56.在一些实施方案中,提供igg抗体混合物的步骤包括:(a)提供来自至少1000个人类受试者的混合血浆;以及(b)从该混合血浆中分离igg抗体混合物。
57.在一些实施方案中,从静脉内免疫球蛋白中分离该igg抗体混合物。
58.在一些实施方案中,该igg抗体混合物是静脉内免疫球蛋白。
59.在一些实施方案中,从混合血浆中分离igg抗体混合物的步骤包括乙醇沉淀或辛酸沉淀。
60.在一些实施方案中,从混合血浆中分离igg抗体混合物的步骤包括将igg抗体结合到离子交换柱,以及从该离子交换柱洗脱igg抗体。
61.本文还提供了制备纯化的高唾液酸化igg(hsigg)组合物的方法,这些方法包括:(a)提供igg抗体混合物;(b)在包含β1,4-半乳糖基转移酶(b4galt)或其酶活性部分和udp-gal的反应混合物中孵育该igg抗体混合物,以产生半乳糖基化igg抗体;(c)在包含st6gal或其酶活性部分和cmp-nana的反应混合物中孵育这些半乳糖基化igg抗体,以产生hsigg组合物;以及(d)从该hsigg组合物中分离b4galt或其酶活性部分以及st6gal或其酶活性部分。
62.在一些实施方案中,该方法还包括从该hsigg组合物中分离b4galt或其酶活性部分以及st6gal或其酶活性部分中的一者或两者。
63.本文还提供了制备高唾液酸化igg(hsigg)的方法,这些方法包括:(a)提供igg抗体混合物;(b)在包含β1,4-半乳糖基转移酶(b4galt)或其酶活性部分、udp-gal、st6gal或
其酶活性部分和cmp-nana的反应混合物中孵育该igg抗体混合物,从而产生hsigg制剂;以及(c)从该hsigg制剂中分离hsigg,以及从该hsigg制剂中分离b4galt或其酶活性部分以及st6gal或其酶活性部分。
64.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg上约60%、65%、70%、75%、80%或85%的支链聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
65.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg上约80%或85%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
66.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg的fab结构域上至少60%、65%、70%、75%、80%或85%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
67.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg上至少80%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
68.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg的fab结构域上至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
69.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg上至少85%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
70.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg的fab结构域上至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
71.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg上至少90%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
72.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之前,hsigg的fab结构域上至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
73.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg上约60%、65%、70%、75%、80%或85%的支链聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
74.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg上约80%或85%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
75.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg的fab结构域上至少60%、65%、70%、75%、80%或85%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
76.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg上至少80%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
77.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg的fab结构域上至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
78.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg上至少85%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
79.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg的fab结构域上至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
80.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg上至少90%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
81.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,在纯化之后,hsigg的fab结构域上至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
82.在本文所述的纯化方法中的任一种纯化方法的一些实施方案中,该方法还包括在色谱步骤之后分析一种或多种igg亚类的量。
83.本文还描述了制备纯化的高唾液酸化igg(hsigg)组合物的方法,该方法包括:(a)提供igg抗体混合物;(b)在包含β1,4-半乳糖基转移酶(b4galt)和udp-gal的反应混合物中孵育该igg抗体混合物,以产生半乳糖基化igg抗体;(c)在包含st6gal1和cmp-nana的第二反应混合物中孵育这些半乳糖基化igg抗体,以产生hsigg混合物;(d)在结合igg抗体的条件下将该hsigg混合物施加到蛋白质a柱;以及(e)从该蛋白质a柱洗脱hsigg。
84.在各种实施方案中,该方法还包括:(g)使用三丙烯酰基蓝色柱进一步纯化步骤(e)中产生的hsigg;b4galt为至少90%相同的seq id no:1或seq id no:2;st6gal1包含为至少90%相同的seq id no:3或seq id no:4或seq id no:5的氨基酸序列;步骤(e)包括用包含甘氨酸的缓冲液洗脱hsigg;在步骤(d)与步骤(e)之间用乙酸盐缓冲液洗涤蛋白质a柱;在将步骤(e)中产生的hsigg施加到三丙烯酰基蓝色柱之前改变其ph和盐含量;步骤(g)包括用高盐缓冲液洗脱hsigg;该高盐缓冲液包括2m nacl;该高盐缓冲液包括2m kcl;以及/或者步骤(e)中产生的hsigg改变为0.4m nacl并且ph 4.5。
85.本文还描述了制备高唾液酸化igg(hsigg)的方法,该方法包括:(a)提供igg抗体混合物;(b)在包含β1,4-半乳糖基转移酶i(b4galt)、udp-gal、st6gal1和cmp-nana的反应混合物中孵育该igg抗体混合物,从而产生hsigg制剂;(d)在结合igg抗体的条件下将hsigg组合物施加到蛋白质a柱;以及(e)从该蛋白质a柱洗脱igg抗体。
86.本文还描述了制备纯化的高唾液酸化igg(hsigg)组合物的方法,该方法包括:(a)提供igg抗体混合物;(b)在包含β1,4-半乳糖基转移酶(b4galt)和udp-gal的反应混合物中孵育该igg抗体混合物,以产生半乳糖基化igg抗体;(c)在包含st6gal1和cmp-nana的反应混合物中孵育这些半乳糖基化igg抗体,以产生hsigg组合物;以及(d)从该hsigg组合物中分离hsigg,以及从该hsigg组合物中分离b4galt和st6gal1。
87.本文还描述了制备高唾液酸化igg(hsigg)的方法,该方法包括:
88.(a)提供igg抗体混合物;(b)在包含β1,4-半乳糖基转移酶i(b4galt)、udp-gal、st6gal1和cmp-nana的反应混合物中孵育该igg抗体混合物,从而产生hsigg制剂;以及(c)从hsigg组合物中分离hsigg,以及从hsigg组合物中分离b4galt和st6gal1。
89.在前述所有方法中的各种实施方案中,b4galt为至少90%相同的seq id no:12或seq id no:13,并且st6gal1包含为至少90%相同的seq id no:19或seq id no:20的氨基
酸序列;igg抗体包括从至少1000个供体中分离的igg抗体;igg抗体的至少70%w/w是igg1抗体;供体受试者的至少90%已经暴露于病毒;hsigg制剂中的igg抗体上至少60%、65%、70%、75%、80%或85%的支链聚糖在α1,3分支和α1,6分支两者上具有唾液酸;hsigg制剂中的igg抗体的fab结构域上至少60%、65%、70%、75%、80%或85%的支链聚糖在α1,3臂和α1,6臂两者上具有唾液酸;提供igg抗体混合物的步骤包括:(a)提供来自至少1000个人类受试者的混合血浆;以及(b)从该混合血浆中分离igg抗体混合物;从静脉内免疫球蛋白中分离该igg抗体混合物;该igg抗体混合物是静脉内免疫球蛋白;从混合血浆中分离igg抗体混合物的步骤包括乙醇沉淀或辛酸沉淀;并且从混合血浆中分离igg抗体混合物的步骤包括将igg抗体结合到离子交换柱,以及从该离子交换柱洗脱igg抗体。
90.在高唾液酸化igg中,fc区上至少60%(例如,65%、70%、75%、80%、82%、85%、87%、90%、92%、94%、95%、97%、98%至100%且包括100%)的支链聚糖通过neuac-α2,6-gal末端键进行二唾液酸化(即,在α1,3分支和α1,6臂两者上)。在一些实施方案中,fc区上少于50%(例如,少于40%、30%、20%、15%、10%、5%、4%、3%、2%、1%)的支链聚糖通过neuac-α2,6-gal末端键进行单唾液酸化(即,仅在α1,3分支上或仅在α1,6分支上唾液酸化)。
91.在一些实施方案中,多肽源自血浆,例如人血浆。在某些实施方案中,尽管多肽绝大多数是igg多肽(例如,igg1、igg2、igg3或igg4或它们的混合物),但是可存在痕量的其他免疫球蛋白亚类。
92.如本文所用,术语
″
抗体
″
是指包括至少一个免疫球蛋白可变区,例如,提供免疫球蛋白可变结构域或免疫球蛋白可变结构域序列的氨基酸序列的多肽。例如,抗体可以包括重(h)链可变区(在本文中缩写为vh)和轻(l)链可变区(在本文中缩写为v
l
)。在另一个示例中,抗体包括两个重(h)链可变区和两个轻(l)链可变区。术语
″
抗体
″
涵盖抗体的抗原结合片段(例如,单链抗体、fab、f(ab
′
)2、fd、fv和dab片段)以及完整抗体,例如,iga、igg、ige、igd、igm类型(以及它们的亚型)的完整免疫球蛋白。免疫球蛋白的轻链可以是κ型或λ型。
93.如本文所用,术语
″
恒定区
″
是指对应于或源自抗体的一个或多个恒定区免疫球蛋白结构域的多肽。恒定区可以包括以下免疫球蛋白结构域中的任何或所有免疫球蛋白结构域:ch1结构域、铰链区、ch2结构域、ch3结构域(源自iga、igd、igg、ige或igm)和ch4结构域(源自ige或igm)。
94.如本文所用,术语
″
fc区
″
是指两个
″
fc多肽
″
的二聚体,每个
″
fc多肽
″
包括除第一恒定区免疫球蛋白结构域之外的抗体恒定区。在一些实施方案中,
″
fc区
″
包括通过一个或多个二硫键、化学接头或肽接头连接的两个fc多肽。
″
fc多肽
″
是指iga、igd和igg的最后两个恒定区免疫球蛋白结构域,以及ige和igm的最后三个恒定区免疫球蛋白结构域,并且还可包括这些结构域的柔性铰链n末端的部分或全部。对于igg,
″
fc多肽
″
包含免疫球蛋白结构域cgamma2(cγ2)和cgamma3(cγ3)以及cgamma1(cγ1)与cγ2之间的铰链的下部。虽然fc多肽的边界可以变化,但通常将人igg重链fc多肽定义为包含从p232开始至其羧基末端的残基,其中编号符合eu系统(edelman等人,proc.natl.acad.usa,第63卷:第78-85页(1969年))。对于iga,fc多肽包含免疫球蛋白结构域calpha2(cα2)和calpha3(cα3)以及calpha1(cα1)与ca2之间的铰链的下部。fc区可以是合成的、重组的或由天然来源诸如ivig产生。
95.如本文所用,
″
聚糖
″
是糖,其可以是糖残基的单体或聚合物,诸如至少三种糖,并且可以是直链或支链的。
″
聚糖
″
可包括天然糖残基(例如,葡萄糖、n-乙酰葡糖胺、n-乙酰神经氨酸、半乳糖、甘露糖、岩藻糖、己糖、阿拉伯糖、核糖、木糖等)和/或改性糖(例如,2
′‑
氟核糖、2
′‑
脱氧核糖、磷酸甘露糖、6
′
磺基n-乙酰葡糖胺等)。术语
″
聚糖
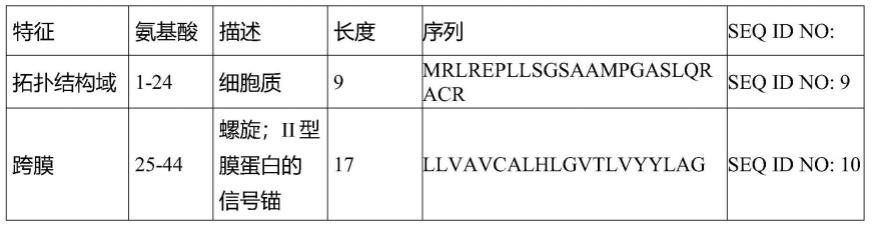
″
包括糖残基的均聚物和杂聚物。术语
″
聚糖
″
还涵盖糖缀合物(例如多肽、糖脂、蛋白聚糖等)的聚糖组分。该术语还涵盖游离聚糖,包括已从糖缀合物裂解或以其他方式释放的聚糖。
96.如本文所用,术语
″
糖蛋白类
″
是指含有共价连接到一个或多个糖部分(即,聚糖)的肽主链的蛋白质。糖部分可为单糖、二糖、低聚糖和/或多糖的形式。糖部分可包含糖残基的单条非支链,或者可包含一条或多条支链。糖蛋白可包含o连接的糖部分和/或n连接的糖部分。
97.如本文所用,
″
ivig
″
是从至少1,000个人供体的血浆中提取的混合的多价igg(包括所有四种igg亚组)的制剂。ivig被批准作为免疫缺陷患者的血浆蛋白替代疗法。ivig fc聚糖唾液酸化的水平在ivig制剂之间有所不同,但通常小于20%。二唾液酸化水平通常远低于20%。如本文所用,术语
″
源自ivig
″
是指通过操纵ivig产生的多肽。例如,从ivig纯化多肽(例如,富集唾液酸化igg或经修饰的igg(例如,酶促唾液酸化的ivig igg))。
98.如本文所用,
″
fc多肽的n-糖基化位点
″
是指聚糖与之n连接的fc多肽内的氨基酸残基。在一些实施方案中,fc区包含fc多肽的二聚体,并且fc区包含两个n-糖基化位点,每个fc多肽上一个。
99.如本文所用,
″
支链聚糖的百分比(%)
″
是指聚糖x相对于所存在的聚糖总摩尔数的摩尔数,其中x表示感兴趣的聚糖。
100.术语
″
药物有效量
″
或
″
治疗有效量
″
是指在治疗患有本文所述的疾病或病症的患者有效的量(例如,剂量)。本文还应当理解,
″
药物有效量
″
可解释为赋予所需治疗效果的量,以单剂量或任何剂量或途径单独服用或与其他治疗剂组合服用。
101.″
药物制剂
″
和
″
药物产品
″
可包括在含有该制剂或产品以及使用说明的试剂盒中。
102.″
药物制剂
″
和
″
药物产品
″
通常是指其中已经实现了唾液酸化的最终预定水平并且不含工艺杂质的组合物。为此,
″
药物制剂
″
和
″
药物产品
″
基本上不含st6gal1和/或唾液酸供体(例如,胞苷5
′‑
单磷酸-n-乙酰神经氨酸)或其副产物(例如,胞苷5
′‑
单磷酸)。
103.″
药物制剂
″
和
″
药物产品
″
通常基本上不含其中产生糖蛋白的细胞的其他组分(例如内质网或细胞质蛋白和rna,如果是重组的话)。
104.所谓
″
纯化的
″
(或
″
分离的
″
)是指多核苷酸或多肽从存在于其天然环境中的其他组分中去除或分离。例如,分离的多肽是与产生其的细胞的其他组分(例如,内质网或细胞质蛋白和rna)分离的多肽。分离的多核苷酸是与其他核组分(例如,组蛋白)和/或与上游或下游核酸分离的多核苷酸。分离的多核苷酸或多肽可至少60%不含、或至少75%不含、或至少90%不含、或至少95%不含所指出的多核苷酸或多肽的天然环境中存在的其他组分。
105.如本文所用,术语
″
唾液酸化
″
是指具有末端唾液酸的聚糖。术语
″
单唾液酸化
″
是指例如在α1,3分支或α1,6分支上具有一个末端唾液酸的支链聚糖。术语
″
二唾液酸化
″
是指在两个臂(例如α1,3臂和α1,6臂两者)上具有末端唾液酸的支链聚糖。
106.除非另有定义,否则本文所用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。本文描述了用于本发明的方法和材料;也可使用本领
域已知的其他合适的方法和材料。另外,材料、方法和示例仅为例示性的,而非旨在进行限制。本文提到的所有出版物、专利申请、专利、序列、数据库条目及其他参考文献均全文以引用方式并入。若有矛盾,应以本说明书及其定义为准。
107.根据如下具体实施方式和附图以及权利要求书,本发明的其他特征和优点将显而易见。
附图说明
108.图1示出了包含两个n-乙酰氨基葡萄糖和三个甘露糖残基的短的支链核心低聚糖。分支之一在本领域中被称为
″
α1,3臂
″
,并且第二分支被称为
″
α1,6臂
″
。正方形:n-乙酰氨基葡萄糖;深灰色圆圈:甘露糖;浅灰色圆圈:半乳糖;菱形:n-乙酰神经氨酸;三角形:岩藻糖。
109.图2示出了ivig中存在的常见fc聚糖。正方形:n-乙酰氨基葡萄糖;深灰色圆圈:甘露糖;浅灰色圆圈:半乳糖;菱形:n-乙酰神经氨酸;三角形:岩藻糖。
110.图3示出了免疫球蛋白(例如igg抗体)如何通过进行半乳糖基化步骤,接着进行唾液酸化步骤而被唾液酸化。正方形:n-乙酰氨基葡萄糖;深灰色圆圈:甘露糖;浅灰色圆圈:半乳糖;菱形:n-乙酰神经氨酸;三角形:岩藻糖。
111.图4示出了对于以ivig开始的反应,igg-fc聚糖图谱的代表性示例的反应产物。左图是用于将igg转化为hsigg的酶促唾液酸化反应的示意图;右图是起始ivig和hsigg的igg fc聚糖图谱。从左至右的条形分别对应于igg1、igg2/3和igg3/4。
112.图5示出了hsigg的示例性生产工艺。
113.图6示出了poros
tm
树脂的结合容量。
114.图7示出了产率和残留st6的预测图谱。
115.图8示出了介于90%至95%之间的产率和小于30ppm的残留st6水平的操作范围。
116.图9是流通物的sec色谱图。
117.图10是洗脱液的sec。
118.图11是tab、capto
tm blue和capto
tm blue sepharose 2 ff的叠层。
119.图12示出了三次运行的回收率(从左到右的条形:tab、capto
tm blue和blue sepharose
tm ff),这三次运行示出了相似的回收率。
120.图13示出了运行1和4的色谱图叠层。
121.图14示出了4次运行的残留st6,其表明capto
tm blue hs(运行3和4)与capto
tm blue(运行1和2)相比具有更好的清除率。
122.图15示出了capto
tm blue hs和tab的残留st6的比较,其表明capto
tm blue hs具有更好的清除率。
123.图16示出了ivig负载、ft和洗脱液的分析sec。
124.图17示出了ivig流通capto
tm blue hs并且针对起始ivig洗脱的质谱。从左到右的条形:igg1、igg2、igg3、igg4。
125.图18示出了在ph为4.5的缓冲液中,5x pbs和mops对残留st6(运行1)的影响。x轴:mg ivig/ml树脂。
126.图19示出了甘氨酸ph 4.5对残留st6的影响(运行2)。x轴:mg ivig/ml树脂。
127.图20示出了甘氨酸 100mm nacl在ph为4.5时对残留st6(运行2)的影响。
128.图21示出了负载量(m254的克数/ml柱体积)对通过tab色谱柱的st6的清除率的影响。橙色点和蓝色点分别表示在cex负载和cex洗脱液的不同负载量下,tab柱流通级分的st6的残留水平。在当前制造规模最大负载1.1g/ml(1x)时,在两种负载(cex负载和cex洗脱液)下,tab柱流通级分的残留st6实现了相似的水平。
129.图22是ivig和沉淀的ivig的分析sec的叠层,其表明在聚集水平上没有变化。
130.图23是粗反应物与沉淀材料的分析sec曲线,其表明核苷酸的显著减少。
具体实施方式
131.抗体在其重链恒定区中和fab结构域上的保守位置处被糖基化。例如,人igg抗体在ch2结构域的asn297(eu编号)处具有单个n连接的糖基化位点。每种抗体同种型在恒定区中具有不同种类的n连接的碳水化合物结构。对于人igg,核心低聚糖通常由具有不同数目的外部残基的glcnac2man3glcnac组成。各个igg之间的差异可经由半乳糖和/或半乳糖-唾液酸在一个或两个末端glcnac处的连接或经由第三glcnac臂的连接(平分glcnac)而发生。
132.本公开部分地涵盖用于制备具有fc区的免疫球蛋白(例如人igg)的方法,该fc区具有特定水平的支链聚糖,支链聚糖在支链聚糖的两个臂上被唾液酸化(例如,通过neuac-α2,6-gal末端键)。水平可基于单个fc区测量(例如,在fc区中的支链聚糖的α1,3臂、α1,6臂或两者上唾液酸化的支链聚糖数目),或基于多肽制剂的总体组成测量(例如,在多肽制剂的fc区中的支链聚糖的α1,3臂、α1,6臂或两者上唾液酸化的支链聚糖的数目或百分比)。
133.可以用于制备高唾液酸化igg的天然来源的多肽包括例如人血清中的igg(特别是混合自超过1,000个供体的人血清)、静脉内免疫球蛋白(ivig)和源自ivig的多肽(例如,从ivig纯化的多肽(例如,富集唾液酸化igg)或经修饰的ivig(例如,酶促唾液酸化ivig igg))。
134.将n连接的低聚糖链添加到内质网的内腔中的蛋白质。具体地,将初始低聚糖(通常为14-糖)添加到asn-x-ser/thr的靶共有序列内包含的天冬酰胺残基的侧链上的氨基,其中x可以是除脯氨酸之外的任何氨基酸。该初始低聚糖的结构是大多数真核生物共有的,并且含有三个葡萄糖残基、九个甘露糖残基和两个n-乙酰葡糖胺残基。该初始低聚糖链可被内质网中的特定糖苷酶修剪,从而得到由两个n-乙酰葡糖胺残基和三个甘露糖残基构成的短支链核心低聚糖。分支之一在本领域中被称为
″
α1,3臂
″
,并且第二分支被称为
″
α1,6臂
″
,如图1所示。
135.n-聚糖可细分成被称为
″
高甘露糖型
″
、
″
杂合型
″
和
″
复杂型
″
的三个不同组,其中在所有三个组中出现共同的五糖核心(man(α1,6)-(man(α1,3))-man(β1,4)-glcpnac(β1,4)-glcpnac(β1,n)-asn)。
136.ivig中存在的更常见的fc聚糖示于图2中。
137.除此之外或另选地,可将n-乙酰葡糖胺的一个或多个单糖单元添加到核心甘露糖亚基以形成
″
复杂聚糖
″
。可将半乳糖添加至n-乙酰葡糖胺亚基,并且可将唾液酸亚基添加到半乳糖亚基,从而得到以唾液酸、半乳糖或n-乙酰葡糖胺残基中的任一者封端的链。另外,可将岩藻糖残基添加到核心低聚糖的n-乙酰葡糖胺残基。这些添加中的每一者均由特定糖基转移酶催化。
138.″
杂合聚糖
″
包含高甘露糖和复杂聚糖两者的特征。例如,杂合聚糖的一个分支可主要包含或仅包含甘露糖残基,而另一个分支可包含n-乙酰葡糖胺、唾液酸、半乳糖和/或岩藻糖。
139.唾液酸是具有杂环结构的9碳单糖家族。它们经由附接到环的羧酸基团以及包括n-乙酰基和n-乙醇酰基基团在内的其他化学修饰而带有负电荷。在产生于哺乳动物表达系统的多肽中发现的两种主要类型的唾液酸残基是n-乙酰神经氨酸(neuac)和n-羟乙酰神经氨酸(neugc)。它们通常作为在n连接的聚糖和o连接的聚糖两者的非还原末端处附接到半乳糖(gal)残基的末端结构出现。这些唾液酸基团的糖苷键构型可以是α2,3或α2,6。
140.fc区在保守的n连接糖基化位点处被糖基化。例如,igg抗体的每条重链在ch2结构域的asn297处具有单个n连接的糖基化位点。iga抗体在ch2和ch3结构域内具有n连接的糖基化位点,ige抗体在ch3结构域内具有n连接的糖基化位点,并且igm抗体在ch1、ch2、ch3和ch4结构域内具有n连接的糖基化位点。
141.每种抗体同种型在恒定区中具有不同种类的n连接的碳水化合物结构。例如,igg在fc区的每个fc多肽中在ch2结构域的asn297处具有单个n连接的双触角碳水化合物,其还包含c1q和fcγr的结合位点。对于人igg,核心低聚糖通常由具有不同数目的外部残基的glcnac2man3glcnac组成。各个igg之间的差异可经由半乳糖和/或半乳糖-唾液酸在一个或两个末端glcnac处的连接或经由第三glcnac臂的连接(平分glcnac)而发生。
142.免疫球蛋白(例如igg抗体)可以通过进行半乳糖基化步骤,接着进行唾液酸化步骤而被唾液酸化。β-1,4-半乳糖基转移酶1(b4galt)是ii型高尔基体膜结合糖蛋白,其将半乳糖从尿苷5
′‑
二磷酸半乳糖([[(2r,3s,4r,5r)-5-(2,4-二氧代嘧啶-1-基)-3,4二羟基氧杂环戊烷-2-基]甲氧基-羟基磷酰基][(2r,3r,4s,5r,6r)-3,4,5-三羟基-6-(羟甲基)环氧乙烷-2-基]磷酸氢盐;udp-gal)转移到glcnac作为β-1,4键。α-2,6-唾液酸转移酶1(st6)是ii型高尔基体膜结合糖蛋白,其将唾液酸从胞苷5
′‑
单磷酸-n-乙酰神经氨酸((2r,4s,5r,6r)-5-乙酰胺基-2-[[(2r,3s,4r,5r)-5-(4-氨基-2-氧代嘧啶-1-基)-3,4-二羟基氧杂环戊烷-2-基]甲氧基-羟基磷酰基]氧基-4-羟基-6-(1,2,3-三羟基丙基)环氧乙烷-2-羧酸;cmp-nana或cmp-唾液酸)转移到gal作为α-2,6键。示意性地,反应如图3所示进行。
[0143]
多肽的聚糖可使用本领域已知的任何方法进行评估。例如,聚糖组合物的唾液酸化(例如,在α1,3分支和/或α1,6分支上唾液酸化的支链聚糖的水平)可使用wo2014/179601中描述的方法来表征。
[0144]
在通过本文所述的方法制备的hsigg组合物的一些实施方案中,fc结构域上至少60%、65%、70%、75%、80%、85%或90%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。另外,在一些实施方案中,fab结构域上至少40%、50%、60%、65%、70%、75%、80%或85%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。总的来说,在一些实施方案中,至少60%、65%、70%、75%、80%、85%或90%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
[0145]
在一些实施方案中,通过本文所述的方法制备的hsigg组合物包含fc结构域上至少50%、55%、60%、65%、70%或75%的支链聚糖,这些支链聚糖在α1,3臂和α1,6臂两者上具有唾液酸。
[0146]
酶
[0147]
半乳糖基化酶
[0148]
β-1,4-半乳糖基转移酶(b4galt)(例如人b4galt,例如人b4galt1)以及其直系同源物、突变体和变体,包括β-1,4-半乳糖基转移酶(b4galt)(例如人b4galt,例如人b4galt1)以及其直系同源物、突变体和变体的酶活性部分,连同包含它们的融合蛋白和多肽适合用于本文所述的方法。b4galt1是七种β-1,4-半乳糖基转移酶(β4galt)基因之一,每个基因编码似乎对供体底物udp-半乳糖具有排他特异性的ii型膜结合糖蛋白;将β1,4键中的半乳糖全部转移到类似的受体糖:glcnac、glc和xyl。b4galt1将半乳糖添加到为单糖或糖蛋白碳水化合物链的非还原末端的n-乙酰氨基葡萄糖残基上。b4galt1也称为ggtb2。编码b4galt1的四种同工型的四种替代转录物(ncbi基因id 2683)在表1中有所描述。
[0149]
表1.人b4galt1同工型
[0150]
转录物长度(核苷酸)蛋白质seq id no:长度(氨基酸)同工型nm_001497.44176np_001488.2seq id no:53981nm_001378495.13999np_001365424.1seq id no:63852nm_001378496.14053np_001365425.1seq id no:73573nm_001378497.11520np_001365426.1seq id no:82254
[0151]
表2.b4galt1同工型1(seq id no:5)的拓扑结构
[0152][0153][0154]
表3.b4galt1同工型1(seq id no:5)的结合位点
[0155][0156][0157]
表4.b4galt1同工型1(seq id no:5)的翻译后氨基酸修饰
[0158][0159]
b4galt1的可溶形式通过蛋白水解处理从膜形式衍生而来。裂解位点位于b4galt1同工型1(seq id no:5)的位置77-78处。
[0160]
在一些实施方案中,与b4galt1同工型1(seq id no:5)的氨基酸113、130、172、243、250、262、310、343或355对应的b4galt1的氨基酸中的一个或多个氨基酸与(seq id no:5)相比是保守的。
[0161]
在一些实施方案中,酶是例如b4galt1的酶活性部分。在一些实施方案中,酶是b4galt1同工型1(seq id no:5)或seq id no:5的直系同源物、突变体或变体的酶活性部分。在一些实施方案中,酶是b4galt1同工型2(seq id no:6)或seq id no:6的直系同源物、突变体或变体的酶活性部分。在一些实施方案中,酶是b4galt1同工型3(seq id no:7)或seq id no:7的直系同源物、突变体或变体的酶活性部分。在一些实施方案中,酶是b4galt1同工型4(seq id no:8)或seq id no:8的直系同源物、突变体或变体的酶活性部分。
[0162]
在一些实施方案中,b4galt1的酶活性部分不包含细胞质结构域,例如seq id no:9。在一些实施方案中,b4galt1的酶活性部分不包含跨膜结构域,例如seq id no:10。在一些实施方案中,b4galt1的酶活性部分不包含细胞质结构域(例如seq id no:9)或跨膜结构域(例如seq id no:10)。
[0163]
在一些实施方案中,b4galt1的酶活性部分包含内腔结构域的全部或一部分,例如seq id no:11或其直系同源物、突变体或变体。
[0164]
在一些实施方案中,b4galt1的酶活性部分包含seq id no:5的氨基酸109-398,或其直系同源物、突变体或变体。在一些实施方案中,b4galt1的酶活性部分由seq id no:5或seq id no:5的直系同源物、突变体或变体组成。
[0165]
b4galt1的合适的功能部分可包含与seq id no:12具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列或由该氨基酸序列组成。
[0166]
还适用于本文所述的方法中的是包含与seq id no:13具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列或由该氨基酸序列组成的氨基酸序列。
[0167]
唾液酸化酶
[0168]
st6,例如st6gal1(例如人st6gal1)以及其直系同源物、突变体和变体包括st6gal1(例如人st6gal1)以及其直系同源物、突变体和变体的酶活性部分,连同包含它们的融合蛋白和多肽适用于本文所述的方法。α-2,6-唾液酸转移酶1(st6)是ii型高尔基体膜结合糖蛋白,其将唾液酸从胞苷5
′‑
单磷酸-n-乙酰神经氨酸(cmp-nana)转移到gal作为α-2,6键。st6gal1也称为st6n或siat1。编码st6gal1的两种同工型的四种替代转录物(ncbi基因id 6480)在表5中有所描述。
[0169]
表5.人st6gal1同工型
[0170][0171]
表6.st6gal1同工型a(seq id no:14)的拓扑结构
[0172][0173]
表7.st6gal1同工型a(seq id no:14)的结合位点
[0174][0175]
表8.st6gal1同工型a(seq id no:14)的翻译后氨基酸修饰
[0176]
[0177]
[0178][0179]
st6gal1的可溶形式通过蛋白水解处理从膜形式衍生而来。
[0180]
在一些实施方案中,与st6gal1同工型a(seq id no:14)的氨基酸142、149、161、184、189、212、233、335、353、354、364、365、369、370、376或406对应的st6gal1的氨基酸中的一个或多个氨基酸与seq id no:14相比是保守的。
[0181]
本文还提供了例如st6gal1的酶活性部分。在一些实施方案中,酶是stg6gal1同工型a(seq id no:14)或seq id no:14的直系同源物、突变体或变体的酶活性部分。在一些实施方案中,酶是stg6gal1同工型b(seq id no:15)或seq id no:15的直系同源物、突变体或变体的酶活性部分。
[0182]
在一些实施方案中,st6gal1的酶活性部分不包含细胞质结构域,例如seq id no:16。在一些实施方案中,st6gal1的酶活性部分不包含跨膜结构域,例如seq id no:17。在一些实施方案中,st6gal1的酶活性部分不包含细胞质结构域(例如seq id no:16)或跨膜结构域(例如seq id no:17)。
[0183]
在一些实施方案中,st6gal1的酶活性部分包含内腔结构域的全部或一部分,例如seq id no:18或其直系同源物、突变体或变体。
[0184]
在一些实施方案中,st6gal1的酶活性部分包含seq id no:14的氨基酸87-406(seq id no:19),或其直系同源物、突变体或变体。在一些实施方案中,st6gal1的酶活性部分由seq id no:19或seq id no:19的直系同源物、突变体或变体组成。
[0185]
st6gal1的合适的功能部分可包含与seq id no:19具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列或由该氨基酸序列组成。
[0186]
在一些实施方案中,st6gal1包含以下或由以下组成:seq id no:19、seq id no:19的氨基酸4至320的部分或seq id no:19的氨基酸5至320的部分。
[0187]
还适用于本文所述的方法中的是包含与seq id no:20具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列或由该氨基酸序列组成的氨基酸序列。
[0188]
抗体
[0189]
本文所述的方法可包括抗体的半乳糖基化和唾液酸化。合适的抗体包括例如igg抗体。可以混合抗体,例如igg抗体。例如,混合igg抗体包括ivig。
[0190]
在一些实施方案中,igg抗体包括从至少1000个供体中分离的igg抗体。
[0191]
在一些实施方案中,igg抗体的至少50%、55%、60%、65%或70%w/w是igg1抗体。
[0192]
在一些实施方案中,供体受试者的至少90%已经暴露于病毒。
[0193]
在一些实施方案中,本文所述的方法包括提供igg抗体混合物。在一些实施方案中,提供igg抗体混合物包括:(a)提供来自至少1000个人类受试者的混合血浆;以及(b)从
该混合血浆中分离igg抗体混合物。在一些实施方案中,从静脉内免疫球蛋白中分离该igg抗体混合物。在一些实施方案中,该igg抗体混合物是静脉内免疫球蛋白。在一些实施方案中,从混合血浆中分离igg抗体混合物的步骤包括乙醇沉淀或辛酸(也称为羊脂酸)沉淀。在一些实施方案中,从混合血浆中分离igg抗体混合物的步骤包括将igg抗体结合到离子交换柱,以及从该离子交换柱洗脱igg抗体。
[0194]
酶促半乳糖基化和唾液酸化
[0195]
本文所述的方法可包括半乳糖基化步骤。示例性半乳糖基化反应描绘于图3中。因此,本文提供了通过以下过程使抗体(例如本文所述的抗体)半乳糖基化的方法,该方法通过:提供包含以下的组合物(半乳糖基化混合物):抗体,例如本文所述的抗体;半乳糖基化酶,例如本文所述的半乳糖基化酶,例如b4galt或者其变体的酶活性部分;udp-gal或其盐;以及在使抗体(例如如本文所述的)有效半乳糖基化的条件下孵育组合物,从而产生半乳糖基化抗体。
[0196]
本文所述的方法可包括唾液酸化步骤。示例性唾液酸化反应描绘于图3中。因此,本文提供了通过以下过程使抗体(例如本文所述的抗体)唾液酸化(例如高唾液酸化)的方法,该方法通过:提供包含以下的组合物(唾液酸化反应混合物):半乳糖基化抗体,例如如本文所述的;唾液酸化酶,例如本文所述的唾液酸化酶,例如st6gal1或其酶活性部分或变体;cmp-nana或其盐;以及在使抗体(例如如本文所述的)有效唾液酸化的条件下孵育组合物。
[0197]
在一些实施方案中,半乳糖基化步骤和唾液酸化步骤在同一反应混合物中依次进行,即,半乳糖基化反应混合物在添加唾液酸化酶以及cmp-nana或其盐时变成唾液酸化反应混合物。在一些实施方案中,在唾液酸化步骤之前未对半乳糖基化反应混合物进行过滤、分馏或纯化。在一些实施方案中,半乳糖基化步骤和唾液酸化步骤单独进行,例如,提供预先半乳糖基化的抗体,尽管在唾液酸化步骤之前可能已经处理(例如,过滤、分馏或纯化)和/或储存这些抗体。
[0198]
因此,本文所述的方法还可包括依次的半乳糖基化步骤和唾液酸化步骤。示例性半乳糖基化反应和唾液酸化反应描绘于图3中。因此,本文提供了通过以下过程使抗体(例如本文所述的抗体)半乳糖基化和唾液酸化(例如高唾液酸化)的方法,该方法通过:a)提供包含以下的组合物(半乳糖基化反应混合物):抗体,例如如本文所述的;半乳糖基化酶,例如本文所述的半乳糖基化酶,例如b4galt或其酶活性部分或变体;udp-gal或其盐;以及b)在使抗体(例如如本文所述的)有效半乳糖基化的条件下孵育组合物;c)将唾液酸化酶,例如本文所述的唾液酸化酶(例如st6gal1或其酶活性部分或变体)以及cmp-nana或其盐添加到半乳糖基化反应混合物,从而产生唾液酸化反应混合物;以及d)在使半乳糖基化抗体(例如如本文所述的)有效唾液酸化的条件下孵育组合物。
[0199]
本文还提供了通过以下过程使抗体(例如本文所述的抗体)半乳糖基化和唾液酸化(例如高唾液酸化)的方法,该方法通过:提供包含以下的组合物:抗体,例如如本文所述的;半乳糖基化酶,例如本文所述的半乳糖基化酶,例如b4galt或其酶活性部分或变体;udp-gal或其盐;唾液酸化酶,例如本文所述的唾液酸化酶,例如st6gal1或其酶活性部分或变体;cmp-nana或其盐;以及d)在使抗体(例如如本文所述的)有效半乳糖基化和唾液酸化的条件下孵育组合物。
[0200]
在一些实施方案中,半乳糖基化反应混合物和/或唾液酸化反应混合物包含双(2-羟乙基)氨基三(羟甲基)甲烷(bis-tris)缓冲液。
[0201]
在一些实施方案中,半乳糖基化反应混合物和/或唾液酸化反应混合物包含mncl2。
[0202]
在一些实施方案中,在孵育期间补充一种或多种反应混合物的一种或多种组分。即,反应混合物可在反应开始时包含一定量的组分(其可在反应过程期间改变),但也可在反应期间补充有附加量的组分。
[0203]
在一些实施方案中,b4galt包含为至少90%相同的seq id no:12或seq id no:13的氨基酸序列或由该氨基酸序列组成。
[0204]
在一些实施方案中,st6gal1包含为至少90%相同的seq id no:19或seq id no:20的氨基酸序列或由该氨基酸序列组成。
[0205]
在一些实施方案中,唾液酸化抗体(例如hsigg)上至少或约60%、65%、70%、75%、80%或85%的支链聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
[0206]
在一些实施方案中,唾液酸化抗体(例如hsigg)上约或至少60%、65%、70%、75%、80%或85%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
[0207]
在一些实施方案中,唾液酸化抗体(例如hsigg)的fab结构域上约或至少60%、65%、70%、75%、80%或85%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
[0208]
在一些实施方案中,唾液酸化抗体(例如hsigg)上约或至少80%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
[0209]
在一些实施方案中,唾液酸化抗体(例如hsigg)的fab结构域上约或至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
[0210]
在一些实施方案中,唾液酸化抗体(例如hsigg)上约或至少85%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
[0211]
在一些实施方案中,唾液酸化抗体(例如hsigg)的fab结构域上约或至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
[0212]
在一些实施方案中,唾液酸化抗体(例如hsigg)上约或至少90%的支链fc聚糖在α1,3分支和α1,6分支两者上具有唾液酸。
[0213]
在一些实施方案中,唾液酸化抗体(例如hsigg)的fab结构域上约或至少60%、65%、70%的支链聚糖在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
[0214]
分离和纯化方法
[0215]
本文提供了用于纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法。
[0216]
本文还提供了用于产生纯化的唾液酸化抗体(例如纯化的hsigg)的方法,该方法包括:i)产生唾液酸化抗体,例如hsigg,例如如本文所述的;以及ii)纯化唾液酸化抗体,例如如本文所述的。
[0217]
用于分离和纯化hsigg的示例性制造工艺示于图5中。本文描述了该工艺的变型。
[0218]
在一些实施方案中,用于纯化抗体的方法包括在纯化之后(例如在色谱步骤之后)分析一种或多种igg亚类的量。
[0219]
淬灭
[0220]
本文所述的方法可包括淬灭酶促反应,例如酶促唾液酸化反应,例如如本文所述的。
[0221]
在一些实施方案中,淬灭包括将包含唾液酸化抗体的组合物(例如唾液酸化反应混合物,例如如本文所述的)与缓冲液(例如磷酸盐缓冲盐水(pbs),例如5x pbs)混合,从而产生淬灭的抗体组合物。在一些实施方案中,淬灭包括将组合物和缓冲液以为或约为1∶1混合。在一些实施方案中,淬灭包括将抗体组合物和缓冲液以1体积或更多的缓冲液混合成一体积抗体组合物。
[0222]
深层过滤
[0223]
本文所述的方法可包括深层过滤。深层过滤是本领域熟知的,并且描述于例如sutherland,
″
filtration overview:a closer look at depth filtration
″
,filtration&separation第45卷第8期:第25-28页(2008年);nguyen等人,
″
improved hcp reduction using a new,all-synthetic depth filtration media within an antibody purification process
″
,biotechnology journal第14卷第1期:1700771(2019年)。
[0224]
在一些实施方案中,本文所述的方法,例如用于产生和/或纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法包括一个或多个深层过滤步骤。在一些实施方案中,该方法包括在色谱步骤之前的一个或多个深层过滤步骤。在一些实施方案中,该方法包括在色谱步骤之后的一个或多个深层过滤步骤。在一些实施方案中,该方法不包括在色谱之前的深层过滤步骤。在一些实施方案中,该方法不包括在色谱之后的深层过滤步骤。在一些实施方案中,该方法不包括深层过滤步骤。
[0225]
缓冲液交换
[0226]
本文所述的方法可包括缓冲液交换。用于缓冲液交换的方法是本领域熟知的,并且描述于例如kurnik,
″
buffer exchange using size exclusion chromatography,countercurrent dialysis,and tangential flow filtration:models,development,and industrial application
″
,biotechnology&bioengineering第45卷第2期:第149-158页(1995年);dizon-maspat等人,
″
single pass tangential flow filtration to debottleneck downstream processing for therapeutic antibody production
″
,biotechnology&bioengineering第109卷第4期:第962-970页(2012年)。
[0227]
在一些实施方案中,缓冲液交换方法是尺寸排阻色谱(sec)。在一些实施方案中,缓冲液交换方法是切向流过滤(tff)。在一些实施方案中,缓冲液交换方法是逆流透析(ccd)。
[0228]
在一些实施方案中,缓冲液交换方法是切向流过滤(tff)。
[0229]
在一些实施方案中,本文所述的方法,例如用于产生和/或纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法包括一个或多个缓冲液交换步骤。在一些实施方案中,该方法包括在色谱
步骤之前的一个或多个缓冲液交换步骤。在一些实施方案中,该方法包括在色谱步骤之后的一个或多个缓冲液交换步骤。在一些实施方案中,该方法不包括在色谱之前的缓冲液交换步骤。在一些实施方案中,该方法不包括在色谱之后的缓冲液交换步骤。在一些实施方案中,该方法不包括缓冲液交换步骤。
[0230]
病毒灭活/去除
[0231]
本文所述的方法可包括病毒灭活或病毒去除。用于病毒灭活和去除的方法是本领域熟知的,并且描述于例如horowitz等人,
″
strategies for viral inactivation
″
,current opinion in hematology第2卷第6期:第484-492页(1995年);klutz等人,
″
continuous viral inactivation at low ph value in antibody manufacturing
″
,chemical engineering and processing:process intensification第102卷:第88-11页(2016年)。
[0232]
在一些实施方案中,病毒灭活方法选自溶剂/去垢剂灭活、低ph灭活、巴氏灭菌、微波加热、辐照、高能量光以及它们的组合。
[0233]
在一些实施方案中,病毒去除方法选自亲和色谱、纳滤以及它们的组合。
[0234]
在一些实施方案中,本文所述的方法,例如用于纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法包括一个或多个病毒灭活和病毒去除步骤。在一些实施方案中,病毒灭活或病毒去除步骤在半乳糖基化和唾液酸化之后进行。在一些实施方案中,病毒灭活或病毒去除步骤在半乳糖基化和唾液酸化之后但在色谱之前进行。在一些实施方案中,病毒灭活和去除包括病毒灭活,随后进行纳滤。在一些实施方案中,该方法包括病毒去除(例如,通过纳滤),但不包括单独的病毒灭活步骤。
[0235]
纳滤
[0236]
本文所述的方法可包括纳滤。用于纳滤的膜和方法是本领域熟知的,并且描述于例如mohammad等人,
″
nanofiltration membranes review:recent advances and future prospects
″
,desalination第356卷:226-254页(2015年)。
[0237]
在一些实施方案中,本文所述的方法,例如用于产生和/或纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法包括一个或多个纳滤步骤。在一些实施方案中,该方法包括在色谱步骤之前的一个或多个纳滤步骤。在一些实施方案中,该方法包括在色谱步骤之后的一个或多个纳滤步骤。在一些实施方案中,该方法不包括在色谱之前的纳滤步骤。在一些实施方案中,该方法不包括在色谱之后的纳滤步骤。在一些实施方案中,该方法不包括纳滤步骤。
[0238]
色谱
[0239]
本文所述的方法,例如用于产生和/或纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法可包括作为纯化工艺的部分的色谱。
[0240]
在一些实施方案中,抗体结合到色谱树脂。在一些实施方案中,抗体流通色谱树脂。
[0241]
在一些实施方案中,杂质(例如酶促反应混合物(例如半乳糖基化反应混合物和/或唾液酸化反应混合物)的其他组分中的一种或多种组分,包括但不限于酶,例如b4galt
和/或st6、核苷酸糖和mncl2)结合到色谱树脂。在一些实施方案中,杂质流通色谱树脂。
[0242]
在一些实施方案中,抗体和杂质两者结合到色谱树脂。在此类实施方案中,抗体和杂质可被单独洗脱。
[0243]
蛋白a亲和色谱
[0244]
本文所述的方法,例如用于产生和/或纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法可包括亲和色谱步骤,例如蛋白a亲和色谱步骤,其中该抗体结合到色谱树脂的配体。
[0245]
用于蛋白a亲和色谱的材料和方法是本领域熟知的,并且描述于例如等人,
″
protein a chromatography:challenges and progress in the purification of monoclonal antibodies
″
,journal of separation science,2019年:doi:10.1002/jssc.201800963。
[0246]
在一些实施方案中,蛋白a亲和色谱树脂是mabselect
tm prisma(ge healthcare)。
[0247]
在一些实施方案中,蛋白a亲和色谱树脂配体选自由以下组成的组:蛋白a、蛋白a衍生物、蛋白a模拟物或它们的组合。
[0248]
在一些实施方案中,本文所述的方法包括蛋白a亲和色谱,随后进行蓝色染料色谱,例如如本文所述的。
[0249]
阳离子交换色谱
[0250]
本文所述的方法,例如用于产生和/或纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法可包括使用强阳离子交换色谱树脂的阳离子交换色谱(cex)步骤,例如强阳离子交换色谱步骤。
[0251]
在一些实施方案中,强阳离子交换树脂选自由以下组成的组:poros
tm xs(例如cytiva 4404336)、sp sepharose high performance(sp hp)(例如cytiva 28950515)、capto
tm sp impres(例如cytiva 17546815)、capto
tm s(例如cytiva 28926979)、capto
tm s impact(例如cytiva 1737174)以及它们的组合。
[0252]
poros
tm
强阳离子交换(cex)树脂是50μm的刚性聚合物离子交换色谱树脂。赛默飞公司(thermoscientific)产品信息表公布编号100031321rev.d。聚羟基表面涂层提供了低非特异性结合,并且在ph 1至14条件下与磺丙基发生表面官能化产生可离子化的强阳离子交换剂。id.载体基质是交联聚苯乙烯-二乙烯基苯,并且表面官能团是磺丙基(-ch2ch2ch2so
3-)。id.poros
tm xs的动态结合容量为≥102mg/ml(在0.46cmd
×
20cml柱中,在20mm mes<40mm nacl ph 5.0、300cm/小时条件下,多克隆人igg具有5%突破)。id.poros
tm 50 hs的动态结合容量为57.0mg/ml至75.3mg/ml(在0.46cmd
×
20cml柱中,在20mm mes ph 6.2、100cm/小时条件下,溶菌酶具有5%突破)。id.
[0253]
sp sepharose high performance(sp hp)树脂基于粒径为24μm至44μm(d
50v
约34μm)的6%交联琼脂糖基质,其使用磺丙基配体(-ch2ch2ch2so
3-)。参见产品公告
″
sp sepharose high performance
″
,cytiva.com。其具有为4至13的操作ph稳定性。id.其具有为约55核糖核酸酶a/ml树脂的动态结合容量。id.
[0254]
capto
tm sp impres基于珠粒大小为约40μm的高流动琼脂糖基础基质。产品公告
″
capto
tm sp impres、capto
tm q impres ion exchange chromatography
″
,cytiva.com。
capto
tm sp impres的官能团是-ch2ch2ch2so
3-。id.工作操作ph稳定性为4至12。结合容量为>70mg溶菌酶/ml培养基和>95mg bsa/ml培养基(在具有10cm床高度的tricorntm 5/100柱中,在4分钟停留时间(150cm/小时)、20mm磷酸钠ph 7.2(溶菌酶)和50mm tris ph 8.0(bsa)条件下,测得10%突破)。
[0255]
capto
tm s是基于高度交联琼脂糖、累积体积分布的中值粒径为约90μm的球形基质的强阳离子交换树脂,其使用下文示出的带电荷基团-so3-。
[0256][0257]
参见cytiva,
″
ion exchange resins
″
,28407452ag,cytiva.com.其动态结合容量为:>120mg溶菌酶/ml树脂(在具有10cm床高(1分钟停留时间)的tricorn
tm 5/100柱中,以600cm/小时的流动相速度对30mm磷酸钠(ph 6.8)中的溶菌酶进行前沿分析,得到10%突破);和>60mgβ-乳球蛋白/ml树脂(在具有10cm床高(1分钟停留时间)的peek 7.5/100柱中,以600cm/小时的流动相速度对100mm柠檬酸盐(ph 3)中的β-乳球蛋白进行前沿分析,得到10%突破),并且可在ph 4至12下操作。
[0258]
capto
tm s impact基于累积体积分布的中值粒径为约50μm的高流动琼脂糖基础基质,其使用-so3-配体。参见capto
tm s impact产品表,cytiva.com.其结合容量为:>85mg bsa/ml树脂、>90mg溶菌酶/ml树脂、>100mg igg/ml树脂。id.
[0259]
在一些实施方案中,强阳离子交换树脂的结合容量为50mg/ml或更高(例如75mg/ml或更高,例如100mg/ml或更高),在0.46cmd
×
20cml柱中,在20mm mes<40mm nacl ph 5.0、300cm/小时条件下,测得多克隆人igg具有5%突破。
[0260]
在一些实施方案中,强阳离子交换树脂保持结合容量为50mg/ml或更高(例如75mg/ml或更高,例如100mg/ml或更高),在0.46cmd
×
20cml柱中,在20mm mes<40mm nacl ph 5.0、300cm/小时、至多150mm nacl(15ms/cm)条件下,测得多克隆人igg具有5%突破。
[0261]
在一些实施方案中,强阳离子交换树脂的官能团包括so
3-。在一些实施方案中,强阳离子交换树脂的官能团是-ch2ch2ch2so
3-。
[0262]
在一些实施方案中,阳离子交换色谱在流通模式下进行。在一些实施方案中,阳离子交换色谱以结合和洗脱模式进行。在一些实施方案中,抗体(例如唾液酸化抗体,例如hsigg)流通阳离子交换色谱树脂。在一些实施方案中,抗体(例如唾液酸化抗体,例如hsigg)被结合,然后从阳离子交换色谱树脂中洗脱。
[0263]
在一些实施方案中,将包含唾液酸化抗体(例如,hsigg)和一种或多种杂质的组合物负载到cex柱上。在一些实施方案中,该组合物是唾液酸化反应混合物(例如包含唾液酸化抗体(例如如本文所述的)的唾液酸化混合物),并且被负载到cex柱上。
[0264]
在一些实施方案中,将为或约为10mg至为或约为110mg抗体/ml树脂负载到cex柱上。在一些实施方案中,将为或约为10mg至为或约为100mg、为或约为10mg至为或约为90mg、为或约为10mg至为或约为80mg、为或约为10mg至为或约为70mg、为或约为10mg至为或约为
60mg、为或约为10mg至为或约为50mg、为或约为10mg至为或约为40mg、为或约为10mg至为或约为30mg、为或约为10mg至为或约为20mg、为或约为20mg至为或约为110mg、为或约为20mg至为或约为100mg、为或约为20mg至为或约为90mg、为或约为20mg至为或约为80mg、为或约为20mg至为或约为70mg、为或约为20mg至为或约为60mg、为或约为20mg至为或约为50mg、为或约为20mg至为或约为40mg、为或约为20mg至为或约为30mg、为或约为30mg至为或约为110mg、为或约为30mg至为或约为100mg、为或约为30mg至为或约为90mg、为或约为30mg至为或约为80mg、为或约为30mg至为或约为70mg、为或约为30mg至为或约为60mg、为或约为30mg至为或约为50mg、为或约为30mg至为或约为40mg、为或约为40mg至为或约为110mg、为或约为40mg至为或约为100mg、为或约为40mg至为或约为90mg、为或约为40mg至为或约为80mg、为或约为40mg至为或约为70mg、为或约为40mg至为或约为60mg、为或约为40mg至为或约为50mg、为或约为50mg至为或约为110mg、为或约为50mg至为或约为100mg、为或约为50mg至为或约为90mg、为或约为50mg至为或约为80mg、为或约为50mg至为或约为70mg、为或约为50mg至为或约为60mg、为或约为60mg至为或约为110mg、为或约为60mg至为或约为100mg、为或约为60mg至为或约为90mg、为或约为60mg至为或约为80mg、为或约为60mg至为或约为70mg、为或约为70mg至为或约为110mg、为或约为70mg至为或约为100mg、为或约为70mg至为或约为90mg、为或约为70mg至为或约为80mg、为或约为80mg至为或约为110mg、为或约为80mg至为或约为100mg、为或约为80mg至为或约为90mg、为或约为90mg至为或约为110mg、为或约为90mg至为或约为100mg、或者为或约为100mg至为或约为110mg抗体(例如唾液酸化抗体,例如hsigg)/ml树脂负载到cex柱上。
[0265]
在一些实施方案中,本文所述的方法包括在cex色谱之前的以下步骤中的一者或多者:(a)淬灭步骤,例如如本文所述的;(b)深层过滤步骤,例如如本文所述的;(c)缓冲液交换步骤,例如如本文所述的;(d)病毒灭活或去除步骤,例如如本文所述的;和(e)纳滤步骤,例如如本文所述的。
[0266]
在一些实施方案中,本文所述的方法包括在cex色谱之后的以下步骤中的一者或多者:(a)蓝色染料色谱,例如如本文所述的;(b)de垫过滤,例如如本文所述的;(c)缓冲液交换,例如如本文所述的;和(d)ps20掺入和过滤,例如如本文所述的。
[0267]
本文提供了用于纯化唾液酸化抗体的方法,该方法按从(a)到(d)的顺序包括:(a)提供包含以下的组合物:唾液酸化抗体(例如hsigg)和半乳糖基化酶和/或唾液酸化酶(例如b4galt和/或st6或它们的酶活性部分,例如如本文所述的),并且例如,如果该组合物是唾液酸化反应混合物(例如如本文所述的),则任选地淬灭反应(例如如本文所述的),例如以1∶1稀释的pbs,例如5x pbs;(b)例如用柠檬酸盐缓冲液(例如,6.757g/l脱水柠檬酸钠和5.192g/l柠檬酸缓冲液)稀释该组合物,例如在为或约为50mm、为或约为ph 4.5条件下的柠檬酸盐缓冲液,从而产生缓冲抗体组合物;(c)在结合唾液酸化抗体(例如,hsigg)以及半乳糖基化酶和/或唾液酸化酶的条件下将该缓冲抗体组合物施加到cex柱,例如本文所述的cex柱;以及(d)选择性地从cex柱中洗脱唾液酸化抗体(例如hsigg),从而产生纯化的唾液酸化抗体。
[0268]
在一些实施方案中,该方法不包含在进行步骤(c)之前的除(a)和(b)之外的任何附加过滤、分馏或纯化步骤。在一些实施方案中,该方法包括在步骤(c)之前(例如在步骤(a)与(b)之间)的除步骤(a)和(b)之外的单个深层过滤步骤,但不包括在进行步骤(c)之前
的除单个深层过滤步骤之外的任何附加过滤、分馏或纯化步骤。在一些实施方案中,该方法包括在步骤(c)之前的病毒灭活步骤。在一些实施方案中,步骤(c)中的施加以时间来间隔开,例如缓冲抗体组合物的一部分通过多于一次施加(例如通过1、2或3次施加)被施加到柱上。在一些实施方案中,步骤(e)重复一次或多次。在一些实施方案中,步骤(c)以为或约为1、2、3、4、5或6分钟的停留时间进行。
[0269]
在一些实施方案中,选择性地洗脱唾液酸化抗体包括在包含400mm或更多nacl的缓冲液(例如在约或约为50mm、400mm或更多nacl,为或约为ph 4.5条件下的柠檬酸盐缓冲液)中洗脱。
[0270]
在一些实施方案中,该方法还包括在步骤(e)之后的以下步骤中的一者或多者:(f)蓝色染料色谱步骤,例如trisacyl blue(tab)色谱,例如如本文所述的;(g)de垫过滤步骤,例如如本文所述的;(h)深层过滤步骤,例如如本文所述的;和(g)ps20掺入和过滤步骤,例如如本文所述的。
[0271]
在一些实施方案中,该方法产生的产率(抗体回收率)为或约为80%、85%、90%或95%或更高,其中唾液酸化酶(例如st6或其酶活性部分)以100ppm、90ppm、80ppm、70ppm、60ppm、50ppm、40ppm或30ppm或更少存在。
[0272]
蓝色染料亲和色谱
[0273]
本文所述的方法,例如用于产生和/或纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法可包括作为纯化工艺的部分的蓝色染料亲和色谱,例如使用蓝色染料树脂的亲和色谱步骤。
[0274]
在一些实施方案中,蓝色染料树脂选自由以下组成的组:blue trisacryl
tm
(例如sartorius 25896-010)、capto
tm blue(例如cytiva 17544801)、capto
tm blue hs(例如cytiva 17545202)、blue sepharose
tm
(例如cytiva 17-0948-01)以及它们的组合。
[0275]
blue trisacryl
tm
树脂基于珠粒大小为60μm的合成聚合物基质,其使用蓝色染料配体作为官能团。参见产品说明书,sartorius 25896-010,sartorius.com.其具有为4至10的操作ph。id.
[0276]
capto
tm blue树脂基于平均粒径为75μm的高度交联琼脂糖基质。参见产品公告,
″
capto blue and capto blue(high sub)affinity chromatography
″
,cytiva.com。它们使用cibacron
tm blue(1-氨基-4-[4-[[4-氯-6-(2-磺酰苯胺)-1,3,5-三嗪-2-基]氨基]-3-磺酰苯胺]-9,10-二氧杂蒽-2-磺酸))配体。id;pubchem id 172469。它们具有为3至13的操作ph。capto
tm blue在停留时间为4分钟时在24mg/ml的10%突破下对hsa具有动态结合容量,并且capto
tm blue hs在4分钟停留时间、30mg/ml的10%突破下对hsa具有动态结合容量。id.
[0277]
blue sepharose
tm
基于累积体积分布的中值粒径为约90μm的高度交联琼脂糖基础基质(6%球形)。参见产品公告,
″
blue sepharose 6 fast flow affinity chromatography
″
,cytiva.com。其使用cibacron
tm blue 3g(1-氨基-4-[4-[[4-氯-6-(3-磺酰苯胺)-1,3,5-三嗪-2-基]氨基]-3-磺酰苯胺]-9,10-二氧杂蒽-2-磺酸))。其具有为4至12的操作ph稳定性,并且总结合容量为≥18mg人血清白蛋白/ml树脂(在peek 7.5/50柱上,将过量的蛋白质装入0.050m磷酸二氢钾(ph 7.0)中。通过测量0.050m磷酸二氢钾、1.5m氯
化钾ph 7.0中结合和洗脱的蛋白质的量来获得结合容量。)。
[0278]
在一些实施方案中,蓝色染料亲和色谱在流通模式下进行。在一些实施方案中,抗体(例如唾液酸化抗体,例如hsigg)流通蓝色染料色谱树脂。
[0279]
在一些实施方案中,将包含唾液酸化抗体(例如,hsigg)和一种或多种杂质的组合物负载到蓝色染料柱上。在一些实施方案中,该组合物是唾液酸化反应混合物(例如包含唾液酸化抗体(例如如本文所述的)的唾液酸化混合物),并且被负载到蓝色染料柱上。
[0280]
在一些实施方案中,将为或约为10mg至为或约为110mg抗体/ml树脂负载到蓝色染料柱上。在一些实施方案中,将为或约为10mg至为或约为100mg、为或约为10mg至为或约为90mg、为或约为10mg至为或约为80mg、为或约为10mg至为或约为70mg、为或约为10mg至为或约为60mg、为或约为10mg至为或约为50mg、为或约为10mg至为或约为40mg、为或约为10mg至为或约为30mg、为或约为10mg至为或约为20mg、为或约为20mg至为或约为110mg、为或约为20mg至为或约为100mg、为或约为20mg至为或约为90mg、为或约为20mg至为或约为80mg、为或约为20mg至为或约为70mg、为或约为20mg至为或约为60mg、为或约为20mg至为或约为50mg、为或约为20mg至为或约为40mg、为或约为20mg至为或约为30mg、为或约为30mg至为或约为110mg、为或约为30mg至为或约为100mg、为或约为30mg至为或约为90mg、为或约为30mg至为或约为80mg、为或约为30mg至为或约为70mg、为或约为30mg至为或约为60mg、为或约为30mg至为或约为50mg、为或约为30mg至为或约为40mg、为或约为40mg至为或约为110mg、为或约为40mg至为或约为100mg、为或约为40mg至为或约为90mg、为或约为40mg至为或约为80mg、为或约为40mg至为或约为70mg、为或约为40mg至为或约为60mg、为或约为40mg至为或约为50mg、为或约为50mg至为或约为110mg、为或约为50mg至为或约为100mg、为或约为50mg至为或约为90mg、为或约为50mg至为或约为80mg、为或约为50mg至为或约为70mg、为或约为50mg至为或约为60mg、为或约为60mg至为或约为110mg、为或约为60mg至为或约为100mg、为或约为60mg至为或约为90mg、为或约为60mg至为或约为80mg、为或约为60mg至为或约为70mg、为或约为70mg至为或约为110mg、为或约为70mg至为或约为100mg、为或约为70mg至为或约为90mg、为或约为70mg至为或约为80mg、为或约为80mg至为或约为110mg、为或约为80mg至为或约为100mg、为或约为80mg至为或约为90mg、为或约为90mg至为或约为110mg、为或约为90mg至为或约为100mg、或者为或约为100mg至为或约为110mg抗体(例如唾液酸化抗体,例如hsigg)/ml树脂负载到蓝色染料柱上。
[0281]
在一些实施方案中,将为或约为10mg至或为或约为110厘克抗体/ml树脂负载到蓝色染料柱上。在一些实施方案中,将为或约为10厘克至为或约为100厘克、为或约为10厘克至为或约为90厘克、为或约为10厘克至为或约为80厘克、为或约为10厘克至为或约为70厘克、为或约为10厘克至为或约为60厘克、为或约为10厘克至为或约为50厘克、为或约为10厘克至为或约为40厘克、为或约为10厘克至为或约为30厘克、为或约为10厘克至为或约为20厘克、为或约为20厘克至为或约为110厘克、为或约为20厘克至为或约为100厘克、为或约为20厘克至为或约为90厘克、为或约为20厘克至为或约为80厘克、为或约为20厘克至为或约为70厘克、为或约为20厘克至为或约为60厘克、为或约为20厘克至为或约为50厘克、为或约为20厘克至为或约为40厘克、为或约为20厘克至为或约为30厘克、为或约为30厘克至为或约为110厘克、为或约为30厘克至为或约为100厘克、为或约为30厘克至为或约为90厘克、为或约为30厘克至为或约为80厘克、为或约为30厘克至为或约为70厘克、为或约为30厘克至
为或约为60厘克、为或约为30厘克至为或约为50厘克、为或约为30厘克至为或约为40厘克、为或约为40厘克至为或约为110厘克、为或约为40厘克至为或约为100厘克、为或约为40厘克至为或约为90厘克、为或约为40厘克至为或约为80厘克、为或约为40厘克至为或约为70厘克、为或约为40厘克至为或约为60厘克、为或约为40厘克至为或约为50厘克、为或约为50厘克至为或约为110厘克、为或约为50厘克至为或约为100厘克、为或约为50厘克至为或约为90厘克、为或约为50厘克至为或约为80厘克、为或约为50厘克至为或约为70厘克、为或约为50厘克至为或约为60厘克、为或约为60厘克至为或约为110厘克、为或约为60厘克至为或约为100厘克、为或约为60厘克至为或约为90厘克、为或约为60厘克至为或约为80厘克、为或约为60厘克至为或约为70厘克、为或约为70厘克至为或约为110厘克、为或约为70厘克至为或约为100厘克、为或约为70厘克至为或约为90厘克、为或约为70厘克至为或约为80厘克、为或约为80厘克至为或约为110厘克、为或约为80厘克至为或约为100厘克、为或约为80厘克至为或约为90厘克、为或约为90厘克至为或约为110厘克、为或约为90厘克至为或约为100厘克、或者为或约为100厘克至为或约为110厘克抗体(例如唾液酸化抗体,例如hsigg)/ml树脂负载到蓝色染料柱上。
[0282]
在一些实施方案中,本文所述的方法包括在蓝色染料色谱之前的以下步骤中的一者或多者:(a)淬灭步骤,例如如本文所述的;(b)深层过滤步骤,例如如本文所述的;(c)缓冲液交换步骤,例如如本文所述的;(d)病毒灭活或去除步骤,例如如本文所述的;和(e)纳滤步骤,例如如本文所述的;或(f)cex色谱步骤,例如如本文所述的。
[0283]
在一些实施方案中,该方法不包括cex色谱步骤。
[0284]
在一些实施方案中,本文所述的方法包括在蓝色染料色谱之后的以下步骤中的一者或多者:(a)de垫过滤,例如如本文所述的;(b)缓冲液交换,例如如本文所述的;和(c)ps20掺入和过滤,例如如本文所述的。
[0285]
本文提供了用于纯化唾液酸化抗体的方法,该方法按从(a)到(c)的顺序包括:(a)提供包含以下的组合物:唾液酸化抗体(例如hsigg)和半乳糖基化酶和/或唾液酸化酶(例如b4galt和/或st6或它们的酶活性部分,例如如本文所述的),并且例如,如果该组合物是唾液酸化反应混合物(例如如本文所述的),则任选地淬灭反应(例如如本文所述的),例如以1∶1稀释的pbs,例如5x pbs;(b)将组合物稀释在适合与柱一起使用的缓冲液中,例如含有柠檬酸盐缓冲液的tab柱,例如含有为或约为800mm nacl的为或约为100mm、为或约为ph 4.5的柠檬酸盐缓冲液;或者例如captblue柱,在为或约为ph 4.5时为或约为250mm甘氨酸加为或约为100mm氯化钠中,从而产生缓冲抗体组合物;以及(c)在允许80%或更多(例如85%或更多、90%或更多、或95%或更多)的唾液酸化抗体(例如hsigg)流通,但允许仅30、40、50、60、70、80、90或100ppm或更少的半乳糖基化酶和/或唾液酸化酶流通的条件下,将缓冲抗体组合物施加到蓝色染料柱,例如本文所述的蓝色柱,从而产生纯化的唾液酸化抗体。
[0286]
在一些实施方案中,该方法不包含在进行步骤(c)之前的除(a)和(b)之外的任何附加过滤、分馏或纯化步骤。在一些实施方案中,该方法包括在步骤(c)之前(例如在步骤(a)与(b)之间)的除步骤(a)和(b)之外的单个深层过滤步骤,但不包括在进行步骤(c)之前的除单个深层过滤步骤之外的任何附加过滤、分馏或纯化步骤。在一些实施方案中,该方法包括在步骤(c)之前的病毒灭活步骤。在一些实施方案中,步骤(c)中的施加以时间来间隔开,例如缓冲抗体组合物的一部分通过多于一次施加(例如通过1、2或3次施加)被施加到柱
上。在一些实施方案中,步骤(c)以为或约为1、2、3、4、5或6分钟的停留时间进行。
[0287]
在一些实施方案中,该方法还包括在步骤(c)之后的以下步骤中的一者或多者:(d)cex色谱步骤,例如如本文所述的;(e)de垫过滤步骤,例如如本文所述的;(f)深层过滤步骤,例如如本文所述的;和(g)ps20掺入和过滤步骤,例如如本文所述的。
[0288]
在一些实施方案中,该方法还包括在步骤(c)之后的以下步骤中的一者或多者:(d)de垫过滤步骤,例如如本文所述的;(e)深层过滤步骤,例如如本文所述的;和(f)ps20掺入和过滤步骤,例如如本文所述,但不包括例如如本文所述的cex色谱步骤。
[0289]
在一些实施方案中,该方法产生的产率(抗体回收率)为或约为80%、85%、90%或95%或更高,其中唾液酸化酶(例如st6或其酶活性部分)以100ppm、90ppm、80ppm、70ppm、60ppm、50ppm、40ppm或30ppm或更少存在。
[0290]
聚山梨醇酯掺入
[0291]
可将聚山梨醇酯(例如聚山梨醇酯20)添加到包含本文所述的抗体(例如hsigg,例如纯化的hsigg)的组合物中。在一些实施方案中,该聚山梨醇酯为聚山梨醇酯20。在一些实施方案中,聚山梨醇酯20是superrefined
tm
聚山梨醇酯20(croda health care)。
[0292]
沉淀
[0293]
本文所述的方法可包括沉淀。在一些实施方案中,该沉淀是硫酸铵沉淀。
[0294]
在一些实施方案中,本文所述的方法,例如用于纯化抗体(例如igg、例如混合igg、例如ivig、例如唾液酸化igg、例如唾液酸化的混合igg、例如唾液酸化ivig、例如hsigg)的方法包括硫酸铵沉淀。
[0295]
变体
[0296]
在一些实施方案中,本文所述的酶与示例性序列(例如,如本文所提供)的氨基酸序列具有至少80%,例如至少85%、90%、95%、98%或100%同一性,例如,在被置换的示例性序列的至多1%、2%、5%、10%、15%或20%残基处具有差异,例如具有保守性突变,例如包括本文所述的突变或除本文所述的突变以外。在优选的实施方案中,变体保留亲本的期望活性,例如β-半乳糖苷α-2,6-唾液酸转移酶活性或β-1,4-半乳糖基转移酶活性。
[0297]
为了确定两个核酸序列的同一性百分比,以最佳比较目的对序列进行比对(例如,为了最佳比对可以在第一和第二氨基酸或核酸序列中的一个或两个中引入空位并且出于比较目的可以忽略非同源序列)。用于比较目的的参考序列的长度是参考序列的长度的至少80%,并且在一些实施方案中为至少90%或100%。然后比较相应氨基酸位置或核苷酸位置处的核苷酸。当第一序列中的位置被与第二序列中的相应位置相同的核苷酸占据时,则分子在该位置处是相同的(如本文所用,核酸
″
同一性
″
相当于核酸
″
同源性
″
)。两个序列之间的百分比同一性是序列所共有的相同位置数目的函数,考虑到空位的数目和每个空位的长度,需要引入这些参数用于两个序列的最佳比对。
[0298]
受试者多肽或核酸序列(即查询序列)与第二多肽或核酸序列(即目标序列)之间的同一性百分比以本领域技术范围内的各种方式确定,例如,使用公开可用的计算机软件,诸如smith waterman alignment(smith,t.f.和m.s.waterman(1981年),j mol biol,第147卷:第195-197页);
″
bestfit
″
(smith和waterman,
″
advances in applied mathematics
″
,第482-489页(1981年)),如并入到genematcher plus
tm
中,schwarz和dayhof(1979年),
″
atlas of protein sequence and structure
″
,dayhof,m.o.编辑,第353-358
页;blast program(基本局部比对搜索工具);(altschul,s.f.,w.gish等人(1990年),j mol biol,第215卷:第403-410页)、blast-2、blast-p、blast-n、blast-x、wu-blast-2、align、align-2、clustal或megalign(dnastar)软件。另外,本领域技术人员可以确定用于测量比对的适当参数,包括在待比较的序列的长度上实现最大比对所需的任何算法。一般而言,对于靶蛋白或核酸,比较的长度可以是任何长度,至多并且包括目标的全长(例如,5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%)。出于本公开的目的,同一性百分比是相对于查询序列的全长。
[0299]
出于本公开的目的,序列的比较和两个序列之间的同一性百分比的确定可以使用blossum 62评分矩阵来实现,其空位罚分为12,空位延伸罚分为4且移码空位罚分为5。
[0300]
保守性取代通常包括以下组内的取代:甘氨酸、丙氨酸;缬氨酸、异亮氨酸、亮氨酸;天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺;丝氨酸、苏氨酸;赖氨酸、精氨酸;和苯丙氨酸、酪氨酸。
[0301]
实施例
[0302]
在以下实施例中进一步描述本发明,实施例不限制权利要求中描述的本发明的范围。
[0303]
实施例1:高唾液酸化igg制剂
[0304]
可以如下制备其中总支链聚糖的超过60%是二唾液酸化的igg。
[0305]
简言之,使igg抗体混合物暴露于使用β1,4半乳糖基转移酶1(b4galt)和α2,6-唾液酸转移酶(st6gal1)的依次酶促反应。不需要在添加st6gal1之前从反应中去除b4galt,并且在酶促反应之间不需要部分或完全纯化产物。
[0306]
半乳糖基转移酶选择性地将半乳糖残基添加到预先存在的天冬酰胺连接的聚糖。所得的半乳糖基化聚糖用作唾液酸转移酶的底物,其选择性地添加唾液酸残基以封端附接到其上的天冬酰胺连接的聚糖结构。因此,总唾液酸化反应采用两种糖核苷酸(尿苷5
′‑
二磷酸半乳糖(udp-gal)和胞苷-5
′‑
单磷酸-n-乙酰神经氨酸(cmp-nana))。定期补充后者以相对于单唾液酸化产物增加二唾液酸化产物。该反应包括辅因子氯化锰。
[0307]
以ivig开始的此类反应和反应产物的igg-fc聚糖图谱的代表性示例示于图4中。在图4中,左图是用于将igg转化为hsigg的酶促唾液酸化反应的示意图;右图是起始ivig和hsigg的igg fc聚糖图谱。在该研究中,经由糖肽质谱分析得出不同的igg亚类的聚糖图谱。用于定量不同igg亚类的糖肽的肽序列是:igg1=eeqynstyr(seq id no:1)、igg2/3 eeqfnstfr(seq id no:2)、igg3/4 eeqynstfr(seq id no:3)和eeqfnstyr(seq id no:4)。
[0308]
聚糖数据按igg亚类示出。来自igg3和igg4亚类的聚糖不能单独定量。如所示,对于ivig,所有未唾液酸化聚糖的总和大于80%,并且所有唾液酸化聚糖的总和小于20%。对于反应产物,所有未唾液酸化聚糖的总和小于20%,并且所有唾液酸化聚糖的总和大于80%。糖图谱中列出的不同聚糖的命名使用n连接的聚糖的oxford符号。
[0309]
实施例2:替代性唾液酸化条件
[0310]
用于半乳糖基化和唾液酸化以在50mm bis-tris ph 6.9中产生hsigg的替代性合适反应条件包括:igg抗体(例如,混合igg抗体、混合免疫球蛋白或ivig)的半乳糖基化如下:7.4mm mncl2;38μmol udp-gal/g igg抗体;和7.5单位b4galt/g igg抗体,在37℃孵育16小时至24小时,然后在7.4mm mncl2中进行唾液酸化;220μmol cmp-nana/g igg抗体(添
加两次:一半在反应开始时,一半在9小时至10小时后);和15个单位的st6-gal1/g igg抗体,在37℃孵育30小时至33小时。可以通过将st6-gal1和cmp-nana添加到半乳糖基化反应中来进行该反应。另选地,可以在开始时将所有反应物组合并补充cmp-nana。
[0311]
实施例3:hsigg的纯化
[0312]
期望具有用于纯化例如通过本文所述的方法中的任一种方法制备的hsigg的经济有效的方法。为了制备适用于药物产品的hsigg,期望在用于制备hsigg的反应中有效地去除酶、糖核苷酸和锰。此外,可能期望减少或消除对缓冲液交换的需求。最后,由于hsigg可包括各种igg亚类(例如,igg1、igg2等),因此可能期望采用产生纯化产物的方法,该纯化产物不会过度改变未纯化材料的亚类分布。
[0313]
检查蛋白a柱色谱。检查洗涤条件,包括简单盐(nacl,na2so4)和离液盐(精氨酸,mgcl2、kscn)、缓冲液(磷酸盐、tris、bis-tris、乙酸盐、甲酸盐、乙醇酸盐、柠檬酸盐、mops)、有机改性剂(乙二醇、丙二醇)、添加剂(咪唑、甲基吡喃半乳糖苷、乳糖)和ph。
[0314]
使用mabselect prisma柱(ge healthcare life sciences),负载经过滤的反应混合物(优选地在ph 7.4的50mm mops中),然后用50mm乙酸钠ph 4.99洗涤,并用甘氨酸ph 3.0洗脱,产生的hsigg具有类似于最初负载的材料的亚类图谱(负载:igg1 68%;igg230%;igg31.8%和igg4 1.4%;洗脱液:igg1 70%;igg229%;igg30.9%和igg41.1%)。该柱步骤基本上去除st6-gal。蛋白质a柱步骤之后是在流通模式下采用blue trisacryl m(pall corp.)柱的抛光步骤。在此处,加载缓冲液是0.4m nacl、50mm柠檬酸钠ph 4.5,洗涤缓冲液是2m nacl,50mm磷酸钠ph 7.0。这提供了非常纯净的产品。具有琼脂糖基础树脂的不同类型的蓝色染料柱(hitrap blue hp;ge healthcare life sciences)用于结合和洗脱模式。在此处,负载于50mm柠檬酸钠ph4.5中并且在1.5m kcl、32.5mm柠檬酸钠、35%乙二醇ph4.51中洗脱提供了非常纯净的产品。
[0315]
实施例4:纯化工艺和改进
[0316]
图5所示和下文所述的以下hsigg制造工艺的各种改进描述于实施例5至7中。
[0317]
在唾液酸化(图5中的步骤4)之后,该工艺包括将反应材料与5x pbs以1∶1稀释来淬灭反应。将经淬灭的反应混合物进行深层过滤以去除颗粒(图5中的步骤5),并经缓冲液交换到50mm tris、100mm nacl、10mm edta ph 8.0缓冲液中以用于六个渗滤体积,然后将缓冲液交换到250mm甘氨酸ph 5.0(图5中的步骤6)。该缓冲液交换步骤是去除反应组分,如核苷酸和氯化锰。另外,edta缓冲液是螯合剂,其也应从溶液中去除氯化锰。
[0318]
在甘氨酸缓冲液中,工艺材料的ph降低至3.5以用于病毒灭活。将其保持在低ph下达90分钟,然后淬灭,并将ph升至4.5(图5中的步骤7)。将经淬灭的病毒灭活池用50mm柠檬酸盐、400mm nacl ph 4.5稀释低至4.5mg/ml,然后通过深层过滤器/纳米过滤器组合(图5中的步骤8)。然后将滤液经缓冲液交换到50mm柠檬酸盐、400mm nacl ph 4.5中以用于6个渗滤体积,并浓缩至30mg/ml(图5中的步骤9)。最终材料在色谱纯化步骤之前进行最后一次深层过滤(图5中的步骤10)。
[0319]
第一纯化步骤(图5中的步骤11)在流通模式下使用强阳离子交换树脂poros
tm xs。这意味着将材料直接负载到柱上,并在流出物中收集产物,而杂质(st6、b4galt)粘附到树脂上。然后将流通物负载到三丙烯酸基蓝色(tab)柱上,该柱也在流通模式下运行(图5中的步骤12)。tab树脂还具有去除反应酶的显著能力。
[0320]
实施例5:结合和洗脱模式下的强阳离子交换树脂
[0321]
该工艺包括在色谱之前的两个tff步骤(缓冲液交换/一个浓度)、三个深层过滤步骤和两次稀释。这些步骤代价大(材料/缓冲液/操作时间/损失产品)。在色谱纯化之前减少步骤数降低了成本、操作时间和材料损失量,同时仍去除了反应杂质(例如,核苷酸、酶、氯化锰)。
[0322]
如本文所述,可通过在结合和洗脱模式下,用50mm柠檬酸盐ph 4.5稀释经淬灭(5x pbs)的反应混合物并且使用强阳离子交换树脂poros
tm xs,从该工艺中消除图5中的步骤5至10。反应混合物将结合到poros
tm xs强阳离子交换树脂,而核苷酸和氯化锰流通到废液中。在此处,可使用当前工艺中使用的相同50mm柠檬酸盐、400mm nacl ph 4.5溶液来选择性地洗脱结合的材料。将需要更高盐浓度用于洗脱的酶保持与柱结合。另外,洗脱产物现在位于tab树脂纯化所需的相同缓冲液中。
[0323]
树脂筛选
[0324]
评价五种不同的强阳离子交换树脂将ivig与掺入溶液中的st6分离的能力:poros
tm xs、capto
tm s、capto
tm sp impres、sp hp和capto
tm s impact。通过将0.55ml ivig(100mg/ml)与50mm柠檬酸盐ph 4.5以1∶10稀释,然后掺入3.3ml的st6(16mg/ml)中来制备负载材料。对于每种树脂,将8ml的负载材料施加到柱上,然后通过线性梯度洗脱到50mm柠檬酸盐,1m nacl ph 4.5中。通过观察色谱图以及通过使用unicorn计算下式所示的峰分离度(t为平均保留时间,w为峰宽)来评价每种树脂分离ivig与st6的能力。分离度计算结果(表9)表明poros
tm xs对于从st6分离ivig表现最佳。
[0325][0326]
表9.树脂的分离度。
[0327]
树脂分离度capto
tm s impact0.87capto
tm s0.37capto
tm sp impres0.90sp hp1.01poros
tm xs1.17
[0328]
结合容量确定
[0329]
在流通模式下操作poros
tm
树脂是有利的,因为流通模式允许仅一个循环以及更小树脂需求,因为树脂仅需要结合杂质。在结合和洗脱模式下使用poros
tm xs树脂时,完全处理所需的循环次数取决于该树脂一次可结合多少产物。通过将ivig与50mm柠檬酸盐ph 4.5以1∶20稀释来制备负载溶液。在2分钟、4分钟和6分钟停留时间下将负载溶液施加到柱上,并在5%突破下评价结合容量。图6表明通过操作高于4分钟停留时间而获得的容量不多,低于色谱操作的标准5分钟停留时间。另外,该容量在约96mg/ml树脂时非常高。
[0330]
产率和残留st6评价
[0331]
通过多次运行评价产率和不同负载容量的残留st6以及洗脱缓冲液电导率,以鉴定最佳洗脱条件和负载容量(表10)。通过将2.8g的ivig和500μl的st6(15.6mg/ml)稀释,并
将该溶液与50mm柠檬酸盐ph 4.5以1:20稀释来制备负载溶液。所有步骤均在5分钟停留时间下操作。负载材料在st6中为2,700ppm。
[0332]
表10.
[0333][0334][0335]
统计分析表明洗脱电导率是针对收率和残留st6两者的回归模型中的唯一显著参数。图7中的预测图谱表明增加的负载容量对产率没有统计意义上的显著影响。
[0336]
图8示出了针对90%至95%之间的产率和小于30ppm的残留st6水平的操作范围。白色空间示出了表明39ms/cm至44ms/cm之间的洗脱电导率可用于小于55mg/ml树脂的负载容量的操作范围。随着负载容量的增加,该范围变得更窄。这些结果基本上证实了50mm柠檬酸盐、400mm nacl ph 4.5(400mm nacl对应于40ms/cm电导率)是用于洗脱缓冲液的最佳选项。
[0337]
hsivig反应混合物的纯化
[0338]
对使用mops中开发的唾液酸化程序产生的hsivig执行多次运行(表11)。用5x pbs以1∶1稀释度来淬灭hsivig反应混合物,然后用50mm柠檬酸盐ph 4.5稀释。将50mm柠檬酸盐、400mm nacl ph 4.5用作以下所有运行的洗脱缓冲液。7.15mg/ml的浓度对应于用50mm柠檬酸盐ph 4.5以1∶20稀释。将五分钟停留时间用于所有步骤。
[0339]
表11.
[0340][0341][0342]
如图9中流通物的sec色谱图所示,流通步骤不含igg,仅含核苷酸和氯化锰。
[0343]
这可与图10中洗脱液的sec进行比较,该图示出了保留时间为6.8分钟的二聚体峰和保留时间为7.8分钟的单体峰。
[0344]
结果概要
[0345]
这些结果表明,通过将反应混合物直接稀释到50mm柠檬酸盐ph 4.5中并负载到相同poros
tm xs树脂上,当前的hsivig工艺得到了显著改进。将hsivig结合到树脂允许以更简单的路径去除核苷酸和氯化锰(通过先前的缓冲液交换实现)。使用50mm柠檬酸盐、400mm nacl ph 4.5,显然可实现显著的st6酶清除率。另外,poros
tm xs洗脱液池在适当的条件下用于后续tab纯化步骤。
[0346]
在制造规模工艺中,仍可使用单个深层过滤步骤。唾液酸化反应混合物通常是非常浑浊的,并且不适合直接负载到色谱树脂上。因此,在将经淬灭的反应混合物与50mm柠檬酸盐ph 4.5稀释之后,可在负载到poros
tm xs树脂上之前,对工艺材料进行深层过滤。
[0347]
实施例6:替代性柱
[0348]
m254的当前制造工艺在流通模式下使用三丙烯酸基蓝色(tab)柱,该柱不能承受高浓度的氢氧化钠洗涤。这导致一些批次中的生物负荷的水平更高。已经评价了不同的蓝色树脂,并且已经发现capto
tm blue high sub(capto
tm blue hs)是具有相似回收率和更好酶清除率的tab柱的良好替代品。另外,capto
tm blue high sub可承受高氢氧化钠洗涤,并且具有减少当前纯化工艺的步骤数的潜力。
[0349]
capto
tm blue和blue sepharose
tm
的评价
[0350]
已经针对tab评价两种色谱树脂,以确定回收率是否受到影响。出于该目的,将250mg ivig以1∶1稀释在800mm nacl 100mm柠檬酸盐ph 4.5中,并且以一式三份直接负载。这些运行中的一次运行的色谱图叠层示于图11中,而三次运行的回收率报告于图12中。可看出,回收率(99%)不受影响。
[0351]
capto
tm blue和capto
tm blue hs的比较
[0352]
已经比较capto
tm blue和capto
tm blue hs以评价回收率和酶清除率。在直接负载或稀释之后负载任一hsigiv(后强阳离子交换柱流通材料)的情况下执行多次运行。表12总结了不同负载条件,而表13示出了质量平衡:
[0353]
表12:负载条件。
[0354][0355]
如图13所示,运行1和4的叠层色谱图看起来非常相似。
[0356]
表13:capto
tm b和capto
tm blue hs的回收率
[0357]
capto
tm blue运行质量平衡(%)反萃取(%)运行1(capto
tm b)97.52.2运行2(capto
tm b)96.72.2运行3(capto
tm b hs)99.64.9运行4(capto
tm b hs)96.26.7
[0358]
capto
tm blue hs的回收率与capto
tm blue非常相似,并且96%回收率被认为是令人满意的,可用于实现代替tab柱。
[0359]
还评价了在capto
tm blue和capto
tm blue hs之后的残留st6,并且发现即使不低于tab,也和tab一样低,如图14和图15所示。
[0360]
使用capto
tm blue hs对产品属性的影响
[0361]
将capto
tm blue hs流通物和洗脱液中的ivig与负载物进行比较,以评价对产品质量的影响。比较了负载物、流通物和洗脱液的分析sec;未发现差异,如图16和表14所示。
[0362]
表14.聚集体、二聚体和单体的水平非常相似
[0363][0364]
通过质谱评价igg亚类分布(图17)。对两种来源的ivig在流通模式下进行了capto
tm blue high sub之前和之后的分析比较,未发现变化。
[0365]
实施例7:阳离子交换柱的消除
[0366]
capto
tm blue hs
[0367]
为了减少当前制造工艺步骤数,评价了不同条件并且评价了残留的st6:
[0368]
·
运行1:在capto
tm blue hs流通的实验中,使用651ppm残留st6作为负载测试材料,以评价作为负载缓冲液的5x pbs和mops(ph 4.5)缓冲液,该负载缓冲液将模拟在反应之后将材料直接负载到柱中。
[0369]
·
运行2:使用250mm甘氨酸ph 4.5将具有1400ppm残留st6的后病毒灭活材料直接负载到capto
tm blue hs树脂上。
[0370]
·
运行3:使用250mm甘氨酸 100mm氯化钠ph 4.5将具有1400ppm残留st6的后病毒灭活材料直接负载到capto
tm blue hs树脂上。
[0371]
评价三次运行的残留st6,如图18(运行1)、图19(运行2)和图20(运行3)所示。将反应混合物直接负载到capto
tm blue high sub上可显著降低st6的水平。然而,即使在100mm nacl的情况下,增加盐量对残留st6也有负面影响。
[0372]
trisacryl blue(tab)
[0373]
当前制造工艺具有两个色谱柱,cex,然后是tab,以减少酶促反应期间添加的st6的水平。历史制造的原料药批次的st6的残留水平为2.5ppm至7.2ppm。使用tab柱的历史制造工艺的最大负载为1.1g ivig/ml树脂(1x)。
[0374]
在本研究中,执行tab柱运行以理解增加负载容量并且从当前制造工艺中消除cex柱的可行性。
[0375]
预填充1ml tab柱以用于负载研究。用从1.5kg gmp运行批次#20006获得的cex负载和cex洗脱液执行tab柱负载研究运行。通过使用akta avant 150来执行tab柱运行。将负载流速保持在0.17ml/分钟,以实现类似于制造柱操作的停留时间。收集负载流通级分,通过a280测量蛋白质浓度,并且通过elisa确定st6的残留水平。
[0376]
如图21所示,当负载0.1g/ml至1.1g/ml时,tab柱流通级分的残留st6的水平为0.1ppm至9ppm,其中x轴是累积蛋白流通。如果混合这些流通级分,则估计st6水平约为5ppm(具有1.1g/ml负载)是合理的,换句话讲,类似于历史制造的原料药批次。本研究的结果证实tab柱的最大负载应保持<1.1g/ml,以维持ds批次中的st6水平。对于制造规模的cex负载和cex洗脱液,st6值的水平分别为161ppm和62ppm,表明当前制造工艺中的cex柱降低了st6的水平。
[0377]
在本研究中,用cex负载执行tab柱运行,换句话讲,无需cex柱纯化。如图21所示,具有两种负载材料(即,cex负载(无需cex柱纯化,161ppm)和cex洗脱液(如当前制造工艺中的cex柱,62ppm))的tab柱流通级分(0.1ppm至9ppm)的st6值的残留水平相似。
[0378]
本研究中的结果表明,tab柱的最大负载为1.1g/ml,以降低原料药的st6水平≤7.2ppm,类似于历史生产运行(st6水平2.5ppm至7.2ppm)。另外,本研究中的结果表明,在没有cex柱的情况下,tab柱有效地降低了st6的水平以满足当前目标(原料药≤7.2ppm)。
[0379]
实施例8:硫酸铵沉淀
[0380]
通过在低温下使用乙醇或聚乙二醇沉淀,以某些方法从人血浆中分离和纯化ivig。在此处,我们使用硫酸铵去除残留st6评价hsivig沉淀。
[0381]
出于该目的,如下沉淀ivig和hsivig。通过在搅拌的同时将粉末直接添加到100ml水中来制备硫酸铵饱和溶液。一旦沉淀了大量粉末,就将溶液搅拌30分钟,然后从沉淀物中倾析并按原样添加到ivig溶液中。添加饱和硫酸铵溶液直到ivig的溶液变白并且没有看到颜色变化。通过离心或通过无菌过滤收集沉淀物。
[0382]
图22示出了经沉淀的ivig与起始ivig和经沉淀的材料的叠层,并且图23示出了用无菌过滤作为收集沉淀材料的方式,在沉淀前后的hsivig。可清楚地看出,在约11分钟时洗脱的核苷酸的去除。如表15所示,残留的st6酶也存在显著减少。
[0383]
从单个实验中,我们可看出可通过沉淀去除残留的酶。通过过滤收集材料时看到的聚集物不是问题,因为过滤不是收集ivig的方式。
[0384]
表15.硫酸铵沉淀结果
[0385][0386]
序列
[0387]
seq id no:1(igg1)
[0388]
eeqynstyr
[0389]
seq id no:2(igg2/3)
[0390]
eeqfnstfr
[0391]
seq id no:3(igg3/4)
[0392]
eeqynstfr
[0393]
seq id no:4(igg3/4)
[0394]
eeqfnstyr
[0395]
seq id no:5(np_001488.2 b4galt1[生物体=智人][基因id=2683][同工型=1])
[0396]
mrlrepllsgsaampgaslqracrllvavcalhlgvtlvyylagrdlsrlpqlvgvstplqggsnsaaaigqssgelrtggarpppplgassqprpggdsspvvdsgpgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtps
[0397]
seq id no:6(np_001365424.1 b4galt1[生物体=智人][基因id=2683][同工型=2])
[0398]
mpgaslqracrllvavcalhlgvtlvyylagrdlsrlpqlvgvstplqggsnsaaaigqssgelrtggarpppplgassqprpggdsspvvdsgpgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtps
[0399]
seq id no:7(np_001365425.1 b4galt1[生物体=智人][基因id=2683][同工型=3])
[0400]
mrlrepllsgsaampgaslqracrllvavcalhlgvtlvyylagrdlsrlpqlvgvstplqggsnsaaaigqssgelrtggarpppplgassqprpggdsspvvdsgpgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtps
[0401]
seq id no:8(np_001365426.1 b4galt1[生物体=智人][基因id=2683][同工型=4])
[0402]
mrlrepllsgsaampgaslqracrllvavcalhlgvtlvyylagrdlsrlpqlvgvstplqggsnsaaaigqssgelrtggarpppplgassqprpggdsspvvdsgpgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqyekirrllw
[0403]
seq id no:9
[0404]
mrlrepllsgsaampgaslqracr
[0405]
seq id no:10
[0406]
llvavcalhlgvtlvyylag
[0407]
seq id no:11
[0408]
rdlsrlpqlvgvstplqggsnsaaaigqssgelrtggarpppplgassqprpggdsspvvdsgpgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtps
[0409]
seq id no:12(b4galt)
[0410]
gpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtps
[0411]
seq id no:13(b4galt)
[0412]
gssplldmgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtpsprdhhhhhhh
[0413]
seq id no:14(np_001340845.1(np_003023.1,np_775323.1)st6gal1[生物体=智人][基因id=6480][同工型=a])
[0414]
mihtnlkkkfsccvlvfllfavicvwkekkkgsyydsfklqtkefqvlkslgklamgsdsqsvsssstqdphrgrqtlgslrglakakpeasfqvwnkdsssknliprlqkiwknylsmnkykvsykgpgpgikfsaealrchlrdhvnvsmvevtdfpfntsewegylpkesirtkagpwgrcavvssagslkssqlgreiddhdavlrfngaptanfqqdvgtkttirlmnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihc
[0415]
seq id no:15(np_775324.1 st6gal1[生物体=智人][基因id=6480][同工型=b])
[0416]
mnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihc
[0417]
seq id no:16
[0418]
mihtnlkkk
[0419]
seq id no:17
[0420]
fsccvlvfllfavicvw
[0421]
seq id no:18
[0422]
kekkkgsyydsfklqtkefqvlkslgklamgsdsqsvsssstqdphrgrqtlgslrglakakpeasfqvwnkdsssknliprlqkiwknylsmnkykvsykgpgpgikfsaealrchlrdhvnvsmvevtdfpfntsewegylpke
sirtkagpwgrcavvssagslkssqlgreiddhdavlrfngaptanfqqdvgtkttirlmnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihc
[0423]
seq id no:19(st6gal1)
[0424]
akpeasfqvwnkdsssknliprlqkiwknylsmnkykvsykgpgpgikfsaealrchlrdhvnvsmvevtdfpfntsewegylpkesirtkagpwgrcavvssagslkssqlgreiddhdavlrfngaptanfqqdvgtkttirlmnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihc
[0425]
seq id no:20(st6gal1)
[0426]
gssplldmlehhhhhhhhmakpeasfqvwnkdsssknliprlqkiwknylsmnkykvsykgpgpgikfsaealrchlrdhvnvsmvevtdfpfntsewegylpkesirtkagpwgrcavvssagslkssqlgreiddhdavlrfngaptanfqqdvgtkttirlmnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihc
[0427]
其他实施方案
[0428]
应当理解,虽然已结合本发明的具体实施方式描述了本发明,但是前述描述旨在说明而非限制由随附权利要求书所限定的本发明的范围。其他方面、优点和修改均在以下权利要求书的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
