1.本发明属于药物化学领域,具体涉及式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,含有该化合物的连接子,及含有该连接子的抗体偶联药物,还涉及这些化合物的制备方法以及这些化合物用于成像、诊断和/或治疗疾病或病症的用途。
背景技术:
2.诊疗一体药物是一种双功能系统,既有治疗前景,又有成像的特征。它们在个性化癌症治疗以及高精度癌症成像方面特别有吸引力。靶向给药的前药能够选择性地靶向癌细胞,提供细胞毒性化疗药物,并允许在体外和体内对抗癌药物的位置和疗效进行简单的监测。但诊疗一体前药仍处于研究早期,目前没有药物进入临床研究,其可能的原因为靶向性不足,半衰期短。
3.抗体偶联药物由高细胞毒药物通过化学连接子与单抗偶联得到,通过单抗将高活性细胞毒药物靶向肿瘤组织,实现增效减毒。抗体偶联药物(antibody-drug-conjugate,adc)作为一种平台技术,具有广阔的应用前景。fda已批准mylotarg,adcetris,kadcyla,besponsa,lumoxiti,polivy,padcev以及enhertu等8个adc药物上市,并有超过80个adc处于临床研究,并在肿瘤,感染,免疫等多个领域显示出了巨大的应用潜力。
4.adc作为一种已经被临床验证过的高效靶向递送体系,如果能成功的引入成像的性质,则有可能成为首个具有临床应用潜力的诊疗一体药物。同时其对于adc的临床前研究也有重大意义。其有助于明确adc的作用机制,快速推动adc的临床前开发。
5.adc采用特定的连接子将抗体和小分子细胞毒药物连接起来,抗体分子主要发挥靶向投递作用,小分子药物发挥效应。理想的连接子在循环中稳定,在细胞内能被释放,例如在溶酶体内酶切释放,或抗体降解后释放。adc最常见的释药过程依赖于对氨基卞醇(p-aminophenylmethyl alcohol,pab)氨基暴露以后,驱动电子转移释放药物。pab可以使药物更完整有效的释放(j med chem,1981,24(5):479-480),目前该结构已广泛应用于各种linker和毒素的设计中。例如pab广泛应用于抗肿瘤adc中,如adcetris/polivy(marketd),immu-132(marketd),rovalpituzumab tesirine(phaseⅲ),syd985(phaseⅲ)等,同时pab在抗菌和免疫adc领域也得到应用,如dsta4637s(phaseⅰ)。
[0006][0007]
作为大分子前药,释药过程研究是adc的核心研究之一。传统方法依赖于液质或者同位素标记(cancer res.66,4426
–
4433;j.pharm.biomed.anal.115,300
–
306.),这种方法操作非常复杂而且不能直观实现药物释放监测。诊疗一体的adc也有助于释药过程的研究。
[0008]
制备诊疗一体的adc存在巨大挑战,如何在保留adc优秀药效的前提下,引入荧光性质,一直是研究人员尝试解决的问题。
技术实现要素:
[0009]
发明人设计合成了式i所示香豆素衍生物,包括7-氨基-3-羟乙基香豆素和7-氨基-3-羟甲基香豆素。该化合物同时具备荧光开-关特性和电子自消除特性,可以作为荧光探针。发明人令人惊讶地发现用该化合物置换传统adc药物中的pab,得到的adc不仅具有优秀的释药性,保留了原有的药效,还具有优越的荧光性质。基于这一发现,本发明得以完成。
[0010]
本发明提供式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,
[0011][0012]
其中,r为h或c
1-4
烷基。
[0013]
在某些实施方案中,本发明提供的式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h、甲基、乙基、正丙基或正丁基。
[0014]
在某些实施方案中,本发明提供的式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h、甲基、乙基或正丙基。
[0015]
在某些实施方案中,本发明提供的式i所示化合物或其几何或光学异构体、盐、水
合物、溶剂化物或多晶型物,其中r为h、甲基或乙基。
[0016]
在某些实施方案中,本发明提供的式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h或甲基。
[0017]
在某些实施方案中,本发明提供的式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为甲基。
[0018]
在某些实施方案中,本发明提供的式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中所述式i所示化合物选自:
[0019][0020]
本发明还提供式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物作为荧光探针的用途。
[0021]
本发明还提供式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物在制备抗体偶联药物中的用途。
[0022]
本发明还提供式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,
[0023][0024]
其中:
[0025]
b为
[0026]
x为-(ch2)mo(ch2)
n-,-(ch2)mo(ch2)
n-c(o)-,-(ch2)
m-c(o)nh-(ch2)
n-,-(ch2)
m-c(o)nh-(ch2ch2o)
n-ch
2-ch
2-c(o)-,-(ch2ch2o)
m-(ch2)
n-c(o)-,-(ch2)
m-(ch2ch2o)
n-c(o)-,-(och2ch2)
m-,-(ch2)
m-,-(ch2)
m-c(o)-,
[0027]
l为
[0028]
r为h或c
1-4
烷基;
[0029]
z为羟基,卤素(例如氟、氯、溴、碘)或
[0030]
m为1、2、3、4、5、6、7、8或9(例如5);
[0031]
n为1、2、3、4、5、6、7、8或9(例如2、4、8);
[0032]
p为0、1、2、3或4;
[0033]
r1为氢、氟、氯、溴、碘、c
1-4
烷基、硝基或c
1-4
烷氧基。
[0034]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,
[0035]
b为
[0036]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,
[0037]
b为
[0038]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,x为-(ch2)
m-c(o)-或-(ch2)
m-c(o)nh-(ch2ch2o)
n-ch
2-ch
2-c(o)-,其中m和n的定义本发明所述。
[0039]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,x为-(ch2)
5-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
2-ch
2-ch
2-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
4-ch
2-ch
2-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
6-ch
2-ch
2-c(o)-或(ch2)
5-c(o)nh-(ch2ch2o)
8-ch
2-ch
2-c(o)-。
[0040]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,
[0041]
l为
[0042]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,
[0043]
l为
[0044]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水
合物、溶剂化物或多晶型物,其中,r为h、甲基、乙基、正丙基或正丁基。
[0045]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,r为h、甲基、乙基或正丙基。
[0046]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,r为h、甲基或乙基。
[0047]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,r为h或甲基。
[0048]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,r为甲基。
[0049]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中,
[0050]
z为oh或
[0051]
在某些实施方案中,本发明提供的式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中所述化合物选自:
[0052]
[0053][0054]
本发明还提供式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物在制备抗体偶联药物中的用途。
[0055]
本发明还提供式iii所示的化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,
[0056][0057]
其中:
[0058]
b为
[0059]
x为-(ch2)mo(ch2)
n-,-(ch2)mo(ch2)
n-c(o)-,-(ch2)
m-c(o)nh-(ch2)
n-,-(ch2)
m-c(o)nh-(ch2ch2o)
n-ch
2-ch
2-c(o)-,-(ch2ch2o)
m-(ch2)
n-c(o)-,-(ch2)
m-(ch2ch2o)
n-c(o)-,-(och2ch2)
m-,-(ch2)
m-,-(ch2)
m-c(o)-,
[0060]
m为1、2、3、4、5、6、7、8或9(例如5);
[0061]
n为1、2、3、4、5、6、7、8或9(例如2、4、8);
[0062]
l为
[0063]
r为h或c
1-4
烷基;
[0064]
d为0或1;
[0065]
c为活性化合物,选自药物,细胞毒素,检测试剂,诊断试剂或靶向载体;优选地,b为细胞毒素,抗肿瘤药物,抗病毒药物,抗感染药物或免疫调节剂药物;进一步优选地,b为细胞毒素,例如微管蛋白抑制剂、dna烷化剂、dna嵌合剂、酶抑制剂、抗代谢药物、肽或核苷酸;
[0066]
c通过活性化合物分子中的n原子或o原子偶联至羰基(即位点*)或z基团。
[0067]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中
[0068]
b为
[0069]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中
[0070]
b为
[0071]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中x为-(ch2)
m-c(o)-或-(ch2)
m-c(o)nh-(ch2ch2o)
n-ch
2-ch
2-c(o)-,其中m和n的定义如本发明所述。
[0072]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中x为-(ch2)
5-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
2-ch
2-ch
2-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
4-ch
2-ch
2-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
6-ch
2-ch
2-c
(o)-或(ch2)
5-c(o)nh-(ch2ch2o)
8-ch
2-ch
2-c(o)-。
[0073]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中
[0074]
l为
[0075]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中
[0076]
l为
[0077]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h、甲基、乙基、正丙基或正丁基。
[0078]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h、甲基、乙基或正丙基。
[0079]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h、甲基或乙基。
[0080]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h或甲基。
[0081]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为甲基。
[0082]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中c选自:奥里斯他汀(auristatin),单甲基奥里斯他汀e(mmae),美登木素(maytansine)或其衍生物(例如类美登木素、dm1、dm3、dm4),紫杉醇,卡里奇霉素,倍癌霉素,多柔比星,喜树碱,pbd(pyrrolobenzodiazepines)类细胞毒素及其衍生物。
[0083]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中c为单甲基奥里斯他汀e(mmae)。
[0084]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中所述化合物选自:
[0085][0086][0087]
其中c的定义如权利要求7或8所述。
[0088]
在某些实施方案中,本发明提供的式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中所述化合物选自:
[0089][0090]
[0091]
本发明还提供式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物在制备抗体偶联药物中的用途。
[0092]
本发明还提供式ⅳ所述化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,
[0093][0094]
其中:
[0095]
x为-(ch2)mo(ch2)
n-,-(ch2)mo(ch2)
n-c(o)-,-(ch2)
m-c(o)nh-(ch2)
n-,-(ch2)
m-c(o)nh-(ch2ch2o)
n-ch
2-ch
2-c(o)-,-(ch2ch2o)
m-(ch2)
n-c(o)-,-(ch2)
m-(ch2ch2o)
n-c(o)-,-(och2ch2)
m-,-(ch2)
m-,-(ch2)
m-c(o)-,
[0096]
m为1、2、3、4、5、6、7、8或9(例如5);
[0097]
n为1、2、3、4、5、6、7、8或9(例如2、4、8);
[0098]
l为
[0099]
r为h或c
1-4
烷基;
[0100]
c为活性化合物,选自药物,细胞毒素,检测试剂,诊断试剂或靶向载体;优选地,b为细胞毒素,抗肿瘤药物,抗病毒药物,抗感染药物或免疫调节剂药物;进一步优选地,b为细胞毒素,例如微管蛋白抑制剂、dna烷化剂、dna嵌合剂、酶抑制剂、抗代谢药物、肽或核苷酸;
[0101]
c通过活性化合物分子中的n原子或o原子偶联至羰基(即位点*)或z基团;
[0102]
d为0或1;
[0103]
a为靶向化合物,选自蛋白、抗体、多肽、酶和小分子;
[0104]
e为1至8之间的数。
[0105]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中x为-(ch2)
m-c(o)-或-(ch2)
m-c(o)nh-(ch2ch2o)
n-ch
2-ch
2-c(o)-,其中m和n的定义如本发明所述。
[0106]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中x为-(ch2)
5-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
2-ch
2-ch
2-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
4-ch
2-ch
2-c(o)-,(ch2)
5-c(o)nh-(ch2ch2o)
6-ch
2-ch
2-c(o)-或(ch2)
5-c(o)nh-(ch2ch2o)
8-ch
2-ch
2-c(o)-。
[0107]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中
[0108]
l为
[0109]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中
[0110]
l为
[0111]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h、甲基、乙基、正丙基或正丁基。
[0112]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h、甲基、乙基或正丙基。
[0113]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h、甲基或乙基。
[0114]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为h或甲基。
[0115]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中r为甲基。
[0116]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中c选自:奥里斯他汀(auristatin),单甲基奥里斯他汀e(mmae),美登木素(maytansine)或其衍生物(例如类美登木素、dm1、dm3、dm4),紫杉醇,卡里奇霉素,倍癌霉素,多柔比星,喜树碱,pbd(pyrrolobenzodiazepines)类细胞毒素及其衍生物。
[0117]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中c为单甲基奥里斯他汀e(mmae)。
[0118]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中a是以巯基为偶联位点的单克隆抗体,或以巯基为偶联位点的定点突变或修饰的单克隆抗体。
[0119]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中a通过靶向化合物分子中的s原子偶联至位点#上。
[0120]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中a选自:抗her2人源化单克隆抗体mil40、曲妥珠单抗(herceptin),帕妥珠单抗(perjeta),西妥昔单抗(erbitux),帕尼单抗(vectibix),利妥昔单抗(rituxan),阿仑单抗(campath),替伊莫单抗(zevalin),托西莫单抗(bexxar),奥法木单抗(arzerra),贝伐单抗(avastin),伊匹单抗(yervoy),地诺单抗(xgeva),派姆单抗
(keytruda),纳武单抗(opdivo),avelumab(bavencio),atezolizumab(tecentriq),durvalumab(imfinzi),sacituzumab,rovalpituzumab,及其生物类似物。
[0121]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中a为抗her2人源化单克隆抗体mil40。
[0122]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中e为2至7之间的数,优选地,e为3至6之间的数或4至5之间的数,更优选地,e约为4。
[0123]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中所述化合物选自:
[0124]
[0125][0126]
其中a、c、e的定义如本发明所述。
[0127]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中所述化合物选自:
[0128][0129][0130]
其中a、e的定义如本发明所述。
[0131]
在某些实施方案中,本发明提供的式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,其中所述化合物选自:
[0132]
[0133][0134]
其中e的定义如本发明所述,
[0135]
为抗体,优选为单克隆抗体(mab),进一步优选为抗her2人源化单克隆抗体mil40。
[0136]
本发明还提供制备式i所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物的方法,包括:
[0137][0138]
还原式i-g所示化合物,得到式i所示化合物;
[0139]
优选地,用水合肼和三氯化铁还原式i-g所示化合物。
[0140]
本发明还提供制备式ii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物的方法,包括:
[0141]
[0142]
1)使式i-a所示化合物与式i所示化合物反应,得到式i-b所示化合物;
[0143]
2)使式i-b所示化合物脱去fmoc保护基,得到式i-c所示化合物;
[0144]
3)使式i-c所示化合物与式i所示化合物反应,得到式i-d所示化合物;
[0145]
4)使i-d所示化合物与式ii所示化合物反应,得到式ii所示化合物,
[0146]
其中r、b、x、l、z的定义如本发明所述,r’为h或其中r1和p的定义如本发明所述。
[0147]
本发明还提供制备式iii所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物的方法,包括:
[0148][0149]
使式ii所示化合物与c代表的活性化合物反应,得到式iii所示化合物,
[0150]
其中r、b、x、l、z、c、d的定义本发明所述。
[0151]
本发明还提供制备式iv所示化合物、其几何或光学异构体、其药学上可接受的盐、溶剂化物或多晶型物的制备方法,包括:
[0152][0153]
使式iii所示化合物与a反应,得到式iv所示的化合物,
[0154]
优选地,所述反应在ph=5~10,温度为0~40℃条件下进行;
[0155]
其中r、x、l、z、c、d、a、e的定义如本发明所述,b为
[0156]
本发明还提供药物组合物,其包含至少一种式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物,以及一种或多种药用载体或赋形剂。
[0157]
在某些实施方案中,本发明还提供的药物组合物,其中所述的化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物以诊断或治疗的有效量存在。
[0158]
本发明还提供式iv所示化合物或其几何或光学异构体、盐、水合物、溶剂化物或多晶型物在制备用于诊断和/或治疗疾病或病症的药物中的用途,其中所述疾病或病症选自肿瘤、感染性疾病、血液学疾病、代谢性疾病、炎症。
[0159]
在某些实施方案中,所述肿瘤选自癌症、淋巴瘤、淋巴样肿瘤、母细胞瘤、肉瘤和白血病。
[0160]
在某些实施方案中,所述癌症选自:乳腺癌(例如,her2阳性的乳腺癌);鳞状细胞癌(例如,上皮鳞状细胞癌);肺癌,包括小细胞肺癌、非小细胞肺癌、肺的腺癌和肺的鳞癌;腹膜癌;肝癌;胃癌;胃肠癌;膜腺癌;胶质母细胞瘤;宫颈癌;卵巢癌;肝癌;膀肮癌;尿道癌;肝细胞瘤;乳腺癌;肠癌;结肠癌;直肠癌;结肠直肠癌;子宫内膜癌;子宫癌;唾液腺癌;肾癌或肾癌;前列腺癌;外阴癌;甲状腺癌;肝癌;肛门癌;阴茎癌;黑色素瘤;多发性骨髓瘤和b细胞淋巴瘤;脑癌;胆囊癌;食管癌;胆管癌;头颈癌和相关转移瘤。
[0161]
定义
[0162]
如本文所用,术语“抗体”是一种常见的免疫性球蛋白,是免疫系统用来识别并中和外来物(如细菌和病毒)的y形蛋白。抗体可以特异性识别外来靶标的独特部分(称为抗原),是由于y形蛋白抗体的的每个尖端含有可对抗原特异性识别的位点,抗体对特异性抗原结合后,可以介导多种相关的生物效应。抗体由两条相同的重链和两条相同的轻链组成,各链间通过半肮氨酸残基中的巯基形成二硫键相连接。“单克隆抗体”是单一特异性抗体,其所有抗体分子均由均作为唯一亲代细胞的克隆的相同免疫细胞组成,因此所有抗体分子是相同的。
[0163]
如本文所用,术语“细胞毒素”是指那些在癌细胞中释放后可对该细胞产生毒性的分子。在本发明中特别关注的毒素包括甲基奥里斯他汀e(mmae),奥里斯他汀、美登木素或其衍生物(例如类美登木素、dm1、dm3、dm4)、卡里奇霉素、倍癌霉素、多柔比星、喜树碱或pbd类细胞毒素。
[0164]
如本文所用,术语“连接子”是具有两个反应活性末端的分子,其一个末端可与抗体相偶联,另一个末端用于与活性化合物,例如细胞毒素相偶联。连接子的抗体偶联性末端通常为能够通过抗体上的半胱氨酸的巯基或赖氨酸胺基相偶联的位点,连接子的毒素的偶联性末端通常为能够通过毒素分子中的上的巯基、氨基、羧基或羟基等活性位点,当术语连接子用于描述偶联形式的连接子时,由于连接子已与抗体和细胞毒素中的一个或两个相反应形成共价键,因此,其可能将不再不包括一个或两个反应性末端反应位点(如巯基反应性基团的离去基团、胺基反应性基团的离去基团)。
[0165]
如本文所用,术语“抗体偶联药物”或“adc”是通过连接子偶联多分子(通常为1-8个)的细胞毒素于抗体分子上形成的产物。缀合于一个或多个细胞毒素的抗体通常为对癌症的特异抗原具有选择性的单克隆抗体。
[0166]
如本文所用,术语“约”可理解为在所述值的 /-10%、 /-9%、 /-8%、 /-7%、 /-6%、 /-5%、 /-4%、 /-3%、 /-2%、 /-1%、 /-0.5%、 /-0.4%、 /-0.3%、 /-0.2%、 /-0.1%以内。除非另外根据上下文显而易见,否则本文提供的所有数值都由术语“约”修饰。
[0167]
本发明所述的抗体偶联药物所关注的肿瘤疾病类型包括但不限于癌症、乳腺癌、淋巴瘤、淋巴样肿瘤、母细胞瘤、肉瘤和白血病。这样的癌症的更具体的实例包括鳞状细胞癌(例如,上皮鳞状细胞癌);肺癌,包括小细胞肺癌、非小细胞肺癌、肺的腺癌和肺的鳞癌;腹膜癌;肝癌;胃癌或胃癌,包括胃肠癌;膜腺癌;胶质母细胞瘤;宫颈癌;卵巢癌;肝癌;膀肮癌;尿道癌;肝细胞瘤;乳腺癌,包括例如her2阳性乳腺癌;结肠癌;直肠癌;结肠直肠癌;子宫内膜或子宫癌;唾液腺癌;肾癌或肾癌;前列腺癌;外阴癌;甲状腺癌;肝癌;肛门癌;阴茎癌;黑色素瘤;骨髓瘤和b细胞淋巴瘤;脑癌;头颈癌和相关转移瘤。
[0168]
如本文所用,术语“盐”指保留某化合物的生物有效性和性质的盐,它们用于药物中在生物学或其它方面是符合需要的。本发明中术语“盐”通常是指药学上可接受的盐。在许多情况下,本文所公开的化合物能够借助氨基和/或竣基或类似基团的存在形成酸和/或碱盐。药学上可接受的酸加成盐可由无机酸和有机酸组成。可以衍生形成盐的无机酸包括,例如,盐酸、氢溴酸、硫酸、硝酸、磷酸等。可以衍生形成盐的有机酸包括,例如,醋酸、丙酸、羟基乙酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、反丁烯二酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。药学上可接受的碱加成盐可由无机碱和有机碱组成。可以衍生形成盐的无机碱包括,比如,钠、钾、锂、铵、钙、镁、铁、锌、铜、猛、铝等;特别优选的是铵,钾,钠,钙和镁盐。可以衍生形成盐的有机碱包括,例如,伯,仲和叔胺,取代的胺,包括天然存在的取代胺,环胺,碱性离子交换树脂等,具体地例如异丙胺,三甲胺,二乙胺,三乙胺,三丙胺和乙醇胺。许多这类盐是本领域已知的,如w087/05297,johnston等人描述的,出版于1987年9月11日(通过引用将其整体并入本文)。
[0169]
如本文所用,c
l-4
中“1和4”是指在指定基团中碳原子的数目。也就是说,该组可以包含从“1”到“4”的(包括端点的)碳原子数。因此,例如,“c
1-4
烷基”指的是具有1~4个碳原子的所有烷基,即,ch3、ch3ch2、ch3ch2ch
2-、(ch3)2ch-、ch3ch2ch2ch
2-、ch3ch
2 ch(ch3)-和(ch3)3c-。
[0170]
如本文所用的术语“卤素”,是指该元素周期表第7列中的放射性稳定的原子中的任何一个,例如,氟、氯、溴、碘等,其中氯为首选。
[0171]
本文中,代表抗体,优选为单克隆抗体(mab),进一步优选为抗her2人源化单克隆抗体mil40。
[0172]
缩写/缩略语
[0173]
adc(antibody-drug conjugate):抗体偶联药物;
[0174]
dar(drug to antibody ratio):抗体药物摩尔比;
[0175]
dcm(dichloromethane):二氯甲烷;
[0176]
dipea(n,n-diisopropylethylamine):二异丙基乙胺;
[0177]
dmac(dimethylacetamide):n,n-二甲基乙酰胺;
[0178]
dmf(n,n-dimethylformamide):n,n-二甲基甲酰胺;
[0179]
dmso(dimethyl sulphoxide):二甲基亚砜;
[0180]
ea(ethyl acetate):乙酸乙酯;
[0181]
her2(human epidermal growth factor receptor 2):人表皮生长因子受体2;
[0182]
mab(monoclonal antibody):单克隆抗体
[0183]
mmae(monomethyl auristatin e):单甲基奥里斯他汀e;
[0184]
nmm(n-methylmorpholine):n-甲基吗琳;
[0185]
nac(n-acetyl-l-cysteine):n-乙酰半胱氨酸;
[0186]
pe(petroleum ether):石油醚;
[0187]
tcep(tris(2-carboxyethyl)phosphine):三(2-羧乙基)膦;
[0188]
thf(tetrahydrofuran):四氢呋喃;
[0189]
tris(tris(hydroxymethyl)aminomethane):三羟甲基氨基甲烷;
[0190]
如本文所述的药物组合物包含本发明式iv所示化合物或其几何或光学异构体、药
学上可接受的盐、水合物、溶剂化物或多晶型物,与常规药用载体或赋形剂。该药物组合物可通过例如口服或非肠道,例如静脉注射、腹腔注射、肌肉注射、皮下注射,等途径给药。
[0191]
如本文所用,术语“有效量”是指足以实现所需治疗效果的量,例如,实现减轻与待治疗疾病相关的症状的量。
[0192]
另外需要指出,本发明化合物使用剂量和使用方法取决于诸多因素,包括患者的年龄、体重、性别、自然健康状况、营养状况、化合物的活性强度、服用时间、代谢速率、病症的严重程度以及诊治医师的主观判断。优选的使用剂量介于0.001-1000mg/kg体重/天。
[0193]
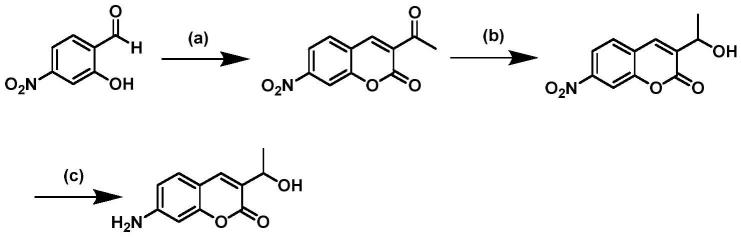
在某些实施方案中,本发明涉及的7-氨基-3-羟甲基香豆素的通用合成步骤如下:
[0194][0195]
其中的反应试剂和反应条件如下:
[0196]
(a)bh3,thf,0℃-20℃,20h;(b)mno2,dcm,r.t.,15h;(c)sodium propionate,tea,170℃,8h;(d)aibn,ccl4,80℃,15h;(e)agno3,acetone,50℃,1h;(f)cecl3,nabh4,0℃,30min;(g)fecl
3 6h2o,n2h
4 h2o。
[0197]
在某些实施方案中,本发明涉及的7-氨基-3-羟乙基香豆素的通用合成步骤如下:
[0198][0199]
其中的反应试剂和反应条件如下:
[0200]
(a)ethyl acetoacetate,piperidine,etoh,reflux,1.5h;(b)nabh4,cecl3,meoh/thf=1:1,0℃,1.5h;(c)fecl3,n2h4·
h2o,c,etoh,reflux,2h。
[0201]
某些实施方案中,本发明所述的含香豆素前药的合成路线如下:
[0202][0203]
其中的反应试剂和反应条件如下:
[0204]
(a)nhs,dcc,thf,rt,16h,30%yield;(b)fmoc-va,nmm,t3p,thf,0℃,3h,33%yield;(c)pbr3,dmf,0℃,15min,rt,6h,91%yield;(d)cddo-me,k2co3,h2o,rt,overnight,rt,3h,51%yield。
[0205]
某些实施方案中,本发明所述的含香豆素的连接子的合成路线如下:
[0206][0207]
其中的反应试剂和反应条件如下:
[0208]
(a)amino coumarin,t3p,nmm,thf,0℃,3.5h;(b)dmf,piperidine,rt,1h;(c)dipea,dmf,rt,12h;(d)bis(4-nitrophenyl)carbonate,dipea,dmf,rt,12h。
[0209]
某些实施方案中,本发明所述的含连接子的adc的合成路线如下:
[0210]
其中的反应试剂和反应条件如下:
[0211]
(a)mmae,dipea,hobt,dmf,12h;(b)mab,tcep,nac,h2o,rt。
[0212]
本发明所提供的式ii所示化合物是一种化学可裂解型连接子。本发明所提供的含有香豆素的连接子的抗体偶联药物,其在释放荷载的同时,实现实现荧光的开-关。其理论
上的释药模式如下所示。
[0213][0214]
发明的有益效果
[0215]
本发明提供了式i所示香豆素衍生物,包括7-氨基-3-羟乙基香豆素和7-氨基-3-羟甲基香豆素。该化合物同时具备荧光开-关特性和电子自消除特性,可以作为荧光探针。由于具有自消除特性,该化合物还可作为自消除片段应用于adc药物的设计中,代替传统的pab片段,所得adc可作为诊疗一体药物。
[0216]
本发明用该化合物置换传统adc药物中的pab片段,得到的adc不仅具有优秀的释药性,保留了原有的药效,还具有优越的荧光性质。
[0217]
本发明提供的诊疗一体adc,其显示了优秀的靶向性,疗效和成像特性。在疗效上,本发明的诊疗一体adc与传统含pab的adc表现出相似的细胞毒性,在体内药效中诊疗一体adc与上市adc药物t-dm1表现了相同的抑瘤效果。同时由于融入了成像特性,本发明提供的诊疗一体adc可以在细胞水平实时监控有效荷载的释放。
附图说明
[0218]
图1为化合物
ⅰ‑
2的紫外吸收图谱和荧光发射图谱;
[0219]
图2为
ⅲ‑
21所示含香豆素的连接子-mmae偶联物的体外荧光光谱;
[0220]
图3为
ⅳ‑
11所示adc体外细胞毒实验结果;
[0221]
图4为
ⅳ‑
21所示adc的细胞荧光成像实验结果;
[0222]
图5为
ⅳ‑
21所示adc在两种异种移植动物模型上的体内药效实验结果。
具体实施方式
[0223]
下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图
和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
[0224]
除非特别说明,本发明采用的试剂、方法和设备为本领域常规试剂、方法和设备。除非特别说明,本发明实施例所用试剂均为市购。
[0225]
实施例1:7-氨基-3-羟甲基香豆素(
ⅰ‑
1)的合成
[0226][0227]
(1)
ⅰ‑
1b的制备
[0228]
在磁力搅拌条件下,于5l三口圆底烧瓶中加入
ⅰ‑
1a(100g,546mmol,1eq.),干燥thf(1.5l),得灰色浑浊液,冰水浴下开始滴加2.0m bh3的四氢呋喃溶液(1.5l,3000mmol,5eq.)分三批次滴加,每批次间隔2h,共计耗时8h滴加完毕。然后自然升至室温继续反应15h得棕色透明溶液。冰水浴下向反应液缓慢加入甲醇约300ml,淬灭反应,浓缩除去溶剂,然后加水2l,ea(1l*3)萃取,有机相用饱和氯化钠水溶液(500ml*2)洗涤,无水na2so4(3g)干燥。浓缩有机相,得红黑色固体粗品
ⅰ‑
1b约80g,无需纯化直接投下一步。
[0229]
(2)
ⅰ‑
1c的制备
[0230]
在磁力搅拌条件下,于3l单口梨形瓶中加入(1)中获得的
ⅰ‑
1b粗品(100g,591mmol,1eq.)、dcm(2.5l),室温下一次性加入二氧化锰(500g,5.7mol,10eq),室温下搅拌过夜(共约15h),得近黑色浑浊液。漏斗中加入硅藻土和硅胶,抽滤,滤液呈黄色澄清。浓缩所得滤液得土黄色固体
ⅰ‑
1c约66g。无需纯化直接投下一步。
[0231]
(3)
ⅰ‑
1d的制备
[0232]
在磁力搅拌条件下,于1l单口梨形瓶中加入一次加入(2)中所得
ⅰ‑
1c(50g,293mmol,1eq),丙酸酐(195g 1496mmol,5eq.),丙酸钠(71.8g,747mmol,1eq.),三乙胺(36.3g,350mmol,1.2eq.),搅拌5min,转入170℃油浴中,在回流条件下搅拌8h,得黑色浑浊液。反应液冷却至室温,加水,ea(1l*2)萃取,水洗三遍后,有机相干燥浓缩,过硅胶柱层析(乙酸乙酯:石油醚=1:3(v/v))纯化得黄色固体
ⅰ‑
1d约30g。
[0233]
(4)
ⅰ‑
1e的制备
[0234]
在磁力搅拌条件下,于5l单口梨形瓶中加入
ⅰ‑
1d(60g,292mmol,1eq.)、n-溴代丁二酰亚胺(260g,1495mmol,5eq.)和四氯化碳(3l),得到的反应液呈黄色浑浊,搅拌5min,转入95℃油浴中回流搅拌约48h,得棕色透明反应液。将反应液浓缩除去溶剂,加入ea,抽滤,
收集滤液,然后浓缩,过硅胶柱(乙酸乙酯:石油醚=1:3(v/v)),得黄色固体
ⅰ‑
1e约25g。
[0235]
(5)
ⅰ‑
1f的制备
[0236]
在磁力搅拌条件下,于500ml单口梨形瓶中加入(4)中所得
ⅰ‑
1e(25g,69mmol,1eq.),然后加入丙酮(约300ml),搅拌至
ⅰ‑
1e完全溶解,得浅棕色透明溶液。50℃下缓慢滴加硝酸银(26g,153mmol,2.2eq.)的水溶液,体系中不断析出白色固体,硝酸银滴加完成后,停止搅拌,补加200ml丙酮,然后继续搅拌30min,抽滤,收集滤液,浓缩滤液,加入ea萃取,水洗三次,有机相浓缩得黄色固体约20g,pe/ea=5/1(v/v)打浆,抽滤得标题化合物
ⅰ‑
1f约11g。1h nmr(dmso-d6,400mhz):δ10.05(s,1h),8.76(s,1h),8.30-8.23(m,3h)。ms(esi)m/z:220.02[m h]
。
[0237]
(6)
ⅰ‑
1g的制备
[0238]
在磁力搅拌条件下,于250ml单口梨形瓶中加入(5)中所得
ⅰ‑
1f(11g,50.6mmol,1eq),甲醇300ml。冰水浴下加入氯化铈(13.6g,55.6mmol,1.1eq.),搅拌,得浅黄色浑浊液。缓慢分批加入硼氢化钠(2.04g,55.6mmol,1.1eq.),约10min加完。搅拌30min,体系稍粘稠。反应液加水(500ml),加入ea(500ml*2)萃取。合并有机相,水洗2遍,干燥浓缩得黄色固体
ⅰ‑
1g约10g。
[0239]
(7)
ⅰ‑
1的制备
[0240]
在磁力搅拌条件下,于1l单口梨形瓶中加入乙醇(500ml),室温下加入(6)中所得
ⅰ‑
1g(10g,45mmol,1eq.)和六水合氯化铁(2.4g,8mmol,0.2eq),室温下搅拌至混合物呈棕色浑浊液。然后再加入80%水合肼(27g,426mmol,12eq.)和活性炭(6.5g,541mmol,13eq.),转入95℃油浴中回流搅拌3h,得黑色浑浊反应液。浓缩除去溶剂,加入dmf搅拌30min,漏斗中加入硅藻土和硅胶,抽滤,得棕黄色滤液,用dmf多洗几次滤饼后,收集滤液,浓缩除去dmf,得棕色固体7g。再用ea打浆除去多余dmf和少许颜色。得棕色固体
ⅰ‑
1约5.6g。1h nmr(dmso-d6,400mhz):δ7.71(s,1h),7.34-7.32(d,j=8hz,1h),6.56-6.53(d,j=12hz,1h),6.44(s,1h),6.07(s,1h),5.23(br,1h),4.28(s,2h)。ms(esi)m/z:192[m h]
。
[0241]
实施例2:7-氨基-3-羟乙基香豆素(
ⅰ‑
2)的合成
[0242][0243]
(1)
ⅰ‑
2b的制备
[0244]
将2-羟基-4-硝基苯甲醛(5.00g,30mmol)和乙酰乙酸乙酯(4.6ml,36mmol)加入到349μl的哌啶中,搅拌回流1.5小时,将黄色固体分离,随后用乙醇洗涤,得到中间体
ⅰ‑
2b(4.00克,57.1%的产量)。1h nmr(dmso-d6,400mhz):δ8.74
–
8.73(d,j=4hz,1h),8.29
–
8.28(m,1h),8.22
–
8.21(d,j=4hz,2h),2.61(s,3h).
13
c nmr(dmso-d6,400mhz):δ195.12,157.74,154.18,150.02,144.92,132.09,127.31,123.44,119.35,111.69,30.11.ms m/z[m
h]
:234.04。
[0245]
(2)
ⅰ‑
2c的制备
[0246]
在甲醇和四氢呋喃(1:1(v/v),200ml)的混合溶液中加入(1)中所得
ⅰ‑
2b(2.40g,10.30mmol)和氯化铈(2.54g,10.3mmol),所得混合溶液在0℃条件下加入硼氢化钠(390mg,10.30mmol),反应约1.5小时。反应完全后,将反应液在真空中浓缩,然后通过柱色谱(etoac/hexanes=1:1.5(v/v))进行纯化,得到
ⅰ‑
2c为黄色固体(1.80克,74.3%的产量)。1h nmr(dmso-d6,400mhz):δ8.24
–
8.23(d,j=4hz,1h),8.19
–
8.17(m,2h),8.09
–
8.06(d,j=12hz,1h),5.60
–
5.55(br,1h),4.75
–
4.70(q,j=4hz,1h),1.36
–
1.34(d,j=8hz,3h).
13
c nmr(dmso-d6,400mhz):δ159.11,152.13,148.20,137.40,135.50,129.67,124.66,119.24,111.61,63.84,22.86.ms m/z[m]
:.235.1。
[0247]
(3)
ⅰ‑
2的制备
[0248]
将中间体
ⅰ‑
2c(500mg,2.13mmol)、六水氯化铁(115mg,0.45mmol)、水合肼(1.50g,25.6mmol)和活性炭(305mg,将25.6mmol)与无水乙醇(30ml)混合并加热回流2h。过滤溶液并在真空中浓缩滤液,并且通过柱层析法(1:1etoac/己烷)纯化粗产物,得到
ⅰ‑
2为白色固体(300mg,68.8%产率)。1h nmr(dmso-d6,400mhz):δ7.77(s,1h),7.36
–
7.34(d,j=8hz,1h),6.55
–
6.52(dd,j=4hz,1h),6.42
–
6.41(d,j=4hz,1h),6.07(s,2h),5.46
–
5.34(br,1h),4.65
–
4.60(q,j=4hz,1h),1.28
–
1.26(d,j=8hz,1h).
13
c nmr(dmso-d6,400mhz):δ160.82,155.21,152.70,137.94,129.35,125.94,111.65,108.65,98.35,63.55,23.44.ms m/z[m na]
:228.06。
[0249]
实施例3:含香豆素的连接子的合成
[0250][0251]
(1)ii-21b的制备
[0252]
将fmoc-va(ii-11a,240mg,0.59mmol)加入到50ml茄形瓶中,采用无水thf(15ml)全部溶解后,冰浴下冷却15min,先滴入nmm(59mg,0.59mmol),后缓慢滴入含50%t3p(丙基磷酸酐)的乙酸乙酯(696μl,1.17mmol),冰浴下搅拌反应20min,将实施例2制备的i-2(100mg,0.49mmol)用thf(4ml)溶解后缓慢滴入上述反应液,冰浴下继续反应3h。反应结束后,反应液减压浓缩,采用硅胶柱层析纯化(石油醚/乙酸乙酯=1:1(v/v)),得到浅黄色粉末状固体ii-21b(96mg,33%yield)。1h nmr(400mhz,dmso-d6)δ10.43(s,1h),8.31(d,j=6.7hz,1h),7.96(s,1h),7.89(d,j=7.5hz,2h),7.83
–
7.64(m,4h),7.54
–
7.37(m,4h),7.33(t,j=7.4hz,2h),5.39(d,j=4.4hz,1h),4.72
–
4.64(m,1h),4.43(p,j=6.8hz,1h),4.34
–
4.19(m,3h),3.97
–
3.89(m,1h),2.00(h,j=7.0hz,1h),1.33(t,j=6.3hz,6h),0.89(dd,j
=15.1,6.8hz,6h).ms(esi)m/z:580.23[m-oh]
;598.23[m h]
;620.21[m na]
。
[0253]
(2)ii-21c的制备
[0254]
将步骤(1)制备的ii-21b(410mg,0.69mmol)溶解于10ml干燥n,n-二甲基甲酰胺中,缓慢添加哌啶(500μl),在室温下搅拌,反应30分钟。反应完成后,将反应液在真空中浓缩,浓缩产物通过柱层析法(dcm/ch3oh=15:1(v/v))纯化,得到ii-21c呈黄色固体(220mg,85.6%产率)。1h nmr(dmso-d6,400mhz):9.98(s,1h),9.85(s,1h),8.01(t,j=8hz,1h),7.76
–
7.59(m,2h),7.32
–
7.30(m,2h),7.26
–
7.23(m,2h),6.97
–
6.94(dd,j=4hz,1h),4.92
–
4.85(m,1h),4.68
–
4.62(m,1h),3.51
–
3.46(q,j=8hz,1h),3.40
–
3.38(m,1h),2.36
–
2.31(m,1h),1.54
–
1.43(m,6h),1.06
–
1.04(m,3h),0.90
–
0.87(m,3h).
13
c nmr(dmso-d6,400mhz):δ175.76,170.92,161.43,153.27,141.06,137.14,129.64,127.93,115.85,114.55,106.41,65.86,59.70,49.73,30.81,21.72,19.35,16.82,16.05.ms m/z[m h]
calculated for c
19h25
n3o5:376.18,found:376.18。
[0255]
(3)
ⅱ‑
21d的制备
[0256]
将步骤(2)制备的ii-21c(186mg,0.50mmol)溶解于7ml干燥的n,n-二甲基甲酰胺,6-马来酰亚胺己酸n-羟基琥珀酰亚胺酯(305mg,0.99mmol)中,并缓慢添加哌啶(77mg,0.60mmol),在室温下搅拌过夜。反应完成后,将反应液在真空中浓缩,浓缩产物通过柱层析法(15:1dcm/ch3oh)纯化,得到白色固体形式的
ⅱ‑
21d。1h nmr(cdcl
3-d6,400mhz):9.92(br,1h),8.39(br,1h),7.75
–
7.70(m,2h),7.48
–
7.42(m,2h),6.66(s,2h),5.06(br,1h),4.92
–
4.87(q,j=8hz,1h),4.75
–
4.71(t,j=8hz,1h),3.46
–
3.43(t,j=8hz,2h),2.48
–
2.37(m,2h),2.10
–
2.05(m,1h),1.78
–
1.67(m,2h),1.61
–
1.51(m,7h),1.35
–
1.21(m,3h),0.99
–
0.94(m,6h).
13
c nmr(cdcl
3-d6,400mhz):δ173.39,171.76,171.63,170.61,170.61,161.04,153.36,140.82,136.91,133.80,133.80,130.24,128.11,116.36,115.17,107.09,65.75,65.45,58.01,37.39,35.99,31.56,28.13,26.22,25.23,21.46,18.93,18.56,18.27.ms m/z[m na]
calculated for c
29h36
n4o8:591.24,found:591.29.
[0257]
(4)
ⅱ‑
21的制备
[0258]
在氩气保护下,向5ml步骤(3)制备的
ⅱ‑
21d(230mg,0.41mmol)和双(4-硝基苯基)碳酸酯(246mg,0.81mmol)的水溶液中添加dipea(63mg,0.49mmol),在室温下搅拌过夜。反应完成后,向残余的棕色反应液中添加乙酸乙酯(10ml)并搅拌30min,过滤,所得沉淀物即为
ⅱ‑
21,为黄色固体(210mg,70.9%产率)。沉淀未经纯化,直接用于下一步反应。
[0259]
(5)ii-22d、ii-23d和ii-24d的制备
[0260]
采用与ii-21d类似的制备方法制备ii-22d、ii-23d和ii-23d,ii-22d中n为2,ii-23d中n为4,ii-24d中n为8。
[0261]
ⅱ‑
4:ms m/z[m h]
:728.35;
ⅱ‑
6:ms m/z[m h]
:992.49。
[0262]
(6)ii-22、ii-23和ii-24的制备
[0263]
采用与ii-21类似的制备方法制备ii-22、ii-23和ii-24,ii-22中n为2,ii-23中n为4,ii-24中n为8。
[0264]
采用实施例3类似的方法制备连接子ii-11、ii-12、ii-13和ii-14,反应流程如下所示。ii-12中n为2,ii-13中n为4,ii-14中n为8。
[0265][0266]
实施例4:含香豆素的连接子-mmae偶联物的制备
[0267]
在氩气保护下,向5ml含有
ⅱ‑
21(230mg,0.41mmol)、mmae(187mg,0.26mmol)和hobt(42mg,0.31mmol)的溶液中添加dipea(67mg,0.52mmol),在室温下搅拌过夜。反应完成后,在真空中浓缩反应液,并通过柱层析法(dcm/ch3oh=15:1(v/v))纯化粗产物,得到含香豆素的连接子-mmae偶联物iii-21,为白色固体(100mg,29.9%产率)。1h nmr(dmso-d6,400mhz):10.41
–
10.28(d,j=12hz,1h),8.30
–
8.22(m,2h),7.85
–
7.65(m,6h),7.30
–
7.25(m,5h),7.00(s,2h),5.74
–
5.64(m,1h),5.43
–
5.36(m,1h),4.50
–
4.37(m,2h),4.20
–
4.16(t,j=8hz,2h),4.04
–
3.92(m,2h),3.58(br,2h),3.39
–
3.37(m,2h),3.25
–
3.15(m,9h),3.00
–
2.95(m,2h),2.90
–
2.80(m,2h),2.30
–
2.27(m,1h),2.18
–
2.08(m,5h),2.03
–
1.95(m,2h),1.81(br,3h),1.48
–
1.45(m,5h),1.34
–
1.16(m,6h),1.11
–
0.97(m,7h),0.87
–
0.73(m,16h).
13
c nmr(cdcl
3-d6,400mhz):δ175.22,174.34,174.34,172.56,172.56,171.81,171.41,171.41,171.41,170.73,154.45,153.13,142.11,141.67,134.58,134.58,134.58,128.84,128.58,128.58,128.58,127.83,126.84,126.84,116.78,115.33,107.54,82.55,77.79,76.21,69.98,65.20,61.45,60.63,59.01,58.48,57.77,54.63,52.03,50.32,48.44,45.37,45.28,38.11,36.61,33.90,32.45,31.63,30.38,30.21,28.82,26.91,26.35,25.80,25.50,23.23,20.88,19.56,19.56,19.56,19.56,19.29,19.01,18.21,18.21,16.65,14.89,14.65,11.50.hr
–
ms(esi )m/z(m h)
calculated for c
69h101
n9o
16
,1312.7366;found:1312.7421。
[0268]
采用类似的方法制备含香豆素的连接子-mmae偶联物iii-22、iii-23、iii-24、iii-11、iii-12、iii-13和iii-14。iii-12中n为2,iii-13中n为4,iii-14中n为8,iii-22中n
为2,iii-23中n为4,iii-24中n为8。
[0269]
实施例5:含香豆素的抗体药物偶联物(adc)的制备
[0270]
本实施例将实施例4制备的含香豆素的连接子-mmae偶联物偶联于抗her2人源化单克隆抗体上。
[0271]
(1)常用缓冲盐溶液的配制:
[0272]
缓冲盐溶液-1(buffer-1):取3.11g的l-组氨酸,溶于1l二次蒸馏水中,全部溶解后,采用医用冰醋酸调其ph=5.50左右(
±
0.05);经0.22μm的滤膜过滤除菌后,装瓶并置于4℃下短期存储,待用。
[0273]
缓冲盐溶液-2(buffer-2):称取tris
·
base 6.06g、edta
·
2na 0.93g溶解后,定容到100ml,得到tris
·
base溶液;另称取tris
·
hcl 7.88g、edta
·
2na 0.93g溶解后,同样也定容到100ml,得到tris
·
hcl溶液;向tris
·
base溶液中加入tris
·
hcl溶液,使其ph=8.50(
±
0.05);经0.22μm的滤膜过滤除菌后,装瓶并置于4℃下短期存储,待用。
[0274]
缓冲盐溶液-3(buffer-3):采用移液枪量取医用冰醋酸1.715ml,溶解于200ml二次蒸馏水中,充分混匀后,经0.22μm的滤膜过滤除菌后,装瓶并置于4℃下短期存储,待用。
[0275]
(2)抗体偶联反应:
[0276]
①
药用抗体的置换:偶联所采用的抗her2人源化单克隆抗体mil40(购买于浙江海正药业股份有限公司),其为赫赛汀的生物仿制药,其初始的制剂溶液中包含盐酸组氨酸(一水)0.616mg/ml、l-组氨酸0.364mg/ml、海藻糖22.727mg/ml、吐温-20 100mg/ml等药用辅料,为去除辅料干扰,首先将冻融的抗体原液置于室温缓慢融化,并经g25葡聚糖凝胶柱,将其置换到buffer-1中。置换完成后,通过超滤离心进行浓缩(终浓度>5mg/ml),并通过紫外分光光度计对其浓度进行测定。
[0277]
②
偶联反应液的准备:根据所需偶联抗体的量(1eq),采用移液枪精确移取抗体的buffer-1溶液,并补加一定量的buffer-1,使得抗体浓度约为10mg/ml。采用buffer-2调其ph=6~8左右,并用移液枪将其转移至洁净的反应小瓶中。
[0278]
③
抗体的还原:缓慢搅拌小瓶中的反应液(100rpm),并加入2~5eq的2.87mg/ml的tcep
·
hcl溶液,加完后,室温下徐徐搅拌,反应60~180min。
[0279]
④
抗体的偶联:计算需要加入有机溶剂(dmac或dmso)的体积,使其占总体积的5%~15%;同时计算需要加入的adc小分子荷载(实施例5制备的含香豆素的连接子-mmae)的
质量,通常小分子荷载需要稍微过量(通常为8eq),进而计算出所需加入的小分子荷载的有机溶剂得浓度。精确配制adc小分子荷载的溶液后,缓慢滴加到已经还原的抗体反应液中。室温下继续缓慢搅拌,根据具体偶联情况反应0.5~5h。
[0280]
⑤
反应的终止:反应液达到预定的偶联时间后,加入过量的包含还原性巯基的水溶性小分子n-乙酰基半胱氨酸溶液(1.63mg/ml),缓慢搅拌继续反应30min。
[0281]
⑥
产物初步纯化:待偶联的终止反应结束后,加入buffer-3回调反应液的ph约为5.50;所得的反应液经过滤后,采用g25葡聚糖凝胶柱进行初步纯化,收集前段(约为80%)的组分流出液,再次经超滤浓缩后,无菌过滤并进行样品分装;除预留的用于产品分析的部分样品置于4℃下短期存储外,其它产品置于-80℃下存储待用。
[0282]
本实施例所制备的含香豆素的adc结构如下所示,其中e为dar,其为3-5之间的数,约为4,代表抗her2人源化单克隆抗体mil40。
[0283]
[0284][0285]
经检测,iv-21的dar为4.2。dar值的测定可参考文献(j.ouyang,in antibody-drug conjugates,vol.1045(ed.:l.ducry),2013,pp.275-283.)中描述的方法进行。
[0286]
实验例1化合物
ⅰ‑
2的紫外吸收光谱和荧光发射光谱测定
[0287]
本实施例评估了实施例2制备的化合物
ⅰ‑
2的紫外吸收光谱和荧光发射光谱。
[0288]
用含10%dmso的pbs缓冲溶液(ph=7.4)溶解化合物
ⅰ‑
2至终浓度为1.25,2.5,5,10,25,50,100μm/l。分别取100μl各浓度的化合物
ⅰ‑
2溶液溶液加入到96孔板中,使用enspire perkinelmer酶标仪测量各浓度的化合物
ⅰ‑
2溶液的紫外吸收光谱(波长范围:280nm-450nm)。如附图1所示,
ⅰ‑
2的最大吸收波长为346nm。
[0289]
用含10%dmso的pbs缓冲溶液(ph=7.4)溶解
ⅰ‑
2至终浓度为1.25,2.5,5,10,25,50,100μm/l。分别取100μl各浓度的化合物
ⅰ‑
2溶液加入到96孔板中,选择373nm为激发波长,使用enspire perkinelmer酶标仪测量各浓度的化合物
ⅰ‑
2溶液的荧光发射光谱(波长范围:393nm-648nm)。
[0290]
结果如图1所示,本发明的化合物
ⅰ‑
2具有典型的荧光发射光谱,且特征发射波长为471nm,可作为荧光探针应用。
[0291]
经检测,本发明的化合物
ⅰ‑
1也具有典型的荧光发射光谱,可作为荧光探针应用。
[0292]
实验例2
ⅲ‑
21所示含香豆素的连接子-mmae偶联物的体外荧光性质研究
[0293]
本实施例评估了实施例4制备的含香豆素的连接子-mmae偶联物
ⅲ‑
21的体外荧光性质。
[0294]
用含10%dmso的组织蛋白酶b(ctsb)活性缓冲液(50mm乙酸钠,100mm nacl,8mm l-半胱氨酸,1mm edta,ph=5.0)溶解化合物
ⅲ‑
21至终浓度为10μm/l。进行试验前
ⅲ‑
21先经nac处理得到相应的nac
‑ⅲ‑
21。nac
‑ⅲ‑
21的制备方法参考文献(y.wang,s.fan,w.zhong,x.zhou,s.li,int.j.mo.l sci.2017,18,e1860.)中的描述进行。向nac
‑ⅲ‑
21的溶液中加入不同浓度的组织蛋白酶b(ctsb,购自sigma),37℃孵育4h后,使用enspire perkinelmer酶标仪测量nac
‑ⅲ‑
11溶液的荧光发射光谱(波长范围:393nm-648nm)。同时测定nac
‑ⅲ‑
21在471nm的荧光值,用graphprism拟合酶解曲线,如图2所示。
[0295]
结果显示,与3un ctsb孵育后nac
‑ⅲ‑
21溶液的荧光光谱与化合物
ⅰ‑
2的荧光光谱完全一致,说明其水解释放mmae的同时释放
ⅰ‑
2。荧光强度随时间的初始速率很大程度上取决于ctsb浓度,0.3un、1un和3un ctsb浓度下对应nac
‑ⅲ‑
11的裂解速率常数vmax分别为10958、45257和52928。
[0296]
经检测,本发明制备的式
ⅲ‑
11所示的含香豆素的连接子-mmae偶联物与
ⅲ‑
21类
似,经nac处理后,所得nac
‑ⅲ‑
11也具有与i-1基本一致的荧光光谱,说明
ⅲ‑
11所示的含香豆素的连接子-mmae偶联物在水解释放mmae的同时能够释放i-1。
[0297]
实验例3
ⅳ‑
21所示adc的体外细胞毒性研究
[0298]
本实施例评估了实施例5制备的adc
ⅳ‑
21的体外细胞毒性。具体地,评估了式
ⅳ‑
21所示adc、毒素mmae、裸抗mil40和传统pab-adc等受试药的体外细胞毒性。测试的细胞系包括her2抗原阳性的细胞系nci-n87、mda-mb-361、mda-mb-453,赫赛汀耐药株sk-ov-3、nci-n87-hdr、bt474-hdr,her2抗原弱阴性的细胞系mcf-7,mda-mb-231(上述细胞系均购自atcc)。
[0299]
试验过程中所用的试剂、仪器和消耗品如下表所述:
[0300][0301][0302]
试验过程如下所述:
[0303]
1)细胞解冻
[0304]
a)在37℃的水浴中轻轻晃动小瓶进行解冻;b)内容物全部解冻后,从水浴中取出小瓶,通过浸入或用70%乙醇喷洒进行净化消毒;c)将小瓶内容物转移到含有9ml完全培养基(细胞系bt474-hdr、mcf-7使用dmem培养基,细胞系nci-n87、mda-mb-361、mda-mb-453和mda-mb-231使用rpmi1640培养基,细胞系sk-ov-3使用mccoy’s 5a培养基;下文所述的培养基与此处相同)的离心管中,并以约200
×
g转速离心5分钟;d)用培养基重悬细胞沉淀并分配到75cm2培养瓶中;e)将培养物在37℃,5%co2培养箱中进行培养。
[0305]
2)展开细胞
[0306]
a)细胞在含有10%fbs(热灭活)和1%青霉素/链霉素溶液(penicillin-streptomycin)的培养基中以1:4的比例每周传代三次;b)对于传代细胞,首先用0.05%的胰蛋白酶/edta溶液(3ml)冲洗贴壁细胞,然后加入胰蛋白酶/edta(3ml)并涡旋以均匀涂覆细胞。培养物在37℃下培养直到细胞分离(在显微镜下验证细胞已分离)。加入等体积的细胞培养基灭活胰蛋白酶,收集分离的细胞,并采用200
×
g离心细胞5分钟,之后重新悬于新鲜培养基中。
[0307]
3)准备受试药
[0308]
a)以1:3比例串联稀释受试药以产生10点稀释(受试药母液为浓度约为2mg/ml的l-his缓冲盐溶液,采用pbs进行稀释,测试点初始最大浓度约为500μg/ml);b)将4μl不同浓
度的受试药分配到384孔板中。
[0309]
4)细胞播种
[0310]
a)收获细胞并计数细胞数量;b)将36μl具有调整密度的细胞悬液加入到上述含有受试药的384孔板中。最终细胞密度约为1,000个细胞/孔;c)盖上盖子,置于37℃,5%co2和0.1%o2培养箱中孵育96小时。
[0311]
5)读板
[0312]
a)96小时后,从培养箱中取出平板并在室温下平衡10分钟;b)celltiter glo试剂在实验前在37℃孵育;c)将40μl的celltiter-glo试剂加入待检测的每个孔中;d)然后将板放置在室温下30分钟,然后在enspire阅读器上阅读,进行细胞计数。
[0313]
6)数据分析
[0314]
采用以下公式计算cell viability:
[0315]
cell viability(%)=100%
×
(s
–
m)/(v
–
m)
[0316]
s:readout of test sample
[0317]
v:readout of vehicle sample
[0318]
m:readout of well without compounds treatment
[0319]
应用originpro 2018拟合曲线,计算ic
50
值。
[0320]
7)实验结果
[0321]
测试结果如图3所示。结果显示,式
ⅳ‑
21所示adc在所测试的细胞株上均表现出了显著优于裸抗体mil40的细胞抑制活性(ic
50
),而且在多株细胞系上,体外细胞毒性ic
50
基本与细胞毒素mmae与pab-adc相当(见图3)。
[0322]
经测试,本发明制备的式iv-11所示的adc在体外细胞毒性测试中也表现出相似的细胞抑制活性,显著优于裸抗体mil40的细胞抑制活性(ic
50
),而且在多株细胞系上,体外细胞毒性ic
50
基本与细胞毒素mmae与pab-adc相当。
[0323]
实验例4
ⅳ‑
21所示adc的细胞荧光成像研究
[0324]
sk-ov-3和mcf-7细胞分别在37℃和5%co2的气氛中生长,它们培养基中均含有10%胎牛血清和0.1%青霉素链霉素。将sk-ov-3细胞(4
×
104个细胞/孔)和mcf-7(4
×
104个细胞/孔)分别接种在激光共聚焦小皿中,并在相应的培养基中稳定过夜。在一些实验中,细胞在含有ctsb抑制剂e-64(购自伊诺凯)的培养基中培养,然后用
ⅳ‑
21处理。孵育8小时或24小时后,用pbs洗涤三次,除去剩余的
ⅳ‑
21,并将细胞置于1ml pbs溶液中。用共焦激光扫描显微镜(蔡司lsm 510,蔡司)拍摄荧光图像。
[0325]
将培养的sk-ov-3和mcf-7细胞接种在12孔平板(4
×
104个细胞/孔)中并培养24小时。然后将细胞暴露于
ⅳ‑
21中,在37℃下以1mg/ml的最终剂量在dmem中稀释8小时和24小时。为了量化
ⅳ‑
21的细胞摄取量,对试验样品进行抽吸,用胰蛋白酶/edta对细胞进行胰蛋白酶消化,用pbs洗涤两次,然后在1ml的pbs中重新悬浮,然后进行流式细胞仪分析(美国beckman coulter,cytomics fc 500)。测定了10000个事件的荧光,并用flowjovx软件对数据进行了分析。未经处理的细胞作为阴性对照。
[0326]
如图4中所示,时程成像实验表明,
ⅳ‑
21在sk-ov-3细胞中孵育8h后释放了有效载荷。同时,在细胞中观察到荧光增强。培养24h后,细胞内荧光进一步增强。相反,在相似的实验条件下,her2阴性细胞mcf-7中几乎没有荧光信号。为了量化细胞内药物释放,我们用流
式细胞仪分析了
ⅳ‑
21的荧光值。在分析中,用
ⅳ‑
11处理sk-ov-3细胞后,0、8和24小时的平均荧光强度分别为1319、4251和8705。然而,mcf-7上的数据保持不变。本实验中,在抗原阳性细胞中,荧光强度增加,指示adc的荷载能够有效释放。在抗原阴性细胞中,荧光强度不变,指示荷载释放量少。这表明本发明制备得到的诊疗一体adc,例如
ⅳ‑
21所示adc,在细胞水平能实时监控药物释放。
[0327]
实验例5:
ⅳ‑
21所示adc的体内药效研究
[0328]
本实施例评估了本发明的式
ⅳ‑
21所示adc在两种异种移植动物模型上的体内药效。
[0329]
受试动物为6~8周龄的雌性nod-scid雌性小鼠(购买于北京安凯毅博生物技术有限公司),平均体重为20~26g,每组6只动物。将sk-ov-3细胞(购自atcc)接种于实验动物的右侧胁肋部皮下,待肿瘤生长至180mm3左右时进行分组给药。给药时间点设置为第0天,第7天,第14天和第21天,共给药4次。裸抗体mil40给药剂量为5mg/kg,式
ⅳ‑
21所示adc给药剂量为1mg/kg,2.5mg/kg和5mg/kg,此外设置溶媒(缓冲溶液-1)对照组。给药后每周使用游标卡尺对肿瘤体积进行2次的测量,测量肿瘤的长径和短径,其体积计算公式为:体积=0.5
×
肿瘤长径
×
短径2。在进行肿瘤体积测量的同时,称量小鼠体重。在skov3-scid鼠的异种移植模型中,adc(
ⅳ‑
21)表现出了明显的肿瘤抑制活性和剂量依赖关系。相比于溶媒空白对照组和等剂量的裸抗mil40受试组,经adc(m9)的体内药效表现出了具有统计学意义的显著性优势(p
(vehicle vs adc)
《0.05,p
(mab vs adc)
《0.05)。在停药后的观察期内,肿瘤实现了持续性消退(图5中的a)。所有受试组的动物体重均有着不同程度的增长,未出现显著的由治疗过程中药物耐受性引起的体重下降(图5中的a)。
[0330]
受试动物为6~8周龄的雌性cb17.scid雌性小鼠(购买于北京安凯毅博生物技术有限公司),平均体重为20~26g,每组6只动物。将bt474细胞(购自atcc)接种于实验动物的右侧胁肋部皮下,待肿瘤生长至100mm3左右时进行分组给药。给药时间点设置为第0天,第7天,第14天和第21天,共给药4次。裸抗体mil40给药剂量为1.5mg/kg,5mg/kg,式
ⅳ‑
11所示adc给药剂量为0.5mg/kg,1.5mg/kg和5mg/kg,mil40与mmae联合用药组(1.5mg/kg 0.029mg/kg),t-dm1(购自上海翰香生物科技有限公司)给药剂量为0.5mg/kg,1.5mg/kg,此外设置溶媒(缓冲溶液-1)对照组。给药后每周使用游标卡尺对肿瘤体积进行2次的测量,测量肿瘤的长径和短径,其体积计算公式为:体积=0.5
×
肿瘤长径
×
短径2。在进行肿瘤体积测量的同时,称量小鼠体重。在bt474-scid鼠的异种移植模型中,adc(
ⅳ‑
21)表现出了明显的肿瘤抑制活性和剂量依赖关系。adc(
ⅳ‑
21)的抗肿瘤作用明显强于相同剂量的mil40及联合用药组(p《0.0001)。更重要的是,5mg/kg adc(
ⅳ‑
21)给药两次后诱导了所有6只小鼠的肿瘤消退,1.5mg/kg adc(
ⅳ‑
21)给药四次诱导了五个小鼠的肿瘤消退。相比之下,1.5mg/kg的t-dm1给药四次后仅在两个小鼠中诱导肿瘤消退。经综合比较,adc(
ⅳ‑
21)的抗肿瘤效果与市面上销售的adc t-dm1相当(图5中的b)。所有受试组的动物体重均有着不同程度的增长,未出现显著的由治疗过程中药物耐受性引起的体重下降(图5中的b)。
[0331]
上述实验结果表明,本发明的化合物i-1和i-2具有优越的荧光性质,是结构全新的荧光探针。同时其具有自消除特性,可作为自消除片段应用于adc药物的设计中,代替传统的pab片段。本发明得到的全新诊疗一体adc显示了优秀的靶向性,疗效和成像特性。在疗效上,本发明的诊疗一体adc与传统含pab的adc表现出相似的细胞毒性,在体内药效中诊疗
一体adc与上市adc药物t-dm1表现了相同的抑瘤效果。同时由于融入了成像特性,本发明提供的诊疗一体adc可以在细胞水平实时监控有效荷载的释放。诊疗一体adc在促进adc临床前开发和诊疗一体体系发展方面有潜在重要应用。
[0332]
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
