一种ric细胞及其制备方法和应用
1.本技术是以cn申请号为202110903886.0,申请日为2021年8月6日,和pct申请号为pct/cn2022/104873,申请日为2022年7月11日的申请为基础,并主张其优先权,该cn申请和pct申请的公开内容在此作为整体引入本技术中。
技术领域
2.本技术涉及干细胞生物学领域,尤其涉及一种ric细胞及其制备方法和应用。特别是多能或多潜能干细胞的谱系特异性分化,具体涉及一种从干细胞分化得到的ric细胞及其制备方法和应用。
背景技术:
3.多能干细胞可以分化成绝大多数细胞类型,包括外胚层、内胚层和中胚层所有衍生细胞。从小鼠或人骨髓或人脐带血(ucb)、外周血分离的造血细胞群开始的淋巴生成过程已有文献记载,然而对多能干细胞体外分化为淋巴细胞知之甚少,技术尚未成熟。与此同时,尽管近年来源自淋巴系的天然免疫细胞已被用于癌症患者的肿瘤治疗,但是高效生产此类细胞仍然是一个巨大的挑战。
技术实现要素:
4.术语定义
5.在本文中,除非另有说明,否则所使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的分子遗传学、核酸化学、细胞培养、生物化学、细胞生物学等操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
6.如本文中所使用的,术语“胚胎干细胞”可以指从胚胎中分离的多能细胞,其在体外细胞培养物中保持。这种细胞是从培养的胚胎中分离出来可快速分裂的,并且同时保持多潜能性的培养细胞。胚胎干细胞可以在有或没有饲养细胞的情况下培养。胚胎干细胞可以从早期的胚胎中分离获得,包括但不限于囊胚期胚胎和前囊胚期胚胎。胚胎干细胞可具有圆形细胞形态,并可在饲养层上以圆形细胞团块生长。胚胎干细胞是本领域普通技术人员众所周知的。其来源可以是人或非人动物。对于人胚干细胞仅限于利用未经过体内发育的受精14天以内的人胚胎分离获取的干细胞。
7.如本文中所使用的,术语“体外”指人为环境,和在其中的过程和反应。体外环境通过试管和细胞培养进行例证,但不限制于此。
8.如本文中所使用的,术语“体内”指自然环境(即动物或细胞)和在其中的过程和反应。
9.如本文中所使用的,术语“培养物”是指,将细胞(例如,本发明的ric细胞群)在培养基中培养后获得的产物。
10.如本文中所使用的,术语“培养上清”是指,对细胞(例如,本发明的ric细胞群)进
行培养而得到的不含细胞本身的培养液。因而,例如可以通过在培养后分离去除细胞成分来得到可用于本发明的培养上清。该培养上清也可以经过其他处理,例如离心、浓缩、溶剂的置换、透析、冷冻、干燥、冷冻干燥、稀释、脱盐、保存等。
11.如本文中所使用的,术语“药学上可接受的载体或赋形剂”是指,在药理学和/或生理学上与受试者和活性成分相容的载体和/或赋形剂,其是本领域公知的(参见例如remington's pharmaceutical sciences.edited by gennaro ar,19th ed.pennsylvania:mack publishing company,1995),并且包括但不限于:ph调节剂,表面活性剂,离子强度增强剂,维持渗透压的试剂,延迟吸收的试剂,稀释剂,佐剂,防腐剂等。例如,ph调节剂包括但不限于磷酸盐缓冲液。表面活性剂包括但不限于阳离子,阴离子或者非离子型表面活性剂,例如tween-80。离子强度增强剂包括但不限于氯化钠。维持渗透压的试剂包括但不限于糖、nacl及其类似物。延迟吸收的试剂包括但不限于单硬脂酸盐和明胶。稀释剂包括但不限于水,水性缓冲液(如缓冲盐水),醇和多元醇(如甘油)等。佐剂包括但不限于铝佐剂(例如氢氧化铝),弗氏佐剂(例如完全弗氏佐剂)等。防腐剂包括但不限于各种抗细菌试剂和抗真菌试剂,例如硫柳汞,2-苯氧乙醇,对羟苯甲酸酯,三氯叔丁醇,苯酚,山梨酸等。在某些实施方案中,所述药学上可接受的载体或赋形剂是无菌等渗水性或非水性溶液(例如,平衡盐溶液或生理盐水)、分散液、悬浮液或乳液。
12.如本文中所使用的,术语“预防”是指,为了阻止或延迟疾病或病症或症状在受试者体内的发生或如果它发生作用减到最小而实施的方法。术语“治疗”是指,为了获得有益或所需临床结果而实施的方法。有益或所需的临床结果包括但不限于,降低疾病进展速率,改善或减轻疾病状态,和消退或改善的预后,无论是可检测或是不可检测的。有效缓解任何特定疾病症状的治疗剂的量可以根据诸如患者的疾病状态,年龄和体重以及药物在受试者中引起期望的反应的能力等因素而变化。疾病症状是否得到缓解可以通过任何临床测量来评估,这些测量通常由医生或其他熟练的医疗保健提供者用于评估该症状的严重程度或进展状态。
13.如本文中所使用的,术语“有效量”是指足以获得或至少部分获得期望的效果的量。例如,预防疾病有效量是指,足以预防,阻止,或延迟疾病的发生的量;治疗疾病有效量是指,足以治愈或至少部分阻止已患有疾病的患者的疾病和其并发症的量。测定这样的有效量完全在本领域技术人员的能力范围之内。例如,对于治疗用途有效的量将取决于待治疗的疾病的严重度、患者自己的免疫系统的总体状态、患者的一般情况例如年龄,体重和性别,药物的施用方式,以及同时施用的其他治疗等等。
14.如本文中所使用的,术语“受试者”包括但不限于各种动物,例如哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、兔科动物、啮齿类动物(例如,小鼠或大鼠)、非人灵长类动物(例如,猕猴或食蟹猴)或人。
15.如本文中所使用的,术语“增殖”或“扩增”是指细胞或细胞群体数目增加的能力。
16.如本文中所使用的,术语含“纯化的细胞群”或“纯化的细胞组合物”的组合物意指至少30%、50%、60%、通常至少70%,并且更优选80%、90%、95%、98%、99%或更多的组合物中的细胞属于已鉴定类型。
17.如本文中所使用的,术语“原代免疫细胞”是指,直接从机体取出的组织(例如脐血、外周血、或骨髓)中分离获得的自然杀伤细胞。
18.如本文中所使用的,术语“car”是指嵌合抗原受体。
19.如本文中所使用的,术语“表达率”是细胞表达某个特定蛋白的阳性比率。譬如80%的car表达率是80%的细胞都表达car。
20.如本文中所使用的,术语“ric囊”是产生ric细胞的囊状结构。
21.如本文中所使用的,术语“ric细胞”是本发明所述的免疫细胞或细胞群,其特征在说明书中阐述。
22.如本文中所使用的,术语“种子细胞”是能够形成某个成体细胞的未成熟的细胞。
23.如本文中所使用的,术语“x 细胞”是x阳性或表达x基因的细胞。譬如cd34 细胞是表达cd34的细胞。x的表达可以通过现有技术去测试。
24.如本文中所使用的,术语“x-细胞”是x阴性或不表达x基因的细胞。譬如cd34-细胞是不表达cd34的细胞。x的表达可以通过现有技术去测试。
25.如本文中所使用的,术语“nkp30/ncr3”属igsf成员,是一种天然细胞毒性受体。分布于静息和活化的nk细胞,通过与含itam的dap12转导激活信号;与nkp46协作,介导nk细胞的杀伤作用。
26.如本文中所使用的,术语“nkp44/ncr2”属igsf成员,是一种天然细胞毒性受体。表达于活化nk细胞,通过与含itam的dap12参与介导nk细胞的杀伤活性。
27.如本文中所使用的,术语和“nkg2c/klrc2”可结合非经典的hla
‑ⅰ
类分子hla-e,传递活化信号。nkg2c能够识别感染hcmv的细胞hla-e递呈的ul40肽段,促进ifnγ的释放。
28.如本文中所使用的,术语“nkg2d/klrk1”是一种在人类天然杀伤细胞表达的激活性受体,dap10仅与nkg2d胞内区结合传代活化信号。在天然免疫中发挥着重要的作用,参与病毒感染细胞的识别及对肿瘤细胞的杀伤。
29.如本文中所使用的,术语“slamf7/cs1”是指信号淋巴细胞激活分子家族成员7,表达于自然杀伤细胞表面。人类cs1分子有两种变体,分别为long-form cs1-l和short form cs1-s,均可表达在nk细胞上,cs1-l是nk激活性受体,而cs1-s不能活化nk细胞。
30.如本文中所使用的,术语“klrb1/cd161”是指杀伤细胞凝集素样受体亚家族b成员1。属于nk细胞抑制性受体。
31.如本文中所使用的,术语“klrc1/nkg2a”可结合非经典的hla
‑ⅰ
类分子hla-e,传递抑制信号。子宫nk细胞却高表达nkg2a。正常生理状态下,胎盘滋养层细胞表达hla-e,与nkg2a互作,抑制子宫脱膜nk细胞的杀伤作用,维持胎盘免疫耐受,而在病理状态下,肿瘤细胞上调hla-e分子可以逃避nk细胞的杀伤。
32.如本文中所使用的,术语“lair1”是指白细胞关联免疫球蛋白样受体1。属于nk细胞抑制性受体。
33.如本文中所使用的,术语“siglec7”是指唾液酸结合性免疫球蛋白样凝集素7。
34.如本文中所使用的,术语“cd96”,dnam-1的配体是cd155。nk细胞的抑制性受体cd96和tigit同样可以结合cd155和cd112,这两种抑制性受体与dnam-1形成tigit-cd226-cd96受体家族。
35.如本文中所使用的,术语“ncam1/cd56”是指神经细胞粘附分子1,在免疫细胞中主要表达于nk或nkt细胞。
36.如本文中所使用的,术语“klrd1/cd94”是指人杀伤细胞凝集素样受体d1,cd94分
子可与nkg2a形成二聚体,识别hla-e分子,传递抑制信。
37.如本文中所使用的,术语“cd69”是一类二型跨膜蛋白,可表达于活化的t细胞和nk细胞上。
38.如本文中所使用的,术语“tnfsf10/trail”是指人肿瘤坏死因子相关凋亡诱导配体,参与介导细胞凋亡。
39.如本文中所使用的,术语“faslg”是指fas配体,参与介导细胞凋亡。
40.如本文中所使用的,术语“prf1/perforin”是指穿孔素,可以破坏靶细胞膜。
41.如本文中所使用的,术语“gzma/granzyme a”是指颗粒酶a,通过穿孔素打孔后进入靶细胞,进而诱导caspase非依赖性的细胞死亡。
42.如本文中所使用的,术语“gzmb/granzyme b”是指颗粒酶b,是颗粒酶最主要的效应分子,进入靶细胞后可激活caspase级联反应,从而迅速引起靶细胞凋亡。
43.如本文中所使用的,术语“治疗有效”是指足以治疗或改善或以某种方式减轻与疾病如癌症或病状如感染相关联的症状的ric细胞的量。当参考一种方法使用时,方法足以有效地治疗或改善或以某种方式减轻与疾病或病状相关联的症状。例如,针对疾病的有效量是足以阻止或预防其发作的量;或如果疾病病理已开始,以减轻、改善、稳定、逆转或减慢疾病的进展,或以其他方式减轻疾病的病理后果。在任何情况下,有效量可以单剂量或分剂量给予。
44.如本文中所使用的,术语“药物组合物”是指药物可接受的组合物,其中组合物包含ric细胞,并且在一些实施例中进一步包含药学上可接受的载剂。在一些实施例中,药物组合物可以是组合。
45.如本文中所使用的,术语“组合”是指一种剂量单位形式的固定组合,或指用于联合施用的部分的试剂盒,其中ric细胞和组合伴侣(例如,下文所解释的另一种药物,也称为“治疗剂”或“共试剂”)可以同时或在时间间隔内分别施用。在一些情况下,组合伴侣表现出配合作用,例如协同作用。
46.如本文中所使用的,术语“共同施用”或“联合施用”等意在涵盖将所选择的组合伴侣施用于需要其的单个受试者,并且旨在包括其中不一定通过相同的施用途径或在同一时间施用的治疗方案。
47.如本文中所使用的,基于基因组编辑工具,如可用于多种生物体(例如,用于添加、破坏或改变特异性基因的序列)的聚类的规则间隔的短回文重复序列(crispr)系统、talen编辑工具等。如本文所用,术语“表位”包括能够特异性结合抗体或t细胞受体的抗原的任何蛋白质决定簇。表位决定簇通常由具有化学活性的分子表面基团组成,例如氨基酸或糖侧链,并且通常具有特定的三维结构特征以及特定的电荷特征。
48.如本文中所使用的,术语“抗体
””
包括单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们表现出所需的生物活性结合目标抗原位点及其感兴趣的同种物的能力术语“抗体片段”包括全长抗体的一部分,通常是其抗原结合区或其可变区或恒定区。在本文中,术语“抗体”包括源自任何物种和资源的任何抗体,包括但不限于人抗体、大鼠抗体、小鼠抗体、兔抗体等,并且可以合成制备或天然存在。
49.如本文中所使用的,术语“分化”是这样一个过程,通过该过程,较不特化的细胞变
成更特化的细胞类型,以在培养或体内形成至少一种新细胞类型的后代,而不是在相同条件下没有分化.在某些条件下,具有新细胞类型特征的后代的比例可以为至少约1%、5%、25%或更多,以增加优先顺序。
50.ric细胞群
51.在第一方面,本发明提供了一种ric细胞群,其中,所述ric细胞的nkg2-e基因平均表达水平(例如,在未经遗传修饰的情况下)是原代免疫细胞的至少约10倍(例如,至少约20倍,至少约30倍,至少约50倍,至少约60倍,至少约80倍,至少约90倍,至少约100倍,至少约150倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍)。
52.在某些实施方案中,所述ric细胞群的sell和cd2的表达水平少于原代免疫细胞的至少约10倍(例如,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约60倍,至少约70倍,至少约80倍,至少约90倍,至少约100倍,至少约150倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍)。
53.所述ric细胞群中的,ric细胞含量不低于60%、不低于70%、不低于80%、不低于90%、不低于95%。
54.在某些实施方案中,所述ric细胞群具有激活性受体ncr1、ncr2、ncr3、klrc2、klrk1和slamf7之中的任意三种以上,或四种、或全部;且和同等数量的原代免疫细胞相比没有显著区别。在某些实施方案中,所述ric细胞群具有抑制性受体klrb1、klrc1、lair1、siglec7和cd96之中的任意三种以上,或四种、或全部,且和同等数量的原代免疫细胞相比没有显著区别。
55.在某些实施方案中,所述ric细胞群具有激活性受体ncr1、ncr2、cd96、klrc2和klrk1之中的任意三种以上,或四种、或全部;且和同等数量的原代免疫细胞相比没有显著区别。在某些实施方案中,所述ric细胞群的抑制性受体klrb1、klrc1、lair1和siglec7之中的任意三种以上,或四种、或全部,和同等数量的原代免疫细胞相比没有显著区别。
56.在某些实施方案中,所述ric细胞群具有受体ncr1、ncr2、cd96、klrc2和klrk1之中的任意三种以上,或四种、或全部;且和同等数量的原代免疫细胞相比没有显著区别。在某些实施方案中,所述ric细胞群具有受体klrb1、klrc1、lair1和siglec7之中的任意三种以上,或四种、或全部,和同等数量的原代免疫细胞相比没有显著区别。
57.在某些实施方案中,所述ric细胞群借助基因递呈载体感染靶点car或借助基因编辑的手段持续性或条件性表达靶点car,car的表达率为60%-100%,优选至少70%,至少80%,至少90%,至少95%。可选的,靶向cd19的car的表达率为60%-100%,优选至少70%,至少80%,至少90%,至少95%。
58.在本文中,所述表达可通过测量基因的全长mrna、mrna片段、全长蛋白质或蛋白质片段的水平来监测。因此,在某些实施方案中,所述表达水平是mrna水平或蛋白水平。
59.在一些实施方案中,所述表达通过分析所述基因的mrna转录物的表达来评估。例如,通过rt-pcr测定tbxt、aplnr、hand1、cd2、sell、nkg2-e、slamf7、ncr2、ncr3、cd96、klrc2、klrk1、klrb1、klrc1、lair1或siglec7的mrna在所述细胞群中的存在或含量从而确定上述基因在该细胞群中的表达情况。
60.在另一些实施方案中,所述表达通过分析所述基因的蛋白产物的表达来评估。例如,通过免疫学检测测定brachyury、aplnr、cd45、cd43、cd34或cd56的蛋白在所述细胞群的
细胞膜表达从而确定上述基因在该细胞群中的表达情况。
61.在某些实施方案中,所述ric细胞是在未经遗传修饰的情况下具备以上所述的一种或多种基因表达特征,术语“未经遗传修饰”指未经历过将dna或rna形式的外源遗传物质添加至细胞的总遗传物质中的过程,此处术语“外源遗传物质”可以指人为引入的核苷酸序列,其相对于未经遗传修饰的细胞而言是外来的。容易理解,上述“未经遗传修饰”仅用于描述本发明的ric细胞群具备以上一种或多种基因表达特征的条件,并非用于限定本发明的ric细胞群不能包含遗传修饰。因此,在某些实施方案中,本发明的ric细胞完全可以包含一种或多种遗传修饰。
62.在某些实施方案中,所述ric细胞群从干细胞产生。优选地,所述干细胞是全能干细胞或多能干细胞,进一步优选所述干细胞是多能干细胞,进一步优选所述多能干细胞选自胚胎干细胞、单倍体干细胞、诱导多能干细胞。
63.在某些实施方案中,所述ric细胞群在体外产生。
64.在某些实施方案中,所述ric细胞群中≥80%(例如≥85%、≥90%、≥95%、≥96%、≥97%、≥98%、≥99%或100%)的细胞同时表达cd45和cd56。
65.本发明的ric细胞群可以作为药物组合物被配制和施用。这样的药物组合物可以是医学领域已知的任何形式,优选为注射剂(包括注射液、冻干粉剂)。在某些实施方案中,该药物组合物包含药学上可接受的无菌等渗水性或非水性溶液(例如,平衡盐溶液或生理盐水)、分散液、悬浮液或乳液。关于该药物组合物的配制的一般原则可参考由g.morstyn和w.sheridan编著的《细胞疗法:干细胞移植,基因疗法和细胞免疫疗法(cell therapy:stem cell transplantation,gene therapy,and cellular immunotherapy)》,剑桥大学出版社,1996;和《造血干细胞疗法(hematopoietic stem cell therapy)》,e.d.ball,j.lister&p.law,churchill livingstone,2000。
66.ric细胞群的制备方法
67.在第二方面,本发明提供了一种产生第一方面所述的ric细胞群的方法,其包括以下步骤:
68.(1)培养干细胞以形成侧板中胚层种子细胞;
69.(2)诱导所述侧板中胚层种子细胞分化为造血种子细胞;
70.(3)诱导所述造血种子细胞分化为ric细胞。
71.所述侧板中胚层种子细胞超过65%以上的细胞是aplnr 细胞;例如,超过70%以上的细胞是aplnr 细胞;例如,超过75%以上的细胞是aplnr 细胞;例如,超过80%以上的细胞是aplnr 细胞;例如,超过85%以上的细胞是aplnr 细胞;例如,超过90%以上的细胞是aplnr 细胞;例如,超过95%以上的细胞是aplnr 细胞。
72.所述侧板中胚层种子细胞超过65%以上的细胞是aplnr hand1 细胞;例如,超过70%以上的细胞是aplnr hand1 细胞;例如,超过75%以上的细胞是aplnr hand1 细胞;例如,超过80%以上的细胞是aplnr hand1 细胞;例如,超过85%以上的细胞是aplnr hand1 细胞;例如,超过90%以上的细胞是aplnr hand1 细胞;例如,超过95%以上的细胞是aplnr hand1 细胞;例如,超过99%以上的细胞是aplnr hand1 细胞。
73.所述侧板中胚层种子细胞超过65%以上的细胞是aplnr hand1 msgn1-osr1-细胞;例如,超过70%以上的细胞是aplnr hand1 msgn1-osr1-细胞;例如,超过75%以上的细
胞是aplnr hand1 msgn1-osr1-细胞;例如,超过80%以上的细胞是aplnr hand1 msgn1-osr1-细胞;例如,超过85%以上的细胞是aplnr hand1 msgn1-osr1-细胞;例如,超过90%以上的细胞是aplnr hand1 msgn1-osr1-细胞;例如,超过95%以上的细胞是aplnr hand1 msgn1-osr1-细胞;例如,超过99%以上的细胞是aplnr hand1 msgn1-osr1-细胞。
74.所述造血种子细胞超过65%以上的细胞是cd45 cd43 cd34 cd235a-细胞;例如,超过70%以上的细胞是cd45 cd34 cd43 cd235a-细胞;例如,超过75%以上的细胞是cd45 cd43 cd34 cd235a-细胞;例如,超过80%以上的细胞是cd45 cd43 cd34 cd235a-细胞;例如,超过85%以上的细胞是cd45 cd43 cd34 cd235a-细胞;例如,超过90%以上的细胞是cd45 cd43 cd34 cd235a-细胞;例如,超过95%以上的细胞是cd45 cd43 cd34 cd235a-细胞。
75.步骤(3)可诱导获得ric细胞,该单层诱导方案可以诱导获得高纯度高得率的ric细胞,ric细胞含量不低于60%、不低于70%、不低于80%、不低于90%、不低于95%。
76.本发明的ric细胞群制备过程中,无需进行自旋聚合,不产生自旋胚体或eb(拟胚体)。
77.概括的总体方案,本发明步骤(1)是单层诱导方式将多能干细胞分化为侧板中胚层种子细胞。可选地,在有基质或无基质的条件下,先后采用两种无血清培养基i和ii,这一步需要2-3天。步骤(1)中无需进行自旋聚合,不产生拟胚体(eb)。本发明步骤(2)是将产生的侧板中胚层种子细胞,不需要分选或富集,直接与一种表达特定基因组合的基质滋养细胞混合制备成ric囊。ric囊培养先后经历两个不同培养基(iii,iv)的逐步培养诱导,分化对应lm至造血种子细胞,其中lm至造血种子细胞阶段需要10-18天;以及步骤(3)造血种子细胞至ric(再生型免疫细胞,简称ric)诱导阶段,其中ric发育阶段需要7-14天。选择性的,也可以在造血种子细胞阶段剔除基质滋养细胞后进行单层诱导获得ric。整个ric囊培养阶段总共历时17-32天。
78.某些实施方案中,步骤(1)所述的侧板中胚层种子细胞为多能干细胞经单层诱导获得的aplnr hand1 细胞。
79.上述步骤可采用以下实施方案:
80.(1)使用培养基i,ii培养干细胞以形成侧板中胚层种子细胞;其中,所述培养基i是添加以下物质的基础培养基:一种或多种血清替代物、一种或多种非必需氨基酸、谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽、以及bmp4、activin a、bfgf、wnt激动剂(如小分子化合物chir-99021)和pi3k抑制剂(如小分子化合物pik-90、ly294002);所述培养基ii是添加以下物质的基础培养基:一种或多种血清替代物、一种或多种非必需氨基酸、谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽、以及bmp4、tgf-β抑制剂(如小分子化合物a-83-01、sb431542)和wnt抑制剂(如小分子化合物c59、iwr-1-endo);
81.在一些实施方案中,所述培养基i是添加以下物质的基础培养基:一种或多种血清替代物、一种或多种非必需氨基酸、谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽、以及bmp4、activin、bfgf、chir-99021和pik-90;所述培养基ii是添加以下物质的基础培养基:一种或多种血清替代物、一种或多种非必需氨基酸、谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽、以及bmp4、a-83-01和c59;
82.(2)使用培养基iii诱导所述侧板中胚层种子细胞分化为造血种子细胞;其中,所
述培养基iii是添加以下物质的基础培养基:一种或多种血清替代物、一种或多种非必需氨基酸、谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽、tgf-β抑制剂(如小分子化合物a-83-01、sb431542)、氢化可的松、抗坏血酸以及细胞生长因子例如flt3l、tpo、scf、egf、vegf、bfgf和igf-1之中的一种,两种或多种;在一些实施方案中,所述培养基iii是添加以下物质的基础培养基:一种或多种血清替代物、一种或多种非必需氨基酸、谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽、以及细胞生长因子例如flt3l、tpo、scf、egf、vegf、bfgf和igf-1之中的一种,两种或多种;
83.(3)使用培养基iv诱导所述造血种子细胞分化为ric细胞;其中,所述培养基iv是添加以下物质的基础培养基:一种或多种血清替代物、一种或多种非必需氨基酸、谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽、亚硒酸钠、乙醇胺、抗坏血酸以及细胞生长因子例如il-3、scf、il-7、il-15和flt3l之中的一种,两种或多种。在某些实施方案中,所述培养基iv进一步包含β-巯基乙醇。在某些实施方案中,β-巯基乙醇的含量为0.1-0.5%(v/v),例如约0.1%(v/v)、约0.2%(v/v)、约0.3%(v/v)、约0.4%(v/v)或约0.5%(v/v);
84.在一些实施方案中,所述培养基iv是添加以下物质的基础培养基:一种或多种血清替代物、一种或多种非必需氨基酸、谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽、以及细胞生长因子例如il-3、scf、il-7、il-15和flt3l之中的一种,两种或多种;在某些实施方案中,所述培养基iv进一步包含β-巯基乙醇;在某些实施方案中,β-巯基乙醇的含量为0.1-0.5%(v/v),例如约0.1%(v/v)、约0.2%(v/v)、约0.3%(v/v)、约0.4%(v/v)或约0.5%(v/v)。
85.在本文中,术语“基础培养基”是指能够支持细胞生长的任何培养基,通常包含无机盐、维生素、葡萄糖、缓冲体系和必需氨基酸,并且通常具有约280-330mosmol的渗透压。例如选自essential 6、dmem-high glucose、dmem/f12、α-mem、f-12、ebm2、mem、bme、rpmi 1640、g-mem及其任意组合。
86.在某些实施方案中,步骤(1)中所述干细胞是全能干细胞或多能干细胞,进一步优选所述干细胞是多能干细胞,进一步优选所述多能干细胞选自胚胎干细胞、单倍体干细胞、诱导多能干细胞。
87.在某些实施方案中,步骤(1)中所述培养在基质中进行。在某些实施方案中,所述基质包括细胞外基质。在某些实施方案中,所述基质包括growth factor reduced matrigel(gr-mtg材料)、糖蛋白(譬如但不限于玻连蛋白(vtn)、纤维连接蛋白)、透明质酸、层粘连蛋白、纤连蛋白、胶原、弹性蛋白、硫酸乙酰肝素、葡聚糖、硫酸葡聚糖、硫酸软骨素中的一种或多种。优选地,所述基质是糖蛋白。优选地,所述基质是玻连蛋白(vtn)和/或纤维连接蛋白。优选地,所述基质是玻连蛋白(vtn)。
88.在某些实施方案中,步骤(2)产生的细胞包括:侧板中胚层种子细胞、生血内皮细胞、造血干种子细胞、免疫种子细胞;步骤(2)包括:使用所述ric囊并使用培养基iii,iv,优选培养基iii进行培养。优选所述ric囊附着于培养容器。
89.在某些实施方案中,所述培养基i、ii、iii、iv具备以下特征中的一项或多项:
90.(i)所述一种或多种血清替代物的总含量为2-30%(v/v),例如3-30%(v/v)、约2%(v/v)、约3%(v/v)、约5%(v/v)、约8%(v/v)、约10%(v/v)、约12%(v/v)、约15%(v/v)、约18%(v/v)、约20%(v/v)、约22%(v/v)、约25%(v/v)、约28%(v/v)或约30%(v/v);
91.(ii)所述一种或多种非必需氨基酸各自的含量分别为0.1-0.5mm,例如约0.1mm、约0.2mm、约0.3mm、约0.4mm或约0.5mm;
92.(iii)谷氨酰胺或l-丙氨酰-l-谷氨酰胺的稳定化二肽的含量为1-5mm,例如约1mm、约2mm、约3mm、约4mm、或约5mm;
93.(iv)bmp4、activin、bfgf、flt3l、tpo、scf、egf、vegf、bfgf、igf-1、il-3、il-7和il-15的每个因子含量独立地为1-100ng/ml,例如2-100ng/ml,2-50ng/ml,5-100ng/ml,5-50ng/ml,或5-20ng/ml;例如约1ng/ml,约2ng/ml,约3ng/ml,约5ng/ml,约8ng/ml,约10ng/ml,约15ng/ml,约20ng/ml,约25ng/ml,约30ng/ml,约35ng/ml,约40ng/ml,约45ng/ml,约50ng/ml,约55ng/ml,约60ng/ml,约65ng/ml,约70ng/ml,约75ng/ml,约80ng/ml,约85ng/ml,约90ng/ml,约95ng/ml,或约100ng/ml。
94.(v)wnt激动剂,pi3k抑制剂,tgf-β抑制剂和wnt抑制剂的每个小分子含量可以为10nm-100μm,例如10-30nm,10-50nm,10-80nm,10-100nm,100nm-1μm,1μm-10μm,10μm-30μm,10μm-50μm,10μm-80μm,30μm-100μm。
95.在某些实施方案中,所述培养基i、ii、iii、iv具备以下特征中的一项或多项:
96.(a)所述血清替代物为无血清添加剂,具体选自kosr、b27、ultroser
tm
g、supergrow及其任意组合;优选地,所述血清替代物是supergrow(达科为,6122011)(以下简称为supergrow)、b27(gibco17504-044);
97.(b)所述非必需氨基酸选自甘氨酸、l-丙氨酸、l-天冬酰胺、l-天冬氨酸、l-谷氨酸、l-脯氨酸、l-丝氨酸及其任意组合;
98.(c)所述基础培养基选自essential 6、dmem-high glucose、dmem/f12、α-mem、f-12、ebm2、mem、bme、rpmi 1640、g-mem及其任意组合。
99.在某些实施方案中,所述培养基i、ii、iii、iv具备以下特征中的一项或多项:
100.培养基ⅰ:含有bmp4、activin a、bfgf、chir-99021和pik-90的essential 6培养基。
101.培养基ⅱ:含有bmp4、a-83-01和c59的essential 6培养基。
102.培养基ⅲ:含有sb431542、氢化可的松、flt3l、tpo、scf、egf、vegf、bfgf、igf-1、抗坏血酸和supergrow细胞培养添加物(达科为,6122011)的essential 6培养基。
103.培养基ⅳ:dmem-high glucose、dmem/f12、supergrow细胞培养添加物(达科为,6122011)、glutamax
tm
、β-巯基乙醇、亚硒酸钠、乙醇胺、抗坏血酸、青霉素-链霉素溶液、il-3、scf、il-7、il-15和flt3l。
104.在某些实施方案中,培养基ⅰ为含有40ng/ml bmp4、30ng/ml activin a、20ng/ml bfgf、6μm chir-99021和100nm pik-90的essential 6培养基。
105.在某些实施方案中,培养基ⅱ为含有30ng/ml bmp4、1μm a-83-01和1μm c59的essential 6培养基。
106.在某些实施方案中,培养基ⅲ为含有10μm sb431542、10μm氢化可的松、5ng/ml flt3l、5ng/ml tpo、50ng/ml scf、50ng/ml egf、50ng/ml vegf、50ng/ml bfgf、50ng/ml igf-1、50μg/ml抗坏血酸和2%supergrow细胞培养添加物(达科为,6122011)的essential 6培养基。
107.在某些实施方案中,培养基ⅳ含有:55%dmem-high glucose、30%dmem/f12、15%
supergrow细胞培养添加物(达科为,6122011)、2mm glutamax
tm
、1μmβ-巯基乙醇、5ng/ml亚硒酸钠、50um乙醇胺、20μg/ml抗坏血酸、1%青霉素-链霉素溶液、5ng/ml il-3、20ng/ml scf、20ng/ml il-7、10ng/ml il-15和10ng/ml flt3l。
108.在本文中,术语“细胞培养皿”是指,表面具有涂层的培养皿,该涂层可以阻止蛋白质在培养皿表面吸附,从而尽可能减少了单层细胞与培养容器的粘附。此类细胞培养皿是本领域技术人员熟知的,包括但不限于,corning的低贴附培养皿(货号3262)。
109.在某些实施方案中,所述步骤(1)中培养的持续时间是1-3天,例如约1天、约1.5天、约2天、约2.5天、约3天。
110.在某些实施方案中,所述步骤(2)中培养的持续时间是10-18天,例如约11天,约12天,约13天,约14天,约15天,约16天,约17天。
111.在某些实施方案中,所述步骤(3)中培养的持续时间是7-14天,例如约8天,约9天,约10天,约11天,约12天,约13天,约14天。
112.在某些实施方案中,所述步骤(2)包括以约1个ric囊/1-10cm2的平面密度将由步骤(1)来源的侧板中胚层种子细胞与滋养细胞构成的ric囊接种于所述培养容器。其中所述侧板中胚层种子细胞,不需要分选或富集。在某些实施方案中,单个ric囊总细胞量在20-1000万个细胞范围。在某些实施方案中,侧板中胚层种子细胞与滋养细胞混合比例范围为1:5-1:200。在某些实施方案中,所述ric囊的滋养细胞选自aft024、op9细胞、ms5细胞、hs-5或其他成纤维细胞中的一种或多种,优选表达至少一种、两种、三种、多种或全部如下基因:dll1、dll4、il7、il15、il3和flt3l。进一步优选地,所述ric囊的滋养细胞为op9-dll1、op9-dll4、或op9-dll1-dll4。
113.在某些实施方案中,所述步骤(2)和(3)培养的持续时间是17-32天,例如约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天、约28天、约29天、约30天、约31天或约32天。
114.在某些实施方案中,所述步骤(2)和(3)包括每天或每隔1-7天(例如,每隔1天、2天、3天、4天、5天、6天或7天)更换新鲜的培养基。
115.从干细胞到ric细胞的培养全流程时间19-34天,例如约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天、约28天、约29天、约30天、约31天、约32天、约33天或约34天。
116.在某些实施方案中,在步骤(1-3)中,所述培养条件为37℃、5%co2。在某些实施方案中,在步骤(1-3)中,在37℃、5%co2的培养箱中进行培养。
117.在第三方面,本发明还涉及由第二方面所述的方法产生的ric细胞群。
118.在某些实施方案中,所述ric细胞群如第一方面定义。
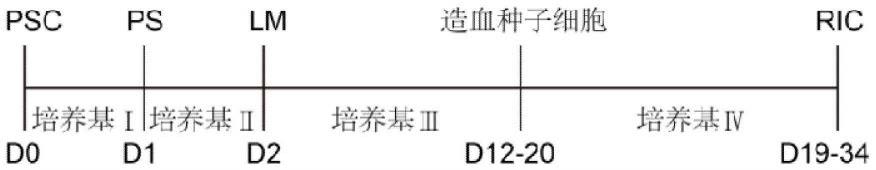
119.在第四方面,本发明还涉及一种中间态细胞组合,其包含培养干细胞以形成的侧板中胚层种子细胞,例如经前述ric细胞群制备方法中步骤(1)产生的侧板中胚层种子细胞。在某些实施方案中,所述侧板中胚层种子细胞超过65%以上是aplnr 细胞,优选超过65%以上是aplnr hand1 细胞。
120.在第五方面,本发明还涉及一种中间态细胞组合,其包含经前述ric细胞群制备方法中步骤(2)产生的造血种子细胞、其它免疫种子细胞(例如髓系细胞)。在某些优选的实施方案中,所述造血种子细胞超过65%以上是cd45 cd43 cd34 cd235a-细胞。
121.ric囊
122.在第五方面,本发明还涉及一种ric囊,其由前文步骤(1)来源的侧板中胚层种子细胞与滋养细胞构成。在某些实施方案中,所述侧板中胚层种子细胞与滋养细胞比例范围可以是1:5-1:200,例如1:15,1:10,1:20,1:30,1:40,1:60,1:90,1:100,1:110,1:120,1:130,1:140,1:150,1:160,1:170,1:180,1:190或1:200等。滋养细胞优选:aft024、op9细胞、ms5细胞、hs-5或其他成纤维细胞,优选表达至少一种、两种、三种、多种或全部如下基因:dll1、dll4、il7、il15、il3和flt3l。ric囊各组分的协同作用,极大的促进了侧板中胚层种子细胞的定向诱导分化。ric囊随着时间呈现动态变化,从边缘平滑,密度均匀状态,逐步呈现分散状态,并从中心向边缘扩展,具体参见图6所示。在某些实施方案中,1个ric囊可以诱导获得1
×
106、2
×
106、3
×
106、4
×
106、5
×
106、6
×
106、7
×
106、8
×
106、9
×
106或1
×
107个ric细胞。
123.单个ric囊总细胞量可以在20-1000万个细胞范围,例如25万,30万,40万,60万,80万,100万,150万,180万,200万,300万,400万,500万,600万,700万,800万,900万等。每个ric囊培养占用面积的范围1-10cm2。ric囊可以在培养基iii条件下连续培养10-18天,之后在培养基iv条件下连续培养7-14天。
124.试剂盒
125.在第六方面,本发明提供了一种试剂盒,其包含分开提供的培养基i,ii,iii,和iv中的一种、两种、三种或四种。
126.本发明的培养物可以作为药物组合物被配制和施用。这样的药物组合物可以是医学领域已知的任何形式,优选为注射剂(包括注射液、冻干粉剂)。在某些优选的实施方案中,该药物组合物包含药学上可接受的无菌等渗水性或非水性溶液(例如,平衡盐溶液或生理盐水)、分散液、悬浮液或乳液。关于该药物组合物的配制的一般原则可参考由g.morstyn和w.sheridan编著的《细胞疗法:干细胞移植,基因疗法和细胞免疫疗法(cell therapy:stem cell transplantation,gene therapy,and cellular immunotherapy)》,剑桥大学出版社,1996;和《造血干细胞疗法(hematopoietic stem cell therapy)》,e.d.ball,j.lister&p.law,churchill livingstone,2000。
127.在本发明中,可以使用本领域已知的任何可用于免疫细胞培养的培养基以及培养条件对本发明的ric细胞群进行培养。
128.用于预防和/或治疗疾病的用途
129.在第七方面,本发明涉及如本文所述的ric细胞群和/或修饰的ric细胞衍生细胞群或含ric细胞群及其衍生细胞群的药物组合物用于在受试者中预防和/或治疗疾病中的用途,或者在制备用于在受试者中预防和/或治疗疾病的药物中的用途,以及一种在受试者中预防和/或治疗疾病的方法,其包括向有此需要的受试者施用本发明的ric细胞群和/或修饰的ric细胞衍生细胞群或含ric细胞群及其衍生细胞群的药物组合物。
130.在某些实施方案中,所述受试者是哺乳动物,例如人。
131.在某些实施方案中,所在受试者中预防和/或治疗疾病包括癌症,感染性疾病,病毒性肺炎、艾滋病、免疫缺陷、免疫功能低下或自身免疫性疾病。
132.在本发明上下文各个方面的实施方案中,所述癌症的实例包括但不限于淋巴瘤、恶性血液病、慢性或急性白血病(包括急性髓细胞样白血病、慢性髓细胞样白血病、急性淋
巴细胞性白血病、慢性淋巴细胞性白血病)、多发性骨髓瘤、淋巴细胞性淋巴瘤、乳腺癌、卵巢癌、肝癌、胶质瘤、胰腺癌、肺癌、结肠癌、直肠癌、黑色素瘤、肾癌、膀胱癌、头颈癌、胃癌、鼻咽癌、喉癌、宫颈癌、子宫体瘤、骨肉瘤、骨癌、皮肤癌、前列腺癌、子宫癌、肛区癌、睾丸癌、输卵管癌、子宫内膜癌、阴道癌、阴户癌、霍奇金病、非霍奇金淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体瘤、膀胱癌、肾或输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管发生、脊柱肿瘤、脑干神经胶质瘤、垂体腺瘤、卡波西肉瘤、表皮状癌、鳞状细胞癌、t细胞淋巴瘤、环境诱发的癌症,包括石棉诱发的癌症,以及所述癌症的组合。
133.在本发明各个方面的实施方案中,所述感染性疾病可以是由选自病毒、细菌、真菌、寄生虫或原生动物的病原体引起,包括但不限于人hiv病毒、免疫缺陷病毒、脊髓灰质炎病毒、甲肝病毒、肠道病毒、鼻病毒、巨细胞病毒cmv、乙肝病毒hbv、单纯疱疹病毒hsv、带状疱疹病毒、冠状病毒、狂犬病毒、埃博拉病毒、副流感病毒、腮腺炎病毒、麻疹病毒、流感病毒、乳头状瘤病毒、多瘤病毒;巴斯德氏菌(pasteurella)、葡萄球菌(staphylococci)、链球菌(streptococcus)、大肠杆菌(escherichia coli)、假单胞菌(pseudomonas)、沙门氏菌(salmonella)、幽门螺旋杆菌(helicobacterpyloris)、分枝杆菌(mycobacteria)、淋病奈瑟球菌(neisseriagonorrhoeae)、脑膜炎奈瑟菌(neisseriameningitidis)、链球菌(streptococcus)、猪红斑丹毒丝菌(erysipelothrixrhusiopathiae)、产气荚膜梭菌(clostridium perfringers)、破伤风梭菌(clostridiumtetani)、产气肠杆菌(enterobacter aerogenes)、肺炎克雷氏菌(klebsiellapneumoniae)、多杀巴斯德菌(pasturellamultocida)、钩端螺旋体(leptospira)和立克次氏体(rickettsia);念珠菌属(candida)、曲霉属(aspergillus)、隐球菌属(cryptococcus)、组织胞浆菌属(histoplasma)、肺囊虫属(pneumocystis)和球孢菌属(coccidioides);牛巴贝虫(babeosis bovis)、疟原虫(plasmodium)、利什曼原虫(leishmania spp.)、鼠弓形体(toxoplasma gondii)以及克氏锥虫(trypanosoma cruzi)。
134.在某一些实施方案中,所述ric细胞是包含嵌合抗原受体(car)的ric细胞(car-ric细胞)。
135.在一些实施方案中,所述car包含抗原结合结构域,例如胞外抗原结合结构域。在一些实施方案中,所述抗原结合结构域对引起感染性疾病的病原体的抗原具有特异性。在一些实施方案中,所述抗原结合结构域对肿瘤相关抗原具有特异性。
136.所述肿瘤相关抗原包括但不限于双唾液酸神经节苷脂gd2、表皮生长因子受体(egfr)、egfr变体iii(egfrviii)、cd19、cd20、bcma(cd269、tnfrsf17)、ny-eso-1、cd16、cd64、cd78、cd96、cll1、cd116、cd117、cd71、cd45、cd71、cd123、cd138、erbb2(her2/neu)、癌胚抗原(cea)、上皮细胞粘附分子(epcam)、cd30、cd40、导管上皮粘蛋白、gp36、tag-72、鞘糖脂、神经胶质瘤相关的抗原、β-人绒毛膜促性腺激素、α胎儿球蛋白(afp)、外源凝集素反应性afp、甲状腺球蛋白、rage-1、mn-ca ix、人端粒酶逆转录酶、ru1、ru2(as)、肠羧基酯酶、mut hsp70-2、m-csf、前列腺酶(prostase)、前列腺酶特异性抗原(psa)、pap、ny-eso-1、laga-1a、p53、prostein、psma、存活和端粒酶、前列腺癌肿瘤抗原-1(pcta-1)、mage、elf2m、嗜中性粒细胞弹性蛋白酶、肝配蛋白b2、cd22、胰岛素生长因子(igf1)-i、igf-ii、igfi受体、间皮素、呈递肿瘤特异性肽表位的主要组织相容性复合体(mhc)分子、5t4、ror1、nkp30、
肿瘤基质抗原、纤维连接蛋白的额外结构域a(eda)和额外结构域b(edb)、腱生蛋白-c的a1结构域(tnc a1)、成纤维细胞相关蛋白(fap)、cd3、cd4、cd8、cd24、cd25、cd33、cd34、cd133、cd138、foxp3、b7-1(cd80)、b7-2(cd86)、gm-csf、细胞因子受体、内皮因子、主要组织相容性复合体(mhc)分子、tnfrsf17(uniprot q02223)、slamf7(uniprot q9nq25)、gprc5d(uniprot q9nzd1)、fkbp11(uniprot q9nyl4)、kamp3、itga8(uniprot p53708)和fcrl5(uniprot q68sn8)。
137.本发明各个方面的实施方案中,所述抗原结合结构域例如可以是单克隆抗体、合成的抗体、人抗体、人源化抗体、单域抗体、纳米抗体、抗体单链可变区(scfv),以及其抗原结合片段。在一些优选实施方式中,所述抗原结合结构域是scfv。
138.在本发明中可以通过各种合适的方式,向受试者施用如本文所述的ric细胞群和/或修饰的ric细胞衍生细胞或含ric细胞群及其衍生细胞群的药物组合物,或包含所述ric细胞群或培养物的药物组合物。在某些实施方案中,通过局部注射移植(例如,立体定向脑内注射移植或脊髓局部注射移植、实体瘤内注射)、血液循环途径移植(例如,静脉内注射移植或动脉内注射移植)或经脑脊液途径移植(例如,腰椎穿刺蛛网膜下腔注射移植)等途径向受试者施用如本文所述的ric细胞群和/或修饰的ric细胞衍生细胞或药物组合物。本领域技术人员已知如何根据病灶的位置和性质等选择合适的细胞移植途径。
139.在某些实施方案中,所述药物为单位剂量形式,并且所述单位剂量的药物中含有不少于1
×
104个/ml(例如不少于1
×
104个/ml,不少于3
×
104个/ml,不少于5
×
104个/ml,不少于7
×
104个/ml,不少于1
×
105个/ml,不少于3
×
105个/ml,不少于5
×
105个/ml,不少于7
×
105个/ml,不少于1
×
106个/ml,不少于3
×
106个/ml,不少于5
×
106个/ml,不少于7
×
106个/ml,不少于1
×
107个/ml,不少于3
×
107个/ml,不少于5
×
107个/ml,不少于7
×
107个/ml,不少于1
×
108个/ml,不少于3
×
108个/ml,不少于5
×
108个/ml,不少于7
×
108个/ml,不少于1
×
109个/ml,不少于3
×
109个/ml,不少于5
×
109个/ml,不少于7
×
109个/ml,不少于1
×
10
10
个/ml,不少于3
×
10
10
个/ml,不少于5
×
10
10
个/ml或不少于7
×
10
10
个/ml)所述ric细胞和/或修饰的ric细胞衍生细胞。在某些实施方案中,所述单位剂量的药物中含有1
×
104~1
×
10
10
个(例如1
×
106~1
×
108个,1
×
106~1
×
107个,或1
×
106~5
×
106个)所述ric细胞群和/或修饰的ric细胞衍生细胞群。
附图说明
140.此处所说明的附图用来提供对本发明的进一步理解,构成本技术的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
141.图1为psc诱导分化为ric流程图,其中psc包括esc和ipsc;ps,原条;lm,侧板中胚层;造血种子细胞,造血祖细胞;ric,诱导型ric细胞;
142.图2为实施例1的胚胎干细胞分化不同阶段节点的细胞形态;
143.图3为实施例1的胚胎干细胞分化为原条(tbxt )、侧板中胚层细胞(aplnr 、hand1 )。y轴值是qpcr分析相关基因mrna表达差异的结果。内参基因为actin,目的基因分别为tbxt、aplnr、hand1、msgn1和osr1。tbxt是原条特异性标记基因,aplnr和hand1是侧板中胚层细胞特异性标记基因,msgn1是轴旁中胚层特异性标记基因,osr1是间介中胚层特异性标记基因。分析方法是2-δct
法,即目的基因相对于内参基因的相对表达量;
144.图4为实施例1中流式分析原条(brachyury )和侧板中胚层(aplnr )的标记蛋白。brachyury是tbxt基因编码的蛋白,是原条身份标记。aplnr是侧板中胚层的身份标记;
145.图5为实施例1中流式分析图,流式分析表明,采用vtn材料与gr-mtg材料进行分化相比,esc来源的侧板中胚层aplnr分子表达强度更高。vtn是vitronectin(玻连蛋白),gr-mtg是growth factor reduced matrigel(低生长因子型基质胶);
146.图6为实施例2的多能干细胞分化不同阶段节点的ric囊形态,体视镜拍摄;
147.图7为ric囊可有效产生cd45 cd34 cd43 cd235a-造血种子细胞;
148.图8为实施例3的day 20,day 24和day 27ric成熟度变化;
149.图9为day 20,day 24和day 27ric细胞数量变化;
150.图10为d27 gfp 基质细胞消失,ric细胞显示高纯度;
151.图11为分离ric囊(d20)的造血种子细胞进行单层诱导获得的ric细胞(d27)产量统计;
152.图12为ric囊造血种子细胞移植至受体鼠体内诱导再生获得成熟ric细胞,图中bm是指骨髓,pb是指外周血,sp是指脾脏;
153.图13为esc-ric表达激活性受体,ncr2、ncr3、klrc2、klrk1和slamf7基因分别编码nkp44、nkp30、nkg2c、nkg2d和cs1激活性受体蛋白;
154.图14为ric细胞的表达抑制性受体,klrb1、klrc1、lair1、siglec7和cd96基因分别编码cd161、nkg2a、lair-1、siglec7和cd96抑制性受体蛋白;
155.图15为ncam1和klrd1基因分别编码cd56和cd94蛋白,主要与ric细胞的成熟相关;cd69、tnfsf10、faslg、prf1、gzma和gzmb基因分别编码cd69、trail、fasl、perforin、granzyme a和granzyme b,与ric细胞的活化及自然杀伤功能相关;
156.图16为ric(esc来源)与原代免疫细胞相比的独特表达基因模式。ric高表达nkg2-e,表达水平可达原代免疫细胞的400倍以上;低表达sell和cd2,表达水平为原代免疫细胞的1/50以下;
157.图17为多能干细胞(esc来源)的ric细胞体外杀伤淋巴瘤细胞系nalm-6来源肿瘤细胞。esc-1,-2,-3,-4,-5:五株中国国家干细胞资源库来源的esc细胞克隆。x轴,e:t比(ric效应细胞:肿瘤细胞)。y轴,残留肿瘤细胞百分比。共孵育时间6小时进行活细胞绝对计数检测;
158.图18为体外esc-ric细胞高效杀伤aml细胞thp-1和molm13。x轴,e:t比(ric效应细胞:肿瘤细胞)。y轴,肿瘤杀伤百分比。共孵育时间4小时检测。
159.图19为多能干细胞(esc来源)的ric细胞体外杀卵巢癌细胞系a1847来源肿瘤细胞。esc-1,-2,-3,-4,-5:五株中国国家干细胞资源库来源的esc细胞克隆。x轴,e:t比(ric细胞:肿瘤细胞)。y轴,残余肿瘤细胞占起始输入肿瘤的百分比。共孵育时间4小时检测;
160.图20多能干细胞(esc来源)的ric细胞可通过adcc作用增强杀伤b淋巴瘤细胞系raji。rituximab为anti-cd20利妥昔单抗。x轴,e:t比(ric细胞:肿瘤细胞)。y轴,杀伤肿瘤的百分比。共孵育时间4小时检测。
161.图21为ric(esc来源)体内杀伤a1847卵巢癌肿瘤细胞。a.治疗流程以及检测示意图。b-c.动态活体成像检测ric治疗组和肿瘤负荷对照组的肿瘤负荷。n=5,统计方法:one-way anova和kruskal-wallis test。ns,not significant。d.生存曲线分析。n=5,统计方
法:log-rank test。e.day 0和day 35治疗组与对照组荷瘤鼠体重。n=5,统计方法:two-sided independent t-test。
162.图22为ric(esc来源)体内杀伤hl60急性髓系白血病细胞。a.治疗流程以及检测示意图。b-c.动态活体成像检测ric治疗组和肿瘤负荷对照组的肿瘤负荷。n=5,统计方法:two-sided independent t-test。d.生存曲线分析。n=5,统计方法:log-rank test。e.day 0和day 28治疗组与对照组荷瘤鼠体重。n=5,统计方法:two-sided independent t-test。ns,not significant。*:p《0.05,**:p《0.01,***:p《0.001。
163.图23为ric细胞感染cd19-car的感染率。与原代免疫细胞相比,ric细胞感染cd19-car病毒(moi=20)后表达率高达82.4%,而天然免疫细胞(moi=35)的感染率只有14.9%。
164.图24为cd19-car-esc-ric高效杀伤all急淋病人原代肿瘤细胞。带有cd19-car的ric细胞与两例all患者来源的原代肿瘤细胞(cd19 b细胞)以1:1的比例在体外共孵育6小时后进行检测cd19 b细胞数量。y轴,残余肿瘤细胞占起始输入肿瘤的百分比;
165.图25为诱导多能干细胞分化不同阶段节点的细胞形态;
166.图26为诱导多能干细胞分化为原条(tbxt )、侧板中胚层细胞(aplnr hand1 )的特定细胞标记检测。y轴值是qpcr分析相关基因mrna表达差异的结果。内参基因为actin,目的基因分别为tbxt,aplnr,hand1,msgn1和osr1。tbxt是原条特异性标记基因,aplnr和hand1是侧板中胚层细胞特异性标记基因,msgn1是轴旁中胚层特异性标记基因,osr1是间介中胚层特异性标记基因。分析方法是2-δct
法,即目的基因相对于内参基因的相对表达量;
167.图27为流式分析原条(brachyury )和侧板中胚层(aplnr )的标记蛋白。brachyury是tbxt基因编码的蛋白,是原条身份标记。aplnr是侧板中胚层的身份标记;
168.图28为流式分析表明,采用vtn材料与gr-mtg材料进行分化相比,ipsc来源的侧板中胚层aplnr分子表达强度更高。vtn是vitronectin(玻连蛋白),gr-mtg是growth factor reduced matrigel(低生长因子型基质胶)。;
169.图29为day 20、day 24和day 27ric成熟度变化;
170.图30为day 20、day 24和day 27ric细胞数量变化;
171.图31为d27 gfp 基质细胞消失;
172.图32为分离rci囊(d20)的造血种子细胞进行单层诱导获得的ric细胞(d27)产量;
173.图33为ipsc-ric表达激活性受体,ncr2、ncr3、klrc2、klrk1和slamf7基因分别编码nkp44、nkp30、nkg2c、nkg2d和cs1激活性受体蛋白;
174.图34为ipsc-ric细胞表达抑制性受体,klrb1、klrc1、lair1、siglec7和cd96基因分别编码cd161、nkg2a、lair-1、siglec7和cd96抑制性受体蛋白;
175.图35为ncam1,klrd1基因分别编码cd56,cd94蛋白;cd69,tnfsf10,faslg,prf1,gzma,gzmb基因分别编码cd69,trail,fasl,perforin,granzyme a和granzyme b;
176.图36为ric(ipsc来源)与原代免疫细胞相比的独特表达基因模式。ric高表达nkg2-e,表达水平可达原代免疫细胞的400倍以上;低表达sell和cd2,表达水平为原代免疫细胞的1/50以下;
177.图37为多能干细胞(ipsc来源)的ric细胞体外杀伤淋巴瘤细胞系nalm-6来源肿瘤细胞。x轴,e:t比(ric效应细胞:肿瘤细胞)。y轴,残留肿瘤细胞百分比。共孵育时间6小时进行活细胞绝对计数检测;
178.图38为多能干细胞(ipsc来源)的ric细胞体外杀卵巢癌细胞系a1847来源肿瘤细胞。x轴,e:t比(ric细胞:肿瘤细胞)。y轴,残余肿瘤细胞占起始输入肿瘤的百分比。共孵育时间4小时检测;
179.图39为多能干细胞(ipsc来源)的ric细胞可通过adcc作用增强杀伤b淋巴瘤细胞系raji。rituximab为anti-cd20利妥昔单抗。x轴,e:t比(ric细胞:肿瘤细胞)。y轴,杀伤肿瘤的百分比。共孵育时间4小时检测。
180.图40:ric(ipsc来源)体内杀伤a1847卵巢癌肿瘤细胞。a.治疗流程以及检测示意图。b-c.动态活体成像检测ric治疗组和肿瘤负荷对照组的肿瘤负荷。n=5,统计方法:one-way anova和kruskal-wallis test。ns,not significant。d.生存曲线分析。n=5,统计方法:log-rank test。e.day 0和day 35治疗组与对照组荷瘤鼠体重。n=5,统计方法:two-sided independent t-test。;
181.图41:ric细胞感染cd19-car的感染率。与原代免疫细胞相比,ric细胞感染cd19-car病毒(moi=20)后表达率高达83.0%,而天然免疫细胞(moi=35)的感染后表达率只有33.4%;
182.图42:cd19-car-ipsc-ric高效杀伤all急淋病人原代肿瘤细胞。带有cd19-car的ric细胞与all患者来源的原代肿瘤细胞(cd19 b细胞)以1:1的比例在体外共孵育6小时后进行检测cd19 b细胞数量。y轴,残余肿瘤细胞占起始输入肿瘤的百分比。
具体实施方式
183.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。以下对至少一个示例性实施例的描述实际上仅仅是说明性的,绝不作为对本发明及其应用或使用的任何限制。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
184.下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。本发明所用试剂和原料均市售可得。
185.可参照图1将psc诱导分化为ric,其中,图1中各符号含义以及培养基组成如下所示:
186.psc包括esc和ipsc;ps指原条;lm指侧板中胚层;造血种子细胞,即造血祖细胞;ric指诱导型ric细胞。
187.培养基ⅰ:含有40ng/ml bmp4(r&d systems,314-bp-010),30ng/ml activin a(peprotech,120-14p),20ng/ml bfgf(peprotech,100-18b),6μm chir-99021(selleck,s1263)和100nm pik-90(selleck,s1187)的essential 6培养基(gibco,a1516401或stemcell technologies,05946)。
188.培养基ⅱ:含有30ng/ml bmp4(r&d systems,314-bp-010),1μm a-83-01(selleck,s7692)和1μm c59(selleck,s7037)的essential 6培养基。
189.培养基ⅲ:含有10μm sb431542(selleck,s1067),10μm氢化可的松(selleck,s1696),5ng/ml flt3l(peprotech,300-19),5ng/ml tpo(peprotech,300-18),50ng/ml scf(peprotech,300-07),50ng/ml egf(peprotech,100-47),50ng/ml vegf(r&d system,
293-ve-010),50ng/ml bfgf(peprotech,100-18b),50ng/ml igf-1(peprotech,100-11),50μg/ml抗坏血酸和2%supergrow细胞培养添加物(达科为,6122011)的essential 6培养基。
190.培养基ⅳ:55%dmem-high glucose(hyclone,sh30022.01b),30%dmem/f12(hyclone,sh30023.01b),15%supergrow细胞培养添加物(达科为,6122011),2mm glutamax
tm
(gibco,35050061),1μmβ-巯基乙醇(sigma-aldrich,m3148),5ng/ml亚硒酸钠(sigma-aldrich,s5261),50um乙醇胺(sigma-aldrich,15014),20μg/ml抗坏血酸(sigma-aldrich,a-5960),1%青霉素-链霉素溶液(hyclone,sv30010),5ng/ml il-3(peprotech,200-03),20ng/ml scf,20ng/ml il-7(peprotech,200-07),10ng/ml il-15(peprotech,200-15)和10ng/ml flt3l(peprotech,300-19)。
191.具体实施方案如下:
192.实施例1多能干细胞(esc来源)分化为侧板中胚层。
193.将单层培养至80%贴壁密度的多能干细胞(esc来源)用accutase(sigma-aldrich,a6964)消化1min,用nctarget培养基(中盛溯源,rp01020)重悬为单细胞悬液,加入2μm rock inhibitor thiazovivin(selleck,s1459)后转移至铺有vtn(animal-free human vitronectin matrix,peprotech,af-vmb-220)的细胞培养皿中,在培养箱中培养24h(此时定义为诱导程序的day 0)。吸去培养皿中的nctarget培养基,加入培养基i,培养箱中继续培养24h(此时定义为诱导程序的day 1)。吸去培养基i,加入培养基ii,继续培养24h(此时定义为诱导程序的day 2)。分别在d0,d1和d2对细胞进行拍照(图2),qpcr检测原条(brachyury ,编码基因为tbxt)和侧板中胚层(aplnr hand1 msgn1-osr1-)的身份标记(图3)和流式检测原条和侧板中胚层诱导效率(图4)。选择vtn的原因是vtn材料与gr-mtg(growth factor reduced matrigel)相比,在其他条件不变的情况下获得侧板中胚层效率更高(图5)。
194.实施例2 ric囊培养-造血种子细胞((esc来源)阶段诱导
195.具体步骤为:
196.消化侧板中胚层细胞制备成单细胞悬液,与op9-dll1/dll4滋养细胞混合,两种细胞混合比例范围可以是1:5-1:200范围,细胞总量根据培养皿孔径大小调整20-1000万,制备成ric囊。每一个ric囊占用培养表面积1-10cm2,在培养基iii条件下,继续诱导10-18天,每1-3天换一次液,并在day9和day 16对ric囊单元形态变化进行拍照记录(图6)。选取day 16的ric囊进行单细胞流式检测造血种子细胞(cd45 cd34 cd43 cd235a-),这种方法比将lm直接进行单层细胞诱导更高效获得cd34 表型的造血种子细胞(图7)。
197.实施例3 ric囊产生ric(esc来源)
198.将培养基iii更换为培养基iv,继续培养ric囊7-14天,每1-3天换一次液。在day 20和day 27对ric囊进行拍照记录(图6)。在day 20,day 24和day 27取ric囊制备单细胞悬液进行流式检测esc-ric细胞(cd45 cd56 ),并抽样进行统计细胞得率(图8,9)。此外,d27已检测不到gfp 基质细胞(图10),并对day27收获的esc-ric细胞进行拍照(图2)。
199.实施例4 ric(esc来源)单层诱导
200.选择性的,将培养基iii培养的day 20ric囊取出制备成单细胞悬液,分选剔除gfp 基质细胞,剩下的造血种子细胞、免疫种子细胞混合物添加培养基iv后转移到培养皿单层
培养,每2天换一次液,继续培养7-14天,可诱导获得成熟的ric细胞,该单层诱导方案同样可以诱导获得高纯度高得率的ric细胞(图11)。
201.实施例5 ric(esc来源)体内诱导
202.分离day 20ric囊中的造血种子细胞后移植至受体鼠内,经过12天后检测到骨髓(bm)、外周血(pb)和脾脏(sp)能高效再生出成熟的ric细胞(图12)。
203.实施例6 ric(esc来源)的单细胞测序转录组特征。
204.将单个ric,单个脐带血来源原代免疫细胞进行深度单细胞rna测序(原代免疫细胞数为32个,esc-ric细胞数为41个,测序方法:smartseq2)。进一步对测序数据进行对比分析,显示ric和原代免疫细胞类似,表达激活性受体nkp30,nkp44,nkg2c,nkg2d,cs1等(图13),抑制性受体klrb1,klrc1,lair1,siglec7,cd96等(图14),表面标记和功能活性相关蛋白cd56,cd94,cd69,trail,fasl,perforin,granzyme a和granzyme b等(图15)。但是,ric与天然原代免疫细胞相比有明显的不同,体现在ric的独特基因表达特征,例如ric与天然原代免疫细胞相比高表达nkg2-e,低表达sell和cd2(图16)。
205.实施例7 ric(esc来源)体外杀伤nalm-6肿瘤细胞
206.将ric(esc来源)与nalm-6肿瘤细胞系共孵育,测试ric细胞的天然杀伤肿瘤细胞的活性。其中,图17:多能干细胞(esc来源)的ric细胞体外杀伤淋巴瘤细胞系nalm-6来源肿瘤细胞。esc-1,-2,-3,-4,-5:五株中国国家干细胞资源库来源的esc细胞克隆。x轴,e:t比(ric效应细胞:肿瘤细胞)。y轴,残留肿瘤细胞百分比。共孵育时间6小时进行活细胞绝对计数检测。
207.实施例8 ric(esc来源)体外高效杀伤急性髓系白血病(aml)细胞
208.具体见图18,多能干细胞(esc来源)的ric细胞体外杀伤aml细胞系thp-1和molm13。x轴,e:t比(ric效应细胞:肿瘤细胞)。y轴,肿瘤杀伤百分比。共孵育时间4小时检测。
209.实施例9 ric(esc来源)体外杀伤a1847卵巢癌肿瘤细胞
210.具体见图19,多能干细胞(esc来源)的ric细胞体外杀卵巢癌细胞系a1847来源肿瘤细胞。esc-1,-2,-3,-4,-5:五株中国国家干细胞资源库来源的esc细胞克隆。x轴,e:t比(ric细胞:肿瘤细胞)。y轴,残余肿瘤细胞占起始输入肿瘤的百分比。共孵育时间4小时检测。
211.实施例10 ric(esc来源)可联合单克隆抗体经adcc作用介导增强抗肿瘤活性
212.具体见图20:ric细胞(esc来源)可通过adcc作用增强杀伤b淋巴瘤细胞系raji。rituximab为anti-cd20利妥昔单抗。x轴,e:t比(ric细胞:肿瘤细胞)。y轴,杀伤肿瘤的百分比。共孵育时间4小时检测。
213.实施例11 ric(esc来源)体内杀伤a1847卵巢癌肿瘤细胞
214.首先建立a1847卵巢癌肿瘤小鼠模型。每只6-8周龄nsg小鼠(没有ric,t,b免疫细胞的免疫缺陷小鼠)通过腹腔注射的方式接种2
×
105个a1847-luciferase (荧光素酶阳性)细胞。在接种肿瘤细胞一天后,对肿瘤模型进行活体成像(ivis spectrum,perkinelmer)。然后通过腹腔注射的方式对每只小鼠移植1~1.5
×
107个ric细胞(500μl)进行治疗。每周输注一次,连续输注两周。在治疗后21天内注射il-2(10000u/mouse),每两天注射一次。每间隔3-4天对小鼠进行活体成像,分析肿瘤负荷变化。esc-ric可有效杀伤体
内a1847卵巢癌细胞。(图21)
215.实施例12 ric(esc来源)体内杀伤aml细胞
216.首先建立hl60 aml小鼠模型。每只6-8周龄nsg小鼠(没有ric,t,b免疫细胞的免疫缺陷小鼠)通过腹腔注射的方式接种1
×
106个hl60-luciferase (荧光素酶阳性)细胞。在接种肿瘤细胞三天后,对肿瘤模型进行活体成像(ivis spectrum,perkinelmer)。然后通过尾静脉注射的方式对每只小鼠移植1~1.5
×
107个ric细胞(200μl)进行治疗。每周输注三次,连续输注两~三周。每间隔7天对小鼠进行活体成像,分析肿瘤负荷变化。esc-ric可有效杀伤hl60 aml细胞。(图22)
217.实施例13 cd19-car-esc-ric(esc来源)杀伤all急淋病人原代肿瘤细胞。
218.首先利用cd19-car慢病毒感染脐血来源的原代免疫细胞和esc-ric细胞。各取5
×
106个原代免疫细胞和esc-ric细胞利用离心感染的方式感染cd19-car慢病毒(原代免疫细胞:moi=35,esc-ric细胞:moi=20)。细胞感染48小时后利用流式细胞仪检测其感染效率,首先各取少量细胞(每种细胞取2
×
105个)孵育cd56-apc和anti-mouse fmc63 scfv monoclonal antibody,pe(cd19-car-pe)抗体,孵育后利用流式细胞仪检测其感染效率,未染色的原代免疫细胞(nc)和esc-ric(nc)作为阴性对照,用以检测cd19-car的阳性率。cd19-car-原代免疫细胞的感染效率为14.9%,cd19-car-esc-ric的感染率高达82.4%(图23)。表达cd19-car后的ric可在体外高效杀伤急性b淋巴细胞白血病患者的b细胞(图24)。图24:cd19-car-esc-ric高效杀伤all急淋病人原代肿瘤细胞。带有cd19-car的ric细胞与两例all患者来源的原代肿瘤细胞(cd19 b细胞)以1:1的比例在体外共孵育6小时后进行检测cd19 b细胞数量。y轴,残余肿瘤细胞占起始输入肿瘤的百分比。
219.实施例14多能干细胞(ipsc来源)分化为侧板中胚层。
220.将单层培养至80%贴壁密度的多能干细胞(ipsc来源)用accutase(sigma-aldrich,a6964)消化1min,用nctarget培养基(中盛溯源,rp01020)重悬为单细胞悬液,加入2μm rock inhibitor thiazovivin(selleck,s1459)后转移至铺有vtn(animal-free human vitronectin matrix,peprotech,af-vmb-220)的细胞培养皿中,在培养箱中培养24h(此时定义为诱导程序的day 0)。吸去培养皿中的nctarget培养基,加入培养基i,培养箱中继续培养24h(此时定义为诱导程序的day 1)。吸去培养基i,加入培养基ii,继续培养24h(此时定义为诱导程序的day 2)。分别在d0,d1和d2对细胞进行拍照(图25),qpcr检测原条(brachyury ,编码基因为tbxt)和侧板中胚层(aplnr hand1 msgn1-osr1-)的身份标记(图26)和流式检测原条和侧板中胚层诱导效率(图27)。选择vtn的原因是vtn材料与gr-mtg(growth factor reduced matrigel)相比,在其他条件不变的情况下获得侧板中胚层效率更高(图28)。
221.实施例15 ric囊产生ric(ipsc来源)
222.参照实施例1-4中方法,ipsc经过培养基ⅰ、ⅱ、ⅲ、ⅳ的诱导作用下,可获得ipsc来源的ric细胞。分别在day 20,day 24和day 27取ric囊制备单细胞悬液进行流式检测ipsc-ric细胞(cd45 cd56 ),并抽样进行统计细胞得率(图29,30)。此外,day 27已检测不到gfp 基质细胞(图31)。
223.实施例16 ric(ipsc来源)单层诱导
224.选择性的,将培养基iii培养的day 20ric囊取出制备成单细胞悬液,分选剔除gfp
基质细胞,剩下的造血种子细胞、免疫种子细胞混合物添加培养基iv后转移到培养皿单层培养,每2天换一次液,继续培养7-14天,可诱导获得成熟的ric细胞,该单层诱导方案同样可以诱导获得高纯度高得率的ric细胞(图32)。
225.实施例17 ric(ipsc来源)的单细胞测序转录组特征。
226.将单个ric,单个脐带血来源原代免疫细胞进行深度单细胞rna测序(原代免疫细胞数为32个,ipsc-ric细胞数为41个,测序方法:smartseq2)。进一步对测序数据进行对比分析,显示ric和原代免疫细胞类似,表达激活性受体nkp30,nkp44,nkg2c,nkg2d,cs1等(图33),抑制性受体klrb1,klrc1,lair1,siglec7,cd96等(图34),表面标记和功能活性相关蛋白cd56,cd94,cd69,trail,fasl,perforin,granzyme a和granzyme b等(图35)。但是,ric与天然ric相比有明显的不同,体现在ric的独特基因表达特征,例如ric与天然原代免疫细胞相比高表达nkg2-e,低表达sell和cd2(图36)。
227.实施例18 ric(ipsc来源)体外杀伤nalm-6肿瘤细胞
228.将ric(ipsc来源)与nalm-6肿瘤细胞系共孵育,测试ric的天然杀伤肿瘤细胞的活性。图37:多能干细胞(ipsc来源)的ric细胞体外杀伤淋巴瘤细胞系nalm-6来源肿瘤细胞。x轴,e:t比(ric效应细胞:肿瘤细胞)。y轴,残留肿瘤细胞百分比。共孵育时间6小时进行活细胞绝对计数检测。
229.实施例19 ric(ipsc来源)体外杀伤a1847卵巢癌肿瘤细胞
230.图38:多能干细胞(ipsc来源)的ric细胞体外杀卵巢癌细胞系a1847来源肿瘤细胞。x轴,e:t比(ric细胞:肿瘤细胞)。y轴,残余肿瘤细胞占起始输入肿瘤的百分比。共孵育时间4小时检测。
231.实施例20 ric(ipsc来源)可联合单克隆抗体经adcc作用介导增强抗肿瘤活性
232.具体见图39:ipsc-ric细胞可通过adcc作用增强杀伤b淋巴瘤细胞系raji。rituximab为anti-cd20利妥昔单抗。x轴,e:t比(ric细胞:肿瘤细胞)。y轴,杀伤肿瘤的百分比。共孵育时间4小时检测。
233.实施例21 ric(ipsc来源)体内杀伤a1847卵巢癌肿瘤细胞
234.首先建立a1847卵巢癌肿瘤小鼠模型。每只6-8周龄nsg小鼠(没有ric,t,b免疫细胞的免疫缺陷小鼠)通过腹腔注射的方式接种2
×
105个a1847-luciferase (荧光素酶阳性)细胞。在接种肿瘤细胞一天后,对肿瘤模型进行活体成像(ivis spectrum,perkinelmer)。然后通过腹腔注射的方式对每只小鼠移植1~1.5
×
107个ric细胞(500μl)进行治疗。每周输注一次,连续输注两周。在治疗后21天内注射il-2(10000u/mouse),每两天注射一次。每间隔3-4天对小鼠进行活体成像,分析肿瘤负荷变化。ipsc-ric可有效杀伤体内a1847卵巢癌细胞。图40:ric(ipsc来源)体内杀伤a1847卵巢癌肿瘤细胞。a,治疗流程以及检测示意图。b,动态活体成像检测ric治疗组和肿瘤负荷对照组的肿瘤负荷。
235.实施例22 cd19-car-ipsc-ric(ipsc来源)杀伤all急淋病人原代肿瘤细胞。
236.首先利用cd19-car慢病毒感染脐血来源的原代免疫细胞和ipsc-ric细胞。各取5
×
106个原代免疫细胞和ipsc-ric细胞利用离心感染的方式感染cd19-car慢病毒(原代免疫细胞:moi=35,ipsc-ric细胞:moi=20)。细胞感染48小时后利用流式细胞仪检测其感染效率,首先各取少量细胞(每种细胞取2
×
105个)孵育cd56-apc和anti-mouse fmc63 scfv monoclonal antibody,pe(cd19-car-pe)抗体,孵育后利用流式细胞仪检测其感染效率,未
染色的原代免疫细胞(nc)和ipsc-ric(nc)作为阴性对照,用以检测cd19-car的阳性率。图41为ric细胞感染cd19-car的感染率。与原代免疫细胞相比,ric细胞感染cd19-car病毒(moi=20)后表达率高达83.0%,而天然免疫细胞(moi=35)的感染后表达率只有33.4%。图42为cd19-car-ipsc-ric高效杀伤all急淋病人原代肿瘤细胞。带有cd19-car的ric细胞与all患者来源的原代肿瘤细胞(cd19 b细胞)以1:1的比例在体外共孵育6小时后进行检测cd19 b细胞数量。y轴,残余肿瘤细胞占起始输入肿瘤的百分比。
237.除本文中描述的那些外,根据前述描述,本发明的各种修改对本领域技术人员而言会是显而易见的,这样的修改也意图落入所附权利要求书的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。