用于预测膀胱癌患者对ici类药物敏感性的模型和应用
技术领域
1.本发明涉及一种用于预测晚期膀胱癌患者应用ici类药物敏感性的模型及应用,设计预测晚期膀胱癌患者应用ici类药物敏感人群的界定。
背景技术:
2.越来越多的研究者开始关注肿瘤进展和免疫状态的联系。对于罹患包括膀胱癌在内的肿瘤患者而言,免疫检查点抑制剂(immune checkpoint inhibitor,ici)疗法已经成为最有前景的治疗方式[1-5]。抗体靶向程序性死亡受体1(programmed cell death protein 1,pd-1),程序性死亡配体1(programmed death-ligand 1,pd-l1)和细胞毒性t淋巴细胞相关蛋白4(cytotoxic t-lymphocyte-associated protein 4 ,ctla4)已经显示出较高的疗效。但不幸的是,只有部分晚期膀胱癌的患者可以从ici治疗中获益[4,6-8]。在一个2期多中心临床试验中,晚期膀胱癌患者对阿替利珠单抗(atezolizumab),一种pd-l1抑制剂的客观缓解率仅为15%[4]。在一项3期国际临床试验中,晚期膀胱癌患者对派姆单抗(pembrolizumab),一种pd-1抑制剂的客观缓解率仅为21.1%[7]。令人鼓舞的是,近期研究已经发现一些ici治疗的阳性预测标记物,例如肿瘤突变负荷(tumor mutation burden, tmb)和微卫星不稳定(microsatellite instability,msi)[9-11]。高水平的tmb和msi与不断累积的新抗原相关,进而刺激免疫应答,导致患者对ici治疗有较好的治疗反应。此外,基因突变特征也逐渐被认为是tmb和msi预测ici治疗反应的较好补充[12,13]。然而,经过验证的膀胱癌ici治疗生物标记物很少被报道。在晚期膀胱癌中,dna损伤修复基因(dna damage response and repair,ddr)和ici治疗反应间的关联已经被阐述,而atm是ddr相关基因中最常改变的基因[14]。thiago等人曾报道在肌层浸润性膀胱癌中,ddr基因突变和肿瘤免疫调控基因表达相关[15]。此外,sangeeta等人也曾报道过arid1a突变加cxcl13表达作为复合生物标记物预测晚期转移膀胱癌对ici治疗的反应[16]。综上所述,体细胞突变有可能成为潜的在生物标记物来预测晚期膀胱癌对ici治疗的反应。
技术实现要素:
[0003]
本发明所要解决的技术问题是克服临床晚期膀胱癌患者应用ici类药物药物敏感性预测和应用方面存在的不足和缺陷,提供一种用于预测晚期膀胱癌患者应用ici类药物敏感性的模型及应用。通过对tp53、pik3ca和atm靶向测序获取基因突变信息,应用cox回归模型建立患者的风险评分模型,将患者分为低危组、中危组和高危组,达到预测晚期膀胱癌患者应用ici类药物敏感性的目的,并建议低危组患者使用ici类药物进行治疗,中危组患者结合临床实际考虑使用ici类药物,高危组患者慎重考虑使用ici类药物进行治疗。
[0004]
本发明的目的是提供一种用于预测膀胱癌患者应用ici类药物敏感性的模型,其特征在于,所述模型通过检测患者tp53、pik3ca和atm突变情况,计算风险评分=(-0.492*tp53) (0.562*pik3ca)-(1.454*atm)。
[0005]
本发明的另一个目的是提供上述模型的应用。
[0006]
本发明的上述目的是通过以下技术方案给予实现的:预测晚期膀胱癌患者应用ici类药物敏感性的模型,通过风险评分分为低危组,中危组和高危组,指导临床用药。
[0007]
本发明还请求保护上述分类器在预测晚期肿瘤患者对ici类药物敏感性方法中的应用。与现有技术相比,本发明具有以下有益效果:本发明公开了一种用于预测晚期膀胱癌患者对ici类药物敏感性的模型及应用。通过靶向测序获取患者肿瘤组织tp53、pik3ca和atm突变情况,根据风险评分将患者分为低危组,中危组和高危组,指导临床ici治疗,对延长患者生存期,减轻患者经济负担和减少医疗资源浪费有具有重大意义。
[0008]
具体实施方法以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0009]
实施例1 用于预测晚期膀胱癌患者应用ici类药物敏感性的生物标记物及预后风险模型建立。
[0010]
1、晚期膀胱癌患者肿瘤突变信息测定。
[0011]
(1) 提取晚期膀胱癌患者肿瘤组织及配对的正常组织dna。
[0012]
(2) 对上述样本进行高通量靶向测序。
[0013]
(3)体细胞突变定义为肿瘤组织中检测到编码区中的非同义体细胞变异(nonsynonymous variations)、插入(insertions)和缺失(deletions)。
[0014]
2、预测晚期膀胱癌患者 ici类药物敏感性的生物标记物筛选及预后风险模型的建立。
[0015]
(1)从cbioportal数据库下载并分析了来自5个队列的881个膀胱癌患者的体细胞突变数据,包括memorial sloan kettering cancer center(mskcc) ici治疗队列(n=215),mskcc 非ici治疗队列(n=172),tcga 队列(n=412),weill cornell medicine/university of trento (cornell/trento) 队列 (n=32),dana-farber cancer institute/mskcc (dfci/mskcc)队列(n=50)。
[0016]
(2)统计881个膀胱癌患者中突变频率排位前20的基因顺序为:tp53、ttn、kdm6a、arid1a、kmt2d、pik3ca、fgfr3、muc16、rb1、kmt2c、crebbp、ep300、atm、erbb2、stag2、cdkm1a、erbb3、fat1、syne1、ryr2。
[0017]
(3)为了研究对ici治疗敏感的膀胱癌患者基因特征,我们选择215人的mskcc ici治疗列队做为训练组。此队列所有膀胱癌患者都接受了pd-1/pd-l1抑制剂治疗或者加入ctla-4抑制剂的联合治疗。
[0018]
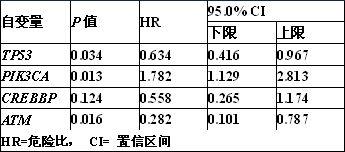
(4)我们首先使用单因素cox回归分析检测了突变频率前20的基因,发现tp53, pik3ca,atm和crebbp有统计学差异(表1)。在对四个潜在的预后因子进行多因素校正后,只有tp53, pik3ca,atm显示出独立预测价值(p 《0.05),被选为预后因子(表2)。crebbp因为p >0.05被排除。最终,tp53, pik3ca,atm被纳入多因素cox生存分析,我们能够根据cox回归系数为每一个患者计算风险评分(表3):风险评分=(-0.492*tp53) (0.562*pik3ca)-(1.454*atm)。其中基因未突变记为0,基因突变记为1。
[0019]
(5)215人的训练组风险评分,范围从-1.946到0.562。我们评估了tp53/pik3ca/atm突变模型风险评分分布和接受了ici治疗患者的生存状态。我们发现患者的风险评分越低,对ici治疗的反应越好(图1)。我们使用x-tile软件确定最佳分界点,患者风险评分《0被分为低危组,》0.07被分为高危组,其余患者被分为中危组。和中高危组患者相比,低危组患者治疗效果和生存明显优于中位组和高危组(图2, log-rank p《0.0001)。森林图cox生存分析显示风险评分分组是膀胱癌患者生存提高的强烈预测因子(图3)。使用时间依赖的roc曲线来描述模型的预测价值。风险评分分组的3年auc为0.78,高于肿瘤突变负荷的预测值0.73(图4)。
[0020]
3、用于预测晚期膀胱癌患者应用ici类药物敏感性的预后风险模型验证。
[0021]
为了评估tp53/pik3ca/atm突变预后风险模型的效力,我们在一个由263名imvigor210队列,26名膀胱癌患者来自broad/dana-farber队列。验证组中所有膀胱癌患者均接受了ici治疗。在验证组中,患者的风险评分越低,从ici治疗中获益越多(图5),与训练组结果一致。低危组患者的治疗反应和生存明显优于中危组和高危组(图6)。单因素和多因素cox生存分析显示风险评分分组是膀胱癌患者生存提高的强烈预测因子(表4)。
[0022]
实施例2、用于预测晚期膀胱癌患者应用ici类药物敏感性的模型的应用具体的,用于预测晚期膀胱癌患者应用ici类药物敏感性的模型应用方法为:s1.提取晚期膀胱癌患者肿瘤组织及配对的正常组织dna;s2.对上述样本进行高通量靶向测序;s3.通过风险评分=(-0.492*tp53) (0.562*pik3ca)-(1.454*atm),计算出患者的风险评分。
[0023]
s4.根据模型阈值(0,0.07)将患者分组,风险评分小于0分分入低危组,风险评分大于0.07分入高危组,其余分入中危组。风险评分越低,患者对ici类药物更敏感,os提高更多。
[0024]
s5.临床中对低危组的患者推荐使用ici类药物治疗;对中危组的患者结合临床实际考虑使用ici类药物;对高危组患者慎重考虑使用ici类药物进行治疗。
[0025]
以上对本发明公开的一种用于预测晚期膀胱癌患者应用ici类药物敏感性的模型及应用进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
[0026]
表1:mskcc ici 治疗队列(n=215)膀胱癌患者突变频率前20位基因的单因素cox回归分析。
[0027] 表2:mskcc ici 治疗队列(n=215)膀胱癌患者四个潜在预后因子的多因素cox回归分析。
[0028]
表3: mskcc ici 治疗队列(n=215)膀胱癌患者3个预后因子的多因素cox回归分析。
[0029]
表4:验证组膀胱癌患者(n=263)的单因素和多因素cox回归分析。
[0030]
附图说明
[0031]
图1是本发明实施例1中训练组队列风险评分与患者生存状态图。
[0032]
图2是训练组队列根据风险评分分组的kaplan-meier曲线图。
[0033]
图3是训练组队列中包含年龄、用药、性别、风险评分和tmb的森领图。
[0034]
图4是训练组队列中对风险评分和tmb的时间依赖性roc曲线图。
[0035]
图5是验证组队列风险评分与患者生存状态图。
[0036]
图6验证组队列根据风险评分分组的kaplan-meier曲线图。
[0037]
参考文献1.hodi fs, o'day sj, mcdermott df, et al. improved survival with ipilimumab in patients with metastatic melanoma. n engl j med 2010; 363(8): 711-23.2.motzer rj, escudier b, mcdermott df, et al. nivolumab versus everolimus in advanced renal-cell carcinoma. n engl j med 2015; 373(19): 1803-13.3.borghaei h, paz-ares l, horn l, et al. nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. n engl j med 2015; 373(17): 1627-39.4.rosenberg je, hoffman-censits j, powles t, et al. atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. lancet 2016; 387(10031): 1909-20.5.antonia sj, villegas a, daniel d, et al. durvalumab after chemoradiotherapy in stage iii non-small-cell lung cancer. n engl j med 2017; 377(20): 1919-29.6.balar av, galsky md, rosenberg je, et al. atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. lancet 2017; 389(10064): 67-76.7.bellmunt j, de wit r, vaughn dj, et al. pembrolizumab as second-line therapy for advanced urothelial carcinoma. n engl j med 2017; 376(11): 1015-26.
8.sharma p, retz m, siefker-radtke a, et al. nivolumab in metastatic urothelial carcinoma after platinum therapy (checkmate 275): a multicentre, single-arm, phase 2 trial. lancet oncol 2017; 18(3): 312-22.9.samstein rm, lee ch, shoushtari an, et al. tumor mutational load predicts survival after immunotherapy across multiple cancer types. nat genet 2019; 51(2): 202-6.10. mandal r, samstein rm, lee kw, et al. genetic diversity of tumors with mismatch repair deficiency influences anti-pd-1 immunotherapy response. science 2019; 364(6439): 485-91.11. petrelli f, ghidini m, ghidini a, tomasello g. outcomes following immune checkpoint inhibitor treatment of patients with microsatellite instability-high cancers: a systematic review and meta-analysis. jama oncol 2020; 6(7): 1068-71.12. chen y, chen g, li j, et al. association of tumor protein p53 and ataxia-telangiectasia mutated comutation with response to immune checkpoint inhibitors and mortality in patients with non-small cell lung cancer. jama netw open 2019; 2(9): e1911895.13. wang f, zhao q, wang yn, et al. evaluation of pole and pold1 mutations as biomarkers for immunotherapy outcomes across multiple cancer types. jama oncol 2019; 5(10): 1504-6.14. teo my, seier k, ostrovnaya i, et al. alterations in dna damage response and repair genes as potential marker of clinical benefit from pd-1/pd-l1 blockade in advanced urothelial cancers. j clin oncol 2018; 36(17): 1685-94.15. vidotto t, nersesian s, graham c, siemens dr, koti m. dna damage repair gene mutations and their association with tumor immune regulatory gene expression in muscle invasive bladder cancer subtypes. j immunother cancer 2019; 7(1): 148.16. goswami s, chen y, anandhan s, et al. arid1a mutation plus cxcl13 expression act as combinatorial biomarkers to predict responses to immune checkpoint therapy in mucc. scitransl med 2020; 12(548)。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。