1.本发明涉及辅助生殖技术领域,特别涉及一种基于胚胎培养液的植入前胚胎的无创筛选方法。
背景技术:
2.辅助生殖技术是解决不孕不育的有效临床技术,根据《reproductive biology and endocrinology》的统计,目前超过20%的不孕不育夫妻必须通过辅助生殖技术治疗。
3.提高辅助生殖的出生率一直是辅助生殖医学领域面临的挑战。辅助生殖过程中挑选优良的胚胎进行移植是提高出生率的有效方法。目前,临床上普遍采用形态学指标以及胚胎植入前遗传学筛查(preimplantation genetic screeing,pgs)来评价和挑选胚胎。
4.形态学指标主要是指根据gardner囊胚评分系统对形成的囊胚进行评分,例如4aa、4bb、4ab等;其中,数字代表囊胚细胞的密度和分裂程度的等级,分为1级到6级,6级为最佳。第1个字母表示将来发育成胎儿的内细胞团的质量,第2个字母表示将来发育成胎盘的滋养层细胞的质量。质量等级最好为a,依次为b、c。虽然采用形态学指标来筛选胚胎,易于操作,但形态学指标无法反映出胚胎遗传物质是否存在异常,并且不能反映胚胎的发育质量以及携带疾病的风险。研究发现,在形态学良好的囊胚中,仅42%的胚胎是染色体完全正常的;其中,仅30%的icm评级为a的胚胎,染色体是正常的(munn
é
et al.,2010)。临床研究发现,胚胎染色体发生异常的概率会随着父母年龄,尤其是女方年龄的增长而升高。研究发现,当年龄≥35岁时,卵母细胞和胚胎非整倍体发生率逐步增加(34~75%)(franasiak et al.,2014),因此,高龄女性的自然妊娠和ivf妊娠的概率都显著下降,并且流产率增加(ola and li,2006)。所以对于高龄人群,采用形态学筛查胚胎的效率进一步降低。因此在一些女方高龄(35岁以上)、复发性流产、反复着床失败的患者中,还会通过pgs技术进一步筛选胚胎(chen et al.,2015;rubio et al.,2017)。
5.胚胎植入前遗传学筛查(pgs)是指在胚胎植入之前,通过活检6-8个细胞,来检测胚胎的染色体数目和结构,判断胚胎是否存在遗传物质异常的检测方法。pgs技术至今已经发展了30几年了,从最开始的采用荧光原位杂交(fluorescence in situ hybridization,fish)只能分析几条特定的染色体的倍数和结构情况,发展到了目前使用全基因组扩增(whole genome amplification,wga),实现对23对染色体的检测。pgs技术虽然在一定程度上提高了辅助生殖的出生率,目前经pgs筛查后,试管婴儿的出生率达到了40%。但是临床研究发现,大量的染色体倍数正常的胚胎仍然不能成功妊娠。并且最新的研究成果显示,对于35岁以下的女性患者人群,pgs在提高妊娠率上没有显著的效果(yan et al.,2021)。另一方面,试管婴儿中表观遗传疾病的发病率是自然受孕的婴儿发病率的2倍,并且约有千分之一的婴儿患有印记基因疾病。然而pgs技术只是检测胚胎的基因组dna,无法检测胚胎的表观组dna,所以pgs无法检测胚胎是否患有表观遗传疾病。除此之外,pgs方法需要对胚胎滋养层细胞进行活检,这一操作对技术要求高,取样难度大,这也限制了这一技术的广泛推广和使用。
6.临床上普遍采用的上述形态学指标以及胚胎植入前遗传学筛查(preimplantation genetic screeing,pgs)主要是基于细胞活检进行的,属于有创筛查。目前还没有一种可用于临床的无创筛查方法。
7.有鉴于此,特提出本技术。
技术实现要素:
8.本技术实施例的主要目的是提供一种以胚胎培养液为检测对象的植入前胚胎的无创筛选方法。
9.本技术实施例提供一种基于胚胎培养液的植入前胚胎的无创筛查方法,对待检植入前胚胎的培养液中的游离dna进行甲基化检测,根据所得检测结果从所述待检植入前胚胎中筛选出染色体正常和dna甲基化水平正常的胚胎作为待植入胚胎。
10.在本技术的一些实施方式中,甲基化检测的步骤包括:提取所述培养液中游离dna,构建甲基化文库,测序。
11.在本技术的一些实施方式中,构建甲基化文库的步骤包括:所述游离dna经蛋白酶消化、末端修复及加a、连接接头及连接产物纯化、双加氧酶氧化及氧化产物纯化、dna变性、脱氨及脱氨产物纯化、pcr扩增及扩增产物纯化。
12.在本技术的一些实施方式中,所述培养液的制备步骤包括:拆除所述植入前胚胎透明带上的颗粒细胞,清洗,培养,收集培养液。
13.在本技术的一些实施方式中,收集培养液之前采用如下方法将培养液中的植入前胚胎移出:先在胚胎转移管前端吸入1个-2个气泡,然而再吸取植入前胚胎将其移出培养液。
14.在本技术的一些实施方式中,所述dna甲基化水平正常包括:dna甲基化水平在0.20-0.30区间内;
15.当从所述待检植入前胚胎中没有筛选到dna甲基化水平在0.20-0.30区间内的胚胎,则优先筛选dna甲基化水平接近0.20-0.30区间的胚胎为待植入胚胎。
16.在本技术的一些实施方式中,所述染色体正常包括:染色体为标准的二倍体且染色体结构正常;
17.当从所述待检植入前胚胎中没有筛选到染色体正常的胚胎,则优先筛选染色体属于嵌合体但嵌合度少于50%的胚胎作为待植入胚胎。
18.在本技术的一些实施方式中,所述植入前胚胎为受精后体外发育5天-7天的胚胎。
19.在本技术的一些实施方式中,所述植入前胚胎为处于囊胚期的胚胎。
20.在本技术的一些实施方式中,所述筛选方法还包括结合所述检测结果中印记基因控制区域或/和启动子区域的甲基化水平来筛查胚胎。
21.与传统技术相比,本技术的有益效果包括:
22.本技术通过检测培养液中的游离dna或者游离细胞dna的甲基化水平并根据检测结果进行胚胎筛选,避免了对胚胎的活检,极大的促进了胚胎植入前检测的临床应用,为植入前胚胎的无创表观筛查、准确评估胚胎体外培养阶段发育质量、表观遗传疾病的风险评估提供新的解决方案。
23.同时,本技术提供的筛选方法不改变现有伦理规则,不会增加检测成本,能够为更
多的家庭提供服务,有助于提高辅助生殖的出生低、出生缺陷比例较高等问题,提高辅助生殖质量。
24.进一步地,本技术在检测培养液中的游离dna或者游离细胞dna的甲基化水平的过程中,采用酶法氧化的方式构建甲基化文库,大幅度提高了全基因组的覆盖度,并显著的提升了检测的精确度;同时通过甲基化测序,有效的减少了母源的污染,使得检测结果能够与细胞活检的检测结果保持一致。
附图说明
25.为了更清楚地说明本技术实施例中的技术方案、更完整地理解本技术及其有益效果,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对本领域技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
26.图1为本技术实施例文库构建流程图;
27.图2为实施例1中样本1囊胚培养液中游离dna检测结果和滋养层细胞检测结果的对比图;
28.图3为实施例1中样本2囊胚培养液中游离dna检测染色体倍数结果和滋养层细胞检测染色体倍数结果的对比图;
29.图4为实施例1中样本3囊胚培养液中游离dna检测染色体倍数结果和滋养层细胞检测染色体倍数结果的对比图;
30.图5为实施例1中样本4囊胚培养液中游离dna检测染色体倍数结果和滋养层细胞检测染色体倍数结果的对比图;
31.图6为实施例1中样本5囊胚培养液中游离dna检测染色体倍数结果和滋养层细胞检测染色体倍数结果的对比图;
32.图7为实施例1中样本6囊胚培养液中游离dna检测染色体倍数结果和滋养层细胞检测染色体倍数结果的对比图;
33.图8为实施例1中样本7囊胚培养液中游离dna检测染色体倍数结果和滋养层细胞检测染色体倍数结果的对比图;
34.图9为实施例1中7例样本囊胚培养液中游离dna检测甲基化水平结果和滋养层细胞检测甲基化水平结果的对比图;
35.图10为实施例1中对囊胚培养液中游离dna的检测,所检测到的印记基因控制区域的dna甲基化状态和活检细胞检测得到的该区域的dna甲基化状态的对比图;
36.图11为实施例1中对囊胚培养液中游离dna的检测,所检测到的启动子区域的dna甲基化状态和活检细胞检测得到的该区域的dna甲基化状态的对比图;
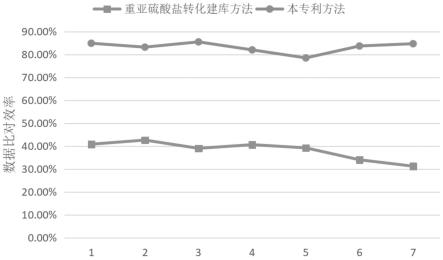
37.图12为实施例2中对囊胚培养液中游离dna的检测,本技术建库方法的建库效率高于重亚硫酸盐建库方法的建库效率;
38.图13为实施例2中对囊胚培养液中游离dna的检测,本技术建库方法的基因组覆盖度高于重亚硫酸盐建库方法的基因组覆盖度;
39.图14为实施例2中对囊胚培养液中游离dna的检测,本技术建库方法的数据质量高于重亚硫酸盐建库方法的数据质量;
40.图15为实施例2中对囊胚滋养层细胞的检测,本技术建库方法的基因组覆盖度高于重亚硫酸盐建库方法的基因组覆盖度;
41.图16为实施例2中对囊胚滋养层细胞的检测,本技术建库方法的数据质量高于重亚硫酸盐建库方法的数据质量。
具体实施方式
42.下面结合附图、实施方式和实施例,对本发明作进一步详细的说明。应理解,这些实施方式和实施例仅用于说明本发明而不用于限制本发明的范围,提供这些实施方式和实施例的目的是使对本发明公开内容理解更加透彻全面。还应理解,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式和实施例,本领域技术人员可以在不违背本发明内涵的情况下作各种改动或修改,得到的等价形式同样落于本技术的保护范围。此外,在下文的描述中,给出了大量具体的细节以便提供对本发明更为充分地理解,应理解,本发明可以无需一个或多个这些细节而得以实施。
43.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述实施方式和实施例的目的,不是旨在于限制本发明。
44.第一目的,本发明提供了检测全基因组dna甲基化水平的试剂在非疾病诊断目的筛选辅助生殖移植胚胎中的应用。本发明首次将表观遗传应用于辅助生殖中无创检测胚胎。本发明包含胚胎的表观遗传信息可以用来检测表观遗传疾病。本发明所提供的方法不仅可以用于微量游离dna的甲基化建库,同时也可以用于微量细胞dna甲基化建库。作为本发明所述应用的优选实施方式,所述全基因组dna采用胚胎囊胚培养阶段的培养液中游离的dna。作为本发明所述应用的优选实施方式,采用dna甲基化水平评估胚胎体外培养阶段发育质量。
45.第二目的,本发明提供了一种采集囊胚培养液的方法用于胚胎的无创筛查,包括以下步骤:1)拆除胚胎透明带上颗粒细胞;2)去除颗粒细胞的胚胎进行清洗;3)清洗后的胚胎继续培养;4)采集囊胚培养液;采用上述培养液的收集方法可以减少母源dna的污染,提高检测的准确度。
46.第三目的,本发明提供了一种胚胎植入前游离dna或极微量细胞的全基因组甲基化水平的检测方法,包括以下步骤:1)对培养液进行消化,dna打断,末端修复,获得末端修复产物;2)在末端修复产物的末端加a碱基,然后连接甲基化接头,用氧化酶进行转化;3)将转化后的核酸进行扩增,dna片段回收,文库质检,再进行文库测序,获得原始测序数据,分析原始测序数据。本发明采用新的技术路线对囊胚培养液中游离的dna或者滋养层活检细胞进行表观遗传学检测,大幅度提高了全基因组的覆盖度和数据质量,提高了检测效率和准确度。本发明适用于囊胚培养液中游离的dna进行检测,避免对胚胎的活检,并且能够准确的判断胚胎染色体倍数以及胚胎甲基化水平信息。采用上述检测方法可以同时检测胚胎的染色体倍数信息和胚胎的甲基化水平信息,能够更加全面的反映胚胎的发育质量。作为本发明所述胚胎植入前无创dna甲基化水平的检测方法的优选实施方式,所述步骤3)中分析原始测序数据的具体步骤包括:对原始测序数据进行数据质量控制(q20》85%;q30》80%;),去接头序列和低质量碱基(q≤5),然后进行基因组比对,再将比对的数据进行合
并,去掉pcr重复序列,分析染色体倍数和甲基化水平,挑选染色体倍数正常,甲基化水平正常的胚胎进行移植。作为本发明所述检测方法的优选实施方式,对于染色体倍数的分析,采用pgs分析流程,对于甲基化水平的分析,除考虑胚胎的整体的甲基化水平状况,还考虑基因组不同区域的甲基化水平状况。
47.本技术实施例提供一种基于胚胎培养液的植入前胚胎的无创筛查方法,对待检植入前胚胎的培养液中的游离dna进行甲基化检测,根据所得检测结果从所述待检植入前胚胎中筛选出染色体正常和dna甲基化水平正常的胚胎作为待植入胚胎。
48.本技术对甲基化检测的方法不做特别限制,可以采用单细胞(微量细胞)简化全因组测序方法,单细胞(微量细胞)全基因组甲基化测序方法等方法进行甲基化检测。
49.可选地,甲基化检测的步骤包括:提取所述培养液中游离dna,构建甲基化文库,测序。
50.可选地,构建甲基化文库的步骤包括:所述游离dna经蛋白酶消化、末端修复及加a、连接接头及连接产物纯化、双加氧酶氧化及氧化产物纯化、dna变性、脱氨及脱氨产物纯化、pcr扩增及扩增产物纯化。
51.可选地,所述培养液的制备步骤包括:拆除所述植入前胚胎透明带上的颗粒细胞,清洗,培养,收集培养液。
52.可选地,收集培养液之前采用如下方法将培养液中的植入前胚胎移出:先在胚胎转移管前端吸入1个-2个气泡,然而再吸取植入前胚胎将其移出培养液。这样操作可以防止在培养液中带入过多的操作液,另外在吸取胚胎的过程中可根据气泡上移的位置来判断吸取培养液的量,尽量少的吸取培养液。
53.可选地,所述dna甲基化水平正常包括:dna甲基化水平在0.20-0.30区间内(例如为0.25、0.26、0.27,如果dna甲基化水平为小数点后三位有效数字的小数,则四舍五入为小数点后两位有效数字的小数);
54.当从所述待检植入前胚胎中没有筛选到dna甲基化水平在0.20-0.30区间内的胚胎,则优先筛选dna甲基化水平接近0.20-0.30区间的胚胎为待植入胚胎。
55.可选地,所述染色体正常包括:染色体为标准的二倍体且染色体结构正常;
56.当从所述待检植入前胚胎中没有筛选到染色体正常的胚胎,则优先筛选染色体属于嵌合体但嵌合度少于50%的胚胎作为待植入胚胎。
57.可选地,所述植入前胚胎为受精后体外发育5天-7天(例如为5天、5.5天、6天、6.5天、7天等)的胚胎。
58.可选地,所述植入前胚胎为处于囊胚期的胚胎。
59.可选地,所述筛选方法还包括结合所述检测结果中印记基因控制区域或/和启动子区域的甲基化水平来筛查胚胎。可以理解的是,本技术可以结合所述检测结果中印记基因控制区域或/和启动子区域的甲基化水平来筛选出这两个区域中的一个或者多个甲基化水平正常或者接近甲基化水平正常的胚胎。
60.具体实施例
61.下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册或常规条件,还可以按照制造
厂商所建议的条件,或者参考本领域已知的实验方法。
62.下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
63.实施例1
64.一、样本
65.本试验共收集了7例临床样本,每一例样本分别包含胚胎培养液和对应的滋养层细胞,分别进行全基因组dna甲基化图谱的检测。受试患者均签署了知情同意书,并自愿捐献胚胎。经过超排,取卵,体外受精,胚胎体外培养等阶段,对滋养层细胞进行活检。对获取的活检细胞和囊胚培养液进行全基因组dna甲基化文库构建。
66.二、囊胚培养液的收集
67.1、拆除颗粒细胞
68.按照生殖中心标准ivf周期或icsi操作流程得到受精卵。day3观察透明带是否存在颗粒细胞,如有需采用如下方法去除颗粒细胞:用145/140剥卵针反复吹吸,仔细观察确保颗粒细胞拆除干净。
69.2、胚胎清洗
70.完全去除颗粒细胞的胚胎按照如下方法进行清洗:
71.(1)day3换液前准备单独的胚胎清洗皿,清洗皿内制作1个50μl的囊胚培养液作为取液滴,并为每个胚胎准备3个30μl的囊胚培养液作为清洗滴,清洗皿需按照囊胚培养液的要求在二氧化碳培养箱内平衡后使用。
72.(2)用记号笔在皿底标记取液滴和每个胚胎对应的清洗液滴,取液滴内不能放置胚胎。
73.(3)用巴斯德管从取液滴中吸取一定量的囊胚培养液后吸取胚胎到清洗滴中,在清洗滴的上部吹出囊胚并用巴斯德管轻轻搅动液滴,使囊胚培养液充分清洗胚胎。
74.(4)将巴斯德管移出清洗滴并把管内剩余的囊胚培养液吹出,再次从取液滴中吸取干净的囊胚培养液。
75.(5)将清洗1次的胚胎吸出,转移到第二个干净的清洗滴中重复步骤3-4操作。
76.(6)每个胚胎按照上述步骤清洗3次。
77.(7)将胚胎转入标记好的囊胚培养皿中进行单微滴培养。
78.3、囊胚培养液采集
79.(1)从-20℃或-80℃冰箱取出预冷的采样盒,用防水记号笔在样品采集管管盖和管身分别标记样品编号。
80.(2)收集培养液前将胚胎移出培养液滴,移出胚胎方法如下:胚胎转移时可在胚胎转移管前端吸入1~2个气泡,以防止在培养液中带入过多的操作液,另外在吸取胚胎的过程中可根据气泡上移的位置来判断吸取培养液的量,尽量少的吸取培养液。
81.(3)在收集囊胚培养液之前,先用移液器小心缓慢的将培养皿中的石蜡油吸出,吸出过程注意不要倾斜培养皿,并观察培养滴是否有随着石蜡油移动的趋势,尽量放慢吸液速度,防止培养滴连在一起。
82.(4)使用带滤芯的枪头,用移液器收集胚胎培养液(避免吸到油滴),吸取8~10μl,
将样本放置于对应编号的样本采集管底部,一个培养滴换一个枪头,避免交叉污染。收集未培养胚胎的培养液作为空白对照培养液,空白对照培养液与样本胚胎培养液一起编号。
83.(5)瞬时离心(必要时),确保采集的样本置于采集管底部,-80℃保存。
84.三、文库构建(参考图1)
85.(1)dna提取:从冰箱取出样品,将装有样本的pcr管短暂离心后放置于冰上;向装有样本的pcr管中加入蛋白酶,消化两个小时。
86.(2)末端修复加a:向装有细胞样本的pcr管中加入末端修复加a酶和末端修复加a缓冲液,混匀后放入pcr仪进行孵育。pcr程序设置:20℃,30min;65℃,30min;4℃,∞。
87.(3)加接头:向末端修复加a产物中加入甲基化接头、连接酶混合液和反应增强剂,混匀后放入pcr仪进行孵育。pcr程序设置:20℃,15min;4℃,∞。
88.(4)连接产物纯化:
89.①
向连接产物中加入磁珠,混匀后静置5min;
90.②
将pcr管放入磁力架中,静置2min,弃去液体;
91.③
向管中加入现配的80%乙醇,静置30s,弃去液体;
92.④
向管中加入现配的80%乙醇,静置30s,弃去液体后开盖晾干5min;
93.⑤
向管中加入洗脱液,混匀后静置5min;
94.⑥
将pcr管放入磁力架中,静置2min,将液体转移至一个新的pcr管中。
95.(5)tet2氧化:在冰上向纯化好的文库中加入tet2酶、反应缓冲液、反应增强液和反应补充剂,涡旋混匀后加入铁溶液,再次涡旋混匀后放入pcr仪进行37℃孵育1h。
96.(6)氧化终止:反应结束后立即取出pcr管置于冰上,加入终止液,混匀后放入pcr仪进行37℃孵育30min。
97.(7)氧化产物纯化:
98.①
向氧化产物中加入磁珠,混匀后静置5min;
99.②
将pcr管放入磁力架中,静置2min,弃去液体;
100.③
向管中加入现配的80%乙醇,静置30s,弃去液体;
101.④
向管中加入现配的80%乙醇,静置30s,弃去液体后开盖晾干5min;
102.⑤
向管中加入洗脱液,混匀后静置5min;
103.⑥
将pcr管放入磁力架中,静置2min,将液体转移至一个新的pcr管中。
104.(8)dna变性:向pcr管中加入0.1n的naoh,然后将样本放入提前50℃预热的pcr仪中孵育10min,孵育结束后立即置于冰上。
105.(9)脱氨反应:在冰上向pcr管中加入脱氨酶、脱氨缓冲液和反应补充剂,涡旋混匀后放入pcr仪进行37℃孵育3h。
106.(10)脱氨产物纯化:
107.①
向脱氨产物中加入磁珠,混匀后静置5min;
108.②
将pcr管放入磁力架中,静置2min,弃去液体;
109.③
向管中加入现配的80%乙醇,静置30s,弃去液体;
110.④
向管中加入现配的80%乙醇,静置30s,弃去液体后开盖晾干5min;
111.⑤
向管中加入洗脱液,混匀后静置5min;
112.⑥
将pcr管放入磁力架中,静置2min,将液体转移至一个新的pcr管中。
113.(11)pcr扩增
114.向pcr管中加入扩增引物和pcr酶混合液,混匀后放入pcr仪进行扩增,pcr程序设置:98℃,45s;(98℃,15s;65℃,30s;72℃,30s)x15;72℃1min;4℃,∞。
115.(12)扩增产物纯化
116.①
向扩增产物中加入磁珠,混匀后静置5min;
117.②
将pcr管放入磁力架中,静置2min,弃去液体;
118.③
向管中加入现配的80%乙醇,静置30s,弃去液体;
119.④
向管中加入现配的80%乙醇,静置30s,弃去液体后开盖晾干5min;
120.⑤
向管中加入洗脱液,混匀后静置5min;
121.⑥
将pcr管放入磁力架中,静置2min,将液体转移至一个新的离心管中。
122.(13)文库质检:使用qpcr仪对文库进行定量,并使用安捷伦2100确定文库片段大小;
123.(14)文库测序:文库质检合格后,采用ngs测序平台对文库进行测序。
124.(15)测序后根据以下数据分析流程对测序数据进行分析,具体如下:
125.对原始测序数据进行数据质量控制,去接头序列和低质量碱基,然后进行基因组比对,再将比对的数据进行合并,去掉pcr重复序列,分析染色体倍数和甲基化水平,挑选染色体倍数正常,甲基化水平正常的胚胎进行移植备用。
126.其中,通过将测序数据与基因组进行对比,确定测序获得的每条碱基序列在染色体上的确切位置,然后使用目前通用的检测染色体拷贝数变异的分析流程或者软件进行染色体倍数的分析;
127.同时,对于基因组上的胞嘧啶位点,通过统计该位点分别被多少胸腺嘧啶(t)和胞嘧啶(c)覆盖,来计算每个位点的甲基化水平(methylation level,ml),计算公式如下:
[0128][0129]
mli:第i个胞嘧啶位点的甲基化水平;
[0130]
ci:覆盖到第i个cg位点的碱基是胞嘧啶的个数;
[0131]
ti:覆盖到第i个cg位点的碱基是胸腺嘧啶的个数;
[0132]
然后再根据被覆盖到的所有胞嘧啶位点的甲基化水平,来计算基因组的平均甲基化水平。
[0133]
对于基因组特定区域,例如启动子区域或印记基因控制区域的dna甲基化水平的计算,统计该区域内所有的胞嘧啶位点,总共被多少胸腺嘧啶(t)和胞嘧啶(c)覆盖,并通过上述公式,来计算每个区域的甲基化水平。
[0134]
实施例1中共检测7例样本,每一例样本分别包含囊胚培养液和滋养层活检细胞,检测结果如下:
[0135]
样本1,见图2:
[0136]
囊胚培养液检测结果显示:11号染色体缺失,16号染色体为3倍体;全基因组甲基化水平为0.27;
[0137]
滋养层细胞检测结果为:11号染色体缺失,16号染色体为3倍体;全基因组甲基化
水平为0.28;
[0138]
样本2,见图3:
[0139]
囊胚培养液检测结果显示:14号染色体为3倍体;全基因组甲基化水平为0.26;
[0140]
滋养层细胞检测结果为:14号染色体为3倍体;全基因组甲基化水平为0.27;
[0141]
样本3,见图4:
[0142]
囊胚培养液检测结果显示:7号染色体缺失,16号染色体为3倍体;全基因组甲基化水平为0.29;
[0143]
滋养层细胞检测结果为:7号染色体缺失,16号染色体为3倍体;全基因组甲基化水平为0.30;
[0144]
样本4,见图5:
[0145]
囊胚培养液检测结果显示:10号染色体缺失,22号染色体缺失;全基因组甲基化水平为0.22;
[0146]
滋养层细胞检测结果为:7号染色体缺失,16号染色体为3倍体;全基因组甲基化水平为0.24;
[0147]
样本5,见图6:
[0148]
囊胚培养液检测结果显示:染色体正常;全基因组甲基化水平为0.24;
[0149]
滋养层细胞检测结果为:染色体正常;全基因组甲基化水平为0.22;
[0150]
样本6,见图7:
[0151]
培养液检测结果显示:22号染色体缺失;全基因组甲基化水平为0.30;
[0152]
滋养层细胞检测结果为:22号染色体缺失;全基因组甲基化水平为0.30;
[0153]
样本7,见图8:
[0154]
囊胚培养液检测结果显示:7号染色体缺失,12号染色体为3倍体,13号染色体缺失;全基因组甲基化水平为0.29;
[0155]
滋养层细胞检测结果为:7号染色体缺失,12号染色体为3倍体,13号染色体缺失;全基因组甲基化水平为0.28;
[0156]
图9为实施例1中7例样本囊胚培养液中游离dna检测甲基化水平结果和滋养层细胞检测甲基化水平结果的对比图,每组条形图中,左边对应游离dna,右边对应活检细胞。
[0157]
图10为对样本2囊胚培养液中游离dna的检测,所检测到的印记基因控制区域的dna甲基化状态和活检细胞检测得到的该区域的dna甲基化状态的对比图;图11为对样本2囊胚培养液中游离dna的检测,所检测到的启动子区域的dna甲基化状态和活检细胞检测得到的该区域的dna甲基化状态的对比图。根据图10和图11可知通过囊胚培养液中游离dna检测到的印记基因控制区域或启动子区域的dna甲基化状态与通过滋养层细胞检测的结果是一致的。
[0158]
临床样本验证结果显示,本技术所提供的方法对囊胚培养液中游离dna检测结果与滋养层细胞活检的结果是一致的。囊胚培养液中游离dna能够完整的反映胚胎的信息,从而能够实现对胚胎的无创表观遗传筛查。
[0159]
实施例2
[0160]
为了验证实施例1所采用的方法是优效的,本技术采用和实施例1一样的采样方法,收集了7例培养液和滋养层活检细胞样本,并使用实施例2的建库方法进行构建文库。
[0161]
实施例2是实施例1的变化,相对于实施例1的变化之处主要是构建文库的方法不同,本实施例主要采用重亚硫酸盐建库方法。建库方法流程如下:
[0162]
1.dna提取
[0163]
从冰箱取出样品,将装有样本的pcr管短暂离心后放置于冰上;向装有样本的pcr管中加入蛋白酶,消化两个小时。
[0164]
2.末端修复
[0165]
向装有待测细胞样本的dna片段的pcr管中加入末端修复酶和末端修复缓冲液,混匀后放入pcr仪进行孵育;pcr程序设置:20℃,30min;75℃,20min;4℃,∞。
[0166]
3.末端加a
[0167]
向末端修复产物中加入datp、dna聚合酶、连接缓冲液和tris-hcl,混匀后放入pcr仪进行孵育;pcr程序设置:37℃,30min;75℃,20min,4℃,∞。
[0168]
4.加接头
[0169]
向末端加a产物中加入甲基化接头、连接酶、连接缓冲液和tris-hcl,混匀后放入恒温柜中,16℃连接12h。
[0170]
5.重亚硫酸盐转化
[0171]
向加接头产物中加入ct转化试剂,混匀后放入pcr仪中,反应2.5h;
[0172]
将转化产物转移至吸附柱中,加入结合缓冲液,混匀后静置5min,离心1min,弃去收集管中液体;
[0173]
向吸附柱中加入洗液,离心1min,弃去收集管中液体;
[0174]
向吸附柱加入去磺化缓冲液,静置15min,离心1min,弃去液体;
[0175]
向吸附柱中加入洗液,离心1min,弃去收集管中液体;
[0176]
向吸附柱中加入洗液,离心1min,弃去收集管中液体;
[0177]
将吸附柱转移至离心管中,开盖室温晾干5min;
[0178]
向吸附柱中加入预热的洗脱液,离心1min。
[0179]
6.一轮扩增
[0180]
将收集到的核酸转移至新的pcr管,向其中加入测序引物和pcr酶混合液1,混匀后放入pcr仪进行扩增,pcr程序设置:98℃,45s;(98℃,15s;65℃,30s;72℃,30s)x8;72℃1min;4℃,∞。
[0181]
7.纯化回收
[0182]
向扩增产物中加入磁珠,混匀后静置8min;
[0183]
将pcr管放入磁力架中,静置2min,弃去液体;
[0184]
向管中加入现配的80%乙醇,静置30s,弃去液体;
[0185]
向管中加入现配的80%乙醇,静置30s,弃去液体后开盖晾干5min;
[0186]
向管中加入洗脱液,混匀后静置5min;
[0187]
将pcr管放入磁力架中,静置2min,将液体转移至一个新的pcr管中。
[0188]
8.二轮扩增
[0189]
向pcr管中加入通用引物和pcr酶混合液2,混匀后片放入pcr仪进行扩增,pcr程序设置:98℃,30s;(98℃,10s;65℃,75s)
×
(9-12);65℃,5min;4℃,∞。
[0190]
9.纯化回收
[0191]
向扩增产物中加入磁珠,混匀后静置8min;
[0192]
将pcr管放入磁力架中,静置2min,弃去液体;
[0193]
向管中加入现配的80%乙醇,静置30s,弃去液体;
[0194]
向管中加入现配的乙醇含量为80%(v/v)的乙醇水溶液,静置30s,弃去液体后开盖晾干5min;
[0195]
向管中加入无核酸酶水,混匀后静置5min;
[0196]
将pcr管放入磁力架中,静置2min,将液体转移至收集管中。
[0197]
10.文库质检
[0198]
使用qpcr仪对文库进行定量,并使用安捷伦2100确定文库片段大小。
[0199]
11.文库测序
[0200]
文库质检合格后,采用ngs测序平台对文库进行测序。
[0201]
数据分析方法和实施例1中所阐述方法一致。
[0202]
在囊胚培养液中游离dna的检测中,实施例1建库方法相对于实施例2采用重亚硫酸盐建库方法,建库效率对比情况如图12所示。根据图12可知实施例1中建库方法建库成功率高于实施例2采用重亚硫酸盐建库方法。
[0203]
在囊胚培养液中游离dna的检测中,实施例1建库方法相对于实施例2采用重亚硫酸盐建库方法,胚胎基因组的覆盖度对比情况如图13所示。根据图13可知实施例1中建库方法所得到的基因组的覆盖度高于实施例2采用重亚硫酸盐建库方法所得到的基因组的覆盖度。
[0204]
在囊胚培养液中游离dna的检测中,实施例1建库方法相对于实施例2采用重亚硫酸盐建库方法,相同测序数据量下,有效数据量的对比情况如图14所示。根据图14可知实施例1中建库方法在相同测序数据量下,有效数据量高于实施例2采用重亚硫酸盐建库方法。
[0205]
在囊胚滋养层活检细胞的检测中,实施例1建库方法相对于实施例2采用重亚硫酸盐建库方法,胚胎基因组的覆盖度对比情况如图15所示。根据图15可知实施例1中建库方法所得到的基因组的覆盖度高于实施例2采用重亚硫酸盐建库方法所得到的基因组的覆盖度。
[0206]
在囊胚滋养层活检细胞的检测中,实施例1建库方法相对于实施例2采用重亚硫酸盐建库方法,相同测序数据量下,有效数据量的对比情况如图16所示。根据图16可知实施例1中建库方法在相同测序数据量下,有效数据量高于实施例2采用重亚硫酸盐建库方法。
[0207]
以上所述实施方式和实施例的各技术特征可以进行任意合适方式的组合,为使描述简洁,未对上述实施方式和实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为在本说明书记载的范围中。
[0208]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,得到的等价形式同样落于本技术的保护范围。还应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利
的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。