一种提取rna的试剂盒及其应用
技术领域
1.本发明属于生物样本纯化领域,尤其涉及一种无dna污染磁珠法提取rna的试剂盒及其应用。
背景技术:
2.rna作为存在于生物细胞以及部分病毒、类病毒中的遗传信息载体,其提取与纯化是各种临床检测应用的基础,在rna纯化的过程中,去除dna是一个非常重要的环节,dna去除不彻底很可能会影响下游实验的进行。目前常见的提取rna的方法主要通过变性剂破碎细胞或者组织,然后经过氯仿等有机溶剂抽提rna。该方法能够得到纯度较高的rna,但是在提取rna的过程中使用了氯仿等毒性较大的化学品,且实验操作复杂不能实现自动化。
3.磁珠法作为核酸提取的一种重要方法,因其适用于实现仪器自动化,被广泛应用于病毒rna的提取检测中。但该方法将rna和dna同时提取出来,因此dna的污染限制了下游实验的应用。例如,临床上通过检测高危型hpv e6/e7 mrna的转录应用于宫颈癌的早期诊断、早期治疗及预后监测,其检测靶标为mrna,dna的干扰会影响检测结果。
4.申请公布号cn 114350650 a的发明专利公开了一种无dna残留血液rna提取试剂盒及核酸提取方法,包括裂解液、第一漂洗液、第二漂洗液、洗脱液、蛋白酶k缓冲液、无rna酶的双蒸水,还包括红细胞裂解液,dna酶缓冲液。细胞裂解后经第一漂洗液洗涤后,在吸附柱上加入dna酶缓冲液和dna酶进行消化,从而达到去除dna的目的。然后再经第一漂洗液、第二漂洗液洗涤,最后洗脱获得rna。该方法虽然可获得高纯度的rna,但采用的是吸附柱式提取,不利于实现仪器自动化。
5.申请公布号cn 110607395 a的发明专利公开了一种横跨内含子的高危型人乳头瘤病毒mrna的检测方法及试剂盒,其提取和纯化方式采用常规磁珠法,其特征还在于使用磁珠法核酸提取纯化试剂,选用与rna亲和力优于dna的硅基磁珠,并可在提取纯化中可选加dna酶消化的步骤。该专利提出在蛋白酶k消化过程中加入dna酶进行dna消化,基于既往的认知,dna酶作为一种蛋白应该会被蛋白酶k消化失活,常见的sds,dtt、巯基乙醇等还原剂,50-100mm以上盐浓度均对dnaseⅰ有显著抑制作用。因此,此环境不能提供给dna酶反应的有利环境,且专利中未提供详尽的实施例数据和结果展示,dna酶消化的效果未可知。
6.申请公布号cn 108949747 a的发明专利公开了一种磁珠法提取核糖核酸(rna)的试剂盒及提取方法,所述试剂盒包括试剂:组织消化液、裂解液、蛋白酶k、dnaseⅰ、dnaseⅰbuffer、核酸、提取磁珠、洗涤液ⅰ、洗涤液ⅱ、洗脱液。其方案在洗涤液i处理步骤后进行dnaseⅰ消化步骤,所述dnaseⅰ浓度为1~3u/μl,为dnaseⅰbuffer包括:终浓度为5~20mmol/l的tris-hcl、终浓度为10~50mmol/l的mgcl2,终浓度为0.1~1mmol/l的cacl2,反应体积为50ul,该反应环境为dnaseⅰ常规反应条件,能够有效去除dna,但其缺点一是,溶液为水相环境,核酸容易溶解在水相中,导致磁珠吸附时回收效率降低,降低得率;二是反应的体积太小,不利于磁珠法自动化提取的实现。
7.综上所列举专利,目前针对rna提取和纯化的产品还存在如下缺陷:1.大部分采用
胍盐-有机溶剂法提取高纯度的rna,但提取过程使用了有毒的有机溶剂,且该方法不适于实现仪器提取自动化。2.有产品不需要使用有机溶剂分离rna和dna,其在提取时采用dnase酶消化dna,但主要在吸附柱上实现,该方式也是不利于实现仪器提取自动化。3.现有的能够实现仪器自动化的磁珠法提取rna纯度不够,存在大量dna污染。有专利提出在该方法提取过程中用dnase酶消化dna,但未提供出详尽实施例数据和结果。4.有专利采用合适的dnase酶反应环境进行消化反应,但因其水相环境会导致核酸磁吸附时回收效率变低,同时,反应的体积小也不适用于磁珠法自动提取操作。因此,需要找到一种磁珠法适用的dna消化方式,获得高纯度的rna。这种rna提取和纯化方法,能够既满足不使用有毒的有机溶剂的要求,同时能够去除dna残留污染,且轻松实现仪器自动化。
技术实现要素:
8.临床检测或科学研究中,需要提取高纯度的rna进行检测,其中dna污染会干扰下游的检测,既往的研究和产品采用有机溶剂如氯仿对rna和dna进行抽提分离,提取的rna纯度虽然高,但该方式使用有毒的有机试剂,且操作较复杂;或者采用dnase酶在吸附柱上进行消化处理,从而去除dna污染,该方式不利于实现仪器自动化提取。
9.本发明的目的是提供一种磁珠法提取rna并且能够有效去除dna的污染。本发明采用dnase酶(脱氧核糖核酸酶)在磁珠法提取过程中进行dna消化,其反应环境既能满足dnase酶的最适反应环境需求;同时提供了磁珠吸附时的疏水性环境,保证核酸的得率;还通过加入一种油的乳化液增大提取操作时的总体积,以促进仪器自动化提取操作的便利性。所提取的rna产量高、纯度高,该方法能够轻松实现仪器自动化提取。解决了临床实际应用过程中快速便捷的提取高纯度rna的需求,极大地降低了高纯度rna提取难度和提取成本,所提取的rna能很好地适应于后续rt-pcr和rna-seq应用。
10.本发明采用如下技术方案实现:
11.一种提取rna的试剂盒,包括以下组分:蛋白酶k、裂解结合液、磁珠、dna酶反应液、洗涤液、洗脱液;
12.其中dna酶反应液包括dnase i、dnase i buffer,dnase i buffer包含水相、油相和乳化剂,油相占两相总体积的70%-90%,优选73-77%,最优选75%、乳化剂占两相总体积的0.5%-5%,优选0.5-2%,最优选1%。
13.所述的提取rna的试剂盒,
14.所述油相包括如下组分中的一种或多种:硅油及其衍生物(如二甲基硅油、乙烯基硅油、苯甲基硅油、乙烯基封端聚甲基硅油、聚甲基氢硅氧烷)、氟油及其衍生物(如hfe-7100、hfe-7200、hfe-7500、fc-40);所述乳化剂包括如下组分中的一种或多种:非离子表面活性剂(如span/triton/tween)、阴离子表面活性剂(如十二烷基苯磺酸钠、月桂基磺酸钠)、阳离子表面活性剂(十二烷基二甲基苄基氯化铵、十六烷基三甲基氯化铵、十八烷基三甲基氯化铵)。
15.所述的提取rna的试剂盒,水相中包含peg。
16.所述的提取rna的试剂盒,水相中含有2.5%-10%peg,优选4-6%,最优5%。
17.所述的提取rna的试剂盒,水相还包含ph缓冲液、1-5mm mgcl2,优选2-3mm,最优2.5mm、0.25-0.75mm cacl2,优选0.4-0.6mm,最优0.5mm;所述ph缓冲液包括如下组分中的
一种或多种:ph 7.5的10mm-50mm的naac-hac缓冲液、ph 7.5的10mm-50mm的tris-hcl缓冲液。
18.所述的提取rna的试剂盒,dna酶反应液中dnase i为40u/-120u/ml,优选60-100u/ml,最优选75u/ml。
19.所述的提取rna的试剂盒,提取rna的对象包括:细胞、组织、血液、尿液、宫颈拭子、口腔拭子、鼻咽拭子样本等。
20.对于培养细胞(浓度105个/ml以上)或组织样本,需要使用蛋白酶k反应buffer作为缓冲液体系,于56℃条件下反应30-60min,将细胞或组织进行消化预处理。
21.如果是血液、尿液、宫颈拭子、口腔拭子、鼻咽拭子样本,则只需要加入蛋白酶k,混合均匀,不需要56℃条件下反应30-60min。
22.蛋白酶k(天根rt403,浓度20mg/ml)。
23.蛋白酶k反应buffer包括如下组分:10-50mm tris
·
cl,优选25-35mm,最优30mm、0.2%-2% sds,进一步优选0.5%-1%,最优1%、5-20mm尿素,进一步优选10-15mm,最优12.5mm;
24.所述的提取rna的试剂盒,裂解结合液包括如下组分:离液盐、核酸助沉剂、核酸酶抑制剂、还原剂、表面活性剂、异丙醇、ph缓冲液;离液盐包括如下组分中的一种或多种:盐酸胍、异硫氰酸胍、尿素和高氯酸钠,浓度为3-6m,进一步优选4-6m,最优5m;核酸助沉剂包括如下组分中的一种或多种:5%-20% peg,进一步优选6%-12%,最优10%、2-4m licl,进一步优选2.5-4m,最优3.2m、0.1-0.5mg/ml glycogen,进一步优选0.25-0.5mg/ml,最优0.4mg/ml、2-10μg/μl carrier rna,进一步优选3-8μg/μl,最优6μg/μl;核酸酶抑制剂包括如下组分中的一种或多种:5mm-50mm edta,进一步优选10mm-40mm,最优20mm、5mm-50mm egta,进一步优选10mm-40mm,最优20mm、0.5-10mm ata,进一步优选2mm-8mm,最优5mm、50mm-200mm甘油醛,进一步优选75mm-150mm,最优125mm、1mg/ml-5mg/ml naf,进一步优选2mg/ml-4mg/ml,最优3mg/ml;还原剂包括如下组分中的一种或多种:20mm-200mm三(2-羧乙基)膦盐酸盐,进一步优选50mm-150mm,最优125mm、2%-10%β-巯基乙醇,进一步优选3%-8%,最优5%、50-400mm dtt,进一步优选100mm-250mm,最优200mm;表面活性剂包括如下组分中的一种或多种:tween 20、triton x-100、nonidet p40、brij35,含量1%-10%,进一步优选1%-5%,最优2%、异丙醇含量30-60%,进一步优选35%-55%,最优40%;ph缓冲液包括如下组分中的一种或多种:50mm-250mm ph6.6naac-hac缓冲液、50mm-250mm ph 6.6tris-hcl缓冲液,进一步优选100mm-200mm,最优200mm;溶剂为无rna酶水;
25.其中磁珠包括羟基磁珠、羧基磁珠中至少一种;;
26.洗涤液分为洗涤液1和洗涤液2;
27.洗涤液1包括如下组分:离液盐、乙醇、ph缓冲液、表面活性剂;离液盐包括如下组分中的一种或多种:盐酸胍、异硫氰酸胍、尿素和高氯酸钠,浓度为1-4m,进一步优选2-3m,最优2.5m;乙醇含量30-60%,进一步优选40-55%,最优50%;ph缓冲液包括如下组分中的一种或多种50mm-250mm ph6.6naac-hac缓冲液、50mm-250mm ph6.6tris-hcl缓冲液,进一步优选50mm-100mm,最优50mm;表面活性剂包括如下组分中的一种或多种:tween 20、triton x-100、nonidet p40、brij35,含量1%-10%,进一步优选1%-5%,最优1%;
28.洗涤液2包括如下组分:70%-80%乙醇,最优80%、ph缓冲液、400-800mm的nacl,
最优500mm;ph缓冲液包括如下组分中的一种或多种:10mm-50mm ph 7.5naac-hac缓冲液、10mm-50mm ph 7.5tris-hcl缓冲液,最优20mm;
29.洗脱液包括如下组分:0.1% depc-treated water(dnase、rnase free)。
30.本发明还提供了所述的试剂盒在提取rna中的应用。
31.具体包括以下步骤:
32.1)将采集的样本至于离心管中,样本缓冲液体积150-250μl,然后加入18-22μl蛋白酶k,涡旋混匀,
33.本发明样本缓冲液包括但不限于蛋白酶k反应buffer,如果是细胞或者组织样本,加入蛋白酶k反应buffer和蛋白酶k后,于56℃反应30-60min;对于血液样本、尿液样本、含保存液的宫颈拭子、口腔拭子、鼻咽拭子直接取200μl样本,无需补充蛋白酶k反应buffer,再加入20μl蛋白酶k进行反应;
34.2)500-2000转/分钟低速离心至少5s后,加入250-350μl裂解结合液和18-22μl磁珠,振荡混匀,56℃裂解结合8-12min,期间颠倒混匀;
35.3)500-2000转/分钟低速离心至少5s后,将离心管置于磁力架上静置2-5min至溶液完全澄清后,小心吸弃液体;
36.4)加入550-650μl洗涤液1,振荡混匀至少1min;
37.5)500-2000转/分钟低速离心至少5s后,将离心管置于磁力架上静置2-5min至溶液完全澄清后,小心吸弃液体;
38.6)将dnase i和dnase i buffer按比例轻柔预混,加入预混液250-700μl,轻柔混匀后常温反应10-20min;500-2000转/分钟低速离心至少5s后,将离心管静置,磁珠完全吸附后,小心吸去液体;加入550-650μl洗涤液1,振荡混匀至少1min;500-2000转/分钟低速离心至少5s后,将离心管置于磁力架上静置2-5min至溶液完全澄清后,小心吸弃液体;
39.7)加入550-650μl洗涤液1,振荡混匀至少1min,500-2000转/分钟低速离心至少5s后,将离心管置于磁力架上静置2-5min至溶液完全澄清后,小心吸弃液体;
40.8)加入550-650μl洗涤液2,振荡混匀;500-2000转/分钟低速离心至少5s后,将离心管置于磁力架上静置2-5min至溶液完全澄清后,小心吸弃液体;
41.9)500-2000转/分钟低速离心至少5s后,将离心管置于磁力架上静置2-5min至溶液完全澄清后,小心吸去全部液体;
42.10)将离心管室温晾干3-5min;
43.11)将离心管加入50-100μl洗脱液,振荡混匀,室温孵育至少5min,期间颠倒混匀;12)将离心管置于磁力架上静置2-5min至溶液完全澄清后,小心将上清液转移至一个新离心管中保存。
44.本发明所述的应用,提取rna的对象包括:细胞、组织、血液、尿液、宫颈拭子、口腔拭子、鼻咽拭子样本。
45.本发明的方法,能够去除dna污染,获得高纯度的rna,并且能够轻松实现流程的仪器自动化操作。通过多种验证方式综合评价了该提取方法提取rna的效果,包括rna浓度、rna纯度、下游应用等。
46.本发明相对于现有技术的优势或者有益效果。
47.优势1:采用磁珠法提取高纯度的rna,提取流程短,操作简单,能够适用于仪器自
动化提取,极大提高了临床应用范围。
48.优势2:提取过程未采用有毒有机试剂,绿色环保。
49.优势3:本发明在提取过程中有效彻底地去除dna的污染,所得rna产量高、纯度高,能很好地适应于后续rt-pcr和rna-seq应用。
50.优势4:本发明采用临床宫颈脱落细胞为样本进行了大量的提取及后续检测验证。该提取方式能够有效应用于hpv e6/e7 mrna的检测。
具体实施方式
51.以下结合实施例旨在进一步说明本发明,而非限制本发明。
52.实施例1:油和乳化剂的测试
53.本发明试剂盒组分和配比如下:蛋白酶k(20mg/ml),蛋白酶k反应buffer(30mm tris
·
hcl、1% sds、12.5mm尿素),裂解结合液(5m异硫氰酸胍、10% peg、3.2m licl、0.4mg/ml glycogen、20mm edta、125mm三(2-羧乙基)膦盐酸盐、2% triton x-100、40%异丙醇、125mm三(2-羧乙基)膦盐酸盐、200mm ph6.6naac-hac缓冲液、溶剂为无rna酶水)、羧基磁珠、dna酶反应液(dna酶反应液包括dnase i、dnase i buffer。dnase i在dna酶反应液中的量为75u/ml。dnase i buffer包含水相、油相和乳化剂,油相(二甲基硅油)占两相总体积的75%、乳化剂(tween 20)占两相总体积的1%,水相中含10mm tris-hcl缓冲液(ph 7.5)、2.5mm mgcl2、0.5mm cacl2、5%peg),洗涤液1(2.5m异硫氰酸胍、50%乙醇、50mm ph6.6naac-hac缓冲液、1% triton x-100),洗涤液2(80%乙醇、500mmnacl、20mm ph 7.5naac-hac缓冲液),洗脱液(0.1% depc-treated water)。
54.本实施例设置3组,第1组为本发明加油和乳化剂的dnase i处理组,第2组为不加油和乳化剂的dnase i处理组(仅仅油和乳化剂不添加,水相体积与第一组的dnase i buffer总体积相同,其余组分均与第1组相同),第3组为未经dnase i处理组(仅仅dnase i和dnase i buffer不使用,其余组分均与第1组相同)。其中,第1、2组进行下述具体操作过程的步骤6(dnase i处理步骤),而第3组不执行步骤6。除此之外,其他步骤都相同。
55.实施例1的具体操作过程如下:
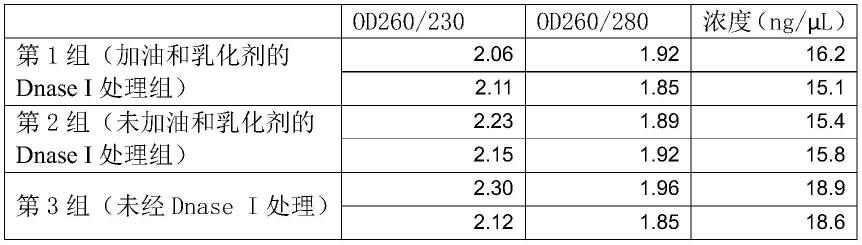
56.1)三组分别取采集的宫颈脱落细胞样本悬液200μl(采用pbs悬浮),至1.5
57.ml离心管中,加入20μl蛋白酶k,涡旋10s混匀。
58.2)2000转/分钟瞬时离心5秒后,加入300μl裂解结合液和20μl磁珠,振荡混匀,56℃裂解结合10min,期间颠倒混匀3回,每回3-5次。
59.3)2000转/分钟瞬时离心5秒后,将离心管放置于磁力架上静置2-3min,磁珠完全吸附后,小心吸去液体。
60.4)加入600μl洗涤液1,振荡混匀1min。
61.5)2000转/分钟瞬时离心5秒后,将离心管放置于磁力架上静置2-3min,磁珠完全澄清后,小心吸去液体。
62.6)将dnase i和dnase i buffer按比例轻柔预混,加入预混液400μl,轻柔混匀后常温反应15min。2000转/分钟瞬时离心5秒后,将离心管放置于磁力架上静置2-3min,磁珠完全吸附后,小心吸去液体。加入600μl洗涤液1,振荡混匀1min。2000转/分钟瞬时离心5秒后,将离心管放置于磁力架上静置2-3min,磁珠完全吸附后,小心吸去液体。
63.7)加入600μl洗涤液2,振荡混匀。2000转/分钟瞬时离心5秒后,将离心管放置于磁力架上静置2min,磁珠完全吸附后,小心吸去液体。
64.8)2000转/分钟瞬时离心5秒后,将离心管放置于磁力架上静置2min,磁珠完全吸附后,小心吸去全部液体。
65.9)将离心管于磁力架上,室温晾干5min。
66.10)将离心管从磁力架上取下,加入80μl洗脱液,振荡混匀,室温孵育5min,期间颠倒混匀3回,每回3-5次。
67.11)将离心管放置于磁力架上静置2min,至溶液完全澄清后,小心将上清液转移至一个新离心管中,并于-20
±
5℃保存,长期保存可放置于-80℃冰箱。
68.所得rna用酶标仪进行浓度及纯度测定,采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行rt-pcr检测。检测结果如下:
69.表1
[0070][0071]
表2
[0072][0073]
两种dnase i处理方式所提rna核酸浓度和纯度都较高,且相比未进行dnase i处理组,两种dnase i处理组均具有dna去除效果。加油和乳化剂进行dnase i处理比不加油和乳化剂处理所得rna量略高,同时dna去除效果一致。
[0074]
实施例2:仪器提取测试
[0075]
本实施例设置与实施例1相同,共设置3组,第1组为加油和乳化剂的dnase i处理组,第2组为不加油和乳化剂的dnase i处理组,第3组为未经dnase i处理组。本实施例采用核酸提取仪进行提取(核酸提取仪提取与实施例1均是采用相同的试剂),其中第1、2组程序设置含dnase i处理步骤,第3组不含dnase i处理步骤。提取流程与实施例1相同。
[0076]
所得rna用酶标仪进行浓度及纯度测定,采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行rt-pcr检测。检测结果如下
[0077]
表3
[0078][0079]
表4
[0080][0081]
两种dnase i处理方式所提rna核酸浓度和纯度都较高,且相比未进行dnase i处理组,两种dnase i处理组均具有dna去除效果。加油和乳化剂进行dnase i处理比不加油和乳化剂处理所得rna量略高,同时加油和乳化剂进行dnase i处理比不加油和乳化剂处理其dna去除效果更好。这也是本发明的创新之处,通过加入油和乳化剂,不改dnase i反应物质有效浓度的情况下,增大dnase i反应时的体积,提高仪器提取的操作友好度,从而提高dna消化效果。
[0082]
实施例3:dnase i buffer中peg含量的测试
[0083]
本实施例设置6组,其中1-5组为dnase i处理组,dnase i在dna酶反应液中的量为75u/ml,第1组dnase i buffer中不含peg,第2组dnase i buffer中peg含量2.5%,第3组dnase i buffer中peg含量5%,第4组dnase i buffer中peg含量10%,第5组dnase i buffer中peg含量20%,第6组为不加dnase i处理组。其余组分配方均一致,且与实施例1中第1组相同,第1-5组进行下述具体操作过程的步骤6(dnase i处理步骤),而第6组不执行步骤6。除此之外,其他步骤都相同。
[0084]
具体操作过程如下:
[0085]
1.6组分别取采集的宫颈脱落细胞样本悬液200μl,至1.5ml离心管中,加入20μl蛋白酶k,涡旋10s混匀。
[0086]
2.后续操作步骤同实施例1的第2-11步骤。
[0087]
所得rna采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行rt-pcr检测。检测结果如下:
[0088]
表5
[0089][0090]
加入一定量的peg,能够提高rna的产率,当peg浓度超过10%时,由于反应体系粘度太大,会导致rna产率下降,同时dna消化效果也下降。本发明摸索到的较适浓度范围为2.5%-10%。
[0091]
实施例4:在磁珠法提取宫颈脱落细胞样本rna时去除dna污染的效果测试
[0092]
本实施例设置两组,一组试验组(dnase i处理),另一组为对照组(未经dnase i处理),其余组分配方均一致,且与实施例1中第1组相同,即试验组进行下述具体操作过程的步骤6,而对照组则不执行步骤6。除此之外,其他步骤都相同。
[0093]
1.取采集的样本悬液200μl,至1.5ml离心管中,加入20μl蛋白酶k,涡旋10s混匀。
[0094]
2.后续操作步骤同实施例1的第2-11步骤。
[0095]
所得rna采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行rt-pcr检测。检测结果如下:
[0096]
表6
[0097][0098][0099]
从本实施例rt-pcr结果来看,试验组(dnase i处理)dna的比率相较于对照组(未经dnase i处理)低很多,即dnase i处理后dna占比降低。
[0100]
所得rna经hiefffast rna library prep kit for illumina(cot 12304es96)试剂盒宿主(人)rrna去除后进行全转录本测序,测序结果如下:
[0101]
表7
[0102][0103]
从本实施例rna-seq结果来看,试验组(dnase i处理)introns的比率相较于对照组(未经dnase i处理)低很多,即dnase i处理后dna占比降低。
[0104]
实施例5:在磁珠法提取细胞系rna时去除dna污染的效果测试
[0105]
本实施例设置两组,一组试验组(dnase i处理),另一组为对照组(未经dnase i处理),其余组分配方均一致,且与实施例1中第1组相同,即试验组进行下述具体操作过程的步骤6,而对照组则不执行步骤6。除此之外,其他步骤都相同。
[0106]
具体操作过程如下:
[0107]
1.两组分别取2份1e5-1e7个cells,pbs补至200μl,至1.5ml离心管中。加入20μl蛋白酶k和200μl蛋白酶k反应液,振荡混匀。
[0108]
2.后续操作步骤同实施例1的第2-11步骤。
[0109]
所得rna采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行rt-pcr检测。检测结果如下:
[0110]
表8
[0111][0112]
从本实施例rt-pcr结果来看,试验组(dnase i处理)dna的比率相较于对照组(未经dnase i处理)低很多,即dnase i处理后dna占比降低。
[0113]
实施例6:在磁珠法提取血液rna时去除dna污染的效果测试
[0114]
本实施例设置两组,一组试验组(dnase i处理),另一组为对照组(未经dnase i处
理),其余组分配方均一致,且与实施例1中第1组相同,即试验组进行下述具体操作过程的步骤6,而对照组则不执行步骤6。除此之外,其他步骤都相同。
[0115]
1.取200μl血液至1.5ml离心管中。加入20μl蛋白酶k,振荡混匀。
[0116]
2.后续操作步骤同实施例1的第2-11步骤。
[0117]
所得rna采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行rt-pcr检测。检测结果如下:
[0118]
表9
[0119][0120]
从本实施例rt-pcr结果来看,试验组(dnase i处理)dna的比率相较于对照组(未经dnase i处理)低很多,即dnase i处理后dna占比降低。
[0121]
实施例7:在磁珠法提取组织rna时去除dna污染的效果测试
[0122]
本实施例设置两组,一组试验组(dnase i处理),另一组为对照组(未经dnase i处理),其余组分配方均一致,且与实施例1中第1组相同,即试验组进行下述具体操作过程的步骤6,而对照组则不执行步骤6。除此之外,其他步骤都相同。
[0123]
1.取组织10-20mg,尽量剪成小块,加入20μl蛋白酶k和200μl蛋白酶k反应液,使用电动匀浆机研磨至组织研磨充分(低温条件),振荡混匀,56℃孵育30min,期间颠倒混匀3回,每回3-5次。
[0124]
2.后续操作步骤同实施例1的第2-11步骤。
[0125]
所得rna采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行rt-pcr检测。检测结果如下:
[0126]
表10
[0127][0128]
从本实施例rt-pcr结果来看,试验组(dnase i处理)dna的比率相较于对照组(未经dnase i处理)低很多,即dnase i处理后dna占比降低。
[0129]
实施例8:在磁珠法提取口腔、鼻咽拭子样本rna时去除dna污染的效果测试本实施例设置两组,一组试验组(dnase i处理),另一组为对照组(未经dnase i处理),其余组分配方均一致,且与实施例1中第1组相同,即试验组进行下述具体操作过程的步骤6,而对照组则不执行步骤6。除此之外,其他步骤都相同。
[0130]
1.含保存液(保存液为病毒保存液或pbs)的拭子样本:取200μl拭子样本至1.5ml离心管中,加入20μl蛋白酶k,涡旋10sec混匀。
[0131]
2.后续操作步骤同实施例1的第2-11步骤。
[0132]
所得rna采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行
rt-pcr检测。检测结果如下:
[0133]
表11
[0134][0135]
从本实施例rt-pcr结果来看,试验组(dnase i处理)dna的比率相较于对照组(未经dnase i处理)低很多,即dnase i处理后dna占比降低。
[0136]
实施例9:在磁珠法提取尿液样本沉淀rna时去除dna污染的效果测试
[0137]
本实施例设置两组,一组试验组(dnase i处理),另一组为对照组(未经dnase i处理),其余组分配方均一致,且与实施例1中第1组相同,即试验组进行下述具体操作过程的步骤6,而对照组则不执行步骤6。除此之外,其他步骤都相同。
[0138]
1.取采集的尿液样本经4℃1600g离心10min后,去上清保留下层约1ml沉淀,将其转移至1.5ml离心管,4℃12000g离心10min后去上清保留下层约200μl沉淀悬液,加入20μl蛋白酶k,涡旋10sec混匀。
[0139]
2.后续操作步骤同实施例1的第2-11步骤。
[0140]
所得rna采用经设计好只能扩增actb rna的引物和只能扩增actb dna的引物进行rt-pcr检测。检测结果如下:
[0141]
表12
[0142][0143]
从本实施例rt-pcr结果来看,试验组(dnase i处理)dna的比率相较于对照组(未经dnase i处理)低很多,即dnase i处理后dna占比降低。
[0144]
实施例10:磁珠法提取rna时进行dna去除处理应用于宫颈细胞hpv病毒e6/e7 mrna检测
[0145]
按实施例4的流程操作要求,将临床采集的20例宫颈细胞提取rna,所提取的rna采用hpv病毒e6/e7 mrna检测试剂进行检测,检测结果与临床阴道镜检查结果对比,统计如下:
[0146]
表13
[0147][0148][0149]
从本实施例的结果看出,采用磁珠法提取rna时进行dna去除处理的技术方法可有
效应用于宫颈细胞hpv病毒e6/e7 mrna检测。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。