一种用于识别atp结合蛋白的光亲和探针及其制备方法和应用
技术领域
1.本发明属于生物检测分析技术领域,具体涉及一种用于识别atp结合蛋白 的光亲和探针及其制备方法和应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不 必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所 公知的现有技术。
3.在过去的40年,激酶作为一类重要的药物靶标被广泛研究,激酶抑制剂的 开发也在近二十年飞速发展。目前常用于激酶抑制剂分析的方法主要有两类:一 类通过体外激酶活性实验,来分析抑制剂的靶点和活性;另一类则使用固载的激 酶抑制剂来钓取与其结合的激酶,从而分析其选择性。第一类方法中,需要使用 纯化的重组蛋白来开展实验,且实验通量较低;第二类方法虽然有较高的通量, 但需要将待分析的激酶抑制剂分别进行固载,然后通过高通量方法如噬菌体展 示、质谱等对其结合蛋白进行分析。因此,开发对不同抑制剂具有普适性的高通 量分析方法在激酶抑制剂的研究中有重要意义。
4.基于活性的蛋白质组学方法主要利用小分子活性探针对其靶蛋白进行标记 和富集,进而通过液质联用进行高通量分析。目前已开发了多种用于分析激酶抑 制剂的探针,主要分为两类:一类以各种激酶抑制剂的衍生物为探针,用于分析 与激酶抑制剂相互作用的特定靶蛋白;一类是对atp进行修饰的探针,可分析 多种激酶抑制剂的相互作用蛋白。第一类激酶抑制剂衍生物探针具有较好的特异 性和选择性,但分析不同的抑制剂需要设计合成不同的探针,不具有普适性;第 二类对atp进行修饰的探针,其修饰基团的不同会影响探针与蛋白的相互作用, 需要根据实验目的在适当的位置添加反应基团和报告基团。
技术实现要素:
5.针对上述现有技术的不足,本发明提供一种用于识别atp结合蛋白的光亲 和探针及其制备方法和应用。本发明开发了一种用于分析atp结合蛋白和激酶 的新型atp光亲和探针,该探针在atp的γ-磷酸部位添加体积较小的光亲和基 团双吖丙啶和可进行生物正交反应的炔基。该探针能够兼顾探针反应活性和稳定 性的同时实现对激酶抑制剂的高通量分析。基于上述研究成果,从而完成本发明。
6.具体的,本发明涉及以下技术方案:
7.本发明的第一个方面,提供一种用于识别atp结合蛋白的光亲和探针,所 述光亲和探针可具有如下结构:
[0008][0009]
本发明设计上述atp光亲和探针,该探针的结合基团为atp,反应基团为 光亲和基团:双吖丙啶,报告基团通过可进行生物正交反应的炔基连接。当该探 针靠近atp结合蛋白并与之结合时,双吖丙啶在紫外光照射下产生卡宾与附近 的atp结合蛋白发生共价结合,探针标记对atp结合蛋白完成标记后其末端炔 基通过点击化学反应可以根据实验的需求连接诸如罗丹明b等荧光染料进行荧 光凝胶成像实验或者连接生物素等进行后续的质谱检测和分析。
[0010]
本发明的第二个方面,提供上述光亲和探针的制备方法,所述制备方法包括 如下合成路线:
[0011]
本发明的第三个方面,提供一种试剂盒,所述试剂盒至少包含上述光亲和探 针。所述试剂盒还可以包含其他任意缓冲液、反应试剂等,在此不做具体限定。
[0012]
本发明的第四个方面,提供上述光亲和探针或试剂盒在atp结合蛋白和激 酶相关研究中的应用。
[0013]
其中,所述应用至少包括:采用上述探针或试剂盒标记并筛选atp结合蛋 白和激酶,和/或针对不同激酶抑制剂的靶蛋白进行高通量分析即蛋白质组学的 分析研究。
[0014]
更具体的,上述应用包括:基于上述探针或试剂盒的非标记定量蛋白质组学 分析方法对激酶抑制剂的靶蛋白进行标记和富集,然后通过液质联用从而实现对 激酶抑制剂的高通量分析。
[0015]
以上一个或多个技术方案的有益技术效果:
[0016]
上述技术方案首次开发了一种新型atp光亲和探针,通过蛋白质组学分析方 法,验证和研究了该探针能有效标记hek 293t细胞裂解液中的atp结合蛋白; 进一步利用该探针通过非标记定量蛋白质组学方法对atp竞争性激酶抑制剂的 靶蛋白进行了全面分析;同时,基于上述发明构思还可用于其他激酶抑制剂或 atp结合蛋白抑制剂作用机制的研究,因此具有良好的实际应用之价值。
附图说明
[0017]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明 的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0018]
图1为本发明实施例1中新型atp光亲和探针的结构(a)和对照探针的结 构(b);(a)和(b)最右侧大框部分是atp即结合基团;(a)中中间浅色小框 部分是双吖丙啶即光亲和基团;(a)和(b)最左侧框部分是炔基即可通过点击 化学连接罗丹明b或生物素的生物正交基团。
[0019]
图2为本发明实施例1中合成atp光亲和探针(a)和对照探针(b)的反应 过程;
[0020]
图3为本发明实施例1中未经hplc分离的探针一级质谱图(a)、分离后探 针的一级
质谱图(b)和分离后探针的二级质谱图(c);
[0021]
图4为本发明实施例2中紫外照射(a)和紫外照射时间(b)以及探针浓度 (c)对探针标记细胞裂解液的影响;
[0022]
图5为本发明实施例2中金属离子和edta对探针标记细胞裂解液的影响; (a)探针标记细胞裂解液时加入不同浓度的二价金属离子;(b)探针标记细胞 裂解液前加或不加入edta;探针标记完成后,通过点击化学连接罗丹明b,样 品经sds-page分离后进行荧光凝胶成像;cbb:考马斯亮蓝;
[0023]
图6为本发明实施例2中atp竞争验证探针对细胞裂解液的特异性标记;
[0024]
图7为本发明实施例2中基于韦恩图显示新型atp光亲和探针在三次生物重 复中鉴定到的总蛋白(a)、atp结合蛋白(b)和激酶(c)的对比;
[0025]
图8为本发明实施例2中火山图显示lfq分析的数据;(a)lfq分析探针/atp 与探针竞争标记细胞裂解液中鉴定到所有蛋白的火山图;(b)lfq分析探针/对 照探针标记细胞裂解液中鉴定到所有蛋白的火山图;(c)lfq分析探针/atp与 探针竞争标记细胞裂解液中鉴定到atp结合蛋白的火山图;(d)lfq分析探针/ 对照探针标记细胞裂解液中鉴定到atp结合蛋白的火山图;
[0026]
图9为本发明实施例3中热图显示激酶抑制剂处理后探针标记蛋白的强度变 化;
[0027]
图10为本发明实施例3中热图显示激酶抑制剂以及atp处理后部分蛋白的 标记强度变化;
[0028]
图11为本发明实施例3中蛋白免疫印迹实验验证激酶抑制剂的靶蛋白;图 (a)、(b)和(c)分别表示用抗体:jnk1、src和pgk1处理不同实验条件下 的蛋白;抑制剂a、b、c、d分别代表sp600125、星形孢菌素、达沙替尼和atp; pull down代表富集后洗脱的蛋白,input代表富集前的蛋白;右图为image j对 左图蛋白免疫印迹实验的定量分析结果,实验条件为左图中所加探针和抑制剂的 条件,相对值为pull down(jnk1/src/pgk1)/input(gapdh)的比值。
具体实施方式
[0029]
应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。 除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普 通技术人员通常理解的相同含义。
[0030]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限 制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出, 否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使 用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或 它们的组合。下列具体实施方式中如果未注明具体条件的实验方法,通常按照本 领域技术内的常规方法和条件,这种技术和条件在文献中有完整解释。
[0031]
结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并 不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件, 或按照销售公司所推荐的条件;实施例中所用的材料、试剂等,如无特殊说明, 均可通过商业途径购买得到。
[0032]
本发明的一个具体实施方式中,提供一种用于识别atp结合蛋白的光亲和 探针,所述光亲和探针可具有如下结构:
[0033][0034]
本发明设计上述atp光亲和探针,该探针的结合基团为atp,反应基团为 光亲和基团:双吖丙啶,报告基团通过可进行生物正交反应的炔基连接。当该探 针靠近atp结合蛋白并与之结合时,双吖丙啶在紫外光照射下产生卡宾与附近 的atp结合蛋白发生共价结合,探针标记对atp结合蛋白完成标记后其末端炔 基通过点击化学反应可以根据实验的需求连接诸如罗丹明b等荧光染料进行荧 光凝胶成像实验或者连接生物素等进行后续的质谱检测和分析。
[0035]
本发明的又一具体实施方式中,提供上述光亲和探针的制备方法,所述制备 方法包括如下合成路线:
[0036][0037]
本发明的又一具体实施方式中,所述制备方法包括如下步骤:
[0038]
利用阳离子交换柱将atp二钠盐由钠盐变为四丁基胺盐;具体的,将atp 二钠盐溶于水中,上样到阳离子交换柱,并用水洗脱样品,收集洗脱的溶液并检 测atp,向产物中加入四丁基氢氧化铵至溶液ph为中性,干燥后即得四丁基胺 盐的atp;然后取atp四丁基胺盐,加入3-(3-炔-1-丁基)-3-(2-碘乙基)-3h-双吖 丙啶进行反应即得。
[0039]
其中,所述阳离子交换柱中使用的阳离子交换树脂具体可以为dowex阳离 子交换树脂;阳离子交换柱使用前,需经过预处理的步骤,所述预处理具体可以 为依次使用盐酸和吡啶冲洗所述阳离子交换柱,并用水冲洗至中性。
[0040]
所述干燥可以采用冷冻干燥工艺;
[0041]
所述反应具体条件为:在室温下避光反应30-60小时,优选为48小时,反 应体系可以为有机溶剂反应体系,具体可以为含碱(如三乙胺)的二甲基亚砜。
[0042]
进一步的,上述反应制得产物还可以经过纯化步骤,具体的,所述纯化可采 用将上述产物溶于水并用c18柱在hplc上分离获得。
[0043]
其中,流动相a为30-70mm三乙基乙酸铵(teaa),流动相b为含20-40% 乙腈(acn)的30-70mm teaa,流速为0.5-2毫升/分钟;分离atp光亲和探 针的梯度洗脱条件具体为:0-5分钟,5%b,10分钟,20%b,30分钟,40%b, 40分钟,60%b,45-60分钟,100%b。
[0044]
本发明的又一具体实施方式中,提供一种试剂盒,所述试剂盒至少包含上述 光亲和探针。所述试剂盒还可以包含其他任意缓冲液、反应试剂等,在此不做具 体限定。
[0045]
本发明的又一具体实施方式中,提供上述光亲和探针或试剂盒在atp结合 蛋白和激酶相关研究中的应用。
[0046]
其中,所述应用至少包括:采用上述探针或试剂盒标记并筛选atp结合蛋 白和激酶,和/或针对不同激酶抑制剂的靶蛋白进行高通量分析即蛋白质组学的 分析研究。
[0047]
经研究发现,探针标记蛋白呈浓度依赖性,因此所述探针浓度控制为10-100 μm;在本发明的一个具体实施方式中,所述探针浓度为100μm。
[0048]
标记atp结合蛋白和激酶需在紫外照射条件下进行,所述紫外照射波长可 以为365nm,同时,照射时间过短,探针标记效率较低,而照射时间过长,则可 能导致蛋白变性,因此在本发明的一个具体实施方式中,紫外照射时间控制为 10-60分钟,优选为30分钟。
[0049]
本发明的又一具体实施方式中,研究发现加入适当浓度mgcl2和cacl2可以 促进探针标记蛋白的效率,上述mgcl2和cacl2的浓度控制为0.5-50mm,优选 为5mm。
[0050]
所述激酶抑制剂可以为atp竞争性激酶抑制剂,包括但不限于sp600125、 星形孢菌素和达沙替尼。
[0051]
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应 理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
[0052]
实施例1新型atp光亲和探针的设计与合成
[0053]
1.材料及方法
[0054]
1.1实验试剂
[0055]
甲醇和acn(oceanpak),dmf(adamas),dmso和四丁基氢氧化铵 (sigma-aldrich),三乙胺(greagent),盐酸、冰醋酸和氢氧化钠(国药),吡啶 (acmec),阳离子交换树脂dowex 50wx4 100-200(h)(alfa),atp二钠盐和 3-(3-炔-1-丁基)-3-(2-碘乙基)-3h-双吖丙啶(毕得医药),6-碘-1-己炔(aladdin), aq-c18,10*250mm,5μm(月旭科技)。
[0056]
1.2实验仪器
[0057]
hplc(安捷伦1260),质谱(赛默飞离子阱质谱lcq fleet),三用紫外分析仪, 冷冻干燥机(北京四环冻干),紫外可见分光光度计(岛津uv-2600)。
[0058]
1.3实验步骤
[0059]
1.3.1atp光亲和探针的合成
[0060]
首先利用阳离子交换柱将atp二钠盐由钠盐变为四丁基胺盐。取适量阳离子 交换树脂,用3倍柱体积的5%盐酸冲洗柱子,然后用去离子水将柱子洗至中性, 然后用3倍柱体积的2m吡啶冲洗柱子,用去离子水将柱子洗至中性,将atp 二钠盐溶于少量去离子水中,小心上样到阳离子交换柱,并用去离子水洗脱样品, 收集洗脱的溶液并用三用紫外分析仪检测atp,向产物中加入20%四丁基氢氧 化铵至溶液ph约为7,用冷冻干燥机冻干产物即得到四丁基胺盐的atp。然后 取atp四丁基胺盐,加入相应的反应试剂,在室温下避光反应约48小时。
[0061]
1.3.2atp光亲和探针的纯化
[0062]
冻干上述产物后,将其溶于适量水中并用c18柱在hplc上分离产物。流动 相a为50mm teaa,流动相b为含30% acn的50mm teaa,流速为1毫 升/分钟,分离atp光亲和探针的流动相梯度为:0-5分钟,5%b,10分钟,20%b, 30分钟,40%b,40分钟,60%b,45-60分钟,100%b。收集产物并冻干,用质 谱检测,atp光亲和探针的分子式为c
17h24
n7o
13
p3,分子量为627.06,质荷比 为626,对照探针的分子式为c
16h24
n5o
13
p3,分子量为587.06,质荷比为586, 在质谱负离子模式下得到产物的一级质谱和二级质谱。
5804r,eppendorf),amersham imager 600(ge healthcare),涡旋混匀器和金属 浴(ika)、水平摇床(dlab),旋转摇床(thermo),酶标仪(multiskan skyhigh 全波长酶标仪),电泳仪(bio-rad),离心浓缩仪(吉艾姆),纳升液相(thermoeasy-nlc),质谱(thermo q exactive orbitrap ms)。
[0075]
1.3实验步骤
[0076]
1.3.1细胞裂解液的制备
[0077]
hek 293t细胞在37℃、5%二氧化碳的细胞培养箱中,在dmem培养基(含 10%胎牛血清、1%青霉素和1%链霉素)中生长,培养至85-90%后用pbs洗涤, 胰酶消化后从培养皿中取出,离心并用pbs洗涤,然后收集细胞并冻存于-80℃ 冰箱。从-80℃冰箱中取出hek 293t细胞置于冰上,待细胞融化后,加入5-10 倍细胞体积提前预冷的1%曲拉通x-100细胞裂解液(1%曲拉通x-100,50mmhepes,150mm nacl,ph=7.4),并加入磷酸酶抑制剂a、b和蛋白酶抑制剂, 用移液枪吹散细胞后继续在冰上裂解30分钟,每隔5-10分钟用涡旋混匀器混悬 细胞,每次5-10秒。将裂解后的hek 293t细胞离心,转速为14000rpm,4℃ 下离心30分钟。取出离心后的上清,在用0.1%曲拉通x-100裂解液(0.1%曲拉 通x-100,50mm hepes,150mm nacl,ph=7.4)充分平衡nap-5柱后,将 上清加入到nap-5中,并用0.1% triton x-100裂解液洗脱以除去上清中的内源 性核苷酸,收集含有蛋白的洗脱液并补加磷酸酶抑制剂a、b和蛋白酶抑制剂, 然后用bradford法或bca法测蛋白浓度。制备细胞裂解液全程在冰上进行,将 已知浓度的hek 293t细胞裂解液直接用于后续探针的标记或分装后冻存在
ꢀ‑
80℃冰箱中。
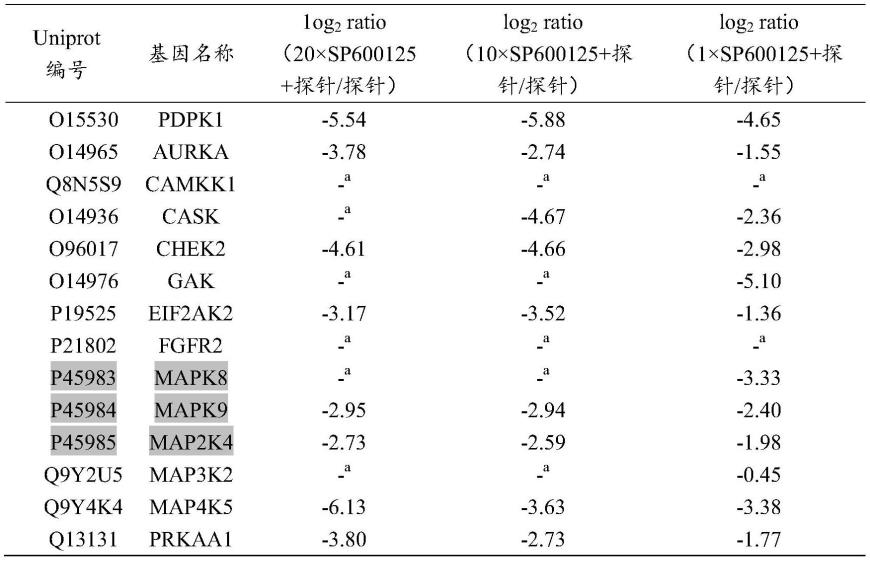
[0078]
1.3.2探针标记hek 293t细胞裂解液
[0079]
取100微克hek 293t细胞裂解液,加入二价金属离子(mgcl2和cacl2), 加入新型atp光亲和探针,并补加0.1%曲拉通x-100裂解液和磷酸酶抑制剂a、 b和蛋白酶抑制剂至蛋白浓度为1毫克/毫升,探针与蛋白在冰上避光孵育15分 钟
45
。(竞争实验中,在加入探针之前加入atp,在冰上避光孵育15分钟。)然 后用uv
365nm
在冰上避光照射30分钟。探针标记完蛋白后,沉降蛋白以除去多 余未反应的探针或抑制剂等化合物。沉降方法是加入4倍细胞裂解液体积的冰甲 醇,用涡旋混匀器使其充分混匀后,再加入等体积的冰氯仿,同样用涡旋混匀器 混匀,最后加入3倍体积提前预冷的水,经涡旋混匀器混匀后可以看到蛋白在甲 醇、水与氯仿交界处呈白色絮状混悬物。将上述蛋白在4℃,14000rpm下离心 10分钟,可以在下层甲醇、水与氯仿交界处看到蛋白沉淀,小心弃去液体,加 入冰甲醇洗蛋白沉淀,然后在相同条件下离心,用冰甲醇共重复洗三次。将沉降 后的蛋白直接用于后续实验或者冻存在-80℃冰箱中。
[0080]
1.3.3荧光凝胶成像
[0081]
取探针标记的蛋白,用4% sds缓冲液(4% sds,50mm hepes,150mmnacl,ph=7.4)溶解蛋白,然后用不含sds的缓冲液(50mm hepes,150mmnacl,ph=7.4)稀释蛋白中sds浓度,使sds浓度为0.4%,蛋白浓度为1毫 克/毫升。加入新鲜配制的tcep(终浓度为1mm)和cuso4(终浓度为1mm)、 tbta(终浓度为0.1mm)以及rhodamine b-(peg)
3-azide(终浓度为0.1mm), 用涡旋混匀器室温下反应2小时。然后用冰甲醇、冰氯仿和水沉降蛋白,步骤同 上述探针标记蛋白中的沉降蛋白方法。
[0082]
沉降后的蛋白用4%sds缓冲液溶解,步骤同上。然后用bca法测每组蛋 白的浓度,
通过统一蛋白的浓度可以减少由实验操作等带来的误差。统一取15 微克或20微克的蛋白,加入上样缓冲液后95℃煮沸5分钟。用sds-page90v 恒压至溴酚蓝到达凝胶最下端时停止电泳。
[0083]
用amersham imager 600对凝胶进行荧光成像,成像完成后用考马斯亮蓝染 色液对蛋白染色作为蛋白上样量的对照。
[0084]
1.3.4制备探针标记hek 293t细胞裂解液的质谱样品
[0085]
hek 293t细胞裂解液的制备和探针标记hek 293t细胞裂解液步骤同上。 取探针标记的蛋白(1毫克),用100微升4% sds缓冲液溶解后加入900微升 不含sds的缓冲液稀释sds的浓度。取50微升链霉亲和素琼脂糖混悬液,并 用不含sds的缓冲液洗三遍。然后将链霉亲和素琼脂糖加入到探针标记蛋白的 溶液中,在室温下旋转摇床孵育2小时。
[0086]
孵育完成后将链霉亲和素琼脂糖转移至离心过滤柱中,分别用1% sds in 1
×
pbs、10
×
pbs、1
×
pbs将链霉亲和素琼脂糖重悬洗五次。将链霉亲和素琼脂 糖转移至离心管中,加入500微升溶于50mm abc的6m尿素,加入dtt(终 浓度为20mm)在37℃下反应1小时。然后加入iaa(终浓度为50mm)室温 下避光反应30分钟。然后将链霉亲和素琼脂糖缓冲液交换为25mm abc,终体 积约为100微升,加入1微克trypsin,在金属浴中37℃下反应16小时。离心链 霉亲和素琼脂糖溶液后收集上清至新离心管中,然后用25mm abc重悬链霉亲 和素琼脂糖,离心后合并上清至上述离心管中,共重复3-5次。
[0087]
将样品用离心浓缩仪旋干,然后除盐。除盐方法:c18 tips分别用含1% fa 的acn、含1% fa的50% acn和含1% fa的h2o充分润洗和平衡;然后将旋 干后的样品用含1% fa的h2o溶解,再用c18 tips反复吹打,使样品被吸附在 c18 tips上;然后用c18 tips吸取含1% fa的h2o并弃掉溶液以除去样品中的盐; 最后将c18 tips在含1% fa的50% acn中反复吹打,使除盐后的样品被洗脱至 溶液中,将样品用离心浓缩仪旋干,保存在-80℃冰箱中。
[0088]
1.3.5液质联用
[0089]
将质谱样品溶于20微升水中,进行液质联用分析。液质联用所用c18柱预 柱填料为reprosil-pur120 c18-aq 5μm,分析柱填料为reprosil-pur120 c18-aq 3 μm。液相设置:a相为含1% fa的h2o,b相为含1% fa的80% acn,进样 量为4微升,流速为300纳升/分钟,洗脱梯度:0分钟,2% b,5分钟,10% b, 140分钟,45% b,145分钟,55% b,146分钟,88% b,156-181分钟,99% b。 质谱设置:在正离子模式下一级质谱全扫描,扫描质荷比范围350-2000,分辨率 为70000,agc target为1e6,最大注入时间为50ms,电喷雾离子源的电压为 2.1kv;dd-ms2的分辨率为17500,agc target为5e4,最大注入时间为50ms, 选择丰度最高的20个离子进行二级质谱扫描;数据采集模式为dda模式,数 据收集时间为0-156分钟。
[0090]
1.3.6质谱数据分析
[0091]
用maxquant处理原始质谱数据。maxquant是基于质谱的蛋白质组学数据分 析最常用的平台之一,将质谱数据导入maxquant,然后添加在uniprot下载的人 类蛋白质数据库,其余参数选择默认设置后运行程序。在进行非标记定量时,还 需要选择label-free quantification。我们主要关注了maxquant处理后数据的protein groups,然后用david进行go分析。最后对得到的数据用origin、 morpheus、prism等软件整理并用图表展示。
[0092]
2.结果与讨论
[0093]
2.1atp光亲和探针对hek 293t细胞裂解液的标记
[0094]
2.1.1紫外照射和探针浓度对探针标记蛋白的影响
[0095]
新型atp光亲和探针对蛋白的标记依赖其光亲和基团双吖丙啶在紫外光照 下产生卡宾,使探针共价结合靶蛋白。首先分析有无紫外照射以及紫外照射时间 对探针标记蛋白的影响,然后分析探针浓度对其标记蛋白的影响。
[0096]
分析有无紫外照射对探针标记蛋白的影响时,实验组为hek 293t细胞裂解 液中加入探针且有紫外照射,三个对照组分别是:不加探针且无紫外照射、加入 探针但无紫外照射、加入对照探针且有紫外照射。荧光凝胶成像实验结果显示(图 4,a),对照组中加入探针或对照探针后在50kda左右有荧光条带,此条带有可 能是探针作为磷酸化的供体将其炔基部分转移至蛋白上导致的,但该假设需要后 期验证;而加入探针且紫外照射后荧光条带的数目以及强度都远大于对照组,因 此紫外照射是atp光亲和探针标记蛋白所必需的条件。
[0097]
分析探针与细胞裂解液预孵育时间以及紫外照射时间对探针标记蛋白的影 响时,分别设置三种不同预孵育时间以及紫外照射时间。荧光凝胶成像实验结果 显示(图4,b),探针与细胞裂解液预孵育时间对其标记效率没有明显影响,而 延长紫外照射时间会增强探针标记蛋白的效率。我们选择探针与细胞裂解液预孵 育15分钟后,用紫外照射30分钟的条件,因为探针标记蛋白时需要先到达其结 合位点发生非共价标记,然后在紫外照射下共价标记;延长紫外照射时间会提高 探针的标记效率,但紫外照射时间过长可能会使蛋白变性,且整个标记过程应在 较短时间内完成,所以选择紫外照射30分钟。
[0098]
用五组不同浓度的探针分析其对蛋白标记的影响。荧光凝胶成像实验结果显 示(图4,c),探针的标记效率随其浓度的增加而升高,探针标记蛋白是浓度依 赖性的。
[0099]
新型atp光亲和探针对hek 293t细胞裂解液的标记是紫外照射依赖和浓度 依赖的。在后续实验中我们选择100μm探针与细胞裂解液预孵育15分钟,然 后紫外照射30分钟的标记条件。
[0100]
2.1.2金属离子和edta对探针标记蛋白的影响
[0101]
二价金属离子在许多生命过程中发挥着重要作用,例如,镁离子参与酶的磷 酰基转移,钙离子在脑神经元代谢中发挥着重要作用,缺少钙离子会导致人患骨 软化病,镁离子、钙离子及锰离子等金属离子都可以与核苷酸形成复合物。
[0102]
为了分析二价金属离子对探针标记蛋白的影响,在探针标记细胞裂解液时加 入不同浓度的mgcl2、cacl2和mncl2。荧光凝胶成像实验结果显示(图5,a), 除mncl2外,加入适当浓度的mgcl2和cacl2可以促进探针标记蛋白的效率,我 们选择在探针标记蛋白时加入5mm的mgcl2和cacl2。
[0103]
edta是镁离子和钙离子等二价金属离子的螯合剂,为了分析edta的存在 对探针标记蛋白的影响,分别在细胞裂解液过nap-5柱前后加入5mm edta, 以及不加入edta。荧光凝胶成像实验结果显示(图5,b),在细胞裂解液过nap-5 柱后加入edta会大大减弱探针的标记效率,而在细胞裂解液过nap-5柱前加 或不加edta对探针标记效率没有明显影响,考虑到atp在细胞内发挥作用需 要与金属离子螯合,而edta与二价金属离子螯合会破会这种作用力,我们选择 细胞裂解液用nap-5柱除去内源性核苷酸前后都不加入edta。
[0104]
2.1.3atp竞争对探针标记蛋白的影响
[0105]
为了验证探针对细胞裂解液的特异性标记,在探针标记蛋白时加入不同浓度 的atp与探针形成竞争标记。荧光凝胶成像实验结果显示(图6),加入atp会 降低探针标记蛋白的数目以及强度,这种趋势随加入atp的浓度增加而升高, 因为atp占据了atp结合蛋白的结合位点使探针无法与其结合,被atp竞争最 明显的几个条带其蛋白分子量在50-70kda左右,在大于70kda也有许多蛋白 被atp竞争。
[0106]
在探针标记蛋白时加入不同浓度的atp,探针标记完成后,通过点击化学连 接罗丹明b,样品经sds-page分离后进行荧光凝胶成像;cbb:考马斯亮蓝。
[0107]
为了使新型atp光亲和探针有效标记hek 293t细胞裂解液,我们筛选了紫 外照射、探针浓度、金属离子、edta以及atp对其标记效率影响。综合荧光 凝胶成像实验结果,我们决定在新型atp光亲和探针标记hek 293t细胞裂解 液时,分别加入5mm的mgcl2和cacl2,然后加入100μm探针与细胞裂解液 孵育15分钟,(竞争实验中将竞争剂与细胞裂解液预孵育15分钟),紫外照射 30分钟使探针共价标记其靶蛋白,并将此条件用于后续的实验中。
[0108]
2.2基于atp光亲和探针的蛋白质组学分析
[0109]
我们通过荧光凝胶成像实验筛选出了atp光亲和探针标记hek 293t细胞裂 解液的最优条件,并得出结论:探针标记蛋白依赖紫外照射;探针的标记效率与 其自身浓度呈正比;atp可以与探针竞争标记细胞裂解液中的蛋白。我们用探针 标记的最优条件标记细胞裂解液并将其制备成质谱样品,进而通过液质联用分 析,并与文献中已报导的atp探针对比。
[0110]
用100μm atp光亲和探针标记1毫克hek 293t细胞裂解液,将其制备成 质谱样品并通过液质联用分析,对得到的质谱数据进行分析。质谱中可以鉴定到 的总蛋白数为2000多个,其中atp结合蛋白有400多个,激酶有约200个。go 分析(图7)显示其蛋白的分子功能涉及atp结合、atp酶和蛋白激酶等,参与 翻译起始因子、srp依赖的靶向膜的翻译蛋白、病毒转录、核转录的mrna分 解代谢过程、细胞质翻译、mrna剪切、mrna稳定性调节等生物过程。
[0111]
我们共进行了三次生物重复实验(图7),其中在三次实验中可以被重复鉴定 到的蛋白有1461个(53.1%),atp结合蛋白有339个(62%),激酶132个(55%); 至少在两次实验中被重复鉴定到的蛋白有2048个(74.5%),atp结合蛋白有441 个(80.7%),激酶有184个(76.8%)。我们采用的质谱采集模式是数据依赖性 采集(dda),选择质谱全扫描过程中信号较强的母离子肽段进行二级碎裂,因 此检测重复性较差,且低丰度肽段的信号不容易被检测。为了使质谱检测到更多 的蛋白,后期可以使用高ph值反相肽分馏的方法降低样品的复杂性,提高数据 采集的覆盖度和深度;或者可以选择数据非依赖性采集(dia),通过将全部肽 段母离子进行碎裂并用二级质谱检测碎片离子的信号,提高对样品中低丰度肽段 信号的检测以及检测的重复性。
[0112]
我们设计了三组实验,高/低浓度探针标记细胞裂解液,探针/atp与探针竞 争标记细胞裂解液,探针/对照探针标记细胞裂解液,液质联用对其分析,然后 用lfq来量化三组实验中被探针标记的蛋白,用lfq intensity的比值大于或小 于1.5筛选探针特异性标记的蛋白,火山图的横坐标为log2(lfq intensity比值), 纵坐标为-log
10
(p-value),特异性标记蛋白在图8中虚线分区的的第一象限(即 右上分区)中展示。
[0113]
第一组实验,用高/低浓度探针标记细胞裂解液,分别用100μm和20μm探 针标记细胞裂解液。探针浓度较高时会标记非特异性结合蛋白,在质谱检测中, 探针特异性标记的蛋白其标记强度不会随探针的浓度升高有太大的变化,探针非 特异性标记的蛋白其标记强度会随探针的浓度升高而变强,根据不同探针浓度下 蛋白的标记强度可以筛选出探针特异性标记的蛋白。质谱中鉴定到lfq intensity (100μm探针/20μm探针)《1.5的蛋白有1000个左右,其中atp结合蛋白有 300个左右,激酶有150个左右,证明探针的选择性比较好,在较高浓度下能够 有效地标记atp结合蛋白和激酶。
[0114]
第二组实验,探针/atp与探针竞争标记细胞裂解液,分别用100μm探针和 100μm探针与1mm atp竞争标记细胞裂解液。atp和探针都可以结合atp结 合位点,从而降低探针对atp结合蛋白的标记,但不会降低探针对非atp结合 蛋白的标记,质谱中鉴定到lfq intensity(100μm探针/100μm探针 1mmatp)》1.5的蛋白有400多个,其中atp结合蛋白有200个左右,激酶有120 个左右。火山图展示了lfq的结果(图8,a,c),lfq将鉴定到的所有蛋白进 行归一化后再进行分析,在atp与探针竞争标记细胞裂解液时,由于atp占据 蛋白的结合位点使其不能被标记,导致鉴定到的蛋白数减少而产生误差,因此 lfq定量结果中被atp竞争的蛋白数比实际要少;当atp占据蛋白的结合位点 使探针对其标记减弱时,lfq标准化分析会缩小蛋白lfq intensity的比值,鉴 于此,未来可以使用silac提高定量的准确性。
[0115]
第三组实验,探针/对照探针标记细胞裂解液,分别用100μm探针和100μm 对照探针标记细胞裂解液,探针通过紫外照射产生卡宾与蛋白形成共价结合,而 对照探针由于没有光亲和基团则不能对蛋白形成共价标记,由此可以筛选出由光 亲和基团共价标记的蛋白。质谱中鉴定到lfq intensity(100μm探针/100μm对 照探针)》1.5的蛋白有1000多个,其中atp结合蛋白多于200个,激酶多于100 个。火山图展示了lfq的结果(图8,b,d),对照探针缺少光亲和基团使其鉴 定到蛋白的数目较少,同样由于lfq对所有鉴定到的蛋白归一化以及标准化分 析使得定量结果中被光亲和基团共价标记的蛋白比实际要少。
[0116]
综上,我们首先通过荧光凝胶成像实验筛选了紫外照射、探针浓度、金属离 子、edta以及atp对探针标记细胞裂解液的影响,根据实验结果选择在探针 标记蛋白时,加入5mm的mgcl2和cacl2,100μm探针与细胞裂解液孵育15 分钟,(竞争实验中将竞争剂与细胞裂解液预孵育15分钟),紫外照射30分钟使 探针共价标记蛋白。然后利用该条件将探针标记的细胞裂解液制备成质谱样品, 通过液质联用对其质谱数据进行分析,从质谱中鉴定到400多种atp结合蛋白, 其中有约200种激酶。我们还设计了三组实验,分别是高/低浓度探针标记细胞 裂解液、探针/atp与探针竞争标记细胞裂解液和探针/对照探针标记细胞裂解液, 然后用lfq来量化三组实验中被探针标记的蛋白,筛选出较高可信度的atp结 合蛋白以及由探针的光亲和基团共价标记的蛋白。
[0117]
实施例3基于atp光亲和探针的激酶抑制剂分析
[0118]
在实施例2中,我们验证了新型atp光亲和探针能有效标记hek 293t细胞 裂解液,接下来我们将该探针用于三种atp竞争性激酶抑制剂的分析。
[0119]
1.材料及方法
[0120]
1.1实验试剂
[0121]
sp600125和达沙替尼(aladdin),星形孢菌素(笛柏),bsa和丽春红 (solarbio),
nc膜(pall),吐温-20和脱脂奶粉(碧云天),tris和甘氨酸 (genview),jnk1抗体、src抗体、pgk1抗体和gapdh抗体(santa cruz), goat anti-mouse lgg(abclonal),ecl发光液(bio-rad),转膜滤纸(博士德), 其余同实施例2的实验试剂。
[0122]
1.2实验仪器
[0123]
同实施例2的实验仪器。
[0124]
1.3实验步骤
[0125]
1.3.1制备激酶抑制剂与探针竞争标记的蛋白质样品
[0126]
细胞裂解液的制备、探针标记蛋白以及质谱样品制备步骤与atp竞争标记的 步骤相似,只是将atp换成不同浓度的激酶抑制剂。
[0127]
1.3.2蛋白免疫印迹实验
[0128]
制备细胞裂解液,探针标记蛋白,以及用链霉亲和素琼脂糖富集被探针标记 的蛋白与上述质谱样品制备步骤相同,另外在加入链霉亲和素琼脂糖之前取出十 分之一的样品为富集前样品。然后在链霉亲和素琼脂糖中加入1
×
上样缓冲液,95℃煮沸5分钟。用sds-page(4%-12%)分离蛋白,90v恒压至溴酚蓝到达 凝胶最下端。
[0129]
在90v恒压,4℃下转膜90分钟,将凝胶上的蛋白转移至nc膜上,并用丽 春红染色膜,以证明转膜成功。用1
×
tbst(25mm tris,137mm nacl, 0.1%tween-20)洗掉丽春红后,加入5%脱脂牛奶,在室温下封闭2小时。用 1
×
tbst洗掉脱脂牛奶后,根据实验需求,剪取40-75kda膜后分别加入jnk1、 src和pgk1的一抗,剪取30-40kda膜加入gapdh的一抗作为对照,在4℃ 孵育16小时。回收一抗并将膜用1
×
tbst洗三次,然后加入相应二抗,在室温 下孵育2小时。回收二抗并将膜用1
×
tbst洗三次。在膜上加入新鲜配制的发光 液,用amersham imager 600对膜进行化学发光成像,并通过image j定量蛋白 免疫印迹实验的结果。
[0130]
2.结果与讨论
[0131]
2.1基于非标记定量蛋白质组学的激酶抑制剂分析
[0132]
为了将该探针用于分析激酶抑制剂的活性和选择性,选择了三种atp竞争性 激酶抑制剂,sp600125、星形孢菌素和达沙替尼,在质谱中检测到了这三种激 酶抑制剂的靶蛋白。sp600125是一种有效的铁死亡抑制剂,可以抑制自噬和诱 导凋亡,其靶蛋白包括jnk1、jnk2和jnk3,sp600125对jnk的选择性比erk1 和p38-2高300倍。星形孢菌素是一种广谱的蛋白激酶抑制剂,可以抑制蛋白激 酶c、camp依赖性蛋白激酶、磷酸激酶、核糖体蛋白s6激酶、表皮生长因子 受体激酶和ca
2
/钙调蛋白依赖性蛋白激酶ii;星形孢菌素可以诱导癌细胞g2/m 期阻断,调整g1期阻断并诱导细胞凋亡,可抑制多种癌细胞增殖,目前星形孢 菌素已进入临床ⅲ期阶段。达沙替尼是一种抗癌药物,临床上主要针对慢性髓细 胞白血病患者,其靶蛋白是多种酪氨酸激酶,可以抑制bcr-abl激酶和src 家族激酶以及其他的致癌激酶。
[0133]
用1倍、10倍和20倍探针浓度的三种激酶抑制剂分别与探针竞争标记细胞 裂解液,与不加抑制剂处理的对照组对比。通过液质联用和lfq进行分析,根 据实验组与对照组的lfq intensity比值筛选出激酶抑制剂的潜在靶蛋白。用热图 展示其结果,蓝色与红色分别表示激酶抑制剂处理后探针对蛋白的标记是减弱或 增强的,颜色的深浅代表其变化的大小,缺失值(抑制剂处理后其不能被探针标 记即lfq intensity为0)用灰色表示。我们
分别展示了不同抑制剂和不同浓度抑 制剂处理后对所有蛋白、atp结合蛋白和激酶的定量分析,整理出抑制剂处理后 被探针标记明显减弱的蛋白,并与文献中报导的抑制剂靶蛋白进行比较。
[0134]
热图显示抑制剂处理后标记强度减弱的蛋白大部分是激酶,这种趋势随抑制 剂的浓度增加而升高;三种抑制剂处理后探针对其靶蛋白的标记减弱,广谱激酶 抑制剂星形孢菌素处理后,被探针标记减弱的激酶的数目多于另外两种有一定特 异性的抑制剂(图9)。
[0135]
目前已报导了三种激酶抑制剂的部分的靶蛋白。bennett以及qian验证了 sp600125的靶蛋白如mapk8、mapk9和map2k4等;shi以及hantschel鉴 定到src、yes、egfr和map3k2等达沙替尼的靶蛋白;fischer以及cheng 利用星形孢菌素衍生物的探针鉴定到pdpk1、src和yes1等星形孢菌素的靶 蛋白;adachi利用生物素偶联酰基atp探针也鉴定到了多种星形孢菌素的靶蛋 白。表格中(表1,表2,表3)列出了激酶抑制剂处理后被探针标记明显减弱 的激酶的lfq intensity比值,其中在文献中已报导的激酶抑制剂的靶蛋白灰色突 出显示。为了验证该探针可用于分析激酶抑制剂的靶蛋白,选择质谱中检测到的 抑制剂的部分靶蛋白用蛋白免疫印迹实验对其进行验证。lfq分析不同激酶抑 制剂对探针标记蛋白的影响,用morpheus绘制热图。
[0136]
表1.lfq分析sp600125处理后探针标记强度明显降低的激酶
[0137][0138][0139]
a表示加入激酶抑制剂后探针标记的激酶lfq intensity为0,用-表示其lfqintensity的比值。
[0140]
表2.lfq分析星形孢菌素处理后探针标记强度明显降低的激酶
[0141][0142][0143]
a表示加入激酶抑制剂后探针标记的激酶lfqintensity为0,用-表示其lfqintensity的比值
[0144]
表3.lfq分析达沙替尼处理后探针标记强度明显降低的激酶
[0145][0146]
a表示加入激酶抑制剂后探针标记的激酶lfq intensity为0,用-表示其lfqintensity的比值。
[0147]
2.2蛋白免疫印迹实验验证atp探针对激酶抑制剂靶蛋白的标记
[0148]
上述实验中,激酶抑制剂处理后,通过液质联用和lfq分析抑制剂对其靶 蛋白的标记强度变化,热图显示sp600125抑制探针对其已报导的靶蛋白jnk1 的标记,同时星形孢菌素和达沙替尼也能抑制探针对jnk1的标记,但达沙替尼 对jnk1的标记影响相对前两种抑制剂要小得多;星形孢菌素和达沙替尼抑制探 针对其已报导的靶蛋白src的标记,其中达沙替尼对src的标记影响大于广谱 激酶抑制剂星形孢菌素,sp600125虽也可以抑制探针标记src,但相较于其他 两种抑制剂要弱得多;激酶抑制剂影响探针标记蛋白减弱的趋势随抑制剂浓度的 增加而升高,而三种抑制剂基本不会抑制探针对其非靶蛋白pgk1的标记(图 10)。
[0149]
lfq分析不同激酶抑制剂以及atp对探针标记其部分靶蛋白和非靶蛋白的 影响,用morpheus绘制热图。
[0150]
蛋白免疫印迹实验中,考虑到抑制剂在水中的溶解性较差,选择用20μm探 针标记500μm激酶抑制剂或atp处理的细胞裂解液。探针分别标记三种激酶抑 制剂处理后的细胞裂解液,对照组分别是无探针和抑制剂处理的细胞裂解液、探 针标记无抑制剂处理的细胞裂解液和探针标记atp处理后的细胞裂解液,探针 标记完成后,用链霉亲和素琼脂糖富集其靶蛋白,然后进行洗脱作为富集后的靶 蛋白,取富集前的蛋白为对照样品,amersham imager 600对不同抗体孵育的样 品成像后,用image j定量分析实验结果。由于抑制剂处理后可能会降低蛋白的 溶解性,选择富集后靶蛋白/富集前对照蛋白为实验的定量结果。
[0151]
蛋白免疫印迹实验结果显示,sp600125、星形孢菌素和atp会抑制探针标 记jnk1,且sp600125的抑制效果最强(图11a)。在上述lfq分析激酶抑制剂 对探针标记蛋白影响的实验中,sp600125、星形孢菌素、达沙替尼和atp对探 针标记jnk1的抑制作用与蛋白免疫印迹实验结果趋势相同;三种激酶抑制剂和 atp都会抑制探针标记src,而在上述lfq分析中,
达沙替尼对探针标记src 的抑制最强,星形孢菌素次之,atp和sp600125的影响比其他两者弱得多。可 能由于三种激酶抑制剂会降低蛋白的溶解性,导致激酶抑制剂处理的富集前样品 探针标记到的jnk1和src减少,考虑到该实验是用同一批蛋白裂解液进行的 平行实验,我们在与富集前样品对比时使用的是gapdh的强度。造成蛋白免疫 印迹实验结果和lfq分析趋势不完全一致的原因可能是lfq定量的准确性有待 提升,如果抑制剂或atp处理后探针对其靶蛋白的标记减弱,lfq分析时由于 归一化和标准化处理会缩小抑制剂对探针标记的影响,从而使定量分析的结果小 于其实际的影响。我们已制备了三组新的抑制剂处理后的质谱样品,通过生物重 复实验和统计学分析来提高定量的准确度,目前正在等待其检测结果。atp及除 达沙替尼外的抑制剂对探针标记其非靶蛋白pgk1都有较弱的抑制作用,该趋势 与lfq分析基本吻合。该实验结果验证了根据lfq分析发现的抑制剂对探针标 记的抑制,证明atp光亲和探针可用于对atp竞争性激酶抑制剂选择性和作用 机制的分析。
[0152]
综上,为了分析激酶抑制剂的活性和选择性,我们开发了一种新型atp光亲 和探针,该探针含有结合基团atp、光反应基团双吖丙啶以及可通过生物正交反 应连接不同报告基团的炔基手柄。该探针设计新颖且功能多样化,第一,光亲和 基团和炔基的体积较小,对atp的生物活性影响较小;第二,炔基可以根据实 验的需要连接罗丹明b用于荧光凝胶成像实验或连接生物素用链霉亲和素琼脂 糖富集探针标记的蛋白,用于质谱检测和分析;第三,将含有光亲和基团和炔基 的小分子化合物连接在atp的γ磷酸末端可以与之前在atp腺苷部位修饰的光 亲和探针形成对比。
[0153]
为了使新型atp光亲和探针有效标记hek 293t细胞裂解液,我们筛选了紫 外照射、探针浓度、金属离子、edta以及atp对其标记效率影响。荧光凝胶 成像实验表明探针标记蛋白是紫外照射依赖性的,探针的标记效率与其浓度成正 比,适当浓度的镁离子和钙离子可以提高探针标记蛋白的效率,edta螯合金属 离子会降低探针的标记效率,atp竞争验证了探针标记的特异性。综合荧光凝胶 成像实验结果,我们决定在新型atp光亲和探针标记hek 293t细胞裂解液时, 分别加入5mm的mgcl2和cacl2,然后加入100μm探针与细胞裂解液孵育15 分钟,(竞争实验中将竞争剂与细胞裂解液预孵育15分钟),紫外照射30分钟使 探针共价标记其靶蛋白,并将此条件用于后续的实验中。然后利用该条件将探针 标记的细胞裂解液制备成质谱样品,通过液质联用对其质谱数据进行分析,从质 谱中鉴定到400多种atp结合蛋白,其中有约200种激酶。我们还设计了三组 实验,分别是高/低浓度探针标记细胞裂解液、探针/atp与探针竞争标记细胞裂 解液和探针/对照探针标记细胞裂解液,然后用lfq来量化三组实验中被探针标 记的蛋白,筛选出较高可信度的atp结合蛋白以及由探针的光亲和基团共价标 记的蛋白。
[0154]
接下来将该探针用于定量分析三种atp竞争性激酶抑制剂,sp600125、星 形孢菌素和达沙替尼。分别用不同浓度的抑制剂与探针竞争标记细胞裂解液,通 过液质联用和lfq进行分析,结果表明激酶抑制剂处理后探针标记减弱的蛋白 大部分是激酶,且减弱的趋势随抑制剂浓度增加而升高。我们用lfq分析了激 酶抑制剂的靶蛋白,并通过蛋白免疫印迹实验验证了抑制剂的部分靶蛋白,证明 该探针可用于激酶抑制剂选择性的分析。
[0155]
我们利用该探针对细胞裂解液中的蛋白进行标记和富集,进而通过液质联用 对其进行蛋白质组学分析,并将该探针用于定量分析激酶抑制剂的靶蛋白,通过 蛋白免疫印迹实验对其靶蛋白进行了验证。该方法的优势体现在与之前通过体外 激酶活性实验分析
激酶抑制剂靶点和使用固载激酶抑制剂通过钓取与之结合的 激酶来分析抑制剂选择性的方法相比,基于探针的蛋白质组学分析方法可利用小 分子活性探针对多种激酶抑制剂的靶蛋白进行标记和富集,然后通过液质联用从 而实现对激酶抑制剂的高通量分析;而且我们采用的非标记定量技术与同位素标 记定量技术相比,适用于多种样品、成本较低,且适合大批量样品的分析,是近 年来重要的质谱定量方法。
[0156]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本 发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员 来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分 技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同 替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。