1.本发明涉及红曲发酵夏秋茶技术领域,尤其涉及一种红曲发酵夏秋茶扩大培养发酵方法。
背景技术:
2.夏秋茶因酚氨比较高而滋味苦涩,常被弃之,但夏秋茶产量远高于春茶,故资源浪费较为明显。近年来,随着农作物增值利用的提出,越来越多的人致力于提高夏秋茶的利用率。2014年,刘淑娟等人系统性的总结了如何利用不同加工工艺来降低夏秋茶苦涩味道。2022年,师大亮等人利用冠突散囊菌接种夏秋茶制作茯砖茶,并对其滋味做出感官评定,进一步表明利用生物转化可提高夏秋茶的品质。2021年,潘天全等人利用夏秋茶和小麦制作酒曲,探究其制曲工艺,为夏秋茶大曲的培养提供了研究基础。2022年,liuyuchuan等人利用红光凋萎改善夏秋茶的风味和滋味。甚至有学者利用夏秋茶改善肉鸡的免疫状态。目前,虽然已经提出了部分增值利用夏秋茶的方案,但利用率扔较低,利用生物转化提高夏秋茶品质的方案更是少之又少。
3.红曲霉菌是丝状真菌,主要应用于食品行业、酿造行业及医药行业。红曲虽起源于中国,但已被世界广泛利用。目前,就食品行业而言,红曲霉菌的利用范围已从最初的发酵大米扩增到发酵各种杂粮,甚至有将红曲菌应用于饲料行业的,主要是因为红曲菌产生的多种活性物质能有效提高畜禽的免疫力。而红曲霉菌在酿酒过程中的应用也越来越广泛,主要用于酿造白酒、黄酒、甜米酒及果蔬酒。如李绍亮等人从酿酒大曲中分离出脂化红曲,生产出的原酒风味及滋味更加丰富。吴玉峰等人从红曲米中分离出酿酒用的高产洛伐他汀红曲菌株,能显著提高黄酒的洛伐他汀含量及风味物质种类。车逸心等人利用紫红曲霉和酿酒酵母共发酵提高米酒的风味和滋味。王冰莹等人利用红曲发酵青稞和红薯制作低度紫薯酒,确定其最佳发酵工艺,并对其品质进行分析,表明该酒滋味和风味具有独特的风格。但目前为止,没有利用红曲霉发酵夏秋茶从而改变夏秋茶的苦涩滋味,扩大培养提高夏秋茶品质的方法。
4.综上所述,有必要提出一种红曲发酵夏秋茶扩大培养发酵方法,以解决上述问题。
技术实现要素:
5.本发明所要解决的技术问题在于,针对目前为止没有利用红曲霉发酵夏秋茶从而改变夏秋茶的苦涩滋味,扩大培养提高夏秋茶品质的方法的问题,提出了一种红曲发酵夏秋茶扩大培养发酵方法。
6.为了解决上述技术问题,本发明提供了一种红曲发酵夏秋茶扩大培养发酵方法,该红曲发酵夏秋茶扩大培养发酵方法包括:步骤一、种子液的制备:准确称取夏秋茶毛茶5g于茶壶中,2000ml蒸馏水煮沸3分钟,过滤,稀释2倍即得备用茶汁;以茶汁为基础溶液,按1.141g/50ml茶汁的蔗糖、0.712g/50ml茶汁的蛋白胨、0.048g/50ml茶汁的硫酸镁配制种子液,并于121℃高压灭菌20min,得到种子液;
7.步骤二、孢子悬浮液的制备:从活化好的红色红曲霉平板中刮取一环菌体于pda培养皿中培养7天,用7mm打孔器从活化好的红色红曲霉平板中打三个菌饼于无菌pda培养皿中,倒置培养5天,再使用30ml无菌水刮洗菌体,过滤于无菌三角瓶中,得到孢子悬浮液;
8.步骤三、种子液扩大培养:取150ml三角瓶,装入种子液,调整ph,接入孢子悬浮液,分别放入摇床中,于180r/min摇瓶培养,测其色价和菌体干重;
9.步骤四、固态发酵培养:准确称取10g夏秋茶毛茶于240ml组培瓶中,按适当含水量加入3%蔗糖水,100℃灭菌,接入种子液,置于恒温培养箱中培养,测其色价。
10.其中,红色红曲霉的保藏编号为cgmcc no.3.15746。
11.其中,步骤二中,使用无菌水刮洗菌体,过滤于无菌三角瓶中后,使用血球计数板计数,确保孢子浓度达106cfu/ml。
12.其中,步骤三中种子液扩大培养,以摇床温度、接种量、初始ph、装液量及培养时间为单因素,以菌体干重及色价为指标分析各因素对种子液扩大培养的影响,确定因素及水平,筛选出较优种子液扩大培养条件:温度28℃、接种量4%、初始ph值5、装液量50ml、发酵时间8天。
13.其中,步骤四中固态发酵培养,以含水量、发酵温度、接种量和培养时间为单因素,以色价为指标分析各因素对固态发酵的影响,在单因素试验的基础上,通过box-benhnken的中心组合试验设计原理,以红曲发酵夏秋茶色价为响应面值,对发酵条件进行优化,筛选出最优固态发酵条件:培养时间7.163d、接种量34.230%、温度28.889℃、含水量42.383%。
14.实施本发明实施例,具有如下有益效果:
15.本红曲发酵夏秋茶扩大培养发酵方法,利用红曲菌发酵夏秋茶,结合红曲菌的优势,进而改变夏秋茶的苦涩滋味,并确定了种子液扩大培养条件和最优固态发酵条件,为扩大发酵提高夏秋茶的品质提供了一定的基础。
附图说明
16.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
17.图1为温度对种子液生长的影响示意图;
18.图2为接种量对种子液生长的影响示意图;
19.图3为初始ph值对种子液生长的影响示意图;
20.图4为装液量对种子液生长的影响示意图;
21.图5为发酵时间对种子液生长的影响示意图;
22.图6为菌体干重因子水平均值图;
23.图7为色价因子水平均值图;
24.图8为含水量对固态发酵的影响示意图;
25.图9为温度对固态发酵的影响示意图;
26.图10为接种量对固态发酵的影响示意图;
27.图11为发酵时间对固态发酵的影响示意图;
28.图12为时间和接种量对色价影响的响应面和等高线;
29.图13为时间和温度对色价影响的响应面和等高线;
30.图14为时间和含水量对色价影响的响应面和等高线;
31.图15为接种量和温度对色价影响的响应面和等高线;
32.图16为接种量和含水量对色价影响的响应面和等高线;
33.图17为温度和含水量对色价影响的响应面和等高线。
具体实施方式
34.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.红曲发酵夏秋茶扩大培养发酵方法包括:
36.步骤一、种子液的制备:准确称取夏秋茶毛茶5g于茶壶中,2000ml蒸馏水煮沸3分钟,过滤,稀释2倍即得备用茶汁;以茶汁为基础溶液,按1.141g/50ml茶汁的蔗糖、0.712g/50ml茶汁的蛋白胨、0.048g/50ml茶汁的硫酸镁配制种子液,并于121℃高压灭菌20min,得到种子液。
37.步骤二、孢子悬浮液的制备:从活化好的红色红曲霉(保藏编号为cgmcc no.3.15746)平板中刮取一环菌体于pda培养皿中培养7天,用7mm打孔器从活化好的红色红曲霉平板中打三个菌饼于无菌pda培养皿中,倒置培养5天,再使用30ml无菌水刮洗菌体,过滤于无菌三角瓶中,使用血球计数板计数,确保孢子浓度达106cfu/ml,得到孢子悬浮液。
38.步骤三、种子液扩大培养:取150ml三角瓶,装入种子液,调整ph,接入孢子悬浮液,分别放入摇床中,于180r/min摇瓶培养,测其色价和菌体干重。菌体干重的测定:使用烘干恒重的定量滤纸过滤发酵液,滤液用50ml离心管收集备用,滤渣用超纯水充分洗涤后置于60℃烘干至恒重,称重计算前后质量差即得菌体干重。色价的测定:参照gb1886.19-2015测定过滤后的发酵液色价及固态发酵茶色价。
39.种子液扩大培养条件筛选,以摇床温度、接种量、初始ph、装液量及培养时间为单因素,以菌体干重及色价为指标分析各因素对种子液扩大培养的影响,确定因素及水平。
40.单因素试验:
41.试验
①
温度:取150ml三角瓶,装入50ml种子液,ph自然,按2%接种量接入孢子悬浮液,分别放入22℃、25℃、28℃、31℃、34℃摇床中,于180r/min摇瓶培养5天。测其色价和菌体干重。
42.温度是影响微生物体生长的重要因素之一,影响微生物生长的环境因素是多样性的,筛选出特定条件下菌体生长的最适温度尤为重要。选择红曲菌生长的常用温度,通过测定不同温度下菌体的干重和色价判断菌体的生长繁殖情况,找出温度的可行性范围,其结果如图1所示。
43.由图1可知,种子液的色价在22℃至28℃呈上升趋势,当温度由28℃升至31℃时色价降低,温度31℃时与34℃时色价相差不大,温度为22℃时色价最低,为1.283μ/g,温度为28℃时,色价最高,为3.422μ/g。种子液菌体干重在22℃时也为最低,为0.038g,温度为31℃
时,菌体干重最高,为0.176g,但28℃时,菌体干重与31℃时相差不大。综合分析,应去除温度22℃,设定温度可行性范围为25℃-34℃。
44.试验
②
接种量:取150ml三角瓶,装入50ml种子液,ph自然,分别按1%、2%、3%、4%、5%接种量接入孢子悬浮液,置于28℃摇床中,于180r/min摇瓶培养5天。测其色价和菌体干重。
45.接种量亦是影响发酵的重要因素之一,接种量过大可能会引起溶氧不足,底物浓度有限,会制约菌体生长繁殖,接种量过小,会加大菌体繁殖的进程,因此,适合的接种量在发酵中至关重要。选择常用的接种量范围,测定不同接种量下种子液菌体的干重和色价,找出接种量的可行性范围,其结果如图2所示。
46.由图2可知,当接种量由1%升至4%时,菌体干重呈上升趋势,当菌体干重由4%升至5%时,菌体干重明显下降,接种量为1%时,菌体干重最低,为0.029g,当接种量为4%时,菌体干重最高,为0.178g。当接种量从1%升至2%时,色价显著上升,当接种量从2%升至3%时,色价显著降低,接种量从3%升至5%时,色价整体变化不大,接种量为1%时,色价最低,为2.038μ/g,当接种量为2%时,色价最高,为3.491μ/g。综合分析,接种量为1%时,菌体干重和色价均为最低值,应去除1%接种量,设定接种量可行性范围为2%-5%。
47.试验
③
初始ph:取150ml三角瓶,装入50ml种子液,分别调ph值为3、4、5、6、7,按2%接种量接入孢子悬浮液,置于28℃摇床中,于180r/min摇瓶培养5天。测其色价和菌体干重。
48.微生物通常在某一个ph值范围内能生长,但是会存在一个最适ph,此时酶活性最高。红曲菌最适ph通常在3.5-6之间,选择常用红曲菌的ph范围,测定不同初始ph值下种子液的菌体干重和色价,找出可行性初始ph值范围,其结果如图3所示。
49.由图3可知,当初始ph值由3升至5时,菌体干重呈上升趋势,初始ph值由5升至7时,菌体干重呈下降趋势,当初始ph值为3时,菌体干重最低,为0.048g,当初始ph值为5时,菌体干重最大,为0.159g。当初始ph值由3升至6时,色价呈上升趋势,初始ph值由6升至7时,色价呈下降趋势,当初始ph值为3时,色价最低,为2.061μ/g,当初始ph值为6时,色价最高,为3.368μ/g。综合分析,应去除初始ph值3,设定初始ph值可行性范围为4-7。
50.试验
④
装液量:取150ml三角瓶,分别装入20ml、30ml、40ml、50ml、60ml种子液,ph自然,按2%接种量接入孢子悬浮液,置于28℃摇床中,于180r/min摇瓶培养5天。测其色价和菌体干重。
51.装液量也是影响摇瓶发酵的重要因素之一,装液量过多,传氧系数较低,制约菌体生长繁殖,装液量过少,营养基质较少,同样会降低菌体生长繁殖能力。因此,选择常规摇瓶装液量范围,测定不同装液量下种子液菌体干重和色价,找出装液量的可行性范围,其结果如图4所示。
52.由图4可知,当装液量从20ml上升至50ml时,菌体干重呈上升趋势,当装液量从50ml上升至60ml时,菌体干重呈下降趋势,当装液量为20ml时,菌体干重最低,为0.042g,当装液量为50ml时,菌体干重最高,为0.143g。当装液量从20ml上升至60ml时,色价一直呈上升趋势,当装液量为20ml时,色价最低,为2.015,当装液量为60ml时,色价最高,为3.418μ/g。综合分析,应去除20ml装液量,设定装液量可行性范围为30ml-60ml。
53.试验
⑤
时间:取150ml三角瓶,装入50ml种子液,ph自然,按2%接种量接入孢子悬浮液,置于28℃摇床中,分别于180r/min摇瓶培养4、5、6、7、8天。测其色价和菌体干重。
54.不同的发酵时间同样是菌体生长繁殖的重要因素之一,根据红曲生理学特性,选择红曲菌发酵常用时间范围,测定不同发酵时间下种子液菌体干重和色价,找出发酵时间可行性范围,其结果如图5所示。
55.由图5可知,无论是从菌体干重还是色价来看,随着发酵时间的延长,整体呈现上升趋势。当发酵时间为4天时,菌体干重最低,为0.040g,当发酵时间为8天时,菌体干重最高,为0.133μ/g。当发酵天数为4天时,色剂最低,为2.181μ/g,当发酵天数为8天时,色价最高,为3.323μ/g。综合分析,应去掉4天发酵时间,设定发酵时间可行性范围为5-8天。
56.正交试验
57.根据单因素试验结果,选取因素及水平,设计以温度、接种量、初始ph、装液量及时间为因素,分别以菌体干重和色价为评分指标的五因素四水平正交试验。因素水平如表1所示,利用spssau科学分析平台系统分析正交试验结果,筛选最优种子液培养方案。
58.表1正交试验因素水平表
[0059][0060][0061]
根据种子液扩大培养条件单因素试验所确定的可行性范围,制定如表1所示的正交试验因素水平表,其正交试验结果如表2所示。利用spssau系统进行极差分析,其菌体干重和色价的极差分析表分别如表3、表4所示。
[0062]
表2正交试验结果表
[0063][0064]
表3菌体干重极差分析表
[0065][0066][0067]
备注:
“‑”
表示没有该水平数据
[0068]
表3中k值为某因素某水平时试验数据求和,k avg值为对应的平均值,最佳水平指某因子时最佳k avg值对应的水平编号,结合表3和图6,可直观得出,当温度为28℃时,因子1的k avg最大,为0.14。接种量为4%时,因子2k avg最大,为0.12。当初始ph为5时,因子3k avg最大,为0.1225(≈0.12)。当装液量为50ml时,因子4k avg最大,为0.12。当发酵时间为8天时,因子4kavg最大,为0.12。因此可确定以菌体干重为评价指标时其最佳水平为温度28℃、接种量4%、初始ph为5、装液量50ml、发酵时间8天。r指因素的极差值,该值=某因素时,k avg最大值减去k avg最小值,可结合因素极差值对比各因素的优劣,由表3可知,r的大小排列为因子1》因子3》因子2》因子4》因子5,即以菌体干重为评价指标时,影响种子液生长的因素大小为温度>初始ph>接种量>装液量>发酵时间。
[0069]
表4色价极差分析表
[0070][0071]
如表4和图7所示,当温度为28℃时,因子1的k avg最大,为2.68。接种量为2%时,因子2k avg最大,为2.65。当初始ph为5时,因子3k avg最大,为2.63。当装液量为50ml时,因子4k avg最大,为2.63。当发酵时间为8天时,因子4k avg最大,为2.63。因此可确定以色价为评价指标时其最佳水平为温度28℃、接种量2%、初始ph为5、装液量50ml、发酵时间8天。由表4可知,r的大小排列为因子2》因子5》因子1》因子4》因子3,即以色价为评价指标时,影响种子液生长的因素大小为接种量>发酵时间>温度>装液量>初始ph。分别以色价和菌体干重为评价指标所得最佳条件水平基本一致,但以菌体干重为评价指标时,最佳接种量为4%,而以色价为评价指标时,最佳接种量为2%,因此,保持发酵温度28℃、初始ph值5、装液量50ml、发酵时间8天不变,分别以接种量2%和4%做验证试验,当接种量为2%时,菌体
干重为0.25,色价为3.61,当接种量为4%时,菌体干重为0.31,色价为3.88,因此,确定的最优种子液培养条件为温度28℃、接种量4%、初始ph值5、装液量50ml、发酵时间8天。
[0072]
步骤四、固态发酵培养:准确称取10g夏秋茶毛茶于240ml组培瓶中,按适当含水量加入3%蔗糖水,100℃灭菌,接入种子液,置于恒温培养箱中培养,测其色价。
[0073]
固态发酵培养,以含水量、发酵温度、接种量和培养时间为单因素,以色价为指标分析各因素对固态发酵的影响,在单因素试验的基础上,通过box-benhnken的中心组合试验设计原理,以红曲发酵夏秋茶色价为响应面值,对发酵条件进行优化。
[0074]
单因素试验
[0075]
试验
①
含水量:准确称取10g夏秋茶毛茶于240ml组培瓶中,分别按10%、20%、30%、40%、50%含水量加入3%蔗糖水,100℃灭菌,按30%(g/ml)接种量接入种子液,置于28℃恒温培养箱中培养9天,测其色价。
[0076]
水是微生物生长所需的六大营养物质之一,适当的水分含量是固态发酵必不可少的,选择常用固态发酵含水量范围,通过测定色价来评价固态发酵程度,确定响应面试验的水平,其结果如图8所示。随着含水量的增加,色价在增加,尤其是当含水量从30%升至40%时,色价急剧上升,当含水量为10%时,色价最低,为14.93μ/g,当含水量为50%时,色价最高,为21.20μ/g。当含水量为10%和20%时色价均较低,确定响应面试验的水分含量水平为30%、40%、50%。
[0077]
试验
②
温度:准确称取10g夏秋茶毛茶于240ml组培瓶中,按30%含水量加入3%蔗糖水,100℃灭菌,按30%(g/ml)接种量接入种子液,分别置于20℃、24℃、28℃、32℃、36℃恒温培养箱中培养9天,测其色价。
[0078]
无论是黑茶渥堆发酵还是红茶发酵,温度都是至关重要的。如图9所示,发酵温度为20℃时,色价最低,为2.11μ/g,发酵温度为36℃时,色价也很低,为9,99μ/g,发酵温度为28℃时,色价最高,为21.8μ/g。因此,应去除发酵温度20℃和36℃,确定响应面试验的固态发酵温度为24℃、28℃、32℃。
[0079]
③
接种量:准确称取10g夏秋茶毛茶于240ml组培瓶中,按30%含水量加入3%蔗糖水,100℃灭菌,分别按10%、20%、30%、40%、50%(g/ml)接种量接入种子液,置于28℃恒温培养箱中培养9天,测其色价。
[0080]
同种子液摇瓶发酵一样,接种量也是影响固态发酵的重要因素之一。如图10所示,当接种量为10%和20%时,色价相差不大,但接种量为10%时色价略高于20%,接种量为30%时,色价最高,为20.77μ/g。接种量为40%和50%时,色价相差不大,但接种量为50%时色价略高于40%。因此,确定响应面试验的接种量水平为10%、30%、50%。
[0081]
④
时间:准确称取10g夏秋茶毛茶于240ml组培瓶中,按30%含水量加入3%蔗糖水,100℃灭菌,按30%(g/ml)接种量接入种子液,置于28℃恒温培养箱中分别培养5、7、9、11、13天,测其色价。
[0082]
固态发酵有其最适的发酵周期,周期过长和周期过短都会降低发酵品质。如图11所示,发酵时间在7d时,色价最高,为22.93μ/g,当发酵时间延长至9d时,色价略微下降,但当发酵时间继续延长至11d及13d时,色价急剧下降,并低于发酵时间为5d时的色价。因此,应去除11d和13d的发酵时间,确定响应面试验的固态发酵时间为5d、7d、9d。
[0083]
响应面优化试验
[0084]
在单因素试验基础上,以时间、接种量、温度和含水量为自变量,每个因素设计三个水平,以色价为响应指标(y),用design-expert 10软件box-benhnken法进行试验设计,确定固态发酵最优条件,每个处理进行3次重复,试验因素水平见表5。
[0085]
表5响应面试验因素和水平
[0086][0087]
试验设计及结果见表6。
[0088]
表6响应面试验设计及结果
[0089]
[0090][0091]
根据表6的试验结果,对结果进行回归拟合,得到如下回归方程:色价=23.50-0.18a 1.52b 0.54c 1.10d 0.17ab-0.57ac 0.13ad-0.49bc 0.82bd 2.39cd-3.11a2-3.82b2-2.15c2-3.81d2。如表7所示,该模型p《0.0001,说明模型是极显著的。模型相关系数r2=0.9794,表明模型拟合较好。模型失拟项的p值为0.1102,差异不显著,表明该模型符合实际情况。由回归方程系数显著性检验可知:
[0092]
表7回归模型方差分析
[0093][0094]
[0095]
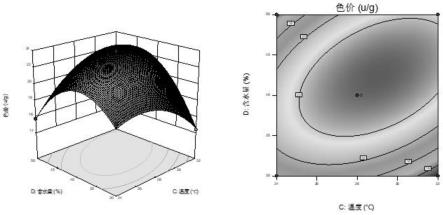
通过design-expert10.0软件绘制色价响应面图,详见图12~图17,并对试验结果进行可视化分析。
[0096]
从响应面三维图可以看出,色价方程的抛物线图形开口向下,说明这个方程存在最大值。由软件分析红曲最优固态发酵条件为时间7.163d、接种量34.230%、温度28.889℃、含水量42.383%,红曲的色价为23.809u/g。
[0097]
为验证响应面法所得结果的可靠性,按照响应面确定的各因素进行固态发酵,发酵完成后,经测定红曲色价为23.791u/g,模型预测值相近。
[0098]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。