1.本发明涉及医药日化领域,具体的说,本发明涉及一种透明质酸脂质体组装体及其制备方法和应用。
背景技术:
2.透皮给药系统(transdermal drug delivery system,tdds),是指在皮肤表面给药,药物以一定速度透过皮肤各层,由毛细血管进入人体全身血液循环而达到有效血药浓度,实现全身或局部治疗作用的新型制剂。相比于口服、静脉注射等方式,透皮给药具有避免和胃肠的首过效应、降低血药浓度的波动、避免药物对肠胃道的刺激、给药无创伤、适应性强以及高效便捷等优点。然而皮肤对大部分药物是一道难以通透的屏障,许多药物难以渗透进入皮肤或是渗透量难以达到治疗水平,因而通过适当的方法促进药物的经皮渗透成为tdds的关键。目前,实现药物高效渗透的方法主要分为添加天然或化学合成的渗透剂的化学方法,以及利用声、光、力、电、热等物理技术或者微针皮下针等减少皮肤对药物吸收的阻碍的物理方法。然而,化学方法的药物渗透效率极易受渗透剂影响,且高效的渗透剂往往刺激性和副作用较大,对皮肤存在一定的刺激和致敏性。物理方法成本和技术要求较高,极易引发皮肤疼痛、轻度流血、伤口化脓并出现面部烧灼热感等现象的出现。因此,一种安全高效的新型透皮制剂成为近年来研究的主要方向。
3.脂质体是由磷脂和其他两亲性物质分散于水中,由一层或多层同心的脂质双分子膜包封而成的封闭囊泡,由于其具备优异的药物包载能力、亲肤性好、皮肤渗透性佳、可延长药物释放以及生物安全性良好等优势,在静脉、皮肤、肺部和口服给药等方面应用广泛。然而,针对皮肤紧致的“砖墙”结构,如何进一步提升脂质体对皮肤的药物渗透能力,实现药物治疗效果的最大化,已经成为脂质体透皮给药制剂的一个关键问题。
4.透明质酸,又称玻尿酸,是一种d-葡萄糖醛酸及n-乙酰葡糖胺组成的双糖单位糖胺聚糖。由于其具备良好的生物相容性、非免疫原性、生物降解性和粘弹性等特点,在抗菌消炎、伤口修复愈合、关节润滑、骨骼填充、药物缓释以及组织工程等生物医学方面应用广泛。
5.由于人体皮肤含有氧化物或透明质酸酶,不同分子量的透明质酸在皮肤的渗透能力和驻留时长有着巨大的差异,从而导致不同分子量的透明质酸的锁水保湿性能差异明显。然而,目前市场上关于透明质酸的透皮技术,多认为大分子量的透明质酸只能在皮肤外层形成保护膜,无法实现皮肤的有效渗透,且相关研究也未曾有所报道。因此,如何实现大分子量(100w-300w分子量)的透明质酸对皮肤的高效渗透与长久驻留,成为提升透明质酸改善皮肤性能,改变市场认知的关键。
技术实现要素:
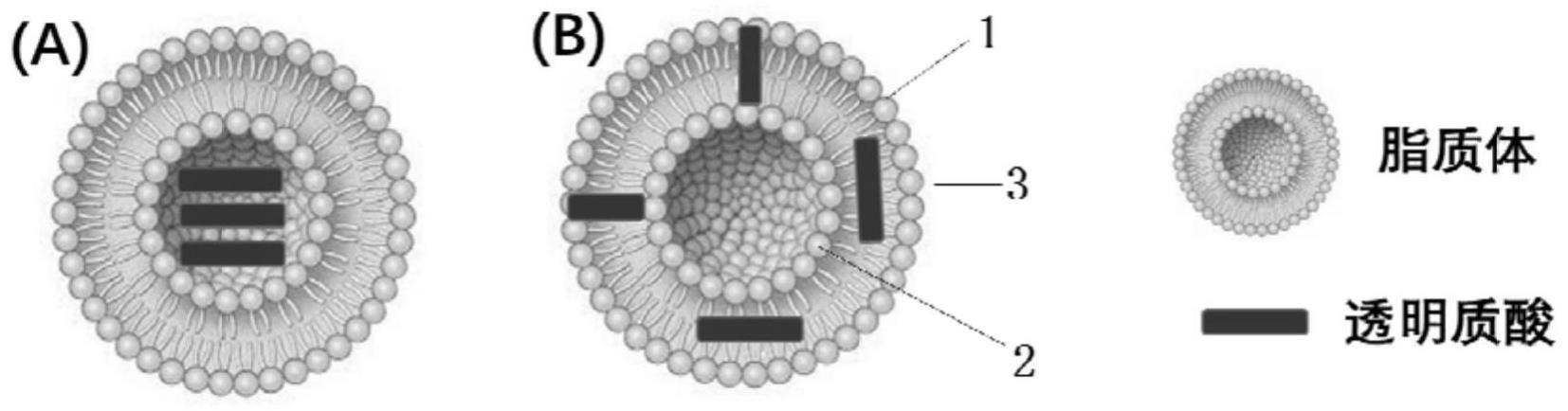
6.现有透明质酸脂质体组装体基本都是透明质酸被包裹着脂质体中,形成如图1的a图的结构。我们通过特殊工艺实现了透明质酸直接参与脂质体骨架的形成,形成图1的b图
的结构。新的结构,对透明质酸的透皮效果、特别是大分子量透明质酸的透皮效果至关重要。因此,本发明针对不同分子量透明质酸、特别是大分子量透明质酸的透皮应用及其剂型的制备进行保护与探索。
7.本发明的一个目的在于提供一种透明质酸脂质体组装体;
8.本发明的另一目的在于提供所述透明质酸脂质体组装体的制备方法;
9.本发明的再一目的在于提供所述透明质酸脂质体组装体的应用。
10.为达上述目的,一方面,本发明提供了一种透明质酸脂质体组装体,其中,所述透明质酸脂质体组装体含有质量比为1:(20-150)的透明质酸和脂质体;所述透明质酸位于脂质体双分子层中以形成透明质酸骨架结构的脂质体双分子层;所述脂质体质量以其中的磷脂质量计。
11.本发明所述透明质酸脂质体组装体是由脂质体和透明质酸通过一定的组装方式,从而使透明质酸参与双分子结构的脂质体构建(透明质酸与脂质体共同构成双分子层结构),进一步形成了一个新型稳定的双分子层骨架结构即透明质酸-脂质体组装体(ha-liposome,结构如图1所示)。
12.本发明构建了一系列不同分子量的透明质酸-脂质体(ha-liposome)组装体,通过调控透明质酸-脂质体中不同组分比例以及脂质体组装条件,从而制备一系列不同分子量的ha-liposome,并对其进行体外透皮实验的研究,探究该ha-liposome组装体透皮性能,评估该ha-liposome组装体对不同分子量ha的透皮性能改变,为全面研究透明质酸透皮给药制剂的渗透能力提供一个新的方向,进一步得到一种可实现皮肤高效渗透的新型材料。
13.与已公开的ha-脂质体的复合体系不同,本发明构建了一类具有创新结构的ha-liposome组装体,ha作为骨架分子参与脂质体本身的形成、而不是被脂质体包裹于中心的空腔中。
14.其中可以理解的是,本发明所述的“所述脂质体质量以其中的磷脂质量计”,是指透明质酸和脂质体中的磷脂质量比为1:(20-150)。
15.根据本发明一些具体实施方案,其中,所述透明质酸脂质体组装体含有质量比为1:(40-100)的透明质酸和脂质体。
16.根据本发明一些具体实施方案,其中,所述透明质酸的分子量为3000-150w。
17.根据本发明一些具体实施方案,其中,所述透明质酸选自如下分子量范围的透明质酸中的至少一种或多种的组合:分子量为3000的透明质酸、分子量为15w-25w的透明质酸、分子量为40w-100w的透明质酸和分子量为100w-150w的透明质酸。
18.根据本发明一些具体实施方案,其中,所述脂质体由质量比为1:(5-30)的胆固醇和磷脂组成。
19.根据本发明一些具体实施方案,其中,所述磷脂为大豆卵磷脂、二油酰基卵磷脂和蛋黄卵磷脂中的一种或多种的组合。
20.根据本发明一些具体实施方案,其中,所述脂质体由质量比为1:(10-25)的胆固醇和磷脂组成。
21.另一方面,本发明还提供了本发明所述的透明质酸脂质体组装体的制备方法,其中,所述方法包括如下步骤:
22.配制脂质体溶液的步骤;
23.配制透明质酸溶液的步骤;
24.搅拌条件下将透明质酸溶液加入脂质体溶液中形成所述透明质酸脂质体组装体的步骤。
25.根据本发明一些具体实施方案,其中,配制脂质体溶液的步骤包括将脂质体溶解在溶剂中并稳定后得到所述脂质体溶液。
26.根据本发明一些具体实施方案,其中,配制脂质体溶液的步骤包括在23-32℃下将脂质体溶解在溶剂中并稳定后得到所述脂质体溶液。
27.根据本发明一些具体实施方案,其中,配制脂质体溶液的步骤包括在25-30℃下将脂质体溶解在溶剂中并稳定后得到所述脂质体溶液。
28.根据本发明一些具体实施方案,其中,用于溶解脂质体的溶剂为乙醇、乙醚或氯仿。
29.根据本发明一些具体实施方案,其中,以脂质体中的磷脂计,用于溶解脂质体的溶剂用量为每10ml溶剂溶解0.1-0.8g磷脂。
30.根据本发明一些具体实施方案,其中,以脂质体中的磷脂计,用于溶解脂质体的溶剂用量为每10ml溶剂溶解0.1-0.5g磷脂。
31.根据本发明一些具体实施方案,其中,以脂质体中的磷脂计,用于溶解脂质体的溶剂用量为每10ml溶剂溶解0.1-0.4g磷脂。
32.根据本发明一些具体实施方案,其中,将脂质体溶解在溶剂后稳定1.5-10h得到所述脂质体溶液。
33.根据本发明一些具体实施方案,其中,将脂质体溶解在溶剂后稳定2-6h得到所述脂质体溶液。
34.根据本发明一些具体实施方案,其中,将脂质体溶解在溶剂后稳定2-5h得到所述脂质体溶液。
35.根据本发明一些具体实施方案,其中,配制透明质酸溶液的步骤包括将透明质酸溶解在缓冲溶液或水中,溶解均匀得到所述透明质酸溶液。
36.根据本发明一些具体实施方案,其中,配制透明质酸溶液的步骤包括在23-32℃下将透明质酸溶解在缓冲溶液中并稳定后,溶解均匀得到所述透明质酸溶液。
37.根据本发明一些具体实施方案,其中,配制透明质酸溶液的步骤包括在25-30℃下将透明质酸溶解在缓冲溶液中并稳定后,溶解均匀得到所述透明质酸溶液。
38.根据本发明一些具体实施方案,其中,配制透明质酸溶液的步骤包括将透明质酸溶解在缓冲溶液或水中后,利用振荡器或均质机进行处理以溶解均匀得到所述透明质酸溶液。
39.根据本发明一些具体实施方案,其中,所述振荡器温度设定为20-30℃,振荡时间为5-15min。
40.根据本发明一些具体实施方案,其中,所述缓冲溶液为浓度为1mg/ml~10mg/ml的磷酸盐缓冲溶液。
41.根据本发明一些具体实施方案,其中,以透明质酸计,缓冲溶液用量为每10ml缓冲溶液溶解10-100mg透明质酸。
42.根据本发明一些具体实施方案,其中,以透明质酸计,缓冲溶液用量为每10ml缓冲
溶液溶解13-60mg透明质酸。
43.根据本发明一些具体实施方案,其中,以透明质酸计,缓冲溶液用量为每10ml缓冲溶液溶解15-50mg透明质酸。
44.根据本发明一些具体实施方案,其中,将透明质酸溶解在缓冲溶液中溶解均匀后先稳定2-10h,再得到所述透明质酸溶液。
45.根据本发明一些具体实施方案,其中,配制透明质酸溶液的步骤中的稳定的时间为3-7h。
46.根据本发明一些具体实施方案,其中,配制透明质酸溶液的步骤中的稳定的时间为3-6h。
47.根据本发明一些具体实施方案,其中,搅拌条件下将透明质酸溶液加入脂质体溶液中是以磁力加热搅拌器进行搅拌。
48.根据本发明一些具体实施方案,其中,搅拌条件下将透明质酸溶液加入脂质体溶液中形成所述透明质酸脂质体组装体的步骤中所述的搅拌条件包括搅拌速度为1000-5000rpm。
49.根据本发明一些具体实施方案,其中,上述搅拌速度为1000-2000rpm。
50.根据本发明一些具体实施方案,其中,将脂质体溶液和透明质酸溶液混合形成所述透明质酸脂质体组装体的步骤包括在20-40℃下将透明质酸溶液加入脂质体溶液中,混合均匀形成稳定溶液后,除掉用于配制脂质体溶液的溶剂,加入缓冲溶液并混合均匀得到所述透明质酸脂质体组装体。
51.根据本发明一些具体实施方案,其中,将脂质体溶液和透明质酸溶液混合形成所述透明质酸脂质体组装体的步骤包括在25-35℃下将透明质酸溶液加入脂质体溶液中。
52.根据本发明一些具体实施方案,其中,将脂质体溶液和透明质酸溶液混合形成所述透明质酸脂质体组装体的步骤包括在25-30℃下将透明质酸溶液加入脂质体溶液中。
53.根据本发明一些具体实施方案,其中,搅拌条件下将透明质酸溶液加入脂质体溶液中形成所述透明质酸脂质体组装体的步骤包括将透明质酸溶液以速度1-25ml/min加入脂质体溶液中,混合均匀形成稳定溶液后,除掉用于配制脂质体溶液的溶剂,加入缓冲溶液或水并混合均匀得到所述透明质酸脂质体组装体。
54.根据本发明一些具体实施方案,其中,搅拌条件下将透明质酸溶液加入脂质体溶液中形成所述透明质酸脂质体组装体的步骤包括将透明质酸溶液以速度5-25ml/min加入脂质体溶液中。
55.其中,加入缓冲溶液或水并混合均匀可以采用搅拌、振荡或超声的方式以混合均匀。
56.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,搅拌条件下将透明质酸溶液加入脂质体溶液中的搅拌条件包括:搅拌时间为5-30min。
57.根据本发明一些具体实施方案,其中,所述搅拌条件包括:搅拌时间5-20min。
58.可以理解的是,这里所述的搅拌时间,是从加入透明质酸溶液开始,至混合均匀形成稳定溶液停止搅拌为止。
59.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,在将透明质酸溶液加入脂质体溶液后,继续在原转速下搅拌以形成稳定溶液。
60.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,在将透明质酸溶液加入脂质体溶液后,是在30-50℃下搅拌形成稳定溶液。
61.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,在将透明质酸溶液加入脂质体溶液后,是在35-45℃下搅拌形成稳定溶液。
62.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,在将透明质酸溶液加入脂质体溶液后,是利用高剪切分散乳化机混合均匀形成稳定溶液。
63.根据本发明一些具体实施方案,其中,所述除掉用于配制脂质体溶液的溶剂是利用旋转蒸发的方式除掉用于配制脂质体溶液的溶剂。
64.根据本发明一些具体实施方案,其中,所述旋转蒸发中所使用的蒸发仪蒸发瓶转速为80-120rpm、温度为40-70℃。
65.根据本发明一些具体实施方案,其中,所述旋转蒸发中所使用的蒸发仪蒸发瓶转速为80-100rpm、温度为45-60℃。
66.根据本发明一些具体实施方案,其中,所述旋转蒸发中所使用的蒸发仪蒸发瓶的真空度为70
ꢀ‑
100kpa。
67.根据本发明一些具体实施方案,其中,所述旋转蒸发中所使用的蒸发仪蒸发瓶的真空度为80-95kpa。
68.所述的温度可以是所述稳定溶液的温度,也可以是旋转蒸发的水浴温度(在旋转蒸发一定时间后,容器内的稳定溶液的温度应当和水浴温度大致相同)。
69.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,还包括在除掉用于配制脂质体溶液的溶剂后,加入缓冲液或水并混合均匀,然后过800nm滤膜形成透明质酸脂质体初级组装体,再加入缓冲液或水,形成稳定状态后,过450nm滤膜,从过800nm滤膜开始重复0-2次,得到所述透明质酸脂质体组装体。
70.根据本发明一些具体实施方案,其中,所述滤膜选自聚碳酸酯滤膜、聚四氟乙烯滤膜、聚丙烯滤膜或聚偏氟乙烯滤膜。
71.可以理解的是,上面所述的重复0-2次,是指重复“过800nm滤膜形成透明质酸脂质体初级组装体,再加入缓冲液或水,形成稳定状态后,过450nm滤膜”这个过程;其中优选重复1-2次。
72.还可以理解的是,在过最后一次450nm滤膜前所得到的产物被称为透明质酸脂质体初级组装体,在过最后一次450nm滤膜后得到的为所述的透明质酸脂质体组装体。
73.根据本发明一些具体实施方案,其中,在形成所述透明质酸脂质体组装体的步骤中,每次加入的缓冲液或水的用量各自分别独立为:以磷脂质量计,每0.1g磷脂加入8-12ml缓冲液或水。
74.根据本发明一些具体实施方案,其中,在形成所述透明质酸脂质体组装体的步骤中,每次加入的缓冲液或水的用量各自分别独立为:以磷脂质量计,每0.1g磷脂加入10ml缓冲液或水。
75.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,在过最后一次450nm滤膜前得到的溶液中初级透明质酸脂质体的质量百分比含量为45%~65%;在过450nm滤膜后得到的溶液中透明质酸脂质体组装体的质量百分比含量为25%~35%。
76.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,过800nm聚碳酸酯膜形成透明质酸脂质体初级组装体,再加入缓冲液或水,形成稳定状态是在转速10000-20000下搅拌5-30min形成稳定状态。
77.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,所述形成稳定状态是在转速10000-15000下搅拌10-25min形成稳定状态。
78.根据本发明一些具体实施方案,其中,形成所述透明质酸脂质体组装体的步骤中,所述形成稳定状态是利用高剪切分散乳化机混合均匀形成稳定状态。
79.根据本发明一些具体实施方案,其中,所述缓冲液分别各自独立的为浓度为1mg/ml~10mg/ml磷酸盐缓冲溶液。
80.再一方面,本发明还提供了一种本发明所述的制备方法制备得到的透明质酸脂质体组装体。
81.又一方面,本发明还提供了本发明任意所述的透明质酸脂质体组装体在制备透皮吸收产品中的应用。
82.根据本发明一些具体实施方案,其中,所述透皮吸收产品为透皮吸收药物或透皮吸收护肤品。
83.综上所述,本发明提供了一种透明质酸脂质体组装体及其制备方法和应用。本发明的透明质酸脂质体组装体具有如下优点:
84.(1)相较于传统的脂质体而言,本发明中使用不同分子量的透明质酸参与脂质体的构建,从而形成一个稳定的透明质酸-脂质体(ha-liposome)组装体,在透明质酸对皮肤保湿和促渗双重作用下,进一步与脂质体相互协同,从而实现ha-liposome对皮肤的高效渗透的效果;
85.(2)ha作为骨架分子参与脂质体组装体结构的形成、而不是被脂质体包裹于其中;该结构有利于ha随脂质体发生适应性形变、从而有利于透皮;
86.(3)透明质酸和脂质体均可以直接通过细胞通路或间隙直接进入到皮肤内部,同时可让皮肤角质层细胞间隙变得肿胀、蓬松,从而实现小分子药物的促吸收作用;因此,将透明质酸和脂质体联用,有望实现针对透皮的协同增效目的;
87.(4)打破原有的市场认知,本发明构建的四种不同分子量的透明质酸-脂质体组装体中,可高效透过大分子量透明质酸,且大分子量的透明质酸对皮肤的保湿修护效果最佳,代谢降解时间长;
88.(5)本发明使用不同分子量的透明质酸参与脂质体的构建,制备了一系列具有皮肤的高效渗透的效果的透明质酸-脂质体组装体,该组装体可作为透皮给药递送载体,可实现多种类型药物的有效负载和皮肤的高效渗透目的;
89.(6)所选用组分均为被国家食药监局批准可用于药用辅料的材料,生物安全性好;
90.(7)该透明质酸-脂质体组装体不仅可实现透明质酸自身的高效透皮,也可负载其它活性小分子,实现对所负载活性成分的高效透皮。
附图说明
91.图1为现有透明质酸脂质体组装体和本发明的透明质酸脂质体组装体的结构示意图;
92.图2a和图2b为实施例1的不同分子量透明质酸-脂质体粒径分布;
93.图3a和图3b分别为实施例3和实施例4的不同分子量透明质酸-脂质体荧光形貌;
94.图4a和图4b分别为实施例3和实施例4的不同分子量透明质酸-脂质体对小鼠皮肤渗透效果;
95.图5为不同分子量透明质酸-脂质体体外透皮实验后皮肤荧光切片;
96.图6为不同分子量透明质酸-脂质体细胞毒性。
具体实施方式
97.以下通过具体实施例详细说明本发明的实施过程和产生的有益效果,旨在帮助阅读者更好地理解本发明的实质和特点,不作为对本案可实施范围的限定。
98.实施例1
99.a、25℃条件下,将一定比例下的大豆卵磷脂和胆固醇溶解于一定量的乙醇中,利用磁力加热搅拌器搅拌溶解(也可适当使用低速均质机溶解),待其充分溶解后稳定2h,即得醇脂质体悬浮液;所述胆固醇与大豆卵磷脂的质量比为1:10;所述乙醇以每10ml加入0.1g大豆卵磷脂计;所述大豆卵磷脂纯度≥90%;所述胆固醇纯度为95%;所述乙醇为工业级,99%;所述磁力加热搅拌器温度为35℃,转速为1500rpm,搅拌时间为20min;
100.b、25℃条件下,将一系列不同分子量的透明质酸(各自用量分别为25mg)分别溶解于一定量的磷酸盐缓冲液中,利用涡旋振荡器使其充分溶解后稳定3h(也可适当使用低速均质机进行溶解);所述一系列不同分子量的透明质酸的分子量分布分别为3000(型号j44455)、15~25万(型号j44456)、40-100万(型号j36310)、100-150万(型号j31234);所述磷酸盐缓冲液以每10ml加入15mg的不同分子量的透明质酸计;所述涡旋振荡器温度为25℃,转速为1000rpm;所述磷酸盐缓冲液ph为7.4;
101.c、25℃条件下,利用磁力加热搅拌器将步骤a所得的醇脂质体悬浮液进行搅拌,将步骤b所得的透明质酸缓冲溶液以5ml/min的速度缓慢加入步骤a所得的醇脂质体悬浮液中,利用高剪切分散乳化机搅拌溶解直至其形成稳定乳液。使用旋转蒸发仪在一定温度和压力下去除乳液中的乙醇,降低温度至室温下,加入一定量的磷酸盐缓冲液均质搅拌均匀,然后将得到的透明质酸脂质体组装体通过800nm聚碳酸酯膜,形成透明质酸脂质体初级组装体。将上述初级组装体缓慢加入至一定量的磷酸盐缓冲液中,使用高剪切分散乳化机搅拌至稳定状态,然后将得到的透明质酸脂质体组装体通过450nm聚碳酸酯膜,依次重复2次,最终得到稳定的最终透明质酸脂质体组装体。所述步骤b中不同分子量的透明质酸与步骤a中大豆卵磷脂的质量比为1:40;所述磁力加热搅拌器温度为45℃,转速为1000rpm,搅拌时间为20min;所述磷酸盐缓冲液ph为7.4,同时可用纯水代替;所述磷酸盐缓冲液与步骤b述磷酸盐缓冲液体积比为1:1.5;所述高剪切分散乳化机功率为300w,转速为10000rpm,每次时间为25min;所述旋转蒸发仪蒸发瓶转速为100rpm、真空度在80kpa、恒温水浴锅温度为60℃;所述初级组装体中透明质酸脂质体组装体中的质量百分比为65%;所述最终组装体中透明质酸脂质体组装体的质量百分比为45%。
102.实施例2
103.a、30℃条件下,将一定比例下的大豆卵磷脂和胆固醇溶解于一定量的乙醇中,利用磁力加热搅拌器搅拌溶解(也可适当使用低速均质机溶解),待其充分溶解后稳定6h,即
得醇脂质体悬浮液;所述胆固醇与大豆卵磷脂的质量比为1:25;所述乙醇以每10ml加入0.1g大豆卵磷脂计;所述大豆卵磷脂纯度≥90%;所述胆固醇纯度为95%;所述乙醇为工业级,99%;所述磁力加热搅拌器温度为45℃,转速为1000rpm,搅拌时间为10min;
104.b、30℃条件下,将一系列不同分子量的透明质酸(各自用量分别为25mg)分别溶解于一定量的磷酸盐缓冲液中,利用涡旋振荡器使其充分溶解后稳定3h(也可适当使用低速均质机进行溶解);所述一系列不同分子量的透明质酸的分子量分布分别为3000(型号j44455)、15~25万(型号j44456)、40-100万(型号j36310)、100-150万(型号j31234);所述磷酸盐缓冲液以每10ml加入50mg的不同分子量的透明质酸计;所述涡旋振荡器温度为35℃,每次振荡时间为5min;转速为1000rpm;所述磷酸盐缓冲液ph为7.4;
105.c、30℃条件下,利用磁力加热搅拌器将步骤a所得的醇脂质体悬浮液进行搅拌,将步骤b所得的透明质酸缓冲溶液以25ml/min的速度缓慢加入步骤a所得的醇脂质体悬浮液中,利用高剪切分散乳化机搅拌溶解直至其形成稳定乳液。使用旋转蒸发仪去除乳液中的乙醇,降低温度至室温下,加入一定量的磷酸盐缓冲液均质搅拌均匀,然后将得到的透明质酸脂质体组装体通过800nm聚碳酸酯膜,形成透明质酸脂质体初级组装体。将上述初级组装体缓慢加入至一定量的磷酸盐缓冲液中,使用高剪切分散乳化机搅拌至稳定状态,然后将得到的透明质酸脂质体组装体通过450nm聚碳酸酯膜,依次重复3次,最终得到稳定的最终透明质酸脂质体组装体。所述步骤b中不同分子量的透明质酸与步骤a中大豆卵磷脂的质量比为1:100;所述磁力加热搅拌器温度为35℃,转速为2000rpm,搅拌时间为5min;所述磷酸盐缓冲液ph为7.4,同时可用纯水代替;所述磷酸盐缓冲液与步骤b述磷酸盐缓冲液体积比为1:4;所述高剪切分散乳化机功率为500w,转速为15000rpm,每次时间为10min;所述旋转蒸发仪蒸发瓶转速为80rpm、真空度在95kpa、恒温水浴锅温度为45℃;所述初级组装体中透明质酸脂质体组装体中的质量百分比为65%;所述最终组装体中透明质酸脂质体组装体的质量百分比为45%。
106.实施例3
107.为了直观的观察并精确测定实施例1和实施例2所得的透明质酸-脂质体的组装过程以及透明质酸的含量,我们使用5-胺基荧光素对实施例1和实施例2中不同分子量的透明质酸进行最大饱和量的荧光标记。具体实验步骤如实施例3和实施例4所示:
108.a、25℃条件下,将一定比例下的大豆卵磷脂和胆固醇溶解于一定量的乙醇中,利用磁力加热搅拌器搅拌溶解(也可适当使用低速均质机进行溶解),待其充分溶解后稳定2h,即得醇脂质体悬浮液;所述胆固醇与大豆卵磷脂的质量比为1:10;所述乙醇以每10ml加入0.1g大豆卵磷脂计;所述大豆卵磷脂纯度≥90%;所述胆固醇纯度为95%;所述乙醇为工业级,99%;所述磁力加热搅拌器温度为35℃,转速为1500rpm,搅拌时间为20min;
109.b、25℃条件下,在不同分子量的透明质酸的水溶液中,分别加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc-hcl)和n-羟基丁二酰亚胺(nhs),利用磁力加热搅拌器避光搅拌反应4h后,加入5-胺基荧光素,继续反应24h后,使用1000da透析袋透析至无荧光素后,冷冻干燥。所述透明质酸、edc-hcl、nhs和5-胺基荧光素的摩尔比为1:1:1.2:1.5;所述纯水以每10ml加入10mg的不同分子量的透明质酸计;所述磁力加热搅拌器温度为25℃,转速为1000rpm;所述使用透析袋透析至无荧光素的判断标准即使用紫外可见光分光光度计测定透析液在486nm处吸光度低于0.06时,即可判定透析液中已无荧光素析出。
110.c、25℃条件下,将上述步骤b得到的5-胺基荧光素标记的不同分子量的透明质酸(各自用量分别为25g)利用磁力加热搅拌器分别溶解于一定量的磷酸盐缓冲液中,待其充分溶解并稳定3h;所述一系列不同分子量的透明质酸的分子量分别为3000(型号j44455)、15~25万(型号j44456)、40-100万(型号j36310)、100-150万(型号j31234);所述磷酸盐缓冲液以每10ml加入15mg的5-胺基荧光素标记的不同分子量的透明质酸计;所述磁力加热搅拌器温度为25℃,转速为1000rpm;所述磷酸盐缓冲液ph为7.4;
111.d、25℃条件下,利用磁力加热搅拌器将步骤a所得的醇脂质体悬浮液进行搅拌,将步骤c所得的透明质酸缓冲溶液以5ml/min的速度缓慢加入步骤a所得的醇脂质体悬浮液中,利用高剪切分散乳化机搅拌溶解直至其形成稳定乳液。使用旋转蒸发仪去除乳液中的乙醇,降低温度至室温下,加入一定量的磷酸盐缓冲液均质搅拌均匀,然后将得到的透明质酸脂质体组装体通过800nm聚碳酸酯膜,形成透明质酸脂质体初级组装体。将上述初级组装体缓慢加入至一定量的磷酸盐缓冲液中,使用高剪切分散乳化机搅拌至稳定状态,然后将得到的透明质酸脂质体组装体通过450nm聚碳酸酯膜,依次重复2次,最终得到稳定的最终透明质酸脂质体组装体。所述步骤b得到的5-胺基荧光素标记的不同分子量的透明质酸与步骤a中大豆卵磷脂的质量比为1:40;所述磁力加热搅拌器温度为45℃,转速为1000rpm,搅拌时间为20min;所述磷酸盐缓冲液可用纯水代替;所述高剪切分散乳化机功率为300w,转速为10000rpm,每次时间为25min;所述旋转蒸发仪蒸发瓶转速为100rpm、真空度在80kpa、恒温水浴锅温度为60℃;所述初级组装体中透明质酸脂质体组装体中的质量百分比为65%;所述最终组装体中透明质酸脂质体组装体的质量百分比为45%。
112.实施例4
113.a、30℃条件下,将一定比例下的大豆卵磷脂和胆固醇溶解于一定量的乙醇中,利用磁力加热搅拌器(或均质机)搅拌溶解,待其充分溶解后稳定6h,即得醇脂质体悬浮液;所述胆固醇与大豆卵磷脂的质量比为1:25;所述乙醇以每10ml加入0.1g大豆卵磷脂计;所述大豆卵磷脂纯度≥90%;所述胆固醇纯度为95%;所述乙醇为工业级,99%;所述磁力加热搅拌器温度为45℃,转速为1000rpm,搅拌时间为10min;
114.b、30℃条件下,在不同分子量的透明质酸的水溶液中,分别加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc-hcl)和n-羟基丁二酰亚胺(nhs),利用磁力加热搅拌器避光搅拌反应8h后,加入5-胺基荧光素,继续反应48h后,使用1000da透析袋透析至无荧光素后,冷冻干燥。所述透明质酸、edc-hcl、nhs和5-胺基荧光素的摩尔比为1:1.5:2:2.5;所述纯水以每10ml加入5mg的不同分子量的透明质酸计;所述磁力加热搅拌器温度为35℃,转速为1000rpm;所述使用透析袋透析至无荧光素的判断标准即使用紫外可见光分光光度计测定透析液在486nm处吸光度低于0.06时,即可判定透析液中已无荧光素析出。
115.c、30℃条件下,将上述步骤b得到的5-胺基荧光素标记的不同分子量的透明质酸(各自用量分别为25mg)分别溶解于一定量的磷酸盐缓冲液中,利用涡旋振荡器(或均质机)使其充分溶解后稳定3h;所述5-胺基荧光素标记的不同分子量的透明质酸分子量分布分别为3000(型号j44455)、15~25万(型号j44456)、40-100万(型号j36310)、100-150万(型号j31234);所述磷酸盐缓冲液以每10ml加入50mg 5-胺基荧光素标记的不同分子量的透明质酸计;所述涡旋振荡器温度为35℃,每次振荡时间为5min;转速为1000rpm;所述磷酸盐缓冲液ph为7.4。
116.d、30℃条件下,利用磁力加热搅拌器将步骤a所得的醇脂质体悬浮液进行搅拌,将步骤c所得的5-胺基荧光素标记的不同分子量的透明质酸缓冲溶液以25ml/min的速度缓慢加入步骤a所得的醇脂质体悬浮液中,利用高剪切分散乳化机搅拌溶解直至其形成稳定乳液。使用旋转蒸发仪去除乳液中的乙醇,降低温度至室温下,加入一定量的磷酸盐缓冲液均质搅拌均匀,然后将得到的透明质酸脂质体组装体通过800nm聚碳酸酯膜,形成透明质酸脂质体初级组装体。将上述初级组装体缓慢加入至一定量的磷酸盐缓冲液中,使用高剪切分散乳化机搅拌至稳定状态,然后将得到的透明质酸脂质体组装体通过450nm聚碳酸酯膜,依次重复3次,最终得到稳定的最终透明质酸脂质体组装体。所述步骤b中得到的5-胺基荧光素标记的不同分子量透明质酸与步骤a中大豆卵磷脂的质量比为1:100;所述磁力加热搅拌器温度为35℃,转速为2000rpm,搅拌时间为5min;所述磷酸盐缓冲液ph为7.4,同时可用纯水代替;所述磷酸盐缓冲液与步骤b述磷酸盐缓冲液体积比为1:4;所述高剪切分散乳化机功率为500w,转速为15000rpm,每次时间为10min;所述旋转蒸发仪蒸发瓶转速为80rpm、真空度在95kpa、恒温水浴锅温度为45℃;所述初级组装体中透明质酸脂质体组装体中的质量百分比为65%;所述最终组装体中透明质酸脂质体组装体的质量百分比为45%。
117.实施例5
118.将实施例1得到的一系列不同分子量透明质酸-脂质体稀释至相同浓度后,使用显微镜观察其形貌,并进一步使用马尔文粒度仪测定其粒径大小,实验结果如图2a和图2b所示。通过显微镜可以直观地看到不同分子量透明质酸-脂质体的粒径均一,分散性良好,且通过粒度仪测定其粒度分布在500nm左右。
119.实施例6
120.将实施例3和实施例4得到的5-胺基荧光素标记的不同分子量透明质酸-脂质体组装体进行荧光显微镜观察,实验结果如图3a和图3b所示。随着透明质酸分子量的增加,我们发现荧光标记后的透明质酸均匀的填充在脂质体内部,并且与脂质体形成稳定的圆环结构,特别是对于100-150万的大分子量透明质酸而言,透明质酸-脂质体组装体的圆环结构更加明显。因此,我们认为透明质酸可有效参与脂质体的构建,并可与脂质体组装形成稳定空腔圆环结构。图3a和图3b证明透明质酸是参与到脂质体骨架中,而不是传统的被脂质体包裹(如果是被包裹,应该的绿色(图3a和图3b中显示的为浅灰色)的球形结构、或者圆环的中心有显著的绿色荧光(在图中应显示为浅灰色或白色))。
121.实施例7
122.对实施例3和实施例4得到的5-胺基荧光素标记的不同分子量透明质酸-脂质体组装体采用franz透皮扩散池进行体外皮肤渗透性试验。具体操作如下:小鼠(购于北京华阜康生物科技股份有限公司),戊巴比妥钠(40mg/kg)腹腔注射麻醉后断颈处死,用电剃刀除去小鼠背部的毛发,再用剪刀剪下已去除毛发的完整皮肤。用沾有生理盐水的棉球擦拭皮肤的真皮层,去除粘附的皮下组织,再用生理盐水洗涤皮肤,擦干,用锡箔纸包裹,置于-20℃的冰箱中保存,备用。将准备好的皮肤固定于franz扩散池的供给室与接收室之间,其中皮肤的表层面向供给室,该扩散池的有效渗透面积为1.767cm2。向接收室加入体积为10ml的磷酸盐缓冲液(pbs,ph=7.4),使得液面与皮肤能够紧密接触。实验过程中采用循环水浴加热,使温度保持在37℃,并以150r/min的转速搅拌。
123.用移液枪分别取2ml相同浓度的实施例3得到的5-胺基荧光素标记的不同分子量
透明质酸-脂质体组装体(记录起始通明质酸浓度)加入至扩散池的供给室,然后在相同时间内从取样口抽取相同体积的下层样液,同时向接收室内补充同等体积的pbs,采用荧光分光光度计对样品进行荧光定量分析,并通过计算得知随时间的增加透明质酸-脂质体透过皮肤的累积量(皮肤内部以及穿透皮肤的透明质酸总和)。实验结束后,对皮肤进行石蜡包埋,制成切片,观察皮肤内部中脂质体分布情况。
124.结果如图4a和图4b所示,在1h到3h后不同分子量透明质酸-脂质体组装体对皮肤都有一定的透皮效果,且随着透明质酸分子量的增加,脂质体透过皮肤的效果也在明显增加,皮肤中透明质酸的累积含量也在增加。经计算,实施例3和实施例4得到的100-150w的透明质酸-脂质体组装体对皮肤渗透效果最佳,皮肤中的透明质酸累积含量可达20%左右,3h可达30%左右。因此,我们发现透明质酸-脂质体组装体可有效实现大分子量透明质酸对皮肤的高效渗透。同时,我们使用荧光显微镜观察,皮肤内部透明质酸-脂质体分布情况,实验结果如图5所示。在皮肤的表面、内部以及真皮层以下等皮肤不同结构部位,我们可以直观发现荧光标记后的透明质酸-脂质体存在,且对于100-150w的透明质酸-脂质体组装体可以清楚发现,大量荧光标记的脂质体已完全穿透皮肤真皮层。因此,以上结果充分说明透明质酸-脂质体组装体对皮肤可实现不同分子量的透明质酸的有效渗透,且分子量在100-150w的效果最佳。
125.实施例8
126.将实施例1制备得到的一系列不同分子量透明质酸-脂质体,经过滤灭菌后用培养基配制成一定的浓度梯度(5、10、20、40g/ml)的溶液,加入到融合度达70%的大鼠成纤维细胞(购于广州第一军区医院)中孵育。24h后,采用cck-8法测定材料的细胞毒性,结果如图5所示,在样品浓度到达40g/ml时,细胞的存活率仍然保持在95%以上,且存在一定的促细胞生长现象。与纯透明质酸和纯脂质体组的细胞存活率相比,透明质酸-脂质体的细胞存活率与之接近,不存在显著性差异。图6的结果表明,不同分子量透明质酸-脂质体不会改变透明质酸的良好生物相容性。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。