1.本发明涉及药物化学技术领域,具体涉及一种3-苯并呋喃基硫咪唑并吡啶衍生物及其制备方法和应用。
背景技术:
2.有机硫化物具有广泛应用前景,在有机硫化合物的合成中,有时会引入杂环来增强其生物活性,某些杂环的引入会带来特殊的药效或者生物活性,如下式代表性的双杂环硫醚化合物可作为多种酶的抑制剂。
[0003][0004]
然而,对于本领域技术人员而言,引入哪些杂环、引入到哪些位点、会产生何种活性均无法预期。并且现有的有机硫化物多为免疫制剂,较少在抗肿瘤方面表现出活性。
[0005]
关于有机硫化物的制备方法,近些年,一些课题组报道了含硫双杂环化合物的合成。如yang课题组(advancedsynthesis&catalysis,2019,361,4558-4567)开发了一种碘化亚铜催化的串联反应用于合成新型硫醚化苯并噻唑/咪唑并吡啶的双杂环衍生物,使用了二硫化碳作为合成砌块。dong课题组(j.org.chem.2022,87,2446-2455)报道了碘催化不对称含硫双杂环化合物的合成新方法,使用了tmtd作为硫基来源,在强氧化剂过硫酸铵的促进下和2位羟基、氨基、巯基取代的芳香胺以及吲哚类衍生物反应,以高收率得到了一系列硫化双杂环衍生物。kapdi课题组(chemicalcommunications,2021,57,8202-8205)报道了一种绿色合成不对称双杂环硫醚化合物的反应,使用了咪唑并吡啶化合物和氯代杂环化合物为原料,在dmso/hfip反应体系中实现了该硫化反应。
[0006]
可以看出,上述有机硫化物均为双环结构,且引入硫桥时使用的硫源有异味,且为液体,不容易操作,而且大多使用了金属催化剂、强氧化剂、活化的底物。金属催化剂和强氧化剂的过多使用会导致合成药物过程中残留,从而对人体产生伤害。在环境友好的绿色化学发展理念指导下,在不添加金属强氧化剂条件下开发一条直接且简洁有效的合成策略来构建具有生物活性的有机硫化物对研发具有自主知识产权的药物具有重要意义。
技术实现要素:
[0007]
为此,本发明的一个目的是提供一种3-苯并呋喃基硫咪唑并吡啶衍生物,该类化合物可以作为一类新的抗肿瘤药物的先导化合物。
[0008]
本发明的另一个目的是提供一种上述3-苯并呋喃基硫咪唑并吡啶衍生物的制备方法。
[0009]
本发明的又一个目的是提供一种上述3-苯并呋喃基硫咪唑并吡啶衍生物的用途。
[0010]
本发明的上述目的是采用如下技术方案来实现的。
[0011]
一方面,本发明提供一种3-苯并呋喃基硫咪唑并吡啶衍生物或其药学上可接受的盐,所述衍生物具有如下结构式:
[0012][0013]
其中r1,r2,r3,r4独立地选自氢、烷基、芳基、烷氧基、卤素和卤代c
1-3
的烷基。
[0014]
优选地,r1,r2,r3,r4独立地选自c
1-6
的烷基、芳基、c
1-6
的烷氧基、卤素和三氟甲基。
[0015]
优选地,r1为氢或卤素;
[0016]
优选地,r2为氢或c
1-3
的烷氧基;
[0017]
优选地,r3为氢、卤素或c
1-3
的烷基;
[0018]
优选地,r4为氢、c
1-3
的烷氧基、卤代c
1-3
的烷基或芳基(例如r4与其相邻的苯环形成联苯)。
[0019]
在一个具体实施方案中,r1为氢或卤素;r2为氢或c
1-3
的烷氧基;r3为氢、卤素或c
1-3
的烷基;r4为氢、c
1-3
的烷氧基、卤代c
1-3
的烷基或芳基 (例如r4与其相邻的苯环形成联苯)。
[0020]
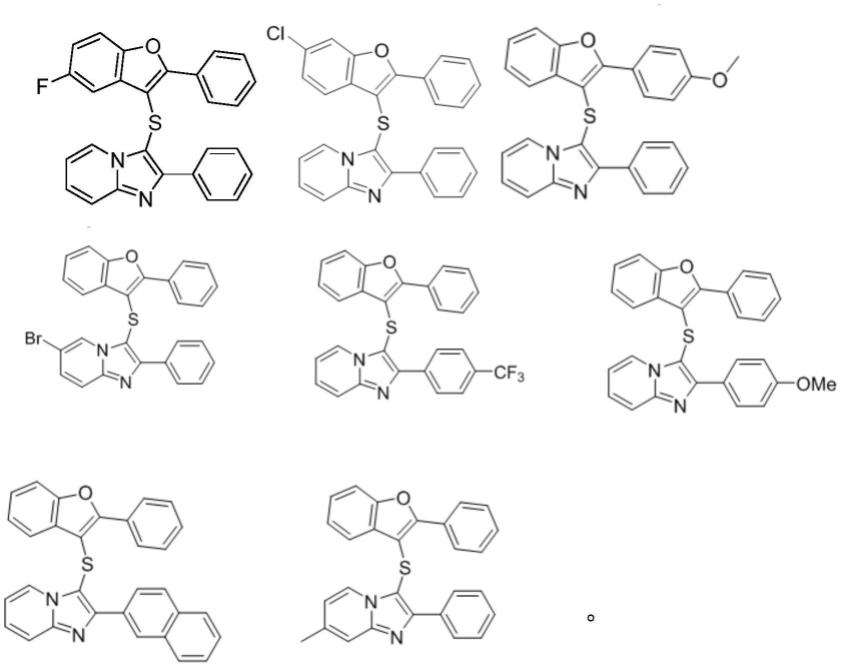
在一些具体的实施方案中,本发明的衍生物的结构如下:
[0021][0022]
另一方面,本发明提供一种3-苯并呋喃基硫咪唑并吡啶衍生物的制备方法,该方法包括如下步骤:
[0023]
在有机溶剂中,使得2-(炔苯基)苯酚、硫粉和咪唑并[1,2-a]吡啶类化合物在碱存在下发生反应。
[0024]
优选地,所述有机溶剂选自dmf、dmac、dmso和nmp中的一种或多种,优选为dmso。
[0025]
优选地,所述碱为碳酸钠、硫化钠、碳酸钾、碳酸氢钠的一种或多种,优选为碳酸氢钠。
[0026]
优选地,所述反应温度为100~120℃,优选为110℃。
[0027]
优选地,所述反应时间为6~24小时,优选为10小时。
[0028]
优选地,所述咪唑并[1,2-a]吡啶类化合物与所述有机溶剂之间的摩尔体积比为0.1~0.3:1(毫摩尔/毫升),优选为0.2(毫摩尔/毫升)。
[0029]
优选地,所述2-(炔苯基)苯酚、所述硫粉和所述咪唑并[1,2-a]吡啶类化合物之间的摩尔比为2:2:1~4:4:1,优选为2:4:1。
[0030]
优选地,所述碱的加入量与所述咪唑并[1,2-a]吡啶类化合物之间的摩尔比为1:1~4:1,优选为2:1。
[0031]
再一方面,本发明提供一种药物组合物,其包括前述的3-苯并呋喃基硫咪唑并吡啶衍生物或其药学上可接受的盐以及药学上可接受的赋形剂。
[0032]
再又一方面,本发明提供一种3-苯并呋喃基硫咪唑并吡啶衍生物或其药学上可接受的盐在制备抗肿瘤的药物中的应用。
[0033]
优选地,所述肿瘤选自肺癌、胃癌、乳腺癌。
[0034]
与现有技术相比较,本技术提供一种3-苯并呋喃基硫咪唑并吡啶衍生物,本技术
的3-苯并呋喃基硫咪唑并吡啶衍生物对多种肿瘤细胞表现出了优异的抗肿瘤活性,可作为进一步开发的候选或者先导化合物,应用于制备抗癌药物,例如制备成抗肺癌,胃癌,乳腺癌药物。
[0035]
此外,在制备方法中,本技术采用廉价无害的硫粉作为原料进行合成,没有异味,绿色、环保,且为固体原料,便于操作。
具体实施方式
[0036]
以下对本发明的具体实施方式进行详细说明,需要解释的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
[0037]
一方面,本发明提供一种3-苯并呋喃基硫咪唑并吡啶衍生物或其药学上可接受的盐,所述衍生物具有如下结构式:
[0038][0039]
其中r1,r2,r3,r4独立地选自氢、烷基、芳基、烷氧基、卤素和三氟甲基。
[0040]
优选地,r1,r2,r3,r4独立地选自c
1-6
的烷基、芳基、c
1-6
的烷氧基、卤素和卤代c
1-3
的烷基。
[0041]
优选地,r1为氢或卤素;
[0042]
优选地,r2为氢或c
1-3
的烷氧基;
[0043]
优选地,r3为氢、卤素或c
1-3
的烷基;
[0044]
优选地,r4为氢、c
1-3
的烷氧基、卤代c
1-3
的烷基或芳基(例如r4与其相邻的苯环形成联苯)。
[0045]
在一个具体实施方案中,r1为氢或卤素;r2为氢或c
1-3
的烷氧基;r3为氢、卤素或c
1-3
的烷基;r4为氢、c
1-3
的烷氧基、卤代c
1-3
的烷基或芳基 (例如r4与其相邻的苯环形成联苯)。
[0046]
在一些具体的实施方案中,本发明的衍生物的结构如下:
[0047][0048]
另一方面,本发明提供一种3-苯并呋喃基硫咪唑并吡啶衍生物的制备方法,该方法包括如下步骤:
[0049]
在有机溶剂中,使得2-(炔苯基)苯酚、硫粉和咪唑并[1,2-a]吡啶类化合物在碱存在下发生反应。
[0050]
优选地,所述有机溶剂选自dmf、dmac、dmso和nmp中的一种或多种,优选为dmso。
[0051]
优选地,所述碱为碳酸钠、硫化钠、碳酸钾、碳酸氢钠的一种或多种,优选为碳酸氢钠。
[0052]
优选地,所述反应温度为100~120℃,优选为110℃。
[0053]
优选地,所述反应时间为6~24小时,优选为10小时。
[0054]
优选地,所述咪唑并[1,2-a]吡啶类化合物与所述有机溶剂之间的摩尔体积比为0.1~0.3:1(毫摩尔/毫升),优选为0.2(毫摩尔/毫升)。
[0055]
优选地,所述2-(炔苯基)苯酚、所述硫粉和所述咪唑并[1,2-a]吡啶类化合物之间的摩尔比为2:2:1~4:4:1,优选为2:4:1。
[0056]
优选地,所述碱的加入量与所述咪唑并[1,2-a]吡啶类化合物之间的摩尔比为1:1~4:1,优选为2:1。
[0057]
在一个具体的实施方案中,在dmso中,加入2-(炔苯基)苯酚、硫粉和咪唑并[1,2-a]吡啶类化合物在碳酸氢钠的作用下发生反应,得到3-苯并呋喃基硫咪唑并吡啶衍生物。上述反应中,除了使用碳酸氢钠,使用碳酸钠、硫化钠、碳酸钾也可得到产物,但收率偏低。有机溶剂除了使用dmso,使用dmf、dmac、dmso、nmp也可得到产物,但收率偏低。上述反应温度为110℃,时间为10小时。所得产物经柱层析提纯得到纯产品。
[0058]
再一方面,本发明提供一种药物组合物,其包括前述的3-苯并呋喃基硫咪唑并吡啶衍生物或其药学上可接受的盐以及药学上可接受的赋形剂。
[0059]
再又一方面,本发明提供一种3-苯并呋喃基硫咪唑并吡啶衍生物或其药学上可接受的盐在制备抗肿瘤的药物中的应用。优选地,所述肿瘤选自肺癌、胃癌、乳腺癌。用dmso溶解后,配置成10000μg/ml浓度进行试药。
[0060]
本发明的3-苯并呋喃基硫咪唑并吡啶衍生物在体外抗肿瘤活性评价测试结果中显示对人肺癌细胞(h1975和pc-9)具有明显抑制作用,对人肺癌细胞的抗肿瘤活性明显优于5-氟脲嘧啶,可作为进一步开发的候选或者先导化合物,应用于制备抗肿瘤药物。
[0061]
实施例
[0062]
实施例1:3-(6-氯-2-苯基苯并呋喃-3-基)硫代)-2-苯基咪唑并[1,2-a]吡啶(化合物1)的制备
[0063][0064]
咪唑并[1,2-a]吡啶类化合物(0.2mmol)、硫粉(0.8mmol)、2-(炔苯基)苯酚(0.4mmol)、碳酸氢钠(0.4mmol)和1毫升dmso于10ml反应管中110℃搅拌反应10小时,随后加入20毫升二氯甲烷,依次采用饱和食盐水洗涤,无水硫酸钠干燥。浓缩、柱层析经过无水硫酸钠干燥,使用旋转蒸发仪将溶剂蒸干得到粗品,通过色谱柱层析纯化(石油醚:乙酸乙酯=10:1~5:1),得到黄色固体62.5mg,总收率69%。1hnmr(500mhz,cdcl3)δ8.18(d,j=7.0hz,2h),8.14
–
8.13(m,2h),7.81(d,j=6.5hz,1h),7.57
–
7.48(m,7h),7.25
–
7.22(m,1h),7.13(t,j=8.0hz,1h),7.05(dd,j=9.0,2.5hz,1h),6.68(d,j=2.0hz,1h),6.52(t,j=7.0hz,1h);
13
cnmr(125mhz,cdcl3)δ157.2,152.0,151.0,146.7,133.6,131.0,130.0,129.3,129.1,128.9,128.9,128.7,128.1,126.2,125.4,124.8,120.1,117.7,112.8,112.2,107.5,105.8;ir(kbr)2921,2852,1464,1440,1341,1230,1054,909,754,682cm-1
;hrmsforc
27h18
cln2os
(m
h):calcd.453.08229,found453.08231.
[0065]
实施例2:3-(2-(4-甲氧基苯基)苯并呋喃-3-基)硫代)-2-苯基咪唑并[1,2-a]吡啶(化合物2)的制备
[0066][0067]
合成方法同化合物1,黄色固体,产率74%。黄色固体,mp155-157℃.1hnmr(500mhz,cdcl3)δ8.32
–
8.30(m,2h),8.11(d,j=8.5hz,2h),7.92(d,j=6.5hz,1h),7.57
–
7.50(m,3h),7.45(t,j=7.0hz,1h),7.34(d,j=8.0hz,1h),7.15
–
7.10(m,2h),7.04(d,j=9.0hz,2h),6.91
–
6.85(m,2h),6.57(t,j=7.0hz,1h),3.90(s,3h);
13
cnmr(125mhz,
cdcl3)δ160.6,155.8,153.5,150.1,146.5,133.8,129.8,129.5,129.1,128.6,128.5,126.0,124.9,124.8,123.4,122.3,119.9,117.6,114.2,112.8,111.1,107.7,103.9,55.5;ir(kbr)2920,1608,1497,1452,1347,1254,1177,1077,1036,828,742cm-1
;hrmsforc
28h21
n2o2s
(m
h):calcd.449.13183,found449.13199.
[0068]
实施例3:6-溴-2-苯基-3-(2-苯基苯并呋喃-3-基)硫代)咪唑并[1,2-a]吡啶(化合物3)的制备
[0069][0070]
合成方法同化合物1,黄色固体,产率74%。1hnmr(500mhz,cdcl3)δ8.27(d,j=8.0hz,2h),8.14(d,j=8.0hz,2h),7.90(s,1h),7.60
–
7.47(m,6h),7.41
–
7.37(m,2h),7.16
–
7.13(m,2h),6.89(t,j=7.5hz,1h),6.79(d,j=8.0hz,1h);
13
cnmr(125mhz,cdcl3)δ156.8,153.8,150.6,144.9,133.4,130.0,129.5,129.5,129.4,129.2,129.0,129.0,128.6,128.2,125.5,125.3,123.5,120.2,118.2,111.3,108.8,107.5,105.1;ir(kbr)2921,2852,1439,1405,1331,1253,1201,1057,811,739,684cm-1
;hrmsforc
27h18
brn2os
(m
h):calcd.497.03177,found;497.03183.
[0071]
实施例4:3-(2-苯基苯并呋喃-3-基)硫基)-2-(4-(三氟甲基)苯基)咪唑并[1,2-a]吡啶(化合物4)的制备
[0072][0073]
合成方法同化合物1,黄色固体,产率63%。1hnmr(500mhz,cdcl3)δ8.4(d,j=8.5hz,2h),8.12(d,j=6.5hz,2h),7.97(d,j=6.5hz,1h),7.69(d,j=8.5hz,2h),7.58
–
7.49(m,4h),7.37(d,j=8.5hz,1h),7.18
–
7.13(m,2h),6.91(t,j=7.5hz,1h),6.80(d,j=7.5hz,1h),6.82(t,j=7.0hz,1h);
13
cnmr(125mhz,cdcl3)δ155.8,153.8,148.3,146.6,137.2,130.2(q,j=32.3hz),129.8,129.6,129.4,129.1,128.8,128.0,126.5,125.4(q,j=3.4hz),125.3,124.9,124.4(q,j=270.6hz),123.5,119.8,117.8,113.2,111.5,108.5,105.4;ir(kbr)2921,1618,1453,1324,1157,1107,1067,1013,847,745,690cm-1
;hrmsforc
28h18
f3n2os
(m
h):calcd.487.10864,found487.10895.
[0074]
实施例5:2-(4-甲氧基苯基)-3-(2-苯基苯并呋喃-3-基)硫代)咪唑并[1,2-a]吡啶(化合物5)的制备
[0075][0076]
合成方法同化合物1,黄色固体,产率59%。1hnmr(500mhz,cdcl3)δ8.27(dd,j=8.5,1.5hz,2h),8.17(d,j=8.0hz,2h),7.89(d,j=7.0hz,1h),7.56
–
7.47(m,4h),7.36(d,j=8.5hz,1h),7.15
–
7.09(m,2h),7.01(d,j=7.0hz,2h),6.92
–
6.88(m,2h),6.54(t,j=6.5hz,1h),3.87(s,3h);
13
cnmr(125mhz,cdcl3)δ160.0,155.1,153.7,150.0,146.5,130.3,129.8,129.5,129.5,128.8,127.9,126.3,126.0,125.1,124.7,123.4,120.2,117.3,113.9,112.6,111.2,106.3,106.0,55.4;ir(kbr)2921,2852,1508,1455,1345,1248,1174,1028,833,738cm-1
;hrmsforc
28h21
n2o2s
(m
h):calcd.449.13183,found449.13187.
[0077]
实施例6:2-(萘-2-基)-3-(2-苯基苯并呋喃-3-基)硫代)咪唑并[1,2-a]吡啶(化合物6)的制备
[0078][0079]
合成方法同化合物1,白色固体,产率69%。1hnmr(500mhz,cdcl3)δ8.82(s,1h),8.50(dd,j=8.5,1.0hz,1h),8.17(d,j=8.0hz,2h),7.97
–
7.95(m,2h),7.89(d,j=8.5hz,2h),7.60(d,j=8.5hz,1h),7.54
–
7.48(m,5h),7.35(d,j=8.5hz,1h),7.17
–
7.09(m,2h),6.86
–
6.79(m,2h),6.59(t,j=6.5hz,1h);
13
cnmr(125mhz,cdcl3)δ155.3,153.7,149.9,146.6,133.5,133.4,131.2,129.8,129.6,129.5,128.8,128.4,128.1,127.9,127.8,126.6,126.5,126.2,125.2,124.8,123.5,120.1,117.6,112.9,111.3,107.6,105.8;ir(kbr)2922,2852,1632,1485,1338,1227,1056,822,738cm-1
;hrmsforc
31h21
n2os
(m
h):calcd.469.13691,found469.13712.
[0080]
实施例7:7-甲基-2-苯基-3-(2-苯基苯并呋喃-3-基)硫代)咪唑并[1,2-a]吡啶(化合物7)的制备
[0081][0082]
合成方法同化合物1,黄色固体,产率70%。1hnmr(500mhz,cdcl3)δ8.28(d,j=7.5hz,2h),8.17(d,j=7.5hz,2h),7.78(d,j=7.0hz,1h),7.55(t,j=7.5hz,2h),7.50(t,j=7.0hz,3h),7.44(t,j=7.0hz,1h),7.38(d,j=8.0hz,1h),7.32(s,1h),7.15(t,j=7.5hz,1h),6.90(t,j=7.5hz,1h),6.84(d,j=8.0hz,1h),6.41(d,j=7.0hz,1h),2.31
(s,3h);
13
cnmr(125mhz,cdcl3)δ155.2,153.8,150.1,147.0,137.3,133.9,129.9,129.6,129.5,129.1,128.8,128.6,128.5,127.9,125.2,124.0,123.5,120.3,116.2,115.5,111.3,106.5,106.2,21.4;ir(kbr)2921,2852,1726,1643,1439,1349,1230,1065,741,686cm-1
;hrmsforc
28h21
n2os
(m
h):calcd.433.13691,found433.13696.
[0083]
实施例8:3-(5-氟-2-苯基苯并呋喃-3-基)硫代)-2-苯基咪唑并[1,2-a]吡啶(化合物8)的制备
[0084][0085]
合成方法同化合物1,黄色固体,产率78%。1hnmr(500mhz,cdcl3)δ8.22(d,j=7.5hz,2h),8.14(d,j=7.5hz,2h),7.86(d,j=7.0hz,1h),7.59
–
7.46(m,7h),7.29
–
7.26(m,1h),7.16(t,j=8.0hz,1h),6.85(td,j=9.0,2.5hz,1h),6.56(t,j=7.0hz,1h),6.40(dd,j=8.5,2.0hz,1h);
13
cnmr(125mhz,cdcl3)δ159.3(d,j
c-f
=238.5hz),157.4,150.7,149.9,146.7,133.6,130.5(d,j
c-f
=10.9hz),129.9,129.6,129.5,129.2,128.9,128.7,128.1,126.2,124.8,117.8,113.1,112.9(d,j
c-f
=2.3hz),112.0(d,j
c-f
=10.3hz),107.3,106.2,106.1(d,j
c-f
=25.8hz);ir(kbr)2922,1463,1437,1344,1163,1056,733,688cm-1
;hrmsforc
27h18
fn2os
(m
h):calcd.437.11184,found437.11176.
[0086]
试验例1:活性测试
[0087]
选取上述得到的化合物1-4、7、8进行如下活性测定。
[0088]
一、实验材料:
[0089]
1.人癌细胞株:均购自中科院上海细胞库。
[0090]
2.受试药物:用dmso溶解后,配置成10000μg/ml最初浓度,备用。
[0091]
3.0.9%生理盐水:规格250ml;2.25g,郑州永和制药有限公司。
[0092]
二、试验方法:
[0093]
细胞常规接种于完全培养基中,经37℃,5%的co2饱和湿度培养、扩增。细胞用0.25%胰蛋白酶消化后,加培养液稀释成1
×
105个/ml癌细胞悬液(胎盘蓝染色,活细胞数均>95%),供试验用。于96孔无菌培养板上设阴性对照孔和阳性对照孔、供试品不同浓度孔,浓度设定为64、32、16、8、4、2、1、0.5微克每毫升,同时每个浓度设3个复孔。将制备好的细胞悬液接种于96孔无菌培养板,培养24h后加入不同浓度的化合物。阴性对照孔内加入等量的培养液,置于培养箱中培养。分别72h后取出,每孔加入mtt20微升,继续培养4h,取出后离心,吸弃去上清液。每孔加入dmso150微升,震荡后使紫蓝色甲瓒结晶完全溶解。用酶标仪测定各孔的od值,通过spss计算其ic
50
.
[0094]
三、试验结果
[0095]
上述化合物对四种人类癌细胞的抗癌活性评价数据如下(ic
50
):
[0096][0097][0098]
上述结果表明,本发明的化合物对多种肿瘤细胞表现出了优异的抗肿瘤活性。
[0099]
试验例2:本技术的制备方法的条件摸索试验
[0100]
申请人在实施例1的基础上,对本技术的制备方法中涉及的碱以及温度进行了研究,结果发现碱和温度对于本发明的最终收率是有影响的。
[0101]
具体实验过程如实施例1,使用的碱和温度如下表所示:
[0102]
序号碱(2eq)温度(℃)溶剂(1ml)收率(%)1k2co3100dmso182t-buona100dmso203na2co3100dmso114k3po4100dmso05na2s100dmso546
‑‑
100dmso07nahco3100dmso568nahco3100dmf209nahco3100二甲苯010nahco3100dmac1811nahco3100nmp2512nahco3100二恶烷013nahco3110dmso7614nahco3120dmso61
[0103]
结果表明,由实验1-7可以看出,该反应使用碱为碳酸氢钠时,效果最好,收率为56%;由实验7-12可以看出,该反应使用溶剂为dmso时,效果最好,收率为56%;由实验12-14可以看出温度过高或过低都会影响实验效果,且温度在110℃时效果最好,收率为76%。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。