荧光多核苷酸测序方法及组合物
1.相关申请的交叉引用
2.本技术要求于2020年4月24日提交的共同拥有的美国临时专利申请第63/015,250号的优先权权益,该美国临时专利申请的内容通过引用以其整体并入本文。
发明领域
3.本发明涉及核酸测序。
4.引言
5.核酸特别是rna和dna的核苷酸序列的确定,对于推进生物学和医学研究是至关重要的。在过去的几十年中,已经提出了促进核酸测序的许多方法。由maxam和gilbert(使用碱基选择性化学降解程序)和sanger(使用称为―3
’‑
终止子”的3
’‑
封闭的核苷酸三磷酸)开发的两种早期方法在20世纪80年代和90年代被广泛用于研究实验室。然而,这些方法是不方便的,因为其依赖于精细的聚丙烯酰胺板凝胶来解析相邻通道中的放射性标记的核酸片段(每个序列4个通道,四种标准核酸碱基类型(a、c、g和t)中的每种一个通道),并且需要长的膜曝光时间来产生可以藉以组装序列的测序片段的图像(也称为测序梯状物)。
6.在20世纪90年代,研究人员利用使用荧光标记的引物(荧光引物方法)或荧光标记的双脱氧核苷酸三磷酸(荧光终止子方法)生成的包含荧光标记的测序片段,将sanger方法改编为非放射性检测方法。使用多重毛细管电泳分离测序片段的荧光终止子方法是用于确定由celera和学术实验室联合于2001年公布的第一批人类基因组序列的主要方法。
7.自2001年以来,开发了几种所谓的―下一代”测序方法。在过去的十年中,主导地位的测序方法是由solexa开发并由illumina商业化的合成测序方法。在solexa方法中,在通过沿着互补样品模板链进行引物延伸来合成互补链时采集测序数据。在这种方法中,使引物与固定化模板链杂交,形成引物-模板复合物。在存在四种不同的荧光标记的可逆性3’封闭的核苷酸终止子(dntp)的情况下,杂交引物通过dna聚合酶进行延伸。聚合酶催化与模板中的核苷酸碱基互补的核苷酸终止子向生长的引物的3’末端的添加,从而产生3’封闭的引物。在去除残余的封闭的dntp之后,对引物-模板复合物进行成像,以确定哪种类型的dntp被添加至引物。在图像采集之后,去除添加的dntp的荧光标记物,并且将添加的dntp的3
’‑
碳脱封闭以产生具有可延伸的3
’‑
羟基基团的脱封闭的引物。然后,脱封闭的引物准备好进一步的添加、成像和脱封闭/脱标记循环,以根据添加至引物的互补dntp序列确定模板链的序列。虽然该方法提供了高通量与良好的准确度,但其需要对大量短序列进行比对,留下大量的序列空位和序列歧义。此外,其价格昂贵且需要大量耗时的样品制备。
8.由pacific biosciences开发的不同的合成测序方法使用γ标记的荧光dntp,该γ标记的荧光dntp通过模板依赖的dna聚合酶添加至可延伸引物的3’末端。在添加每个dntp时,γ标记物同时从ntp裂解并被检测。由于该方法需要将聚合酶保持靠近由高强度隐失场(evanescent field)照射的反应室底部,因此聚合酶、模板和附近的标记的ntp遭受光损伤,该光损伤可以通过光诱导的交联使聚合酶失活,并且可以通过光漂白破坏γ标记物。另一个限制是,由于需要预装载每个dna聚合酶分子与dna模板,然后将聚合酶固定在每个
反应室底部,因此对于单个序列读段,每个反应室仅能使用一次。
9.oxford nanopore technologies已经将涉及在单链样品核酸通过蛋白纳米孔时测量跨膜电流的测序技术商业化。核酸的序列根据取决于在特定时间通过纳米孔的特定核苷酸序列的测量的电流的变化推导出。然而,由于许多因素,这一方法尚未得到广泛采用。该方法通常使用需要疏水环境(诸如脂质双层)的蛋白纳米孔,其不稳定且难以制造。太快或不一致的易位速度可能引起核苷酸被错误鉴定或整个遗漏。在纳入所谓的分子马达来减缓易位时,这些问题并未完全解决。此外,通过这种方法进行序列确定通常需要复杂的算法来对个体核苷酸对测量的电流的贡献(所述电流具有来自蛋白纳米孔中多于一个(例如,五个或更多个)连续核苷酸的同时贡献)进行解卷积。
10.以上pacific biosciences和oxford nanopore technologies的方法产生了有限的准确度,在将来自针对相同序列区段的多于一个读段的数据合并之后有所改进。
11.对于使用方便、成本较低及提供高准确度的新测序方法仍然存在强烈需求。
12.所选实施方案的简述
13.在一些实施方案中,本公开内容提供了一种用于确定多核苷酸的核苷酸序列的方法。该方法包括提供包括顺式侧和反式侧的固态基底,基底包括反应阱,该反应阱限定反应体积并且包括(i)在基底的顺式侧与反式侧之间延伸的近侧通孔,(ii)一个或更多个侧壁,以及(iii)远侧开口。固态基底还包括不透明金属层,该不透明金属层大体上阻止激发光穿透到反应体积中及穿透到基底的顺式侧。本发明还提供了一种载体颗粒,该载体颗粒包含附接至载体颗粒的荧光标记的多核苷酸链。荧光标记的多核苷酸链包含(i)附接至载体颗粒的近侧末端,(ii)能够被外切核酸酶裂解的远侧末端,和(iii)至少一种包含荧光标记物的荧光标记的核苷酸。载体颗粒位于基底的顺式侧,但不穿过通孔,使得附接的荧光标记的多核苷酸链穿过通孔突出,使得荧光标记的链的远侧末端在反应体积中。基底的反式侧用激发光照射,以产生与反应阱的远侧开口相邻的荧光激发区。在底物被照射时,荧光标记的多核苷酸链与外切核酸酶反应,使得单核苷酸从链的远侧末端连续释放并且扩散通过荧光激发区,使得荧光标记的单核苷酸在激发区中发射荧光信号。检测随着时间变化的荧光信号,由此根据从释放的荧光标记的单核苷酸检测到的荧光信号的时间顺序来确定核苷酸序列。
14.在一些实施方案中,反应阱的远侧开口具有至少30nm的最小直径。在一些实施方案中,反应阱的远侧开口具有50nm至150nm的最小直径。
15.在一些实施方案中,反应阱的一个或更多个壁不是锥形的。在一些实施方案中,反应阱的一个或更多个壁是大体圆柱形的。
16.在一些实施方案中,不透明金属层包含金或铝。在一些实施方案中,不透明金属层具有100nm至600nm的厚度。在一些实施方案中,固态基底包括多于一个不透明金属层。
17.在一些实施方案中,反应阱具有至少200nm的阱深度。在一些实施方案中,反应阱具有200nm至1000nm的阱深度。
18.在一些实施方案中,反应体积中的荧光标记的多核苷酸链包含含有至少100个连续核苷酸的荧光标记的多核苷酸区段。
19.在一些实施方案中,通孔具有至少2nm的最小直径。在一些实施方案中,通孔具有2nm至50nm的最小直径。在一些实施方案中,基底包括薄膜层,所述薄膜层包含近侧通孔并
且具有20nm与50nm之间的厚度。在一些实施方案中,薄膜层包括氮化硅。
20.在一些实施方案中,激发光具有380nm或更大的波长。
21.在一些实施方案中,固体基底包括限定反应体积的一个或更多个表面部分,并且一个或更多个表面部分包括至少一个表面钝化涂层。
22.在一些实施方案中,反应阱的一个或更多个侧壁包含氧化硅涂层和氧化铝涂层中的一种或两种。
23.在一些实施方案中,荧光标记的多核苷酸链包含至少两种不同种类的核苷酸,每个种类核苷酸都用可区分的荧光标记物标记。
24.在一些实施方案中,载体颗粒不是磁性的。在一些实施方案中,载体颗粒是磁性的。
25.在一些实施方案中,在所述反应期间,通过偏置电压将载体颗粒维持在近侧通孔旁边。
26.在一些实施方案中,载体颗粒包含具有彼此不同的多核苷酸序列的多于一条荧光标记的多核苷酸链。
27.在一些实施方案中,在所述反应之后,停止偏置电压以允许载体颗粒移动离开近侧通孔,使得剩余的荧光标记的多核苷酸链从反应体积中移除,并且然后施加偏置电压以将相同或不同的载体颗粒朝向近侧通孔移动,使得将新的荧光标记的多核苷酸链递送到反应阱中,用于与外切核酸酶反应。
28.在一些实施方案中,反应体积中的荧光标记的多核苷酸链包含双链核酸。在一些实施方案中,反应体积中的荧光标记的多核苷酸链包含单链核酸。在一些实施方案中,载体颗粒包含多于一条荧光标记的多核苷酸链,在一些实施方案中,所述荧光标记的多核苷酸链是单链或双链核酸。
29.在一些实施方案中,固态基底包括多于一个反应阱。在一些实施方案中,多于一个反应阱被配置为一维或二维阵列。在一些实施方案中,多于一个反应阱中的两个或更多个各自包含待测序的荧光标记的多核苷酸链。
30.以上方法还可用于确定多于一种多核苷酸的核苷酸序列。
31.本发明还提供用于在本发明方法中使用的试剂盒。
附图说明
32.图1a-图1d示出了本发明的固态基底的示例性反应阱的特征和操作。
33.图2示出了本发明的示例性测序设备。
34.图3示出了根据荧光标记的多核苷酸链的核酸外切裂解获得的示例性测序谱。
35.示例性实施方案的详述
36.虽然本发明适用于各种修改和替代形式,但其细节通过附图中的实例示出并在本文中进一步详细描述。然而,应该理解,意图并不是将本发明限制于本文描述的特定实施方案。相反,本发明将覆盖落入本发明的精神和范围内的所有修改、等效物和替代物。
37.例如,为了说明的目的,示出了特定反应阱结构、特定标记物和制造实例。然而,应该理解,本公开内容并不意图限于这方面,因为可以利用本文未具体详述的其他结构、反应阱阵列和其他制造技术来实现本发明的各方面。对本发明各方面的指导可见于本领域普通
技术人员已知的许多参考文献和专著中,包括例如,cao,nanostructures&nanomaterials(imperial college press,2004);levinson,principles of lithography,第2版(spie press,2005);doering和nishi,编者,handbook of semiconductor manufacturing technology,第2版(crc press,2007);sawyer等人,electrochemistry for chemists,第2版(wiley interscience,1995);bard和faulkner,electrochemical methods:fundamentals and applications,第2版(wiley,2000);lakowicz,principles of fluorescence spectroscopy,第3版(springer,2006);hermanson,bioconjugate techniques,第2版(academic press,2008)等,其相关部分通过引用特此并入。
38.在一些方面,本发明涉及使用通过外切核酸酶活性对荧光标记的多核苷酸链顺序的消化对多核苷酸进行的基于荧光的分析。
39.―多核苷酸”和―寡核苷酸”被可互换地使用并且意指核苷酸单体的线性聚合物或其类似物。多核苷酸和寡核苷酸中的核苷酸单体能够通过单体与单体相互作用的常规模式(诸如watson-crick类型的碱基配对、碱基堆积、hoogsteen或反向hoogsteen类型的碱基配对等)与天然多核苷酸特异性结合。这样的单体及其核苷间连接可以是天然存在的,或者可以是其类似物,例如天然存在的或非天然存在的类似物。非天然存在的类似物可以包括pna、硫代磷酸酯核苷间连接、含有允许标记物(诸如荧光团或半抗原等)附接的连接基团的碱基。每当寡核苷酸或多核苷酸的使用需要酶促加工(诸如通过聚合酶延伸、通过连接酶连接等)时,普通技术人员将理解,那些实例中的寡核苷酸或多核苷酸在任何位置或一些位置处将不包含核苷间连接、糖部分或碱基的某些类似物。多核苷酸的尺寸范围通常为几个单体单元例如5-40个(此时多核苷酸通常被称为―寡核苷酸”)至数千个单体单元。每当多核苷酸或寡核苷酸以字母(大写或小写)序列诸如―atgcctg”表示时,应该理解,该核苷酸从左至右是以5'
→
3'的顺序,并且―a”表示脱氧腺苷,―c”表示脱氧胞苷,―g”表示脱氧鸟苷,并且―t”表示胸苷,―i”表示脱氧肌苷,―u”表示尿苷,除非另外指定或从上下文明显的。除非另外说明,否则术语和原子编号惯例将遵循strachan和read,human molecular genetics 2(wiley-liss,new york,1999)中公开的那些。通常多核苷酸包含由磷酸二酯键连接的四种天然核苷(例如,脱氧腺苷、脱氧胞苷、脱氧鸟苷、脱氧胸苷(对于dna)或它们的核糖对应物(对于rna));然而,多核苷酸也可以包含非天然的核苷酸类似物,例如包含修饰的碱基、糖或核苷间连接。本领域技术人员清楚,在酶的活性要求特定的寡核苷酸或多核苷酸底物(例如单链dna、rna/dna双链体等)的情况下,则选择寡核苷酸或多核苷酸底物的适当组成是在普通技术人员的知识范围内,特别是在来自专著,诸如sambrook等人,molecular cloning,第2版(cold spring harbor laboratory,new york,1989)以及类似的参考文献的指导下。同样,寡核苷酸和多核苷酸可以指单链形式或双链形式(即寡核苷酸或多核苷酸与其对应互补序列的双链体)。普通技术人员根据使用的上下文将清楚哪种形式是意图的或者是否两种形式都是意图的。
40.―引物”意指能够在与多核苷酸模板形成双链体后用作核酸合成的起始点并从其3'末端沿模板延伸从而形成延伸的双链体的天然或合成的寡核苷酸。引物的延伸通常用核酸聚合酶诸如dna或rna聚合酶进行。在延伸过程中添加的核苷酸的序列由模板多核苷酸的序列决定。通常引物通过dna聚合酶延伸。引物通常具有14个至40个核苷酸的范围内或18个至36个核苷酸的范围内的长度。然而,也可以使用长得多的引物。引物用于各种核酸扩增反
应,例如使用单一引物的线性扩增反应,或者采用两种或更多种引物的聚合酶链式反应。对于选择用于特定应用的引物的长度和序列的指导是本领域普通技术人员已知的,如以下所展示的:例如,dieffenbach,编者,pcr primer:a laboratory manual,第2版(cold spring harbor press,new york,2003)。
41.―核酸”涵盖如下定义的多核苷酸和寡核苷酸,它们可以是天然的或人工的,任何长度的,单链、双链、三链、线性、环状或支链的,并且它们通过2
’‑
脱氧核糖核酸(dna)、核糖核酸(rna)(诸如核糖体rna、转移rna、微rna)、dna/rna杂交体和dna-rna嵌合体示例。核酸通常包含一个或更多个标准核苷酸碱基,诸如腺嘌呤、胞嘧啶、鸟嘌呤、胸腺嘧啶和尿嘧啶及其类似物,使得碱基通常能够与互补链中的互补碱基以双链形式与相对碱基中的碱基进行碱基配对。
42.在提及多核苷酸时,―序列确定”、―测序”、―确定核苷酸序列”、―确定多核苷酸序列”以及类似术语包括确定一个或更多个多核苷酸的部分或全部核苷酸序列信息。这些术语还包括确定四种天然核苷酸全集的子集的序列,对于dna的a、c、g和t(或对于rna的a、c、g或u),诸如,例如,靶多核苷酸的仅a和c的序列。这些术语还包括确定靶多核苷酸内的四种类型的核苷酸中的一种、两种、三种或全部的身份、顺序和位置。在一些实施方案中,这些术语包括确定靶多核苷酸内的四种类型的核苷酸中的两种、三种或全部的身份、顺序和位置。在一些实施方案中,序列确定可以通过以下来完成:鉴定靶多核苷酸―catcgc...”内单一类型的核苷酸例如胞嘧啶的顺序和位置,使得其序列被表示为二进制代码,例如―100101...”代表―c-(非c)(非c)c-(非c)-c...”等。在一些实施方案中,这些术语还可以包括用作靶多核苷酸的指纹的靶多核苷酸子序列;即独特地鉴定一组多核苷酸(例如由细胞表达的所有不同的rna序列)内的靶多核苷酸或一类靶多核苷酸的子序列。
43.―靶多核苷酸”意指其序列待被确定的多核苷酸或多核苷酸区段。如果靶多核苷酸是双链的,那么根据watson和crick碱基配对规则,确定靶多核苷酸的一条链的序列将揭示对应的互补链的序列。如果靶多核苷酸是单链的(或意图指双链核酸中的单链),那么确定与靶多核苷酸互补的链的序列(例如,通过靶rna多核苷酸的逆转录制备的cdna的序列)将揭示靶多核苷酸的序列。因此,根据如何使用―靶”的上下文,靶多核苷酸可以被认为是荧光标记的多核苷酸链,其序列根据通过外切核酸酶介导的消化连续释放的单核苷酸序列直接确定,或者靶多核苷酸可以被认为是其序列与荧光标记的多核苷酸链的序列互补的多核苷酸链。
44.―靶序列”意指靶多核苷酸的序列。
45.多核苷酸可以从用于使用本发明进行测序的任何合适的样品来源获得。各种各样的生物来源都可以是合适的,诸如病毒、细菌、分枝杆菌、真菌、植物、动物、哺乳动物、人类等。对于复杂的生物体,诸如人类,各种不同的样品类型可能是感兴趣的,诸如全血、血浆、血清、细胞(诸如红细胞、白细胞、破骨细胞、成骨细胞、肝细胞)、尿液、鼻粘液、粪便、痰、唾液、脑脊液、线粒体、外泌体、福尔马林固定的组织样品和组织拭子。
46.核酸可以使用任何适当的方法制备和/或纯化。用于不同样品类型的许多方法是已知的。例如,对于从各种样品类型中分离dna和rna,许多试剂和试剂盒是商业可得的,诸如qiagen、roche、promega、biomerieux等。核酸可以以其天然状态分离,或者可以在测序之前以其他方式片段化或修饰。例如,核酸可以通过机械方法(例如,声处理或雾化)或通过酶
促消化来片段化。
47.制备质粒文库或其他种类的文库用于储存和/或制备样品核酸用于随后使用是常见的。样品核酸可以是片段化的,或者不是片段化的,并且可以通过两个末端上的衔接子加帽以便更容易的操作。衔接子可以包含可用于使引物杂交以便使互补链通过引物延伸或者促进在这样的衔接子下游或这样的衔接子之间的序列的聚合酶链式反应扩增的序列。
48.例如,机械剪切的dna片段通常需要末端修复,其中在片段化期间产生的突出端使用dna聚合酶填充,以产生双链平末端片段。一些可以用于填充反应的dna聚合酶产生具有非模板化的3
’‑
a突出端而不是平末端的填充片段,这可以增加衔接子连接的效率。在衔接子连接之前,使用商业试剂盒,诸如spri珠(beckman coulter life sciences)或凝胶纯化,对dna片段进行尺寸选择。然后将双链的合成dna衔接子酶促连接至尺寸选择的dna片段的两个末端。dna衔接子在一侧包含平末端(或用于对应的3
’‑
a突出端片段的5
’‑
t突出端),dna衔接子通过所述平末端(或用于对应的3
’‑
a突出端片段的5
’‑
t突出端)被连接至片段化的dna。在相对末端,y形非互补单链部分确保衔接子的定向连接,并且提供用于引物延伸的引发位点,例如,通过聚合酶介导的引物延伸掺入荧光标记的核苷酸。另参见shendure&ji,nature biotechnology 26(10):1135-1145(2008)。
49.优选地,核酸被纯化以大体上去除非靶多核苷酸和其他物质,诸如细胞碎片、蛋白等。用于从各种样品类型中纯化核酸的方法是熟知的,并且在例如以下出版物中描述:诸如green和sambrook,molecular cloning:a laboratory manual,fourth edition,cshl press(2012),ausubel等人,current protocols in molecular biology,wiley press(2020)等。
50.根据本发明用于测序的荧光标记的多核苷酸链(也称为―荧光标记的链”)可以通过任何合适的方法制备。每条荧光标记的链可以具有近侧末端和远侧末端。近侧末端直接或间接偶联至载体颗粒,如下文进一步描述的。当荧光标记的链偶联至载体颗粒时,荧光标记的链的远侧末端远离载体颗粒突出。每个荧光标记的链能够被外切核酸酶裂解,使得从链的远侧末端连续(一个接一个)释放单核苷酸(单核苷酸中的一些或全部包含荧光标记物),用于随后的检测(下文进一步讨论)。
51.在一些实施方案中,荧光标记的链可以以单链形式提供,用于通过单链特异性外切核酸酶连续裂解荧光标记的链的远侧末端。在其他实施方案中,荧光标记的链可以以包含荧光标记的链的双链形式提供,用于通过双链特异性外切核酸酶连续裂解荧光标记的链的远侧末端。
52.在一些实施方案中,使用5’外切核酸酶。5’外切核酸酶可以是单链特异性的或双链特异性的。对于单链特异性的5’外切核酸酶,荧光标记的链可以以单链形式提供,使得3’末端是偶联至载体颗粒的近侧末端,并且5’末端是被5
’‑
外切核酸酶裂解的远侧末端。对于双链特异性的5’外切核酸酶,除了荧光标记的链以包含与荧光标记的链杂交的互补链的双链形式提供之外,前一句的所有特征都适用。
53.在一些实施方案中,使用3’外切核酸酶。3’外切核酸酶可以是单链特异性的或双链特异性的。对于单链特异性的3’外切核酸酶,荧光标记的链可以以单链形式提供,使得5’末端是偶联至载体颗粒的近侧末端,并且3’末端是被3’外切核酸酶裂解的远侧末端。对于双链特异性的3’外切核酸酶,除了荧光标记的链以包含与荧光标记的链杂交的互补链的双
链形式提供之外,前一句的所有特征都适用。
54.荧光标记的链也可以以包含双链区和单链区的形式提供。例如,如果荧光标记的链以双链形式提供并与互补链杂交,使得荧光标记的链包含从双链区延伸的单链3’突出端,则3’突出端可以被单链特异性3’外切核酸酶裂解,直到外切核酸酶到达双链区。在该实例中,3’突出端的3’末端是荧光标记的链的远侧末端,并且3’突出端的5’末端是荧光标记的链的近侧末端。在可选的实例中,如果荧光标记的链以双链形式提供并与包含从双链区延伸的单链3’突出端的互补链杂交,则双链特异性5’外切核酸酶可以裂解双链区中荧光标记的链的凹陷5’末端。在该可选的实例中,荧光标记的链的5’末端是远侧末端,并且荧光标记的链的3’末端是近侧末端。
55.如果荧光标记的链以双链形式提供并与互补链杂交,使得荧光标记的链包含从双链区延伸的单链5’突出端,则5’突出端可以被单链特异性5’外切核酸酶裂解,直到外切核酸酶到达双链区。在该实例中,5’突出端的5’末端是荧光标记的链的远侧末端,并且5’突出端的3’末端是荧光标记的链的近侧末端。在可选的实例中,如果荧光标记的链以双链形式提供并与包含从双链区延伸的单链5’突出端的互补链杂交,则双链特异性3’外切核酸酶可以裂解双链区中荧光标记的链的凹陷3’末端。在该可选的实例中,荧光标记的链的3’末端是远侧末端,并且荧光标记的链的5’末端是近侧末端。
56.在一些实施方案中,荧光标记的链可以通过与样品多核苷酸序列互补的引物的dna聚合酶介导的延伸(产生荧光标记的dna链)或rna聚合酶介导的延伸(产生荧光标记的rna链)来制备。对于多于一个样品序列的测序,可以使用多于一种引物。引物可以全部相同(即,具有选择的引物序列的单一引物),或者引物可以包括多于一种不同的引物序列。在一些实施方案中,所有引物都具有预选的引物序列。在一些实施方案中,引物包括随机产生的引物序列。在一些实施方案中,引物可以包括所有可能的n-mer序列,诸如所有可能的6-mer、7-mer、8-mer、9-mer或10-mer序列,这可以促进样品中所有可能序列的引发。在一些实施方案中,一种或更多种引物可以各自包含亲和部分,以促进延伸的引物附接至载体颗粒,如下文进一步讨论的。
57.在一些实施方案中,靶多核苷酸的核苷酸序列通过进行四种单独的反应(各自在单独的反应阱中)来确定,其中靶多核苷酸(或其互补序列)的拷贝的四种不同种类的核苷酸(a、c、g和t)中的每一种用单一荧光标记物标记。
58.在一些实施方案中,荧光标记的多核苷酸链包含一个种类的用荧光标记物标记的核苷酸。在一些实施方案中,荧光标记的多核苷酸链包含两种不同种类的核苷酸,每个种类的核苷酸用可区分的荧光标记物标记。在一些实施方案中,荧光标记的多核苷酸链包含至少两种不同种类的核苷酸,每个种类的核苷酸用可区分的荧光标记物标记。在一些实施方案中,荧光标记的多核苷酸链包含三种不同种类的核苷酸,每个种类的核苷酸用可区分的荧光标记物标记。在一些实施方案中,荧光标记的多核苷酸链包含至少三种不同种类的核苷酸,每个种类的核苷酸用可区分的荧光标记物标记。在一些实施方案中,荧光标记的多核苷酸链包含四种不同种类的核苷酸,每个种类的核苷酸用可区分的荧光标记物标记。
59.在一些实施方案中,靶多核苷酸链的核苷酸序列通过进行四种单独的反应来确定,其中靶多核苷酸链的拷贝的四种不同种类的核苷酸(a、c、g和t)中的每一种用一种荧光标记物标记,而同时同一靶多核苷酸链上的其他核苷酸用第二荧光标记物标记。例如,如果
在第一反应中第一荧光标记物附接至靶多核苷酸链的a,则在第一反应中第二荧光标记物附接至靶多核苷酸连的c、g和t(即附接至―非-a”核苷酸)。同样地,继续该实例,在第二反应中,第一标记物被附接至靶多核苷酸链的c,并且第二荧光标记物附接至靶多核苷酸链的a、g和t(即附接至―非c”核苷酸)。对于核苷酸g和t,依此类推。
60.相同的标记方案可以以核苷酸类型的子集的常规术语表示;因此,在以上实例中,在第一反应中,第一荧光标记物附接至a,并且第二荧光标记物附接至b;在第二反应中,第一荧光标记物附接至c,并且第二荧光标记物附接至d;在第三反应中,第一荧光标记物附接至g,并且第二荧光标记物附接至h;并且在第四反应中,第一荧光标记物附接至t,并且第二荧光标记物附接至v。
61.在一些实施方案中,荧光标记的多核苷酸链包含附接至单一种类单体的单一荧光标记物,例如,多核苷酸链的每个t(或大体上每个t)用荧光标记物例如菁染料标记。在这样的实施方案中,来自多核苷酸链的荧光信号的集合或序列可以形成特定多核苷酸的特征或指纹。在一些这样的实施方案中,这样的指纹可以为待确定的单体的序列提供足够的信息,或者可以不为待确定的单体的序列提供足够的信息。
62.在一些实施方案中,荧光标记物是相互猝灭的。在一些实施方案中,荧光标记物不是相互猝灭的。
63.相互猝灭的荧光标记物具有以下特性:(i)每个元件猝灭每一个元件的荧光(例如,通过fret或通过静态或接触机制),以及(ii)每个元件在被激发且处于非猝灭状态时产生不同的荧光信号。即,如果相互猝灭组由两种染料d1和d2组成,则(i)d1是自我猝灭的(例如通过与另一个d1分子接触猝灭),并且其被d2猝灭(例如通过接触猝灭)并且(ii)d2是自我猝灭的(例如通过与另一个d2分子接触猝灭)并且其被d1猝灭(例如通过接触猝灭)。接触猝灭通常在相邻单核苷酸上的荧光标记物之间强烈发生,但接触猝灭也可以在彼此不相邻的单核苷酸上的荧光标记物之间发生。使用相互猝灭的荧光标记物的益处包括,例如,使来自荧光标记的多核苷酸链的非特异性荧光背景最小化,以及保存荧光标记物免受甚至可能存在于反应阱的非照射(或可忽略照射)区中的偶发自由基和三重态物质的影响。
64.荧光标记物包括在本发明的方法中由使用者选择的用于鉴定附接的单核苷酸的任何荧光染料。用于标记ntp、dntp、ntp类似物和dntp类似物的示例性荧光标记物包括但不限于呫吨、荧光素、罗丹明、磺酰罗丹明、rhodals、菁、香豆素和芘。如果使用不同的荧光标记物来鉴定和区分不同种类的核苷酸,则荧光标记物可以来自相同结构类别的荧光标记物(例如,全部是荧光素)或来自不同类别的荧光标记物。
65.对于选择相互猝灭组的荧光标记物的示例性指导可以见于以下参考文献中,这些参考文献通过引用并入本文:johansson,methods in molecular biology,335:17-29(2006);marras等人,nucleic acids research,30:el22(2002)等。在一些实施方案中,相互猝灭组的成员包括有机荧光染料,其包含能够堆叠相互作用的组分或部分,诸如芳族环结构。在一些实施方案中,荧光标记物的示例性相互猝灭组可以选自罗丹明染料、荧光素染料和菁染料。在一些实施方案中,相互猝灭组可以包括罗丹明染料tamra以及荧光素染料fam。在一些实施方案中,荧光染料的相互猝灭组可以包括选自以下的两种或更多种染料:oregon green 488、荧光素-ex、异硫氰酸荧光素、罗丹明红-x、lissamine罗丹明b、钙黄绿素、荧光素、罗丹明、一种或更多种bodipy染料、texas red、oregon green 514和一种或更
多种alexa fluor。示例性bodipy染料包括bodipy fl、bodipy r6g、bodipy tmr、bodipy 581/591、bodipy tr、bodipy 630/650和bodipy 650/665。示例性alexa荧光标记物包括alexa fluor 350、alexa fluor 405、alexa fluor 430、alexa fluor 488、alexa fluor 500、alexa fluor514、alexa fluor 532、alexa fluor 546、alexa fluor 555、alexa fluor 568、alexa fluor 594、alexa fluor 610、alexa fluor 633、alexa fluor 635、alexa fluor 647、alexa fluor 660、alexa fluor 680、alexa fluor 700、alexa fluor750和alexa fluor 790。
66.在另外的实施方案中,用于标记ntp、dntp、ntp类似物和dntp类似物的示例性荧光标记物包括但不限于alexa 488、amca、atto 655、cy3、cy5、evoblue 30、荧光素、gnothis blue 1、gnothis blue 2、gnothis blue 3、dy630、dy635、mr121、罗丹明、罗丹明绿、oregon green、tamra等。用于dutp类似物的示例性荧光标记物包括但不限于alexa 488、amca、atto 655、cy3、cy5、dy630、dy665、evoblue 30、evoblue 90、荧光素、gnothis blue 1、gnothis blue 2、gnothis blue 3、mr121、oregon green、罗丹明、罗丹明绿、tamra等。用于dctp类似物的示例性荧光标记物包括但不限于atto 655、cy5、evoblue 30、gnothis blue 3、罗丹明、罗丹明绿、tamra等。用于datp类似物的示例性荧光标记物包括但不限于atto 655、cy5、evoblue 30、gnothis blue 3、罗丹明绿等。用于dgtp类似物的示例性荧光标记物包括但不限于evoblue 30、gnothis blue 3、罗丹明绿等。用于dutp类似物和dctp类似物的示例性荧光标记物对包括但不限于tamra,罗丹明绿、atto 655、evoblue 30、evoblue 30、atto 655、evoblue 30、gnothis blue 3、evoblue 30、罗丹明绿、gnothis blue 1、罗丹明绿、gnothis blue 2、atto 655、gnothis blue 3、cy5等。
67.在另外的实施方案中,用于标记ntp、dntp、ntp类似物和dntp类似物的示例性荧光标记物包括但不限于oregon green 488、荧光素-ex、fitc、罗丹明红-x、lissamine罗丹明b、钙黄绿素、荧光素、罗丹明、bodipy和texas红,例如,它们公开于截至本公开之日在线修订的molecular probes handbook—a guide to fluorescent probes and labeling technologies,第11版(2010)中。
68.在存在ntp、dntp、ntp类似物和/或dntp类似物的情况下,选择待标记的核苷酸种类、标记物种类、用于附接的接头和用于合成荧光标记的多核苷酸链的核酸聚合酶的另外的指导可以见于以下参考文献中,这些参考文献通过引用并入:例如,goodman等人,美国专利5,945,312;jett等人,美国专利5,405,747;muehlegger等人,美国专利公布us2004/0214221;giller等人,nucleic acids research,31(10):2630-2635(2003);tasara等人,nucleic acids research 31(10):2636-2646(2003);augustin等人,j.biotechnology,86:289-301(2001);brakmann,current pharmaceutical biotechnology,5(1):119-126(2004);以及anderson等人,biotechniques38:257-264(2005)。
69.用于在存在ntp、dntp、ntp类似物和/或dntp类似物的情况下合成荧光标记的多核苷酸链的示例性核酸聚合酶包括但不限于,vent(exo minus)聚合酶、taq聚合酶、大肠杆菌(e.coli)pol i、tgo(exo minus)聚合酶、klenow片段(exo minus)、thermococcus kodakaraensis kod1 dna聚合酶(emd millipore和其他供应商)、deep vent(exo minus)聚合酶、therminator聚合酶、pfu(exo minus)聚合酶、pfu苜蓿花叶病毒(alfalfa mosaic virus)逆转录酶、鼠白血病病毒逆转录酶、t4聚合酶等。在一些实施方案中,示例性核酸聚
合酶包括但不限于vent(exo minus)聚合酶和klenow片段(exo minus)。应注意,相对于保留3
’‑
外切核酸酶活性的对应聚合酶,无外切酶活性(exo minus)聚合酶具有更大的持续合成能力(processivity),从而可以更有效地完成荧光标记的多核苷酸链的合成。
70.在其他实施方案中,链的选择种类的核苷酸通过在延伸反应中掺入选择种类的核苷酸的类似物dntp来标记,其中类似物dntp通过正交反应性官能团来衍生化,其允许在随后反应中将不同的标记物附接至不同种类的核苷酸,如例如jett等人的美国专利5,405,747中描述的,该专利通过引用并入本文。
71.载体颗粒具有足够大的尺寸,以防止载体颗粒通过反应阱的通孔移动到反应阱中。每个载体颗粒能够通过电磁力移动至反应阱的通孔附近,以将附接至载体颗粒的第一荧光标记的多核苷酸链的远侧末端穿过通孔递送到反应阱中。在一些实施方案中,载体颗粒是磁性载体颗粒。在一些实施方案中,载体颗粒不是磁性载体颗粒。在一些实施方案中,电磁力是偏置电压。在一些实施方案中,电磁力是磁力。
72.在一些实施方案中,载体颗粒具有为以下的直径或最大直径:至少15nm、或至少20nm、或至少25nm、或至少30nm、或15nm至100nm、或15nm至75nm、或15nm至50nm或20nm至50nm。然而,也可以使用具有更大或更小直径的载体颗粒。在一些实施方案中,本发明的载体颗粒是一个或多于一个纳米颗粒或者包括一个或多于一个纳米颗粒。如本文使用的,―纳米颗粒”是指具有小于200nm、或小于150nm、或小于100nm的直径或最大直径的载体颗粒。
73.载体颗粒可以是带电荷的或不带电荷的。基于在周围水性介质(通常包括水性缓冲液)的ph条件下颗粒上的带正电荷的基团和带负电荷的基团的净平衡,载体颗粒可以具有净中性电荷、净正电荷或净负电荷。优选地,为了通过电场(偏置电压)控制移动,当载体颗粒包含一个或更多个附接的荧光标记的多核苷酸链时,载体颗粒具有净负电荷。
74.在一些实施方案中,每个载体颗粒能够通过电磁力移动离开反应阱的通孔,以从通孔移除裂解的荧光标记的多核苷酸链。在本发明方法的优选的实施方案中,在阱中的荧光标记的多核苷酸链被外切核酸酶裂解之后,将载体颗粒移动离开孔,使得裂解的链从阱中抽出,并且然后相同或不同的载体颗粒移动靠近阱的通孔,以将第二(有时称为―新的”)荧光标记的多核苷酸链的远侧末端穿过通孔递送到反应阱中。为了促进荧光标记的多核苷酸链的远侧末端通过偏置电压或磁场进入和离开反应阱的移动,载体颗粒不与通孔共价偶联。
75.在一些实施方案中,载体颗粒包括球形颗粒。在一些实施方案中,载体颗粒包括具有例如椭圆形或不规则形状的非球形颗粒。在一些实施方案中,载体颗粒包括球形颗粒和非球形颗粒两者。在一些实施方案中,载体颗粒被设置为在一定尺寸范围内(例如,在一定的正或负标准偏差或变异系数内)大体上相同的载体颗粒的均匀群体,但载体颗粒不必相同,条件是它们有效地携带荧光标记的多核苷酸链并将其递送至反应阱。
76.载体颗粒可以由适于本发明目的的任何材料制成。在一些实施方案中,载体颗粒是金属颗粒,诸如金属纳米颗粒。在一些实施方案中,载体颗粒是金纳米颗粒。在一些实施方案中,载体颗粒是银纳米颗粒。在一些实施方案中,一个或更多个载体颗粒包含允许颗粒通过磁场被移动的一种或更多种磁性材料,诸如铁或氧化铁。在一些实施方案中,载体颗粒是氧化铁颗粒。在一些实施方案中,载体颗粒是二氧化硅颗粒或受控孔玻璃颗粒。
77.在一些实施方案中,载体颗粒包含用于结合附接或缔合待测序的荧光标记的多核
苷酸链的生物素部分或抗原部分的固定化蛋白,诸如链霉亲和素或抗原特异性抗体。在一些实施方案中,载体颗粒是用于结合一种或更多种生物素化的寡核苷酸或抗原-寡核苷酸缀合物的蛋白,诸如链霉亲和素或抗体。
78.荧光标记的多核苷酸链可以通过任何合适的手段附接至载体颗粒。通常,荧光标记的多核苷酸链通过捕获部分附接至载体颗粒。捕获部分通常包括彼此具有相互亲和力的部分对(也称为―结合对”)的成员。在一些实施方案中,捕获部分是多肽诸如抗体或抗原。在一些实施方案中,捕获部分是与待测序的荧光标记的多核苷酸链中的序列互补或与待测序的荧光标记的多核苷酸链缔合的寡核苷酸。
79.捕获部分可以是单价的(用于捕获一个结合配对体)或多于一价的(用于捕获多于一个结合配对体)。亲和素是单价捕获部分的实例,并且具有四个生物素结合位点的链霉亲和素是多价捕获部分的实例。在一些实施方案中,捕获部分包括抗体(用于特异性结合一个或两个抗原)。更一般地,捕获成员可以是结合对中的任何成员,对于该结合对,该对的另一成员与荧光标记的多核苷酸链缔合,以促进荧光标记的多核苷酸链附接至载体颗粒。
80.通常,如果载体颗粒本身不是捕获部分(例如,如果载体颗粒不是链霉亲和素、抗体或另一单价或多于一价的实体),则载体颗粒包含至少一个,并且优选地多于一个捕获部分,通过这些捕获部分,荧光标记的多核苷酸链可以直接或间接地附接至载体颗粒。
81.捕获部分通常通过接头附接至载体颗粒。可以使用任何合适的接头。由于本发明的外切核酸酶裂解和其他要素通常在水性溶液中进行,因此接头通常是亲水性的。示例性接头包括聚合物,诸如聚乙二醇、聚酰胺、聚(聚乙二醇磷酸酯)、聚烷基磷酸酯、多胺等。这样的接头可以具有任何合适的长度。在下文的实施例1中描述了一些说明性接头和缀合方法。
82.用于将捕获部分附接至载体颗粒的示例性官能团对及其所得的连接示于下文的表1中。
83.表1
84.载体颗粒寡核苷酸连接氨基nhs(n-羟基琥珀酰亚胺)酰胺-nh-c(=o)-氨基羧基酰胺-nh-c(=o)-羧基氨基酰胺-c(=o)nh-硫醇硫醇二硫键-s-s-金硫醇硫醇化金-au-s-叠氮化物dbco或bcn环加成加合物马来酰亚胺硫醇迈克尔加合物
85.荧光标记的多核苷酸链通过任何合适的手段固定在(附接至)载体颗粒上。在一些实施方案中,荧光标记的多核苷酸链各自通过使用样品模板链的核酸聚合酶介导的模板依赖性引物延伸来合成。在一些实施方案中,从溶液中的样品模板核酸链合成荧光标记的多核苷酸链,然后将荧光标记的多核苷酸链附接至载体颗粒。在一些实施方案中,在样品模板核酸链与附接至载体颗粒的互补引物(用作―捕获部分”)杂交之后,通过聚合酶介导的引物延伸在载体颗粒上合成荧光标记的多核苷酸链。
86.在一些实施方案中,载体颗粒包含与样品核酸链的序列互补的一个或更多个寡核
苷酸。在一些实施方案中,载体颗粒包含与荧光标记的多核苷酸链的序列互补的一个或更多个寡核苷酸。在一些实施方案中,一个或更多个寡核苷酸通过其5’末端偶联至载体颗粒。在一些实施方案中,一个或更多个寡核苷酸通过其3’末端偶联至载体颗粒。
87.在一些实施方案中,例如,当寡核苷酸通过其5’末端偶联至载体颗粒时,可以通过作为引物的寡核苷酸的3’末端(3
’‑
羟基)的聚合酶介导的模板依赖性延伸在载体颗粒上合成荧光标记的多核苷酸链。将样品核酸与固定化寡核苷酸杂交,使得寡核苷酸的3’末端与待测序的样品核酸链区域上游的序列区域杂交。在存在包括对应于atp、ctp、gtp和ttp或utp中的一种或更多种的荧光标记的核苷酸三磷酸的一种或更多种不同的核苷酸三磷酸的情况下,聚合酶通过将作为引物的固定化寡核苷酸的3’末端延伸,将互补的标记的核苷酸掺入到成为荧光标记的链的生长的引物延伸产物中,从而合成与杂交的样品核酸链互补的荧光标记的多核苷酸链。
88.在一些实施方案中,如以上所述,荧光标记的多核苷酸链可以使用非固定化引物在溶液中形成。引物与待测序的样品核酸链区域上游的互补样品核酸序列杂交。在存在一种或更多种不同的荧光标记的核苷酸三磷酸的情况下进行聚合酶介导的引物延伸之后,可以使所得的杂交复合物(包括与新合成的荧光标记的多核苷酸链杂交的样品核酸链)与已固定在载体颗粒上的捕获寡核苷酸接触,使得荧光标记的多核苷酸链通过样品链/荧光标记的多核苷酸链复合物与捕获寡核苷酸的杂交变为固定在载体颗粒上。
89.在一些实施方案中,在使用非固定化引物在溶液中形成荧光标记的多核苷酸链之后,所得的样品链/荧光标记的多核苷酸链杂交复合物通过捕获寡核苷酸与样品核酸链中的序列的杂交被固定在载体颗粒上。
90.在一些实施方案中,在使用非固定化引物在溶液中形成荧光标记的多核苷酸链之后,所得的样品链/荧光标记的多核苷酸链杂交复合物通过捕获寡核苷酸与荧光标记的多核苷酸链中的序列的杂交被固定在载体颗粒上。例如,样品链/荧光标记的多核苷酸链杂交复合物可以通过捕获寡核苷酸与用于合成荧光标记的多核苷酸链的引物中的序列的杂交被固定在载体颗粒上。
91.在一些实施方案中,引物包括非多核苷酸亲和部分,诸如生物素或抗原部分,并且载体颗粒包含链霉亲和素部分或抗体部分,使得在使用非固定化引物在溶液中形成荧光标记的多核苷酸链之后,所得的样品链/荧光标记的多核苷酸链杂交复合物通过固定化链霉亲和素部分与生物素部分之间(或固定化抗体与抗原部分之间)的结合被固定在载体颗粒上。
92.如以上所述,本发明的荧光标记的多核苷酸链使用一种或更多种外切核酸酶裂解。选择大体上没有内切核酸酶活性的外切核酸酶,以确保外切核酸酶仅从荧光标记的链的远侧末端裂解单个连续的单核苷酸。外切核酸酶可以是3’特异性外切核酸酶或5’特异性外切核酸酶,并且外切核酸酶可以裂解以单链或双链形式提供的荧光标记的链。
93.可以使用任何合适的外切核酸酶。外切核酸酶可以是天然的(即,具有存在于自然界中的化学结构)或相对于其天然结构被修饰的,并且可以来自其天然来源或来自重组宿主。例如,外切核酸酶可以在分离或纯化之后被化学修饰,并且也可以通过组合和重组技术产生,包括例如筛选具有期望特性的外切核酸酶。示例性3’特异性外切核酸酶包括例如大肠杆菌外切核酸酶iii、外切核酸酶x、酵母tatd外切核酸酶xi、t7 dna聚合酶的3’外切核酸
酶活性、t4 dna聚合酶的3’外切核酸酶活性、3’外切核酸酶活性大肠杆菌dna聚合酶i klenow片段、dna聚合酶的3’外切核酸酶活性、deepdna聚合酶的3’外切核酸酶活性、高保真dna聚合酶的3’外切核酸酶活性、热启动高保真dna聚合酶的3’外切核酸酶活性、高保真dna聚合酶的3’外切核酸酶活性和phi29dna聚合酶的3’外切核酸酶活性。示例性5’特异性外切核酸酶包括例如t7外切核酸酶、taq dna聚合酶的5’外切核酸酶活性、热启动taq dna聚合酶的5’外切核酸酶活性和bst dna聚合酶的5’外切核酸酶活性。
94.在一些情况下,外切核酸酶可以裂解以单链存在或以双链结构存在的链。例如,酵母tatd外切核酸酶xi能够以3’至5’方向裂解呈单链形式或双链形式的核酸链。
95.具有3’外切核酸酶活性和5’外切核酸酶活性两者的核酸酶包括,例如大肠杆菌dna聚合酶i、dna聚合酶和taq dna聚合酶。如果反应混合物中的多核苷酸链全都不可被另一(例如5’至3’)外切核酸酶活性裂解,则这样的外切核酸酶可以不经修饰地使用,以利用其外切核酸酶活性之一(例如3’至5’)来裂解荧光标记的多核苷酸链。可选地,修饰这样的外切核酸酶,例如通过重组或化学修饰,以保留期望的外切核酸酶活性并使不想要的外切核酸酶活性失活可能是期望的。
96.对单链核酸具有外切核酸酶活性的外切核酸酶包括,例如大肠杆菌rna酶t、大肠杆菌外切核酸酶i、大肠杆菌热不稳定外切核酸酶i、大肠杆菌外切核酸酶vii、绿豆核酸酶、毒液外切核酸酶、外切核酸酶vii、recjf外切核酸酶和bal-31外切核酸酶。
97.就上述任何酶(例如,聚合酶)具有除了外切核酸酶活性之外的其他酶活性来说,选择反应条件来抑制那些活性,使得它们不干扰根据本发明的多核苷酸测序。例如,在一些实施方案中,在不包含为聚合底物的任何标准核苷酸5-三磷酸的外切核酸酶裂解反应条件下,聚合活性将是可忽略不计的或不存在。
98.在本文公开的本发明的一些方面,固态基底包括顺式侧和反式侧。基底包括限定反应体积的反应阱。反应阱包括(i)在基底的顺式侧与反式侧之间延伸的近侧通孔,(ii)一个或更多个侧壁,以及(iii)远侧开口。固态基底还包括不透明金属层,该不透明金属层大体上阻止入射在基底的反式侧上的激发光穿透到反应阱的反应体积中及穿透到基底的顺式侧。
99.用于容纳待测序的荧光标记的多核苷酸链的反应阱可以具有各种形状和尺寸中的任何一种。例如,尽管具有圆形截面和平行侧壁的圆柱形阱是合适的,但反应阱也可以具有椭圆形、三角形、正方形、矩形、五边形、六边形、八边形或其他规则或不规则的截面形状,具有平行或非平行的侧壁。例如,具有上述任何形状的反应阱的侧壁可以是平行的、锥形的、截锥形的或沙漏形的。例如,圆柱形阱可以被认为具有固有地与自身平行的单一侧壁。
100.反应阱可以具有使用者可以选择的各种尺寸中的任何一种。具体尺寸的选择可以考虑将被测序的荧光标记的链的选择的长度和最小直径,荧光标记的链是单链还是双链形式,以及任何其他相关考虑。
101.通常选择反应阱的深度和最小直径使得每个反应阱可以容纳(1)待测序的荧光标记的多核苷酸链的远侧末端,以及(2)在末端单核苷酸的核酸切割裂解期间与链的远侧末端结合的外切核酸酶分子。
102.如本文使用的,―最小直径”意指反应阱或通孔的最短直径(如适用)。例如,圆柱体具有单一直径,其为最小直径。对于具有垂直于反应阱的深度轴的正方形顶截面的反应阱,最小直径是反应阱的两个相对壁之间(且垂直于壁)的距离(正方形截面的一边的长度),而最大直径是穿过正方形截面的对角线的长度。对于具有锥形或其他非平行壁的反应阱,反应阱的最小直径是阱的截面中最短的尺寸。更一般地,远侧开口和从远侧开口延伸的反应阱的至少一部分具有满足以上要求(1)和(2)的最小直径。因此,如果反应阱的远侧开口具有特定的最小直径,则从远侧开口朝向阱的通孔延伸的反应阱的至少一部分或全部的最小直径等于或大于反应阱的远侧开口的最小直径。在一些实施方案中,近侧通孔可以具有与远侧开口的直径和由一个或更多个侧壁限定的反应体积的直径大体上相同的直径。
103.在一些实施方案中,反应阱或反应阱的远侧开口具有至少30nm、或至少40nm、或至少50nm、或至少60nm、或至少70nm、或至少80nm、或至少90nm或至少100nm的最小直径。在一些实施方案中,反应阱具有小于150nm、或小于120nm、或小于100nm、或小于90nm或小于80nm的最小直径。在一些实施方案中,反应阱具有30nm至250nm、或30nm至150nm、或30nm至120、或30nm至100、或30nm至90nm、或50nm至150nm、或50nm至120nm、或50nm至100nm、或50nm至90nm或80nm至120nm的最小直径。
104.反应阱的深度通常被选择为长于将被外切核酸酶裂解以产生序列信息的荧光标记的多核苷酸链区段的长度。双链dna具有相对刚性的棒状外形,具有每3.6埃(0.36nm)约一个碱基对的单位长度。因此,包含1000个连续碱基对的dsdna区段具有约360nm的长度。因此,400nm的反应阱深度可以适于包封固定化的1000bp dsdna,而不会使dsdna的远侧末端暴露于不想要的激发光,并且500nm的阱深度可以提供甚至更好的保护以免于不想要的激发光影响。可选地,对于单链dna或rna链,400nm的反应阱深度可以包封具有多于1000个连续碱基的固定化的荧光标记的链,而不会使ssdna的远侧末端暴露于不想要的激发光,因为单链核酸比双链核酸刚性小且具有更小的直径。
105.在一些实施方案中,反应阱具有至少150nm、或至少200nm、或至少300nm、或至少400nm或至少500nm的阱深度。在一些实施方案中,反应阱具有小于1000nm、或小于800nm、或小于700nm、或小于600nm或小于500nm的阱深度。在一些实施方案中,反应阱具有150nm至1000nm、或150nm至800nm、或150nm至700nm、或150nm至600nm或150nm至500nm的阱深度。在一些实施方案中,反应阱具有200nm至1000nm、或200nm至800nm、或200nm至700nm、或200nm至600nm或200nm至500nm的阱深度。在一些实施方案中,反应阱具有300nm至1000nm、或300nm至800nm、或300nm至700nm、或300nm至600nm或300nm至500nm的阱深度。在一些实施方案中,反应阱具有400nm至1000nm、或400nm至800nm、或400nm至700nm、或400nm至600nm或400nm至500nm的阱深度。
106.如以上所述,反应阱还包括在基底的顺式侧与反式侧之间延伸的近侧通孔。这里,―近侧”通孔意味着通孔比相关反应阱的远侧开口更靠近基底的顺式侧。每个近侧通孔具有以下最小直径,即(1)足够大以允许荧光标记的多核苷酸链的远侧末端被电场拉入通孔并穿过通孔,并且(2)足够小以防止荧光标记的链附接至的载体颗粒穿过通孔到达基底的反式侧。优选地,近侧通孔的最小直径足够小,以防止任何外切核酸酶分子穿过近侧通孔从基底的反式侧到达顺式侧。在一些实施方案中,每个近侧通孔具有小于外切核酸酶最小尺寸的最小直径。
107.在一些实施方案中,近侧通孔具有至少2nm的最小直径。在一些实施方案中,近侧通孔具有2nm至50nm、或3nm至50nm、或5nm至50nm、或10nm至50nm、或20nm至50nm、或2nm至40nm、或3nm至40nm、或5nm至40nm、或10nm至40nm、或20nm至40nm、或3nm至30nm、或5nm至30nm、或10nm至30nm、或2nm至20nm、或3nm至20nm、或5nm至20nm、或10nm至20nm、或2nm至10nm、或3nm至10nm或5nm至10nm的最小直径。
108.在一些实施方案中,近侧通孔具有至少10nm、或至少15nm、或至少20nm、或10nm至60nm、或10nm至50nm、或10nm至40nm、或20nm至60nm、或20nm至50nm、或20nm至40nm、或30nm至60nm、或30nm至50nm的纵向厚度。
109.在一些实施方案中,基底包括包含近侧通孔的薄膜层。在一些实施方案中,薄膜层包括氮化硅(sin)。
110.包括用于在本发明中使用的反应阱的基底可以通过任何合适的方法以包括但不限于以下的各种形式的固体材料制造:硅类(例如si3n4、sio2)、金属、金属氧化物(例如al2o3)、塑料、玻璃、半导体材料及其组合。用于制造固态基底的制造技术可以见于以下通过引用并入的示例性参考文献中:golovchenko等人,美国专利6,464,842;sauer等人,美国专利7,001,792;su等人,美国专利7,744,816;meller等人,国际专利公布wo2009/020682;yan等人,nano letters,5(6):1129-1134(2005);wanunu等人,nano letters,7(6):1580-1585(2007);dekker,nature nanotechnology,2:209-215(2007);storm等人,nature materials,2:537-540(2003);zhe等人,j.micromech.microeng.,17:304-313(2007)等。
111.固态基底包括在本文中称为不透明金属层的一个或更多个阻光层。每个不透明金属层反射和/或吸收来自激发光束的入射光,从而(1)保护反应阱中和基底顺式侧上的荧光标记的链免于光漂白和由入射光引起的其他损伤,以及(2)防止入射光引起荧光标记的链中的标记物被外切核酸酶从标记的链上裂解之前发荧光,潜在地干扰来自被裂解的荧光标记的单核苷酸的正确荧光信号。
112.不透明金属层可以包括例如sn、al、v、ti、ni、mo、ta、w、au、ag或cu和/或其合金或组合。在一些实施方案中,不透明金属层包含al、au、ag或cu。在一些实施方案中,不透明金属层包含铝(al)或金(au)。不透明金属层的组成可以基于入射光的金属反射率的波长依赖性来选择。对于本发明中的荧光检测,入射光通常处于约380nm至约740nm范围内的可见光光谱中。铝表现出跨整个可见光谱的约90%的反射率,使其成为用作不透明层的良好候选。金表现出对约260nm至约480nm之间的波长的约35%的反射率,并且然后对约480nm至700nm之间的波长的反射率急剧上升,对大于约550nm的波长的反射率超过约90%。因此,金具有跨可见光光谱(特别是对高于约480nm的波长,特别是在红色和红外区中)的良好的阻光特性。银对高于约350nm的波长具有高于约80%的反射率。
113.在一些实施方案中,基底包括两个或更多个不透明金属层。例如,基底可以包括金层和铝层,这两者都反射和/或吸收作用于基底的反式侧上的入射光。在一些实施方案中,基底包括铝层上的金层,使得铝层比金层更靠近基底的顺式侧。具有金顶层(其也可以被称为外部金层或远侧金层,并且其包围反应阱的远侧开口)的一个益处是,金可增强反应阱的远侧开口周围的光激发强度,从而增加来自扩散通过激发区的每个释放的荧光标记的单核苷酸的荧光信号的产量。在一些实施方案中,基底包括金层上的远侧铝层,使得金层比铝层更靠近基底的顺式侧。
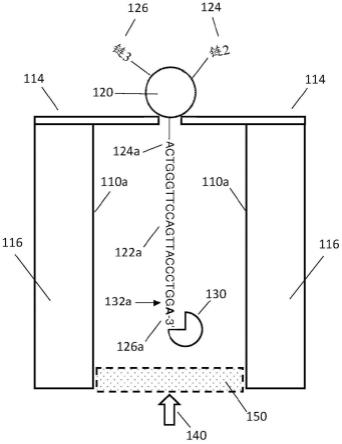
114.不透明金属层的厚度可以变化,并且取决于构成该不透明层的材料的物理特性和化学特性。在一些实施方案中,不透明层的厚度可以是至少40nm、或至少80nm、或至少120nm、或至少200nm或至少300nm。在其他实施方案中,不透明层的厚度可以在50nm至700nm的范围内;在其他实施方案中,不透明层的厚度可以在从100nm至600nm的范围内。如果基底包括多于一个不透明金属层,则―厚度”是指每个单独层的厚度。
115.不透明金属层不需要阻挡(即反射或吸收)来自激发光束的100%的光。在一些实施方案中,不透明金属层或多于一个不透明金属层(如果存在多于一个层)阻挡入射在距离反应阱的近侧通孔50nm的深度处的反应阱的远侧开口上的激发光的至少30%、至少50%、或至少90%、或至少95%、或至少99%、或至少99.5%或至少99.9%。
116.不透明层可以通过各种技术制造。可以使用材料沉积技术,包括例如,化学气相沉积、电沉积、外延生长、热氧化、物理气相沉积(包括蒸发和溅射)、casting。在一些实施方案中,可以使用原子层沉积,例如美国专利6,464,842;wei等人,small,6(13):1406-1414(2010),将它们通过引用并入。
117.固态基底可以包括其他层。例如,固态基底可以包括一个或更多个非不透明层以增加基底中一个或更多个反应阱的深度。这样的介电层可以包括例如,sio2、tio2。
118.在一些实施方案中,固态基底可以包括两个其他层之间的薄黏合层,以增强层的稳定性并防止脱层或其他类型的损坏。例如,在金层与铝层之间包括薄黏合层可以增强固态基底中金层的黏合,如由aouani等人,acs nano 3(7):2043-2048(2009)教导的。这样的薄黏合层可以包括任何合适的材料,包括例如铬、钛、二氧化钛、氧化铬或镍。薄黏合层可以具有任何合适的厚度。例如,薄黏合层可以具有1nm至40nm或5nm至20nm的厚度。在一些实施方案中,当薄黏合层距离反应阱的远侧开口数十或数百纳米时,薄黏合层对扩散通过激发区的荧光标记的单核苷酸的荧光产量具有可忽略不计的影响或没有影响。在一些实施方案中,当薄黏合层在反应阱的远侧开口的边缘附近(例如,在10nm或20nm或30nm内)时,可以选择薄黏合层的厚度和组成以提供激发区中荧光激发的最佳增强。在一些实施方案中,固态基底包括多于一个薄黏合层。例如,固态基底可以包括第一不透明金属层与第二不透明金属层之间的第一薄黏合层,以及第二不透明金属层与介电层(诸如sio2或sin)之间的第二薄黏合层。
119.在一些实施方案中,固态基底包括具有用于各种目的的多于一层的多层结构。示例性多层结构包括具有从左至右列出的从顺式侧至反式侧的以下层的基底:
120.(1)sin(30nm)、cr(5nm)、au(300nm)
121.(2)sin(30nm)、al(200nm)、cr(5nm)、au(300nm)
122.(3)sin(30nm)、sio2(200nm)、cr(5nm)、au(300nm)
123.(4)sin(30nm)、sio2(200nm)、al(200nm)、cr(5nm)、au(300nm)
124.(5)sin(30nm)、al(400nm)
125.通孔可以用各种材料(括但不限于氮化硅、二氧化硅(sio2)等)在固态膜中制造。虽然氮化硅通常符号为si3n4(指示si:n化学计量为3:4),但可以使用具有硅和氮化物的其他化学计量比的硅/氮混合物。例如,接近3:4但在3:4与4:4之间的si:n化学计量可以比si3n4具有更低的结构应力。
126.一般而言,本发明的方法和基底不包括或不需要蛋白纳米孔或脂质双层,从而避
免其复杂性和不稳定性问题。
127.固态通孔可以以各种方式制备,如在以上引用的参考文献中例示的。在一些实施方案中,可以使用氦离子显微镜在各种材料中钻出合成通孔,例如,如yang等人,nanotechnology,22:285310(2011)中公开的。支撑已被加工成独立的膜的薄膜材料(例如氮化硅)的一个或更多个区域的芯片被引入到氦离子显微镜(him)室中。在显微镜被设置为低放大率时使用him电机控制将独立的膜带入离子束的路径。在与独立的膜相邻但在固体基底上的区域调节包括焦点和消像散(stigmation)的束参数。在参数被适当地固定后,芯片位置被移动,使得独立的膜区域被集中在离子束扫描区域上并且束被遮没(blank)。him视野被设置为足以包含整个预期的反应阱图案并且足以用于光学读出(即,取决于光学放大率、相机分辨率等)的尺寸(以微米计)。任选地,然后,在整个视野上以导致足以去除全部或大部分的膜自体荧光(如果有的话)的总离子剂量的像素驻留时间(pixel dwell time)使离子束栅格化(raster)一次(例如,参见wo 2014/066905)。然后将视野设置为适当的值(小于以上使用的值),以进行与对应的反应阱对齐的单个通孔或通孔阵列的光刻限定的磨铣(mill)。例如,通孔可以制成与对应的反应阱同轴或不同轴。图案的像素驻留时间被设置为产生一个或更多个预定直径的通孔,所述一个或更多个预定直径任选地在样品处理之前通过使用校准样品确定。对单个芯片上的每个期望的区域和/或对引入到him室中的每个芯片重复这整个过程。在下文的实施例1中提供了根据本发明制备包括包含通孔的反应阱的基底的另外的指导。
128.反应阱的深度和直径,以及基底的一个或更多个不透明金属层的类型和厚度也可以选择为实现阱中离开远侧开口并朝向近侧通孔的激发光的可接受水平或使其最小化。通常,入射在阱的远侧开口上的光的强度随着光朝向通孔更深地进入阱而呈指数减弱,使得大部分反应体积大体上是暗的,特别是在近侧通孔附近。当不透明金属层包围反应阱的远侧开口时尤其如此。这种现象的益处是,反应阱中的大部分或全部荧光标记的多核苷酸链被保护免于入射光的不想要的激发。这减少了背景荧光和荧光标记的链的不想要的修饰或降解。因此,较深的阱提供了免于入射光的更大保护,使得比具有相同直径但较小深度的反应阱更大比例的反应阱大体上无光。较深的阱还提供用于更长的待测序的荧光标记的链的更大的空间。类似地,具有较小远侧开口的阱在远离远侧开口的阱中提供比用较大远侧开口提供的黑暗更大的黑暗。这些一般趋势在例如下文的表2中说明,表2示出了在使用lumerical(2020年3月)软件(从lumerical inc.,vancouver,canada可得)的模拟中测量的光强度。更具体地,对于距离阱(具有铝侧壁)的通孔50nm的阱深度的强度被计算为远侧开口处入射光强度(640nm)的分数。
129.表2
130.阱直径(nm)阱深度(nm)强度501504
×
10-4
1001501.5
×
10-2
502505
×
10-8
1002501
×
10-4
131.在一些实施方案中,每个反应阱具有由下表3中的组合所例示的深度和最小直径的组合。
132.表3
[0133][0134]
基底,特别是将与反应组分接触的基底表面也可以涂覆一个或更多个涂层,以赋予期望的特性,诸如对缓冲液或反应组分(诸如外切核酸酶、荧光标记的多核苷酸链、释放的单核苷酸和/或其他反应组分或缓冲液组分)惰性、无反应性或无亲和力。
[0135]
在一些实施方案中,可以将一个或更多个涂层施加至基底的可以接触本发明的方法中使用或产生的一种或更多种缓冲组分和/或反应组分的表面(在本文中也称为基底的―内表面”)。例如,这样的涂层可以帮助钝化反应阱的表面,以减少它们对外切核酸酶和/或单核苷酸的亲和力。这样的涂层还可以用于保护金属组分免于氧化或其他降解过程,或减少可以产生沿阱壁的水性流的缓冲离子沿这样的表面的电渗流(eof)。
[0136]
在一些实施方案中,反应阱的内表面、通孔的内表面、或反应阱和通孔两者的内表面包括至少一个涂层。在一些实施方案中,施加单个涂层。在一些实施方案中,施加多于一个涂层。在一些实施方案中,当施加多于一个涂层时,涂层是相同的。在一些实施方案中,当施加多于一个涂层时,涂层是不相同的。这样的涂层可以具有使用者选择的任何合适厚度。例如,涂层可以具有1nm至20nm、或1nm至10nm、或2nm至10nm或5nm至10nm的厚度。优选地,涂层厚度大体上是均匀的,如可以通过各种方法诸如原子层沉积(ald)提供的。
[0137]
在一些实施方案中,涂层包括无机涂层。在一些实施方案中,无机涂层包括包含hfo2、al2o3、sio2、tio2、sin或pt的膜。这样的涂层可以通过任何合适的方法制成。例如,这样的涂层可以通过ald添加。这样的涂层特别适用于涂覆多种金属表面,诸如铝、铜和金,并且也适用于涂覆多种其他类型的材料表面,诸如硅和氮化硅。在其中基底包括金层的一些实施方案中,金表面可以用有机硫醇化合物涂覆。例如参见li等人,bioconjugate chem.24(11):1790
–
1797(2013)。在其中基底包括非金金属或金属氧化物层的一些实施方案中,金属或金属氧化物表面可以用含膦酸的化合物涂覆,诸如由mutin等人,chemical materials 16:5670-5675(2004),gao等人,langmuir 12:6429-6435(1996)和zoulalian等人,j.physical chemistry b 110:25603-25605(2006)教导的。
[0138]
在一些实施方案中,基底包括包含聚乙烯吡咯烷酮的动态涂层,所述动态涂层可以存在于进行本发明的测序方法的缓冲液中。这样的涂层可以特别适于涂覆例如sin、sio2和金属氧化物。在一些实施方案中,这样的涂层可以减少外切核酸酶、单核苷酸或其他缓冲液或反应组分的非特异性结合。
[0139]
在一些实施方案中,固态基底包括如本公开内容中描述的多于一个反应阱,每个
反应阱可以包含用于测序的荧光标记的多核苷酸链。多于一个反应阱可以布置成任意构造,诸如随机或非随机构造,并且通常设置在平面内。在一些实施方案中,反应阱被配置为阵列,以促进并行地进行多于一个测序反应。在一些实施方案中,阵列包括布置成线性阵列的多于一个反应阱。在一些实施方案中,阵列包括布置成行和列的二维阵列的多于一个反应阱。在一些实施方案中,反应阱被规则地间隔开,例如,以直线模式,其中平行行垂直于平行列(即,类似于相距90度的x轴和y轴)。在一些实施方案中,行不垂直于列。例如,行可以彼此平行,但列可以以非90度角延伸,诸如相对于行45度或60度。在一些实施方案中,反应阱可以配置为六边形阵列,其中阱的列相对于行的方向以60度角从行延伸。在一些实施方案中,每行中的相邻阱彼此间隔相同的距离。在一些实施方案中,每列中的相邻阱彼此间隔相同的距离。在一些实施方案中,每行和每列中相邻阱之间的间距彼此间隔相同的距离。在一些实施方案中,相邻行之间的间距不同于相邻列之间的间距。
[0140]
当固态基底包括多于一个反应阱时,每个阱优选地与所有其他阱间隔一定距离,该距离允许从每个阱明确地检测荧光信号而不受来自任何其他阱的荧光信号的实质干扰。通常,相邻阱之间的最小距离取决于(1)被检测的荧光的最长波长,以及(2)信号检测器的像素分辨率。
[0141]
通常认为,当光源间隔为检测的光的波长的至少一半(λ/2)的距离时,实现来自两个相邻光源的光信号的光学分辨率,即使在光源的尺寸小于λ/2时(例如,当反应阱具有150nm、100nm或80nm的直径时)。然而,为了更好的分辨率,可以优选更大的间距,以使来自相邻阱的光信号的串扰干扰最小化。因此,对于从相邻阱发射的具有700nm波长的荧光信号,最小350nm(λ/2)的阱间距离可能足以提供两个信号的足够分辨率。然而,较大的阱间距离将可能提高信号分辨率和检测准确度。
[0142]
信号检测器可以具有使用者认为适当的任何合适的像素分辨率。例如,如果信号检测器的每个像素具有100nm
×
100nm的面积,并且每个反应阱具有100nm的直径,则来自每个阱的光信号通常针对每个阱使用多于一个检测器像素(例如,3
×
3像素面积/阱、或4
×
4像素面积/阱、或5
×
5像素面积/阱)来采集,以捕获从每个阱发射的大部分或全部光子。通常,使用更大数量的像素用于从阱进行信号检测将提供从每个阱采集的荧光信号的更高的光子产量(即,更高的信号强度),条件是像素面积不过于靠近下一相邻阱。
[0143]
在一些实施方案中,反应阱间隔至少1微米、或至少1.3微米、或至少1.5微米、或至少1.7微米或至少2微米。然而,也可以使用具有大于或小于这些阱间间隔距离的反应阱间隔距离的基底。
[0144]
在一些实施方案中,多于一个阱包括至少10乘以10个反应阱、或至少30乘以30个反应阱、或至少100乘以100个反应阱、或至少500乘以500个反应阱或至少1000乘以1000个反应阱的阵列。
[0145]
用于制备示例性固态基底的示例性程序也见于下文的实施例2中。
[0146]
如以上所述,在反应阱中使荧光标记的多核苷酸链与外切核酸酶反应从链的远侧末端释放单核苷酸,所述单核苷酸是荧光标记的单核苷酸或包括荧光标记的单核苷酸。在与荧光标记的链进行外切核酸酶反应期间,基底的反式侧用激发光照射,以产生与反应阱的远侧开口相邻的荧光激发区,使得扩散通过激发区的荧光标记的单核苷酸发射荧光信号,检测随时间变化的该荧光信号。以不同的方式表述,基底反式侧用激发光照射,以产生
与反应阱的远侧开口相邻的荧光激发区。在底物被照射时,荧光标记的多核苷酸链与外切核酸酶反应,使得单核苷酸从链的远侧末端连续释放并扩散通过荧光激发区,使得荧光标记的单核苷酸在激发区中发射荧光信号。
[0147]
检测随着时间变化的荧光信号,由此核苷酸序列根据从释放的荧光标记的单核苷酸检测到的荧光信号的时间顺序来确定。
[0148]
荧光信号的产生和检测可以使用任何合适的检测器来完成。检测器包括发射在同一时间或不同时间照射一个或更多个测序反应阱的光的激发源。
[0149]
通常,激发光包括为单色的光,即,所述光包括窄的波长范围。如果激发源发射为非单的色光,则所述光可以通过一个或更多个滤光器以阻止不期望的波长作用于反应阱。示例性光源包括激光器(例如,氩激光器)、发光二极管、激光二极管、和灯诸如氙灯和汞灯。在一些实施方案中,检测器包括一个或更多个自由空间激光器(free space laser)。在一些实施方案中,检测器包括一个或更多个光纤偶联激光器。
[0150]
在一些实施方案中,检测器包括多于一个光源,诸如两个或更多个激光器或发光二极管,各自具有选择的发射波长或发射波长范围,适于产生激发光,用于激发扩散通过每个反应阱的激发区的荧光标记的单核苷酸的选择的荧光标记物。
[0151]
在一些实施方案中,激发光是圆偏振的。在一些实施方案中,激发光是线偏振的。在一些实施方案中,激发光是非偏振的。在一些实施方案中,激发光包括具有488nm波长的光。在一些实施方案中,激发光包括具有532nm波长的光。在一些实施方案中,激发光包括具有640nm波长的光。在一些实施方案中,激发光包括具有730nm波长的光。
[0152]
在一些实施方案中,将激发光准直以照射一个或更多个反应阱,诸如可以被配置为阵列的多于一个反应阱。在一些实施方案中,将激发光聚焦,诸如在共聚焦显微镜配置中,其可以用于例如检测来自单个反应阱的荧光信号。
[0153]
对于采用多于一种荧光标记物的实施方案,即,当荧光标记的多核苷酸链包含含有不同鉴定性荧光标记物的不同核苷酸时,可以定制激发波长以平衡从不同荧光标记物发射的光的相对强度。平衡从不同荧光标记物发射的光的相对强度的另一种方法是基于由一个光源或更多个光源产生的激发波长来选择不同的荧光标记物。例如,由荧光标记物发射的荧光信号的强度可以通过以比对应于标记物的荧光发射波长的标记物的最大吸收波长(λmax,abs)短的波长激发标记物来减少。还可以选择不同的荧光标记和一个或更多个光源以平衡和优化不同荧光标记物的发射信号的分辨率。这可以通过选择具有视为区分来自不同标记物的信号所需的彼此相距尽可能远的发射波长的标记物来实现。例如,在一些实施方案中,选择具有比荧光标记的核苷酸中其他标记物的最近发射波长最大值大或小至少20nm、或至少25nm或至少30nm的发射波长最大值的标记物。标记物的选择也可以取决于由一个或更多个光源提供的激发波长。
[0154]
荧光检测可以使用各种检测模式中的任何一种来完成。合适的光检测器包括,例如,雪崩光电二极管检测器;光电倍增管;电荷耦合器件(ccd),诸如增强型ccd(iccd)和电子倍增ccd(emccd);互补金属氧化物半导体(cmos)检测器;共聚焦显微镜;和二极管阵列检测器。通常,检测器诸如ccd和二极管阵列包括用于从反应阱采集荧光信号的二维像素阵列。如以上所述,来自反应阱的荧光信号通常由检测器中的多于一个像素采集,以使来自该阱的光子采集最大化,使得可以正确地鉴定每个荧光标记物。像素通常被设计为检测包括
将由外切核酸酶裂解荧光标记的链释放的所有荧光标记物的波长的波长谱上的光子。
[0155]
荧光信号通常被连续监测,以获得检测的荧光信号的最大产量。荧光信号使用快于通过激发区的每个释放的单核苷酸发射的荧光信号的持续时间的帧频(frame rate)来检测和/或记录。帧频可以通过考虑由荧光标记的单核苷酸发射的单独光子或光子爆发(photon burst)的荧光信号强度和持续时间来选择。荧光信号通常在减去在不存在荧光单核苷酸的情况下测量的背景/基线荧光之后测量。
[0156]
本发明的包括反应阱的示例性固态基底示于图1a至图1d中截面图中。基底100包括顺式侧102a和反式侧102b。基底100还包括限定反应体积106的反应阱104。反应阱104包括(i)在基底的顺式侧与反式侧之间延伸的近侧通孔108,(ii)一个或更多个侧壁110a和110b,以及(iii)远侧开口112。可以为圆柱形或非圆柱形的近侧通孔108可以设置为穿过薄膜层114的开口。
[0157]
固态基底100还包括不透明金属层116,该不透明金属层116大体上阻止激发光穿透到反应体积中及从基底的反式侧穿透到顺式侧。尽管图1a-图1d描绘了包括单个不透明金属层的固态基底,但固态基底可以包括另外的层和材料,如本文别处所讨论的。
[0158]
参考图1a,反应阱104是圆柱形的,尽管反应阱可以具有其他非圆柱形的形状。反应体积106由层116的侧壁110a、薄膜层114的侧壁110b和反应阱的直径限定和包封,反应阱的直径由跨远侧开口112的虚线水平双头箭头指示。反应阱104的深度由虚线垂直双头箭头118示出。
[0159]
每个反应阱的最小直径应足够大,以允许至少一个外切核酸酶分子从基底的反式侧扩散通过远侧开口并进入反应阱,并结合和消化荧光标记的多核苷酸链的远侧末端。因此,每个反应阱的最小直径是或可以使其至少与所使用的外切核酸酶的最小尺寸或截面一样大。例如,对于具有6nm
×
6nm
×
6nm的x-y-z尺寸的外切核酸酶,50nm或100nm或150nm的最小直径各自都足够大,以提供足够的空间以便外切核酸酶扩散到反应阱中,并从荧光标记的多核苷酸链的远侧末端连续消化单核苷酸。
[0160]
当跨基底施加电场以影响装载有荧光标记的多核苷酸链的载体颗粒的移动或位置时,基底100的顺式侧102a与阳极(带负电荷)电极相连,并且基底100的反式侧102b与阴极(带正电荷)电极相连。
[0161]
固体基底的顺式侧和反式侧与一种或更多种水性缓冲液接触。在一些实施方案中,基底的顺式侧和反式侧上的缓冲液可以是相同的,除了在顺式侧上存在载体颗粒(如果存在)和在反式侧上存在外切核酸酶分子(如果存在)之外。在其他实施方案中,基底的顺式侧和反式侧上的缓冲液彼此不同。
[0162]
提供了适用于本发明的测序方法的缓冲组合物。通常,缓冲液包含缓冲分子,诸如hepes、mops、tris和磷酸盐,例如,以维持选择的ph(例如,参见关于―good buffers”的sigma-aldrich目录)。5mm至100mm的缓冲分子浓度通常是有用的,尽管也可以使用更高或更低的浓度。如果需要,还可以包括盐和其他添加剂,诸如nacl、licl、kcl和甘油(例如,10mm kcl至1mm kcl和/或1-60或1-70体积百分比的甘油)等,以及所使用的特定酶的适当的辅因子(例如,对于一些外切核酸酶为mgcl2或mncl2)。在一些实施方案中,缓冲液组合物被构成为将ph大体上恒定维持在6.0至8.8的范围内的值,尽管也可以使用具有更高或更低ph的缓冲液。例如,对于外切核酸酶iii和t4外切核酸酶,可以使用如下缓冲液1或缓冲液2,
其中dtt是二硫苏糖醇,ac是乙酸,并且bsa是牛血清白蛋白:
[0163]
缓冲液1:10mm bis-tris-丙烷-hcl、10mm mgcl2、1mm dtt,在25℃ph 7.5。
[0164]
缓冲液2:50mm kac、20mm tris-ac、10mm mgac2、100μg/ml bsa,在25℃ph 7.9。
[0165]
可以用于t4外切核酸酶的另一缓冲液是缓冲液3:
[0166]
缓冲液3:50mm nacl、10mm tris-hcl、10mm mgcl2、100μg/ml bsa,在25℃ph 7.9。
[0167]
为了将荧光标记的多核苷酸链递送至反应阱中,使包含一个或更多个载体颗粒(每个载体颗粒包含一个或更多个附接的荧光标记的多核苷酸链)的水性溶液与基底100的顺式侧102a接触。每个荧光标记的多核苷酸链包含(i)附接至载体颗粒的近侧末端,(ii)能够被外切核酸酶裂解的远侧末端,和(iii)至少一种包含荧光标记物的荧光标记的核苷酸。使用建立从基底的顺式侧至反式侧的电场的一组电极跨基底施加偏置电压,通常在基底的顺式侧上具有一个或更多个阳极电极(阳极),并且在基底的反式侧上具有一个或多个阴极电极(阴极)。电场将载体颗粒吸引至反应阱的通孔,使得载体颗粒上的荧光标记的多核苷酸链的远侧末端被拉入并穿过近侧通孔进入反应阱的反应体积中。
[0168]
然而,载体颗粒不穿过通孔。由于载体颗粒的最小尺寸大于通孔的最小直径,或者载体颗粒以其他方式太大而不能穿过通孔,因此载体颗粒保留在基底的顺式侧上。此外,当通孔定尺寸仅允许一条荧光标记的多核苷酸链经由通孔进入每个反应阱时,或者如果载体颗粒具有足够低的荧光标记的多核苷酸链的装载密度,则反应阱中仅存在一条荧光标记的多核苷酸链用于被外切核酸酶分子消化。
[0169]
通过跨基底(在顺式与反式侧之间)维持温和的偏置电压以保持载体颗粒邻近或压在通孔的顺式侧,载体颗粒和附接的荧光标记的多核苷酸链可以保持(维持)在适当的位置。载体颗粒不与通孔共价键合。偏置电压足够温和,使得其不会引起荧光标记的多核苷酸链从载体颗粒释放。温和的偏置电压可以与用于将载体颗粒吸引至通孔以将附接的多核苷酸链递送至反应阱的偏置电压相同或不同。
[0170]
图1b示出了示例性反应阱,其中载体颗粒120已经通过电场(通过偏置电压)移动至与通孔108的顺式侧相邻的位置。载体颗粒120包括三个荧光标记的多核苷酸链122a、122b和122c。每条链通过近侧末端(如所示的链122a通过近侧末端124a)附接至载体颗粒,并且远侧末端(如所示的链122a的远侧末端126a)能够被外切核酸酶裂解。链122a具有连续的核苷酸序列5
’‑
actgggttccagttaccctgga-3’(seq id no.:1),其中5’末端附接至载体颗粒120,并且3’腺苷酸(a)是远侧末端。对于图1b至图1d,链122a、链122b和链122c中的所有核苷酸都是荧光标记的核苷酸,其中每个包括将每个种类的核苷酸(a、c、g和t)与其他种类的核苷酸区分开的不同的荧光标记物。
[0171]
尽管图1b中的链122a被示出为仅具有单链形式,但应理解,荧光标记的多核苷酸链可以替代地以双链形式提供,或者还可以包含一个或更多个单链和双链区域。例如,如果荧光标记的多核苷酸链122a是完全双链的,则它将与包含序列5
’‑
tccagggtaactggaacccagt-3’(seq id no.:2)的互补链杂交,如下文示出的,其中互补核苷酸之间的碱基配对由垂直线表示:
[0172]
[0173]
如以上讨论的,如果荧光标记的多核苷酸链的远侧末端是双链的,则可以使用双链特异性外切核酸酶来裂解荧光标记的链的远侧末端。
[0174]
继续参考图1b,外切核酸酶可以通过使包含外切核酸酶分子的第二水性溶液与基底100的反式侧102b接触来引入,使得外切核酸酶分子(在这种情况下是用于裂解链122a的3’特异性单链裂解性外切核酸酶)可以与反应阱中的荧光标记的多核苷酸链的远侧末端结合,从链的远侧末端连续裂解单核苷酸并释放它们。外切核酸酶分子130结合多核苷酸链122a的远侧末端126a并且裂解3’末端a核苷酸与紧邻的g核苷酸之间的磷酸二酯键(由箭头132a指示)。
[0175]
在外切核酸酶与荧光标记的多核苷酸链反应期间,基底的反式侧用激发光140照射,以产生与反应阱的远侧开口相邻的荧光激发区150。应该注意,荧光激发区150(其被示为跨整个远侧开口的直径并在反应阱的反应体积的外部和内部都延伸的阴影区)不具有离散的边界。相反,激发区中入射光的强度主要集中在远侧开口附近,大致如图1a中所示,并且在反应阱更内部或外部(以上)的位置处快速减弱(例如,参见表2和上文的相关讨论)。然而,激发区的直径与反应阱远侧开口的直径相同或大体上相同。换言之,激发区不延伸至固态基底的远侧开口直径以外的区域。反应阱的入射光的三维强度谱还将取决于阱周围的固态基底材料(例如,铝、金或其他材料)的组成和其他特征。因此,如参考本发明使用的,―与反应阱的远侧开口相邻”意图指在跨过整个远侧开口的平面(并且限定反应体积的远侧末端)的正上方和正下方两者的空间,诸如在图1a中由箭头112边缘描绘的,以及反应阱内引起扩散通过该空间的释放的荧光标记的单核苷酸发射可检测荧光信号的任何其他附近照射空间。
[0176]
参考图1c,释放的单核苷酸128a(示为a*)扩散出反应体积并且通过荧光激发区150。当处于激发区中时,荧光标记的单核苷酸128a以多个(多于一个)光子(hν)的形式发射荧光信号,该荧光信号被检测器检测为腺苷酸单核苷酸(参见图2,下文进一步讨论)。值得注意的是,被动扩散为释放的荧光标记的单核苷酸能够到达激发区进行荧光激发和检测提供了充分的机制。在外切核酸酶裂解和检测期间,不需要并且本发明不包括水性溶液流入或流出反应阱的活动体积流(active bulk flow)。
[0177]
从链122a的初始3’末端a单核苷酸的核酸外切裂解和释放产生在其远侧末端具有3’末端g的较短的链122b。链122b的远侧末端与外切核酸酶130的反应裂解3’末端g核苷酸与紧邻的g核苷酸之间的磷酸二酯键(由箭头132b指示),产生更短的链122c和释放的单核苷酸128b(示为g*),如图1d中所示。释放的荧光标记的单核苷酸128b扩散出反应体积并且通过荧光激发区150,发射荧光信号(hν),该荧光信号(hν)被检测器检测为鸟苷酸单核苷酸。然后外切核酸酶130准备以与前两个3’单核苷酸相同的方式从链122c裂解下一个3’末端单核苷酸。
[0178]
随着消化沿着荧光标记的多核苷酸链继续进行,单核苷酸逐个释放,其中一些(或其中全部,在图1b-图1d中的链122abc的情况下)是荧光标记的单核苷酸。释放的单核苷酸通过扩散以比外切核酸酶的裂解速率大得多的速率离开反应阱,使得释放的荧光标记的单核苷酸连续进入并且穿过激发区进入反应阱反式侧上的大体积溶液(bulk solution)中。由于附接至荧光标记的多核苷酸链的载体颗粒对近侧通孔的封闭,因此大体上避免了单核苷酸通过近侧通孔的非有效益的扩散。
[0179]
如果外切核酸酶分子在荧光标记的链被完全消化之前从荧光标记的链解离,则来自溶液的另一个外切核酸酶与荧光标记的链的远侧末端结合并继续消化。消化继续进行,直到荧光标记的链短到外切核酸酶停止消化荧光标记的链,或者直到裂解反应或照射以其他方式终止。
[0180]
外切核酸酶介导的对荧光标记的多核苷酸链的消化被允许进行选择的消化时间,或者直到可靠的荧光信号的产量减少一定的量或低于选择的最小数量阈值或质量阈值。
[0181]
在一个或更多个反应阱中的一个或更多个荧光标记的多核苷酸链的外切核酸酶介导的裂解(有时也称为―外切核酸酶介导的消化”或―外切核酸酶消化”)结束后,反应阱可以通过以下方法重新装载新的荧光标记的多核苷酸链:向基底施加反向偏置电压以将载体颗粒移动离开通孔,使得从反应体积中移除任何剩余的荧光标记的多核苷酸链,并且然后向(跨)基底施加新的偏置电压,以用进入每个反应阱的不同的荧光标记的多核苷酸链重新装载每个反应阱(即,使得不同的荧光标记的多核苷酸链的远侧末端被递送到每个反应阱中),用于与外切核酸酶反应。装载到反应阱中的新的荧光标记的多核苷酸链可以来自相对于先前外切核酸酶裂解轮中提供荧光标记的多核苷酸链的载体颗粒相同或不同的载体颗粒。可以进行多于一轮(循环)将荧光标记的多核苷酸链装载到反应阱中并且使用外切核酸酶介导的裂解对链进行测序,直到采集到期望的量的序列数据或直到测序循环不再充分有效益。
[0182]
在一些实施方案中,使用约250mv至500mv的偏置电压以将附接的载体颗粒移动至反应阱的通孔,从而用荧光标记的多核苷酸链装载反应阱,尽管也可以使用更小或更大的偏置电压。在一些实施方案中,使用约250mv至500mv的电压将载体颗粒保持与通孔相邻,尽管也可以使用更小或更大的偏置电压。在一些实施方案中,使用约-250mv至-500mv的偏置电压将载体颗粒移动离开(―弹出(eject)”)反应阱,尽管也可以使用更小或更大的负偏置电压。
[0183]
重复使用载体颗粒将多于一条荧光标记的多核苷酸链递送至一个或更多个反应阱的一个优点是可以从单个固态基底和单个核酸样品对大量荧光标记的多核苷酸链测序。另一个优点是,从总核酸样品群体的更大比例中采集序列数据可以提高序列数据的完整性,减少空位,和/或增加冗余序列数据的采集,以对序列进行比对并且产生最佳共有序列。
[0184]
本发明的包括固态基底的示例性测序设备200示于图2中。具有顺式侧和反式侧的基底202与显微镜物镜222相邻放置,使得基底的反式侧面向透镜。将激发光递送至基底202中的一个或更多个反应阱的激发区,并且从该激发区接收荧光信号。光路通过虚线示出。
[0185]
该设备还包括激发光源204a和204b,以提供具有选择波长的激发光,诸如分别为532nm和640nm的波长,选择所述波长以激发通过外切核酸酶活性从荧光标记的多核苷酸链释放的单核苷酸的荧光标记物。这里,该设备包括两个光纤偶联激光光源204a和204b。来自光源204a和204b的具有不同波长的激发光束通过波长组合器(wc)206(基于光纤的波长组合器)、光纤连接器208、准直透镜210(例如,消色差双透镜,thorlabs#ac254-060-a)、任选的快门211,并且然后通过四分之一波片212(例如,消色差四分之一波片,thorlabs aqwp05m-600),以将来自激光器的线偏振光束转换成圆偏振光束。然后,光通过聚焦透镜214(例如,来自thorlabs ac254-400-a的消色差双透镜),以将光束聚焦至显微镜物镜的后焦平面,并且然后通过多带激发滤光器216(例如,来自chroma technology zet532/640x)。
在通过滤光器216之后,光从多带二向色分束器218(例如,chroma technology zt 532/640rpc)反射至反射镜220,通过显微镜物镜222,并反射到基底201的反式侧上。在一些实施方案中,显微镜物镜222是油浸显微镜物镜(例如,olympus apon60xotirf)。在一些实施方案中,物镜222是水浸显微镜物镜。在一些实施方案中,物镜222是空气显微镜物镜。
[0186]
激发光作用于基底200的反式侧,特别是作用于基底200的一个或更多个反应阱的一个或更多个远侧开口,产生与反应阱的远侧开口相邻的荧光激发区(参见图1b-图1d)。
[0187]
当荧光标记的单核苷酸从荧光标记的多核苷酸链的远侧末端连续释放并通过反应阱的远侧开口扩散出反应体积时,单核苷酸扩散通过激发区并响应于激发光发射荧光。所发射的荧光由显微镜物镜222采集和聚焦,并由反射镜220反射通过多带二向色分束器218、通过多带发射滤光器224(例如,chroma technology zet 532/640m)至二向色分束器226(例如,chroma technology t635lpxr)。在图2的设备中,通过二向色分束器226的发射的荧光由透镜228a(例如,olympus swtlu-c tube lens)聚焦,并且然后至检测器相机230a进行检测;并且由二向色分束器226反射的发射的荧光由透镜228b聚焦,并且然后至检测器相机230b进行检测(例如,hamamatsu c13440-20cu orca flash 4.0)。检测器相机230a和230b优选地是同步的,以适当地检测来自释放的荧光标记的单核苷酸的荧光信号的时间顺序。
[0188]
对于更多的颜色,可以用单个相机替代两个相机,并且可以使用棱镜替代聚焦透镜228a,通过该棱镜,发射的光信号按波长成角度地分离到检测器视野的不同区域上,用于单独定量和鉴定核苷酸特异性荧光信号。可选地,可以包括配有伴随透镜和分束器的第三和第四相机,以捕获多于两种不同的荧光信号。
[0189]
用于在本发明中使用的测序设备还可以包括用于采集和处理荧光信号数据的计算机和软件。
[0190]
由于在反应阱通孔与激发区之间的反应体积中的荧光标记的多核苷酸链的部分实质上不被照射,因此在荧光标记的链的该部分中的未被照射的荧光核苷酸不发射荧光信号,或者如果它们发射荧光信号,则这样的信号是可忽略不计的。只有在激发区中被激发的荧光单核苷酸才会发射被检测器检测到的荧光信号。此外,如果远侧开口由包括金的侧壁限定,则入射光的激发强度可以大于铝,从而提供荧光增强,换言之,提供更大通量荧光光子的用于检测。
[0191]
作用于每个反应阱的远侧开口的激发光可以被定向以便与基底表面正交,换言之,与每个反应阱的中心轴平行,例如,当反应阱呈圆柱形时。可选地,作用于每个反应阱的远侧开口的激发光可以被定向以便与基底表面非正交。
[0192]
还选择激发光的波长以与释放的单核苷酸的荧光标记物相容,使得当激发光作用于每个荧光标记物时,荧光标记物吸收激发光,并且然后发射具有比激发光的波长长(能量低)的波长的光子。与荧光标记物相关的最大吸收波长和最大发射波长之间的差称为斯托克斯位移。
[0193]
荧光信号使用快于最短时间窗的检测器帧频来检测,在最短时间窗期间,荧光标记的单核苷酸在其扩散通过激发区时发射单独光子或光子爆发。通常,释放的荧光标记的单核苷酸在10毫秒内、或20毫秒内或50毫秒内进入激发区,而荧光标记的单核苷酸通过外切核酸酶介导的裂解在约100毫秒与约10秒之间的时间间隔内逐个释放。通常,释放的荧光
标记的单核苷酸在从荧光标记的链裂解之后10毫秒内进入激发区。帧频也可以部分地基于存储器的大小和速度、信噪比和荧光信号强度来选择。
[0194]
外切核酸酶裂解速率和释放的荧光标记的单核苷酸的扩散时间(或扩散速度)可以通过改变反应参数诸如ph、黏度、温度和外切核酸酶的选择来调节。例如,黏度可以通过在基底反式侧上的水性缓冲液中包含黏度添加剂(诸如甘油,例如以1%至60%(v:v)、或1%至70%(v:v)或50%至70%(v:v)的浓度)来增加。在一些实施方案中,基底反式侧上的水性缓冲液包含约50%至约60%(v:v)甘油、或约50%至70%(v:v)甘油、或约50%(v:v)甘油、或约60%(v:v)甘油或约70%(v:v)甘油。在检测区中和周围存在增加的黏度可以有助于荧光检测期间减少单核苷酸扩散速度(并且提供更长的单核苷酸驻留时间),从而提供几个益处,诸如(1)由于对通过检测区的每个荧光单核苷酸采集更多发射光子而产生更高的荧光信号,(2)更高的信噪比,(3)如果需要,使用更低激光功率从而产生更少的热的能力,(4)从反应阱朝向相邻反应阱扩散的荧光单核苷酸的更少的交叉污染(如果有的话),(5)以及将反应阱更紧密地一起放置在阵列中的能力。
[0195]
每个释放的荧光标记的单核苷酸可以根据测量的荧光信号的以下特征鉴定(例如,鉴定为a、c、g或t):诸如(1)与每个不同种类的核苷酸缔合的荧光标记物的特定发射波长或荧光峰形,(2)信号强度,在通过反应阱的激发区期间,信号强度可以被测量为来自同一单核苷酸的多于一个光子的总和,以及(3)不存在来自任何其他释放的单核苷酸的荧光信号的贡献。例如,从第一反应阱的激发区扩散出来进入第二反应阱的激发区中的荧光标记的单核苷酸可以基于荧光标记的单核苷酸朝向第二阱的运动轨迹从对第二阱检测的荧光信号中排除。类似地,从第一反应阱的激发区扩散出来并且然后返回至第一反应阱的激发区的荧光标记的单核苷酸可以基于荧光标记的单核苷酸朝向第一反应阱返回的运动轨迹从对第一反应阱检测的荧光信号中排除。
[0196]
此外,本发明中使用的荧光标记的单核苷酸可以被选择为在基底的照射条件下对光漂白中度易感的,使得在单核苷酸标记物在第一反应阱的激发区中被检测之后,从激发区扩散出的荧光标记的单核苷酸在返回至同一激发区或扩散至另一激发区之前,被入射激发光大体上漂白,并因此被呈现为非荧光的。来自失活反应阱的荧光信号可以被计算机软件忽略。
[0197]
序列可以从包含相同或重叠序列区域的多个多核苷酸片段获得的序列数据组装。在一些实施方案中,多核苷酸序列的确定包括确定四种天然核苷酸全集的子集的序列,对于dna为a、c、g和t(或者对于rna为a、c、g或u),诸如,例如,靶多核苷酸的仅a和c的序列。在一些实施方案中,多核苷酸序列的确定包括确定靶多核苷酸内的四种类型的核苷酸中的一种、两种、三种或全部的身份、顺序和位置。在一些实施方案中,多核苷酸序列的确定包括确定靶多核苷酸内的四种类型的核苷酸中的两种、三种或全部的身份、顺序和位置。在一些实施方案中,多核苷酸序列的确定包括确定用作靶多核苷酸的指纹的靶多核苷酸的一个或更多个子序列,诸如独特地鉴定一组多核苷酸内的靶多核苷酸或一类靶多核苷酸的子序列,例如由细胞表达的所有不同的rna序列。
[0198]
本发明还提供了可以用于进行本发明方法的试剂盒。通常,试剂盒可以是用于递送用于实施本发明方法的材料或试剂的任何递送系统。在反应测定的上下文中,这样的递送系统包括允许反应试剂(例如,在适当的容器中的包含荧光标记物(诸如相互猝灭的荧光
标记物)的核苷酸5
’‑
三磷酸、酶、载体颗粒等)和/或支持材料(例如,缓冲液,用于进行测定的书面说明等)从一个位置至另一个位置的储存、运输或递送的系统。例如,试剂盒包括包含相关反应试剂和/或支持材料的一种或更多种外罩(例如,盒子)。这样的内含物可以一起或单独地被递送到预期的接收者。例如,第一个容器可以包含用于在测定中使用的酶,而第二个或更多个容器包含相互猝灭的荧光标记物。在一些实施方案中,试剂盒可以包括以下中的一种或更多种:外切核酸酶、模板依赖性dna聚合酶或rna聚合酶、一种或更多种荧光标记的核苷酸5
’‑
三磷酸、缓冲液和载体颗粒,所述载体颗粒包含亲和标记物,诸如亲和素、链霉亲和素、与待测序的多核苷酸互补的多核苷酸等。
[0199]
实施例1
[0200]
核酸与载体颗粒的缀合
[0201]
a.附接至载体颗粒的dna的选择与设计.为了将dna直接缀合至金或银纳米颗粒或者金或银表面,将单个或多于一个(2-6个)硫醇基团附接在寡核苷酸(5
’‑
gctatgtggcgcggtattat-3’)(seq id no.:3)的3’末端或5’末端上。单个硫醇从商业上可得的前体3
’‑
二硫化物或5
’‑
二硫化物(ch2)
n-s-s-(ch2)
n-oh(n=3或6)修饰的寡核苷酸(idt,iowa)获得。两个硫醇基团经由将商业上可得的3
’‑
氨基官能化或5
’‑
氨基官能化的寡核苷酸(idt,iowa或trilink)与(
±
)-α-硫辛酸缀合引入。可选地,多于一个硫醇用寡核苷酸的3’末端或5’末端上的1个、2个或3个连续的dtpa亚磷酰胺(idt,iowa)引入。为了将dna与官能化的纳米颗粒缀合,将适当的互补缀合基团(胺、硫醇、dbco、bcn)附接至寡核苷酸的3’末端或5’末端。在缀合部分与寡核苷酸之间引入各种长度的接头,以便促进酶与寡核苷酸序列的接近(例如,如果将使用固定在载体颗粒上的模板通过dna聚合酶或rna聚合酶合成与样品核酸链互补的荧光标记的多核苷酸链,则接近聚合酶)。接头的实例是胸苷单磷酸
×
n(n=1
–
40)、peg3、peg4、peg5和(peg6-p(o)(oh)o-)
×
n(n=1
–
12),其中peg意指聚乙二醇,并且对于n=3、4、5和6的pegn意指n个乙二醇单元的聚合物。
[0202]
b.dna与金纳米颗粒的缀合.在3’末端或5’末端处用非环状二硫基团(ch2)
n-s-s-(ch2)
n-oh(n=3或6),1个、2个或3个dtpa(来自idt,iowa)或(
±
)-α-硫辛酸官能化的寡核苷酸与过量50倍的还原剂(三(2-羧乙基)膦(tcep)或二硫苏糖醇(dtt)在ph 7.4的磷酸盐缓冲液中一起孵育45min。还原的硫醇官能化的寡核苷酸通过用填充有sephadex g-25的凝胶过滤柱和作为洗脱液的milli-q水脱盐纯化。
[0203]
将纯化的寡核苷酸与金纳米颗粒(10nm、15nm、50nm和100nm直径,来自sigma-aldrich)以不同摩尔比(100:1、300:1、500:1、1000:1、3000:1、10000:1、20000:1等)混合,并且用50mm柠檬酸盐-hcl缓冲液将ph调节为4.3,或用10mm磷酸钠缓冲液调节为ph 7.4或ph 8。将tween 20添加至0.02%、0.05%或0.1%的终浓度,或者替代tween 20,将sds添加至0.01%、0.025%或0.05%的终浓度。在环境温度初始孵育1小时至24小时之后,将4m nacl以小份添加多达1m总浓度。将反应混合物进一步孵育1小时至24小时。任选地,为了封闭金纳米颗粒上未反应的表面积(也称为―回填”),将水溶性寡聚物(乙二醇)-烷基硫醇(其中寡聚物(乙二醇)是peg3或peg6,并且烷基是(ch2)8–
(ch2)
12
)添加至反应混合物中(相对于硫醇修饰的寡核苷酸的可变比例:1:1、4:1、10:1、25:1、100:1)并将反应混合物孵育15min至24小时。寡核苷酸-纳米颗粒缀合物通过离心和用适当的缓冲液(例如10mm磷酸盐缓冲液ph 8与0.02% tween 20)多次洗涤来收获。纳米颗粒在进一步使用之前,在相同的
洗涤缓冲液中储存在4℃。
[0204]
为了对dna载量进行定量,寡核苷酸经由用kcn/k3[fe(cn)6]混合物或dtt蚀刻从纳米颗粒释放。释放的寡核苷酸使用sybr
tm gold或oligreen
tm
(thermofisher scientific)作为染色剂用荧光计定量。对于在存在至少一种荧光标记(cy3、cy5、cy7、alexa fluor488等)的脱氧核苷酸三磷酸(datp、dctp、dgtp或dutp)的情况下通过引物延伸获得的内部标记的寡核苷酸,在核苷酸从纳米颗粒释放之后,固有吸光度或荧光被用作定量的读数。可选地,使用合适地标记的互补寡核苷酸的可逆杂交进行定量。
[0205]
表4示出了用包含不同量的寡核苷酸5
’‑
gctatgtggcgcggtattat-3’(seq id no.:3,同上)的载体颗粒获得的dna载量数据,所述寡核苷酸作为缀合至金纳米颗粒的捕获部分和/或引物,用于在随后用荧光dntp进行的引物延伸或与单独制备的引物延伸产物的退火中使用。
[0206]
表4*
[0207][0208]
*t
40
是40-mer腺苷;au颗粒供应商是sigma aldrich(sa)、ted pella(tp)和cytodiagnostics(c);缀合条件为(1)磷酸盐ph 7.4,随后是1m nacl过夜(盐老化),或(2)50mm柠檬酸盐-hcl ph 4.3。
[0209]
c.氨基官能化的dna;酰胺偶联.将羧酸官能化的纳米颗粒(商业上可得的量子点、聚合物涂覆的金或铁氧化物纳米颗粒
–
例如来自sigma-aldrich的p/n 900226、747254、765481、900475,来自thermofisher scientific的p/n q21301mp,来自nanocs的p/n mp25-ca或来自ocean nanotech的p/n sc0050)悬浮在硼酸钠缓冲液(ph 8-9)中,并用n-(3-二甲基氨基丙基)-n
′‑
乙基碳二亚胺盐酸盐(edc
·
hcl;100
–
2000当量)和n-羟基磺基琥珀酰亚胺(sulfo-nhs,100-2000当量)在环境温度处理1小时至2小时。然后将氨基官能化的dna(1当量)添加至混合物中。任选地,以小份添加4m nacl至最多0.15m
–
0.5m(取决于特定纳米颗
粒的胶体稳定性)。将反应混合物孵育3小时至24小时。dna纳米颗粒缀合物通过离心和随后洗涤或通过尺寸排阻层析随后透析来纯化。
[0210]
d.dbco或bcn官能化的dna;无铜点击反应偶联.将羧酸官能化的纳米颗粒(商业上可得的量子点、聚合物涂覆的金或铁氧化物纳米颗粒
–
例如来自sigma-aldrich的p/n 900226、747254、765481、900475;来自thermofisher scientific的p/n q21301mp;来自nanocs的p/n mp25-ca或来自ocean nanotech的p/n sc0050)与适当的叠氮胺按上文的方案偶联。将叠氮基官能化的纳米颗粒(以上制备的)与3
’‑
或5
’‑
dbco(二苯并环辛炔)-或bcn(双环辛炔)-官能化的dna(从idt商业上可得,或经由与对应的nhs酯(例如来自click chemical tools的p/n a102或来自broadpharm的p/n bp-22851)偶联从3
’‑
氨基官能化或5
’‑
氨基官能化的dna制备)在适当的反应缓冲液(10mm
–
50mm磷酸钠,ph 7
–
ph 8)中混合。任选地,以小份添加4m nacl至最多0.15m
–
0.5m(取决于特定纳米颗粒的胶体稳定性)。将反应混合物孵育3小时至24小时。dna纳米颗粒缀合物通过离心和随后洗涤或通过尺寸排阻层析随后透析来纯化。
[0211]
e.硫醇官能化的dna;对马来酰亚胺的迈克尔加成.将胺官能化的纳米颗粒(商业上可得的量子点、聚合物涂覆的金或铁氧化物纳米颗粒
–
例如来自sigma aldrich的p/n900290、765341、747327)与4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(smcc)在ph 7.0
–
ph 7.4遵循确立的方案(例如thermo fisher)偶联。将马来酰亚胺官能化的纳米颗粒(商业上的,例如来自sigma aldrich的900461,或以上制备的)与硫醇官能化的dna(用tcep或dtt脱保护并如以上描述纯化的)在10mm
–
50mm磷酸钠缓冲液中ph 7.0
–
ph 7.4中混合。任选地,以小份添加4m nacl至最多0.15m
–
0.5m(取决于特定纳米颗粒的胶体稳定性)。将反应混合物孵育0.5
–
24小时。dna纳米颗粒缀合物通过离心和随后洗涤或通过尺寸排阻层析随后透析来纯化。
[0212]
实施例2
[0213]
固态基底
[0214]
基底制备.300μm厚的100mm双侧抛光硅晶片通过低压化学气相沉积(lpcvd)在晶片(例如,来自virginia semiconductor,fredericksburg,va或rogue valley,or)的每一侧沉积30nm的sin层来制备。在每一侧上旋涂负性电子束光刻胶,并且然后在电子束光刻(ebl)仪器中将晶片的一侧(―前”侧)上的光刻胶曝光,以在该侧上的sin层上形成图案化反应阱。然后将光刻胶显影,并去除未曝光的光刻胶。通过电子束蒸发在晶片的前侧上沉积5nm的铬或钛黏合层,随后在晶片的前侧上电子束沉积选择厚度的不透明金属层(例如,200nm的au或al)电子束。然后将晶片放置在从前侧去除剩余的曝光的光刻胶(―剥离”步骤)的溶液中,在金属膜层中留下具有40nm至120nm的直径和100nm至250nm的阱深度、或根据使用者的偏好的其他尺寸的反应阱。
[0215]
然后经由常规光刻法用正性光刻胶使与前面ebl特征对齐的方形窗口曝光来对晶片的背(未图案化)侧进行图案化。这些特征用反应离子刻蚀(rie)通过晶片背侧的sin层向下刻蚀到si层。然后将晶片安装在具有o形环(该o形环保护金属涂覆侧免于koh溶液的影响)的保持器中,并且然后浸入koh溶液中,koh溶液优先向下蚀刻该(100)平面,直至到达相对的sin膜,在晶片的前侧上产生具有向下开口至sin层的反应阱的独立的sin 金属基底。
[0216]
反应阱-对齐的通孔制造.然后将以上描述的基底装载到聚焦离子束(fib)仪器
(例如,以带有氦气的gfis模式的zeiss orion nanofab)中,以在每个反应阱的底部产生通孔。在独立的sin膜中磨铣出通孔,如先前描述的(marshall等人,direct and transmission milling of suspended silicon nitride membranes with a focused helium ion beam.scanning 34:101-106(2012))。简言之,在工具上将离子束对齐并使待磨铣的基底处于焦距中。通过在基底中曝光点或栅格化形状,持续给定驻留时间,并且束流相对于基底厚度,以达到期望的最终尺寸和形状,从而在基底的独立的sin层中磨铣出通孔。其他能够制造小通孔的工具包括tem和其他种类的fib(例如,镓或气场离子源(gfis)氖)。也可以在产生较大的反应阱之后,通过叠加第二ebl图案化步骤来光刻形成通孔(如在以上基底制备部分中描述的)。在第一特征上叠加第二特征产生由与较小的第一特征(通孔)同心对齐的第二特征(反应阱)组成的图案。所得的图案可以直接使用,或者如果第二特征大于期望的最终尺寸,则其可以通过诸如hfo2、al2o3、sio2、tio2、sin或pt的膜的原子层沉积(ald)以亚纳米精度减小。
[0217]
实施例3
[0218]
核酸外切释放的单核苷酸的检测
[0219]
a.荧光标记的多核苷酸链的形成.双链荧光标记的dna通过模板依赖性聚合酶介导的5’双生物素化引物的延伸来制备。5’双生物素化引物包含附接至其5’末端的两个生物素基团,以增强与链霉亲和素的非共价结合。
[0220]
双生物素部分的结构如下,其中3’磷酸附接至引物的5’末端核苷酸的5’羟基:
[0221][0222]
引物的核苷酸序列为:
[0223]5’‑
(双生物素)-gctatgtggcgcggtattag-3’(seq id no.:4)。
[0224]
乙型肝炎病毒(hbv)模板(称为―hbv-pos=1980”)的序列为:
[0225]5’‑
gactactaggtctctagacgctggatcttccaaattaacacccacccagg
[0226]
tagctagagtcattagttccccccagcaaagaattgcttgcctgagtgca
[0227]
gtatggtgaggtgaacaatgctcaggagactctaaggcttcccgatacag
[0228]
agctgaggcggtatctagaagatctcgtacctaataccgcgccacatagc-3’[0229]
(seq id no.:5)。
[0230]
模板的前180个5’核苷酸对应于hbv基因组的核苷酸1980至2159。模板的最后20个
3’末端核苷酸(加下划线的)与引物序列互补。模板的最后5个3’末端核苷酸被合成为包含硫代磷酸酯核苷酸间键,以抑制外切核酸酶对模板3’末端的降解。
[0231]
在存在atp、gtp、cy3b-dctp和cy5-dutp的情况下,在以下条件下进行模板依赖性引物延伸:20mm tris-hcl、10mm(nh4)2so4、10mm kcl、4mm mgso4、0.1%在25℃ph 8.8,1mm dtt、1%(v/v)甲酰胺、10%(v/v)甘油、0.1mm dntp、0.8微摩尔/升dna模板和2微摩尔/升引物。这产生了包含与互补引物延伸产物杂交的hbv模板序列的双链核酸,其中引物延伸产物包含荧光标记的多核苷酸链,该荧光标记的多核苷酸链包含荧光标记的胞苷和尿苷碱基。
[0232]
引物延伸产物的对应于seq id no.:5的前180个5’核苷酸的互补序列的荧光标记部分(不考虑来自未标记的引物的前20个5’末端核苷酸)的预测序列为:
[0233]5’‑
guacgagaucuucuagauaccgccucagcucuguaucgggaagccuuaga
[0234]
gucuccugagcauuguucaccucaccauacugcacucaggcaagcaauuc
[0235]
uuugcuggggggaacuaaugacucuagcuaccuggguggguguuaauuug
[0236]
gaagauccagcgucuagagaccuaguaguc-3’(seq id no.:6)。
[0237]
b.荧光标记的多核苷酸链与示例性载体颗粒的附接.将具有50nm平均直径的链霉亲和素涂覆的铁氧化物纳米颗粒(来自ocean nanotech的料号sv0050)与生物素官能化的dna以不同摩尔比(10:1、5:1、2:1和1:1)在反应缓冲液(10mm pbs ph 7.4,含有10mm磷酸钠、134mm氯化钠)中混合。添加tween 20至0.01%(v/v)的终浓度,并将附接(缀合)反应混合物在25℃以250rpm振荡孵育4小时至14小时。在缀合反应完成之后,将反应混合物以15,000rpm离心10min,并且去除无纳米颗粒、含dna的上清液。dna纳米颗粒缀合物通过以下进一步纯化:(1)离心,(2)随后用含0.05%(v/v)tween-20的10mm pbs缓冲液ph 7.4离心洗涤,以及(3)重悬于相同洗涤缓冲液中。将dna缀合的纳米颗粒储存在4℃。
[0238]
c.将荧光标记的多核苷酸链装载到反应阱中.包括顺式侧和反式侧的固态基底使用以上描述的技术制备。固体基底包括4
×
4正方形阵列的反应阱,反应阱具有径向对称侧壁和~40nm的内径和约315nm的阱深度。反应阱的侧壁通过离子轰击限定在基底内的膜而形成,该膜从反式侧到顺式侧包括以下的平面层:(1)铝(250nm)、(2)钛(15nm)和(3)sin(30nm)。此外,膜的反式侧和顺式侧以及反应阱的内侧壁涂覆有10nm厚的sio2涂层(其是通过原子层沉积添加的)。在本实施例中,每个反应阱的近侧通孔的内径、被径向对称侧壁包围的反应体积和远侧开口大致相同。
[0239]
反应阱在x和y方向上彼此间隔1500nm的间距。固态基底组装在测序盒中,使得基底的顺式侧和反式侧是流体上可及的。测序盒中的固态基底如图2中基底202示意性示出的那样定位,使得固态基底的反式侧上的反应阱的远侧开口处于通过显微镜物镜222的激发激光束的焦距中。靠近物镜的流体室称为反式室,并且远侧室称为顺式室。每个室填充有包含20mm tris-hcl ph 7.5、10mm mgcl2的反应缓冲液,并且然后向顺式室添加相同缓冲液中的25皮摩尔dna缀合载体颗粒(终浓度100pm纳米颗粒,其中~7条dna链/纳米颗粒)。
[0240]
室经由两个电极(ag/agcl2电极)电连接。这些电极用于施加跨基底顺式至反式300mv偏置电压,以将dna缀合的纳米颗粒电泳运送至纳米孔反应阱,使得附接至载体颗粒的带负电荷的荧光标记的多核苷酸链(在dsdna复合物中与互补模板链杂交)被电泳拉过近侧通孔并进入反应阱的反应体积中。
[0241]
载体颗粒对近侧通孔的封堵通过测量从约1000namp的起始(开放、未封堵)电流到电流变化率稳定时低于约200namp的电流的顺式至反式电流来监测。全部16个阱的封堵在约30秒内完成。由于载体颗粒的直径大于通孔的直径,因此阻止载体颗粒从基底的顺式侧向反式侧通过通孔。此外,由于载体颗粒稀疏地装载荧光标记的多核苷酸链,因此不多于一条荧光标记的多核苷酸链被装载到每个反应阱中。
[0242]
将反应阱的近侧通孔封堵,并且将荧光标记的多核苷酸链装载到反应阱中之后,将反式室缓冲液替换为以下外切核酸酶反应缓冲液:20mm tris-hcl ph 7.5、10mm mgcl2、50%至70%(v/v)甘油和20nm大肠杆菌外切核酸酶iii。
[0243]
在引入外切核酸酶反应缓冲液之后,立即开始激光照射基底的反式侧和相机记录来自反应阱远侧末端的荧光发射。用于发射信号检测的相机帧频通常在每秒200帧与500帧(fps)之间,并且在535nm和648nm的激光强度通常在5毫瓦至15毫瓦。
[0244]
图3示出了对来自如本实施例部分a中描述制备的dsdna hbv序列复合物的荧光标记的多核苷酸链(seq id no.:6)的3’末端的核酸外切裂解的前九个核苷酸获得的示例性测序谱。绘制随着时间(以秒)变化的相对荧光单位(rfu)的荧光。检测时间、荧光发射峰强度、发射颜色(cy3b-dctp=571nm=红色),并且cy5-dutp=670nm=绿色)总结于下表5中,其中c是胞苷,并且u是尿苷。
[0245]
表5
[0246][0247]
如可以观察到的,荧光信号的时间顺序和荧光发射波长与seq id no.:6中胞苷核苷酸和尿苷核苷酸的顺序(从3’至5’方向)相匹配,从该荧光标记的链的第一个3’单核苷酸开始。对被3’外切核酸酶裂解的不同单核苷酸测量的荧光信号强度的变化部分地取决于个体荧光团的随机光漂白时间。释放的荧光标记的单核苷酸之间的可变时间间隔反映了dna的单分子核酸外切消化的随机性,并且与本实验条件下每1秒至3秒释放约一个单核苷酸的催化裂解速率一致。
[0248]
本公开内容不意图限于所阐述的特定形式的范围,而是意图涵盖本文描述的变化形式的替代、修改和等同物。此外,本公开内容的范围完全包括鉴于本公开内容对本领域技术人员可以变得明显的其他变化形式。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。