海藻酸-g-香豆素衍生物的合成及其制备负载阿霉素的pickering乳液的方法
技术领域
1.本发明涉及一种海藻酸衍生物的合成,特别涉及一种海藻酸-g-香豆素衍生物的合成及其制备负载阿霉素的pickering乳液的方法,属于疏水性药物制剂技术领域。
背景技术:
2.两亲性聚合物在水溶液中能够自组装形成结构明确的聚合物胶束,可通过化学键合或物理包埋方式实现对药物的包载,尤其是可以将疏水性药物包埋到胶束的疏水内核中,实现对药物的有效增溶,从而提高药物药效,减小副作用。亲水性外壳可以起到稳定胶束的作用,使其在血液循环中免受res吞噬,延长药物在血液中的循环时间。因此,两亲性聚合物胶束作为药物递送载体一直是药物递送领域的研究热点之一。然而,传统的药物递送载体在药物定位跟踪及药物在病灶部位的快速释放能力有限。
3.自1965年hirayama等提出通过化学反应将荧光分子引入高分子主链或侧链用于开发荧光聚合物以来,研究者们对高分子荧光聚合物的研究越来越感兴趣。这类聚合物在光照作用下能够发光,既有高分子材料的特性,又有有机荧光小分子对光的强吸收性和发色性能。目前通常使用的荧光分子有香豆素、7-硝基-1,2,3-苯并氧杂恶二唑(nbd)、荧光素和萘二甲酰亚胺等。在这些荧光分子中,香豆素由于具有荧光量子产率高、斯托克斯(stokes)位移大、光学稳定性好和结构可修饰等特性,因而在物理、化学、医学和生物领域得到了广泛的应用。
4.pickering乳液是一种通过颗粒吸附在界面上形成界面膜从而形成动力学稳定而热力学不稳定的分散体系,因而它具有良好的物理化学稳定性。两亲性海藻酸衍生物作为一种高效的乳化剂,可以像功能表面活性剂一样发挥重要作用。其胶束在油水界面具有很强的吸附能力,促进了弹性膜的形成,保证了乳液的长期稳定性。近年来,对pickering乳液界面颗粒膜性能的研究引起了广泛的关注,通过引入一些荧光标记分子观察乳液得到详细的荧光特性,清晰直观地观察软颗粒稳定乳液的界面颗粒膜。li等报道了用尼罗红染色的嵌段共聚物胶束稳定pickering乳液的界面性质。albert等用钙黄素和罗丹明分别对乳液的水相和纳米颗粒进行染色,研究了纳米颗粒在油滴周围的分布。然而,染料过多会影响体系的稳定性;染料过少会使染色效果不好,这会影响对乳液体系的性质的理解。为了更准确、更方便地了解pickering乳液的油水界面性质,迫切需要开发一种新的方法。pickering乳液由聚合物胶束粒子稳定,因此乳液的发光可以通过胶束自身发光来实现。原则上,如果胶束聚集能发光,则可以用荧光显微镜直接观察乳液液滴形态,可以实现乳液界面的直接可视化观测。
技术实现要素:
5.本发明的目的在于提供一种海藻酸-g-香豆素衍生物(lsa-ss-deac)的合成方法,该方法制得的含发色基团的两亲性海藻酸衍生物(lsa-ss-deac),其在水溶液中能够自组
装形成具有还原响应性的聚合物胶束,并可以有效负载抗肿瘤药物阿霉素(dox)。
6.本发明解决其技术问题所采用的技术方案是:
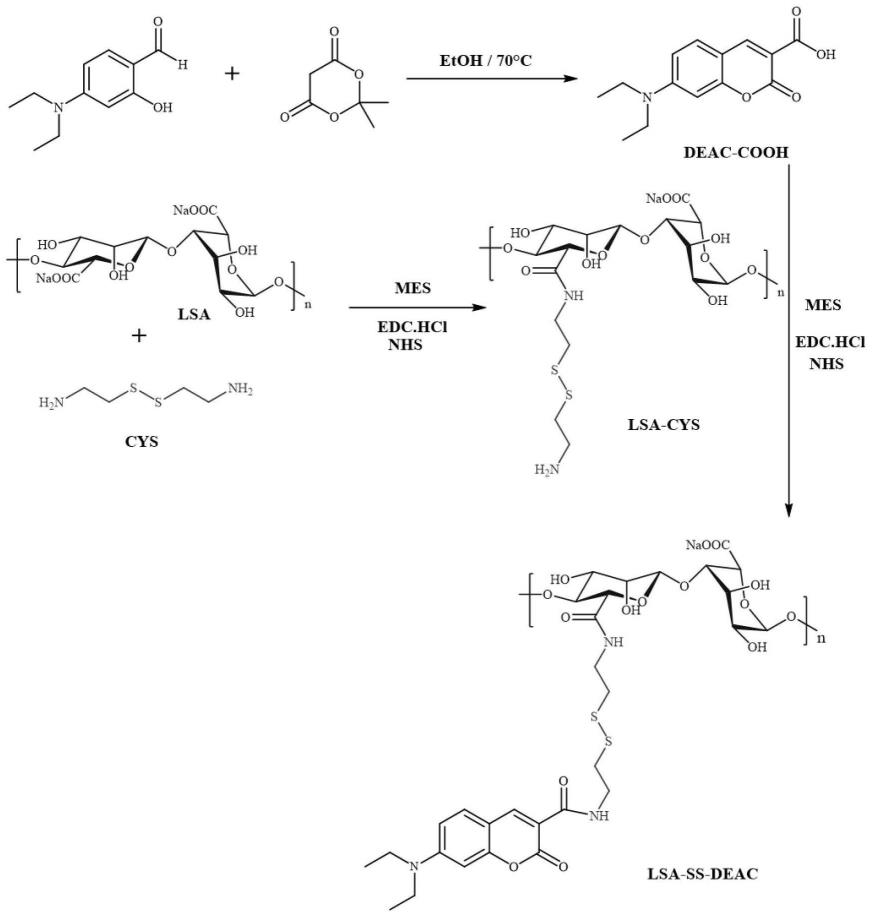
7.一种海藻酸-g-香豆素衍生物(lsa-ss-deac)的合成方法,合成路线示意图如图1所示,该方法包括如下步骤:
8.s1、海藻酸钠-胱胺的合成:
9.用ph为6.4
±
0.2的mes缓冲液配制0.01~0.05g/ml的lsa溶液,
10.加入edc
·
hcl和nhs,充分搅拌以活化lsa中的羧基,然后加入胱胺二盐酸盐,继续搅拌反应24h以上,将反应液装入mwco 3500da透析袋,透析以去除残留的杂质,冷冻干燥,得到中间产物海藻酸钠-胱胺(lsa-cys);
11.lsa糖醛酸单体与edc
·
hcl和nhs的摩尔比为1:(2~4):(2~4),lsa糖醛酸单体和胱胺二盐酸盐的摩尔比为1:1~3;
12.s2、7-(二乙氨基)香豆素-3-甲酸(deac)的合成:
13.4-(二乙氨基)水杨醛和米氏酸以摩尔比0.83~1.2:1混合,并加入适量无水乙醇,在70℃
±
10℃的温度下搅拌5h~6h,析出大量固体,抽滤,用少量无水乙醇洗涤3~5次,烘干,得到7-(二乙氨基)香豆素-3-甲酸(deac-cooh);
14.s3、海藻酸-g-香豆素衍生物(lsa-ss-deac)的合成:
15.将deac-cooh溶解在少量dmf中,依次加入edc
·
hcl和nhs,室温搅拌充分以活化deac-cooh中的羧基基团,备用,其中deac-cooh与edc
·
hcl和nhs的摩尔比为1:1:1;
16.将s1得到的lsa-cys在溶剂中溶解,剧烈搅拌下滴入上述活化好的deac-cooh溶液,所述lsa-cys糖醛酸单体与deac-cooh的摩尔比为1:1~5,室温机械搅拌48h以上,将反应液装入mwco 3500da透析袋进行透析,以除去小分子原料试剂和有机溶剂,冷冻干燥,得海藻酸-g-香豆素衍生物(lsa-ss-deac)。
17.本发明以疏水性荧光分子7-(二乙氨基)香豆素-3-甲酸(deac)作为疏水改性剂,采用水溶性的碳二亚胺化学法,通过胱胺二盐酸盐(构建二硫键)将其连接到亲水性的低分子量海藻酸钠(lsa,mw≤80000)骨架上,合成一种新型的含发色基团的两亲性海藻酸衍生物(lsa-ss-deac),其在水溶液中能够自组装形成具有还原响应性的聚合物胶束,并可以有效负载抗肿瘤药物阿霉素(dox)。进而以自组装的载药lsa-ss-deac胶束为软颗粒乳化剂,通过超声乳化法构建了稳定性好且具有荧光特性的载药pickering乳液,在谷胱甘肽(gsh)的作用下可实现肿瘤部位药物的快速释放,有望实现给药过程的可视化监测和跟踪。
18.本发明利用lsa-ss-deac在水溶液中自组装形成的胶束来稳定pickering乳液,并通过粒径电位测试和乳化外观观察等方法综合评价了乳液的稳定性。采用超声透析法实现了抗癌药物在纳米胶束中的负载,同时也考察了载药pickering乳液在模拟肿瘤微环境中的释药行为及体外细胞毒性,以期找到具有药物定位跟踪及药物在病灶部位快速释放的抗癌药物载体。
19.本发明所述的lsa-ss-deac胶束及其稳定的pickering乳液可应用于体内药物靶向递送及示踪。
20.作为优选,s1中所述的海藻酸盐质均分子量mw≤80000,其单体古洛糖醛酸(g)和甘露糖醛酸(m)的摩尔比g/m≤1.0。
21.作为优选,s3中,溶剂是由dmf与水等体积混合而成。
22.作为优选,s3中,透析方法是:先用乙醇与水体积比4:1的混合溶液透析三天除去小分子原料试剂,然后再用水透析三天除去有机溶剂。
23.一种采用所述的lsa-ss-deac制备负载阿霉素的pickering乳液的方法,该方法包括如下步骤:
24.①
负载阿霉素(dox)lsa-ss-deac胶束的制备:
25.有机溶剂存在下,将三乙胺与dox
·
hcl以摩尔比2~3:1混合,避光搅拌2~3h,得到dox溶液;
26.将lsa-ss-deac制成lsa-ss-deac的水溶液,在100
±
100rpm的搅拌速度下缓慢滴入所述的dox溶液,超声分散,然后将该溶液置于mwco 3500da透析袋,透析去除有机溶剂,用0.45μm的微孔滤膜过滤除去未负载于胶束中的dox,得到lsa-ss-deac载药胶束;
27.②
以lsa-ss-deac载药胶束溶液为水相,以醋酸乙酯为油相,以3:7~5:5的油水体积比将两者混合,超声搅拌,得到载药lsa-ss-deac胶束稳定pickering乳液。
28.作为优选,
①
中的有机溶剂是dmso,所述dox
·
hcl预先溶于dmso中,dox
·
hcl的dmso溶液质量浓度为1.0~5.0mg/ml。
29.作为优选,
①
中,lsa-ss-deac的水溶液质量浓度为1.0~5.0mg/ml。
30.作为优选,
②
中,所述lsa-ss-deac载药胶束溶液浓度为0.5~2.0mg/ml。
31.一种所述的lsa-ss-deac或所述的负载阿霉素的pickering乳液在药物靶向递送及示踪方面的应用。
32.与现有技术相比,本发明的有益效果在于:本发明将疏水性荧光分子deac通过水溶性碳二亚胺化学法接枝在lsa骨架上合成了具有还原响应性的两亲性荧光聚合物lsa-ss-deac。
33.本发明所述的两亲性荧光聚合物lsa-ss-deac在水溶液中自组装形成球形胶束且粒径分布相对较窄,在ph 7.4的pbs中的稳定性好,并具有良好的荧光性能和还原响应性。采用超声搅拌法制备载药o/w型lsa-ss-deac胶束稳定pickering乳液,稳定性好,其对dox药物具有较好的包封作用,同时它对dox的释放具有还原响应性。体外细胞毒性结果表明聚合物lsa-ss-deac具有较低的细胞毒性,而负载dox后表现出对hela细胞明显的抑制作用。clsm结果显示聚合物lsa-ss-deac胶束被细胞摄取后能发出绿光,且载药后不会影响其荧光性能。因此,相比于其它药物载体,lsa-ss-deac胶束及其稳定的pickering乳液具有药物定位跟踪及病灶部位快速释放药物的潜能,有望应用于癌症的精准治疗。
附图说明
34.图1为lsa-ss-deac的合成路线示意图。
35.图2(a)为deac-cooh的1h nmr(400mhz,cdcl3)图谱;(b)为deac-cooh的
13
c nmr图谱(400mhz,cdcl3)。
36.图3(a)为lsa-ss-deac的ft-ir谱图;(b)为lsa-ss-deac(d2o)的1h nmr谱图;
37.图4为芘荧光强度的比值i1/i3与聚合物lsa-ss-deac浓度的关系图;
38.图5为空白聚合物lsa-ss-deac胶束的(a)粒径和(b)zeta电位分布图;
39.图6(a)为lsa-ss-deac胶束在含水量不同的thf溶液中的光致发光光谱;(b)为lsa-ss-deac胶束在不同浓度下的光致发光光谱;
40.图7为lsa-ss-deac胶束在10mm gsh的pbs中孵育6h(a)和12h(b)的粒径分布图和透射电镜图;
41.图8为不同浓度的游离dox和负载dox的聚合物lsa-ss-deac胶束与hela细胞共培养(a)24h和(b)48h的体外细胞毒性;
42.图9为hela细胞与空白和载dox聚合物lsa-ss-deac胶束孵育4h的荧光显微图像;
43.图10为不同浓度lsa-ss-deac胶束溶液稳定的载药pickering乳液光学显微镜图:(a)0.5mg/ml,(b)1.0mg/ml,(c)2.0mg/ml;
44.图11为负载dox聚合物lsa-ss-deac胶束稳定pickering乳液在37℃的pbs(ph 7.4、ph 5.0和ph 5.0 10mm gsh)中的体外累积释放曲线。
具体实施方式
45.下面通过具体实施例,对本发明的技术方案作进一步的具体说明。应当理解,本发明的实施并不局限于下面的实施例,对本发明所做的任何形式上的变通和/或改变都将落入本发明保护范围。
46.在本发明中,若非特指,所有的份、百分比均为重量单位,所采用的设备和原料等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
47.edc
·
hcl,1-乙基-(3-二甲基氨基丙基)碳醯二亚胺盐酸盐;
48.nhs,n-羟基琥珀酰亚胺;
49.lsa,低分子量海藻酸钠,mw≤80000;
50.dox
·
hcl,盐酸阿霉素;
51.本发明所述的lsa-ss-deac,通过元素分析仪测试其元素含量,并采用以下公式(1)计算其取代度(ds)。
[0052][0053]
其中,m
deac
为通过标准曲线方程测定的deac的含量,m
lsa-ss-deac
为聚合物lsa-ss-deac的投料量,m
dead
为deac基团的摩尔分数,m
lsa
表示lsa中单位糖单元的摩尔分数。
[0054]
本发明所述的lsa-ss-deac自组装纳米胶束,采用动态光散射技术(dls)探究其胶束的稳定性和还原响应性。利用激光粒度分析仪测定纳米粒的粒径大小、pdi和zeta电位值。采用tem观察自组装纳米粒的形貌和大小。
[0055]
本发明所述载药lsa-ss-deac胶束稳定pickering乳液,通过紫外可见分光光度计检测dox的包封率。取5ml载药pickering乳液,将其加入到10ml dmso和去离子水(v
dmso
:v
h2o
,9:1)的混合溶液中,在强涡旋振荡下使dox溶于dmso中,用0.45μm的微孔滤膜过滤,利用紫外可见分光光度计在480nm处测定dox的含量。然后采用下列公式(2)计算载药pickering乳液的包封率(ee)。
[0056][0057]
所述的载药pickering乳液,采用光学显微镜和荧光显微镜观测其乳液液滴形貌
和荧光示踪功能。
[0058]
本发明所述负载类胡萝卜素的osaola胶束,分别以ph 7.4磷酸缓冲液(pbs)、ph5.0磷酸缓冲液(pbs)和ph 5.0含10mm谷胱甘肽(gsh)的磷酸缓冲液(pbs)作为释药介质,在37℃条件下进行模拟释药试验,考察其对dox的释放性能。
[0059]
下述实施例中,选择pbs(0.1m,ph 7.4)、pbs(0.1m,ph 5.0)和10mm gsh的pbs(0.1m,ph 5.0)三种不同的释放介质研究负载dox聚合物胶束稳定pickering乳液在37℃下的体外释药行为。具体操作步骤如下:取2.0ml载药lsa-ss-deac胶束稳定pickering乳液装入截留分子量为3500的透析袋中,随后将该透析袋浸没在28ml相应的缓冲溶液中,在37℃,100rpm转速下进行体外释药。在预设时间点取出1.0ml释放介质并补加相同体积的新鲜释放介质以维持总体积不变。取出的试样经0.45mm微孔滤膜过滤后用紫外可见分光光度计在480nm处测定其含量。各个时间段内dox的释放量与前一时间dox的释放总量相加,为该时段累积释药量,它与载药量的比值即为累积释药率,根据实验数据可绘制累计释药率随时间变化的释药动力学曲线。
[0060]
采用hela细胞进行mtt细胞活力实验,测定空白和负载dox的聚合物lsa-ss-deac胶束的细胞毒性。简单来讲,将培养好的hela细胞(1
×
104细胞/孔)接种于96孔板中并置于细胞培养箱中孵育24h使细胞贴壁,然后加入完全由dmem培养基配置的不同浓度的空白胶束(0~500μg/ml)、游离dox溶液和负载dox的胶束溶液(0~10μg/ml)替换旧的培养基进行培养24h和48h,接着在每孔中加入20μl mtt的pbs溶液(5.0mg/ml)进一步培养4h,吸出孔中的培养基和mtt,用pbs洗涤后在每孔中加入100μl dmso,置于振荡器上低速震荡10min以充分溶解mtt甲瓒晶体。用酶标仪测定570nm波长处各孔内溶液的吸光度值,计算细胞存活率。
[0061]
实施例1
[0062]
一种采用lsa-ss-deac制备负载阿霉素的pickering乳液的方法,具体步骤是:
[0063]
s1、海藻酸钠-胱胺的合成:
[0064]
精确称取1.0g lsa于250ml三口烧瓶中,加入100ml mes缓冲液(ph 6.4),室温机械搅拌将其充分溶解,依次加入2.87g edc
·
hcl和1.72g nhs,室温机械搅拌2h以活化lsa中的羧基,然后加入3.38g胱胺二盐酸盐,室温继续搅拌反应24h,将反应液装入透析袋(mwco 3500da)中,用去离子水透析三天去除残留的杂质,经冷冻干燥后得到中间产物海藻酸钠-胱胺(lsa-cys)。
[0065]
s2、7-(二乙氨基)香豆素-3-甲酸(deac)的合成:在50ml的圆底烧瓶中依次加入1.93g4-(二乙氨基)水杨醛、1.44g米氏酸和5ml无水乙醇,置于70℃的油浴锅中磁力搅拌5h,析出大量固体,抽滤,用少量无水乙醇洗涤3~5次,烘干后得到7-(二乙氨基)香豆素-3-甲酸(deac-cooh)约2.1g。1h nmr(400mhz,cdcl3,δppm):1.26(t,6h,j=8.0hz),3.27(dd,4h,j=8.0hz、16.0hz),6.51(d,1h,j=4.0hz),6.70(dd,1h,j=4.0hz、8.0hz),7.42(d,1h,j=8.0hz),8.62(s,1h),12.36(s,1h).
13
c nmr(400mhz,cdcl3,δppm):12.40,45.37,96.82,108.56,126.7,110.96,132.0,150.3,153.8,158.1,164.6,165.6。
[0066]
s3、海藻酸-g-香豆素衍生物(lsa-ss-deac)的合成:
[0067]
将0.23gdeac-cooh溶解在少量dmf中,依次加入0.38gedc
·
hcl和0.23gnhs,室温搅拌2h活化deac-cooh中的羧基基团,备用。在三口烧瓶中依次加入上述制备的lsa-cys 0.30g和30ml去离子水,室温机械搅拌将其充分溶解,然后加入30ml dmf,在剧烈搅拌下滴
ss-deac)。
[0078]
s4、制备负载阿霉素的pickering乳液:
[0079]
最后,精确称取10mg dox
·
hcl溶解于5ml dmso中,加入2倍摩尔量的三乙胺(三乙胺:dox
·
hcl,2:1),室温避光搅拌2h,得到游离的dox溶液,待用。将30mg lsa-ss-deac聚合物分散溶解在15ml去离子水中,在室温100rpm的搅拌速度下缓慢滴入上述制备好的dox溶液,探头超声10min,然后将该溶液置于透析袋(mwco 3500da)中,用去离子水透析三天彻底去除dmso,期间每隔4h更换一次去离子水,用0.45μm的微孔滤膜过滤除去未负载于胶束中的dox。然后量取5ml lsa-ss-deac载药胶束溶液作为水相,5ml醋酸乙酯作为油相,将油相和水相混合,最后经超声搅拌制得载药o/w型lsa-ss-deac胶束稳定pickering乳液。
[0080]
所制得lsa-ss-deac的取代度为11.4%,临界胶束浓度(cmc)值为0.20mg/ml,在水溶液中自组装形成球形胶束,粒径和zeta电位分别约为221.5
±
3.1nm和-47.4
±
0.5mv,分布相对较窄。该胶束在ph 7.4的pbs中的稳定性好,并具有良好的荧光性能和还原响应性。采用超声搅拌法制备载药o/w型lsa-ss-deac胶束稳定pickering乳液,稳定性好,其对dox药物的包封率可达49%以上,同时它对dox的释放具有还原响应性,在模拟肿瘤细胞微环境(ph 5.0,10mm gsh中12h的累积释放量达到62%左右,高于其在ph 7.4和5.0的pbs中的累积释放量。体外细胞毒性结果表明该聚合物具有较低的细胞毒性,而载药胶束对hela细胞表现出明显的毒性和抑制作用,培养48h的细胞存活率为21.1%,ic50值为2.2μg/ml。
[0081]
实施例3
[0082]
一种采用lsa-ss-deac制备负载阿霉素的pickering乳液的方法,具体步骤是:
[0083]
s1、海藻酸钠-胱胺的合成:
[0084]
精确称取1.0glsa于250ml三口烧瓶中,加入100mlmes缓冲液(ph 6.4),室温机械搅拌将其充分溶解,依次加入1.91gedc
·
hcl和1.15gnhs,室温机械搅拌2h以活化lsa中的羧基,然后加入2.25g胱胺二盐酸盐,室温继续搅拌反应24h,将反应液装入透析袋(mwco 3500da)中,用去离子水透析三天去除残留的杂质,经冷冻干燥后得到中间产物海藻酸钠-胱胺(lsa-cys)。
[0085]
s2、7-(二乙氨基)香豆素-3-甲酸(deac)的合成:
[0086]
在50ml的圆底烧瓶中依次加入1.93g4-(二乙氨基)水杨醛、1.728g米氏酸和5ml无水乙醇,置于70℃的油浴锅中磁力搅拌5h,析出大量固体,抽滤,用少量无水乙醇洗涤3~5次,烘干后得到7-(二乙氨基)香豆素-3-甲酸(deac-cooh)约2.4g。
[0087]
s3、海藻酸-g-香豆素衍生物(lsa-ss-deac)的合成:
[0088]
将0.23gdeac-cooh溶解在少量dmf中,依次加入0.76gedc
·
hcl和0.46gnhs,室温搅拌2h活化deac-cooh中的羧基基团,备用。在三口烧瓶中依次加入上述制备的lsa-cys 0.10g和30ml去离子水,室温机械搅拌将其充分溶解,然后加入30ml dmf,在剧烈搅拌下滴入上述活化好的deac-cooh溶液,室温机械搅拌48h后将反应液装入透析袋(mwco 3500da)中,先用乙醇:去离子水(4:1,v/v)的混合溶液透析三天除去小分子原料试剂,然后再用去离子水透析三天除去有机溶剂,冷冻干燥即得目标聚合物海藻酸-g-香豆素衍生物(lsa-ss-deac)。
[0089]
s4、制备负载阿霉素的pickering乳液:
[0090]
最后,精确称取10mg dox
·
hcl溶解于5ml dmso中,加入2倍摩尔量的三乙胺(三乙
胺:dox
·
hcl,2:1),室温避光搅拌2h,得到游离的dox溶液,待用。将30mg lsa-ss-deac聚合物分散溶解在15ml去离子水中,在室温100rpm的搅拌速度下缓慢滴入上述制备好的dox溶液,探头超声10min,然后将该溶液置于透析袋(mwco 3500da)中,用去离子水透析三天彻底去除dmso,期间每隔4h更换一次去离子水,用0.45μm的微孔滤膜过滤除去未负载于胶束中的dox。然后量取5ml lsa-ss-deac载药胶束溶液作为水相,5ml醋酸乙酯作为油相,将油相和水相混合,最后经超声搅拌制得载药o/w型lsa-ss-deac胶束稳定pickering乳液。
[0091]
所制得lsa-ss-deac的取代度为14.7%,临界胶束浓度(cmc)值为0.17mg/ml,在水溶液中自组装形成球形胶束,粒径和zeta电位分别约为205.9
±
4.2nm和-45.2
±
0.3mv,分布相对较窄。该胶束在ph 7.4的pbs中的稳定性好,并具有良好的荧光性能和还原响应性。采用超声搅拌法制备载药o/w型lsa-ss-deac胶束稳定pickering乳液,稳定性好,其对dox药物的包封率可达53%以上,同时它对dox的释放具有还原响应性,在模拟肿瘤细胞微环境(ph 5.0,10mm gsh中12h的累积释放量达到60.5%左右,高于其在ph 7.4和5.0的pbs中的累积释放量。体外细胞毒性结果表明该聚合物具有较低的细胞毒性,而载药胶束对hela细胞表现出明显的毒性和抑制作用,培养48h的细胞存活率为19.5%,ic50值为2.0μg/ml。
[0092]
实施例4
[0093]
一种采用lsa-ss-deac制备负载阿霉素的pickering乳液的方法,具体步骤是:
[0094]
s1、海藻酸钠-胱胺的合成:
[0095]
精确称取1.0glsa于250ml三口烧瓶中,加入100mlmes缓冲液(ph 6.4),室温机械搅拌将其充分溶解,依次加入2.87gedc
·
hcl和1.72gnhs,室温机械搅拌2h以活化lsa中的羧基,然后加入3.38g胱胺二盐酸盐,室温继续搅拌反应24h,将反应液装入透析袋(mwco 3500da)中,用去离子水透析三天去除残留的杂质,经冷冻干燥后得到中间产物海藻酸钠-胱胺(lsa-cys)。
[0096]
s2、7-(二乙氨基)香豆素-3-甲酸(deac)的合成:
[0097]
在50ml的圆底烧瓶中依次加入1.93g4-(二乙氨基)水杨醛、1.728g米氏酸和5ml无水乙醇,置于70℃的油浴锅中磁力搅拌5h,析出大量固体,抽滤,用少量无水乙醇洗涤3~5次,烘干后得到7-(二乙氨基)香豆素-3-甲酸(deac-cooh)约2.4g。
[0098]
s3、海藻酸-g-香豆素衍生物(lsa-ss-deac)的合成:
[0099]
将0.23gdeac-cooh溶解在少量dmf中,依次加入0.38gedc
·
hcl和0.23gnhs,室温搅拌2h活化deac-cooh中的羧基基团,备用。在三口烧瓶中依次加入上述制备的lsa-cys 0.15g和30ml去离子水,室温机械搅拌将其充分溶解,然后加入30ml dmf,在剧烈搅拌下滴入上述活化好的deac-cooh溶液,室温机械搅拌48h后将反应液装入透析袋(mwco 3500da)中,先用乙醇:去离子水(4:1,v/v)的混合溶液透析三天除去小分子原料试剂,然后再用去离子水透析三天除去有机溶剂,冷冻干燥即得目标聚合物海藻酸-g-香豆素衍生物(lsa-ss-deac)。
[0100]
s4、制备负载阿霉素的pickering乳液:
[0101]
最后,精确称取10mg dox
·
hcl溶解于5ml dmso中,加入2倍摩尔量的三乙胺(三乙胺:dox
·
hcl,2:1),室温避光搅拌2h,得到游离的dox溶液,待用。将30mg lsa-ss-deac聚合物分散溶解在15ml去离子水中,在室温100rpm的搅拌速度下缓慢滴入上述制备好的dox溶液,探头超声10min,然后将该溶液置于透析袋(mwco 3500da)中,用去离子水透析三天彻底
去除dmso,期间每隔4h更换一次去离子水,用0.45μm的微孔滤膜过滤除去未负载于胶束中的dox。然后量取5ml lsa-ss-deac载药胶束溶液作为水相,5ml醋酸乙酯作为油相,将油相和水相混合,最后经超声搅拌制得载药o/w型lsa-ss-deac胶束稳定pickering乳液。
[0102]
所制得lsa-ss-deac的取代度为12.3%,临界胶束浓度(cmc)值为0.18mg/ml,在水溶液中自组装形成球形胶束,粒径和zeta电位分别约为213.7
±
3.7nm和-46.1
±
0.3mv,分布相对较窄。该胶束在ph 7.4的pbs中的稳定性好,并具有良好的荧光性能和还原响应性。采用超声搅拌法制备载药o/w型lsa-ss-deac胶束稳定pickering乳液,稳定性好,其对dox药物的包封率可达50%以上,同时它对dox的释放具有还原响应性,在模拟肿瘤细胞微环境(ph 5.0,10mm gsh中12h的累积释放量达到61%左右,高于其在ph 7.4和5.0的pbs中的累积释放量。体外细胞毒性结果表明该聚合物具有较低的细胞毒性,而载药胶束对hela细胞表现出明显的毒性和抑制作用,培养48h的细胞存活率为20.5%,ic50值为2.1μg/ml。
[0103]
clsm结果显示,上述各实施例制得的聚合物lsa-ss-deac胶束被细胞摄取后能发出绿光,且载药后不会影响其荧光性能。因此,lsa-ss-deac胶束及其稳定的pickering乳液具有药物定位跟踪及病灶部位快速释放药物的潜能,有望应用于癌症的精准治疗。
[0104]
对上述实施例制得的中间产物及材料进行检测,以实施例1为主要对象,
[0105]
图2(a)为deac-cooh的1h nmr(400mhz,cdcl3)图谱;(b)为deac-cooh的
13
c nmr图谱(400mhz,cdcl3)。
[0106]
图3(a)为lsa-ss-deac的ft-ir谱图;(b)为lsa-ss-deac(d2o)的1h nmr谱图。如图3a所示,在3429和3415cm-1
处的吸收峰对应于聚合物结构中羟基和氨基的伸缩振动峰。2925和2854cm-1
处的吸收峰为聚合物结构中-ch
2-的反对称和对称伸缩振动峰。1618和1419cm-1
处的吸收峰归属于聚合物结构中羧酸盐c-o的非对称和对称伸缩振动峰。在1720和1540cm-1
处出现的新的特征吸收峰归属于聚合物结构中c=o的伸缩振动和n-h弯曲振动峰(酰胺ii带)。上述结果表明聚合物lsa-ss-deac通过酰胺反应成功合成。如图3b所示,δ3.2~5.0ppm之间出现的质子信号峰归属于糖环骨架上氢质子的化学位移,δ2.89ppm和δ3.27ppm处的质子信号峰对应于胱胺链上亚甲基-ch
2-的化学位移,δ1.27ppm和δ3.27ppm处的质子信号峰对应于deac中末端甲基-ch3和亚甲基-ch
2-的化学位移,δ6.51、6.70、7.42和8.62ppm处的质子信号峰归属于deac中上苯环上质子的化学位移,说明deac成功发生了酰胺化反应并合成了聚合物lsa-ss-deac。
[0107]
图4为芘荧光强度的比值i1/i3与聚合物lsa-ss-deac浓度的关系图。采用芘荧光探针法测定了聚合物lsa-ss-deac的cmc值大小。该曲线拐点处的浓度为聚合物的cmc值。由图4可知聚合物lsa-ss-deac的cmc值为0.26mg/ml。
[0108]
图5为空白聚合物lsa-ss-deac胶束的(a)粒径和(b)zeta电位分布图。聚合物lsa-ss-deac具有两亲性,通过超声辅助溶解法可以制备以疏水荧光分子deac为疏水内核,亲水性lsa为壳的自组装胶束。从图5中可以看出,胶束的粒径和zeta电位值分别为250.2
±
4.3nm和-49.1
±
0.4mv,分布相对较窄(pdi=0.23)。胶束呈球形形貌,未发现胶束间的团聚现象。
[0109]
图6(a)为lsa-ss-deac胶束在含水量不同的thf溶液中的光致发光光谱;(b)为lsa-ss-deac胶束在不同浓度下的光致发光光谱。两亲性聚合物lsa-ss-deac在水溶液中能够自组装形成胶束,随着自组装过程的进行,疏水链段deac会不断缔合形成疏水deac内核,
用410nm的波长激发后胶束溶液会在475nm处出现最强荧光,该峰为deac的特征峰。
[0110]
图7为lsa-ss-deac胶束在10mm gsh的pbs中孵育6h(a)和12h(b)的粒径分布图和透射电镜图。聚合物lsa-ss-deac结构中含有二硫键,通过在ph 7.4的pbs中加入10mm gsh评价了聚合物lsa-ss-deac胶束的还原响应性。在10mm gsh中孵育6h后胶束粒径由孵育前的250nm变成了390nm,且粒径分布变宽,与tem的结果相一致,表明聚合物胶束在10mm gsh作用下二硫键发生断裂,胶束结构开始发生了破坏。图7b是胶束孵育12h后粒径分布图,可以看出胶束的粒径接近1000nm,分布很宽且变得很复杂,表明胶束彻底解体。
[0111]
图8为不同浓度的游离dox和负载dox的聚合物lsa-ss-deac胶束与hela细胞共培养(a)24h和(b)48h的体外细胞毒性。hela细胞与游离dox和负载dox的聚合物lsa-ss-deac胶束共培养24h和48h的细胞毒性。dox的浓度为10μg/ml的载药胶束与hela细胞共培养24h和48h的细胞存活率分别下降为45.2%和22.2%,ic50值分别为7.6μg/ml和2.6μg/ml,显示出了良好的细胞毒性。
[0112]
图9为hela细胞与空白和载dox聚合物lsa-ss-deac胶束孵育4h的荧光显微图像。如图9所示,空白聚合物lsa-ss-deac胶束与细胞培养4h后,通过绿色光路观察到的细胞呈现绿色,而空白对照组的细胞看不到细胞影像,表明胶束被细胞成功摄取。负载dox后,通过绿色光路观察到的细胞同样呈绿色,且荧光强度上未见明显差异,说明聚合物lsa-ss-deac胶束载药后不会影响其荧光性能。
[0113]
图10为不同浓度lsa-ss-deac胶束溶液稳定的载药pickering乳液光学显微镜图:(a)0.5mg/ml,(b)1.0mg/ml,(c)2.0mg/ml。
[0114]
图11为负载dox聚合物lsa-ss-deac胶束稳定pickering乳液在37℃的pbs(ph 7.4、ph 5.0和ph 5.0 10mm gsh)中的体外累积释放曲线。如图11所示,载药pickering乳液在无gsh的pbs中均表现出对dox的缓慢释放行为,在ph 5.0和7.4的pbs中48h的累积释放量分别为46.6%和40.3%。该pickering乳液在ph 5.0的pbs中的累积释放量比在ph 7.4的pbs中更高,这可能归因于dox在弱酸性条件下的溶解度(1.04
±
0.05mg/ml,ph 5.0pbs)要比在中性条件(0.51
±
0.04mg/ml,ph 7.4pbs)下的溶解度更高。同时,聚合物胶束的疏水链段上含有n原子,在酸性条件下会发生质子化形成铵盐,亲水性增强,胶束发生溶胀,从而加快了dox药物分子的释放。载药pickering乳液在模拟肿瘤细胞微环境(ph 5.0,10mm gsh)中表现出较高的累积释放量和较快的释放速率,12h的累积释放量达到64.0%左右,高于其在ph 7.4和5.0的pbs中的累积释放量。这归因于还原响应性的lsa-ss-deac胶束在高浓度的gsh作用下,亲疏水链间的二硫键会发生断裂,造成胶束解体,致使dox快速从破坏的胶束中释放出来。
[0115]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其它实施例的不同之处,各个实施例之间相同或相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
[0116]
以上对本发明所提供的海藻酸-g-香豆素衍生物的合成及其制备负载阿霉素的pickering乳液的方法进行了详细介绍。本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明
进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。